LAMPIRAN Lampiran 1. Pembuatan Larutan Stok dan Buffer A. LARUTAN STOK
CTAB 5 % (100 ml)
- Ditimbang NaCl sebanyak 2.0 gram - Ditimbang CTAB sebanyak 5.0 gram.
- Dimasukkan bahan kimia ke dalam erlenmeyer dan ditambahkan 100 ml aquades.
Tris HCl 1 M pH 8.0 (100 ml)
- Ditimbang Tris sebanyak 12.114 gram.
- Dimasukkan Tris ke dalam erlenmeyer dan ditambahkan 80 ml aquades, diaduk di atas hot plate menggunakan stirrer.
- Diatur pH mencapai 8 dengan HCl (4.2 ml)
- Dimasukkan ke dalam gelas ukur, lalu ditambahkan aquades hingga volume larutan mencapai 100 ml.
- Disterilisasi dengan autoklaf. Tris HCl 1 M pH 7.4 (50 m)
- Ditimbang Tris sebanyak 6.057 gram.
- Dimasukkan Tris ke dalam erlenmeyer dan ditambahkan 30 ml aquades, diaduk di atas hot plate menggunakan stirrer.
- Diatur pH mencapai 7.4 dengan NaOH 2.5 M.
- Dimasukkan ke dalam gelas ukur lalu ditambahkan aquades hingga volume larutan mencapai 50 ml.
- Disterilisasi dengan autoklaf. EDTA O.5 M pH 8.0 (100 ml)
- Ditimbang NaOH sebanyak 2.0 gram.
- Dimasukkan ke dalam erlenmeyer dan ditambahkan 80 ml aquades, diaduk di atas hot plate menggunakan stirrer.
- Diatur pH mencapai 8 dengan HCl.
- Dimasukkan ke dalam gelas ukur, lalu ditambahkan aquades hingga volume larutan mencapai 100 ml.
- Disterilisasi dengan autoklaf. NaCl 5 M pH 7.7 (l00 ml)
- Ditimbang NaCl sebanyak 29.22 gram.
- Masukkan ke dalam erlenmeyer dan ditambahkan 80 ml aquades, diaduk di atas hot plate menggunakan stirrer.
- Dimasukkan ke dalam gelas ukur, , lalu ditambahkan aquades hingga volume larutan mencapai 100 ml.
- Disterilisasi dengan autoklaf. B. LARUTAN BUFFER
Buffer Ekstraksi/CTAB (100 ml)
- Dicampurkan 40 ml CTAB 5%, 25.1 ml NaCl 5 M, 4 ml EDTA 0.5 M pH 8.0, 10 ml Tris HCl 1 M pH 8.0 dan 20.8 ml aquades.
Buffer TAE 50 X (100 ml)
- Dicampurkan 24.2 ml Tris HCl 1 M pH 7.4, 5.7 ml Asam Asetat Glasial, 10 ml EDTA 0.5 M PH 8.0, dan aquades hingga volume larutan menjadi 100 ml.
Buffer TAE 1X (700 ml)
- Dilarutkankan 70 ml Buffer TAE 10 X dengan dan 630 ml aquades. Buffer TE (50 ml)
- Dicampurkan 0.5 ml Tris HCl 1 M pH 8.0, 0.1 ml EDTA 0.5 M pH 8.0 dan 49.4 ml aquades.
KIAA (Kloroform : Isoamilalkohol = 24 : 1 (50 ml) - Dicampurkan 48 ml Kloroform dan 2 ml Isoamilalkohol. Etanol 70 % (100 ml)
- Dicampurkan 70 ml Etanol dengan 30 ml aquades.
Lampiran 2. Alur Penelitian
Sampel Daun Bawang Merah
Isolasi DNA
Uji Kuantitas
PCR-RAPD
Elektroforesis
Analisis Hasil mplifikasi PCR
Lampiran 3. Proses Isolasi dan Purifikasi
Sterilisasi alat dan bahan dengan autoklaf (121 oC 1 atm)
Daun dibersihkan dan ditimbang sampel 3 gr
Daun digerus ditambahkan 0.1 g PVPP dan 0.5 ml b.e CTAB
Dimasukkan ke tabung mikro 2 ml yang diisi 1 ml b.e CTAB
Ditambahkan 10 µlβ-mercaptoetanol, lalu divortex hingga rata.
Tabung diinkubasi dalam waterbath selama 30 menit pada suhu 650C, setiap 10 menit sekali tabung dibolak balik dengan perlahan
Ditambahkan 1 ml larutan KIAA ke dalam tabung dan dikocok hingga homogen.
Tabung disentrifugasi selama 10 menit kecepatan 13.000 rpm
Fase atas dipindahkan ke tabung lain, ditambahkan 1 ml larutan KIAA. Tabung disentrifugasi selama 10 menit kecepatan 13.000 rpm
Fase atas dipindahkan ke tabung lain, ditambahkan 1 ml isopropanol dingin
Tabung dikocok perlahan dan diperhatikan adanya benang-benang halus putih yang muncul. Inkubasi suhu 4oC selama 30 menit.
Tabung disentrifugasi selama 10 menit kecepatan 13.000 rpm, lalu cairan isopropanol dibuang
Setelah cairan dibuang, kemudian pellet dicuci dengan etanol absolut lalu dikeringanginkan
Ditambahkan 30 µl buffer TE dan pellet DNA disuspensikan ke dalam buffer. Stok DNA yang diperoleh disimpan salam freezer pada
suhu ± 20 oC bila tidak digunakan.
Lampiran 4. Proses PCR-RAPD Komposisi Master Mix volume 25 µl
Go Taq PCR 12.5 µl Nuclease free wter 8.0 µl
Primer c.p 2.5 µl
DNA templak 2.0 µl
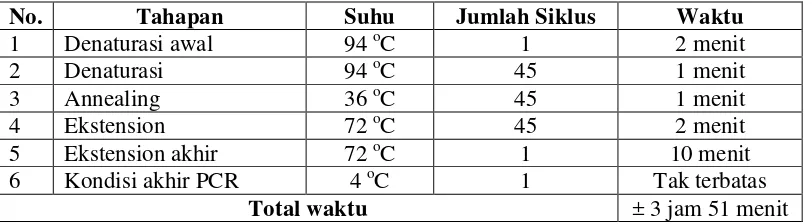
Tabel 1. Proses Amplifikasi PCR
No. Tahapan Suhu Jumlah Siklus Waktu
1 Denaturasi awal 94 oC 1 2 menit
2 Denaturasi 94 oC 45 1 menit
3 Annealing 36 oC 45 1 menit
4 Ekstension 72 oC 45 2 menit
5 Ekstension akhir 72 oC 1 10 menit 6 Kondisi akhir PCR 4 oC 1 Tak terbatas
Total waktu ± 3 jam 51 menit
DAFTAR PUSTAKA
AAK. 1998. Pedoman Bertanam Bawang. Kanisius. Yogyakarta.
Allard, R.W. 2005. Principles of Plant Breeding. John Wiley and Sons. New York.
Azrai, M. 2005. Pemanfaatan Markah Molekuler Dalam Proses Seleksi Pemuliaan Tanaman. Jurnal AgroBiogen 1:26-37.
Bardacki, F. 2001. Random Amplified Polymorphic DNA (RAPD) Markers. Turki Jurnal Biol 25:185-196.
Berita Resmi Statistik Provinsi Sumatera Utara (BRSPSU). 2015. Produksi Cabai Besar, Cabai Rawit, dan Bawang Merah Tahun 2014. Medan.
Brewster. J.L. 2008. Onions and Other Vegetable Allium, 2nd Edition. CAB International. Oxfordshire.
Chen, H.A. 2000. PCR [online]. Chen'sown protocols: Chen’s protocol list: PCR. http://users. breathe.com/hachen/protocols/PCR.html.
Ebrahimi, R, Z., Zamani, A. Kashi. 2009. Genetic diversity evaluation of wild persial shallot (Allium hirtifolium Boiss.) using morphological and RAPD markers. Scientia Horticulturae 119:345-351.
Fatchiyah, Arumingtyas, E.L., Widyarti, S., dan Rahayu, S. 2011. Biologi Molecular: Prinsip Dasar Analisis. Erlangga. Jakarta.
Ferreira, M.E dan D. Gratapaglia. 1998. Introducao Ao Uso De Marcadores Em Analise Genetic. Embrapa-Cenargen.Brasilia.
Hittalmani, S., M.R. Foolad, T. Mew, R.L. Rodriguez, dan N. Huang. 1995. Development of a PCR-Based Marker to Identify Rice Blast Resistance-Gene, Pi-2(t) in a Segregating Population. Theor. Appl. Gen. 91:9-14. Ishak. 1998. Identifikasi DNA Genom Mutan Padi Atomita-2 dan Tetuanya
Menggunakan RAPD Markers. Zuriat 9: 71-83.
Lee, G. A., Kwon, S. J., Park, Y. J., Lee, M. C., Kim, H. H., Lee, J. S., Young, S. Y., Gwag, J. G., Kim, C. K., Ma, K. H. 2011. Crossamplification of SSR markers developed from Allium sativum to other Allium species. Scientia Horticulturae 128:401-407.
Lembaga Ilmu Pengetahuan Indonesi (LIPI). 2010. Hasil Identifikasi Bawang Merah. Universitas Sumatera Utara Press. Medan.
loci from the genome of garlic (Allium sativum L.). Scientia Horticulturae 122:355-361.
Maftuchah dan A. Zainuddin. 2013. Studi Pendahuluan Variasi Genetik Jarak Pagar (Jatrpha curcas L.) Lokal Berdasarkan Random Amplified Polymorphic DNA. Pusat Pengembangan Bioteknologi Universitas Muhammadiyah Malang (123-131).
Mahardika, I.G.N.K. 2003. Polymerase Chain Reaction. Laboratorium Virologi. Fakultas Kedokteran Hewan. Universitas Udayana. Denpasar.
Murray, R.K., Granner, D.K., dan Rodwell, V.W. 2006. Biokimia Harper. Buku Kedokteran EGC. Jakarta.
Mullis, K., Faloona, F., Scharf, S., Saiki, R., Horn, G. and Erlich, H. 1986. Spesific Enzymatic Amplification of DNA Invitro: The Polymerase Chain Reaction. Cold Spring Harbor Symp. Quantit. Biol. 51:263–273.
Numba, S. 2010. Analisis Keragaman Genetic Kultivar Kentang Dan Kentang Spesies Liar. J. Agrivigor 9 (3):305-316, Mei-Agustus 2010; ISSN1412-2286.
Orozco-Castillo, Chalmers, K.J., Waugh, R., Powell, W. 1994. Detection of genetic diversity and selective gene introgression on coffe using RAPD markers. Theor. Appl. Genest. 87.934-940.
Ovesna, J. L., Kucera, J., Hornickova, L., Svobodova, H., Stavelikova, J., Valisek, L., Milella. 2011. Diversity of S-alk(en)nyl cystein sulphoxide content with a collection of garlic (Allium sativum L.) and its association with the morphological and genetic background assessed by AFLP. Scientia Horticulturae 129:541-547.
Perrier, X dan J.P. Jacquemoud-Colled. 2006. DARwin Software. http://darwin.cirad.fr/darwin
Pitojo, S. 2003. Benih Bawang Merah. Kansius. Yogyakarta.
Prana KD, NS Hartati. 2003. Identifikasi Sidik Jari DNA Talas (Colocasia esculenta L. Schott) Indonesia dengan Teknik RAPD (RandomAmplified Polymorphic DNA). Skrining Primer dan Optimasi Kondisi PCR. J. Natur Indonesia Vol 5 (2): 107-112.
Rukmana, R. 1994. Bawang Merah Budidaya Dan Pengolahan Pasca Panen. Kanisius. Jakarta.
, R. 1995. Bawang Merah Budidaya Dan Pengolahan Pasca Panen. Kanisius. Jakarta.
morphological characterization and RAPD Markers. Plant Soil Environment49 (4): 176-182.
Sambrook, J, Fritsch E.F., Maniatis, T. 1989. Molecular Cloning A Laboratory Manual. Second Edition. New York: Cold Spring Harbor Laboratory Pr. Sianipar, J.F.2015. J. Agronom. (151) : 1962-1972. Desember 2015. E-ISSN No.
2337-6597.
Sinclair, P. 1988. The Botany of Onions. Australian Onion Grower. Vol 5:7-10.
Siregar,E. 2016. Bawang merah Impor Ada pada Tahun 2013 dan 2014. Antara Sumut. Diakses melalui
Sitompul, S. M. dan B. Guritno. 1995. Analisis Pertumbuhan Tanaman. Gadjah Mada University Press. Yogyakarta.
Sumarni, N. dan Hidayat, A. 2005. Panduan Teknis Budidaya Bawang Merah. Balai Penelitian Tanaman Sayuran. Lembang.
Sumarsono. 2000. Keanekaragaman Genetik Lima Populasi Kelapa Dalam Dari Jawa Berdasarkan Penanda RAPD. Tesis. PPS IPB. Bogor, hlm. 12-18.
Suparman. 2010. Bercocok Tanam Bawang Merah. Azka Press. Jakarta.
Sutarya, R. dan G. Grubben. 1995. Pedoman Bertanam Sayuran Dataran Rendah. Gadjah Mada University Press. Prosea Indonesia – Balai Penel. Hortikultura Lembang.
Van Steenis, C.G.G.J. 2003. Flora. PT Pradnya Paramita. Jakarta.
Wibowo, S. 2007. Budidaya Bawang Merah. Penebar Swadaya. Jakarta.
Williams, J.G.K., Kubaik, A.R., Livak, K.J., Rafalski, J.A., and Tinge,y S.V. 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers. Nucleic Acid Research 18:6531-6535.
Wilson, K. dan Walker, J. 2010. Principles and Techniques of Biochemistry and Molecular Biology. Cambridge University Press. Cambridge
Wirnas, D. 2005. Analisis Kuantitatif Dan Molekular dalam Rangka Mempercepat Perakitan Varietas Baru Kedelai Toleran Terhadap Intensitas Cahaya Rendah. Falsafah Sains. PPS 702.
Yuwono, T. 2006. Teori dan Aplikasi Polymerase Chain Reaction. Andi Offset. Yogyakarta.
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Terpadu Fakultas Kedokteran
Universitas Sumatera Utara, Medan dimulai pada bulan Maret hingga Mei 2016
Bahan dan Alat
Bahan yang akan digunakan pada penelitian ini adalah daun muda bawang
merah dari beberapa aksesi di Samosir, cetyl trimethyl ammonium bromide
(CTAB) 5%, polyvinilpolypyrolidone (PVPP), buffer ekstraksi CTAB, buffer
TAE, buffer TE, kloroform, isoamilalkohol, NaCl, NaOH, ethylenediamine
tetraacetic (EDTA), HCl, alkohol 70% an absolut, isopropanol, agarose, tris, asam asetat glacial, ethidium bromide (EtBr), DNA marker I00bp Ladder, Go Taq
Green Master Mix, nitrogen cair, loading dye, aquabidestila, primer (OPA-2,
OPA-4, OPA-19, dan OPA-20), label, dan tissue.
Alat yang akan digunakan pada penelitian ini adalah gunting, timbangan
digital, hot plate, mortar, centrifuge, tabung eppendorf 2 ml, freezer, vortex,
mikro pipet 1-50 µl, 100-500 µl, dan 200-1000 µl, sarung tangan karet, tips pipet
(kristal, kuning, biru), autoklaf, kamera, penangas air (water bath), oven, pH
meter, magnetic stirrer, alat-alat gelas (beaker gelas, erlenmeyer, dll), UV
Transluminator (UV Tec Cambridge 20 UV), elektroforesis (Power PAC 3000,
Biorad), PCR (Therma Cycler), Gel-Doc (UV Cambridge), power supply, spektrofotometri, dan alat tulis.
Metode Penelitian
Metode penelitian yang digunakan adalah Metode RAPD (Random
Pelaksanaan Penelitian Pengambilan Sampel Daun
Daun bawang merah yang digunakan adalah daun dari enam aksesi di
Samosir yaitu aksesi Sianjur mula-mula, Harian, Nainggolan, Palipi Simanindo,
dan Pangururan. Daun yang dipilih masih muda/lembut berwana hijau muda,
kemudian dicuci bersih, dilap dengan tissue lalu dibawa ke Laboratorium Terpadu
Fakultas Kedokteran Universitas Sumatera Utara, Medan.
Isolasi dan Pemurnian DNA
Daun bawang merah dicuci dan dikeringkan dengan tissue kemudian
ditimbang masing-masing 0,3 gram. Daun dipotong melintang dengan gunting.
Kemudian daun dimasukkan ke dalam mortar lalu digerus searah jarum jam untuk
membantu memecah dinding sel secara mekanik. Lalu ditambahkan 0,5 ml buffer
ekstraksi CTAB, dan 0,1 g PVPP sebagai antioksidan, lalu digerus lagi hingga
benar-benar halus, kemudian sampel dipindahkan ke dalam tabung eppendorf
2 ml yang telah diisi 1 ml buffer ekstraksi CTAB (bermuatan positif) untuk
memisahkan polisakarida dari DNA (bermuatan negatif). Kemudian ditambahkan
10 µl β-mercaptoetanol supaya menghambat enzim polifenol oksidase
mendegradasi rantai DNA dan senyawa fenol teroksidasi yang ditandai dengan
terbentuk warna coklat pada jaringan tanaman. Tabung divortex hingga rata.
Setelah itu tabung diinkubasi dalam waterbath selama 30 menit pada suhu 650C,
setiap 10 menit sekali tabung dibolak balik dengan perlahan-lahan. Dimasukkan
1 ml larutan KIAA ke dalam tabung dan dikocok hingga homogen menghilangkan
kontaminasi akibat polisakarida. Tabung disentrifugasi dengan kecepatan
13.000 rpm pada suhu ruang selama 10 menit untuk memisahkan
molekul-molekul berdasarkan bobot molekul-molekulnya.
Bila ekstraksi berhasil maka supernatan akan terpisah. Supernatan yang
diperoleh dipindahkan pada tabung eppendorf 2 ml yang lain dan ditambahkan
lagi dengan KIAA lalu disentrifugasi 13.000 rpm lagi selama 10 menit. Setelah
itu, supernatant dipindahkan pada tabung lain dan ditambahkan isopropanol
dingin. Tabung dikocok perlahan dan diperhatikan adanya benang-benang halus
putih yang muncul. Benang yang muncul tampak jelas, tabung disimpan ke dalam
freezer pada suhu 4oC selama 30 menit. Setelah 30 menit, tabung disentrifugasi dengan kecepatan 13.000 rpm selama 10 menit. Kemudian cairan isopropanol
dalam tabung dibuang sedangkan benang-benang halus yang telah mengendap di
dasar tabung ditinggalkan dan dikeringanginkan. Setelah kering, DNA dan
permukaan dalam tabung dicuci dengan etanol absolut kemudian
dikeringanginkan lagi. Setelah itu, dilarutkan dengan 30 µl buffer TE dan dispin
manual agar terbentuk suspensi antara pelet dengan buffer TE. Stok DNA yang
diperoleh disimpan dalam freezer pada suhu ± 20 oC bila tidak digunakan
(Orozco-Castillo dkk., 1994).
Meskipun demikian, dalam suatu teknik isolasi DNA masih diperlukan
suatu tahapan untuk meminimalkan senyawa kontaminan yang dapat mengganggu
reaksi PCR seperti polisakarida dan metabolit sekunder. Hal ini disebabkan
keberadaan polisakarida dan metabolit sekunder dalam sel tanaman sering
menyulitkan dalam isolasi asam nukleat (Maftuchah dan Zainuddin, 2013).
Uji Kuantitas DNA
Pengujian dilakukan dengan menggunakan alat nanophotometer. Larutan
stok DNA diambil sebanyak 2 µl, kemudian alat dijalankan. Absorbansi (Å)
diukur pada panjang gelombang 260 nm dan 280 nm. Tingkat kemurnian DNA
ditentukan dengan nilai perbandingn Å260/Å280. Sampel DNA murni akan
menghasilkan rasio Å260/Å280 berkisar 1,8-2,0. Nilai kemurnian yang lebih dari
2,0 menunjukkan bahwa sampel mengandung kontaminan RNA, sedangkan nilai
kemurnian yang kurang dari 18,0 menunjukkan bahwa sampel mengandung
kontaminan protein (Wilson dan Walker, 2010).
Prinsip dasar pada spektrofotometri adalah sampel harus jernih dan larut
sempurna. DNA yang mengandung basa-basa purin dan pirimidin dapat menyerap
cahaya UV. Pita ganda DNA dapat menyerap cahaya UV pada 260 nm, sedang
kontaminan protein atau phenol dapat menyerap cahaya pada 280 nm. Dengan
adanya perbedaan penyerapan cahaya UV ini, sehingga kemurnian DNA dapat
diukur dengan menghitung nilai absorbansi 260 nm dibagi dengan nilai
absorbansi 280 (Å260/Å280) (Fatchiyah dkk., 2011).
Amplifikasi dan Genotyping
Persiapan awal PCR adalah mencairkan komponen untuk running PCR yaitu
paket PCR produksi Promega dalam kotak berisi pecahan es. Pembuatan larutan
master setiap sampel yang akan digunakan terdiri atas: ddH2O 8,0 µl, Go tag 12,5,
aliquot primer 2,5 µl. Dari tube diambil 21 µl ke tube yang lain sehingga
diperoleh 24 tube untuk PCR dan ditambahkan masing-masing DNA sebanyak 4
µl. Kemudian tabung diisi manual. Tabung berisi stok DNA dan campuran master
dimasukkan dalam block sampel dimesin PCR dengan suhu annealing 36ºC.
Reaksi amplifikasi Gene Amp PCR Applied Biosystem di desain waktu, suhu, dan
jumlah siklus termal 45 kali (3 jam 51 menit).
Keberhasilan teknik ini ditentukan oleh ada tidaknya situs penempelan
primer, kemurnian DNA dan keutuhan DNA cetakan (Bardakci, 2001).
Konsentrasi DNA yang terlalu tinggi dapat meningkatkan kontaminan yang
menggangu reaksi amplifikasi (Chen, 2000).
Meskipun demikian dalam suatu teknik isolasi DNA masih diperlukan
suatu tahapan untuk meminimalkan senyawa kontaminan yang dapat mengganggu
reaksi PCR seperti polisakarida dan metabolit sekunder. Hal ini disebabkan
keberadaan polisakarida dan metabolit sekunder dalam sel tanaman sering
menyulitkan dalam isolasi asam nukleat (Maftuchah dan Zainuddin, 2013).
Elektroforesis
Sebelum dilakukan elektroforesis disiapkan gel agarose konsentrasi 1,5%
(b/v). Agarose ditimbang 1,95 g kemudian dilarutkan dengan menambahkan
130 ml buffer TAE 1x. Larutan tersebut dimasukan ke dalam erlenmeyer,
kemudian dipanaskan dan diaduk dengan pengaduk magnetik hingga larutan
menjadi bening. Setelah larutan dipanaskan kemudian didingikan dan ditambah
larutan etidium bromide 3 µl kemudian dipanaskan kembali lalu didinginkan
dengan cara yang sama. Setelah larutan agak dingin (suhu ± 60º C) larutan
dimasukkan dalam cetakan agar yang telah dipasang sisir pembuat lubang (
well-forming combs) dan dibiarkan memadat selama ± 40 menit atau sampai gel mengeras. Well-forming combs dilepas secara perlahan dan gel agarose siap
digunakan untuk elektroforesis.
Untuk elektroforesis tray yang berisi gel agarose diletakkan dalam tank
elektroforesis dan larutan buffer TAE 1x dituang ke dalam tank tersebut ± 670 ml
(hingga terendam) hingga 1 mm diatas permukaan gel atau sampai batas yang
telah ditemukan. Contoh DNA yang telah disiapkan dimasukkan ke dalam sumur
pada gel.
Setelah semua sampel dimasukkan ke dalam sumur (well), tank
elektroforesis ditutup dan dihubungkan dengan arus listrik. Kemudian proses
elektroforesis siap dijalankan. Running elektroforesis dilakukan pada kondisi
70 volt selama 80 menit. Setelah running elektroforesis selesai arus listrik
dimatikan dan tray diambil dengan menggunakan sarung tangan. Visualisasi DNA
yang telah dielektroforesis dilakukaan dengan UV transluminator dan jika
pita/band molekul DNA kelihatan terang maka didokumentasikan.
Analisis Data
Penentuan Skoring Marka RAPD
Untuk menentukan keragaman genetik, produk PCR-RAPD diskoring
berdasarkan muncul tidaknya pita DNA. Pita yang muncul pada gel diasumsikan
sebagai alel RAPD. Keragaman alel RAPD ditentukan dari perbedaan migrasi alel
pada gel masing-masing individu sampel. Berdasarkan ada atau tidaknya pita,
profil pita diterjemahkan ke dalam data biner. Pita yang muncul diberi kode 1
(ada) dan 0 (tidak ada) ( Ferreira dan Grattapaglia, 1994).
Penentuan Ukuran Pasangan Basa
Ukuran fragmen basa (pasangan basa = bp) produk PCR ditentukan
dengan menggunakan software UVITEC Cambridge Fire Reader. Fragmen DNA
yang digunakan yaitu 1000 bp DNA ladder. Dengan menggunakan software
UVITEC Cambridge FireReader maka ukuran pita DNA hasil amplifikasi dapat
terukur pada gambar. Ukuran pita DNA (base pairs) ini akan berpacuan dari
ladder yang kita gunakan. Program ini akan mengukur pita yang muncul berdasarkan ukuran ladder yang digunakan. Pengukuran pola pita yang terbentuk
ini dengan pendar cahaya DNA yang terbentuk saat proses elektroforesis dengan
sinar UV.
HASIL DAN PEMBAHASAN Data Geografis Enam Aksesi Bawang Merah di Samosir
Sampel diambil dari enam aksesi (Sianjur mula-mula, Harian,
Nainggolan, Palipi Simanindo, dan Pangururan) bawang
merah (Allium ascalonicum L.) di Samosir memiliki data nomor, aksesi,
ketinggian tempat, dan umur tanaman sebagai berikut pada Table 1.
Tabel 1. Data geografis enam aksesi bawang merah di Samosir
Nomor Aksesi Ketinggian
Tempat (mdpl)
Umur Tanaman (MST)
1 Sianjur mula-mula 1100 2
2 Harian 1000 4
3 Nainggolan 1100 3
4 Palipi 1200 2
5 Simanindo 1000 2
6 Pangururan 1000 3
Terlampir pada tabel 1. umur bawang merah yang dianalisis berkisar
2-4 minggu setelah tanam (MST). Karena pada saat pengambilan sampel, bawang
merah pada masing-msing aksesi ditanam dengan waktu tanam yang tidak
serentak dan petani di Samosir tidak menentukan waktu penanaman yang
bersamaan dengan petani lain. Umur tanaman 2-4 MST masih dalam masa
vegetatif dan memenuhi kriteria untuk isolasi DNA yaitu masih meristematik dan
tingkat polisakarida yang rendah. Ini akan membantu memidahkan isolasi dan
purifikasi DNA. Selain umur tanaman, ketinggian tempat asal tanaman (sampel)
bawang merah juga berbeda namun tidak signifikan hanya berkisar 1000-1200
Hasil Uji Kuantitas DNA
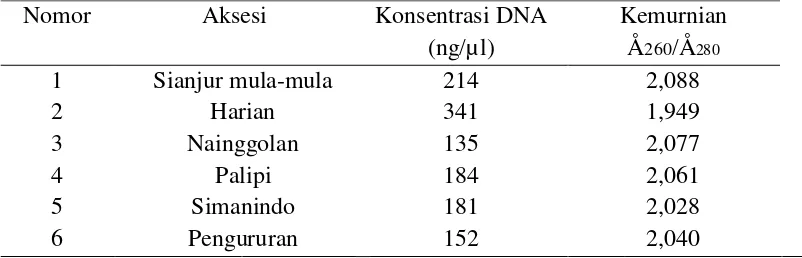
Tabel 2. Hasil uji kuantitatif DNA enam aksesi bawang merah di Samosir
Nomor Aksesi Konsentrasi DNA
(ng/µl)
Kemurnian Å260/Å280
1 Sianjur mula-mula 214 2,088
2 Harian 341 1,949
3 Nainggolan 135 2,077
4 Palipi 184 2,061
5 Simanindo 181 2,028
6 Pengururan 152 2,040
Nilai kemurnian dan konsentrasi DNA hasil isolasi diperoleh dengan Uji
kuantitatif DNA dilakukan secara spektrofotometri pada panjang gelombang
260 nm dan 280 nm. Panjang gelombang 260 nm merupakan serapan maksimum
untuk asam nukleat sedangkan panjang gelombang 280 nm merupakan serapan
maksimum untuk protein.
DNA yang berkualitas tinggi dengan tingkat kemurnian yang tepat
dibutuhkan untuk mendapatkan hasil amplifikasi yang baik dari reaksi PCR. Stok
DNA yang diperoleh dari hasil isolasi daun segar tanaman bawang merah
(Tabel. 2) rata-rata 2,040 dengan selang 1,949-2,088 menunjukkan tingkat
kemurnian yang sesuai dengan Sambrook dkk., (1989) yaitu 1,80-2,00. Apabila
tingkat kemurnian di luar batas selang tersebut berarti masih terdapat kontaminan
yang berupa fenolik, karbohidrat, protein, dan RNA. Kuantitas DNA yang
dihasilkan mempunyai kisaran 135-341 ng/ul. Jumlah ini relatif cukup banyak dan
dapat digunakan untuk reaksi PCR sampai ratusan kali.
Rata-rata konsentrasi DNA yang diperoleh hasil isolasi dan purifikasi
adalah 197 dengan selang 135-341. Tingkat kemurnian cukup baik dan sesuai,
terbukti dari amplifikasi dan genotyping DNA berhasil dilakukan. Salah satu
diisolasi masih muda. Penggunaan organ muda tanaman karena masih
meristematik dan daun bawang merah sendiri tidak mengandung polisakarida
yang tinggi. Sesuai dengan literatur Hittalmani et al. (1995) yang menyatakan
bahwa identifikasi dilakukan pada level DNA, tidak dipengaruhi oleh lingkungan
dan dapat dilakukan pada tahap awal pertumbuhan tanaman.
Hasil PCR dengan marka RAPD
Hasil amplifikasi menggunakan empat primer yang digunakan yaitu
OPA-2, OPA-4, OPA-19, dan OPA-20 pada enam aksesi bawang merah yang
menghasilkan produk PCR yang dapat dibaca dan diskoring, sehingga hasilnya
dapat dianalisis.
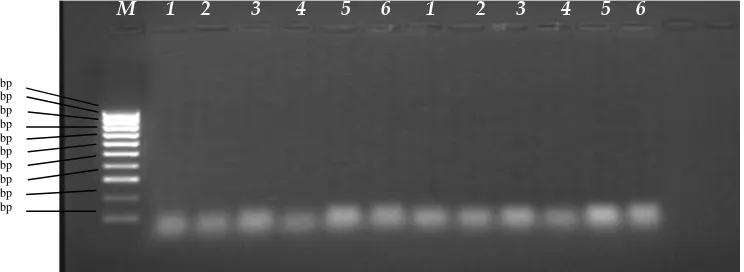
Gambar 1.Elektroforegram amplifikasi DNA enam aksesi bawang merah dengan primer OPA-2 dan OPA-4.
ket; M = marker ladder 100 bp, (1) Sianjur mula-mula, (2) Harian, (3) Nainggolan, (4) Palipi, (5) Simanino, dan (6) Pangururan.
Amplifikasi PCR dengan primer OPA-2 dan OPA-4 dari enam DNA sampel menghasilkan 12 pita 100 bp (Gambar 1).
Gambar 2. Elektroforegram amplifikasi 6 DNA Bawang merah dengan primer OPA-19 dan OPA-20. ket; M = marker ladder 100 bp, (1) Sianjur mula-mula, (2) Harian, (3) Nainggolan,
(4)Palipi, (5) Simanino, dan (6) Pangururan.
M 1 2 3 4 5 6 1 2 3 4 5 6
1000 bp 900 bp 800 bp 700 bp 600 bp 500 bp 400 bp 300 bp 200 bp 100 bp 1000 bp 900 bp 800 bp 700 bp 600 bp 500 bp 400 bp 300 bp 200 bp 100 bp
M 1 2 3 4 5 6 1 2 3 4 5 6
Amplifikasi PCR dengan primer OPA-19 dan OPA-20 pada enam DNA
sampel menghasilkan 12 pita dengan ukuran 100 bp (Gambar 2).
Hasil amplifikasi DNA yang dihasilkan dengan teknik RAPD
menggunakan mesin PCR menunjukkankan bahwa pola pita yang dihasilkan
tidak bervariasi. Keempat primer ini dapat mengenali DNA bawang merah
sehingga primer ini dapat melakukan komplemen sekuen DNA. Ukuran pasangan
basa yang sama antar aksesi bawang merah menunjukkan sifat monomorfis dari
keseluruhan aksesi yang diidentifikasi.
Visualisasi DNA yang telah dielektroforesis dengan UV transluminator
menampilkan pita/band molekul DNA yang tampak terang. Hal ini membuktikan
bahwa kemurnian dan konsentrasi DNA memenuhi syarat dan cukup baik
sehingga primer dapat menempel (annealing) pada untaian DNA bawang merah,
akan tetapi intensitas pita hasil visualisasi sedikit berbeda satu sama lain.
Williams dkk., (1990) menyatakan bahwa bila pita yang muncul memiliki ukuran
basa dan intensitas yang bervariasi dipengaruhi oleh sebaran situs penempelan
primer pada genom, kemurnian DNA dan konsentrasi DNA dalam reaksi.
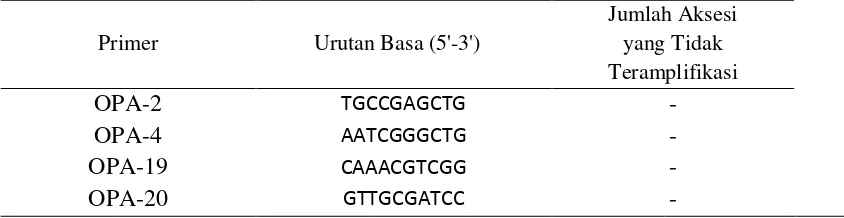
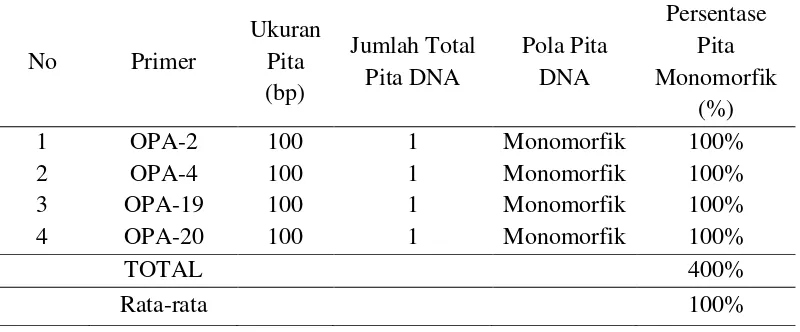
Tabel 3. Hasil amplifikasi empat primer yang digunakan
Primer Urutan Basa (5'-3')
Jumlah Aksesi yang Tidak Teramplifikasi
OPA-2 TGCCGAGCTG -
OPA-4 AATCGGGCTG -
OPA-19 CAAACGTCGG -
OPA-20 GTTGCGATCC -
Pola pita yang dihasilkan oleh empat primer yang digunakan
memperlihatkan pola pita yang tidak berbeda. Ukuran pita-pita yang dihasilkan
terletak pada 100 bp. Total pola pita dari keempat primer yang tampak sebanyak
empat dengan rata-rata satu pita per primer yang monomorfik 100%.
Penelitian ini menggunakan primer acak (random primer) lebih dari satu,
agar hasil analisis yang dilakukan lebih akurat. Masing-masing primer dengan
urutan basa yang berbeda. Sehingga peluang besar untuk mendeteksi perubahan
dan perbedaan pada gen tanaman bila ada. Menurut Ishak (1998), penggunaan
primer yang lebih dari satu dikarenakan semakin banyak jenis primer yang
digunakan akan menambah kemampuan mendeteksi perubahan yang kecil dan
pasangan yang kecil dan pasangan basa genom.
Kualitas DNA yang diperoleh cukup bagus karena keseluruhan DNA
contoh dapat teramplifikasi dengan PCR menggunakan primer acak (random
primer). Hal ini sesuai dengan pernyataan Numba (2010) bahwa faktor yang mempengaruhi keberhasilan PCR adalah ukuran/panjang primer yang digunakan,
tingkat konsentrasi dan kemurnian DNA, komposisi primer acak (urutan
nukleotida) yang digunakan dan enzim Taq DNA polymerase.
Tabel 4. Jumlah fragmen DNA dan tingkat keinformatifan masing-masing primer
No Primer
Ukuran Pita (bp) Jumlah Total Pita DNA Pola Pita DNA Persentase Pita Monomorfik (%)
1 OPA-2 100 1 Monomorfik 100%
2 OPA-4 100 1 Monomorfik 100%
3 OPA-19 100 1 Monomorfik 100%
4 OPA-20 100 1 Monomorfik 100%
TOTAL 400%
Rata-rata 100%
Pola pita monomorfisme ini menggambarkan tidak adanya tingkat
keragaman genetik dari bawang merah yang dianalisis. Bila tingkat keragaman
genetik diantara aksesi bawang merah tinggi, seharusnya menunjukkan pita
polimormik, dimana jumlah dan pola pita yang bervariasi. Maka tidak perlu
tanaman yang dianalisis menggunakan software DARwin 5.05
(Perrier dan Jacquemoud-Collet, 2006).
Hasil analisis pola pita monomorfis 100% menunjukkan bahwa perbedaan
warna, panjang, dan ketebalan daun tersebut tidak disebabkan karena adanya
keragaman genetik bawang merah. Tetapi karena keadaan lingkungan yang tidak
sama di setiap areal pertanaman petani seperti kondisi tanah yang berbatu, air
tanah, intensitas cahaya matahari dan sumber air. Hal ini sesuai dengan
pernyataan Allard (2010) yang menyatakan bahwa gen dari tanaman tidak dapat
menyebabkan berkembangnya suatu karakter terkecuali bila mereka berada dalam
kondisi yang sesuai. Jika mereka berada dalam kondisi yang tidak sesuai maka
tidak ada pengaruh gen terhadap berkembangnya karakteristik dengan mengubah
tingkat keadaan lingkungan.
KESIMPULAN DAN SARAN Kesimpulan
Hasil analisis dari enam aksesi (Sianjur mula-mula, Harian, Nainggolan,
Palipi Simanindo, dan Pangururan) bawang merah (Allium ascalonicum L.) di Samosir berdasarkan empat primer (OPA-2, OPA-4, OPA-19, dan OPA-20)
menunjukkan fragmen tunggal dengan ukuran sama besar sekitar 100 bp dan
persentase pita monomorfik 100%. Hasil penelitian ini menunjukkan tidak ada
keragaman genetik dari enam aksesi bawang merah yang diamati di Samosir.
Saran
Perlu dilakukan penelitian lebih lanjut untuk menganalisis bawang merah
dari aksesi di daerah lain dengan cangkupan yang lebih luas dengan menggunakan
TINJAUAN PUSTAKA Botani Tanaman
Menurut Van Steenis (2003) bawang merah dapat diklasifikasikan sebagai
berikut: Kingdom Plantae, divisi Spermatophyta, subdivisi Angiospermae,
kelas Monocotyledonae, ordo Liliales, famili Liliaceae, genus Allium,
spesies Allium ascalonicumL.
Bentuk daun tanaman bawang merah seperti pipa, yakni bulat kecil
memanjang antara 50-70 cm, berlubang, bagian ujungnya meruncing, berwarna
hijau muda sampai hijau tua, dan letak daun melekat pada tangkai yang ukurannya
relatif pendek (Rukmana, 1994).
Tanaman bawang merah memiliki batang sejati (discus), yang merupakan
bagian seperti kayu yang berada pada dasar umbi bawang merah, sebagai tempat
melekatnya perakaran dan mata tunas. Pangkal daun akan bersatu dan membentuk
batang semu. Yang kelihatan seperti batang pada tanaman bawang merah
sebenarnya merupakan batang semu yang akan berubah bentuk dan fungsinya
sebagai umbi lapis (Sinclair, 1988).
Bentuk daun bawang merah memanjang seperti pipa dan berbentuk bulat,
tetapi ada juga yang membentuk setengah lingkaran pada penampang melintang
daun. Bagian ujung daun meruncing, sedangkan bagiaan bawahnya melebar dan
membengkak. Daun berwarna hijau (Brewster, 2008).
Bunga bawang merah merupakan bunga sempurna, memiliki benang sari
dan kepala putik. Tiap kuntum bunga terdiri atas enam daun bunga yang berwarna
putih, enam benang sari yang berwarna hijau kekuning-kuningan, dan sebuah
putik. Kadang-kadang di antara kuntum bunga bawang merah ditemukan bunga
bunga banyak, namun bunga yang berhasil mengadakan persarian relatif sedikit
(Pitojo, 2003).
Buah berbentuk bulat dengan ujungnya tumpul membungkus biji
berjumlah 2-3 butir. Bentuk biji pipih, sewaktu masih muda berwarna bening atau
putih, tetapi setelah tua menjadi hitam. Biji-biji berwarna merah dapat
dipergunakan sebagai bahan perbanyakan tenaman secara generatif
(Rukmana, 1995).
Umbi bawang merah merupakan umbi ganda ini terdapat lapisan tipis yang
tampak jelas, dan umbi-umbinya tampak jelas juga sebagai benjolan kekanan dan
kekiri, dan mirip siung bawang putih. Lapisan pembungkus siung umbi bawang
merah tidak banyak, hanya sekitar 2 sampai 3 lapis dan tipis yang mudah kering.
Sedangkan lapisan dari setiap umbi berukuran lebih banyak dan tebal. Maka besar
kecilnya siung bawang merah tergantung oleh banyak dan tebalnya lapisan
pembungkus umbi (Suparman, 2010).
Syarat Tumbuh Iklim
Tanaman bawang merah lebih optimum tumbuh di daerah beriklim kering.
Tanaman bawang merah peka terhadap curah hujan dan intensitas hujan yang
tinggi serta cuaca berkabut. Tanaman ini membutuhkan sinar matahari yang
maksimal (minimal 70% penyinaran), suhu udara 25-32 °C, dan kelembapan nisbi
(RH) 50-70 % (Sumarni dan Hidayat, 2005).
Bawang merah dapat tumbuh dengan baik pada dataran rendah dengan
ketinggian tempat 10-250 meter diatas permukaan laut (mdpl). Pada ketinggian
yang berarti suhunya rendah pertumbuhan tanaman terhambat dan umbinya
kurang baik (Wibowo, 2007).
Tanah
Bawang merah menghendaki struktur tanah remah. Tanah remah memiliki
perbandingan bahan padat dan pori-pori yang seimbang. Bahan padat merupakan
tempat berpegang akar. Tanah remah lebih baik daripada tanah bergumpal
(AAK, 1998)
Tanaman bawang merah memerlukan tanah berstruktur remah, tekstur
sedang sampai liat, drainase/aerasi baik, mengandung bahan organik yang cukup,
dan reaksi tanah tidak masam (pH tanah : 5,6-6,5). Tanah yang paling cocok
untuk tanaman bawang merah adalah tanah aluvial atau latosol
(Sutarya dan Grubben, 1995).
Keragaman Genetik
Untuk mempelajari keanekaragaman genetik pada tanaman dapat
dilakukan dengan cara analisis langsung terhadap sifat morfologi agronomi,
melalui penggunaan penanda tertentu baik pada tingkat sitologi maupun
molekuler, ataupun melalui analisis kimiawi jaringan tanaman. Penanda adalah
karakter yang dapat diturunkan dan berasosiasi dengan genotip tertentu.
Sedangkan penanda DNA dapat digunakan untuk menganalisis keanekaragaman
genetik dengan lebih baik karena penanda DNA mampu menampakkan
polimorfisme pola pita DNA dalam jumlah banyak, konsisten, dan tidak
dipengaruhi lingkungan (Sumarsono, 2000).
Perbedaan susunan genetik merupakan salah satu faktor penyebab
keragaman penampilan tanaman. Program genetik yang akan diekspresikan pada
menghasilkan keragaman pertumbuhan tanaman. Keragaman penampilan tanaman
akibat perbedaan susunan genetik selalu mungkin terjadi sekalipun bahan
tanaman yang digunakan berasal dari jenis tanaman yang sama
(Sitompul dan Guritno, 1995).
Lingkungan yang sering mempengaruhi tanaman adalah lingkungan yang
terdapat dekat di sekitar tanaman dan disebut lingkungan mikro. Faktor ini
tergantung dari gen tanaman menerima respon dari lingkungan tersebut. Gen dari
tanaman tidak dapat menyebabkan berkembangnya suatu karakter terkecuali bila
mereka berada dalam kondisi yang sesuai. Jika mereka berada dalam kondisi yang
tidak sesuai maka tidak ada pengaruh gen terhadap berkembangnya karakteristik
dengan mengubah tingkat keadaan lingkungan (Allard, 2005).
Genetik molekuler memainkan peranan penting pada berbagai aspek
konservasi tanaman seperti untuk deteksi, karakterisasi yang dulu dilakukan
secara langsung dengan pengamatan fenotipik. Dengan kemajuan dibidang biologi
molekuler pengamatan dapat dilakukan dengan lebih teliti pada level DNA yaitu
dengan bantuan penanda DNA. Bila dibandingkan pengamatan fenotipik,
karakterisasi dengan bantuan penanda molekuler manjanjikan akurasi dan
efisiensi yang lebih tinggi. Identifikasi dilakukan pada level DNA, tidak
dipengaruhi oleh lingkungan dan dapat dilakukan pada tahap awal pertumbuhan
tanaman (Hittalmani et al., 1995).
Polymerase Chain Reaction (PCR)
Reaksi berantai polimerase (polymerase chain reaction / PCR) adalah
metode amplifikasi suatu sekuen DNA tertentu. PCR merupakan cara yang
sensitif, selektif, dan sangat cepat untuk memperbanyak sekuen DNA yang
melipatkgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan
cara in vitro. Metode ini pertama kali dikembangkan pada tahun 1985 oleh Kary
B. Mullis. Metode PCR tersebut sangat sensitive. Sensivitas tersebut menjadikan
PCR dapat digunakan untuk melipatgandakan satu molekul DNA. Kelebihan lain
metode PCR adalah bahwa reaksi ini dapat dilakukan dengan menggunakan
komponen dalam jumlah sangat sedikit (Yuwono, 2006).
Beberapa faktor yang mempengaruhi hasil PCR adalah: konsentrasi dan
kemurnian DNA contoh, ukuran/panjang primer, komposisi primer (urutan
nukleotida), konsentrasi ion magnesium, dan enzim Taq-DNA polymerase
(Numba, 2010).
Primer adalah suatu sekuen pendek DNA yang menunjukkan adanya
polimorfisme antara individu berbeda dalam satu spesies. Penanda molekuler
mempunyai tingkat polimorfisme yang sangat tinggi, jumlahnya tidak terbatas,
tidak dipengaruhi oleh lingkungan, dan tingkat heritabilitasnya hampir 100%.
Suatu penanda akan efektif jika dapat membedakan antara dua tetua yang berbeda
genotipenya dan dapat dideteksi dengan mudah dalam populasi yang diuji
(Wirnas, 2005).
Primer berupa untai DNA pendek yang menempel pada fragmen DNA
target serta sebagai tempat awal terjadinya replikasi. Reaksi PCR membutuhkan
suatu buffer yang mengandung MgCl2 karena aktivitas enzim polimerase
dipengaruhi oleh konsentrasi ion Mg2+. Ion Mg2+ akan menstimulasi aktivitas
enzim secara maksimal pada konsentrasi 2 mM. Jika konsentrasinya lebih tinggi,
maka dapat bersifat sebagai inhibitor (Sambrook, 1989).
Bila pita yang muncul memiliki ukuran basa dan intensitas yang
penempelan primer pada genom, kemurnian DNA, dan konsentrasi DNA dalam
reaksi. Banyaknya pita yang dihasilkan pada setiap primer tergantung pada
sebaran situs yang homolog pada genom (Williams dkk., 1990).
Keunggulan PCR yaitu Polimerase-DNA dapat diarahkan untuk sintesis
wilayah DNA tertentu. Teknik PCR sebenarnya mengeksploitasi berbagai sifat
alami replikasi DNA. Dalam proses tersebut, polimerase DNA menggunakan
DNA berserat tunggal sebagai cetakan untuk mensintesis serat baru yang
komplementer. Cetakan berserat tunggal dapat diperoleh dengan mudah
dilaboratorium melalui pemanasan DNA berserat ganda pendek untuk memulai
(prime) proses sintesis. Posisi awal dan akhir sintesis DNA pada PCR dapat
ditentukan dengan menyediakan suatu oligonukleotida sebagai primer yang
menempel secara komplementer pada cetakan sesuai dengan keinginan peneliti
dan PCR menghasilkan amplifikasi wilayah DNA tertentu. Serat DNA dapat
berfungsi sebagai cetakan untuk mensintesis bila primer oligonukleotida
disediakan untuk masing-masing serat (Mahardika, 2003).
Random Amplified Polymorphic DNA (RAPD)
Penanda molekuler dapat dilakukan dengan RLFP (Ristriction Fragment
Polymorphism), AFLP (Amplified Fragment Length Polymorphism), SSR (Single
Sequence Repeat), dan RAPD (Random Amplified Polimorphic DNA). (Ebrahimi
et al., 2009, Ovesna et.al., 2011, Ma et al., 2009, Lee et al., 2011). Penanda RAPD memiliki kelebihan yaitu lebih sederhana, DNA yang dibutuhkan sedikit,
mampu menghasilkan polimorfisme lebih cepat. Kekurangan metoda RAPD
adalah tingkat pengulangan yang rendah, tetapi dapat dijaga dengan konsistensi
kondisi PCR (Prana dan Hartati, 2003).
Salah satu pendekatan untuk mengetahui keragaman genetik dan hubungan
kekerabatan serta mendeteksi pohon induk yang berproduksi tinggi adalah
menggunakan RAPD. RAPD merupakan marka molekuler yang lebih cepat, lebih
murah dan lebih mudah dibandingkan AFLP dan RFLP dalam mempelajari
keragaman genetik, hubungan kekerabatan antar genotip dan identifikasi varietas.
Marka DNA hasil penelitian ini dapat digunakan sebagai indikator seleksi tanpa
dipengaruhi lingkungan, juga dapat digunakan mengidentifikasi aksesi-aksesi,
koleksi plasma nutfah baik itu hasil persilangan atau yang berasal dari daerah lain
tanpa menunggu tanaman tersebut berproduksi dan materi-materi genetik hasil
persilangan diperlukan untuk evaluasi dalam upaya penemuan varietas unggul
produksi tinggi (Samal et al., 2003).
Teknik RAPD hanya digunakan pada satu primer arbitrasi yang dapat
menempel pada kedua utas DNA setelah didenaturasi pada situs tertentu yang
homolog dengan spesifitas penempelan yang tinggi. Potongan DNA yang
teramplifikasi berdasarkan pilihan penempelan yang bersifat acak dan tidak harus
berkaitan dengan gen tertentu. Penggunaan penanda RAPD relatif sederhana dan
mudah dalam hal preparasi. Teknik RAPD memberikan hasil yang lebih cepat
dibandingkan dengan teknik molekuler lainnya. Teknik ini juga mampu
menghasilkan jumlah karakter yang relatif tidak terbatas, sehingga sangat
membantu untuk keperluan analisis keanekaragaman organisme yang tidak
diketahui latar belakang genomnya, baik organisme tingkat tinggi (eukariot)
maupun organisme tingkat rendah (prokariot) (Bardakci, 2001).
Keunggulan teknik RAPD antara lain kuantitas DNA yang dibutuhkan
sedikit, hemat biaya, mudah dipelajari dan primer yang diperlukan sudah banyak
RAPD untuk meningkatkan efisiensi seleksi awal. Teknik RAPD telah banyak
diaplikasikan dalam kegiatan pemuliaan tanaman, antara lain analisis keragaman
genetik plasma nutfah tanaman (padi, kapas, dan jeruk mandarin), dan analisis
populasi genetik tanaman (kakao dan kelapa) (Azrai, 2005).
PENDAHULUAN Latar Belakang
Bawang merah (Allium ascalonicum L.) merupakan satu dari berbagai tanaman hortikultura yang berpotensi untuk dikembangkan baik dari dataran
rendah sampai dataran tinggi di Indonesia khususnya Sumatera Utara. Petani di
Samosir membudidayakan bawang merah dan menjadikan itu sebagai mata
pencaharian mereka. Namun sampai sekarang ini fluktuasi harga bawang merah
tergolong tinggi sehingga mempengaruhi perekonomian petani.
Hasil penelitian LIPI (2010), ternyata bawang merah mengandung
senyawa yang berkhasiat sebagai anti inflamasi dan antioksidan seperti kuersetin
untuk antikanker pada regulasi siklus sel. Kandungan lain dari bawang merah
diantaranya protein, mineral, sulfur, antosianin, kaemferol, karbohidrat, dan serat.
Potensi bawang merah yang berperan penting untuk keperluan medis, kosmetik,
dan bumbu yang tidak tergantikan menjadi alasan utama mengapa bawang merah
akan semakin diminati di masa mendatang. Maka perlu dilakukan upaya
pemuliaan tanaman agar diperoleh sumber bahan tanam yang unggul yang dapat
menghasilkan kualitas tinggi. Salah satu dasar pemuliaan tanaman adalah adanya
ketersediaan keragaman yang tinggi pada tanaman tersebut, sehingga
memungkinkan dapat dilakukan seleksi terhadap bibit yang diinginkan.
Prospek dan potensi bawang merah sangat besar, dapat dilihat dari
kebutuhan bawang merah yang semakin meningkat berbanding lurus dengan
pertambahan penduduk. Oleh karena itu pengusahaan bawang merah Sumatera
Utara perlu ditingkatkan dalam kuantitas, kualitas, dan kontinuitas. Data BRSPSU
(2015) menyatakan bahwa produksi bawang merah tahun 2014 sebesar 7.810 ton.
menurunnya produktivitas sebesar 0,14 ton per hektar (1,74%) dan luas panen
menurun sebesar 45 hektar (4,29%) dibandingkan tahun 2013. Sehingga
diperlukan impor bawang merah untuk menutupi kekurangan dari kebutuhan
bawang merah tersebut. Beberapa tahun terakhir, pemerintah Sumatera Utara
mengimpor bawang merah untuk memenuhi kebutuhan penduduknya. Terbukti
dari laporan Siregar (2016) di Antara Sumut, pada tahun 2014 pemerintah
Sumatera Utara mengimpor bawang merah 15.684 ton dari Thailand, India, dan
Vietnam.
Impor bawang merah dapat ditekan dengan pengembangan bawang merah
melalui kegiatan pemuliaan seperti karakterisasi dan evaluasi keragaman genetik
untuk menghasilkan klon berdaya hasil tinggi. Strategi penelitian dan
pengembangan bawang merah di Sumatera Utara diarahkan pada efisiensi usaha
tani dan peningkatan produktivitas melalui perbaikan dalam hal budidaya dan
genetik tanaman.
Dalam pengelolaan plasma nutfah, karakterisasi tanaman diperlukan
untuk mengidentifikasi jenis atau varietas bawang merah dalam menyusun
deskripsi varietas tetua sebagai substansi sifat keturunan yang diseleksi pada
program pemuliaan, dan menentukan kekerabatan atau hubungan genetik diantara
aksesi bawang merah tersebut. Informasi ini sebagai data bagi pemulia tanaman
seperti: membedakan genotip intra maupun inter spesies, perbaikan produktivitas,
ketahanan terhadap hama penyakit, toleran kekeringan, dan sebagainya.
Karakterisasi berdasarkan sejumlah karakter yang berbeda dari suatu spesies yang
sama dapat berupa analisis keragaman genetik. Tentunya hal ini dapat diterapkan
pada bawang merah dari beberapa aksesi di Samosir, Sumatera utara.
Namun kendalanya, sampai saat ini gambaran deskripsi bawang merah di
Sumatera Utara masih didasarkan pada karakter morfologi dan agronomi.
Keragaman secara fenotip (morfologi) ditunjukkan melalui perbedaan karakter
warna, bentuk, panjang jumlah anakan, diameter umbi, bentuk umbi, bobot umbi
dan produktivitas. Deskripsi ini dinilai kurang akurat dan tidak sepenuhnya
memenuhi syarat sebagai informasi dalam pengembangan bawang merah karena
karena sifat-sifat yang kelihatan merupakan interaksi genetik dan kondisi
lingkungan. Untuk mendukung pengembangan bawang merah di Sumatera Utara
diperlukan kegiatan pemuliaan yang dapat menghasilkan klon bawang merah
yang berdaya hasil tinggi, salah satunya adalah mengkarakterisasi dan
mengevaluasi keragamana genetik, maka dari itu diperlukan data tingkat
molekuler.
Identifikasi keragaman genetik dapat dilakukan melalui pendekatan
morfologi dan molekuler. Perbedaan karakter morfologi dapat digunakan untuk
mengkarakterisasi pola diversitas genetik, namun sifat yang ditunjukkan hanya
dalam proporsi kecil dari karakter genetik dan cenderung dipengaruhi oleh kondisi
lingkungan. Oleh karena itu identifikasi genetik secara molekuler diperlukan
untuk melengkapi keterbatasan data keragaman genetik menggunakan penanda
DNA (Deoxyribose Nucleid Acid / Asam Deoksiribosa Nukleat). Identifikasi
genetik lebih akurat karena bersifat stabil, tidak dipengaruhi oleh faktor
lingkungan. Pelaksanaannya juga dapat dilakukan tanpa menunggu tanaman
sampai berproduksi dengan bantuan alat penanda molekuler
Salah satu teknologi bidang biologi molekuler untuk mendeteksi
keragaman genetik adalah penanda RAPD (Random Amplified Polimorphic
keunggulan antara lain: kuantitas DNA yang dibutuhkan sedikit, hemat biaya,
mudah dipelajari dan primer yang diperlukan sudah banyak dikomersialisasikan
sehingga mudah diperoleh dan cepat menunjukkan tingkat polimorfis. Lagi pula
selain tanaman musiman, analisis keragaman genetik pada tanaman tahunan juga
menggunakan teknologi RAPD untuk meningkatkan efisiensi seleksi. Namun
metoda RAPD memiliki kurangan yaitu tingkat pengulangan yang rendah, tetapi
dapat diatasi dengan konsistensi kondisi PCR (Polymerase Chain Reaction).
Metode PCR sangat sensitif sehingga digunakan untuk melipatgandakan DNA
meskipun dalam jumlah yang sedikit.
Tujuan Penelitian
Penelitian ini bertujuan untuk evaluasi keragaman genetik bawang merah
(Allium ascalonicum L.) pada beberapa aksesi di Samosir menggunakan Marka
RAPD (Random Amplified Polymorphic DNA)
Hipotesis Penelitian
Ada keanekaragaman genetik pada enam aksesi bawang
merah (Allium ascalonicumL.) di Samosir yang diamati.
Kegunaan Penelitian
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di
Fakultas Pertanian Universitas Sumatera Utara Medan, dan sebagai sumber
informasi bagi pihak yang membutuhkan.
ABSTRAK
ROSLINA HULU: Analisis Keragaman Genetik Bawang Merah (Allium ascalonicum L.) pada Beberapa Aksesi di Samosir Menggunakan Marka RAPD (Random Amplified PolymorphicDNA), dibimbing oleh MARIATI dan EDISON PURBA. Beberapa tahun terakhir, pemerintah Sumatera Utara mengimpor bawang merah untuk memenuhi kebutuhan penduduknya yang semakin meningkat seiring dengan pertambahan penduduk. Hal ini dapat ditekan dengan pengembangan bawang merah melalui kegiatan pemuliaan seperti karakterisasi dan evaluasi keragaman genetik untuk menghasilkan klon berdaya hasil tinggi. Namun sejauh ini, deskripsi bawang merah di Sumatera Utara masih terbatas pada morfologi dan agronomi. Data ini kurang akurat karena sifat-sifat yang kelihatan merupakan interaksi genetik dan lingkungan, sehingga diperlukan data tingkat molekuler. Identifikasi genetik dengan penanda molekuler akurat karena tidak dipengaruhi lingkungan. Salah satu teknologi bidang biologi molekuler untuk mendeteksi keragaman genetik adalah teknologi penanda RAPD untuk meningkatkan efisiensi seleksi. Tujuan penelitian ini untuk menganalisis keragaman genetik bawang merah pada beberapa aksesi di Samosir menggunakan Marka RAPD. Penelitian dilakukan di Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara pada Maret hingga Mei 2016. Materi genetik yang dianalisis berasal dari enam aksesi yaitu: Aksesi Sianjur mula-mula, Harian, Nainggolan, Palipi, Simanindo dan Pangururan menggunakan empat primer acak: OPA-2, OPA-4, OPA-19, dan OPA-20. Setiap sampel DNA diamplifikasi menurut metode elektroforesis. Amplifikasi empat primer tersebut menghasilkan fragmen tunggal dengan ukuran sama besar sekitar 100 bp dan persentase pita monomorfik 100%. Hasil penelitian ini menunjukkan tidak ada keragaman genetik dari enam aksesi bawang merah yang diamati di Samosir
ABSTRACT
ROSLINA HULU: Genetic Variability Analysis of accessions the shallot (Allium ascalonicum L.) in Samosir Based on the RAPD (Random Amplified Polymorphic DNA) Markers, supervised by MARIATI and EDISON PURBA. In last few years, North Sumatera Provincial Government has been imported the shallot to meet the needs of the ever increasing population. It can be suppressed by the development of the shallot through breeding such as characterization and evaluation of genetic diversity to produce high yielding clones. But so far description of the shallot in Norh Sumatera still limited to morphological and agronomic. This data is less accurate because the properties that seem is interaction between genetic and environmental, so needed the molecular level data. Identification of genetic molecular markers is accurate because it is not influenced by the environment. One of the technologies of molecular biology to detect the genetic diversity is RAPD marker technology to improve the efficiency of selection. The aim of the research was to analyze genetic variability of accessions the shallot in Samosir based on the RAPD marker. The research was conducted in Integrated Laboratory, Medicines Faculty, Sumatera Utara University began from March up to May 2016. The genetic material that analized came from six accessions i.e.: Sianjur mula-mula, Harian, Nainggolan, Palipi, Simanindo dan Pangururan by using four random primers i.e.: OPA-2, OPA-4, OPA-19, and OPA-20. Every DNA sample amplified by electrophoresis method. Amplification of four primers produces single fragment with same size about 100 bp and percentage of monomorpic band is 100%. The research shwoed no genetic variability by six accessions of shallot that observed in Samosir.
ANALISIS KERAGAMAN GENETIK BAWANG MERAH (Allium ascalonicum L.) PADA BEBERAPA AKSESI DI SAMOSIR MENGGUNAKAN MARKA
RAPD (Random Amplified Polymorphic DNA)
SKRIPSI
Oleh:
ROSLINA HULU / 120301246 AGROEKOTEKNOLOGI-BPP
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
ANALISIS KERAGAMAN GENETIK BAWANG MERAH (Allium ascalonicum L.) PADA BEBERAPA AKSESI DI SAMOSIR MENGGUNAKAN MARKA
RAPD (Random Amplified Polymorphic DNA)
SKRIPSI
Oleh:
ROSLINA HULU / 120301246 AGROEKOTEKNOLOGI-BPP
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul Penelitian : Analisis Keragaman Genetik Bawang Merah (Allium ascalonicum L.) pada Beberapa Aksesi di Samosir Menggunakan Marka RAPD (Random Amplified Polymorphic DNA)
Nama : Roslina Hulu
NIM : 120301246
Program Studi : Agroekoteknologi
Minat : Budidaya Pertanian dan Perkebunan
Disetujui Oleh : Komisi Pembibing
Ir. Mariati, M.Sc. Ketua Anggota
Mengetahui
Prof. Ir. T. Sabrina, MSc.
ABSTRAK
ROSLINA HULU: Analisis Keragaman Genetik Bawang Merah (Allium ascalonicum L.) pada Beberapa Aksesi di Samosir Menggunakan Marka RAPD (Random Amplified PolymorphicDNA), dibimbing oleh MARIATI dan EDISON PURBA. Beberapa tahun terakhir, pemerintah Sumatera Utara mengimpor bawang merah untuk memenuhi kebutuhan penduduknya yang semakin meningkat seiring dengan pertambahan penduduk. Hal ini dapat ditekan dengan pengembangan bawang merah melalui kegiatan pemuliaan seperti karakterisasi dan evaluasi keragaman genetik untuk menghasilkan klon berdaya hasil tinggi. Namun sejauh ini, deskripsi bawang merah di Sumatera Utara masih terbatas pada morfologi dan agronomi. Data ini kurang akurat karena sifat-sifat yang kelihatan merupakan interaksi genetik dan lingkungan, sehingga diperlukan data tingkat molekuler. Identifikasi genetik dengan penanda molekuler akurat karena tidak dipengaruhi lingkungan. Salah satu teknologi bidang biologi molekuler untuk mendeteksi keragaman genetik adalah teknologi penanda RAPD untuk meningkatkan efisiensi seleksi. Tujuan penelitian ini untuk menganalisis keragaman genetik bawang merah pada beberapa aksesi di Samosir menggunakan Marka RAPD. Penelitian dilakukan di Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara pada Maret hingga Mei 2016. Materi genetik yang dianalisis berasal dari enam aksesi yaitu: Aksesi Sianjur mula-mula, Harian, Nainggolan, Palipi, Simanindo dan Pangururan menggunakan empat primer acak: OPA-2, OPA-4, OPA-19, dan OPA-20. Setiap sampel DNA diamplifikasi menurut metode elektroforesis. Amplifikasi empat primer tersebut menghasilkan fragmen tunggal dengan ukuran sama besar sekitar 100 bp dan persentase pita monomorfik 100%. Hasil penelitian ini menunjukkan tidak ada keragaman genetik dari enam aksesi bawang merah yang diamati di Samosir
ABSTRACT
ROSLINA HULU: Genetic Variability Analysis of accessions the shallot (Allium ascalonicum L.) in Samosir Based on the RAPD (Random Amplified Polymorphic DNA) Markers, supervised by MARIATI and EDISON PURBA. In last few years, North Sumatera Provincial Government has been imported the shallot to meet the needs of the ever increasing population. It can be suppressed by the development of the shallot through breeding such as characterization and evaluation of genetic diversity to produce high yielding clones. But so far description of the shallot in Norh Sumatera still limited to morphological and agronomic. This data is less accurate because the properties that seem is interaction between genetic and environmental, so needed the molecular level data. Identification of genetic molecular markers is accurate because it is not influenced by the environment. One of the technologies of molecular biology to detect the genetic diversity is RAPD marker technology to improve the efficiency of selection. The aim of the research was to analyze genetic variability of accessions the shallot in Samosir based on the RAPD marker. The research was conducted in Integrated Laboratory, Medicines Faculty, Sumatera Utara University began from March up to May 2016. The genetic material that analized came from six accessions i.e.: Sianjur mula-mula, Harian, Nainggolan, Palipi, Simanindo dan Pangururan by using four random primers i.e.: OPA-2, OPA-4, OPA-19, and OPA-20. Every DNA sample amplified by electrophoresis method. Amplification of four primers produces single fragment with same size about 100 bp and percentage of monomorpic band is 100%. The research shwoed no genetic variability by six accessions of shallot that observed in Samosir.
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Malombu pada tanggal 04 September 1992
dari ayah Saredi Hulu dan ibu Yusniar Zebua. Penulis merupakan anak ketiga dari
delapan bersaudara.
Tahun 2012 penulis lulus dari SMA Negeri 1 Tukka dan pada tahun yang
sama masuk ke Fakultas Pertanian Universitas Sumatera Utara melalui jalur Ujian
Masuk Bersama (UMB). Penulis memilih program studi Agroekoteknologi.
Selama mengikuti perkuliahan, penulis aktif sebagai anggota Himpunan
Mahasiswa Agroekoteknologi (HIMAGROTEK) dan aktif pada Unit Kegiatan
Mahasiswa Kebaktian Mahasiswa Kristen (UKM-KMK). Penulis melaksanakan
Praktek Kerja Lapangan (PKL) di PTPN V Kebun Sei Buatan Afd. II Inti Riau
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena
atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi ini dengan baik
dan tepat pada waktunya.
Adapun judul dari skripsi ini adalah “Analisis Keragaman Genetik
Bawang Merah (Allium ascalonicum L.) pada Beberapa Aksesi di Samosir
Menggunakan Marka RAPD (Random Amplified Polymorphic DNA)”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada orang tua
penulis yang telah memberikan dukungan serta motivasi baik materil maupun
spiritual. Penulis juga mengucapkan terimakasih kepada komisi pembimbing
banyak saran, petunjuk, bimbingan, dan arahan kepada penulis sehingga dapat
menyelesaikan skripsi ini.
Akhir kata penulis mengucapkan terimakasih. Semoga skripsi ini
bermanfaat.
Medan, Maret 2016
DAFTAR ISI
ABSTRAK ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Hipotesis Penelitian ... 4
Kegunaan Penelitian... 4
TINJAUAN PUSTAKA Botani Tanaman ... 5
Syarat Tumbuh ... 6
Iklim ... 6
Tanah ... 7
Keragaman Genetik ... 7
Polymerase Chain Reaction (PCR) ... 8
Random Amplified PolymorphicDNA (RAPD) ... 10
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian ... 13
Bahan dan Alat Penelitian ... 13
Metode Penelitian... 13
Pelaksanaan Penelitian ... 14
Pengambilan Sampel Daun ... 14
Isolasi dan Pemurnian DNA ... 14
Uji Kuantits DNA ... 15
Amplifikasi dan Genotiping ... 16
Elektroforesis ... 17
Analisis Data ... 18
Penentuan Skoring Marka RAPD ... 18
HASIL DAN PEMBAHASAN
KESIMPULAN DAN SARAN
Kesimpulan ... 25 Saran ... 25 DAFTAR PUSTAKA
DAFTAR TABEL
No. Hal.
1. Data geografis enam aksesi bawang merah dari enam aksesi
di Samosi ... ... 19
2. Hasil uji kuantitatif DNA enam aksesi bawang merah di
Samosir ... 19
3. Hasil amplifikasi empat primer yang digunakan ... 22
4. Jumlah fragmen DNA dan tingkat keinformatifan
DAFTAR GAMBAR
No. Hal.
1. Elektroforegram amplifikasi enam DNA bawang merah dengan
primer OPA-2 dan OPA-4 ... 21
2. Elektroforegram amplifikasi enam DNA bawang merah dengan
primer OPA-19 dan OPA-20... 21