PERUBAHAN KARAKTERISTIK KRISTALIN
PATI GARUT (Maranta arundinaceae L.) DALAM
PENGEMBANGAN PATI RESISTEN TIPE III
DIDAH NUR FARIDAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini penulis menyatakan bahwa disertasi yang berjudul: Perubahan
Karakteristik Kristalin Pati Garut (Maranta arundinaceae L.) dalam Pengembangan Pati Resisten Tipe III adalah karya penulis dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada
perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya
yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Disertasi ini.
Bogor, 19 Januari 2011
v
ABSTRACT
DIDAH NUR FARIDAH. The Changes on Crystalline in the Development of Resistant Starch Type III from Arrowroot Starch (Maranta arundinaceae L.). Under the supervision of DEDI FARDIAZ as the chairman, NURI ANDARWULAN and TITI C. SUNARTI as advisory committe members.
Studies on functional properties of nutritious food for health and fitness are increasing in line with the increasing awareness of the importance of healthy living. People consume foods not only to meet the nutritional needs but also to be able to provide functional effects in maintaining health and fitness as well as to improve physiological function. Food that can play a role on the above health effects is known as a functional food.
One of food ingredients that can be used as a raw material for the manufacturing of functional foods is resistant starch (RS). RS is part of starch that is not digestible in a small intestine of a healthy human but it is fermentable by intestinal microflora to produce short chain fatty acids that are related to health. Arrowroot starch is potentially used as a raw material to produce a resistant starch type III (RS3), since naturally it consists of DP 9-30 in amylopectin structure.
The objective of this study was to modify the arrowroot starch to increase RS content by (1) autoclaving-cooling (2) acid hydrolysis (lintnerization) (3) debranching (4) combination of the treatments. This effect of above starch modification on the crystallinity changes of arrowroot starch was also studied.
This research was conducted in three steps as follows: (1) arrowroot starch extraction and characterization, (2) determination of starch modification processes (autoclaving-cooling, acid hydrolysis and debranching conditions), and (3) arrowroot starch modifications. The third steps consisted of different modification treatments, i.e (a) autoclaving-cooling, (b) acid hydrolysis, (c) debranching and autoclaving-cooling cycles, (d) acid hydrolysis and autoclaving-cooling cycles; (e) acid hydrolysis, debranching and autoclaving-cooling cycles.
Arrowroot starch before and after modification was monitored (1) the changes of its chemical components, (2) resistant starch, amylose, reducing sugar content, and in vitro starch digestibility, (3) starch gelatinization profile by Rapid Visco Analyzer (RVA), (4) surface morphology by a polarized microscope and SEM (Scanning Electron Microscope); (5) changes of molecular weight distribution by GPC (Gel Permeation Chromatography (GPC), (6) chain length distribution of amylopectin by FACE (Fluorophore-Assisted Capillary Elec; (7) thermal stability and degree of retrogradation by DSC, and (8) changes of the crystalline and amor-phous regions by FTIR and X-ray diffraction.
A wet starch extraction method yielded 15.69% of arrowroot starch. The arrowroot starch contained starch (98.10%), amylose (24.64%), amylopectin (75.36%), reducing sugar (4.94%) and resistant starch (2.12%). The analysis by RVA showed that arrowroot starch had an A-type starch gelatinization profile.
vi
HCl 2.2N for 2 hours (H2) while debranching by pullulanase at concentration of 1.3 U/g starch (D1) and 10.4 U/g starch (D10) at 50oC for 24-hours incubation.
GPC analysis showed that arrowroot starch modified by autoclaving-cooling (AC), acid hidrolysis (H2), combination of acid hidrolysis and autoclaving-cooling (H2AC), combination of debranching at 1.3 U/g starch or 10.4 U/g starch and autoclaving-cooling (D1AC and D10AC), and combination of acid hidrolysis, debranching and autoclaving-cooling (H2D1AC and H2D10AC) reduced amylo-pectin fraction and increased amylose fraction. The distribution of linear chains by using FACE indicated four groups of degree of polymerization (DP), i.e. DP 6-8, 9-12, 13-24 and 25-30.
Modification treatments of arrowroot starch (AC, H2AC, D1AC, and H2D1AC) increased degree of polymerization (DP) 25-30 which contributed to the formation of RS3. Arrowroot starch debranched at a high concentration of pullulanase (D10AC dan H2D10AC) increased DP 11-12. Autoclaving-cooling treatment increased DP 6-8, especially that of debranched at a high concentration of pullulanase (10.4 U/g starch).
All modification treatments of arrowroot starch raised the levels of RS3 and lowered starch digestibility. The highest resistant starch (39.30%) as the result of modification of arrowroot starch that mimiced to a commercial resistant starch (Novelose 330) was obtained from the combination of acid hydrolisis, debranching (10.4 U/g starch) and 3-cycle autoclaving-cooling.
The X-ray diffraction analysis showed that native arrowroot starch had an A-type crystalline. In exception to that of acid hydrolysis treatment, the arrowroot starch changed to a B-type crystalline after modifications which were accom-panied by the decrease of crystallinity from 20.01% to 9.37%. The analysis of thermal stability by DSC exhibited that modified arrowroot starch increased the degree of retrogradation and the endothermic enthalpy. In addition, FTIR analysis revealed that modification treatments increased the amorphous region by raising the wave number ratio of 1022/995 ranging from 0.991 to 1.030.
It is recommended that resistant starch (RS3) of arrowroot starch can be produced by following procedure: Starch suspension (20%w/w) was hidrolyzed by HCl 2.2N for 2 h at 35oC, preheated at 80oC for 5 minutes, debranched by pullulanase (10.4 U/g starch) at 50oC for 24 h, and 3-cycles of autoclaving at 121oC for 15 minutes and cooling at 4oC for 24 h. This modification process yielded 39.3% resistant starch with in vitro starch digestibility of 54.81%.
vii
RINGKASAN
DIDAH NUR FARIDAH. Perubahan Karakteristik Kristalin Pati Garut (Maranta arundinaceae L.) dalam Pengembangan Pati Resisten Tipe III. Di bawah bim-bingan DEDI FARDIAZ sebagai ketua komisi pembimbing, NURI ANDAR-WULAN dan TITI C. SUNARTI sebagai anggota komisi pembimbing.
Fungsi pangan semakin berkembang, bukan hanya untuk memenuhi kebu-tuhan gizi saja tetapi juga untuk dapat memberikan efek fungsional dalam men-jaga kesehatan dan kebugaran tubuh serta memperbaiki fungsi fisiologis. Pangan yang dapat memberikan efek terhadap kesehatan tersebut dikenal dengan pangan fungsional.
Salah satu ingredien pangan yang dapat dijadikan sebagai bahan baku untuk pembuatan pangan fungsional adalah pati resisten tipe III (RS3). Pati resisten merupakan bagian dari pati yang tidak dapat dicerna oleh usus halus manusia yang sehat tetapi dapat difermentasi oleh mikroflora usus untuk menghasilkan asam lemak rantai pendek yang berkhasiat untuk kesehatan. Pati garut berpotensi untuk digunakan sebagai bahan baku untuk pembuatan RS3.
Penelitian ini bertujuan memodifikasi pati garut untuk meningkatkan kadar pati resisten tipe RS3, yaitu melalui proses (1) autoclaving-cooling, (2) hidrolisis asam; (3) debranching; dan (4) kombinasi hidrolisis asam, debranching dan siklus autoclaving-cooling. Pengaruh modifikasi pati tersebut terhadap perubahan sifat kristalitas dari pati garut juga dipelajari.
Penelitian ini dilakukan dalam tiga tahapan sebagai berikut : (1) Tahap ekstraksi dan karakterisasi pati garut, (2) Tahap penentuan kondisi proses modi-fikasi pati garut (autoclaving-cooling, hidrolisis asam dan debranching), dan (3) Tahap modifikasi pati garut yang terdiri dari perlakuan hidrolisis asam (lintnerization), pemutusan ikatan cabang amilopektin secara enzimatis (debranching) dan pemanasan suhu tinggi dan pendinginan secara berulang (siklus autoclaving-cooling), dan kombinasinya. Tahap ketiga terdiri dari bebe-rapa perlakuan modifikasi, yaitu: (a) autoclaving-cooling, (b) hidrolisis asam, (c) debranching dan siklus autoclaving-cooling, (d) hidrolisis asam dan siklus auto-claving-cooling; (e) hidrolisis asam, debranching dan siklus autoclaving-cooling.
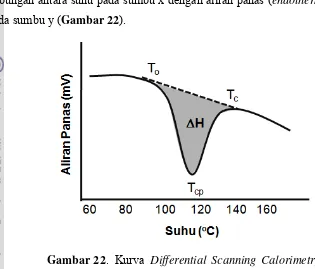
Analisis pati yang dilakukan mencakup (1) analisis proksimat; (2) kadar pati resisten, kadar amilosa, kadar gula pereduksi, dan daya cerna pati in vitro; (3) profil gelatinisasi dengan Rapid Visco Analyzer (RVA); (4) morfologi pati dengan mikroskop polarisasi dan SEM (Scanning Electron Microscope); (5) perubahan struktur pati dengan GPC (Gel Permiation Chromatography); (6) distribusi panjang rantai amilopektin dengan FACE (Fluorophore-Assisted Capillary Elec-trophoresis); (7) kestabilan panas dan derajat retrogradasi dengan DSC (Diffren-tial Scanning Calorimetry); (8) perubahan daerah kristalin dan amorf dengan FTIR (Fourier Transform Infrared Spectroscopy) dan difraksi sinar X.
viii
Proses autoclaving-cooling dilakukan dengan pemanasan awal pada 80oC selama 5 menit dan dilanjutkan dengan 3 siklus autoclaving pada suhu 121oC selama 15 menit dan pendinginan pada suhu 4oC selama 24 jam (AC). Proses hidrolisis asam dilakukan dengan HCl 2,2N selama 2 jam (H2). Proses debranching dengan enzim pullulanase dilakukan pada konsentrasi 1,3 U/g pati (D1) dan 10,4 U/g pati (D10) pada 50oC selama 24 jam.
Hasil analisis GPC memperlihatkan perlakuan modifikasi pati garut, baik dengan autoclaving-cooling (AC), hidrolisis asam (H2), kombinasi hidrolisis asam dan cooling (H2AC), kombinasi debranching dan autoclaving-cooling (D1AC dan D10AC), serta kombinasi hidrolisis asam, debranching dan autoclaving-cooling (H2D1AC dan H2D10AC) menyebabkan penurunan fraksi amilopektin dan peningkatan fraksi amilosa. Distribusi rantai linear baik dari hasil debranching amilopektin maupun hidrolisis amilosa yang diukur dengan menggu-nakan FACE menunjukkan empat rentang derajat polimerisasi (DP), yaitu 6-8, 9-12, 13-24, dan 25-30.
Perlakuan modifikasi pati garut (AC, H2AC, D1AC, dan H2D1AC) meningkatkan DP 25-30 yang berkontribusi pada pembentukan RS3. Perlakuan debranching dengan konsentrasi enzim pullulanase yang tinggi (D10AC dan H2D10AC) meningkatkan DP 11-12. Proses autoclaving-cooling meningkatkan DP 6-8 dengan peningkatan yang cukup besar terutama bila dikombinasikan dengan debranching pada konsentrasi enzim tinggi (H2D10AC).
Semua perlakuan modifikasi pati garut di atas dapat meningkatkan kadar RS3 dan menurunkan daya cerna patinya. Kadar pati resisten tertinggi (39,30%) hasil modifikasi pati garut yang mendekati kadar pati resisten komersial (Nove-lose 330) diperoleh dari perlakuan hidrolisis asam, debranching dengan konsen-trasi tinggi (10,4 U/g pati) dan autoclaving-cooling.
Hasil analisis dengan menggunakan difraksi sinar X menunjukkan bahwa pati garut alami memiliki kristalin tipe A dan berubah menjadi kristalin tipe B setelah mengalami modifikasi dengan semua perlakuan, kecuali pati garut yang hanya diberi perlakuan hidrolisis asam. Perubahan tipe kristalinitas tersebut menyebabkan penurunan derajat kristalinitas dari 20,01% menjadi 9,37%. Hasil analisis kestabilan panas dengan DSC menunjukkan bahwa modifikasi pati garut dapat meningkatkan derajat retrogradasi dan entalpi endotermik. Hasil pengu-kuran dengan FTIR juga memperlihatkan bahwa modifikasi pati garut mening-katkan bagian amorf melalui peningkatan rasio bilangan gelombang 1022/ 995 dari 0,991 hingga 1,030.
ix
Selanjutnya pati garut tersebut dipanaskan pada suhu 121oC selama 15 menit dan pendinginan pada suhu 4oC selama 24 jam (proses autoclaving-cooling dilakukan sebanyak 3 kali siklus). Proses modifikasi tersebut dapat menghasilkan kadar pati resisten sebesar 39,3% dan daya cerna pati sebesar 54,81%.
xi
© Hak Cipta milik IPB, Tahun 2011 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
xiii
PERUBAHAN KARAKTERISTIK KRISTALIN PATI GARUT
(
Maranta arundinaceae
L.) DALAM PENGEMBANGAN
PATI RESISTEN TIPE III
DIDAH NUR FARIDAH
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
xv
Judul Disertasi : Perubahan Karakteristik Kristalin Pati Garut (Maranta arundinaceae L.) dalam Pengembangan Pati Resisten Tipe III Nama : Didah Nur Faridah
NRP : F261060061
Disetujui Komisi Pembimbing
Prof.Dr.Ir. Dedi Fardiaz,MSc Ketua
Dr.Ir. Nuri Andarwulan,MS Dr.Ir. Titi Candra Sunarti
Anggota Anggota
Diketahui,
Ketua Program Studi Ilmu Pangan
Dr.Ir. Ratih Dewanti-Hariyadi,MSc
Dekan Sekolah Pascasarjana
Prof.Dr.Ir. Khairil A. Notodiputro,MS
Tanggal Ujian : Tanggal Lulus :
xvi
Penguji Luar pada Ujian Tertutup: 1. Prof.Dr.Ir Suminar T. Achmadi
2. Dr.Ir. Feri Kusnandar,MSc
Penguji Luar pada Ujian Terbuka: 1. Prof.Dr.Ir, Deddy Muchtadi,MS
xvii
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah Subhanuhu Wata’ala, karena atas karunia dan rahmat-Nya penulis dapat menyelesaikan pendidikan program Doktor Ilmu Pangan di Institut Pertanian Bogor.
Penulis mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada Prof.Dr.Ir. Dedi Fardiaz,MSc sebagai ketua komisi pembimbing serta Dr.Ir. Nuri Andarwulan,MS dan Dr.Ir. Titi Candra Sunarti,MS sebagai anggota komisi pembimbing, karena dengan pengarahan dan bimbingannya penulis dapat menyelesaikan penelitian dan disertasi ini dengan sebaik-baiknya. Penulis juga mengucapkan terima kasih kepada Prof.Dr. Makoto Hisamatsu dan Dr. Naoto Isono di Mie University Jepang yang telah memberikan dukungan fasilitas laboratorium dalam melaksanakan sebagian dari penelitian ini.
Penulis juga mengucapkan terima kasih kepada Prof.Dr. Suminar S. Achmadi dan Dr.Ir. Feri Kusnandar,MSc sebagai penguji luar komisi dalam ujian kualifikasi Doktor dan penguji pada ujian tertutup atas masukannya dalam menyempurnakan disertasi ini. Ucapan terima kasih juga kepada Prof.Dr. Ridwan Thahir dan Prof.Dr.Ir. Deddy Muchtadi,MS sebagai penguji luar komisi pada ujian terbuka.
Penulis juga mengucapkan terima kasih kepada Dekan Fakultas Teknologi Pertanian (Dr.Ir. Sam Herodian) dan Ketua Departemen Ilmu dan Teknologi Pangan (Dr.Ir. Dahrul Syah) di Institut Pertanian Bogor yang telah mengizinkan dan mendukung penulis dalam melanjutkan program pendidikan Doktor Ilmu Pangan ini. Terima kasih juga kepada Ketua Program Studi Ilmu Pangan (Dr.Ir. Ratih Dewanti-Hariyadi,MSc) dan Kepala Laboratorium Analisis Pangan (Dr.Ir. Dede R. Adawiyah,MS) yang selalu mendukung dan menjadi tempat berbagi suka dan duka selama penulis menyelesaikan tugas belajar ini.
Terima kasih juga kepada seluruh kolega staf pengajar dan tenaga kependi-dikan di Departemen Ilmu dan Teknologi Pangan IPB yang tidak penulis sebutkan satu persatu atas dukungannya selama penulis mengikuti program pendidikan ini.
Terima kasih kepada Ditjen DIKTI atas dukungan beasiswa BPPS selama masa studi, pemberian dana penelitian melalui Program Hibah Bersaing dan beasiswa untuk mengikuti program sandwich-like di Mie University, Jepang. Juga kepada PT ISM-Bogasari Flour Mills atas dukungan dana penelitian melalui Program Hibah Indofood Riset Nugraha. Program-program tersebut sangat mem-bantu penulis dalam menyelesaikan studi ini.
Ucapan terima kasih juga kepada teman sejawat di Program Studi Magister dan Doktor Ilmu Pangan angkatan 2005, 2007 dan khususnya angkatan 2006 yang telah melewati masa perkuliahan dan penelitian bersama penulis dengan penuh kebersamaan dan persahabatan. Juga kepada semua mahasiswa bimbingan penulis di Program Studi Teknologi Pangan yang telah banyak membantu.
xviii
mendidik penulis dengan penuh ketulusan dan kasih sayang. Semoga proses menuntut ilmu yang telah penulis jalani ini merupakan bukti kecintaan penulis kepada mereka berdua. Penulis berdoa agar apa yang telah penulis tempuh ini dicatat Allah SWT sebagai amal kebaikan yang pahalanya dapat mengalir kepada mereka. Amin Ya Rabbal Alamin.
Penulis ucapkan pula terima kasih kepada ketujuh kakak kandung penulis atas dukungan, doa dan curahan kasih penulisngnya yang tiada putus kepada penulis sebagai adik bungsunya dalam menyelesaikan pendidikan ini. Khususnya kepada kakakku Teh Adah, sebagai kakak yang sekaligus juga telah penulis anggap sebagai pengganti ibu, juga keponakan penulis Budi dan Neli yang yang telah menjadi tempat tumpuan penulis untuk berbagi dalam segala hal. Penulis ucapkan terima kasih banyak.
Kepada kedua anakku tercinta, Gaida Salsabila dan Muhammad Adzka Noor, Mamah ucapkan terima kasih banyak karena kalian sangat memahami kondisi Mama yang harus berbagi antara pekerjaan, sekolah dan waktu untuk bersama-sama dengan kalian. Mamah mohon maaf karena kadangkala mening-galkan kalian berdua. Tetapi hal itu bukan berarti Mamah mengabaikan kalian atau berkurang rasa kasih sayang Mamah kepada kalian berdua. Mamah persem-bahkan karya disertasi ini untuk kalian berdua.
Akhirnya kepada semua pihak yang telah membantu, memberi dukungan dan berkontribusi baik secara langsung maupun tidak langsung yang tidak dapat penulis sebutkan satu per satu, penulis ucapkan terima kasih. Semoga Allah SWT dapat membalas kebaikan Bapak Ibu sekalian.
Semoga disertasi ini dapat bermanfaat bagi masyarakat secara umum dan berkontribusi dalam perkembangan ilmu pengetahuan dan teknologi, khususnya di bidang ilmu pangan.
Bogor, 19 Januari 2011
xix
RIWAYAT HIDUP
Penulis dilahirkan di Tasikmalaya pada tanggal 17 November 1971 sebagai putri bungsu dari delapan bersaudara pasangan H Ma’mun (almarhum) dan Hj Aisyah (almarhumah). Pendidikan sarjana ditempuh di Program Studi Teknologi Pangan, Jurusan Teknologi Pangan dan Gizi, Institut Pertanian Bogor (1991-1996). Pada tahun 1996 dengan beasiswa dari URGE Bank Dunia, penulis melan-jutkan pendidikan Program Magister di Program Studi Ilmu Pangan, Sekolah Pascasarjana Institut Pertanian Bogor dan menamatkannya pada tahun 2001. Pada tahun 2006, penulis melanjutkan Program Doktor di Program Studi Ilmu Pangan, Sekolah Pascasarjana Institut Pertanian Bogor dengan dukungan beasiswa BPPS. Sejak tahun 1998 hingga sekarang, penulis bekerja sebagai staf pengajar di bagian Kimia Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
xxi
DAFTAR GAMBAR...... xxvii
DAFTAR LAMPIRAN...... xxxi
2.2. Struktur Amilosa dan Amilopektin... 10
2.3. Model Struktur Granula Pati... 13
2.4. Pengaruh Proses Pengolahan terhadap Gelatinisasi dan Retrogradasi Pati………..………….……….. 22
2.4.1. Gelatinisasi Pati ……….. 22
2.4.2. Retrogradasi Pati………. 25
2.5. Pati Resisten... 28
2.5.1. Jenis Pati Resisten... 29
2.5.2. Pemanasan Suhu Tinggi-Pendinginan (Autoclaving-cooling)…. 32 2.5.3. Hidrolisis Asam secara Lambat (Lintnerisasi)... 37
2.5.4. Debranching oleh Enzim Pullulanase…………... 39
3. METODE PENELITIAN... 43
3.1. Waktu dan Tempat Penelitian... 43
3.2. Bahan dan Alat... 43
3.3. Tahapan Penelitian... 44
3.3.1. Proses Ekstraksi dan Karakterisasi Pati Garut... 46
3.3.2. Penentuan Kondisi Proses Modifikasi Pati Garut... 46
3.3.2.1. Penentuan Kondisi Siklus Autoclaving-cooling... 46
3.3.2.2. Penentuan Kondisi Hidrolisis Asam... 48
3.3.2.3. Penentuan Kondisi Debranching... 49
3.3.2.4. Analisis Statistika... 50
3.3.3. Pengaruh Modifikasi Pati Garu terhadap Pembentukan Pati Resisten……….. 50
3.3.3.1. Perlakuan Siklus Autoclaving-cooling…... 50
xxii
3.3.3.3. Perlakuan Debranching dan Siklus Autoclaving-cooling……….………... 51 3.3.3.4. Kombinasi Perlakuan Hidrolisis Asam,
De-branching, dan Siklus Autoclaving-cooling... 52 3.3.3.5. Analisis Statistika... 52 3.4. Prosedur Analisis……….. 52 3.4.1. Analisis Proksimat... 52 3.4.1.1. Kadar Air... 52 3.4.1.2. Kadar Abu... 52 3.4.1.3. Kadar Lemak... 53 3.4.1.4. Kadar Protein... 54 3.4.1.5. Kadar Karbohidrat... 55 3.4.2. Kadar Total Gula... 55 3.4.3. Kadar Amilosa... 56 3.4.4. Kadar Gula Pereduksi... 57 3.4.5. Kadar Pati Resisten... 58 3.4.6. Daya Cerna Pati in Vitro... 59 3.4.7. Analisis Profil Gelatinisasi Pati... 61 3.4.8. Analisis Morfologi Pati...………... 62 3.4.8.1. Mikroskop Polarisasi………... 62 3.4.8.2. Scanning Electron Microscope………...… 62 3.4.9. Analisis Perubahan Struktur Pati Garut………. 62 3.4.9.1. Distribusi Amilosa dan Amilopektin……….. 63 3.4.9.2. Distribusi Panjang Rantai Amilopektin……….. 64 3.4.10. Analisis Kestabilan Panas dan Derajat Retrogradasi……...… 65 3.4.11. Analisis Sifat Kristalinitas………... 66 3.4.11.1. Perubahan Daerah Kristalin dan Amorf ………... 66 3.4.11.2. Pola Difraksi Sinar X………..…….. 67
4. HASIL DAN PEMBAHASAN... 71 4.1. Ekstraksi dan Karakterisasi Pati Garut... 71 4.1.1. Ekstraksi Pati Garut……….………….. 71 4.1.2. Komposisi Kimia……….……….. 71 4.1.3. Bentuk dan Ukuran Granula……….. 73 4.1.4. Profil Gelatinisasi Pati Garut………. 74 4.2. Penentuan Kondisi Proses Modifikasi Pati Garut... 77 4.2.1. Penentuan Kondisi Siklus Autoclaving-cooling………... 77 4.2.1.1. Penentuan Suhu Pemanasan Awal……… 78 4.2.1.2. Penentuan Waktu Autoclaving dan Jumlah Siklus
Autoclaving-cooling………. 83 4.2.2. Penentuan Kondisi Hidrolisis Asam……….. 86 4.2.3. Penentuan Kondisi Debranching………...… 90 4.2.3.1. Aktivitas Enzim Pullulanase………... 90 4.2.3.2. Penentuan Konsentrasi dan Waktu Inkubasi Enzim
xxiii
4.3.1.2. Kadar Pati Resisten………... 94 4.3.2. Daya Cerna Pati in Vitro………... 97 4.3.3. Struktur Morfologi Permukaan Granula Pati ………... 99 4.3.4. Perubahan Struktur Pati Garut…...……… 102 4.3.4.1. Distribusi Amilosa dan Amilopektin………... 102 4.3.4.2. Distribusi Panjang Rantai Amilopektin dan
Ami-losa Rantai Pendek………... 108 4.3.5. Kestabilan Panas dan Derajat Retrogradasi Pati……… 114 4.3.5.1. Kestabilan Panas………...………... 114 4.3.5.2. Derajat retrogradasi... 117 4.3.6. Sifat Kristalinitas Pati………...………. 118 4.3.6.1. Perubahan Daerah Kristalin dan Amorf…………... 118 4.3.6.2. Pola Difraksi Sinar X……… 121
5. SIMPULAN DAN SARAN... 131 5.1. Simpulan... 131 5.2. Saran... 132
DAFTAR PUSTAKA... 135
xxv
DAFTAR TABEL
Halaman 1. Komposisi kimia umbi garut kultivar creole dan banana... 9
2. Bentuk dan ukuran granula pati garut dibandingkan sumber pati lainnya... 10
3. Distribusi panjang rantai amilopektin... 13
4. Kristalinitas pati tipe A, B dan C pada kandungan amilosa yang berbeda... 20
5. Rekapitulasi kondisi modifikasi untuk meningkatkan kadar pati resisten pada berbagai jenis sumber pati... 33
6. Komposisi kimia pati garut alami hasil ekstraksi cara basah... 72
7. Profil gelatinisasi pati garut dari hasil pengukuran Rapid Visco
Ana-lyzer (RVA)... 76 8. Nisbah total karbohidrat pati garut pada fraksi I dan II sebelum dan
setelah perlakuan modifikasi dari hasil analisis GPC... 104
9. Persentase distribusi panjang rantai pada amilopektin dan amilosa rantai pendek dari hasil pengukuran dengan FACE... 109
10. Hasil pengukuran Diffential Scanning Calorimeter (DSC) pada pati garut alami dan hasil modifikasi... 116
11. Perubahan daerah amorf dan kristalin dari pati garut pada berbagai perlakuan modifikasi berdasarkan hasil pengukuran dengan FTIR... 120
12. Derajat kristalinitas dan tipe kristalin pati garut alami dan yang mengalami modifikasi... 123
xxvii
DAFTAR GAMBAR
Halaman 1. Tanaman garut... 7
2. Umbi garut: (a) sebelum dikupas; dan (b) sesudah dikupas... 8
3. Model molekul amilopektin yang diadopsi dari (a) French (1972); (b) Hizukuri (1986); dan (c) Robin et al. (1974)... 12
4. Model daerah amorf dan kristalin dari granula pati... 14
5. Model superhelix daerah kristalin yang terbentuk dari
amilopek-tin... 14
6. APTS, derivatisasi gugus pereduksi karbohidrat (A) dan pelabelan amilopektin dengan APTS (B) penentuan distribusi panjang rantai amilopektin dengan FACE... 16
7. Model struktur granula pati. (A) Daerah kristalin; (B) lamella amorf dan lamella kristalin; (C) Struktur double helix dari rantai
amilo-pektin yang berdekatan membentuk lamella kristalin... 17
8. Struktur granula pati berdasarkan model “Blocklet”... 19
9. Profil kristal pati hasil pengukuran dengan difraksi sinar X... 19
10. Perbedaan struktur kristalin tipe A dan B dari pati... 21
11. Perubahan granula pati (alami: I) selama proses gelatinisasi, terjadi pengembangan (IIa) pelepasan amilosa (IIb), retrogradasi, proses penggabungan kembali rantai linear pati setelah dekristalisasi akibat gelatinisasi... 23
12. Profil gelatinisasi dengan pengukuran menggunakan Rapid Visco Analyzer (RVA) dan perubahan granula pati selama pemanasan... 24 13. Mekanisme gelatinisasi dan retrogradasi pati... 26
14. Ilustrasi perubahan pasta pati selama siklus freeze-thaw... 27
15. Model pembentukan pati resisten (R3): (a) model micelle); (b) model lamella... 31 16. Mekanisme pembentukan RS3 dari rekristalisasi amilosa akibat
proses autoclaving-cooling... 35
17. Ilustrasi degradasi daerah amorf selama hidrolisis asam... 38
18. Pemotongan ikatan α-1,6 pada titik percabangan molekul
amilo-pektin oleh enzim pullulanase... 40
19. Tahapan penelitian dalam proses modifikasi pati garut dan
karak-terisasinya... 45
xxviii
21. Profil kurva gelatinisasi pati dengan Rapid Visco Analyzer (RVA)…. 61
22. Kurva Differential Scanning Calorimetry (DSC)... 66 23. Kurva difraksi sinar X yang sudah dihaluskan dan dibuat model
Gaussian dan Lorentz... 68
24. Struktur granula pati garut alami di bawah mikroskop polarisasi... 73
25. Struktur granula pati garut di bawah Scanning Electron Microscope (SEM)……… 74
26. Profil gelatinisasi pati garut alami yang diukur dengan Rapid Visco Analyzer (RVA)………... 75 27. Pati garut yang diotoklaf tanpa proses pemanasan awal ……….. 79
28. Pati garut yang diotoklaf dengan proses pemanasan awal ……… 79
29. Perubahan kadar amilosa pati garut sebagai akibat pengaruh suhu pemanasan awal sebelum proses siklus autoclaving-cooling... 80
30. Daya cerna pati garut sebagai akibat pengaruh suhu pemanasan awal sebelum proses siklus autoclaving-cooling... 81
31. Perubahan kadar gula pereduksi pati garut sebagai akibat pengaruh suhu pemanasan awal sebelum proses siklus autoclaving-cooling... 82
32. Perubahan kadar pati resisten pati garut sebagai akibat pengaruh suhu pemanasan awal sebelum proses siklus autoclaving-cooling... 83
33. Daya cerna pati garut sebagai akibat pengaruh waktu autoclaving dan jumlah siklus autoclaving-cooling... 84
34. Kadar resisten pati garut sebagai akibat pengaruh jumlah siklus autoclaving-cooling dengan waktu pemanasan 15 menit... 86 35. Daya cerna pati garut sebagai akibat pengaruh konsentrasi HCl dan
waktu inkubasi selama hidrolisis asam... 88
36. Kadar amilosa sebagai akibat pengaruh konsentrasi HCl dan waktu inkubasi selama hidrolisis asam... 90
37. Pengaruh konsentrasi enzim pullulanase dan waktu inkubasi terhadap kadar gula pereduksi... 92
38. Pengaruh perlakuan modifikasi terhadap kadar gula pereduksi pati garut... 94
39. Pengaruh perlakuan modifikasi terhadap kadar pati resisten pati garut 96
40. Pengaruh perlakuan modifikasi terhadap daya cerna pati garut... 98
41. Struktur granula pati garut yang dimodifikasi dengan perlakuan (1) Hidrolisis asam 2 jam (2) Hidrolisis asam-autoclaving-cooling (3x) 100
xxix
43. Struktur granula pati garut yang dimodifikasi dengan perlakuan hidrolisis asam, debranching dan autoclaving-cooling………. 102
44. Profil GPC pati garut dan termodifikasi pada sepharose toyopearl HW-65F... 103
45. Distribusi panjang rantai pada amilopektin dan amilosa rantai pendek dari hasil pengukuran dengan FACE... 110
46. Persentase panjang rantai pada pati garut termodifikasi dibandingkan dengan pati garut alami... 111
47. Profil DSC pati garut alami dan yang mengalami modifikasi………... 115
48. Kurva hasil pengukuran FTIR dari pati garut alami dan yang
menga-lami modifikasi……….. 119
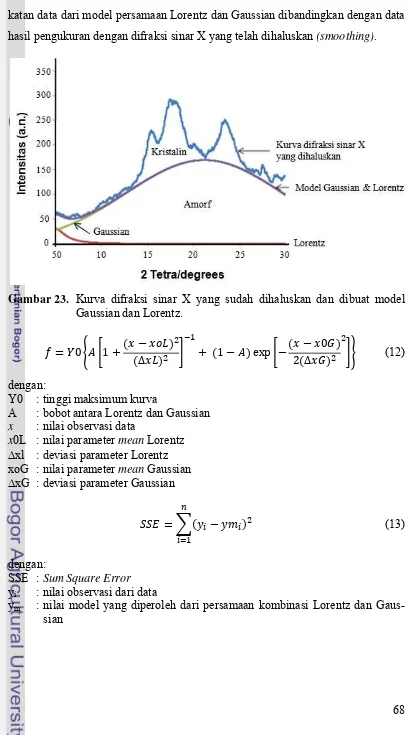
49. Difraktogram pati garut alami dan yang mengalami modifikasi dari hasil smoothing……….. 122
50a. Perubahan daerah amorf dan kristalin dari pati garut alami dan hasil hidrolisis asam dan autoclaving-cooling………... 125
50b. Perubahan daerah amorf dan kristalin dari pati garut dari hasil kombinasi perlakuan debranching dan autoclaving-cooling…………. 126
50c. Perubahan daerah amorf dan kristalin dari pati garut alami dan hasil kombinasi perlakuan hidrolisis asam, debranching dan
xxxi
DAFTAR LAMPIRAN
Halaman
1a. Difraktogram difraksi sinar X pada pati garut alami, pati yang diberi perlakuan autoclaving-cooling sebanyak 3 siklus (AC), dan pati yang dihidrolisis asam selama 2 jam dan autoclaving-cooling sebanyak 3 siklus (H2AC)... 145
1b. Difraktogram difraksi sinar X pada pati garut yang diberi perlakuan debranching dan autoclaving-cooling sebanyak 3 siklus... 146 1c. Difraktogram difraksi sinar X pada pati garut yang diberi perlakuan
hidrolisis asam selama 2 jam, debranching dan autoclaving-cooling sebanyak 3 siklus... 147
2a. Kurva difraktogram dari hasil pemodelan persamaan Lorentz dan Gaussian. H2=hidrolisis 2 jam………... 148
2c. Kurva difraktogram dari hasil pemodelan persamaan Lorentz dan Gaussian. H2=hidrolisis 2 jam; D1=debranching 1,3 U/g pati; D10= debranching 10,4 U/g pati; AC=autoclaving-cooling 3 siklus……….. 149 2c. Kurva difraktogram dari hasil pemodelan persamaan Lorentz dan
Gaussian. D1=debranching 1,3 U/g pati; D10= debranching 10,4 U/g pati; AC=autoclaving-cooling 3 siklus……….. 150
2d. Kurva difraktogram dari hasil pemodelan persamaan Lorentz dan Gaussian. H2=hidrolisis 2 jam; D1=debranching 1,3 U/g pati; D10= debranching 10,4 U/g pati; AC=autoclaving-cooling 3 siklus……... 151 3. Contoh kurva kristalinitas setiap peak pada pati garut alami………… 152
1 I. PENDAHULUAN
1.1. Latar Belakang
Kajian mengenai sifat fungsional pangan yang berkhasiat untuk kesehatan
dan kebugaran semakin mendapat perhatian sejalan dengan semakin
meningkat-nya kesadaran masyarakat akan pentingmeningkat-nya hidup sehat. Fungsi pangan pun
semakin berkembang, bukan hanya ditujukan untuk memenuhi kebutuhan zat gizi
saja tetapi juga untuk dapat memberikan efek fungsional dalam menjaga
kese-hatan dan kebugaran tubuh serta memperbaiki fungsi fisiologis. Pangan yang
dapat memberikan efek terhadap kesehatan tersebut dikenal dengan pangan
fung-sional.
Salah satu ingredien pangan yang dapat dijadikan sebagai bahan baku untuk
pembuatan pangan fungsional adalah pati resisten atau resistant starch (RS). Pati
resisten adalah pati dan produk hasil degradasi pati yang tidak dapat dicerna oleh
enzim α-amilase dalam usus halus manusia yang sehat tetapi dapat difermentasi
oleh mikroflora usus untuk menghasilkan asam lemak rantai pendek (Champ
2004). Sajilata et al. (2006) menyatakan bahwa pati resisten dapat berperan dalam
mengurangi resiko timbulnya kanker kolon, mempunyai efek hipoglikemik,
ber-peran sebagai prebiotik, mengurangi resiko pembentukan batu empedu,
mempu-nyai efek hipokolesterolemik, menghambat akumulasi lemak, dan meningkatkan
absorpsi mineral. Pati resisten juga memiliki nilai kalori rendah, yaitu sebesar
11,7 kJ/g RS (Bauer et al. 2005) atau (1,9 Kkal/g), sehingga dapat dijadikan
sebagai ingredien untuk pangan rendah kalori (Taggart 2004).
Pati resisten (RS) dapat dikelompokkan menjadi empat tipe, yaitu pati
resisten yang secara fisik terperangkap dalam sel-sel tanaman dan matriks bahan
pangan (RS1), pati resisten yang secara alami sangat tahan terhadap pencernaan
oleh enzim α-amilase (RS2), pati resisten yang dimodifikasi secara fisik (RS3)
dan pati resisten yang dimodifikasi secara kimia (RS4) (Bird et al. 2000; Champ
2004; Liu 2005). Di antara keempat jenis pati resisten tersebut, pati resisten tipe
III (RS3) merupakan tipe pati resisten yang paling banyak digunakan sebagai
2 Pati resisten tipe III (RS3) dapat dihasilkan dari proses pemanasan suhu
tinggi dan pendinginan secara berulang atau disebut siklus autoclaving-cooling.
Proses ini dapat menyebabkan terjadinya retrogradasi fraksi amilosa, dimana
kadar RS3 secara proporsional berbanding lurus dengan kandungan amilosa dalam
bahan pangan (Shu et al. 2007). Proses retrogradasi pati tersebut menyebabkan
terjadinya rekristalisasi dan meningkatkan pembentukan RS3. Kristalisasi ini
disebabkan oleh adanya pembentukan double helix baru di antara
molekul-mole-kul amilosa. Double helix yang terbentuk tersebut akan membentuk pembesaran
(agregasi) dengan double helix pada molekul amilosa lainnya melalui ikatan
hidrogen sehingga membentuk kristalit (Vasanthan et al. 1998).
Peningkatan fraksi amilosa rantai pendek yang berperan dalam
pemben-tukan RS3 dapat dihasilkan melalui proses hidrolisis asam secara lambat
(lintneri-zation) atau pemutusan ikatan percabangan α,1-6 pada rantai amilopektin
(debranching). Hidrolisis secara lambat oleh asam dan debranching dapat
mem-perpendek panjang rantai α-glukan sehingga derajat polimerisasi (DP) menurun.
Schmiedl et al. (2000) menunjukkan bahwa nilai DP antara 10-35 cukup optimal
untuk meningkatkan kadar RS3. Nilai DP tersebut dapat diperoleh baik dengan
cara menghidrolisis amilosa secara parsial maupun memotong titik percabangan
rantai amilopektin (Lehmann et al. 2003).
Beberapa teknik modifikasi pati untuk meningkatkan kadar pati resisten tipe
III (RS3) telah dilaporkan, yaitu siklus pemanasan suhu tinggi dan pendinginan
(autoclaving-cooling cycles) (Mahadevamma et al. 2003; Shin et al. 2004;
Apa-ricio-Saguilan et al. 2005; Zabar et al. 2008), hidrolisis asam secara lambat yang
dilanjutkan dengan siklus autoclaving-cooling (Onyango et al. 2006 dan Lehmann
et al. 2003), pemutusan ikatan cabang α-1,6 amilopektin (debranching) oleh
enzim pullulanase yang dilanjutkan dengan siklus autoclaving-cooling (Leong et
al. 2007; Ozturk et al. 2009; Pongjanta et al. 2009a) atau kombinasi perlakuan
hidrolisis asam secara lambat, debranching dan siklus autoclaving-cooling
(Lehmann et al. 2003; Gonzales-Soto et al. 2004 dan 2007; Koksel et al. 2008a;
Miao et al. 2009; Zhao dan Lin 2009).
Beberapa penelitian sebelumnya telah berhasil meningkatkan kadar RS3
3
atas atau kombinasinya, yaitu pati sagu (Leong et al. 2007), pati pisang
(Aparicio-Saguilan et al. 2005), pati kacang merah (Lehmann et al. 2003), pati jagung tinggi
amilosa (Ozturk et al. 2009), pati beras (Pongjanta et al. 2009a dan 2009b), pati
jagung (Koksel et al. 2008a dan 2008b, Zhao dan Lin 2009), pati jagung tinggi
amilopektin (Miao et al. 2009), pati pisang (Gonzales-Soto et al. 2004 dan 2007),
pati singkong (Mutungi et al. 2009; Onyango et al. 2006) dan pati beras (Shu et
al. 2007).
Pati garut berpotensi sebagai sumber bahan baku RS3. Hasil pengamatan
dengan menggunakan difraksi sinar X menunjukkan bahwa pati garut memiliki
tipe kristalin A, rantai amilopektin pati garut memiliki derajat polimerisasi (DP)
berkisar 9-30 dalam jumlah yang tinggi (96,0%) (Srichuwong 2006). Pati garut
juga memiliki densitas yang lebih tinggi pada daerah struktur helikal (Wang et al.
1998), proporsi lebih tinggi pada rantai cabang amilopektin yang berukuran
pendek (Hizukuri et al. 1983), serta jumlah rantai per klaster yang relatif lebih
banyak bila dibandingkan dengan tipe kristalin B (Takeda et al. 2003). Struktur
pati garut tersebut sangat mendukung dalam pembentukan RS3 apabila dilakukan
proses hidrolisis dengan asam atau pemutusan ikatan cabang α-1,6 amilopektin
(debranching) atau kombinasi keduanya yang dapat menghasilkan amilosa rantai pendek. Hingga saat ini belum ada laporan yang menyebutkan pengaruh hidrolisis
parsial dengan asam, debranching, siklus autoclaving-cooling dan kombinasinya
terhadap peningkatan kadar RS3 dari pati garut.
Berdasarkan penjelasan di atas, maka diperlukan penelitian untuk dapat
meningkatkan kadar pati resisten (RS3) dari pati garut dengan cara proses
pemanasan suhu tinggi dan pendinginan secara berulang (siklus
autoclaving-cooling), proses hidrolisis asam (lintnerisasi) dan pemutusan ikatan cabang
amilopektin secara enzimatis (debranching), atau kombinasinya. Kondisi proses
untuk tiap perlakuan modifikasi di atas juga perlu ditentukan agar peningkatan
RS3 dapat maksimal. Pengamatan terhadap perubahan struktur dan kristalisasi
pada pati garut yang telah mengalami proses modifikasi tersebut juga diperlukan
untuk mengetahui mekanisme perubahan struktur pati yang menjadikannya lebih
4 1.2. Perumusan Masalah
Pati garut berpotensi untuk dijadikan sebagai bahan baku untuk
menghasil-kan pati resisten. Secara alami sebagaimana sumber pati lainnya, pati garut
memiliki kadar pati resisten yang rendah. Salah satu cara untuk meningkatkan pati
resisten adalah dengan proses retrogradasi pati yang dapat menghasilkan pati
resisten tipe III (RS3). Retrogradasi pati dapat dilakukan dengan cara pemanasan
pada suhu tinggi (autoclaving) yang dilanjutkan dengan proses pendinginan
(cooling) secara berulang-ulang. Pati lebih mudah mengalami retrogradasi dalam bentuk molekul amilosa rantai pendek dengan derajat polimerasi (DP) berkisar
10-35. Semakin banyak jumlah fraksi amilosa rantai pendek maka semakin besar
peluang terbentuknya pati yang teretrogradasi.
Jumlah fraksi amilosa rantai pendek dapat ditingkatkan dengan cara
meng-hidrolisis secara parsial ikatan glikosidik pada rantai molekul amilosa dan
amilo-pektin, baik dengan hidrolisis asam maupun secara enzimatis. Proses hidrolisis
asam secara parsial dapat menyerang bagian amorf dari granula pati yang dapat
menghasilkan amilosa rantai pendek. Hidrolisis secara enzimatis dapat dilakukan
secara spesifik dengan memotong ikatan glikosidik pada titik percabangan α-1,6
dari molekul amilopektin (debranching), yaitu dengan menggunakan enzim
pullu-lanase. Hasil hidrolisis secara enzimatis ini pun dapat menghasilkan amilosa rantai
pendek. Dengan adanya kombinasi hidrolisis asam atau secara enzimatis dan
autoclaving-cooling, diharapkan jumlah fraksi amilosa rantai pendek bertambah sehingga jumlah pati yang mengalami retrogradasi dapat meningkat, dan sebagai
akibatnya terjadi peningkatan kadar RS3.
1.3. Tujuan Penelitian
Penelitian ini bertujuan memodifikasi pati garut untuk meningkatkan kadar
pati resisten tipe III (RS3), yaitu melalui proses (1) siklus autoclaving-cooling, (2)
kombinasi proses hidrolisis asam (lintnerisasi) dan siklus autoclaving-cooling; (3)
kombinasi pemutusan ikatan cabang α-1,6 amilopektin (debranching) secara
enzimatis dengan enzim pullulanase yang dilanjutkan siklus autoclaving-cooling;
(4) kombinasi antara hasil hidrolisis parsial oleh asam (lintnerisasi), pemutusan
5 autoclaving-cooling, serta mengkaji pengaruh modifikasi tersebut terhadap perubahan sifat kristalitasnya.
1.4. Manfaat Penelitian
Penelitian ini memberikan informasi ilmiah tentang metode modifikasi pati
garut dengan proses siklus autoclaving-cooling, hidrolisis asam secara lambat,
debranching dan atau kombinasinya untuk dapat meningkatkan kadar pati resis-tennya (RS3). Hasil penelitian ini diharapkan dapat mendukung dilakukannya
penelitian aplikasi RS3 dari pati garut termodifikasi pada berbagai sistem pangan,
sehingga hasilnya dapat dijadikan sebagai dasar untuk pengembangan pangan
7 II. TINJAUAN PUSTAKA
2.1. Umbi Garut
Tanaman garut (Marantha arundinacea L.)merupakan tanaman tropis yang
termasuk jenis rumput-rumputan tegak dengan tinggi 60-80 cm. Batang sejati
tanaman garut terdapat dalam tanah dan berbentuk silinder yang menebal di
ujungnya. Daun tanaman garut berbentuk bulat telur hingga lanset bulat telur yang
berwarna hijau polos atau dengan bercak putih (Gambar 1). Tanaman garut dapat
tumbuh pada ketinggian 0-900 m di atas permukaan laut (dpl) dengan
pertum-buhan terbaik pada ketinggian 60-90 m dpl, pada kondisi tanah yang lembab dan
terlindung dari sinar matahari langsung (Sastrapradja et al. 1977).
Gambar 1. Tanaman garut
Tanaman garut berasal dari Amerika Tengah dan Amerika Selatan yang
kemudian menyebar luas ke negara-negara iklim tropis seperti Indonesia, India,
Sri Langka dan Filipina. Di Indonesia, tanaman garut banyak ditemukan di
Sumatra, Nias, Jawa, Madura dan Bali (Lingga et al. 1986). Tanaman garut terdiri
atas dua jenis kultivar yang penting, yaitu creole dan banana. Tanaman garut
kultivar creole dapat tumbuh dan menyebar di dalam tanah dengan lebih dalam,
sedangkan kultivar banana tumbuh dengan tandan terbuka pada permukaan tanah
yang tidak terlalu dalam sehingga lebih mudah dipanen (Villamajor dan Jurkema
8 Umbi garut merupakan rhizoma dari tanaman garut dan dibungkus dengan
sisik-sisik secara teratur dan berbentuk silinder (Gambar 2a). Umbi garut dapat
dipanen setiap tahun dengan waktu rotasi 5-7 tahun dan dapat tumbuh kembali
dengan hanya meninggalkan sisa ujung umbi saat dipanen (Lingga et al. 1986).
Baik umbi kultivar creole maupun kultivar banana memiliki umbi yang berwarna
putih, namun berbeda dalam bentuk dan ukuran umbinya. Kultivar creole
memi-liki umbi yang lebih panjang dan langsing, sedangkan kultivar banana
mempu-nyai umbi yang lebih pendek dan gemuk. Apabila kulitnya dikupas, bagian dalam
umbi garut berwarna putih (Gambar 2b). Tanaman garut kultivar creole banyak
dibudidayakan di daerah Bogor dan menjadi prioritas kultivar yang dikembangkan
oleh Balai Besar Bioteknologi dan Sumberdaya Genetika, Cimanggu, Bogor.
(a) (b)
Gambar 2. Umbi garut sebelum dikupas (a) dan sesudah dikupas (b) (Faridah et
al. 2007)
Tabel 1 menyajikan komposisi zat gizi dari umbi garut kultivar creole dan banana. Umbi garut kultivar creole merupakan sumber karbohidrat, yaitu
seba-gian besar karbohidrat penyusunnya adalah pati. Kadar pati umbi kultivar creole
sedikit lebih tinggi (20,96%) dibandingkan dengan kultivar banana (19,40%).
Kedua kultivar umbi garut tersebut memiliki kandungan protein dan lemak yang
relatif rendah. Menurut Lingga et al. (1986), komposisi kimia umbi garut ini dapat
berubah yang dipengaruhi oleh pada umur tanaman dan kondisi tempat
9 Tabel 1. Komposisi kimia umbi garut kultivar creole dan banana
Komposisi Kultivar Umbi Garut
Creole 1 Banana2
Umbi garut sering dimanfaatkan oleh masyarakat sebagai bahan makanan
dan ramuan obat-obatan. Umbi garut yang masih muda biasanya dikukus, direbus,
atau dibakar untuk dikonsumsi sebagai makanan kecil. Umbi garut muda ini
rasa-nya manis, tetapi berangsur hilang kemanisanrasa-nya dengan bertambah umur, karena
terjadinya sintesis pati dan serat yang banyak. Umbi garut yang sudah tua
umum-nya diolah menjadi tepung atau diambil patiumum-nya (Yustiareni 2000).
Pati garut mudah dicerna, sehingga dapat dimanfaatkan sebagai makanan
bayi atau makanan bagi orang yang mengalami gangguan pencernaan. Pati garut
juga dapat dijadikan sebagai makanan bagi anak yang menyandang penyakit autis
dan makanan diet bagi orang tua lanjut usia dan pasien yang dalam masa
penyem-buhan (Ariesta et al. 2004). Di samping sebagai bahan pangan, pati garut juga
digunakan sebagai bahan baku non-pangan, seperti digunakan di industri
kosme-tik, lem, alkohol, dan tablet yang diinginkan bersifat mudah larut (Kay 1973).
Sebagaimana sumber pati yang lain, pati garut tersimpan dalam bentuk
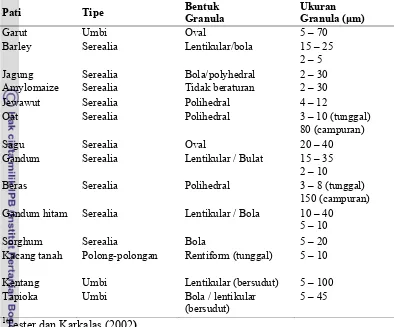
gra-nula pati yang berperan sebagai cadangan makanan. Tester dan Karkalas (2002)
melaporkan bahwa granula pati garut berbentuk oval seperti granula pati sagu
(Tabel 2). Ada juga yang melaporkan bahwa granula pati garut berbentuk bulat
(round) dan poligonal. Ukuran granula pati garut dilaporkan berbeda-beda oleh peneliti, yaitu 5-70,0 µm (Tester dan Karkalas 2002), 5-50,0 µm (Moorthy 2002),
10 Tabel 2. Bentuk dan ukuran granula pati garut dibandingkan sumber pati lainnya1
Pati Tipe Bentuk
Granula
Ukuran Granula (μm)
Garut Umbi Oval 5 – 70
Barley Serealia Lentikular/bola 15 – 25
2 – 5 Jagung Serealia Bola/polyhedral 2 – 30 Amylomaize Serealia Tidak beraturan 2 – 30
Jewawut Serealia Polihedral 4 – 12
Kacang tanah Polong-polongan Rentiform (tunggal) 5 – 10
Kentang Umbi Lentikular (bersudut) 5 – 100 Tapioka Umbi Bola / lentikular
(bersudut)
5 – 45
1
Tester dan Karkalas (2002)
Granula pati garut tersusun oleh molekul amilosa yang berantai lurus dan
molekul amilopektin yang memiliki rantai bercabang-cabang. Sebagaimana jenis
pati lainnya, kandungan amilopektin dalam pati garut lebih tinggi dibandingkan
amilosa. Naraya dan Moorthy (2002) menyebutkan bahwa kadar amilosa pati
garut berada pada kisaran 16-27%.
2.2. Struktur Amilosa dan Amilopektin
Amilosa dan amilopektin tersusun oleh monomer α-D-glukosa. Amilosa
mempunyai struktur lurus, yaitu α-D-glukosa yang dihubungkan satu sama lain
dengan ikatan glikosidik α-1,4 dan memiliki dengan berat molekul sekitar 1x105–
1x106. Amilopektin mempunyai struktur bercabang-cabang, yaitu titik
perca-bangannya dihubungkan dengan ikatan glikosidik α-1,6. Karim et al. (2000)
menyebutkan kisaran yang berbeda untuk jumlah α-D-glukosa penyusun titik
percabangan pada amilopektin, yaitu 20-30 unit anhidroglukosa. Amilopektin
11
sekitar 106-109. Berat molekul amilosa dan amilopektin berbeda untuk sumber pati
yang berbeda. Hingga saat ini, belum ada laporan yang menyebutkan berat
molekul amilosa dan amilopektin dari pati garut.
Gugus-gugus hidroksil yang banyak pada struktur amilosa dan amilopektin
memungkinkan terbentuknya ikatan hidrogen, namun dengan kekuatan ikatan
yang berbeda. Bentuk molekul amilosa yang linear dengan jumlah gugus hidroksil
yang banyak memungkinkannya untuk lebih mudah membentuk ikatan hidrogen
satu sama lain, sehingga ikatan hidrogen yang terbentuk menjadi lebih kuat.
Ada-nya ikatan hidrogen ini membentuk struktur heliks pada amilosa. Karena molekul
amilopektin memiliki ukuran yang besar dengan struktur yang bercabang-cabang,
maka ikatan hidrogen antara molekul amilopektin lebih lemah dibandingkan
dengan ikatan hidrogen antar molekul amilosa (Liu 2005).
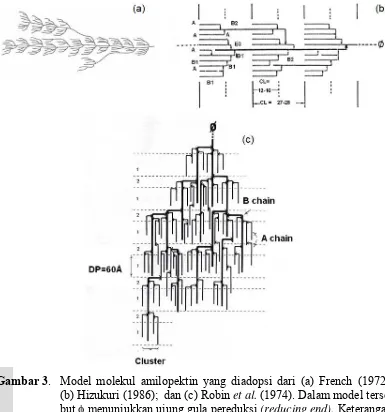
Beberapa model struktur amilopektin dilaporkan oleh beberapa peneliti,
yaitu oleh French (1972) (Gambar 3a), Hizukuri (1986) (Gambar 3b) dan Robin
et al. (1974) (Gambar 3c). Imberty et al. (1991) menyatakan bahwa rantai linear
amilopektin dengan DP ∼15 membentuk daerah kristalin dalam struktur granula
pati. Rantai-rantai pendek tersebut membentuk struktur double helix oleh adanya
ikatan hidrogen dan tersusun dalam bentuk klaster.
Hizukuri (1986) mengilustrasikan model amilopektin dalam bentuk struktur
klaster, yaitu sebanyak 80-90,0% dari keseluruhan rantai amilopektin terletak
pada klaster tersebut, sedangkan 10-20,0% sisanya berperan dalam pembentukan
ikatan antar klaster (Gambar 3b). Berdasarkan pada panjang dan titik
perca-bangannya, rantai amilopektin dapat dibagi menjadi tiga bagian, yaitu bagian
rantai A, rantai B dan rantai C. Bagian rantai A tersusun oleh struktur linear
beran-tai pendek dengan DP 6-12. Bagian rantai B membentuk stuktur bercabang
amilo-pektin yang mengikat rantai A atau rantai B lainnya (B1, B2 dan B3).
Rantai B1 memiliki DP 13-24, rantai B2 memiliki DP 25-36 dan rantai B3
memiliki DP >37. Bagian struktur amilopektin berantai pendek dengan DP sekitar
6-24 terdapat pada rantai A dan B1. Rantai tersebut dapat membentuk struktur
12 dalam granula pati. Rantai C membentuk struktur linear yang panjang, yaitu
klaster rantai B terikat di titik percabangannya.
Gambar 3. Model molekul amilopektin yang diadopsi dari (a) French (1972);
(b) Hizukuri (1986); dan (c) Robin et al. (1974). Dalam model
terse-but φ menunjukkan ujung gula pereduksi (reducing end). Keterangan
rantai (A), (B), (B1, B2 dan B3), dan (C) dijelaskan di dalam teks.
CL menunjukkan panjang rantai (chain length). Daerah kristalin dan
amorf ditunjukkan dengan kode 1 dan 2.
Profil rantai amilopektin dapat diketahui dengan pengukuran menggunakan
Size Exclusion Chromatography (SEC), Ion-exchange Chromatography (IEC)
atau Fluorophore-Assisted Capillary Electrophoresis (FACE) dengan cara
memo-tong dahulu ikatan-ikatan percabangan pada amilopektin secara enzimatis. Nisbah
rantai A dan B dalam amilopektin dapat ditentukan dengan menggunakan enzim
iso-13 amilase dan pullulanase. Kedua jenis enzim tersebut dapat memutus secara
spesi-fik ikatan-ikatan glikosidik α-1,6 sehingga membentuk struktur linear amilosa
rantai pendek (Morell et al. 1998).
Tabel 3 memperlihatkan distribusi panjang rantai amilopektin dari beberapa
sumber pati yang dianalisis dengan menggunakan FACE (Srichuwong et al.
2005a). Terlihat bahwa sumber pati yang berbeda memiliki distribusi rantai
amilo-pektin yang berbeda. Dibandingkan jenis pati lainnya, pati garut memiliki
distri-busi panjang rantai amilopektin pada DP 6-8 paling sedikit (4,0%). Distridistri-busi
rantai amilopektin pati garut yang terbesar berada pada kisaran DP 9-30 (96,0%).
Tabel 3. Distribusi panjang rantai amilopektin1
Sumber Pati Nisbah
APC2
Distribusi Panjang Rantai (%) DP 6-8 DP 9-12 DP 13-24 DP 25-30
(Amylopectin unit-chain) merupakan nisbah relatif molar distribusi amilo-pektin dengan DP 6-12 terhadap DP 6-24.
2.3. Model Struktur Granula Pati
Buleon et al. (1998) membagi struktur granula pati menjadi daerah kristalin
dan daerah amorf (Gambar 4). Daerah kristalin disusun oleh rantai pendek dari
amilopektin dalam bentuk klaster. Menurut Oostergetel dan van Bruggen (1993),
daerah kristalin pada granula pati membentuk struktur superheliks (Gambar 5).
Daerah amorf merupakan daerah titik-titik percabangan dalam rantai amilopektin
14 (2005), ikatan hidrogen yang menghubungkan antar molekul amilosa dan atau
amilopektin di daerah kristalin lebih kuat dibandingkan dengan di daerah amorf.
Gambar 4. Model daerah amorf dan kristalin dari granula pati (Buleon et al. 1998)
15 Teknik pelabelan dengan fluorofor dapat digunakan untuk menganalisis
struktur amilosa (Hanashiro dan Takeda 1998) dan amilopektin (Morell et al.
1998; Edwards et al. 1999; Hanashiro et al. 2002; Nakamura et al. 2002).
Distri-busi panjang rantai amilosa dan amilopektin dapat dilakukan dengan teknik
pela-belan pada rantai tersebut dengan menggunakan metode Size-exclusion
Chromato-graphic (SEC) (Hanashiro dan Takeda, 1998; Hanashiro et al. 2002) atau
elektro-foresis dengan detektor Laser-induced Fluorescence (Morell et al. 1998).
Distri-busi panjang rantai glukan berdasarkan satuan molar dapat dilakukan dengan
menggunakan metode Fluorophore-Assisted Capillary Electrophoresis (FACE)
yang merupakan jenis instrumen DNA squencer. Metode analisis lain yang dapat
digunakan untuk menganalisis panjang rantai glukan adalah High Performance
Anion Exchanger Chromatography–Pulse Amperometric Detection
(HPAEC-PAD) (Schmiedl et al. 2000; Lehmann et al. 2002).
Menurut Morell et al. (1998), panjang rantai glukan dengan derajat
polime-risasi (DP) 6-30 dapat dianalisis dengan menggunakan FACE. Pati dihidrolisis
dengan menggunakan enzim isoamilase dan dilabel dengan senyawa
8-amino-1,3,6-pyrenetrisulfonic acid (APTS) yang berfungsi untuk menderivatisasi gula pereduksi pada rantai glukan dan APTS membentuk kompleks dengan rantai
glu-kan sehingga membentuk senyawa kromofor atau fluorofor yang dapat terdeteksi
oleh FACE (O’Shea et al. 1998; Edwards et al. 1999) (Gambar 6). Metode
FACE banyak digunakan untuk menganalisis derajat polimerisasi dari pati dan
umumnya digunakan untuk menentukan panjang rantai amilopektin dengan DP
6-30. Srichuwong et al. (2005a) telah melakukan analisis DP amilopektin pada 15
jenis pati baik dengan menggunakan FACE maupun dengan HPAEC-PAD.
Metode FACE juga digunakan oleh Singh et al. (2008) untuk melihat DP
amilo-pektin pada kentang dan pati mangga serta pisang (Espinosa-Solis et al. 2009).
Metode HPAEC-PAD sudah banyak digunakan di antara pada pati RS3 dari pati
pisang (Lehmann et al. 2002), kacang merah (Lehmann et al. 2003) dan pati beras
(Shu et al. 2007).
Donald et al. (1997) mengilustrasikan daerah amorf dan daerah
semi-kris-talin pada granula pati dengan bagian tengahnya merupakan hilum sebagai titik
16 Gambar 6. APTS, derivatisasi gugus pereduksi karbohidrat (A) dan
pelabelan amilopektin dengan APTS (B) penentuan distri-busi panjang rantai amilopektin dengan FACE (Srichu-wong 2006)
A
λex488 nm λem520 nm A
A
17 berselang-seling. Struktur tersebut digambarkan seperti cincin yang berlapis-lapis
yang dimulai dari hilum ke arah luar secara radial. Daerah semi-kristalin tersusun
oleh lamella amorf dan lamella kristalin, sedangkan daerah amorf sebagian besar
tersusun oleh amilosa dan ikatan antar klaster. Ukuran satu lamella amorf dan satu
lamella kristalin berkisar 9-10 nm, sedangkan satu lamella kristalin berkisar 5-6
nm. Perbedaan istilah dikemukakan oleh Gallant et al. (1997) yang membagi
granula pati menjadi daerah kristalin dan semi-kristalin. Daerah kristalin menurut
Gallant et al. (1997) sama dengan daerah kristalin, sedangkan daerah
semi-kristalin sama dengan daerah amorf. Seluruh jenis granula pati, termasuk granula
pati garut, memiliki daerah kristalin dan amorf sebagaimana dijelaskan di atas.
Gambar 7. Model struktur granula pati (Donald et al. 1997). (A) Daerah
kris-talin; (B) lamella amorf dan lamella kriskris-talin; (C) Struktur double
helix dari rantai amilopektin yang berdekatan membentuk lamella kristalin
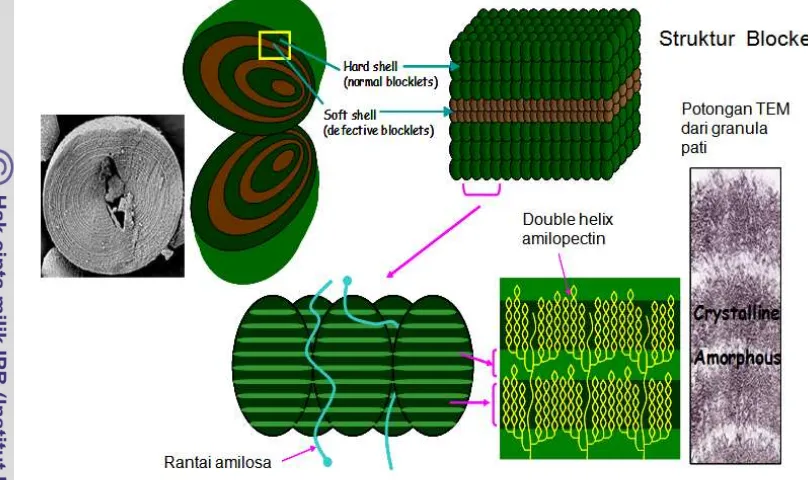
Model granula pati yang lain menurut Gallant et al. (1997) adalah berbentuk
“Blocklets” (Gambar 8). Daerah lamella kristalin-amorf disusun dalam bentuk
spherical blocklets yang merupakan hasil pengamatan dengan menggunakan Atomic Force Microscopy (AFM) pada permukaan pati kentang dan gandum. Berdasarkan pengukuran menggunakan instrumen difraksi sinar X, pati alami
diketahui memiliki derajat kristalinitas sebesar 15-45,0% (Zobel 1988).
Kristalini-tas granula pati dapat diamati dengan menggunakan metode difraksi sinar X
(Pomeranz dan Meloan 2000). Puncak intensitas dari difraksi sinar X berhubungan
semi-18
kristalin pati menjadi tipe A, B, C dan V (Gambar 9). Kristalin tipe A umumnya
ditemukan pada pati yang berasal dari serealia, seperti beras, gandum, dan jagung.
Kristalin tipe B banyak ditemukan pada pati yang berasal dari umbi-umbian,
amilomaize dan pati yang teretrogradasi. Kristalin tipe C yang merupakan
gabungan antara tipe A dan B biasanya terdapat pada pati biji-bijian. Kristalin tipe
V terjadi apabila amilosa membentuk kompleks dengan senyawa lain, seperti
lemak. Pola difraksi sinar X tersebut dapat berubah oleh pemanasan, misalnya pati
kentang dengan tipe B dapat berubah menjadi tipe A atau C dengan perlakuan
Heat Moisture Treatment (HMT) (Liu 1997).
Beberapa peneliti menggunakan difraksi sinar X dalam mengkarakterisasi
perubahan struktur kristal dari pati (Stute 1992; Hoover dan Vasanthan 1994a dan
1994b). Stute (1992) menemukan bahwa perlakuan modifikasi Heat Moisture
Treatment (HMT) pati kentang mengubah kristalinitas pati dari tipe B menjadi tipe A. Hoover dan Vasanthan (1994a) menemukan bahwa modifikasi dengan
annealing juga mengubah kristalinitas pati non-sereal dari kristalin tipe B menjadi campuran kristalin tipe A dan B.
Sebagaimana telah dijelaskan di atas, bagian non-kristalin dari granula pati
disebut dengan amorf. Berdasarkan model klaster amilopektin (Gambar 7),
daerah percabangan amilopektin merupakan daerah amorf. Molekul amilosa juga
berada sebagian besar di daerah amorf tersebut dan dapat berinteraksi dengan
rantai amilopektin. Berbeda dengan daerah kristalin, daerah amorf tidak
menun-jukkan pola difraksi sinar X (Zobel 1992). Daerah amorf ini mudah mengalami
reaksi kimia, misalnya dihidrolisis oleh asam atau bereaksi dengan suatu gugus
fungsional. Daerah amorf merupakan bagian yang dapat mengembang dalam
proses gelatinisasi pati (Liu 2005).
Distribusi daerah kristalin dan amorf dari pati telah didekati melalui
hidro-lisis asam. Hidrohidro-lisis oleh asam, terutama di awal proses, terjadi secara cepat pada
daerah amorf yang mengandung titik percabangan α-1,6 dari molekul
amilo-pektin dan sebagian besar amilosa. Selanjutnya, proses hidrolisis terjadi secara
lambat di daerah kristalin. Kristalilitas granula pati dapat ditentukan dengan
menggunakan pemisahan dan integrasi kurva di bawah puncak daerah kristalin
19 Gambar 8. Struktur granula pati berdasarkan model “Blocklet” (Gallant
et al. 1997)
Gambar 9. Profil kristal pati hasil pengukuran dengan difraksi
20
15-45,0% (Tabel 4), tergantung pada sumber pati dan metode penghitungannya.
Kristalinitas pati juga sangat dipengaruhi oleh kadar air dari granula. Kristalinitas
pati tipe A dipengaruhi oleh kadar amilosa. Pada pati tipe B yang memiliki kadar
amilosa yang cukup tinggi (seperti amilomaize), derajat kristalinitasnya lebih
kecil dibandingkan dengan pati jenis lain pada tipe yang sama (ganyong dan
kentang). Untuk pati tipe C, derajat kristalinitas tidak menunjukkan pola yang
sistematis (Zobel 1988 dan Tang et al. 2001).
Tabel 4. Kristalinitas pati tipe A, B dan C pada kandungan
ami-losa yang berbeda1
Pati Kristalinitas (%) Amilosa (%)
Struktur Pati Tipe A
Barley 22-27 22-27
Struktur Pati Tipe B
Amilomaize 15-22 55-75
Edible canna 26 25
Kentang 28 22
Struktur Pati Tipe C
Ubi jalar 38 20
Tapioka 38 18
1
Zobel (1988) dan Tang et al. (2001)
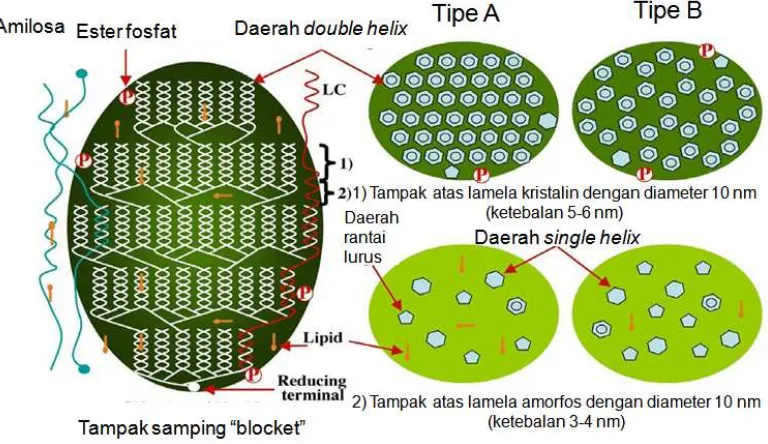
Pola difraksi sinar X menunjukkan kristalin pati garut tergolong tipe A
dengan karakteristik amilopektin pati garut memiliki derajat polimerisasi (DP)
9-30 yang cukup tinggi, densitasnya lebih padat pada daerah struktur heliks
(menun-jukkan semakin banyak double helix yang terbentuk) (Gambar 10) dengan derajat
kristalinitas sebesar 31,5% (Wang et al. 1998; Srichuwong et al. 2005a), proporsi
rantai cabang berukuran pendek pada amilopektin lebih tinggi (Hizukuri et al.
1983) dan jumlah rantai per klaster lebih banyak (10-23 per klaster)
diban-dingkan dengan kristalinitas tipe B (6-7 per klaster) (Takeda dan Hanashiro
21
molekul amilopektin dihidrolisis oleh enzim pullulanase (debranching) maka akan
dihasilkan lebih banyak fraksi amilosa rantai pendek.
Gambar 10. Perbedaan struktur kristalin tipe A dan B dari pati (Tang et al. 2006)
Karakteristik pati garut yang diukur dengan difraksi sinar X sebagaimana
dijelaskan di atas menunjukkan potensinya untuk dijadikan sebagai bahan baku
dalam pembuatan pati resisten. Semakin banyak fraksi amilosa rantai pendek baik
hasil pemutusan ikatan percabangan amilopektin (debranching) atau hidrolisis
asam, maka akan semakin banyak fraksi amilosa yang teretrogadasi sehingga
kadar pati resisten yang terbentuk akan semakin tinggi. Menurut Lehmann et al.
(2003), amilopektin dengan derajat polimerisasi (DP) kurang dari 10 dapat
meng-halangi pembentukan pati resisten, namun struktur linear dengan DP bekisar
10-35 merupakan panjang rantai yang optimal untuk pembentukan pati resisten.
Sementara itu, distribusi panjang rantai amilopektin pada pati garut dengan DP
13-24 cukup tinggi, yaitu sebesar 58,4%. Bila rantai-rantai tersebut dihidrolisis
oleh enzim pullulanase pada titik percabangannya, maka diharapkan dapat
meningkatkan pati resisten yang terbentuk.
22 2.4. Pengaruh Proses Pemanasan terhadap Gelatinisasi dan Retrogradasi Pati
Gelatinisasi dan retrogradasi merupakan fenomena yang paling penting dari
pati dan sangat berkaitan dengan sifat fungsional pati. Studi mengenai gelatinisasi
dan retrogradasi pati dapat juga menjelaskan hubungan antara struktur dan sifat
fungsional pati.
2.4.1. Gelatinisasi Pati
Granula pati alami bersifat tidak larut dalam air, namun dapat menjadi larut
dalam air bila suspensi pati dipanaskan di atas suhu gelatinisasinya. Bila pati
disuspensikan dalam air yang berlebih dan dipanaskan pada suhu dan waktu
tertentu, maka granula pati secara berangsur-angsur mengalami perubahan yang
bersifat ireversibel, artinya tidak dapat kembali pada kondisi granula semula.
Gelatinisasi pati ditandai dengan terjadinya pengembangan (swelling) granula
pati, peluruhan (melting) dari bagian kristalit, hilangnya sifat birefringence,
peningkatan kekentalan dan peningkatan kelarutan pati (Gambar 11). Suhu awal
terjadinya gelatinisasi yang teramati dipengaruhi oleh konsentrasi pati, metode
analisis, jenis pati dan keseragaman ukuran granula pati. Mekanisme gelatinisasi
pati tersebut dapat dipelajari dengan beberapa teknik, yaitu dengan menggunakan
instrumen viskometer, mikroskop optik, mikroskop elektron, difraksi sinar X,
Differential Scanning Calorimetry (DSC), Nuclear Magnetic Resonance (NMR) spectroscopy dan X-ray scatting (Liu 2005).
DSC digunakan untuk analisis termal dalam menentukan transisi
kristali-nitas pati yang diakibatkan oleh penambahan panas (Schenz dan Davis 1998).
Pemecahan kristal pati adalah reaksi endotermik karena dibutuhkan sejumlah
energi yang dapat diserap untuk memutuskan ikatan antara molekul. Perubahan
panas dapat dideteksi dengan membandingkan panas yang diserap oleh sampel
pati dengan referensi kosong. DSC dapat digunakan untuk mengamati dan
mengu-kur suhu dan besarnya entalpi pada saat pati mulai mengalami pelelehan.
Dalam proses gelatinisasi pati ini, granula pati secara berangsur-angsur
mengalami pengembangan (swelling) dengan meningkatnya suhu pemanasan.
Pengembangan granula pati terjadi karena molekul-molekul air masuk ke dalam
granula pati dan terperangkap pada susunan molekul-molekul amilosa dan amilo-
23 Gambar 11. Perubahan granula pati (alami: I) selama proses gelatinisasi,
terjadi pengembangan (IIa) pelepasan amilosa (IIb), retrogra-dasi, proses penggabungan kembali rantai linear pati setelah dekristalisasi akibat gelatinisasi (Srichuwong 2006)
Mekanisme pengembangan tersebut disebabkan ikatan-ikatan hidrogen yang
menghubungkan molekul-molekul amilosa dan amilopektin semakin melemah
dengan meningkatnya suhu pemanasan, sehingga mengganggu kekompakan
gra-nula pati. Di sisi lain, dengan meningkatnya suhu, maka molekul-molekul air
mempunyai energi kinetik yang lebih tinggi sehingga dengan mudah berpenetrasi
ke dalam granula pati. Dengan demikian, bila suhu suspensi pati meningkat, maka
air akan terikat secara simultan dalam molekul amilosa dan amilopektin yang
mengakibatkan pengembangan ukuran granula pati tersebut. Setelah
pengem-bangan granula mencapai maksimum pada suhu pemanasan tertentu, maka
gra-nula pati akan pecah (rupture), sehingga pemanasan pada suhu yang lebih tinggi
akan menyebabkan penurunan kekentalan pasta pati secara tajam (Meyer 2003,
Parker 2003).
Proses gelatinisasi pati seperti dikemukakan di atas dapat diamati dengan
menggunakan alat Brabender Viscoamilograph (BVA) atau Rapid Visco Analyzer
(RVA). BVA dan RVA mencatat data-data profil gelatinisasi selama fase
pema-nasan dan pendinginan, yaitu suhu awal gelatinisasi, viskositas puncak, viskositas
24 memiliki profil gelatinisasi yang khas yang membedakan antara satu jenis pati
dengan jenis pati yang lainnya. Dari parameter profil gelatinisasi tersebut,
visko-sitas setback dapat menggambarkan kecenderungan pasta pati untuk mengalami
retrogradasi selama fase pendinginan, yaitu semakin tinggi viskositas setback
maka kecenderungan retrogradasi semakin meningkat(Srichuwong 2006).
Gambar 12. Profil gelatinisasi dengan pengukuran menggunakan Rapid Visco Analyzer (RVA) dan perubahan granula pati selama pemanasan (Srichuwong 2006)
Schoch dan Maywald (1968) mengelompokkan pati berdasarkan profil
gela-tinisasinya ke dalam empat jenis, yaitu tipe A, B, C dan D. Profil gelatinisasi pati
tipe A menunjukkan pati yang memiliki kemampuan mengembang yang tinggi
yang ditunjukkan dengan tingginya viskositas maksimum dan diikuti dengan
penurunan viskositas selama pemanasan (mengalami breakdown), contohnya pati
kentang, dan tapioka. Profil gelatinisasi pari tipe B mirip dengan tipe A, tetapi