Peran Melatonin pada ekspresi
Malondialdehyde (MDA)
dan
Myeloperoksidase (MPO)
Sel Mikroglia serta
Aquaporin-4
(AQP4)
dan
Vascular Endothelial Growth
Factor (VEGF)
Sawar Darah Otak Tikus
pascacedera Kepala
DISERTASI
KHAIRUL IHSAN NASUTION
NIM: 108102020
PROGRAM STUDI DOKTOR (S-3) ILMU KEDOKTERAN
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Peran Melatonin pada ekspresi
Malondialdehyde (MDA)
dan
Myeloperoksidase (MPO)
Sel Mikroglia serta
Aquaporin-4
(AQP4)
dan
Vascular Endothelial Growth
Factor (VEGF)
Sawar Darah Otak Tikus
pascacedera Kepala
DISERTASI
Diajukan sebagai Salah Satu Syarat untuk Memperoleh Gelar Doktor dalam Program Studi Doktor (S-3) Ilmu Kedokteran pada
Fakultas Kedokteran Universitas Sumatera Utara di bawah Pimpinan
Rektor Universitas Sumatera Utara
Prof. Dr. dr. Syahril Pasaribu, DTM&H, M.Sc(CTM), Sp.A(K) Untuk Dipertahankan di Hadapan Sidang Ujian Terbuka
Program Studi Doktor (S-3) Ilmu Kedokteran Universitas Sumatera Utara
Oleh
KHAIRUL IHSAN NASUTION NIM: 108102020
PROGRAM STUDI DOKTOR (S-3) ILMU KEDOKTERAN
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PROMOTOR
Prof. Dr. dr. A. Hafid Bajamal, Sp.BS Guru Besar Tetap Ilmu Bedah Saraf
Fakultas Kedokteran Airlangga Surabaya
KO-PROMOTOR
Prof. Dr. dr. Hasan Sjahrir, Sp.S Guru Besar Tetap Ilmu Penyakit Saraf Fakultas Kedokteran Universitas Sumatera Utara
Medan
KO-PROMOTOR
Prof. dr. Aznan Lelo, PhD, Sp.FK Guru Besar Tetap Ilmu Farmakologi Klinik Fakultas Kedokteran Universitas Sumatera Utara
Judul Disertasi : Peran Melatonin pada ekspresi Malondialdehyde (MDA) dan
Myeloperoksidase (MPO) Sel Mikroglia serta Aquaporin-4 (AQP4) dan Vascular Endothelial Growth Factor (VEGF)
Sawar Darah Otak Tikus pascacedera Kepala Nama Mahasiswa : KHAIRUL IHSAN NASUTION
NIM : 108102020
Program Studi : Doktor (S-3) Ilmu Kedokteran
Menyetujui Komisi Pembimbing
Prof. Dr. dr. A. Hafid Bajamal, Sp.BS Promotor
Prof. Dr. dr. Hasan Sjahrir, Sp.S Ko-Promotor
Prof. dr. Aznan Lelo, PhD, Sp.FK Ko-Promotor
Ketua Program Studi Doktor (S-3) Dekan
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : KHAIRUL IHSAN NASUTION
NIM : 108102020
Program Studi : Ilmu Kedokteran Jenis Karya : Disertasi
Demi pengembangan Ilmu Pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-eksklusif
(Non-exclusive Royalty Free Right) atas disertasi saya yang berjudul :
Peran Melatonin pada ekspresi
Malondialdehyde (MDA)
dan
Myeloperoksidase (MPO)
Sel Mikroglia serta
Aquaporin-4
(AQP4)
dan
Vascular Endothelial Growth
Factor (VEGF)
Sawar Darah Otak Tikus
pascacedera Kepala
beserta perangkat yang ada (jika diperlukan), dengan Hak Bebas Royalti Non-eksklusif ini Universitas Sumatera Utara berhak menyimpan, mengalih media/formatkan, mengelola dalam bentuk database, merawat, dan mempublikasikan disertasi saya tanpa meminta izin dari saya sebagai penulis dan sebagai pemilik hak cipta.
Demikian pernyataan ini saya perbuat dengan sebenarnya.
Dibuat di Medan
Pada tanggal 23 Desember 2014 Yang menyatakan
Telah diujji pada Ujian Tertutup Tanggal 03 Desember 2014
TIM PENGUJI DISERTASI
Ketua : Prof. Dr. dr. A. Hafid Bajamal, Sp. BS Anggota : Prof. Dr. dr. Hasan Sjahrir, Sp.S(K)
Prof. dr. Aznan Lelo, Ph.D, Sp.FK
Allah akan mengangkat (derajat) orang yang beriman diantara kamu
dan orang yang diberi Ilmu Pengetahuan beberapa derajat.
Dan Allah Maha Mengetahui terhadap apa yang kamu kerjakan
(QS Al Mujaadalah (58):11)
UCAPAN TERIMA KASIH
Assalamualaikum Warahmatullahi Wabarakatuh
Puji syukur ke hadirat Allah SWT Yang Maha Pengasih dan Maha Penyayang, atas segala rahmat dan karunia-Nya, saya dapat melaksanakan pendidikan S-3 Ilmu Kedokteran dan menyelesaikan disertasi ini dengan judul “Peran Melatonin pada ekspresi
Malondialdehyde (MDA) dan Myeloperoksidase (MPO) Sel Mikroglia serta
Aquaporin-4(AQP4) dan Vascular Endothelial Growth Factor (VEGF)
Sawar Darah Otak Tikus pascacedera Kepala”. Penelitian dan penulisan disertasi ini mendapat dukungan dan masukan dari berbagai pihak. Dengan hati yang tulus, penulis mengucapkan terima kasih dan penghargaan kepada yang terhormat.
Rektor Universitas Sumatera Utara, Prof. Dr. dr. Syahril Pasaribu, DTM&H,M.Sc(CTM),Sp.A(K) atas kesempatan dan fasilitas yang diberikan kepada saya untuk mengikuti dan menyelesaikan pendidikan Program Studi Doktor (S-3) Ilmu Kedokteran di Fakultas Kedokteran Universitas Sumatera Utara.
Dekan Fakultas Kedokteran Universitas Sumatera Utara, Prof. dr. Gontar A. Siregar, Sp.PD-KGEH, atas kesempatan dan fasilitas yang diberikan kepada saya untuk mengikuti dan menyelesaikan Program Studi Doktor (S-3).
Sp.A(K), dan Sekretaris Program Studi S-3, Prof. Dr. dr. Delfitri Munir, Sp.THT-KL(K), yang telah memberi kesempatan kepada saya untuk mengikuti dan menyelesaikan Program Studi Doktor (S-3).
Prof. Dr. dr. A. Hafid Bajamal, Sp.BS, Guru Besar Tetap Ilmu Bedah Saraf Universitas Airlangga/RSUD. dr. Soetomo Surabaya, atas kesediannya dengan tulus ikhlas menjadi Promotor serta meluangkan waktu membimbing, mendorong, dan memberi masukan dengan penuh kesabaran dan ketelitian yang sangat bermanfaat dalam pelaksanaan penelitian dan penulisan disertasi ini.
Prof. Dr. dr. Hasan Sjahrir, Sp.S, yang telah membantu dan bersedia menjadi Ko-Promotor, serta memberi dukungan, meluangkan waktu, mengarahkan dan memperluas wawasan keilmuan saya, memberi masukan yang sangat bermanfaat dalam penulisan disertasi ini.
Prof. dr. Aznan Lelo, PhD, Sp.FK, sebagai Ko-Promotor yang telah memberi semangat, pengetahuan dan masukan yang sangat bermanfaat dalam mengikuti program studi dan penulisan disertasi ini.
Para penguji disertasi : Prof. Dr. dr. A. Hafid Bajamal, Sp. BS, Prof. Dr. dr. Hasan Sjahrir, Sp.S(K), Prof. dr. Aznan Lelo, Ph.D, Sp.FK, Prof. Dr. dr. Iskandar Japardi, Sp. BS(K), Prof. Dr. Syafruddin Ilyas, M. Biomed, Prof. Dr. dr. Sri Maliawan, Sp.BS(K), Dr. Ir. Erna Mutiara, MKM, yang telah memberi penilaian dan masukan demi kesempurnaan disertasi ini.
Sp.OG(K) yang telah memberi masukan dan menyetujui penelitian ini, serta menerbitkan Persetujuan Komisi Etik tentang Pelaksanaan Penelitian Bidang Kesehatan.
Para pemberi kuliah Program Studi Doktor (S-3): Prof. dr. Chairuddin P. Lubis, DTM&H, Sp.A(K), Prof. dr. Harun Rasyid Lubis, Sp.PD-KGH, Alm Prof. dr. Iskandar Zulkarnain Lubis, Sp.A(K), Prof. dr. Rozaimah Hamid, Ph.D.MSc,Sp.FK, Dr. Ir Sumono MS, Dr. Drs. Sutarman, M.Si, Dr. Drs. Ridwan Siregar, M.Lib, dr. Adang Bachtiar, MPH, DSC, Dr. dr. Endang Sri Rostini Harjo Lukito, MS, Ph.D, Sp.PA(K), Dr. dr. Rosita Juwita Sembiring, Sp.PK(K), dan dr. Gino Tann, Ph.D, Sp.PK(K), saya ucapkan terima kasih yang sebesar-besarnya atas bimbingan dan diskusi selama saya mengikuti Program Studi S-3.
Prof. Dr. Syafruddin Ilyas, M. Biomed, Ketua Program Studi Magister Biologi dan Dr. dr Agus Turchan, Sp.BS Dosen Tetap Ilmu Bedah Saraf Universitas Airlangga/RSUD. dr. Soetomo Surabaya, yang telah memberikan dukungan dan motivasi terhadap penelitian dan disertasi ini.
Wibi Riawan, SSi, Staf Animal Laboratorium Universitas Brawijaya Malang, yang telah membantu melaksanakan dan menyelesaikan penelitian ini dengan penuh rasa tanggung jawab serta tulus ikhlas.
Dandenkesyah IM. 04.01 LSW, yang telah memberi izin dan keluangan waktu bagi saya untuk mengikuti Program Studi S-3 di FK USU.
Dr. dr. Imam Budi Putra, MHA, Sp.KK. Kiky Lestari, SE, Petty Angelia H, SS, Dipa Hidayat, S.Kom, Muhammad Ridho di sekretariat Program Studi Doktor (S-3), para sejawat Peserta Program Studi Doktor (S-3) seangkatan, Dr. dr. Rustam Effendi YS, SpPD, Dr. dr. Fauzi Yusuf, Sp.PD-KGEH, Dr. dr. Henry Salim Siregar, SpOG, dr. Indra Zachreini, Sp.THT-KL, dr. Dadik Wahyu Wijaya, SpAn dan sejawat lainnya.
Terima kasih yang tidak terhingga serta doa saya untuk orangtua tercinta, ayahanda Alm. H. Ibrahim Nasution dan ibunda Hj. Husniah Batubara, yang telah melahirkan, membesarkan, mendidik, serta membimbing dan memberi teladan dalam bekerja keras, mendalami pendidikan ilmu pengetahuan dan agama Islam, mengutamakan kejujuran, saling menyayangi sesama saudara dan umat, bertanggung jawab atas tugas yang diembankan, serta tabah dalam menjalani kehidupan. Terima kasih yang setinggi-tingginya saya ucapkan kepada bapak mertua Alm. H. Khaeroman Lase dan ibu mertua Hj. Rehatun Djani.
yang saleh dan saleha. Juga ucapan terima kasih kepada saudara-saudara saya Ir. H. Ahmad Syafri Nasution MMA, H. Muhammad Syafran Nasution, SE Ak, dan Mayor Ckm dr. Riza Anshori Nasution, SpBS.
Semua pihak yang telah membantu, secara langsung atau tidak langsung yang tidak dapat saya sebutkan satu persatu namanya, semoga Allah SWT, Tuhan Yang Mahakuasa memberikan balasan yang terbaik.
Semoga disertasi ini dapat memberi sumbangan berharga bagi perkembangan Ilmu Kedokteran serta peningkatan pelayanan kedokteran kepada masyarakat, dan Allah SWT senantiasa memberi rahmat dan hidayah-Nya kepada kita semua, Amin Ya Robbal Alamin.
Wassalamualaikum Warahmatullahi Wabarakatuh.
Medan, Desember 2014 Peneliti
DAFTAR RIWAYAT HIDUP
A. Identitas Pribadi
1. Nama : dr. Khairul Ihsan Nasution, SpBS 2. Tempat.Tanggal lahir: Medan, 15 Juli 1971
3. Agama : Islam
4. N R P : 11950008620771
5. Pangkat/Golongan : Letkol Ckm
6. Jabatan : DANDENKESYAH IM.04.01 LSW 7. Pekerjaan : TNI-AD
8. Alamat Rumah : Pahlawan No. 52/77 Medan 9. Telp.Rumah/HP : 061-5535030/081361080738 10. E-mail : qiconnast@yahoo.com
B. Riwayat Pendidikan
1. 1978 – 1983 : SD Nahdlatul Ulama Medan 2. 1983 – 1986 : SMP Negeri 15 Medan 3. 1986 – 1989 : SMA Negeri 10 Medan
4. 1989 – 1997 : Fakultas Kedokteran USU Medan 5. 2002 – 2007 : Bedah Saraf FK Airlangga Surabaya
C. Riwayat Pekerjaan
1. Dokter di Akademi Militer Magelang, 1997-2002.
2. Kasubdep Penyakit Dalam dan Jiwa RS Tk III IM Iskandar Muda, 2008-2009.
3. Kepala RS Tk IV IM.07.01 Lhokseumawe, 2010-2012. 4. Dandenkesyah IM.04.01 Lhokseumawe, 2013.
D. Riwayat Organisasi
1. Anggota IDI Cab Medan. 2. Anggota PERSPEBSI.
3. Anggota Komisi Trauma IKABI
E. Karya Tulis
1. Cedera Kepala pada Petinju, Media Bedah Saraf II (3) : 182-189, 2004.
2. Double Compartment Hydrocephalus. Muktamar PERSPEBSI III, Yogyakarta, Mei 2005.
3. Shaken Baby Syndrom. Report of 2 Cases. Presented in Annual Scientific Meeting of Indonesian Society of Neurological Surgeon (PIT PERSPEBSI) in Conjunction with The World Federation of Neurosurgiacal Societies (WFNS) Course, Bali International Convention Center, Nusa Dua, Bali, Indonesia, 21-22 November, 2006.
PERNYATAAN ORISINALITAS
Saya yang bertanda tangan di bawah ini, dengan ini menyatakan bahwa Hasil penelitian ini adalah hasil karya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan dengan benar
Medan, Desember 2014
RINGKASAN
Cedera kepala merupakan salah satu kondisi yang sangat membahayakan bagi kehidupan manusia. Setiap tahun di Amerika Serikat hampir 1.500.000 kasus cedera kepala. Dari jumlah tersebut 80.000 di antaranya mengalami kecacatan dan 50.000 orang meninggal dunia. Saat ini di Amerika Serikat terdapat sekitar 5.300.000 orang dengan kecacatan akibat cedera kepala (Centres for Disease Control, 2002). Indonesia belum memiliki laporan yang pasti tentang angka kejadian cedera kepala. Namun, di Rumah Sakit Cipto Mangunkusumo (RSCM) Jakarta, pada tahun 2005 dilaporkan bahwa angka kejadian cedera kepala mencapai 750 kasus dengan mortalitas sebanyak 23 kasus dan di Rumah Sakit Dr. Soetomo dilaporkan bahwa angka kejadian cedera kepala mencapai 1.578 pada tahun 2009 dan 1.402 pada tahun 2011 data Bagian Bedah Saraf FK Unair/Dr. Soetomo. Untuk mengatasi hal tersebut telah dilakukan berbagai upaya antara lain pemberian manitol, hiperventilasi dan cairan hipertonis. Upaya tersebut belum memberikan hasil yang optimal.
Apabila edema serebri pada cedera kepala tidak ditangani dengan baik, akan mengakibatkan terjadinya peningkatan tekanan intrakranial (TIK) dan kemudian mengakibatkan iskemia pada sel otak sehingga memicu terjadinya kematian. Namun, terapi tersebut belum memberikan hasil yang optimal, sehingga untuk mengatasi edema serebri dikembangkan pemberian Melatonin.
Tujuan penelitian ini untuk mengetahui peran Melatonin pada ekspresi Malondialdehyde (MDA) dan Myeloperoksidase (MPO) sel mikroglia, serta Vascular Endothelial Growth Factor (VEGF) dan
Aquaporin-4 (AQP4) dari Sawar Darah Otak (SDO) setelah cedera kepala pada hewan coba (Kaal Evert, Charles, 2004).
Penelitian ini merupakan penelitian true experimental karena randomisasi, kontrol, perlakuan, dan replikasi. Adapun rancangannya adalah post test only control group design.
Keterangan P : populasi
AR : alokasi random
Ko : kelompok hewan coba tanpa cedera kepala
K1 : kelompok hewan coba cedera kepala yang tidak diberi Melatonin K2 : kelompok hewan coba cedera kepala yang diberi Melatonin
P1
K1 O-1
2O-2 P2
K2 AR
P
Po
Po : Perlakuan tidak ada
P1 : Perlakuan cedera kepala tanpa diberi Melatonin P2 : Perlakuan cedera kepala diberi Melatonin Oo : Observasi kelompok tanpa cedera
O1 : Observasi kelompok cedera kepala tanpa Melatonin O2 : Observasi kelompok cedera kepala diberi Melatonin
Variabel bebas dalam penelitian ini adalah kondisi edema serebri pada hewan coba, dan Melatonin. Variabel kendali dalam penelitian ini adalah jenis hewan coba, jenis kelamin, umur, berat badan, model cedera kepala, obat perlakuan, dosis obat perlakuan, teknik pengambilan dan pemeriksaan sampel. Variable tergantung dalam penelitian ini adalah hasil ekspresi MDA, MPO, VEGF dan AQP4, yang diperiksa secara Imunohistokimia.
bahwa penurunan MDA tidak hanya terjadi pada sel-sel mikroglia, tetapi juga pada jaringan otak, terutama di sekitar area induksi cedera kepala.
SUMMARY
The brain injury is one of the dangerous condition for human life. Every year in United States of America, there are almost 1.500.000 brain injury cases. From those cases 80-000 among others have disabilities and 50.000 people died. Currently in United States, about 5.300.000 people living with disabilities due to brain injury (Centres for Disease Control, 2002). Indonesia hasn't any exactly report about the number of brain injury. But, in the Cipto Mangunkusumo General Hospital (RSCM) in Jakarta, in 2005 reported that the number of brain injury cases reach 750 cases with mortality about 23 cases and Dr. Soetomo General Hospital in Surabaya reports that the number of brain injury cases is reach 1.578 cases in 2009 and 1.402 cases in 2011 based on data from department of neurosurgery FK Unair/Dr. Soetomo. To cure those cases, many efforts are done like giving mannitol, hyperventilation and hypertonic liquid. Those efforts aren't give the optimum result yet.
After primary head injury occurs, there are several chain of chemical occurances for that have purpose to keep still the cell alive. However, in the reality, the chemical reactions is often gives bad impact which is known as secondary head injury. The secondary head injury marked by cerebral edema.
give the optimum result, therefore to cure cerebral edema, giving Melatonin is developed.
The purpose of this research was to know the use of Melatonin in expression of Malondialdehyde (MDA) and Myeloperoxidase (MPO) microglia cell, as well as Vascular Endothelial Growth Factor (VEGF) and
Aquaporin-4 (AQP4) from blood brain barier (BBB) after head injury occurs in experimental animal.
This research was a true experimental research because it used randomization, control, treatment, and replication. Eventhough the research design was a post test control group design.
K0 P0 0-0
P AR K1 P1 0-1
K2 P2 0-2 Note:
P : population
AR : random allocation
Ko : group of experimental animal without head injury
K1 : group of experimental animal with head injury weren't given Melatonin
K2 : group of experimental animal with the head injury were given Melatonin
P1 : Trial of experimental animal with head injury weren't given Melatonin
P2 : Trial of experimental animal with the head injury were given Melatonin
O0 : Observation of experimental animal without head injury
O1 : Observation of experimental animal with head injury weren't given Melatonin
O2 : Observation of experimental animal with the head injury were given Melatonin
Free variables in this research was a condition of cerebral edema in experimental animal, and Melatonin. Control variables in this research were kind of experimental animal, sex, age, body mass, model of brain injury, kind of drug treatments, the dosage of drug treatments, sampling and diagnose techniques. And the defend variables the result of expression of MDA, MPO, VEGF and AQP4.
that MDA reduction doesn't only occur in microglia cells, but also in brain tissue, especially around induction of head injury area.
Peran Melatonin pada ekspresi
Malondialdehyde (MDA)
dan
Myeloperoksidase (MPO)
Sel Mikroglia serta
Aquaporin-4
(AQP4)
dan
Vascular Endothelial Growth Factor (VEGF)
Sawar Darah Otak Tikus pascacedera Kepala
ABSTRAK
Latar Belakang: Cedera kepala merupakan salah satu kondisi yang sangat membahayakan kehidupan manusia. Penelitian ini mengkaji penggunaan Melatonin dalam mereduksi oksidan dan hambatan pembentukan edema serebri pada model cedera kepala. Tujuan dari penelitian ini adalah untuk membuktikan apakah terdapat peran perbaikan Melatonin terhadap berbagai parameter terkait ekspresi MDA, MPO, VEGF dan AQP-4, serta gambaran histologis pada tikus model cedera kepala.
Metode Penelitian: Penelitian ini merupakan penelitian true experimental
dengan randomisasi, kontrol-perlakuan, dan replikasi. Adapun rancangannya adalah post test only control group design yaitu menggunakan hewan coba Rattus novergicus strain Sprague Dawley dengan kriteria jenis kelamin jantan, umur 10-12 minggu, dan berat badan 200-300 gram. Penelitian ini menggunakan model cedera kepala menurut Marmarou (1994). Semua parameter terkait diamati secara hitologis menggunakan pemulasan rutin HE dan pemulasan imunohistokimia, menggunakan antibodi spesifik terhadap protein masing-masing, MDA, MPO, VEGF dan AQP-4. Pemeriksaan dan perhitungan secara imunohistokimia.
Hasil Penelitian: Pada penelitian ini didapatkan hasil pengamatan histologis yang meliputi jumlah sel-sel imunokompeten serta diameter pembuluh darah arteri. Dari hasil histologis didapatkan hasil bahwa terdapat penurunan yang signifikan diameter pembuluh darah arteri jaringan cedera otak dengan paparan Melatonin. Pada pemulasan imunohistokimia, didapatkan hasil bahwa terdapat penurunan yang signifikan jumlah ekspresi MDA dan MPO sel-sel mikroglia jaringan otak cedera dengan paparan Melatonin. Demikian juga pada ekspresi VEGF dan AQP-4 SDO jaringan otak cedera menunjukkan penurunan yang signifikan setelah mendapatkan Melatonin. Antara ekspresi VEGF dengan AQP-4 terdapat korelasi positip.
Simpulan: Melatonin dapat menurunkan produksi MDA dan MPO. VEGF terlibat dalam regulasi AQP4 pada kejadian cedera kepala. Penurunan VEGF dapat dikaitkan dengan hambatan Melatonin terhadap kemampuannya untuk mengganggu aktivitas transkripsi VEGF. Secara signifikan dapat dinyatakan penurunan ekspresi VEGF berkorelasi positif terhadap penurunan ekspresi AQP-4.
Role of Melatonin in The Expression of MDA, MPO on Microglia Cells and AQP4 and VEGF in Blood Brain Barrier of Rat after Head Injury
Abstract
Background: The brain injury is one of the conditions that are very harmful to human life. This study will examine the use of Melatonin in reducing oxidant status and barriers to the formation of cerebral edema in a model of brain injury. The purpose of this study is to prove the role of Melatonin on the expression of MDA, MPO, VEGF and AQP-4 and histological injury in a rat model of the head injury.
Methods: This study was a true experimental study with randomization. This study uses a post-test only control group design, using experimental animals Sprague Dawley strain Rattus novergicus, male, aged 10 -12 weeks, and weight of 300 grams. Model of brain injury according to Marmarou (1994). All parameters were observed histologically using hematoxilen-eosin staining and immunohistochemistry, using antibodies specific to each protein, MDA, MPO, VEGF and AQP-4. Observation and calculation of the results of immunohistochemical studies.
Results: In this study, histological observation number of immunocompetent cells and the diameter of the arteries. From the histological results showed that there is a significant reduction in the diameter of the arterial blood vessels of the brain injury tissue. In the immunohistochemical results, showed that there is a significant reduction of MDA and MPO expression amount of cells microglia brain injury tissue . Similarly, the expression of VEGF and AQP-4 BBB of rat brain injury tissue showed a significant reduction inhibitor after getting Melatonin. And by analyzing the relationship between the expression of VEGF by AQP-4 appears there is a positive correlation.
Conclusion: Melatonin is a potent scavanger hydrogen peroxide, which is a co-substrate of MPO, thereby reducing the production of MPO. VEGF is involved in the regulation of AQP4 in the incidence of head trauma. Reported that VEGF is co-localization with AQP4 at the Blood Brain Barier disruption. Decreased expression of VEGF by Melatonin, often associated with its ability to interfere with VEGF transcriptional. Significantly decreased expression of VEGF can be expressed positively correlated to decreased expression of AQP-4.
KATA PENGANTAR
Puji syukur kehadirat Allah Subhanahu Wa Ta’ala atas rahmat, karunia serta izin-Nya, penulis dapat menyelesaikan disertasi yang berjudul “Peran Melatonin pada Ekspresi Malondialdehyde (MDA) dan
Myeloperoksidase (MPO) Sel Mikroglia serta Aquaporin-4 (AQP4) dan
Vascular Endothelial Growth Factor (VEGF) Sawar Darah Otak Tikus Pascacedera Kepala”. Tidak lupa shalawat dan salam penulis sampaikan kepada junjungan Nabi Muhammad SAW yang telah membawa kita ke alam yang penuh dengan ilmu pengetahuan.
Penelitian dan penulisan disertasi ini tidak terlepas dari bimbingan dan masukan dari promotor : Prof. Dr. dr. A. Hafid Bajamal, Sp.BS, Ko-Promotor : Prof. Dr. dr. Hasan Sjahrir, Sp.S dan Prof. dr. Aznan Lelo, PhD, Sp.FK. di samping itu masukan dari para penguji yaitu Prof. Dr. dr. A. Hafid Bajamal, Sp. BS, Prof. Dr. dr. Hasan Sjahrir, Sp.S(K), Prof. dr. Aznan Lelo, Ph.D, Sp.FK, Prof. Dr. dr. Iskandar Japardi, Sp. BS(K), Prof. Dr. Syafruddin Ilyas, M. Biomed, Prof. Dr. dr. Sri Maliawan, Sp.BS(K), Dr. Ir. Erna Mutiara, MKM, serta semua pihak yang telah membantu untuk penelitian dan penulisan disertasi ini.
Penulis menyadari bahwa disertasi ini jauh dari kesempurnaan, untuk itu, penulis mengharapkan saran dan masukan agar disertasi ini dapat bermanfaat bagi kita semua. Amin ya robbal’alamin.
DAFTAR ISI
Halaman SAMPUL DEPAN ... i LEMBAR PRASYARAT GELAR ... ii LEMBAR PROMOTOR DAN CO-PROMOTOR ... iii LEMBAR PERSETUJUAN ... iv PERNYATAAN PERSETUJUAN PUBLIKASI AKADEMIS ... v LEMBAR PENGUJI ... vi UCAPAN TERIMA KASIH ... viii DAFTAR RIWAYAT HIDUP ... xiii HALAMAN PERNYATAAN ORISINALITAS ... xv RINGKASAN ... xvi
SUMMARY ... xx ABSTRAK ... xxiv
ABSTRACT ... xxv KATA PENGANTAR ... xxvi DAFTAR ISI ... xxvii DAFTAR TABEL ... xxix DAFTAR GAMBAR ... xxx DAFTAR SINGKATAN ... xxxii DAFTAR LAMPIRAN ... xxxiv
BAB I PEDAHULUAN ... 1 1.1 Latar Belakang Masalah ... 1 1.2 Rumusan Masalah ... 5 1.3 Tujuan Umum ... 6 1.4 Tujuan Khusus ... 6 1.5 Manfaat Penelitian ... 6 1.5.1 Manfaat Akademis ... 6 1.5.2 Manfaat Klinis ... 7 1.5.3 Manfaat Masyarakat Luas ... 7 BAB II TIJAUAN PUSTAKA ... 8 2.1 Cedera Kepala ... 8 2.1.1 Edema Serebri ... 9 2.1.2 Sel Mikroglia ... 19 2.1.3 Malondialdehyde ... 20
2.1.3.1 Malondialdehyde (MDA) sebagai
produk hasil Stres Oksidatif ... 22 2.1.4 Reactive Oxygen Species dan respon
2.2. Melatonin ... 41 2.2.1 Metabolisme dan Biosintesis Melatonin ... 41 2.2.2 Regulasi Melatonin ... 43 2.2.3 Fungsi Melatonin ... 44 2.2.4 Kebutuhan Melatonin ... 47 2.2.5 Bioavailabilitas Melatonin ... 48 2.2.6 Peran Melatonin pada penurunan Edema
Serebri... 49 2.3 Kerangka Teori ... 56 2.4 Hipotesis Penelitian ... 58 2.5 Kerangka Konseptual ... 59 BAB III METODE PENELITIAN ... 60 3.1 Desain Penelitian ... 60 3.2 Populasi dan sampel ... 61 3.2.1 Populasi ... 61 3.2.2 Sampel ... 61 3.2.3 Perkiraan Besar Sampel ... 61 3.2.4 Cara Kerja dan Alur Penelitian ... 62 3.2.5 Kerangka Operasional ... 70 3.2.6 Identifikasi Variabel ... 71 3.2.7 Definisi Operasional Penelitian ... 71 3.3 Etika Penelitian ... 73 3.4 Lokasi dan Waktu Penelitian ... 73 BAB IV HASIL DAN ANALISIS ... 74 4.1 Karakteristik Subjek Penelitian ... 74 4.2 Pemberian Melatonin terhadap Gambaran
Histologis Jaringan Otak Pascacedera Kepala ... 75 4.3 Distribusi Sel Mikroglia jaringan otak Model Cedera
Kepala dengan Paparan Melatonin ... 77 4.4 Studi Imunohistokimia AQP-4 dan VEGF Sawar
Darah Otak ... 79 4.5 Status Oksidan MDA dan MPO Jaringan Otak ... 82 BAB V PEMBAHASAN ... 88
5.1 Melatonin Menghambat Pembentukan MDA Sel
Mikroglia ... 90 5.2 Melatonin Menghambat Pembentukan MPO Sel
Mikroglia ... 92 5.3 Melatonin Menghambat Pembentukan AQP Sawar
Darah Otak ... 93 5.4 Melatonin Menghambat Pembentukan VEGF dan
DAFTAR TABEL
DAFTAR GAMBAR
No. Gambar Halaman
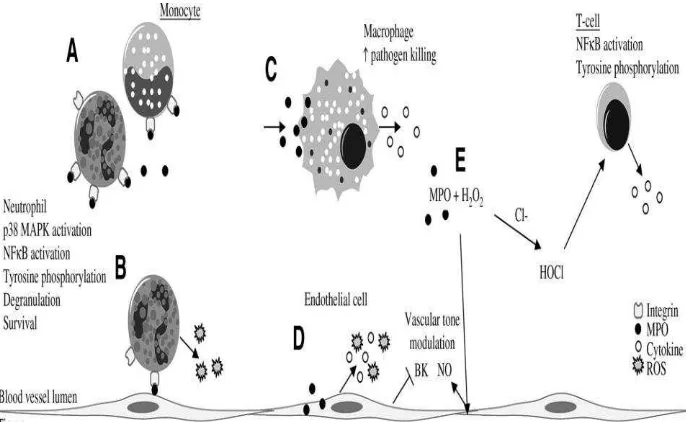
2.1 Ilustrasi keadaan Sel ... 11 2.2 Pelepasan MPO oleh Sel-Sel Imunokompeten pada
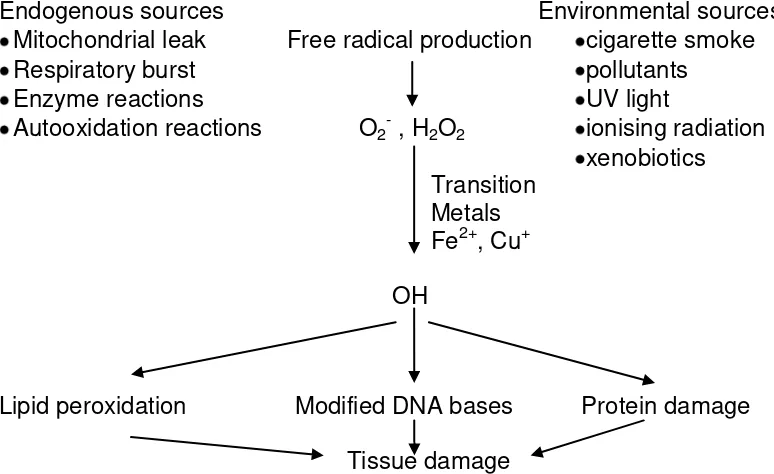
sistem SDO ( Sawar Darah Otak) ... 14 2.3 Sumber eksogen dan endogen Radikal Bebas (Young
and Woodside) ... 23 2.4 Fif1 adalah regulator utama Homeostasis Oksigen ... 35 2.5 Mekanisme VEGF dalam memediasi Edema
Vasogenik ... 36 2.6 Struktur Organisasi dari AQP4 dalam membantu
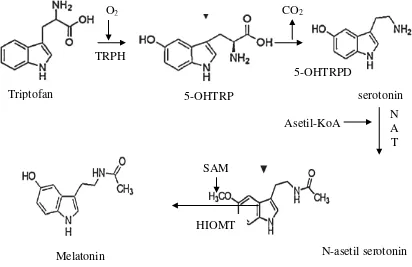
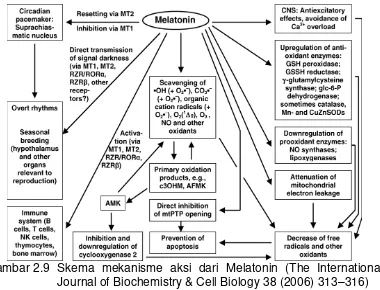
Astrosit ... 38 2.7 Struktur Melatonin ... 41 2.8 Metabolisme dan biosintesis Melatonin ... 43 2.9 Skema mekanisme aksi dari Melatonin ... 47 2.10 Singnaling Melatonin pada Sel melalui aktivasi Gpcr
dan Reseptor Inti ... 50 2.11 Skematik tahapan Cedera Kepala secara molekuler ... 55 3.1 Skematik alat Cedera Kepala ... 62 4.1 Gambaran histologis pembentukan Edema Serebri
Pascacedera Kepala ... 75 4.2 Gambaran histologis distribusi Sel-Sel
Imunokompeten Pascacedera Kepala ... 76 4.3 Gambaran histologis diameter pembuluh darah
jaringan otak Pascacedera kepala ... 76 4.4 Gambar histogram diameter pembuluh darah Jaringan
4.5 Gambaran imunohistokimia Sel Mikroglia jaringan otak
Pascacedera Kepala ... 78 4.6 Gambar histogram jumlah Sel Mikroglia jaringan otak .... 78 4.7 Gambaran imunohistokimia ekspresi AQP-4 Sawar
Darah jaringan otak pascacedera kepala ... 79 4.8 Gambar histogram ekspresi AQP-4 Sawar Darah Otak .. 80 4.9 Gambaran imunohistokimia ekspresi VEGF Sawar
Darah Otak Pascacedera kepala ... 81 4.10 Gambar histogram ekspresi VEGF Sawar Darah Otak ... 81 4.11 Gambar korelasi VEGF terhadap AQP-4 Sawar Darah
jaringan Otak... 82 4.12 Gambar histogram rerata kadar MDA (µmol/L)
jaringan otak ... 83 4.13 Gambaran imunohistokimia ekspresi MDA Sel
Mikroglia jaringan otak Pascacedera Kepala ... 84
4.14 Gambar histogram rerata ekspresi MDA pada Sel
Mikroglia jaringan otak ... 85 4.15 Gambaran imunohistokimia ekspresi MPO Sel
Mikroglia jaringan otak Pascacedera Kepala ... 86 4.16 Gambar histogram rerata ekspresi MPO Sel Mikroglia
DAFTAR SINGKATAN AQP-4 : Aquaporin-4
AQP : Aquaporin
ADO : Aliran Darah Otak ADP : Adenesin Diphosfat ATP : Adenosin Triphosfat
ACTH : Adrenocoticotropin Hormone AGE : Advance Glicostatin End-product ALE : Advance Lipoxidation End-product AP -1 : Apoptocyc – 1
APACHE : Acute Physiology and Chronic Health Evaluation BBB : Blood Brain Barier
B1 : Bradikinin – 1 B2 : Bradikinin – 2
CGRP : Calcitonin Gene-Related Peptide CAM : Cell Adhesion Molecules
CK : Cedera Kepala
CSF : Cerebrospinal Fluid
GCS : Glasgow Coma Scale
DNA : Deoxyribo Nucleic Acid
DNA M1G : Deoxyribo Nucleic Acid Malondialdehide 1 Group GPx : Glutathion peroksidase
HE : Haematoxylin Eosin
HNE : Hydroxynorenal
HPA : Hipotalamus Pituitari Adrenal HIOMT : Hidroksindole-O-Metil Transferase IL-1 : Interleukin-1
IL-6 : Interleukin-6 IL-8 : Interleukin-8 LDL : Low Density Lipid LPS : Lipopolisakarida
MPO : Myeloperoxidase
MMP : Matrix Metalloproteinase
MDA : Malondialdehyde
MCA : Middle Cerebral Artery
NADPH : Nicotinamide Adenine dinucleotida phosphate NCF : Neutrofil Chemotactic Factor
NO : Nitric Oxide
NAS : N-Asetilserotonin
NF kB : Nuclear Factor kappa Beta OAP : Orthogonal Array Particle PARP : Poli ADP Ribose Polimerase PFA : Protein Fase Akut
ROS : Reactive Oxygen Species SAM : S-adenosil-metionin SDO : Sawar Darah Otak SDR : Sawar Darah Retina
SH : Sulfhydryl
SLE : Sistema Lupus Erytematous SOD : Superoksid Dismutase SSP : Susunan Saraf Pusat
SNAT : Serotonin N-Acetil-Tranferase SAM : S-Asetilserotonin-Metionin
TBAR : Thribarbituric Acid Reactive Substance TIK : Tekanan Intra Kranial
TGF : Tumor Growth Factor TPS : Tekanan Perfusi Serebral TNF α : Tumor Necrosis Factor α TRPH : Triptofan Hidroksilase
DAFTAR LAMPIRAN
No. Lampiran
1. Rekapitulasi hasil pemeriksaan histopatologis dan Immunohistokimia
2. Surat persetujuan komite etik tentang pelaksanaan penelitian bidang kesehatan Fakultas Kedokteran USU
3. Surat izin melakukan penelitian 4. Surat persetujuan penelitian
Peran Melatonin pada ekspresi
Malondialdehyde (MDA)
dan
Myeloperoksidase (MPO)
Sel Mikroglia serta
Aquaporin-4
(AQP4)
dan
Vascular Endothelial Growth Factor (VEGF)
Sawar Darah Otak Tikus pascacedera Kepala
ABSTRAK
Latar Belakang: Cedera kepala merupakan salah satu kondisi yang sangat membahayakan kehidupan manusia. Penelitian ini mengkaji penggunaan Melatonin dalam mereduksi oksidan dan hambatan pembentukan edema serebri pada model cedera kepala. Tujuan dari penelitian ini adalah untuk membuktikan apakah terdapat peran perbaikan Melatonin terhadap berbagai parameter terkait ekspresi MDA, MPO, VEGF dan AQP-4, serta gambaran histologis pada tikus model cedera kepala.
Metode Penelitian: Penelitian ini merupakan penelitian true experimental
dengan randomisasi, kontrol-perlakuan, dan replikasi. Adapun rancangannya adalah post test only control group design yaitu menggunakan hewan coba Rattus novergicus strain Sprague Dawley dengan kriteria jenis kelamin jantan, umur 10-12 minggu, dan berat badan 200-300 gram. Penelitian ini menggunakan model cedera kepala menurut Marmarou (1994). Semua parameter terkait diamati secara hitologis menggunakan pemulasan rutin HE dan pemulasan imunohistokimia, menggunakan antibodi spesifik terhadap protein masing-masing, MDA, MPO, VEGF dan AQP-4. Pemeriksaan dan perhitungan secara imunohistokimia.
Hasil Penelitian: Pada penelitian ini didapatkan hasil pengamatan histologis yang meliputi jumlah sel-sel imunokompeten serta diameter pembuluh darah arteri. Dari hasil histologis didapatkan hasil bahwa terdapat penurunan yang signifikan diameter pembuluh darah arteri jaringan cedera otak dengan paparan Melatonin. Pada pemulasan imunohistokimia, didapatkan hasil bahwa terdapat penurunan yang signifikan jumlah ekspresi MDA dan MPO sel-sel mikroglia jaringan otak cedera dengan paparan Melatonin. Demikian juga pada ekspresi VEGF dan AQP-4 SDO jaringan otak cedera menunjukkan penurunan yang signifikan setelah mendapatkan Melatonin. Antara ekspresi VEGF dengan AQP-4 terdapat korelasi positip.
Simpulan: Melatonin dapat menurunkan produksi MDA dan MPO. VEGF terlibat dalam regulasi AQP4 pada kejadian cedera kepala. Penurunan VEGF dapat dikaitkan dengan hambatan Melatonin terhadap kemampuannya untuk mengganggu aktivitas transkripsi VEGF. Secara signifikan dapat dinyatakan penurunan ekspresi VEGF berkorelasi positif terhadap penurunan ekspresi AQP-4.
Role of Melatonin in The Expression of MDA, MPO on Microglia Cells and AQP4 and VEGF in Blood Brain Barrier of Rat after Head Injury
Abstract
Background: The brain injury is one of the conditions that are very harmful to human life. This study will examine the use of Melatonin in reducing oxidant status and barriers to the formation of cerebral edema in a model of brain injury. The purpose of this study is to prove the role of Melatonin on the expression of MDA, MPO, VEGF and AQP-4 and histological injury in a rat model of the head injury.
Methods: This study was a true experimental study with randomization. This study uses a post-test only control group design, using experimental animals Sprague Dawley strain Rattus novergicus, male, aged 10 -12 weeks, and weight of 300 grams. Model of brain injury according to Marmarou (1994). All parameters were observed histologically using hematoxilen-eosin staining and immunohistochemistry, using antibodies specific to each protein, MDA, MPO, VEGF and AQP-4. Observation and calculation of the results of immunohistochemical studies.
Results: In this study, histological observation number of immunocompetent cells and the diameter of the arteries. From the histological results showed that there is a significant reduction in the diameter of the arterial blood vessels of the brain injury tissue. In the immunohistochemical results, showed that there is a significant reduction of MDA and MPO expression amount of cells microglia brain injury tissue . Similarly, the expression of VEGF and AQP-4 BBB of rat brain injury tissue showed a significant reduction inhibitor after getting Melatonin. And by analyzing the relationship between the expression of VEGF by AQP-4 appears there is a positive correlation.
Conclusion: Melatonin is a potent scavanger hydrogen peroxide, which is a co-substrate of MPO, thereby reducing the production of MPO. VEGF is involved in the regulation of AQP4 in the incidence of head trauma. Reported that VEGF is co-localization with AQP4 at the Blood Brain Barier disruption. Decreased expression of VEGF by Melatonin, often associated with its ability to interfere with VEGF transcriptional. Significantly decreased expression of VEGF can be expressed positively correlated to decreased expression of AQP-4.
BAB I PENDAHULUAN
1.1 Latar Belakang
Cedera kepala merupakan salah satu kondisi yang sangat membahayakan bagi kehidupan manusia. Setiap tahun di Amerika Serikat hampir 1.500.000 kasus cedera kepala. Dari jumlah tersebut 80.000 di antaranya mengalami kecacatan dan 50.000 orang meninggal dunia. Saat ini di Amerika Serikat terdapat sekitar 5.300.000 orang dengan kecacatan akibat cedera kepala (Centres for Disease Control, 2002). Indonesia belum memiliki laporan yang pasti tentang angka kejadian cedera kepala. Namun, di Rumah Sakit Cipto Mangunkusumo (RSCM) Jakarta, pada tahun 2005 dilaporkan bahwa angka kejadian cedera kepala mencapai 750 kasus dengan mortalitas sebanyak 23 kasus dan di Rumah Sakit Dr. Soetomo dilaporkan bahwa angka kejadian cedera kepala mencapai 1.578 pada tahun 2009 dan 1.402 pada tahun 2011 data Bagian Bedah Saraf FK Unair/Dr. Soetomo. Untuk mengatasi hal tersebut telah dilakukan berbagai upaya antara lain pemberian manitol, hiperventilasi dan cairan hipertonis. Upaya tersebut belum memberikan hasil yang optimal.
kepala sekunder tersebut ditandai dengan edema serebri. Apabila edema serebri pada cedera kepala tidak ditangani dengan baik, akan mengakibatkan terjadinya peningkatan tekanan intrakranial (TIK) dan kemudian mengakibatkan iskemia pada sel otak sehingga memicu terjadinya kematian.
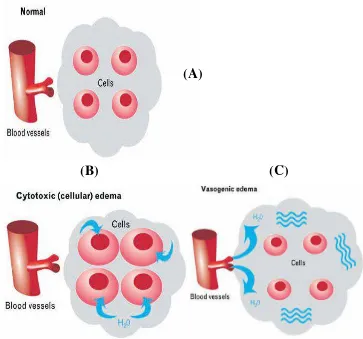
Edema serebri merupakan bertambahnya volume otak karena adanya peningkatan kadar air dan natrium. Edema serebri memiliki dua tipe, yaitu edema intraselular dan ekstraselular. Terjadinya edema intraselular karena faktor iskemia mengakibatkan pembengkaan sel (cell swelling), sedangkan edema ekstraselular mengakibatkan peningkatan cairan interstitial (Kaal Evert, Charles, 2004).
Cedera kepala akan memicu kerusakan sel. Bila makrofag (monosit pada jaringan) memfagositosis sel debris, akan merespon sebagai sinyal inflamasi (Murray, 2011). Pada respon inflamasi, monosit yang terinduksi lipopolisakarida (LPS) akan mengekspresikan interleukin (IL)-1, IL-6, IL-8 dan tumor necrosis factor (TNF)-α (Agarwal, 1995). Tumor necrosis
factor-α menginduksi reactive oxygen species (ROS) pada endotel sehingga
endotel mensekresikan e-selektin. E-selektin merupakan molekul adhesi dari neutrofil (Rahman, 1998) dan IL-8 merupakan neutrofil protraktan atau
endotel untuk mensekresikan vascular cell adhesion molecule (VCAM) yang merupakan molekul adhesi terhadap monosit (Kuby, 2000).
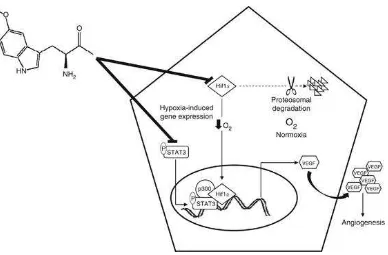
Myeloperoxidase (MPO) merupakan enzim yang disekresi oleh neutrophil dan makrofag atau mikroglia aktif. Enzim ini memicu pembentukan ROS yang selanjutnya akan terjadi iskemia. Iskemia inilah yang kemudian mengakibatkan gangguan pompa natrium pada astrosit sehingga membengkak (swelling) dan terjadi edema serebri (Breckwoldt et al., 2008). Interleukin-1 menginduksi endotel pada vaskuler otak dan mengakibatkan endotel melepaskan vascular endothel growth factor
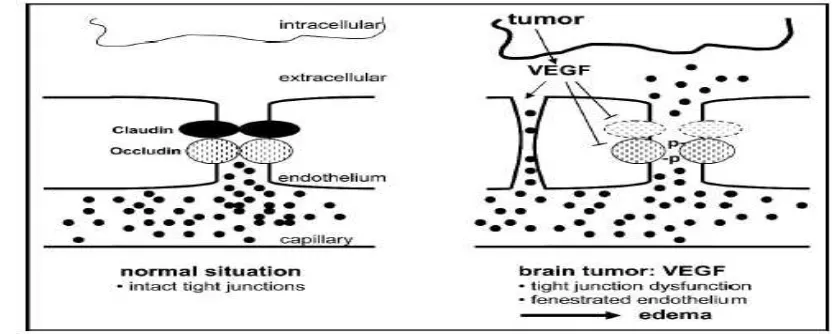
(VEGF) (Mei Bin, Susan, Victor, 2007). Selain bersifat otokrin dalam proses angiogenesis (Villegas, Baerbel, Alda Tufro, 2005), VEGF juga menginduksi astrosit untuk melepaskan aquaporin (AQP)-4. Selanjutnya, AQP4 ini menginduksi dinding vaskuler untuk memfasilitasi air keluar ke jaringan interstitial otak sehingga terjadi edema serebri (Rite, 2008). Untuk mengatasi cedera kepala telah diupayakan berbagai cara antara lain metode terapi osmolaritas, pemberian diuretik (Puri, Patna, Bihar, 2003), dan kortikosteroid (Puri, Patna, Bihar, 2003; Kaal Evert, Charles, 2004). Namun, terapi tersebut belum memberikan hasil yang optimal, sehingga untuk mengatasi edema serebri dikembangkan pemberian Melatonin.
Melatonin dapat berperan sebagai antioksidan (Reiter et al., 1997; Reiter, 1998; Reiter et al., 2003), modulator biologis untuk mood, tidur, perilaku seksual, sistem reproduksi, ritme sirkadian (Beyer, Steketee,
Singh,Guchait, 2001; Maestroni, 2001). Selain itu, Melatonin juga dapat berperan sebagai antikonvulsan (Turgut et al., 2003; Yahyavi-Firouz-Abadi, 2006; Yildirimdan Marangouz, 2006). Beberapa studi mendapatkan bahwa Melatonin bersifat neuroprotektif di SSP, seperti pada keadaan cedera kepala (Beni, Kohen, Reiter, Tan, Shohami, 2004), cedera kepala iskemia (Gupta, Kohil, 2003; Pei, Cheung, 2004), alzheimer (Feng, Chang,Cheng, 2004), amyotrophic lateral sclerosis (Weishaupt et al.,
2006), parkinson (Mayo et al., 2005; Sharma, Mcmillan, Tenn, Niles, 2006), gangguan neuropsikiatri (Srinivasan et al., 2006). Melatonin juga dapat mengurangi kebocoran vaskular pada otak dan retina ketika terjadi kerusakan SDO dan sawar darah retina (SDR) (Kaur, Sivakumar, Foulds, 2006; Kaur, Sivakumar, Yong,2007).
Sifat antioksidan Melatonin adalah karena kemampuannya dalam membersihkan radikal bebas dan menginduksi ekspresi enzim antioksidan (Burkhardt et al., 2001). Aktivitas dan ekspresi enzim antioksidan, seperti superoksid dismutase, katalase, glutation peroksidase, dan glutation reduktase meningkat karena Melatonin (Pablos Agapito, Guiterrez, 1995; Ozturk, Cokun, Erba, Hasanoglu, 2000; Meki Hussein, 2011; Reiter et al.,
2004; Subramania, Mirunalini, Pandi, 2007).
dapat menurunkan kerusakan oksidatif selama iskemia dan reperfusi (Tan
et al., 1999). Suplementasi Melatonin efektif menurunkan stres oksidatif pada cedera kepala karena dapat menurunkan kadar malondialdehid (MDA) plasma (Tutunculer et al., 2005), yang merupakan penanda peroksidasi lipid. Selain itu, Melatonin juga membantu perbaikan fungsi mitokondria pada iskemia dan reperfusi. Gangguan fungsi mitokondria ini menyebabkan produksi ROS berlebih (Bai, Cederbaum, 2001). Perbaikan fungsi mitokondria oleh Melatonin akan menekan stres oksidatif mitokondria (Alonso,Collado, Gonzales, 2006). Namun, sampai saat ini mekanisme kerja Melatonin pada hambatan edema serebri belum jelas.
Oleh karena penelitian tentang penurunan MDA dan MPO dari sel mikroglia, AQP-4 dan VEGF SDO tidak mungkin dilakukan pada manusia, penelitian dilakukan pada hewan coba yang mengalami cedera otak. Berdasarkan latar belakang pemikiran tersebut, dirumuskan permasalahan sebagai berikut:
1.2 Rumusan Masalah
1. Apakah peran Melatonin pada ekspresi MDA sel mikroglia hewan coba yang mengalami cedera kepala?
2. Apakah peran Melatonin pada ekspresi MPO sel mikroglia hewan coba yang mengalami cedera kepala?
4. Apakah peran Melatonin pada ekspresi AQP-4 SDO pada hewan coba yang mengalami cedera kepala?
5. Bagaimana korelasi antara VEGF dengan AQP-4 pada SDO hewan coba yang diberi Melatonin?
1.3 Tujuan Umum
Mengetahui peran Melatonin pada ekspresi MDA dan MPO sel mikroglia, serta VEGF dan AQP4 dari SDO setelah cedera kepala pada hewan coba.
1.4 Tujuan Khusus
1. Diketahuinya peran Melatonin dalam ekpresi MDA pada sel mikroglia hewan coba yang mengalami cedera kepala.
2. Diketahuinya peran Melatonin dalam ekspresi MPO pada sel mikroglia hewan coba yang mengalami cedera kepala.
3. Diketahuinya peran Melatonin dalam produksi VEGF pada SDO hewan coba yang mengalami cedera kepala.
4. Diketahuinya peran Melatonin dalam ekspresi AQP4 pada SDO hewan coba yang mengalami cedera kepala.
1.5 Manfaat Penelitian 1.5.1 Manfaat Akademis
1. Memberikan sumbangan bagi pengembangan ilmu pengetahuan bedah saraf dari sudut ilmu dasar dan klinis. 2. Memberikan informasi tambahan tentang peran Melatonin
dalam menurunkan edema serebri.
1.5.2 Manfaat Klinis
1. Dapat digunakan sebagai alternatif penatalaksanaan edema serebri.
2. Dapat menghambat berlanjutnya edema serebri dan kerusakan jaringan otak.
1.5.3 Manfaat Masyarakat Luas
Membantu mempercepat proses pemulihan pascacedera kepala, sehingga dapat mengurangi biaya perawatan pasien cedera kepala.
BAB II
TINJAUAN PUSTAKA
2.1 Cedera Kepala
Cedera kepala adalah jejas atau perlukaan jaringan otak bukan karena proses degeneratif atau bawaan lahir, melainkan akibat dorongan dari luar yang dapat mengakibatkan penurunan ataupun perubahan status kesadaran (National Head Injury Foundation, 1985). Berdasarkan patofisiologi ini, cedera kepala dapat diklasifikasikan menjadi
1. Komosio serebri
Komosio serebri adalah kehilangan fungsi otak sesaat tanpa adanya kerusakan jaringan otak, seperti pingsan kurang dari 10 menit atau amnesia pascacedera kepala.
2. Kontusio serebri
Kontusio serebri adalah kerusakan jaringan otak dengan defisit neurologik yang timbul setara dengan kerusakan otak tersebut, seperti pingsan lebih atau sama dengan 10 menit atau ada lesi neurologis yang jelas.
3. Laserasi otak
Laserasi otak adalah kerusakan jaringan otak yang luas disertai dengan robekan jaringan otak dan umumnya disertai fraktur terbuka kranium.
tidak langsung melalui mekanisme sekunder (Maas et al., 2000). Mekanisme ini secara konseptual terbagi menjadi dua, yaitu secondary brain insult dan secondary brain damage. Secondary brain insult timbul akibat dari perburukan sistemik dan intrakranial yang memperberat kerusakan neuron setelah cedera kepala primer. Gejala yang timbul pada keadaan ini adalah systemic secondary insult dan intrakranial secondary insult (Teasdale, 1998; Maas et al., 2000). Secondary brain damage
adalah cedera kepala sekunder yang terjadi setelah aktivasi langsung proses imunologi dan biokimia yang merusak dan menyebar secara ritmik. Mediator biokima dan inflamasi pada cedera ini terdiri atas asidosis laktat, kalsium, asam amino eksitatorik, asam arakhidonat, nitric oxide (NO), radikal bebas, peroksidasi lipid, aktivasi kaskade komplemen, sitokin, bradikinin, makrofag, dan pembentukan edema serebri (Hsu et al., 1995; Kossman, 2002; Lezlinger et al., 2001; McIntosh et al., 1999; Maas et al.,
2000; Teasdale, 1998).
2.1.1 Edema serebri
Cedera kepala dapat memicu terjadinya berbagai mekanisme sehingga menyebabkan perlukaan sekunder yaitu edema serebri (Cooper, 1985). Edema serebri adalah peningkatan akumulasi cairan otak intraselular dan atau ekstraselular (Klatzo, 1967). Keadaan ini ditandai dengan pembengkakan jaringan otak sesuai dengan peningkatan progresif kadar cairan otak yang dapat terjadi karena iskemia (Ribeiro et al., 2006), trauma (Zador et al., 2007), tumor (Saadoun et al., 2002), dan inflamasi (Papadopoulos dan Verkman, 2005). Terbatasnya rongga kranium dan pembengkakan progresif jaringan otak mengakibatkan peningkatan tekanan intrakranial (TIK), penurunan aliran darah ke otak, herniasi serebri, dan bahkan kematian. Berdasarkan mekanismenya, Klatzo membagi edema serebri menjadi dua kategori, yaitu edema sitotoksik atau intraselular dan edema vasogenik atau ekstraselular. Keduanya dapat diketahui dengan rinci melalui studi mikroskopik dan ultrastruktural. Pengukuran kadar cairan jaringan melalui pencitraan
Magnetic Resonance Imaging (MRI) dapat membedakan edema sitotoksik dan edema vasogenik (Klatzo, 1967).
Edema sitotoksik adalah akumulasi cairan di kompartemen intraselular (Klatzo, 1967) neuron, mikroglia, dan astrosit (Unterberg et al.,
2004). Edema sitotoksik berhubungan dengan kegagalan pompa Na/K
Gambar 2.1 Ilustrasi keadaan Sel Normal (A); Edema Sitotoksik (B), Edema Vasogenik (C) (Donkin dan Vink, 2010)
Edema vasogenik adalah peningkatan cairan esktrasel yang terjadi karena kebocoran SDO. Akibatnya terjadi peningkatan tekanan osmotik dan cairan ke luar dari pembuluh darah dan kemudian masuk ke dalam kompartemen ekstraselular. Cairan intravaskular ini keluar melalui endotel dengan mekanisme pinositosis dan atau tight junction yang bocor. Edema vasogenik sering disebut juga edema osmotik. Kebocoran SDO dapat terjadi karena beberapa keadaan seperti cedera kepala, tumor, infeksi, perdarahan intraserebri, dan inflamasi. Oleh karena itu, edema vasogenik
(C)
(B)
sangat berhubungan dengan peningkatan kadar cairan otak, pembengkakan jaringan otak, dan peningkatan TIK.
Pada keadaan tertentu dapat terjadi edema serebri yang didasari oleh kedua mekanisme di atas, misalnya edema transependimal. Edema transependimal adalah peningkatan cairan interstitial periventrikular karena kerusakan lapisan ependimal dinding ventrikular. Hal ini biasanya terjadi pada hidrosefalus. Edema hidrostatik adalah bagian dari edema vasogenik yang terjadi ketika tekanan perfusi serebral meningkat. Keadaan ini biasanya terjadi pada ensefalopati hipertensi. Pada dasarnya, baik edema sitotoksik maupun edema vasogenik terjadi ketika osmolalitas plasma menurun sehingga terjadi pengeluaran cairan. Meskipun demikian, keduanya dipisahkan menjadi dua klasifikasi yang berbeda. Beberapa keadaan klinik berkembang menjadi edema serebri berdasarkan kombinasi mekanisme edema yang berbeda. Ini bergantung pada gangguan yang timbul akibat penyakit dan waktu perjalanan penyakit (Nag
et al., 2009).
meningkatkan TIK, menurunkan TPS, serta memicu berlanjutnya iskemia (Rosner dan Rosner, 1995). Beberapa studi eksperimental menyatakan bahwa beberapa neurotransmitter, seperti glutamat, asetilkolin, dan senyawa vasoaktif, seperti serotonin, histamin, prostaglandin, asam amino, asam laktat, dan lain-lain berperan dalam mediasi, inisiasi, dan propagasi edema otak. Platelet adalah sumber utama senyawa-senyawa di atas yang akan memproduksi neurotransmitter ketika melekat di pembuluh darah kapiler (Baethmann et al., 1980; Baethmann et al., 1991; Hayes et al., 1991). Prostaglandin berperan pada terjadinya edema serebri melalui mekanisme (1) peningkatan permeabilitas kapiler serebral, (2) vasokonstriksi yang menyebabkan iskemia (Yamamoto et al., 1972), dan (3) potensiasi dari senyawa lain seperti serotonin dan katekolamin.
[image:51.595.120.463.471.682.2]
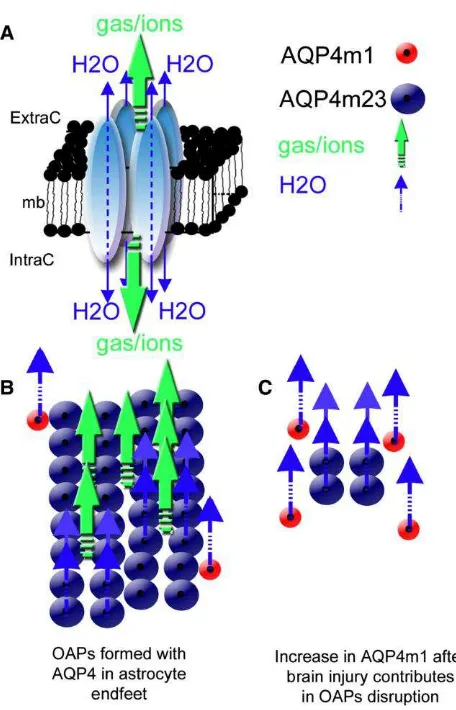
Proses terjadinya edema serebri diantarai oleh beberapa mediator di antaranya adalah aquaporin (AQP) dan sitokin. Aquaporin adalah kunci utama terjadinya edema serebri (Manley et al., 2000; Papadopoulos dan Verkman, 2008; Taya et al., 2008). Beberapa studi mendapatkan peningkatan kadar AQP pascacedera kepala dan peranannya pada kejadian edema serebri (Manley et al., 2000) sehingga penggunaan agen penghambat AQP diduga berperan dalam pengendalian edema serebri (Taya et al., 2008). Namun, beberapa studi lain mendapatkan bahwa perubahan kadar AQP ini berhubungan dengan jenis edema (Ghabriel et al., 2006; Papadopoulos et al., 2004, Sun et al., 2003). Penelitian pada hewan coba dengan iskemia serebral mendapatkan, bahwa hambatan ekspresi AQP berhubungan dengan penurunan tingkat edema dan luas area infark, serta peningkatan status fungsional. Keadaan ini terjadi pada edema sitotoksik. Hasil yang berbeda didapatkan pada edema vasogenik, yang luasnya edema meningkat saat dihambatnya AQP. Hasil ini menunjukkan bahwa AQP bermanfaat dalam menekan terjadinya edema vasogenik (Papadopoulos et al., 2004). Studi eksperimental mendapatkan adanya peningkatan kadar AQP4 pada sel glia dan penurunan kadar AQP4 perivaskular terhadap terjadinya edema vasogenik (Ghabriel et al.,
yang berperan pada sintesis protein (Taya et al., 2009). Peningkatan kadar cairan jaringan otak ditunjukkan oleh komponen vaskular sebagai tempat pergeseran kompartemen sitotoksik. Hambatan AQP channel
berperan pada keadaan edema sitotoksik, tetapi tidak pada edema vasogenik, karena AQP channel melekat pada dinding sel.
Selain AQP, terdapat matriks metalloproteinase (MMP) yang berperan saat terjadinya edema serebri. Matriks metalloproteinase adalah enzim endopeptidase zinc-dependent yang berperan dalam perbaikan jaringan pada berbagai keadaan patologis. Regulasi MMP sangat kompleks dan terkontrol. Hilangnya kontrol regulasi sangat berperan dalam patofisiologi kerusakan sinaps dan SDO pada cedera kepala,
stroke, dan neurodegenerasi (Rosenberg dan Yang, 2007; Candelario-Jalil
et al., 2009; Ding et al., 2009; Rosenberg, 2009). Peran MMP dalam edema serebri adalah kemampuannya dalam memecah berbagai jenis protein matriks ekstraselular termasuk protein lamina basal neurovaskular dan protein tight junction SDO (Grossetete et al., 2009; Hayashi et al.,
2009; Vajtr et al., 2009). Kadar MMP terutama MMP2, MMP3, dan MMP9 meningkat pada keadaan cedera kepala (Falo et al., 2006; Vilalta et al.,
efek protektif pada cedera kepala dengan iskemia fokal dan global (Wang
et al., 2000; Asahi et al., 2001; Gidday et al., 2005). Defisiensi gen MMP9 ini menurunkan kebocoran SDO dan pembentukan edema, menurunkan respons inflamasi, serta meningkatkan integritas membran sel dan status fungsional (Fujimoto et al., 2008; Vajtr et al., 2009, Homsi et al., 2009; Tejima et al., 2009).
Plesnila, 2009; Su et al., 2009). Anggota lain dari keluarga kinin adalah takikinin, yaitu sebuah mediator peptida yang berperan pada inflamasi neurogenik.
Inflamasi neurogenik adalah proses yang terdiri atas vasodilasi, ekstravasasi plasma, dan hipersensitivitas neuronal yang disebabkan oleh penglepasan neuropeptida dari neuron sensorik (Geppetti et al., 1995). Neuropeptida yang telah teridentifikasi berperan pada inflamasi neurogenik adalah calcitonin gene-related peptide (CGRP), CGRP ini berperan pada vasodilasi yang senyawa P-nya meningkatkan ekstravasasi protein plasma (Nimmo et al., 2004).
Ada keterkaitan langsung antara aliran darah otak (ADO) dan metabolisme tubuh. Penurunan ADO berhubungan dengan hipoksia dan glikolisis anaerob. Hipoksia dapat menimbulkan gangguan SDO melalui berbagai mekanisme yang diperantarai oleh VEGF, NO, dan respon inflamasi. Hipoksia memicu peningkatan produksi Vascular endothelial growth factor (VEGF) yang berakibat pada peningkatan permeabilitas vaskular dan pembentukan edema. VEGF diketahui berikatan dengan reseptor VEGF di pembuluh darah area iskemik dan berperan pada gangguan dan kebocoran SDO (Zhang et al., 2000; Zhang et al., 2002).
iskemia-hipoksia meningkatkan produksi prostaglandin dan kinin. Kedua mediator ini selanjutnya menginisiasi respon inflamasi yang dapat berakibat pada gangguan SDO (Zach et al., 1997; Yang et al., 1999; Saleh et al., 2004). Kemokin dan sitokin yang diproduksi oleh sel glia dan endotel pada saat iskemia-hipoksia meningkatkan migrasi limfosit melalui SDO dan juga permeabilitas pembuluh darah (Zach et al., 1997; Gong et al., 1998; Weiss
et al., 1998; Prat et al., 2001). Selain itu, respon inflamasi dapat mengaktivasi caspase, translokase, dan endonuklease yang dapat menginisiasi perubahan membran dan nukleosom DNA secara progresif. Hipoksia juga menyebabkan penglepasan beberapa neurotransmitter, seperti glutamat dan aspartat. Neurotransmiter ini akan mengaktivasi reseptor ionotropik dan metabotropik. Akibat dari ini akan terjadi influks ion kalsium (Ca) dan ion natrium (Na), serta efluks ion kalium (K). Influks ion Ca menimbulkan proses katabolisme intraselular, aktivasi enzim lipid peroksidase, akumulasi asam lemak bebas, dan radikal bebas. Untuk glikolisis anaerob, keadaan ini menyebabkan deplesi adenosin trifosfat (ATP) dan terganggunya pompa ion energy dependent di otak. Glikolisis anaerob ini juga berhubungan dengan akumulasi asam laktat dan peningkatan permeabilitas membran yang berakibat pada edema serebri.
2.1.2 Sel Mikroglia
Mikroglia dapat dianggap sebagai sel imun dari sistem saraf pusat, yang berperan setara dengan sel fagosit mononuklear yang ada pada jaringan soma (Gonzales-Scarano dan Baltuch, 1999), yakni immun surveillance dan pertahanan tubuh terhadap invasi berbagai proses infeksi. Namun demikian, jika mikroglia teraktivasi sebagai respon terjadinya proses inflamasi, mikroglia aktif akan mengalami berbagai proses diferensiasi, proliferasi, dan menghasilkan berbagai faktor proinflamasi.
Mikroglia yang aktif akan mensekresi berbagai faktor proinflamasi dan neuroinflamasi yang bersifat neurotoksik. Faktor-faktor ini bila tidak dikendalikan maka akan menimbulkan kerusakan yang luas (Liu dan Hong, 2002). Proses aktivasi mikroglia diawali oleh inflamasi sel dan jaringan akibat adanya lesi dan/atau iskemia. Mikroglia aktif akan melepaskan glial derived neurotrophic factor, TNFα, IL-1 , IL-6, NO,
superoxide, eikosanoid, asam kuinolat, plasminogen, dan nuclear factor
(NF)κB (Shigemoto-Mogami et al., 2001; Suzuki et al., 2004). Nuclear
factor (NF)κB adalah suatu faktor transkripsi yang bila teraktivasi akan
Ada berbagai metode dalam mengendalikan aktivasi mikroglia seperti mekanisme cell adhesion molecules (CAM) oleh neuron (McMillian
et al., 1994), penggunaan reseptor antagonis opioid dan golongan steroid (Kong et al.,1997), mekanisme vasoactive intestinal peptide (VIP), dan aktivasi sitokin antiinflamasi, seperti TGF dan IL-10 melalui mekanisme
mikroglia-deactivating factor (Delgado dan Ganea, 2003).
2.1.3 Malondialdehyde
Malondialdehyde (MDA) adalah senyawa organik dengan rumus CH2(CHO)2. Struktur senyawa ini lebih kompleks dan sangat reaktif, terjadi secara alami, dan merupakan penanda stres oksidatif (Romieu et al.,
2008).
Malondialdehyde utama terdapat dalam bentuk enol dengan rumus kimianya :
CH2(CHO)2 Hoch = CH-CHO
Malondialdehyde merupakan senyawa golongan sebagai hasil produksi proses lipid peroksida, yang bersifat toksik pada sel.
Malondialdehyde dapat diukur degan metode Thibarbituric Acid Reactive Substance (TBARS). Nilai stres oksidatif berdasarkan reaksi asam
thibarbiturat pada suhu 1000C akan menghasilkan krofor berwarna merah muda yang dapat dibaca pada panjang gelombang 532 m (Halliwell and Gutterge, 1999).
hidrolis dari 1,1,3,3-tetramethoxypropane, yang tersedia secara komersial. Hal ini memudahkan hilangnya proton dalam memberikan garam sodium dari enolat (mp 2450C). Spesies oksigen reaktif menurunkan lipid
polyunsaturated, dan membentuk Malondialdehyde. Senyawa ini merupakan aldehida reaktif dan merupakan salah satu spesies yang memiliki banyak elektrofil reaktif. Akibatnya dapat menimbulkan stres toksid dalam sel, dan membentuk protein kovalen adduct yang disebut akhir lipoxidation sebagai lanjutan produk Advance Lipoxidation End-product (ALE), dan mengakhiri glikasi maju-produk Advance Glicostatin End-product (AGE). Produksi aldehida ini digunakan sebagai biomarker untuk mengukur tingkat stres oksidatif dalam organisme. Malondialdehyde
bereaksi dengan deoxyadenosine dan deoxyguanosine dalam DNA, serta membentuk DNA M1G yang mutagenik (Hall, 1995).
Malondialdehyde (MDA) adalah suatu senyawa yang berasal dari peroksidasi lipid dan biosintesis eicosanoid. Keduanya terdapat dalam matriks biologis dalam bentuk bebas dan terikat kepada SH atau kelompok NH2 dari berbagai biomolekul. Meskipun senyawa lain
besar dalam pengukuran, bahkan pada konsentrasi fisiologis MDA plasma manusia (Cighetti etal., 2002).
2.1.3.1 Malondialdehyde (MDA) sebagai produk hasil Stres Oksidatif Radikal bebas dihasilkan selama proses fisiologis normal. Namun pelepasannya meningkat pada keadaan iskemia, reperfusi, reaksi inflamasi, dan penyakit neuro-degeneratif. Sumber-sumber endogen pembentukan radikal bebas meliputi sistem NADPH oksidase, reaksi fosforilasi oksidatif, enzim oksidasi dan metabolisme arakhidonat, sedangkan sumber oksigennya adalah radiasiionisasi, merokok, alkohol, paparan polutan, sinar ultraviolet, dan radiasiterionisasi (Droge, 2002).
teraktivasinya NADPH oksidase dan superoksid diproduksi akibat aktivasi oleh 12-LO (lipooksigenase) dalam vasculer smooth muscle cell (VSMCs). Pada hiperkolesterolemia produksi ROS dan LDL teroksidasi (Ox-LDL) berhubungan dengan NaDPH oksidase pada subunit p22 phox. ROS yang diproduksi akibat aktivasi NaDPH oksiadse meningkat secara bermakna dan secara progresif mencapai kadar puncak saat terjadi dekompensasi kordis (Ardhibatla et al., 2003).
Penelitian yang dilakukan oleh Walter et al., didapatkan adanya peningkatan kadar MDA dengan metode TBARS pada perokok, hipertensi, hiperlipidemia dan diabetes melilitus. (Walter et al., 2004).
Kadar MDA juga meningkat pada penyakit asma, rheumatoid arthritis dan preeklamsia. (Ladecola and Zhang, 1995).
Endogenous sources Environmental sources Mitochondrial leak Free radical production cigarette smoke
Respiratory burst pollutants
Enzyme reactions UV light
Autooxidation reactions O2- , H2O2 ionising radiation
xenobiotics
Transition
Metals
Fe2+, Cu+
OH
Lipid peroxidation Modified DNA bases Protein damage
[image:61.595.114.501.446.683.2]Tissue damage
Stres oksidatif merupakan keadaan yang tidak seimbang antara prooksidan dan antioksidan. Produksi radikal bebas dapat melebihi kemampuan penghambat radikal alamiah atau mekanisme scavenging
(pembersih). Mekanisme penghambat radikal bebas terdiri atas oksidan endogen dan eksogen. Antioksidan endogen terdiri dari superoksid dismutase (SOD), Glutathion peroksidase (GPx) dan katalase. Anti oksidan eksogen terdiri atas vitamin E, betakaroten dan vitamin C. (Cherubini et al., 1995).
Stres oksidatif pada susunan saraf pusat sangat mematikan sebab otak manusia utamanya memakai metabolisme oksidatif. Meskipun berat otak hanya 2 % dari berat tubuh, otak menggunakan sekitar 50% dari seluruh oksigen tubuh. Faktor lain yang sangat berbahaya adalah stres oksidatif pada otak dengan kandungan polyunsaturated fatty acid (PUFA) yang tinggi, yaitu hampir 50 % dari struktur jaringan otak. Jaringan otak mengandung asam askorabat 100 kali lipat dibandingkan dengan pembuluh darah perifer, yang juga dapat meningkatkan risiko terjadinya stres oksidatif. Radikal bebas merusak sel dan bereaksi dengan makro molekuler sel melalui proses peroksidasi lipid, oksidasi DNA, dan protein (Gusev and Skvortsova, 2003).
bertambah. Produk-produk peroksidasi lipid MDA, HNE, dan acrolein juga dapat bereaksi dengan protein dan mengakibatkan perubahan fungsi protein (Weigan et al., 1999).
Kerusakan pada DNA baik disebabkan radikal maupun perosinitrit mengakibatkan terbentuknya single stand break DNA dan struktur ini akan mengaktivasi poli-ADP ribose polymerase (PARP). Aktivasi PARP mengakibatkan berkurangnya adenin nukleotida yang akan menghambat fungsi mitokondria sehingga terjadi penurunan ATP sel dan kematian sel. PARP juga dapat menaktivasi apoptoticinducing factor (AIF) di mitokondria. Mekanisme ini juga didukung dengan berkurangnya infark otak tikus didapat dengan PARP inhibitor (Lipton, 1999).
Oksidasi protein oleh radikal bebas membentuk kelompok karbonil atau disfid, dan juga sebagai reduktan, yang menyebabkan formasi S-H dari ikatan S-s. Kerusakan pada protein, terutama bentuk enzim, akan mengganggu fungsinya (Cherubini et al., 1999).
2.1.4 Reactive Oxygen Species dan Respon Inflamasi
mitokondria, dan retikulum endoplasma; hidrogen peroksida (H2O2) yang diproduksi peroksisom; radikal hidroksil reaktif (OH); oksigen singlet (1O2). Ketidakseimbangan oksidatif seperti gangguan keseimbangan produksi ROS atau radikal bebas atau prooksidan dengan antioksidan dikenal sebagai stres oksidatif. Keadaan ini dapat menyebabkan berbagai kerusakan sel yang pada akhirnya berakibat pada hilangnya fungsi dan integritas sel (Halliwell dan Gutteridge, 1999). Molekul ROS secara fisiologis berperan sebagai second messenger dalam regulasi proses apoptosis (Curtin et al., 2002) dalam mengaktivasi faktor transkripsi, seperti NFκB dan pγ8-MAPkinase yang berperan pada aktivasi gen
respon imun (Owuor dan Kong, 2002) dan gen yang mengkoding enzim-enzim antioksidan (Holgrem, 2003). Peran stres oksidatif sangat krusial pada modulasi fungsi selular, terutama pada apoptosis dan excitotoxicity
astrosit dan mikroglia. Apoptosis dan produksi ROS berlebih pada akhirnya akan menimbulkan disfungsi mitokondria (Yun et al., 1996). Stres oksidatif erat kaitannya dengan respon inflamasi. Sehingga secara teori respon inflamasi akan meningkatkan produksi ROS.
pituitari atau hipofisis. Stimulasi kelenjar pituitari meningkatkan sekresi
adrenocoticotropin hormone (ACTH) dan stimulasi kelenjar adrenal. Kelenjar adrenal yang terstimulasi akan mengeluarkan katekolamin dan menstimulasi sel makrofag dan limfosit. Stimulasi makrofag dan limfosit selanjutnya menyebabkan pengeluaran sitokin, yaitu mediator biokimia yang berperan besar pada respon inflamasi seperti edema serebri (Visser dan Labadarios, 2002).
adalah serangkaian proses fisiologis sistemik yang terjadi segera setelah terjadinya infeksi, trauma, dan beberapa jenis keganasan sehingga terjadi berbagai perubahan patologis dan metabolik seperti demam, peningkatan permeabilitas vaskular, dan yang paling mencolok adalah peningkatan protein fase akut (PFA).
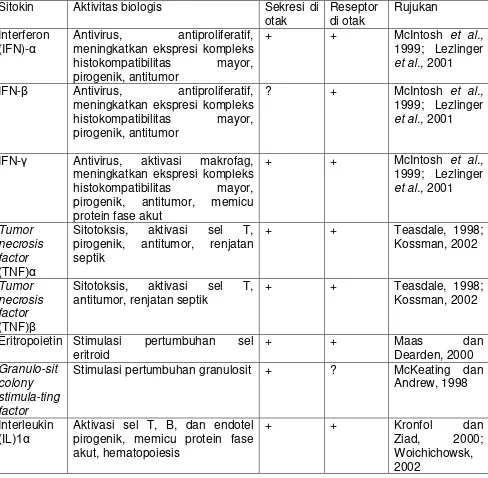
Tabel 2.1. Jenis Sitokin berdasarkan aktivitas Biologis Sitokin Aktivitas biologis Sekresi di