KARAKTERISASI SIMPLISIA DAN SKRINING
FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN
EKSTRAK ETANOL BUAH KESEMEK
(Diospyros kaki Thunb.)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SILVANA COSTANTIA SIMORANGKIR
NIM 071501078
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING
FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN
EKSTRAK ETANOL BUAH KESEMEK
(Diospyros kaki Thunb.)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SILVANA COSTANTIA SIMORANGKIR
NIM 071501078
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN SKRINING
FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN
EKSTRAK ETANOL BUAH KESEMEK
(Diospyros kaki Thunb.)
OLEH:
SILVANA COSTANTIA SIMORANGKIR
NIM 071501078
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal 21 Agustus 2013
Pembimbing I, Panitia Penguji:
Prof. Dr. Rosidah, M.Si., Apt. Prof. Dr. Urip Harahap, Apt. NIP 195103261978022001 NIP 195301011983031004
Pembimbing II, Prof. Dr. Rosidah, M.Si., Apt. NIP 195103261978022001
Dra. Aswita Hafni Lubis, M.Si., Apt. Dra. Herawaty Ginting, M.Si., Apt. NIP. 195304031983032001 NIP 195112231980032002
Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, September 2013
Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan rahmat
kasih dan karunianya, sehingga penulis dapat menyelesaikan skripsi ini yang
berjudul ”Karkterisasi Simplisia dan Skrining Fitokimia Serta Uji Aktivitas
Antioksidan Ekstrak Etanol Buah Kesemek (Diospyros kaki Thunb.)”. Skripsi ini
diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana farmasi pada
Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih dan penghargaan yang tulus kepada
Ayahanda dan Ibunda tercinta, L. Simorangkir dan B. Manullang, yang tiada
pernah berhenti berkorban dengan tulus ikhlas bagi kesuksesan penulis, juga
kepada kakakku Maria dan adik-adikku Cia, Lia, Mery, Alex, dan Jo, yang selalu
setia memberi doa, dorongan dan semangat.
Penulis menyampaikan terima kasih yang sebesar-besarnya kepada Ibu
Prof. Dr. Rosidah, M.Si., Apt., dan Dra. Aswita Hafni Lubis, M.Si., Apt., selaku
pembimbing yang telah memberikan waktu, bimbingan, dan nasehat selama
penelitian hingga selesainya penyusunan skripsi ini.
Penulis menyampaikan terima kasih kepada Bapak Prof. Dr. Urip Harahap.,
Apt., Ibu Dra. Herawaty Ginting, M.Si., Apt. dan Bapak Drs. Suryadi Achmad,
M.Sc, Apt., selaku dosen penguji yang telah memberikan kritik, saran, dan arahan
kepada penulis dalam menyelesaikan skripsi ini.
Penulis menyampaikan terima kasih kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Medan yang telah
Penulis menyampaikan terima kasih kepada Bapak dan Ibu staf pengajar
Fakultas Farmasi USU Medan yang telah mendidik selama perkuliahan dan Bapak
Drs. Ismail, Msi., Apt., selaku penasehat akademis yang telah memberikan
bimbingan kepada penulis selama ini.
Penulis juga menyampaikan terima kasih kepada sahabat-sahabatku yang
telah memberi bantuan, dukungan, dan motivasi selama penelitian hingga
selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih memiliki
banyak kekurangan. Oleh karena itu, penulis mengharapkan kritikan dan saran
yang membangun dalam penyempurnaan skripsi ini. Harapan saya semoga skripsi
ini dapat bermanfaat bagi ilmu pengetahuan kefarmasian.
Medan, September 2013
Penulis,
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
BUAH KESEMEK
(Diospyros kaki Thunb.)
ABSTRAK
Buah kesemek (Diospyros kaki Thunb.) termasuk suku Ebenaceae yang tumbuh di dataran tinggi. Secara tradisional digunakan masyarakat dalam menurunkan kadar kolesterol, mencegah penyakit jantung, dan mengatasi hipertensi. Tujuan penelitian ini adalah untuk mengetahui karakterisasi simplisia dan golongan senyawa kimia serta uji aktivitas antioksidan dari sari buah kesemek segar dan ekstrak etanol buah kesemek dengan metode β-karoten-asam linoleat dan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil).
Ekstrak etanol simplisia buah kesemek dibuat secara maserasi dengan pelarut etanol 96%, sari buah kesemek segar dibuat dengan menghaluskan daging buah segar lalu ditambah air, diperas, disaring, dikeringkan menggunakan freeze dryer sehingga diperoleh sari buah kental. Uji aktivitas antioksidan terhadap ekstrak etanol buah kesemek dan sari buah kesemek segar dilakukan dengan metode β-karoten-asam linoleat pada 0-120 menit dengan interval waktu 15 menit pada panjang gelombang 470 nm dan pemerangkapan radikal bebas DPPH setelah didiamkan selama 60 menit pada suhu kamar dengan panjang gelombang 516 nm.
Hasil karakteristik simplisia buah kesemek diperoleh kadar air 5,32%, kadar sari larut air 35,38%, kadar sari larut etanol 42,92%, kadar abu total 4,93%, dan kadar abu tidak larut asam 0,26%. Hasil skrining fitokimia diperoleh bahwa buah kesemek mengandung senyawa flavonoid, glikosida, tanin dan steroid. Hasil uji aktivitas antioksidan sari buah kesemek segar dengan metode β-karoten-asam linoleat pada konsentrasi 4000, 5000, 6000 ppm adalah 43,33%, 46,66%, dan 55,00%. Hasil uji aktivitas antioksidan ekstrak etanol buah kesemek pada konsentrasi 2000, 2500, 3000 ppm adalah 50,83%, 53,33%, dan 57,50%. Hasil uji aktivitas antioksidan BHA, BHT dan Kuersetin pada konsentrasi masing-masing 100 ppm adalah 79,44%, 75,00% dan 63,33%. Hasil uji aktivitas antioksidan sari buah kesemek segar dengan metode DPPH pada konsentrasi 4000, 5000, 6000 ppm memerangkap 47,99%, 51,39%, 54,23% dan IC50 5038,88 ppm. Ekstrak etanol buah kesemek pada konsentrasi 2000, 2500, 3000 ppm memerangkap 44,29%, 52,13%, 58,65% dan IC50 2436,50 ppm. Vitamin C pada konsentrasi 4, 5, 6 ppm memerangkap 50,82%, 65,32%, 71,06% dan IC50 4,08 ppm.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING WITH ANTIOXIDANT ACTIVITIES TEST OF
ETHANOL EXTRACT OF PERSIMMON FRUIT
(Diospyros kaki Thunb.)
ABSTRACT
The persimmon fruit (Diospyros kaki Thunb.) is grouped into family of Ebenaceae that grown in the highland. In traditional used by the people to lower cholesterol, prevent of heart disease and treat of hypertention. The purpose of this study is to know about the characteristics, the class of chemical compounds of persimmon simplex and antioxidant activity of the persimmon fruit ethanol extracts, the persimmon fruit juice by 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method andβ-carotene-linoleat acidmethod.
The prersimmon fruit ethanol extract is produced by maceration method with 96% ethanol solvent, the fresh persimmon fruit juice is usually extracted by refining the flesh persimmon fruit, added water, squeezed, filtered, dried use freeze dryer then produce a viscous juice. The antioxidant activity test for the persimmon fruit ethanol extract and the fresh persimmon fruit juice byβ -carotene-linoleat acid at 0-120 minute with 15-minute interval at a wavelength of 470nm and 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method after incubated for 60 minutes at room temperature and a wavelength of 516 nm.
The result of persimmon fruit characteristics gave the water content value 5.32%, the water soluble extract value 35.38%, the ethanol soluble extract value 42.92%, the total ash value 4.93%, and the acid insoluble ash value 0.26%. The persimmon fruit contained flavonoid, glycosides, tannin and steroids. The result of antioxidant activity test with β-carotene-linoleat acid method was the fresh persimmon fruit at 4000, 5000, 6000 ppm is 43.33%, 46.66%, and 55.00%. The persimmon fruit ethanol extract at 2000, 2500, 3000 ppm is 50.83%, 53.33%, and 57.50%. The results antioxidant activity of BHA, BHT and Quercetin at a concentration of 100 ppm respectively were 79,44%, 75,00% and 63.33%. The result of antioxidant activity test with 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method was the fresh persimmon fruit juice at 4000, 5000, 6000 ppm scavenged 47.99%, 51.39%, 54.23% and IC50 5038.88 ppm. The persimmon fruit ethanol extract at 2000, 2500, 3000 ppm scavenged 44.29%, 52.13%, 58.65% and IC50 2436.50 ppm. Vitamin C at 4, 5, 6 ppm scavenged 50.82%, 65.32%, 71.06% and IC50 4.08 ppm.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Kesemek ... 6
2.1.1.1 Klasifikasi ... 6
2.1.1.3 Nama Daerah ... 7
2.1.1.4 Nama Asing ... 7
2.1.2 Morfologi Tumbuhan ... 7
2.1.3 Asal dan Habitat ... 7
2.1.4 Kandungan ... 8
2.1.5 Kegunaan ... 8
2.2 Ekstraksi ... 8
2.3 Radikal Bebas ... 10
2.4 Antioksidan ... 11
2.5 Spektrofotometri UV-Visible ... 12
2.6 Metode Pengukuran Antioksidan ... 13
BAB III METODE PENELITIAN ... 17
3.1 Alat-alat ... 17
3.2 Bahan-bahan ... 17
3.3 Penyiapan Bahan Tumbuhan ... 18
3.2.1 Pengambilan bahan tumbuhan ... 18
3.2.2 Identifikasi tumbuhan ... 18
3.2.3 Pembuatan simplisia ... 18
3.4 Pembuatan Pereaksi ... 19
3.4.1 Besi (III) klorida 1 % ... 19
3.4.2 Larutan HCL 2N ... 19
3.4.3 Timbal (II) asetat 0,4 M ... 19
3.4.4 Pereaksi Mayer ... 19
3.4.6 Pereaksi Dragendorf ... 19
3.4.7 Larutan kloralhidrat 70% ... 20
3.4.8 Larutan pereaksi asam sulfat 2 N ... 20
3.4.9 Pereaksi Bouchardat ... 20
3.4.10 Pereaksi Liebermann-Burchard ... 20
3.4.11 Larutan pereaksi DPPH 0,5 mM ... 20
3.5 Pemeriksaan Karakteristik Simplisia ... 20
3.5.1 Pemeriksaan organoleptis ... 21
3.5.2 Pemeriksaan mikroskopik ... 21
3.5.3 Penetapan kadar air simplisia ... 21
3.5.4 Penetapan kadar sari yang larut dalam air ... 22
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 22
3.5.6 Penetapan kadar abu total ... 23
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ... 23
3.6 Skrining Fitokimia ... 23
3.6.1 Pemeriksaan Alkaloid ... 23
3.6.2 Pemeriksaan Glikosida ... 24
3.6.3 Pemeriksaan Steroid/ Triterpenoid ... 25
3.6.4 Pemeriksaan Flavonoid ... 25
3.6.5 Pemeriksaan Tanin ... 25
3.6.6 Pemeriksaan Saponin ... 25
3.6.7 Pemeriksaan Antrakinon ... 26
3.7 Pembuatan SBKS dan EEBK ... 26
3.7.2 Pembuatan EEBK ... 26
3.8 Pengujian Aktivitas Antioksidan ... 27
3.8.1 Metode β-karoten-asam linoleat ... 27
3.8.1.1 Pembuatan larutan blanko ... 27
3.8.1.2 Pembuatan larutan stok β-karoten ... 27
3.8.1.3 Pembuatan larutan induk sampel uji ... 27
3.8.1.4 Pembuatan larutan uji sari buah kesemek segar (SBKS) ... 27
3.8.1.5 Pembuatan larutan uji ekstrak etanol buah kesemek (EEBK) ... 28
3.8.1.6 Pembuatan larutan pembanding BHA, BHT dan Kuersetin ... 28
3.8.1.7 Penentuan aktivitas antioksidan menggunakan metode β-karoten-asam linoleat ... 28
3.8.2 Metode Pemerangkapan Radikal Bebas DPPH ... 29
3.8.2.1 Prinsip metode pemerangkapan radikal Bebas DPPH ... 29
3.8.2.2 Pembuatan larutan blanko ... 29
3.8.2.3 Penentuan panjang gelombang serapan maksimum .... 29
3.8.2.4 Pembuatan larutan induk ... 29
3.8.2.5 Pembuatan larutan induk vitamin C ... 29
3.8.3 Pembuatan larutan uji ... 30
3.8.3.1 Larutan uji sari buah kesemek segar ... 30
3.8.3.2 Larutan uji ekstrak etanol simplisia buah kesemek ... 30
3.8.3.3 Larutan uji vitamin C ... 30
BAB IV HASIL DAN PEMBAHASAN ... 32
4.2 Hasil Identifikasi Tumbuhan ... 32
4.2 Hasil Karakteristik Simplisia ... 32
4.2.1 Identifikasi organoleptis ... 32
4.2.2 Identifikasi mikroskopik ... 32
4.3 Hasil skrining fitokimia ... 33
4.4 Hasil Analisis Antioksidan ... 34
4.4.1 Hasil analisis aktivitas antioksidan sampel uji dengan metode β-karoten-asam linoleat ... 34
4.4.2 Hasil analisis aktivitas antioksidan sampel uji dengan metode DPPH ... 46
4.5 Analisi Nilai IC 50 ... 48
BAB V KESIMPULAN DAN SARAN ... 50
5.1 Kesimpulan ... 50
5.2 Saran ... 51
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pemeriksaan karakteristik simplisia ... 32
4.2 Hasil skrining fitokimia ... 33
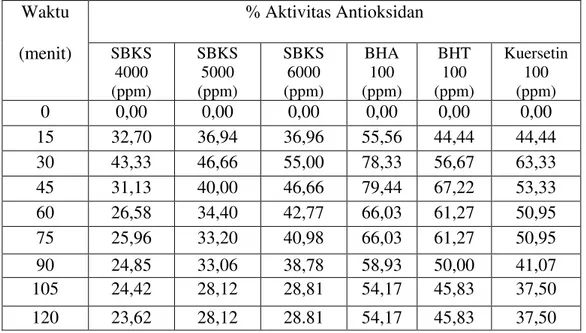
4.3 Persentase aktivitas antioksidan Sari Buah Kesemek Segar (SBKS) ... 35
4.4 Persentase aktivitas antioksidan Ekstrak Etanol Buah Kesemek Kesemek (EEBK) ... 35
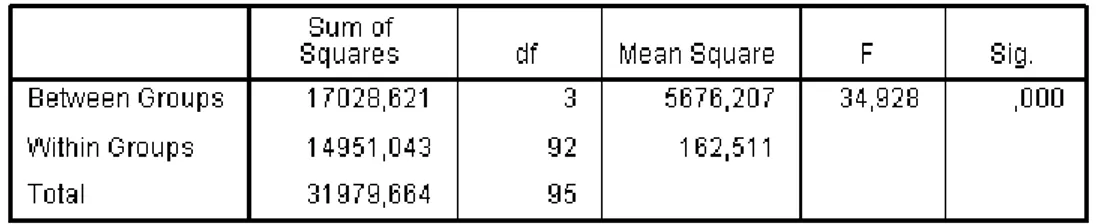
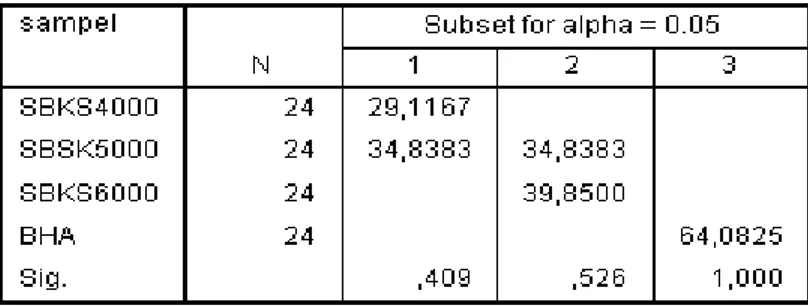
4.5 Hasil analisis SBKS dan BHA secara Anova ... 40
4.6 Hasil analisis SBKS dan BHA secara Tukey ... 41
4.7 Hasil analisis SBKS dan BHT secara Anova ... 41
4.8 Hasil analisis SBKS dan BHT secara Tukey ... 42
4.9 Hasil analisis SBKS dan Kuersetin secara Anova ... 42
4.10 Hasil analisis SBKS dan Kuersetin secara Tukey ... 43
4.11 Hasil analisis EEBK dan BHA secara Anova ... 43
4.12 Hasil analisis EEBK dan BHA secara Tukey ... 44
4.13 Hasil analisis EEBK dan BHT secara Anova ... 44
4.14 Hasil analisis EEBK dan BHT secara Tukey ... 44
4.15 Hasil analisis EEBK dan Kuersetin secara Anova ... 45
4.16 Hasil analisis EEBK dan Kuersetin secara Tukey ... 45
4.17 Penurunan absorbansi DPPH dengan penambahan SBKS ... 47
4.18 Penurunan absorbansi DPPH dengan penambahan EEBK ... 47
4.19 Penurunan absorbansi DPPH dengan penambahan vitamin C ... 47
4.20 Kategori kekuatan aktivitas antioksidan ... 48
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema Kerangka Pikir Penelitian ... 5
2.1 Struktur dasar flavonoid ... 12
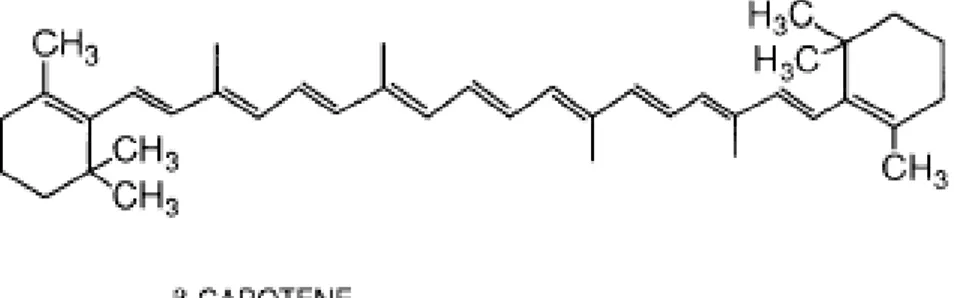
2.2 Rumus bangun β-karoten ... 14
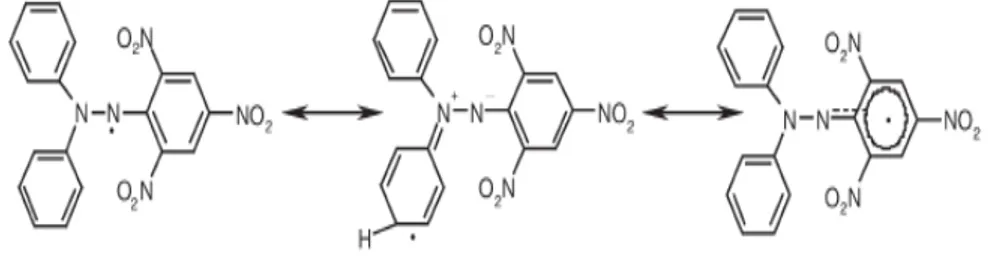
2.3 Struktur kimia DPPH ... 15
2.4 Resonansi DPPH ... 15
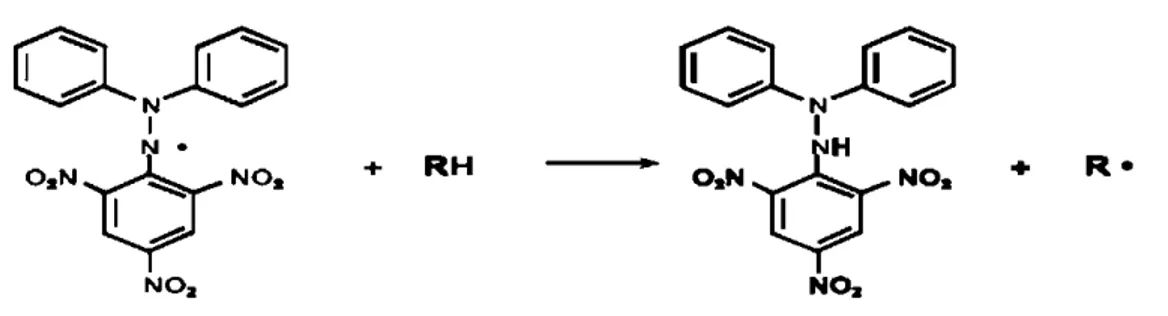
2.5 Reaksi antara DPPH dengan senyawa antioksidan ... 16
4.1 Grafik hasil uji aktivitas antioksidan SBKS vs BHA ... 36
4.2 Grafik hasil uji aktivitas antioksidan SBKS vs BHT ... 37
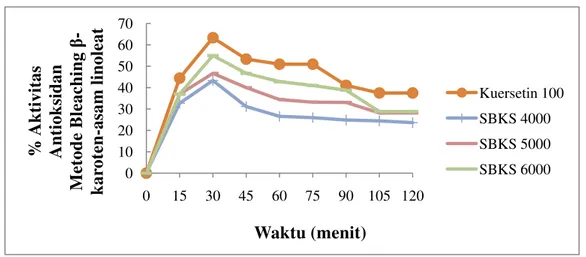
4.3 Grafik hasil uji aktivitas antioksidan SBKS vs kuersetin ... 37
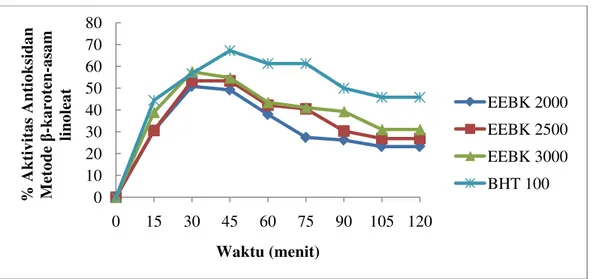
4.4 Grafik hasil uji aktivitas antioksidan EEBK vs BHA ... 38
4.5 Grafik hasil uji aktivitas antioksidan EEBK vs BHT ... 39
4.6 Grafik hasil uji aktivitas antioksidan EEBK vs kuersetin ... 39
4.7 Serapan maksimum larutan DPPH 40 ppm dalam metanol ... 46
4.8 Buah kesemek ... 55
4.9 Simplisia buah kesemek ... 56
4.10 Serbuk simplisia buah kesemek ... 56
4.11 Mikroskopik serbuk simplisia buah kesemek ... 57
4.12 Bagan Penelitian ... 58
DAFTAR LAMPIRAN
Lampiran Halaman
1. Identifikasi Buah Kesemek ... 52
2. Gambar Tumbuhan dan Buah Kesemek ... 53
3. Makroskopik Buah Kesemek ... 54
4. Mikroskopik Buah Kesemek ... 55
5. Bagan Penelitian ... 56
6. Perhitungan Pemeriksaan Karakteristik Simplisia Buah Kesemek .. 57
7. Gambar Alat Spektrofotometri ... 62
8. Data Absorbansi dan Hasil Uji Aktivitas Antioksidan SBKS, EEBK, BHA, BHT dan Kuersetin Metode β-Karoten-Asam Linoleat ... 63
9. Perhitungan Nilai Aktivitas Antioksidan Metode β-Karoten-Asam Linoleat ... 74
10. Hasil Uji Aktivitas Antioksidan Metode DPPH ... 75
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
BUAH KESEMEK
(Diospyros kaki Thunb.)
ABSTRAK
Buah kesemek (Diospyros kaki Thunb.) termasuk suku Ebenaceae yang tumbuh di dataran tinggi. Secara tradisional digunakan masyarakat dalam menurunkan kadar kolesterol, mencegah penyakit jantung, dan mengatasi hipertensi. Tujuan penelitian ini adalah untuk mengetahui karakterisasi simplisia dan golongan senyawa kimia serta uji aktivitas antioksidan dari sari buah kesemek segar dan ekstrak etanol buah kesemek dengan metode β-karoten-asam linoleat dan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil).
Ekstrak etanol simplisia buah kesemek dibuat secara maserasi dengan pelarut etanol 96%, sari buah kesemek segar dibuat dengan menghaluskan daging buah segar lalu ditambah air, diperas, disaring, dikeringkan menggunakan freeze dryer sehingga diperoleh sari buah kental. Uji aktivitas antioksidan terhadap ekstrak etanol buah kesemek dan sari buah kesemek segar dilakukan dengan metode β-karoten-asam linoleat pada 0-120 menit dengan interval waktu 15 menit pada panjang gelombang 470 nm dan pemerangkapan radikal bebas DPPH setelah didiamkan selama 60 menit pada suhu kamar dengan panjang gelombang 516 nm.
Hasil karakteristik simplisia buah kesemek diperoleh kadar air 5,32%, kadar sari larut air 35,38%, kadar sari larut etanol 42,92%, kadar abu total 4,93%, dan kadar abu tidak larut asam 0,26%. Hasil skrining fitokimia diperoleh bahwa buah kesemek mengandung senyawa flavonoid, glikosida, tanin dan steroid. Hasil uji aktivitas antioksidan sari buah kesemek segar dengan metode β-karoten-asam linoleat pada konsentrasi 4000, 5000, 6000 ppm adalah 43,33%, 46,66%, dan 55,00%. Hasil uji aktivitas antioksidan ekstrak etanol buah kesemek pada konsentrasi 2000, 2500, 3000 ppm adalah 50,83%, 53,33%, dan 57,50%. Hasil uji aktivitas antioksidan BHA, BHT dan Kuersetin pada konsentrasi masing-masing 100 ppm adalah 79,44%, 75,00% dan 63,33%. Hasil uji aktivitas antioksidan sari buah kesemek segar dengan metode DPPH pada konsentrasi 4000, 5000, 6000 ppm memerangkap 47,99%, 51,39%, 54,23% dan IC50 5038,88 ppm. Ekstrak etanol buah kesemek pada konsentrasi 2000, 2500, 3000 ppm memerangkap 44,29%, 52,13%, 58,65% dan IC50 2436,50 ppm. Vitamin C pada konsentrasi 4, 5, 6 ppm memerangkap 50,82%, 65,32%, 71,06% dan IC50 4,08 ppm.
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING WITH ANTIOXIDANT ACTIVITIES TEST OF
ETHANOL EXTRACT OF PERSIMMON FRUIT
(Diospyros kaki Thunb.)
ABSTRACT
The persimmon fruit (Diospyros kaki Thunb.) is grouped into family of Ebenaceae that grown in the highland. In traditional used by the people to lower cholesterol, prevent of heart disease and treat of hypertention. The purpose of this study is to know about the characteristics, the class of chemical compounds of persimmon simplex and antioxidant activity of the persimmon fruit ethanol extracts, the persimmon fruit juice by 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method andβ-carotene-linoleat acidmethod.
The prersimmon fruit ethanol extract is produced by maceration method with 96% ethanol solvent, the fresh persimmon fruit juice is usually extracted by refining the flesh persimmon fruit, added water, squeezed, filtered, dried use freeze dryer then produce a viscous juice. The antioxidant activity test for the persimmon fruit ethanol extract and the fresh persimmon fruit juice byβ -carotene-linoleat acid at 0-120 minute with 15-minute interval at a wavelength of 470nm and 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method after incubated for 60 minutes at room temperature and a wavelength of 516 nm.
The result of persimmon fruit characteristics gave the water content value 5.32%, the water soluble extract value 35.38%, the ethanol soluble extract value 42.92%, the total ash value 4.93%, and the acid insoluble ash value 0.26%. The persimmon fruit contained flavonoid, glycosides, tannin and steroids. The result of antioxidant activity test with β-carotene-linoleat acid method was the fresh persimmon fruit at 4000, 5000, 6000 ppm is 43.33%, 46.66%, and 55.00%. The persimmon fruit ethanol extract at 2000, 2500, 3000 ppm is 50.83%, 53.33%, and 57.50%. The results antioxidant activity of BHA, BHT and Quercetin at a concentration of 100 ppm respectively were 79,44%, 75,00% and 63.33%. The result of antioxidant activity test with 1,1-diphenyl-2-picrylhydrazil (DPPH) radical scavenging method was the fresh persimmon fruit juice at 4000, 5000, 6000 ppm scavenged 47.99%, 51.39%, 54.23% and IC50 5038.88 ppm. The persimmon fruit ethanol extract at 2000, 2500, 3000 ppm scavenged 44.29%, 52.13%, 58.65% and IC50 2436.50 ppm. Vitamin C at 4, 5, 6 ppm scavenged 50.82%, 65.32%, 71.06% and IC50 4.08 ppm.
BAB I
PENDAHULUAN
1.1Latar Belakang
Dewasa ini telah banyak diungkapkan bahaya lingkungan yang tidak sehat
antara lain terbentuknya radikal bebas. Asap kendaraan bermotor, asap rokok dan
asap dari industri menyumbang ratusan bahan kimia yang mengakibatkan
pembentukan radikal bebas. Radikal bebas dapat masuk dan terbentuk dalam
tubuh melalui pernafasan, kondisi lingkungan yang tidak sehat dan makanan yang
berlemak (Kumalaningsih, 2006).
Radikal bebas merupakan senyawa yang memiliki satu atau lebih elektron
yang tidak berpasangan dan bersifat sangat reaktif. Selain terdapat di luar tubuh,
radikal bebas juga secara normal dibentuk di dalam tubuh. Radikal bebas dalam
jumlah kecil masih dapat ditoleransi, namun berbahaya apabila dalam jumlah
yang berlebih. Radikal bebas akan merusak DNA, protein dan lipid, perubahan ini
dapat mempercepat proses penuaan bahkan menyebabkan berbagai penyakit
(Silalahi, 2006).
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat
memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi
berantai dari radikal bebas. Penggunaan senyawa antioksidan saat ini semakin
meluas seiring dengan semakin besarnya pemahaman masyarakat tentang
peranannya dalam mencegah penyakit degeneratif. Kombinasi beberapa jenis
antioksidan memberikan perlindungan yang lebih baik terhadap oksidasi
Diketahui bahwa masuknya antioksidan alami yang berasal dari makanan
seperti sayur-mayur dan buah-buahan dapat memberi manfaat yang baik dalam
mempertahankan tubuh dari gangguan kesehatan dan menghambat proses penuaan
(Kosasih, dkk., 2004).
Kesemek (Diospyros kaki Thunb.) suku Ebenaceae berasal dari Cina yang
kemudian menyebar dan dibudayakan di Jepang hingga ke bagian Asia lainnya
termasuk Indonesia (Anonim, 2012). Buah ini mengandung karbohidrat, protein,
vitamin A, vitamin C, kalium dan phenol yang berkhasiat sebagai antioksidan
(Isnindar, 2011). Mengkonsumsi satu buah kesemek setiap hari dapat membantu
mencegah penyakit jantung. Senyawa antioksidan yang terdapat dalam kesemek
mampu menjaga kelenturan pembuluh darah agar tidak terjadi penyumbatan
(Sekar, 2011). Buah kesemek berwarna oranye dengan ukuran buah 200-300 g,
memiliki rasa manis dan daya simpan buah lebih dari 14 hari. Di Sumatera Utara,
buah ini tumbuh subur di daerah Berastagi dengan ketinggian 1000 m dari
permukaan laut dengan curah hujan tinggi di daerah beriklim sejuk dan lembab
(Baswarsiati, dkk., 2006).
Beberapa metode yang digunakan untuk menguji aktivitas antioksidan
adalah β-karoten-asam linoleat dan metode pemerangkapan radikal bebas
1,1-diphenyl-2-picrylhydrazil (DPPH). Metode β-karoten-asam linoleat merupakan
metode spektrofotometri yang didasarkan pada kemampuan antioksidan untuk
mencegah pemucatan warna jingga karoten akibat oksidasi dalam sistem emulsi
asam linoleat dan β-karoten. Pemucatan warna jingga karoten ditunjukkan dengan
penurunan absorbansi dan aktivitas antioksidan. Metode pemerangkapan radikal
DPPH dari ungu menjadi kuning lemah. Hal ini terjadi apabila elektron dari
DPPH berpasangan dengan atom hidrogen yang disumbangkan senyawa
antioksidan (Prakash, 2001; Rosidah, dkk., 2008; Utami, dkk., 2009).
Berdasarkan hal di atas, penulis tertarik melakukan uji karakterisasi
simplisia, skrining fitokimia serta uji aktivitas antioksidan dengan metode β
-karoten-asam linoleat dan metode pemerangkapan radikal bebas 1,1-diphenyl-2
-picrylhydrazil (DPPH) dari sari buah kesemek segar dan ekstrak etanol buah
kesemek.
1.2 Perumusan Masalah
Berdasarkan latar belakang tersebut maka perumusan masalahnya adalah:
a. Apakah karakterisasi simplisia senyawa kimia hasil penelitian ini dapat
digunakan pada penelitan selanjutnya.
b. Apakah golongan senyawa kimia yang terkandung dalam buah kesemek.
c. Apakah sari buah kesemek segar dan ekstrak etanol buah kesemek
memiliki aktivitas antioksidan dengan metode β-karoten-asam linoleat.
d. Berapakah nilai IC50 sari buah kesemek segar dan ekstrak etanol buah
kesemek dengan metode DPPH.
1.3Hipotesis
Berdasarkan perumusan di atas, maka hipotesis penelitian adalah sebagai
berikut:
a. Karakterisasi simplisia buah kesemek dapat digunakan pada penelitian
b. Kandungan golongan senyawa kimia yang terdapat pada buah kesemek
adalah golongan alkaloid, saponin, flavonoid, tanin, glikosida,
steroid/triterpenoid, dan antrakinon.
c. Sari buah kesemek dan ekstrak etanol buah kesemek mempunyai aktivitas
antioksidan.
d. Nilai IC50 sari buah kesemek segar dan ekstrak etanol buah kesemek
adalah <50 ppm-200 ppm.
1.4Tujuan Penelitian
Berdasarkan hipotesis, maka tujuan penelitian ini adalah:
a. Mengetahui karakter simplisia buah kesemek (Diospyros kaki Thunb.)
b. Mengetahui kandungan golongan senyawa kimia yang terdapat pada buah
kesemek.
c. Mengukur kemampuan antioksidan dari sari buah kesemek segar dan
ekstrak etanol buah kesemek dengan metode β-karoten-asam linoleat.
d. Mengukur kemampuan antioksidan dari sari buah kesemek segar dan
ekstrak etanol buah kesemek dengan metode pemerangkapan radikal bebas
DPPH.
1.5Manfaat Penelitian
Dapat memberikan informasi mengenai karakteristik dan golongan
senyawa kimia buah kesemek (Diospyros kaki Thunb.) dan menambah data
1.6Kerangka Pikir Penelitian
Penelitian ini dilaksanakan dengan kerangka pikir seperti ditunjukkan pada
Gambar 1.1.
Variabel Bebas Variabel Terikat Parameter
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi daerah tumbuh, sistematika tumbuhan, sinonim
tumbuhan, nama daerah, nama asing, morfologi tumbuhan, kandungan kimia dan
kegunaan dari tumbuhan.
2.1.1 Kesemek
2.1.1.1 Klasifikasi
Menurut Hutapea, dkk., (1994), taksonomi tumbuhan kesemek adalah:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Ebenales
Suku : Ebenaceae
Marga : Diospyros
Jenis : Diospyros kaki Thunb.
2.1.1.2 Sinonim Tumbuhan
Kesemek mempunyai nama latin Diospyros kaki Thunb. sedangkan
sinonim dari kesemek adalah Diospyros chinensis Blume., Diospyros schitse
2.1.1.3 Nama Daerah
Di Indonesia daerah Banjarmasin disebut buah samak dan di Jawa Tengah
disebut buah tledung (Baswarsiati, dkk., 2006).
2.1.1.4 Nama Asing
Di Cina/Jepang, kesemek dikenal dengan nama persimmon kaki
(Baswarsiati, dkk., 2006).
2.1.2Morfologi Tumbuhan
Kesemek adalah tanaman dengan tinggi 6-8 m, memiliki batang berbentuk
tegak, bulat, berkayu, kasar, dan berwarna hijau kotor. Daun tumbuhan kesemek
merupakan daun tunggal, berseling, berbentuk lonjong, tepi rata, ujung runcing,
bertangkai pendek dan berwarna hijau. Bunga berbentuk tunggal, tumbuh di
ketiak daun, kelopak bentuk bintang dan berwarna hijau, panjang benang sari ± 1
cm berwarna hijau pucat, kepala putik bulat, mahkota berbulu. Buah kesemek
berbentuk bulat dengan diameter 6-8 cm, ketika masih muda berwarna hijau dan
setelah tua berwarna kuning dan berakar tunggang. Pada pangkal buah terdapat
kelopak bunga yang terdiri dari 4. Pangkal buah agak cekung kedalam dan
ditutupi dengan kelopak bunga berwarna hijau kecoklatan (Hutapea, dkk., 1994;
Baswarsiati, dkk., 2006).
2.1.3 Asal dan Habitat
Kesemek berasal dari Cina dan Jepang, banyak dijumpai di daerah
subtropis dan dataran tinggi daerah tropis. Didaerah tropik, kesemek umumnya
dijumpai pada ketinggian 1000 m dari permukaan laut. Di Jawa, tanaman ini
tumbuh baik pada ketinggian 1000-1500 m dari permukaan laut dengan curah
Sumatera Utara, Garut dan Ciloto Jawa Barat, Magetan, Malang dan Batu Jawa
Timur (Baswarsiati, dkk., 2006).
2.1.4 Kandungan
Buah kesemek mengandung karbohidrat, protein, vitamin A, vitamin C,
kalium, potasium, tanin dan phenol yang berkhasiat sebagai antioksidan (Isnindar,
2011).
2.1.5 Kegunaan
Kesemek membantu mencegah penyakit jantung. Senyawa antioksidan
yang terdapat dalam kesemek mampu menjaga kelenturan pembuluh darah agar
tidak terjadi penyumbatan. Buah kesemek juga digunakan untuk mengobati
hipertensi (Sekar, 2011).
2.2 Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari
jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya
bahan-bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan
tertentu (Harborne, 1984).
Menurut Departemen kesehatan (2000), beberapa metode ekstraksi yang
sering digunakan dalam berbagai penelitian antara lain yaitu:
A. Cara dingin
a. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
kinetik sedangkan yang dilakukan pengulangan panambahan pelarut setelah
dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut
remaserasi.
b. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu
baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada
temperatur kamar. Proses perkolasi terdiri dari tahap pelembaban bahan, tahap
perendaman antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak)
terus-menerus sampai diperoleh perkolat yang jumlahnya 1-5 kali bahan.
B. Cara panas
a. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik.
b. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-50°C.
c. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang
selalu baru, dilakukan dengan menggunakan alat soklet sehingga menjadi
ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
d. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 15 menit.
e. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit.
2.3 Radikal Bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih
elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah
menjurus ke reaksi yang tidak terkontrol, menghasilkan ikatan dengan DNA,
protein, lipida, atau kerusakan oksidatif pada gugus fungsional yang penting pada
biomolekul ini. Radikal bebas juga terlibat dan berperan dalam patologi dari
berbagai penyakit degeneratif, yakni kanker, aterosklerosis, jantung koroner,
katarak, dan penyakit degeneratif lainnya (Silalahi, 2006).
Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan
berlangsung sepanjang hidup. Radikal bebas yang sangat berbahaya dalam
makhluk hidup antara lain adalah golongan hidroksil (OH-), superoksida (O-2),
nitrogen monooksida (NO), peroksidal (RO-2), peroksinitrit (ONOO-), asam
2.4 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat
memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi
berantai dari radikal bebas (Kumalaningsih, 2006).
Antioksidan atau reduktor berfungsi untuk mencegah terjadinya oksidasi
atau menetralkan senyawa yang telah teroksidasi dengan cara menyumbangkan
hidrogen dan atau elektron (Silalahi, 2006).
Menurut Kumalaningsih (2006), antioksidan tubuh dikelompokkan
menjadi 3 yakni:
a. Antioksidan primer yang berfungsi untuk mencegah pembentuk
senyawa radikal baru karena dapat merubah radikal bebas yang ada
menjadi molekul yang berkurang dampak negatifnya, sebelum radikal
bebas ini sempat bereaksi. Contohnya adalah enzim superoksida
dismutase (SOD) yang berfungsi sebagai pelindung hancurnya sel dalam
tubuh dari radikal bebas.
b. Antioksidan sekunder merupakan senyawa yang berfungsi menangkap
senyawa serta mencegah terjadinya reaksi berantai. Contohnya adalah
vitamin E, vitamin C, dan betakaroten yang dapat diperoleh dari
buah-buahan.
c. Antioksidan tersier merupakan senyawa yang memperbaiki kerusakan
sel-sel dan jaringan yang disebabkan radikal bebas. Contohnya enzim
metionin sulfoksidan reduktase untuk memperbaiki DNA pada inti sel.
Antioksidan alami yaitu antioksidan yang dapat diperoleh dari tanaman
fenolik (Kumalaningsih, 2006). Salah satu antioksidan alami yang berperan
sebagai antioksidan adalah flavanoid. Senyawa ini berperan sebagai penangkap
radikal bebas karena mengandung gugus hidroksil. Karena bersifat sebagai
reduktor, flavonoid dapat bertindak sebagai donor hidrogen terhadap radikal bebas
(Silalahi, 2006).
Antioksidan sintetik dibuat dari bahan-bahan kimia yang biasanya
ditambahkan ke dalam bahan pangan untuk mencegah terjadinya reaksi
autooksidasi (Kumalaningsih, 2006).
Struktur dasar dan sistem penomoran untuk turunan flavonoid dapat dilihat pada
Gambar 2.1.
Gambar 2.1 Struktur dasar flavonoid (Robinson, 1995)
2.5 Spektrofotometer Visibel
Prinsip kerja Spektrofotometer Visibel adalah sinar/cahaya dilewatkan
melewati sebuah wadah (kuvet) yang berisi larutan, dimana akan menghasilkan
spektrum. Sebagian dari cahaya tersebut akan diserap dan sisanya akan
dilewatkan. Nilai absorbansi dari cahaya yang dilewatkan akan sebanding dengan
konsentrasi larutan di dalam kuvet. Alat ini menggunakan hukum Lambert Beer
sebagai acuan (Ewing, 1975).
Spektrofotometer pada dasarnya terdiri atas sumber sinar monokromator,
pencatat. Panjang gelombang untuk sinar ultraviolet antara 200-400 nm
sedangkan panjang gelombang untuk sinar tampak/visible antara 400-750 nm
(Rohman, 2007).
2.6 Metode Pengukuran Antioksidan
Beberapa tahun belakangan ini, pengujian absorbansi oksigen radikal telah
digunakan untuk mengevaluasi dan mengukur aktivitas antioksidan pada
makanan, serum dan cairan biologi lainnya. Metode analisa ini mengukur aktivitas
dari antioksidan dalam melawan radikal bebas seperti 1,1-
diphenyl-2-picrylhydrazyl (DPPH) radikal, anion superoksida radikal (O2·), hidroksi radikal
(OH·) atau peroksi radikal (ROO·). Bermacam-macam metode yang digunakan
untuk mengukur aktivitas antioksidan dari produk makanan dapat memberikan
hasil yang beragam tergantung pada spesifitas dari radikal bebas yang digunakan
sebagai reaktan (Sunarni, dkk., 2007).
Perkiraan aktivitas antioksidan bergantung kepada sistem pengujiannya.
Spesifitas dan sensitifitas satu metode saja tidak dapat menguji seluruh senyawa
fenol yang terdapat pada ekstrak. Oleh karena itu dibutuhkan kombinasi pengujian
aktivitas antioksidan lebih dari satu (Sun dan Ho, 2005). Pada uji aktivitas
antioksidan dengan menggunakan metode β-karoten-asam linoleat, radikal bebas
terbentuk dari hidroperoksid yang dihasilkan oleh asam linoleat. Radikal bebas
asam linoleat terbentuk karena pengurangan atom hidrogen dari satu gugus
metilen dialil yang menyerang ikatan rangkap pada beta karoten sehingga terjadi
memberi warna orange (Rosidah, dkk., 2008). Perubahan warna ini dapat diukur
secara spektrofotometri.
Rumus bangun β-karoten dapat dilihat pada Gambar 2.2.
Gambar 2.2Rumus bangun β-karoten (Robinson, 1995)
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
metode β-karoten-asam linoleat menurut literatur adalah 470 nm (Rosidah, dkk.,
2008; Sugiastuti, 2002). Lama pengukuran metode β-karoten-asam linoleat
menurut literatur yang direkomendasikan adalah 0 menit sampai 120 menit
dengan interval waktu 15 menit (Rosidah, dkk., 2008).
DPPH pertama kali ditemukan pada tahun 1922 oleh Goldschmidt dan
Renn. DPPH berwarna ungu pekat seperti KMnO4, bersifat tidak larut dalam air
(Ionita, 2003). DPPH (1,1-diphenyl-2-picrylhydrazil) merupakan radikal bebas
yang stabil pada suhu kamar dan sering digunakan untuk mengevaluasi aktivitas
antioksidan beberapa senyawa atau ekstrak bahan alam. DPPH menerima elektron
atau radikal hidrogen akan membentuk molekul diamagnetik yang stabil. Interaksi
antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada
DPPH, akan menetralkan karakter radikal bebas dari DPPH (Molyneux, 2004).
DPPH (radikal bebas) DPPH (non radikal)
Gambar 2.3 Struktur kimia DPPH (Molyneux,2004)
Metode pemerangkapan radikal 1,1-diphenyl-2-picrylhydrazyl (DPPH)
adalah suatu metode sederhana yang dapat digunakan untuk menguji kemampuan
antioksidan yang terkandung dalam makanan. Metode ini dapat digunakan untuk
sampel yang padat dan bentuk larutan. Prinsipnya adalah elektron ganjil pada
molekul DPPH memberikan serapan maksimum pada panjang gelombang
tertentu, berwarna ungu. Warna akan berubah dari ungu menjadi kuning lemah
apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang
disumbangkan senyawa antioksidan. Perubahan warna ini berdasarkan reaksi
kesetimbangan kimia (Prakash, 2001).
DPPH merupakan radikal bebas yang stabil karena resonansi yang
dialaminya. Resonansi juga menyebabkan peningkatan kepekatan warna ungu
(Molyneux, 2004). Resonansi DPPH dapat dilihat pada Gambar 2.4.
Ketika larutan DPPH dicampurkan dengan senyawa yang dapat
mendonorkan atom hidrogen, akan dihasilkan bentuk tereduksi dari DPPH dan
berkurangnya warna ungu (Molyneux, 2004). Reaksi antara DPPH dengan atom H
dari senyawa antioksidan dapat dilihat pada Gambar 2.5.
Gambar 2.5 Reaksi antara DPPH dengan senyawa antioksidan (Molyneux, 2004).
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang
maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm
dan 520 nm. Apabila pengukuran menghasilkan tinggi puncak maksimum, maka
itulah panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan di
atas. Nilai absorbansi yang mutlak tidaklah penting, karena panjang gelombang
dapat diatur untuk memberikan absorbansi maksimum sesuai dengan alat yang
digunakan (Molyneux, 2004).
Lama pengukuran metode DPPH menurut beberapa literatur yang
direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian
waktu yang digunakan sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30
menit dan 60 menit. Waktu reaksi yang tepat adalah ketika reaksi sudah mencapai
kesetimbangan. Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah penelitian eksperimental.
Penelitian meliputi pengumpulan dan penyiapan bahan, karakterisasi simplisia,
skrining fitokimia, pembuatan ekstrak etanol dan uji aktivitas antioksidan dengan
metode β-karoten-asam linoleat dan metode pemerangkapan radikal bebas DPPH
dengan menggunakan alat spektrofotometer visibel.
3.1 Alat-alat
Alat-alat yang digunakan terdiri dari alat-alat gelas laboratorium,
spektofotometer UV/Vis (Shimadzu UV-1800), rotary evaporator (Heidolph
VV-300), freeze dryer (Edwards), mikroskop, neraca kasar (Ohaus), neraca analitis
(Vibra), oven listrik (Strok), penangas air (Yenaco), desikator, tanur
(Gallenkamp), blender (National), seperangkat alat penetapan kadar air, cawan
porselin dan lemari pengering.
3.2 Bahan-bahan
Bahan yang digunakan dalam penelitian adalah buah kesemek segar yang
sudah tua. Bahan-bahan kimia yang berkualitas pro analisis yaitu β-karoten,
Tween 40, asam linoleat, DPPH (Sigma), butil hidroksianisol (BHA), butil
hidroksitoluena (BHT), kuersetin, vitamin C (Scharlau chemie SA/the Europian
Union), produksi E-Merck: metanol, toluen, kloroform, isopropanol, benzen, n
klorida, bismut (III) nitrat, besi (III) klorida, timbal (II) asetat, kalium iodida,
kloralhidrat, asam asetat anhidrida, natrium hidroksida, amil alkohol, natrium
sulfat anhidrat, serbuk magnesium. Bahan kimia berkualitas teknis; etanol 96%.
3.3 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengambilan bahan tumbuhan,
identifikasi tumbuhan, dan pembuatan simplisia buah kesemek.
3.3.1 Pengambilan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa
membandingkan dengan daerah lain. Bahan tumbuhan yang digunakan adalah
buah kesemek segar yang sudah tua, diperoleh dari Pasar Buah Berastagi
Kecamatan Berastagi, Kabupaten Karo, Provinsi Sumatera Utara.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani
Pusat Penelitian Biologi-LIPI Bogor. Hasil identifikasi tumbuhan dapat dilihat
pada lampiran 1, halaman dan gambar tumbuhan dapat dilihat pada lampiran 2,
halaman 54 dan 55.
3.3.3 Pembuatan simplisia
Cara pembuatan simplisia yaitu, buah kesemek segar dikumpulkan, dicuci
dengan air sampai bersih, dikupas kulitnya, dipotong-potong dengan ukuran lebar
1-2 cm, panjang 3-4 cm dan tebal 0,3-0,4 cm, lalu ditimbang sebagai berat basah,
dikeringkan dalam lemari pengering pada suhu 40°C, setelah kering bahan
Simplisia yang sudah diserbuk dimasukkan ke dalam wadah yang terlindung dari
cahaya matahari. Bagan kerja penelitian dapat dilihat pada lampiran 5 halaman 58.
3.4 Pembuatan Pereaksi
3.4.1 Besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 ml
(Departemen Kesehatan, 1995).
3.4.2 Larutan HCl 2N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai
100 ml (Departemen Kesehatan, 1995).
3.4.3 Timbal (II) asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas CO2
hingga 100 ml (Departemen Kesehatan, 1995).
3.4.4 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida, kemudian dilarutkan dalam air suling
hingga 60 ml. Pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu
dilarutkan dalam 10 ml air suling. Kedua larutan dicampurkan dan ditambahkan
air suling hingga diperoleh larutan 100 ml. (Departemen Kesehatan, 1995).
3.4.5 Pereaksi Molisch
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga 100 ml
(Departemen Kesehatan, 1995).
3.4.6 Pereaksi Dragendorf
Sebanyak 0,8 g bismut nitrat dilarutkan dalam asam nitrat pekat 20 ml
kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam 50
diambil dan diencerkan dengan air suling secukupnya hingga 100 ml (Departemen
Kesehatan, 1995).
3.4.7 Larutan kloralhidrat 70%
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml
air suling (Departemen Kesehatan, 1995).
3.4.8 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga
diperoleh 100 ml (Departemen Kesehatan, 1995).
3.4.9 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya
kemudian ditambahkan 2 g iodida sedikit demi sedikit cukupkan dengan air suling
(Departemen Kesehatan, 1995).
3.4.10 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrida dengan 5 ml asam
sulfat pekat tambahkan etanol hingga 50 ml (Harborne, 1984).
3.4.11 Larutan pereaksi DPPH 0,5 mM
Sebanyak 19,7 mg DPPH ditimbang, kemudian dilarutkan dalam metanol
hingga volume 100 ml.
3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan organoleptis,
pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari yang larut
dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu
3.5.1 Pemeriksaan organoleptis
Pemeriksaan organoleptis dilakukan pada buah kesemek segar dan
simplisia yang meliputi pemeriksaan warna, bau, rasa, ukuran dan bentuk buah
kesemek.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap penampang melintang
jaringan segar dari buah kesemek dengan cara meneteskan kloralhidrat di atas
kaca objek, kemudian diatasnya diletakkan sayatan jaringan segar dan ditutup
dengan kaca penutup lalu diamati di bawah mikroskop. Serbuk simplisia
ditaburkan diatas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan
tutup dengan kaca penutup, kemudian diamati di bawah mikroskop.
3.5.3 Penetapan kadar air simplisia
Penetapan kadar air dilakukan dengan metode Azeotropi. Alat terdiri dari
labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung dan
tabung penerima.
a. Penjenuhan toluen
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Kemudian kedalam labu tersebut dimasukkan 5 gram serbuk simplisia
yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah
besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap
detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan
toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan
mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume
air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai
dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air
dihitung dalam persen (WHO, 1998).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu
bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan
selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat pertama diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam
persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di
udara (Departemen Kesehatan, 1995).
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan
etanol 96% dihitung terhadap bahan yang telah dikeringkan di udara (Departemen
Kesehatan, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada
suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh
bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara
(Departemen Kesehatan, 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring, dipijarkan sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang telah dikeringkan di udara (Departemen Kesehatan,
1995).
3.6 Skrining Fitokimia
Skrining fitokimia dilakukan untuk mengetahui golongan senyawa
alkaloida, flavonoida, glikosida, glikosida antrakinon, saponin, tanin, dan
steroid/triterpenoid.
3.6.1 Pemeriksaan alkaloida
Ekstrak diitimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam
didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida:
diambil tabung reaksi, lalu kedalamnya dimasukkan 0,5 ml filtrat.
Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning.
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bouchardat, akan terbentuk
endapan berwarna coklat sampai kehitaman.
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau tiga
dari percobaan di atas (Departemen Kesehatan, 1995).
3.6.2 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, disari dengan 30 ml campuran
dari 7 bagian etanol 95% dengan 3 bagian air suling (7:3) dan 10 ml asam klorida
2N. Kemudiaan direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20
ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok,
didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol
dan kloroform (2:3), dilakukan sebanyak 3 kali. Sari air dikumpulkan kemudiaan
diuapkan pada temperatur tidak lebih dari 500C, sisanya dilarutkan dalam 2 ml
metanol. Larutan sisa digunakan untuk percobaan berikut, 0,1 ml larutan
percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas
air. Pada sisa ditambahkan 2 ml air dan 5 tetes larutan perekasi Molish, lalu
ditambahkan dengan perlahan-lahan 2 ml asam sulfat pekat melalui dinding
tabung, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya
3.6.3 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g sebuk simplisia ditimbang, dimaserasi dengan 20 ml n
-heksan selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada
sisa ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat
(pereaksi Lieberman-Burchard), timbulnya warna biru atau biru hijau
menunjukkan adanya steroida, sedangkan warna merah, merah muda atau ungu
menunjukkan adanya triterpenoid (Harborne, 1984).
3.6.4 Pemeriksaan flavonoid
Sebanyak 10 g serbuk simplisia ditimbang, dilarutkan 100 ml air panas,
dididihkan selama 5 menit, disaring dalam keadaan panas, ke dalam 5 ml filtrat
ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil
alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.5 Pemeriksaaan tanin
Sebanyak 0,5 g serbuk simplisia ditimbang, disari dengan 10 ml air suling
lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin
(Departemen Kesehatan, 1995).
3.6.6 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia ditimbang, dimasukkan ke dalam tabung
reaksi, ditambahkan 10 ml air suling panas, didinginkan, kemudian dikocok
dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam
klorida 2N buih tidak hilang (Departemen Kesehatan, 1995).
3.6.7 Pemeriksaan antrakinon
Sebanyak 0,2 g serbuk simplisia ditimbang, dicampur dengan 5 ml asam
sulfat 2N, dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen,
dikocok dan didiamkan. Lapisan benzen dipisahkan dan disaring, kemudian kocok
dengan 2 ml NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan
benzene tidak berwarna menunjukkan adanya antrakinon (Departemen Kesehatan,
1995).
3.7 Pembuatan Sari Buah Kesemek Segar dan Ekstrak Etanol Buah Kesemek
3.7.1 Pembuatan sari buah kesemek segar (SBKS)
Sebanyak 200 g daging buah kesemek segar dihaluskan menggunakan
blender, ditambah air secukupnya, lalu diperas melalui kain kasa, hasil perasan
ditampung pada beker gelas, disaring, lalu diukur volumenya. Sari buah
dibekukan di freezer, selanjutnya dipekatkan di freeze dryer sampai diperoleh sari
buah kesemek yang kental. Sari buah kesemek yang diperoleh adalah 20,412 g.
3.7.2 Pembuatan ekstrak etanol buah kesemek (EEBK)
Pembuatan ekstrak dilakukan secara maserasi dengan pelarut etanol 96%,
Caranya, sebanyak 200 g serbuk simplisia dimasukkan ke dalam wadah kaca,
dituangi dengan 1500 ml etanol 96%, ditutup, dibiarkan selama 5 hari terlindung
dari cahaya sambil sesekali diaduk. Setelah 5 hari campuran tersebut diserkai.
Ampas dicuci dengan etanol 96% secukupnya hingga diperoleh 2000 ml.
cahaya selama 2 hari, kemudian dienaptuangkan lalu disaring. Maserat dipekatkan
menggunakan alat rotary evaporator pada suhu 40°C sampai diperoleh maserat
pekat dikeringkan menggunakan freeze dryer sehingga diperoleh ekstrak kental.
Ekstrak yang diperoleh 109,767 g (Departemen Kesehatan, 1979).
3.8 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel
3.8.1 Metode β-karoten-asam linoleat
3.8.1.1 Pembuatan larutan blanko
Asam linoleat 20 mg dan Tween-40 200 mg dimasukkan kedalam labu
erlenmeyer 50 ml, kemudian ditambahkan 10 ml air suling dan 40 ml air
beroksigen (Rosidah, dkk., 2008)
3.8.1.2 Pembuatan larutan stok β-karoten
Serbuk β-karoten 1 mg dalam 1 ml kloroform dan ditambah dengan 20 mg
asam linoleat dan 200 mg Tween-40. Kloroform kemudian diuapkan dari
campuran dengan rotavapor. Residu yang tertinggal dilarutkan dengan 10 ml air
suling, dicampur sehingga homogen lalu ditambahkan 40 ml air beroksigen,
dicampur homogen (Rosidah, dkk., 2008).
3.8.1.3 Pembuatan larutan induk sampel uji.
Sebanyak 500 mg sampel uji (ekstrak kental) ditimbang, dimasukkan ke
dalam labu tentukur 50 ml dilarutkan dengan etanol lalu volumenya dicukupkan
dengan etanol sampai garis tanda (konsentrasi 10000 ppm).
3.8.1.4 Pembuatan larutan uji sari buah kesemek segar (SBKS)
Larutan induk SBSK dipipet sebanyak 10 ml; 12,5 ml; 15 ml kemudian
dicukupkan dengan etanol sampai garis tanda (untuk mendapatkan konsentrasi
4000 ppm, 5000 ppm, 6000 ppm).
3.8.1.5 Pembuatan larutan uji ekstrak etanol buah kesemek (EEBK)
Larutan induk EEBK dipipet sebanyak 5 ml; 6,25 ml; 7,5 ml kemudian
dimasukkan ke dalam labu tentukur 25 ml dengan etanol lalu volumenya
dicukupkan dengan etanol sampai garis tanda (untuk mendapatkan konsentrasi
2000 ppm, 2500 ppm, 3000 ppm).
3.8.1.6 Pembuatan larutan pembanding butil hidrosianisol (BHA), butil hidroksitoluena (BHT), dan kuersetin
Sebanyak 5 mg masing-masing butil hidrosianisol (BHA), butil
hidroksitoluena (BHT), dan kuersetin, ditimbang, kemudian dilarutkan dalam labu
tentukur 50 ml dengan etanol, lalu volumenya dicukupkan dengan etanol sampai
garis tanda (konsentrasi 100 ppm).
3.8.1.7 Penentuan aktivitas antioksidan menggunakan metode β -karoten-asam linoleat
Larutan stok β-karoten sebanyak 4 ml dipipet ke dalam tabung-tabung uji
yang masing-masing berisi 0,2 ml larutan sari buah kesemek segar (konsentrasi
4000 ppm, 5000 ppm dan 6000 ppm), butil hidrosianisol (konsentrasi 100 ppm),
butil hidroksitoluena (konsentrasi 100 ppm), kuersetin (konsentrasi 100 ppm).
Penyerapan UV setiap sampel dan blanko (tanpa β-karoten) diukur langsung (0
menit) sampai 120 menit pada panjang gelombang 470 nm dengan
spektrofotometer. Pengukuran diulang sebanyak 3 kali untuk setiap sampel.
Aktivitas Antioksidan (AA) ditentukan dengan menggunakan rumus berikut:
A0 dan A00 ialah serapan sampel dan blanko pada waktu 0 menit. At dan
At0 ialah serapan sampel dan blanko pada waktu t menit. Demikian dilakukan hal
yang sama terhadap ekstrak etanol buah kesemek (Rosidah, dkk., 2008).
3.8.2 Metode pemerangkapan radikal bebas DPPH
3.8.2.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi DPPH (
1,1-diphenyl-2-picryl-hidrazyl) sebagai radikal bebas dalam larutan metanol (sehingga
terjadi peredaman warna ungu DPPH) dengan nilai IC50 (konsentrasi sampel uji
yang mampu meredam radikal bebas sebesar 50%) digunakan sebagai parameter
untuk menentukan aktivitas antioksidan sampel.
3.8.2.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM dipipet sebanyak 5 ml, kemudian dimasukkan ke
dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis
tanda (konsentrasi 40 ppm).
3.8.2.3Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur serapannya
pada panjang gelombang 400-800 nm.
3.8.2.4 Pembuatan larutan induk (EEBK dan SBKS)
Sebanyak 500 mg sampel uji (ekstrak kental) ditimbang, dimasukkan ke
dalam labu tentukur 50 ml dilarutkan dengan metanol lalu volumenya dicukupkan
3.8.2.5 Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam labu
tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan
metanol sampai garis tanda (konsentrasi 1000 ppm).
3.8.3 Pembuatan larutan uji
3.8.3.1 Larutan uji sari buah kesemek segar
Larutan induk dipipet sebanyak 10 ml; 12,5 ml; 15 ml kemudian
dimasukkan ke dalam labu tentukur 25 ml (untuk mendapatkan konsentrasi 4000
ppm, 5000 ppm, 6000 ppm), kemudian dalam masing-masing labu tentukur
ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 40 ppm) lalu volume
dicukupkan dengan metanol sampai garis tanda. Setelah didiamkan selama 60
menit pada temperatur kamar, absorbansi diukur pada panjang gelombang serapan
maksimum dengan menggunakan spektrofotometer visibel (Rosidah, dkk., 2008).
3.8.3.2 Larutan uji ekstrak etanol simplisia buah kesemek
Larutan induk dipipet sebanyak 5 ml; 6,25 ml; 7,5 ml ke dalam labu ukur
25 ml untuk mendapatkan konsentrasi larutan uji 2000 ppm, 2500 ppm, 3000
ppm, kedalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM
(konsentrasi 40 ppm) lalu volumenya dicukupkan dengan metanol sampai garis
tanda. Diamkan selama 60 menit, lalu diukur serapannya menggunakan
spektrofotometer UV-visible, panjang gelombang 516 nm.
3.8.3.3 Larutan uji vitamin C
Larutan induk dipipet sebanyak 0,1 ml; 0,125 ml; 0,15 ml ke dalam labu
kedalam masing-masing labu ukur ditambahkan 5 ml larutan DPPH 0,5 mM
(konsentrasi 40 ppm) lalu volumenya dicukupkan dengan metanol sampai garis
tanda. Diamkan selama 60 menit, lalu diukur serapannya menggunakan
spektrofotometer UV-visible, panjang gelombang 516 nm.
3.8.4 Penentuan nilai IC50
Menurut Utami, dkk (2009) nilai IC50 dihitung berdasarkan persentase
inhibisi terhadap radikal DPPH dari masing-masing konsentrasi larutan sampel
dengan rumus :
% inhibisi = x 100%
blangko A
sampel A -blangko A
Keterangan : AKontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji
yang memberikan peredaman DPPH 50% (mampu meredam proses oksidasi
DPPH sebesar 50%). Nilai 0% berarti tidak mempunyai aktivitas antioksidan,
sedangkan nilai 100% berarti peredaman total dan pengujian perlu dilanjutkan
dengan pengenceran larutan uji untuk melihat batas konsentrasi aktivitasnya.
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan radikal
bebas adalah nilai IC50 (Inhibitory Concentration). Secara spesifik, suatu senyawa
dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50 μg/ml,
kuat untuk IC50 bernilai 50-100 μg/ml, sedang jika IC50 bernilai 100-150 μg/ml,
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia
(LIPI) Bogor menunjukkan bahwa sampel termasuk suku Ebenaceae, spesies
Diospyros kaki Thunb.
4.2 Hasil Karakteristik Simplisia
4.2.1 Identifikasi organoleptis
Hasil karakteristik simplisia secara organoleptis berupa
potongan-potongan berwarna kuning, rasa manis dan berbau karamel.
4.2.2 Identifikasi mikroskopik
Secara mikroskopik terlihat adanya parenkim, pati, sel batu, jaringan
pengangkut dengan bentuk spiral dan kristal kalsium oksalat bentuk prisma. Hasil
mikroskopik buah kesemek dapat dilihat pada lampiran 4 halaman 57.
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol,
kadar abu total dan kadar abu yang tidak larut asam dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil karakteristik simplisia buah kesemek
No. Penetapan Hasil (%)
1. Kadar air 5,32
2. Kadar sari larut air 35,38
3. Kadar sari larut etanol 42,92
4. Kadar abu total 4,93
Penetapan kadar air dilakukan berhubungan dengan mutu simplisia agar
tidak mudah ditumbuhi mikroorganisme. Kadar air simplisia buah kesemek 5,32%
memenuhi persyaratan Materia Medika Indonesia yaitu tidak lebih dari 10%.
Kadar air yang melebihi persyaratan memungkinkan terjadinya pertumbuhan
jamur. Penetapan kadar sari dilakukan terhadap sari larut air dan sari larut etanol.
Penetapan kadar sari menyatakan jumlah zat yang tersari dalam air atau etanol
(Departemen Kesehatan, 1995).
Penetapan kadar abu dilakukan untuk mengetahui kandungan senyawa
anorganik dalam simplisia misalnya Mg, Ca, Na dan K. Kadar abu tidak larut
asam untuk mengetahui kadar senyawa anorganik yang tidak larut dalam asam
misalnya silika (WHO, 1998).
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap simplisia buah kesemek dapat dilihat
pada Tabel 4.2.
Tabel 4.2 Hasil pemeriksaan skrining fitokimia serbuk simplisia buah kesemek
No. Pemeriksaan Simplisia buah kesemek
Sari buah kesemek segar
1. Alkaloida - -
2. Flavonoida + +
3. Glikosida + +
4. Antrakinon Glikosida - -
5. Saponin - -
6. Tanin + +
7. Steroid + +
Hasil skrining fitokimia menunjukkan adanya senyawa flavonoid,
glikosida, tanin dan steroid. Senyawa antioksidan alami dari tumbuhan,
diantaranya adalah senyawa polifenol yang dapat berupa golongan flavonoid.
Senyawa tersebut bertindak sebagai penangkap radikal bebas karena gugus
hidroksil yang dikandungnya mendonorkan hidrogen kepada radikal bebas. Hasil
di atas menunjukkan bahwa simplisia buah kesemek memiliki potensi sebagai
antioksidan (Kumalaningsih, 2006; Silalahi, 2006).
4.4. Hasil Analisi Antioksidan
Hasil analisis aktivitas antioksidan sampel uji dengan metode β -karoten-asam linoleat.
Pengukuran aktivitas antioksidan terhadap sampel uji dilakukan secara
spektrofotometri pada panjang geombang 470 nm. Pengujian aktivitas antioksidan
dengan metode β-karoten-asam linoleat didasarkan atas hilangnya warna β
-karoten oleh adanya radikal bebas yaitu hidroperoksid yang berasal dari asam
linoleat. Untuk melihat kemampuan aktivitas antioksidan dari sari buah kesemek
segar (SBKS), ekstrak etanol buah kesemek (EEBK), butil hidroksianisol (BHA),
butil hidroksitoluena (BHT) dan kuersetin dapat dilihat pada Tabel 4.3 dan Tabel
Tabel 4.3 Persentase Aktivitas Antioksidan Sari Buah Kesemek Segar (SBKS) dari Berbagai Konsentrasi dengan metode β-karoten-asam linoleat.
Waktu
Tabel 4.4 Persentase Aktivitas Antioksidan Ekstak Etanol Buah Kesemek (EEBK) dari Berbagai Konsentrasi dengan metode β-karoten-asam linoleat.
Dari data persentase aktivitas antioksidan pada Tabel 4.3 terlihat bahwa
persentase aktivitas antioksidan SBKS 6000 ppm>SBKS 5000 ppm>SBKS 4000
ppm. Pada Tabel 4.4 terlihat bahwa persentase aktivitas antioksidan EEBK 3000
pembanding butilhidroksianisol (BHA), butilhidroksitoluena (BHT) dan kuersetin
(masing-masing konsentrasi 100 ppm) lebih besar jika dibandingkan dengan
aktivitas antioksidan SBKS dan EEBK.
β-karoten akan kehilangan sifatnya sebagai antioksidan karena terjadi
proses oksidasi yang menyebabkan ikatan rangkap pada β-karoten berikatan
dengan atom hidrogen dari salah satu gugus metilen dialil pada asam linoleat
sehingga β-karoten akan kehilangan gugus kromofor yang memberikan warna
jingga.
Hubungan antara aktivitas antioksidan sari buah kesemek segar dan
butilhidroksianisol (BHA) dengan konsentrasi yang berbeda dapat dilihat pada
Gambar 4.1
Gambar 4.1 Grafik hasil uji aktivitas antioksidan sari buah kesemek segar vs butilhidroksianisol (BHA)
Pada Gambar 4.1 terlihat bahwa aktivitas antioksidan sari buah kesemek
segar dari ke tiga konsentrasi bervariasi (4000 ppm, 5000 ppm, 6000 ppm) dan
BHA 100 ppm. Kekuatan aktivitas antioksidan BHA 100ppm>SBKS