STUDI TESTOSTERON PLASMA, KUANTITAS DAN
KUALITAS SPERMATOZOA MENCIT (Mus musculus L.)
SETELAH PEMBERIAN KOMBINASI HORMON
TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK AIR BIJI
BLUSTRU (Luffa aegyptica Roxb.)
SKRIPSI
DESMINA KRISTIANI HUTABARAT
060805050
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI TESTOSTERON PLASMA, KUANTITAS DAN KUALITAS SPERMATOZOA MENCIT (Mus musculus L.) SETELAH PEMBERIAN
KOMBINASI HORMON TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK AIR BIJI BLUSTRU (Luffa aegyptica Roxb.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DESMINA KRISTIANI HUTABARAT 060805050
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : STUDI TESTOSTERON PLASMA, KUANTITAS
DAN KUALITAS SPERMATOZOA MENCIT (Mus
musculus L.) SETELAH PEMBERIAN
KOMBINASI HORMON TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK AIR BIJI BLUSTRU (Luffa aegyptica Roxb.)
Kategori : SKRIPSI
Nama : DESMINA KRISTIANI HUTABARAT
Nomor Induk Mahasiswa : 060805050
Program Studi : SARJANA (S-1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, Maret 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Masitta Tanjung S.Si, M.Si Prof. Dr. Syafruddin Ilyas, M. Biomed NIP.19710910 200012 2 001 NIP. 19660209 199203 1 003
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
STUDI TESTOSTERON PLASMA, KUANTITAS DAN KUALITAS SPERMATOZOA MENCIT (Mus musculus L.) SETELAH PEMBERIAN KOMBINASI HORMON TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK
AIR BIJI BLUSTRU (Luffa aegyptica Roxb.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Maret 2011
LEMBAR PENGESAHAN
JUDUL : STUDI TESTOSTERON PLASMA, KUANTITAS DAN KUALITAS SPERMATOZOA MENCIT (Mus musculus L.) SETELAH PEMBERIAN KOMBINASI HORMON TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK AIR BIJI BLUSTRU (Luffa
aegyptica Roxb.)
NAMA : DESMINA KRISTIANI HUTABARAT NIM : 060805050
No. Nama Keterangan Tanggal Tanda Tangan
1. Prof. Dr. Syafruddin Ilyas, M. Biomed NIP. 196602 091992 031003
Dosen
Pembimbing 1
2. Masitta Tanjung, S.Si. M.Si. NIP. 197109 102000 122001
Dosen
Pembimbing 2
3.
Dra. Emita Sabri. M.Si
NIP. 196506291992032002 Dosen Penguji 1
4. Dra. Nunuk Priyani, M.Sc NIP. 195810181990031001
PENGHARGAAN
Puji Syukur dipanjatkan kepada Tuhan Yang Maha Esa karena atas berkat dan
Karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ”STUDI TESTOSTERON PLASMA, KUANTITAS DAN KUALITAS
SPERMATOZOA MENCIT (Mus musculus L.) SETELAH PEMBERIAN KOMBINASI TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK BIJI BLUSTRU (Luffa aegyptica Roxb.)”, yang merupakan syarat untuk melengkapi dan memenuhi syarat mencapai gelar Sarjana Sains di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Ucapan terima kasih penulis sampaikan kepada bapak Prof. Dr. Syafruddin Ilyas,. M. Biomed selaku Dosen Pembimbing I, ibu Masitta Tanjung, S.Si., M.Si selaku Dosen Pembimbing II, ibu Dra. Emita Sabri, M.Si selaku Dosen Penguji I dan ibu Dra. Nunuk Priyani, M.Sc selaku Dosen Penguji II yang telah banyak memberikan arahan, bimbingan dan waktu serta perhatian dalam proses penyusunan skripsi ini.
Ucapan terima kasih juga penulis sampaikan kepada bapak Drs, Nursal S.Si., M.Si selaku Dosen Penasehat Akademik, dan kepada ibu Dr. Nursaharah Pasaribu, M.Sc, selaku Ketua Departemen Biologi FMIPA USU, dan Bapak Drs. Kiki Nurjahja M.Sc, selaku Sekretaris Departemen Biologi FMIPA USU, penulis juga mengucapkan terima kasih kepada bapak Sukirmanto (Alm) dan ibu Nurhasni Muluk selaku laboran di Laboratorium dan ibu Rosliana Ginting dan bapak Ewin selaku Pegawai Administrasi Departemen Biologi FMIPA USU.
Teristimewa penulis sampaikan rasa terima kasih yang sebesar-besarnya kepada orang tua tersayang: M. Hutabarat dan E. Sinaga yang telah memberikan doa, harapan, dukungan, materi sehingga penulis dapat menyelesaikan penyusunan hasil penelitian ini. Kepada kakak Febrina Hutabarat, Amk., Pahala Sinaga, SSTP, Michael Jackson Hutabarat, dan adek Diana Anastasia Hutabarat yang telah memberi doa dan semangat serta motivasi pada penulis sehingga dapat menyelesaikan penyusunan skripsi ini. Terima kasih juga penulis ucapkan kepada Felix Sinaga dan Irene Sinaga atas doa dan dukungannya .
Dame, Maysarah, Gilang, Eka dan seluruh stambuk 2008 dan stambuk 2009, serta stambuk 2010, adik asuh Frans Grovi, dan seluruh Anggota PKBKB yang memberikan dukungan dan motivasi serta doa selama penyusunan skripsi ini.
Ucapan terimakasih juga penulis ucapkan kepada abang Taripar Mahmud Nababan, SSi., karena kebersamaannya berbagi suka dan duka selama ini. Terima kasih buat motivasi, dukungan, semangat serta doanya selama penelitian sampai pada penyusunan skripsi ini.
Penulis mengucapkan terima kasih juga kepada Frans Simanjuntak, SSi., Saulina, Marsel Once, Amos, Gomgom Sinaga, SSi., Whendy Sinambela, SSi., dan asisten Laboratorium Kimia Bahan Alam yang tidak dapat disebutkan satu persatu namanya yang telah banyak membantu penulis pada saat melakukan penelitian di laboratorium tersebut
Penulis menyadari masih banyak kekurangan dalam penyusunan skripsi ini untuk itu penulis mengharapkan kritik dan saran yang membangun dari semua pihak demi kesempurnaan skripsi ini. Akhir kata semoga skripsi ini bermanfaat bagi pembaca. Sebelum dan sesudahnya penulis mengucapkan terima kasih.
Medan, Februari 2011
STUDI TESTOSTERON PLASMA, KUANTITAS DAN KUALITAS SPERMATOZOA MENCIT (Mus musculus L.) SETELAH PEMBERIAN KOMBINASI TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK AIR
BIJI BLUSTRU (Luffa aegyptica Roxb.)
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh kombinasi TU dan ekstrak biji blustru terhadap testosteron plasma, kuantitas (jumlah spermatozoa), dan kualitas (motilitas, viabilitas dan morfologi) spermatozoa mencit. Penelitian dilakukan dengan rancangan acak lengkap dengan lima kelompok kontrol dan lima perlakuan dengan injeksi TU 0,25 mg/ekor dengan interval waktu pemberian TU 6 minggu, masing-masing waktu pemberian kombinasi 0; 6; 12; 18; 24 minggu dan pemberian ekstrak biji blustru 270mg/ekor/hari. Masing-masing lama waktu pemberian kombinasi, mencit dibedah dan diambil kauda epididimis dan darah mencit. Darah dianalisis mendapatkan data kandungan testosteron plasma sedangkan kauda epididimis diamati untuk mendapatkan data kuantitas dan kualitas spermatozoa mencit. Data kemudian dianalisis dengan SPSS 15.0 for windows. Hasil penelitian menunjukkan pada lama pemberian kombinasi TU dan blustru minggu ke-18 merupakan penurunan kandungan testosteron plasma, kuantitas, dan kualitas spermatozoa paling rendah dan memiliki perbedaan yang nyata (p<0,01) antara kontrol dan perlakuan. Pada minggu ke-24 merupakan masa pemulihan bagi kandungan testosteron plasma dan kualitas spermatozoa mencit sedangkan bagi kuantitas spermatozoa mencit tidak mengalami masa pemulihan karena mengalami penurunan jumlah spermatozoa. Dari hasil penelitian, dapat disimpulkan bahwa pemberian kombinasi testosteron undekanoat dan ekstrak biji blustru mampu menurunkan kualitas spermatozoa, testosteron plasma , kuantitas spermatozoa dan memiliki masa pemulihan kecuali bagi kuantitas spermatozoa.
Study of Plasma Testosterone, Quantity and Quality of Spermatozoa Mice (Mus musculus L.) After Administration of The Combination Testosterone
Undekanoat (TU) and Water Seed Extract of Blustru (Luffa aegyptica Roxb.)
ABSTRACT
The aim of this study was to determine the influence of a combination of TU and blustru seed extract against plasma testosterone, the quantity (number of spermatozoa), and quality (motility, viability and morphology) of mice sperm. The study was conducted with complete randomized design with five control and five treatment groups with TU injection of 0.25 mg / mice with a time interval of TU 6 weeks, each time giving a combination of 0, 6; 12; 18; 24 weeks and the provision of seed extract blustru 270mg/mice/day. Each combination of a duration, mice were dissected and taken cauda epididymis and blood of mice. Blood was analyzed to get the data content of plasma testosterone whereas cauda epididymis were observed to obtain data on the quantity and quality of spermatozoa of mice. The data were analyzed with SPSS 15.0 for Windows. The results showed that at duration of 18 weeks of treatment caused significantly declining of plasma testosterone content and both quantity and quality of spermatozoa at low and has a significant difference (p <0.01) between control and treatment. At 24 week was a period for recovery of plasma testosterone contents and quality of spermatozoa but quantity of spermatozoa of mice didn’t under go recovery period because decreased number of mice spermatozoa. From the results of this study, it was concluded that administration of the combination of testosterone undecanoate and blustru seed extract could lower sperm quality and quantity, plasma testosterone, and showed a recovery period except for the quantity of spermatozoa.
DAFTAR ISI
Daftar Gambar viii
Daftar Lampiran ix
Bab 1 Pendahuluan 1
2.3 Fisiologi Reproduksi Mencit Jantan 7
2.4 Spermatozoa Mencit 8
2.4.1 Viabilitas Spermatozoa 8
2.4.2 Morfologi Spermatozoa 9
2.4.3 Motilitas Spermatozoa 10
2.5 Spermatogenesis 11
2.6 Hormon pada Jantan 11
2.6.1 Testosteron 11
2.6.2 Hormon Gonadotropin 12
2.7 Hubungan Testosteron dalam Spermatogenesis 13
Bab 3 Bahan dan Metode 15
3.1 Waktu dan Tempat 15
3.2 Alat dan Bahan 15
3.3 Prosedur Penelitian 16
3.3.1 Hewan Percobaan 16
3.3.2 Pembuatan Ekstrak Air Biji Blustru 16 3.3.3 Uji Skrining Fitokimia Biji Blustru 17 3.3.4 Pemberian Kombinasi Testosteron Undekanoat (TU) dan Ekstrak Biji Blustru (Luffa aegyptica Roxb). 18
3.3.5 Metode Penelitian 19
3.4 Penentuan Kadar Testosteron 19
3.5 Pengamatan 20
3.5.2 Penentuan Motilitas Spermatozoa 21 3.5.3 Penentuan Viabilitas Spermatozoa 21 3.5.4 Penentuan Morfologi Spermatozoa 22
3.6 Analisis Statistik 22
Bab 4 Hasil dan Pembahasan 23
4.1 Hasil Uji Skrining Fitokimia Biji Blustru
(Luffa aegyptica Roxb) 23
4.2 Kandungan Testosteron Plasma Mencit 24
4.3 Penentuan Jumlah Konsentrasi Spermatozoa (Kuantitas) 27
4.4 Kualitas Spermatozoa 30
4.4.1 Motilitas Spermatozoa 30
4.4.2 Viabilitas Spermatozoa 36
4.4.3 Morfologi Spermatozoa 38
Bab 5 Kesimpulan dan Saran 42
5.1 Kesimpulan 42
5.2 Saran 42
Daftar Pustaka 43
DAFTAR TABEL
Halaman
Tabel 3.3.5 Model Rancangan Percobaan Penelitian 19
DAFTAR GAMBAR
Halaman
Gambar 2.1 Buah L. aegyptica Roxb. (Foto di Lapangan) 5
Gambar 2.2 Rumus Bangun Testosteron Undekanoat (TU) 7
Gambar 2.4.2 Morfologi Spermatozoa Mencit 10
Gambar 2.7 Mekanisme Genomik dan Nongenomik Androgen 14 Gambar 3.3.4 Jadwal Kegiatan Pemberian TU+Luffa aegyptica Roxb.
Selama 24 Minggu 18
Gambar 3.5.1 Kamar Hitung Improved Neubauer (Zaneveld et al, 1977) 21 Gambar 4.2 Kadar Testosteron Serum Mencit Antara Kontrol dan
Perlakuan di Setiap Minggu Perlakuan 25
Gambar 4.3 Jumlah Spermatozoa Mencit Antara Kontrol dan
Perlakuan di Setiap Minggu Perlakuan 28
Gambar 4.4.1 Konsentrasi Motilitas Spermatozoa Mencit Antara
Kontrol dan Perlakuan di Setiap Minggu Perlakuan 31 Gambar 4.4.2 Konsentrasi Viabilitas Spermatozoa Mencit Antara
Kontrol dan Perlakuan Di Setiap Minggu Perlakuan 36 Gambar 4.4.3 Konsentrasi Morfologi Normal Mencit Antara Kontrol
DAFTAR LAMPIRAN
Halaman
Lampiran A Data Mentah Kandungan Testosteron Plasma Mencit 53
Lampiran B Data Mentah Jumlah Spermatozoa Mencit 57
Lampiran C Data Mentah Motilitas Spermatozoa Mencit 61
Lampiran D Data Mentah Viabilitas Spermatozoa Mencit 73 Lampiran E Data Mentah Morfologi Normal Spermatozoa Mencit 77
Lampiran F Dokumentasi Penelitian 81
Lampiran G Cara Pembuatan Ekstrak Air Biji Blustru 82
Lampiran H Lampiran I Lampiran J Lampiran K Lampiran L
Pemeriksaan Testosteron Plasma Mencit Pengamatan Jumlah Spermatozoa Mencit Pengamatan Viabilitas Spermatozoa Mencit Pengamatan Motilitas Spermatozoa Mencit Pengamatan Morfologi Spermatozoa Mencit
STUDI TESTOSTERON PLASMA, KUANTITAS DAN KUALITAS SPERMATOZOA MENCIT (Mus musculus L.) SETELAH PEMBERIAN KOMBINASI TESTOSTERON UNDEKANOAT (TU) DAN EKSTRAK AIR
BIJI BLUSTRU (Luffa aegyptica Roxb.)
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh kombinasi TU dan ekstrak biji blustru terhadap testosteron plasma, kuantitas (jumlah spermatozoa), dan kualitas (motilitas, viabilitas dan morfologi) spermatozoa mencit. Penelitian dilakukan dengan rancangan acak lengkap dengan lima kelompok kontrol dan lima perlakuan dengan injeksi TU 0,25 mg/ekor dengan interval waktu pemberian TU 6 minggu, masing-masing waktu pemberian kombinasi 0; 6; 12; 18; 24 minggu dan pemberian ekstrak biji blustru 270mg/ekor/hari. Masing-masing lama waktu pemberian kombinasi, mencit dibedah dan diambil kauda epididimis dan darah mencit. Darah dianalisis mendapatkan data kandungan testosteron plasma sedangkan kauda epididimis diamati untuk mendapatkan data kuantitas dan kualitas spermatozoa mencit. Data kemudian dianalisis dengan SPSS 15.0 for windows. Hasil penelitian menunjukkan pada lama pemberian kombinasi TU dan blustru minggu ke-18 merupakan penurunan kandungan testosteron plasma, kuantitas, dan kualitas spermatozoa paling rendah dan memiliki perbedaan yang nyata (p<0,01) antara kontrol dan perlakuan. Pada minggu ke-24 merupakan masa pemulihan bagi kandungan testosteron plasma dan kualitas spermatozoa mencit sedangkan bagi kuantitas spermatozoa mencit tidak mengalami masa pemulihan karena mengalami penurunan jumlah spermatozoa. Dari hasil penelitian, dapat disimpulkan bahwa pemberian kombinasi testosteron undekanoat dan ekstrak biji blustru mampu menurunkan kualitas spermatozoa, testosteron plasma , kuantitas spermatozoa dan memiliki masa pemulihan kecuali bagi kuantitas spermatozoa.
Study of Plasma Testosterone, Quantity and Quality of Spermatozoa Mice (Mus musculus L.) After Administration of The Combination Testosterone
Undekanoat (TU) and Water Seed Extract of Blustru (Luffa aegyptica Roxb.)
ABSTRACT
The aim of this study was to determine the influence of a combination of TU and blustru seed extract against plasma testosterone, the quantity (number of spermatozoa), and quality (motility, viability and morphology) of mice sperm. The study was conducted with complete randomized design with five control and five treatment groups with TU injection of 0.25 mg / mice with a time interval of TU 6 weeks, each time giving a combination of 0, 6; 12; 18; 24 weeks and the provision of seed extract blustru 270mg/mice/day. Each combination of a duration, mice were dissected and taken cauda epididymis and blood of mice. Blood was analyzed to get the data content of plasma testosterone whereas cauda epididymis were observed to obtain data on the quantity and quality of spermatozoa of mice. The data were analyzed with SPSS 15.0 for Windows. The results showed that at duration of 18 weeks of treatment caused significantly declining of plasma testosterone content and both quantity and quality of spermatozoa at low and has a significant difference (p <0.01) between control and treatment. At 24 week was a period for recovery of plasma testosterone contents and quality of spermatozoa but quantity of spermatozoa of mice didn’t under go recovery period because decreased number of mice spermatozoa. From the results of this study, it was concluded that administration of the combination of testosterone undecanoate and blustru seed extract could lower sperm quality and quantity, plasma testosterone, and showed a recovery period except for the quantity of spermatozoa.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Jumlah penduduk Indonesia berdasarkan sensus penduduk tahun 2005 adalah sebesar 219.204.700 dengan pertambahan penduduk sekitar 1,9% (http://www.datastatistik in donesia.com/proyeksi/index.php) dan menurut informasi tahun 2007 laju pertumbuhan penduduk diprediksi sudah menurun namun masih kisaran 1 %. Laju pertambahan penduduk yang tinggi tersebut akan berpengaruh kepada tingkat kehidupan dan kesejahteraan penduduk. Untuk menanggulanginya, pemerintah telah mencanangkan program Kependudukan dan Keluarga Berencana (KB) sebagai program Nasional. Program pemerintah ini mengakibatkan pengembangan obat-obat kontrasepsi semakin marak tidak saja pengembangan senyawa kimia yang sudah ada namun juga upaya pencarian senyawa dari bahan alam. Sampai saat ini pengaturan fertilitas lebih banyak ditujukan pada wanita, sedangkan pada pria masih terus dilakukan penelitian untuk mendapatkan suatu cara pengaturan fertilitas yang efektif dan aman. Salah satu penyebab utamanya adalah terbatasnya jenis kontrasepsi pria yang tersedia bila dibandingkan dengan alat kontrasepsi wanita. Oleh sebab itu untuk mendorong kaum pria dapat lebih banyak menjadi akseptor KB maka perlu dikembangkan jenis kontrasepsi pria yang baru (Moeloek & Ilyas., 2006).
Pendapat lain menyatakan bahwa pencapaian azoospermia karena pemberian hormon dapat terjadi melalui peningkatan peristiwa apoptosis (kematian sel secara terprogram) pada sel spermatogenik (Francavilla et al, 2002). Seperti yang telah dilaporkan, bahwa penekanan terhadap spermatogenesis dapat terjadi selain oleh pengaruh testosteron undekanoat (hormon kontrasepsi pria) melalui mekanisme
negative feed-back, juga dapat melalui mekanisme apoptosis. Pada kondisi normal,
testosteron (T) merupakan suatu androgen yang bereaksi secara langsung dengan membentuk ikatan dengan reseptor androgen (RA) (Wang et al, 2006). Reseptor androgen termasuk famili reseptor inti yang bereaksi sebagai ligand-responsive
transcription factor (Liu et al, 2003). Pada testis, RA berlokasi di sel Leydig, sel
Peritubular, dan sel Sertoli (Luisi, 1991). Testosteron secara bebas berdifusi melalui membran plasma dan mengikat RA membentuk suatu komplek yang kemudian berinteraksi dengan elemen respon androgen pada bagian promotor gen target. Transkripsi gen target dapat diinduksi sehingga menimbulkan efek long term genomic (Nandi et al, 1999) atau dihambat tergantung pada faktor yang berasosiasi dengan
ligand-receptor complex yang terikat pada elemen respon androgen (Omezzine et al,
2003).
1.2. Permasalahan
Salah satu faktor yang diinginkan dalam penemuan bahan kontrasepsi pria adalah kurangnya kandungan spermatozoa tetapi tidak mempengaruhi kandungan testosteron plasma. Kadar testosteron yang normal dalam darah berfungsi memelihara dan mempertahankan spermatogenesis. Sebaliknya kadar testosteron yang tinggi di atas kadar fisiologis akan menghambat spermatogenesis. Akibatnya terjadi oligozoospermia atau azoospermia. Hal ini menjadi dasar pemikiran perkembangan kontrasepsi pada pria. Bahan yang digunakan dalam penelitian ini adalah Testosteron Undekanoat (TU) dan blustru (Luffa aegyptica Roxb.) yang diduga dapat menekan jumlah spermatozoa mencit.
1.3. Tujuan Penelitian
Tujuan penelitian ini adalah:
a. Mengetahui jumlah (kuantitas), viabilitas dan morfologi (kualitas) spermatozoa kauda epididimis mencit yang diberi kombinasi TU dan blustru. b. Mengetahui kadar testosteron plasma mencit yang diberi kombinasi TU dan
blustru.
1.4. Hipotesis
Hipotesis dari penelitian adalah:
a. Pemberian kombinasi TU dan blustru mempengaruhi kuantitas (jumlah) spermatozoa kauda epididimis mencit.
b. Pemberian kombinasi TU dan blustru mempengaruhi kualitas (viabilitas, morfologi) spermatozoa kauda epididimis mencit.
c. Pemberian kombinasi TU dan blustru mempengaruhi motilitas spermatozoa kauda epididimis mencit.
1.5. Manfaat Penelitian
Adapun manfaat yang dapat diambil setelah pelaksanaan penelitian ini berakhir adalah:
a. Memberikan gambaran tentang pengaruh penekanan TU dan blustru terhadap jumlah spermatozoa kauda epididimis mencit.
b. Memberikan informasi adanya pengaruh TU dan blustru terhadap kadar testosteron plasma mencit.
BAB 2
TINJAUAN PUSTAKA
2.1 Blustru (Luffa aegyptica Roxb.)
Tumbuhan Luffa aegyptica Roxb. disebut dengan blustru (Gambar 2.1) merupakan tumbuhan khas Tropis dan sering digunakan sebagai makanan terutama buahnya. Sedangkan bijinya tidak dimanfaatkan atau dibuang begitu saja. Panjang batangnya dapat mencapai 2-10 m, memanjat dengan sulur-sulur (alat pembelit) yang keluar dari ketiak daun. Menurut Corner dan Watanabe (1969), susunan taksonomi blustru adalah sebagai berikut;
Divisio : Spermatophyta Subdivisio : Angiospermae Kelas : Dicotiledonae Ordo : Cucurbitales Famili : Cucurbitaceae Genus : Luffa
Species : L. aegyptica Roxb.
Daun dan batang mengandung saponin dan tanin. Luffa berkhasiat sebagai pencahar ringan dan saponin triterpen mempunyai aktivitas spermatisidal (membunuh sperma) sehingga dapat dikembangkan sebagai obat kontrasepsi (program keluarga berencana). Ekstrak seluruh bagian tanaman Luffa aegyptica Roxb., berpengaruh terhadap penekanan jumlah anak mencit yang dilahirkan (Fransworth et al, 1975). Pemberian ekstrak biji blustru sebanyak 270 mg/25 g BB mencit dapat menghambat laju kebuntingan mencit dengan aktitivitas positif tercermin dari rendahnya angka kebuntingan dan dapat menurunkan tapak implantasi, jumlah fetus yang dikandung dan jumlah korpus luteum (Dian et al, 1998).
2.2. Testosteron Undekanoat
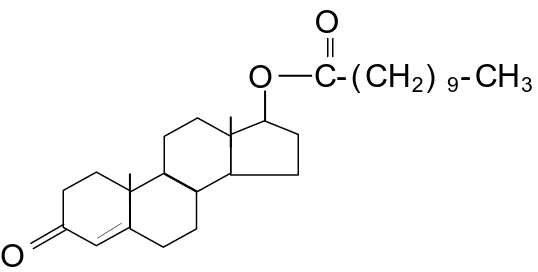
Testosteron Undekanoat (17-hydoxy-4-androsten-3-0ne17-undecanoate) (Gambar 2) terdiri dari bahan yang mudah dicerna, suatu alifatik, ester asam lemak testosteron yang sebagiannya diabsorpsi lewat usus yang mengandung sistem limfatikus setelah pemberian secara oral. Pemberian TU secara oral telah digunakan pada terapi penggantian androgen dan hal lain yang berhubungan dengan perlakuan klinik selama lebih dari 2 dekade. TU secara oral juga telah diuji sebagai kontrasepsi tunggal atau dikombinasikan dengan progestin(Kamische et al, 2002 dalam Ilyas, 2008).
Gambar 2.2 Rumus bangun Testosteron Undekanoat (TU).
2.3 Fisiologi Reproduksi Mencit Jantan
Sistem reproduksi mencit jantan terdiri atas testis dan kantong skrotum, epididimis dan vas deferens, sisa sistem ekskretori pada masa embrio yang berfungsi untuk transport sperma, kelenjar aksesoris, uretra dan penis. Selain uretra dan penis, semua struktur ini berpasangan. Epididimis adalah tuba terlilit yang panjangnya mencapai 20 kaki (4 m sampai 6 m). Epididimis terletak pada bagian dorsolateral testis, merupakan suatu struktur memanjang dari bagian atas sampai bagian bawah testis. Organ ini terdiri dari bagian kaput, korpus dan kauda epididimis. Bagian ini menerima sperma dari duktus eferen (Rugh, 1968).
Spermatozoa bergerak dari tubulus seminiferus lewat duktus eferen menuju kepala epididimis. Epididimis merupakan pipa dan berkelok-kelok yang menghubungkan vas eferensia pada testis dengan duktus eferen (vas deferen). Kepala epididimis melekat pada bagian ujung dari testis dimana pembuluh-pembuluh darah dan saraf masuk. Badan epididimis sejajar dengan aksis longitudinal dari testis dan ekor epididimis selanjutnya menjadi duktus deferen yang rangkap dan kembali ke daerah kepala. Epididimis berperan sebagai tempat untuk pematangan spermatozoa sampai pada saat spermatozoa dikeluarkan dengan cara ejakulasi. Spermatozoa belum matang ketika meninggalkan testikel dan harus mengalami periode pematangan di dalam epididimis sebelum mampu membuahi ovum (Frandson, 1995).
O
C- ( CH
2)
9- CH
3O
Jika spermatozoa terlalu banyak ditimbun, seperti oleh abstinensi (tak ejakulasi) yang lama atau karena sumbatan pada saluran keluar, sel epididimis dapat bertindak phagocytosis terhadap spermatozoa. Spermatozoa itu kemudian berdegenerasi dalam dinding epididimis. Pada orang vasektomi, epididimis juga berperan untuk memphagocytosis spermatozoa yang tertimbun terus-menerus (di samping makrofag). Terbukti spermatozoa yang diambil dari daerah kaput dan korpus tak fertil, sedang yang diambil dari daerah kauda fertil; sama halnya dengan spermatozoa yang terdapat dalam ejakulat (Yatim, 1994).
2.4 Spermatozoa mencit
Spermatozoa mencit adalah sel kelamin (gamet) yang diproduksi di dalam tubulus seminiferus melalui proses spermatogenesis, dan bersama-sama dengan plasma semen akan dikeluarkan melalui sel kelamin jantan. Menurut Rugh (1968), spermatozoa mencit yang normal terbagi atas bagian kepala yang bentuknya bengkok seperti kait, bagian tengah yang pendek (middle piece), dan bagian ekor yang sangat panjang. Panjang bagian kepala kurang lebih 0,0080 mm, sedangkan panjang spermatozoa seluruhnya sekitar 0,1226 mm (122,6 mikron).
Kemampuan bereproduksi dari hewan jantan dapat ditentukan oleh kualitas dan kuantitas semen yang dihasilkan. Produksi semen yang tinggi dinyatakan dengan volume semen yang tinggi dan konsentrasi spermatozoa yang tinggi pula. Sedangkan kualitas semen yang baik dapat dilihat dari persentase spermatozoa yang normal dan motilitasnya (Hardjopranoto, 1995)
2.4.1 Viabilitas spermatozoa
viabilitas merupakan indikator fertilisasi. Bila semen tersimpan lama maka sedikit yang motil (Nalbandov, 1990).
Banyak faktor yang mempengaruhi pembuahan misalnya viabilitas sperma yang rendah sehingga sperma tersebut tidak mampu untuk mengadakan pembuahan. Faktor hambatan ini dapat berasal dari struktur histologi saluran reproduksi pria, struktur sperma yang diperoleh selama di dalam alat genital, enzim-enzim yang terdapat di dalam saluran reproduksi pria serta dalam spermatozoa itu sendiri. Sperma yang belum dewasa maupun bentuk-bentuk yang tidak sempurna tidak akan mampu membuahi (Hafes 1976 dalam Ilyas, 1997).
Viabilitas diukur dengan melihat % motil maju/ml setelah jangka waktu tertentu. Makin lama semen tersimpan makin sedikit yang motil. Penurunan motilitas normal adalah:
a. 2-3 jam sudah ejakulasi 50-60% spermatozoa motil maju/ml b. 7 jam sudah ejakulasi: 50% spermatozoa motil maju/ml.
Jika setelah 3 jam yang motil kurang dari 50% menandakan adanya gangguan atau kelainan dalam genitalia. Spermatozoa yang motilitasnya rendah disebut
asthenozoospermia. Jika ejakulasi sering, volume semen dan konsentrasi menurun,
tapi tidak menurun ketahanan (Yatim, 1994).
2.4.2 Morfologi spermatozoa
Menurut Rugh (1968), spermatozoa mencit yang normal terbagi atas bagian kepala yang bentuknya bengkok seperti kait, bagian tengah yang pendek middle piece dan bagian ekor yang sangat panjang. Panjang bagian kepala kurang lebih 0,0080 mm sedangkan panjang spermatozoa seluruhnya sekitar 0,1226 mm (122,6 mikron).
tidak beraturan (amorphous), bentuk kepala terlalu membengkok dan lipatan-lipatan ekor yang abnormal.
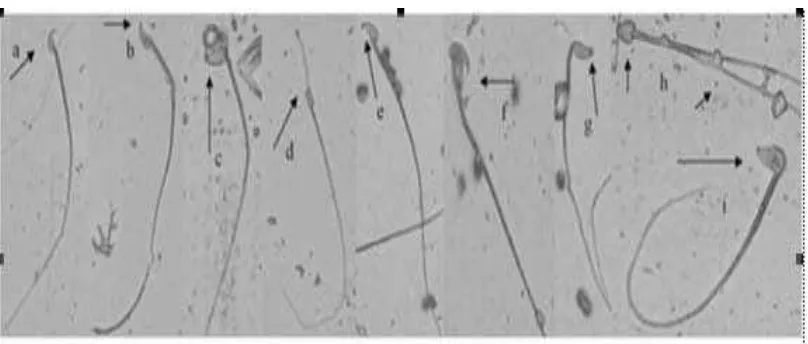
Gambar 2.4.2 Morfologi spermatozoa mencit. (a) spermatozoa normal, (b) pengait salah membengkok, (c) sperma melipat, (d) kepala terjepit, (e) pengait pendek, (f) kesalahan ekor sebagai alat tambahan, (g) tidak ada pengait, (h) sperma berekor ganda dengan kepala tidak berbentuk, (i) kepala tidak berbentuk. Perbesaran 800 x. (Wyrobek AJ & Bruce WR , 1975)
2.4.3 Motilitas spermatozoa
Jumlah yang bergerak maju ialah jumlah spermatozoa semua dikurangi jumlah mati. Dianggap normal jika motil maju >40 %. Menurut Yatim (1994) bahwa spermatozoa yang normal % motilnya ialah 63 ± 16 SD, dengan range 10-95%. Ada orang yang spermatozoanya lemah sekali gerak majunya, disebut asthenozoospermia. Jika hampir semua sperma diperiksa nampak mati, tak bergerak, disebut necrozoospermia, berarti orang ini infertil. Tapi ada laporan spermatozoa yang tak bergerak belum menunjukkan mati. Mungkin ada suatu zat cytotoxic atau antibodi yang membuatnya tak bergerak.
Menurut Tadjudin (1988), kategori untuk mengklasifikasi motilitas sperma yaitu:
a. Jika sperma bergerak cepat dengan lurus ke muka (dahulu disebut sebagai gerak maju sangat baik/ buruk)
b. Jika geraknya lambat/ sulit maju lurus/ bergerak tidak lurus (dahulu disebut sebagai gerak lemah atau sedang)
d. Jika sperma tidak bergerak 2.5 Spermatogenesis
Sel germinal primordial mencit jantan muncul sekitar 8 hari kehamilan, dengan jumlah hanya 100, yang merupakan awal dari jutaan spermatozoa yang akan diproduksi dan masih berada di daerah ekstrak gonad. Karena sel germinal kaya akan alkalin fosfatase untuk mensuplai energi pergerakannya melalui jaringan embrio, maka sel germinal dapat dikenali dengan teknik pewarnaan. Pada hari ke-9 dan hari ke-10 kehamilan sebagian mengalami degenerasi dan sebagian lagi mengalami proliferasi dan bahkan bergerak (pada hari ke-11 dan hari ke-12) ke daerah genitalia. Pada saat itu jumlahnya mencapai sekitar 5000 dan identifikasi testis dapat dilakukan. Proses diferensiasi dan proliferasi berlangsung di daerah medula testis (Rugh, 1968).
Setiap spermatozoa membawa enzim yang cukup untuk membersihkan jalan melalui cell cumulus menuju matriks jel ovum. Bahan asam hialuronik semen cenderung bergabung ke sel granulosa sel cumulus, agar kepala sperma dapat disuplai dengan enzim berlimpah. Proses spermatogenesis ini baru dimulai secara aktif pada hari ke-9 setelah lahir (Rugh, 1968). Volume cairan spermatozoa dapat ditingkatkan dengan rangsangan hormonal, sedangkan menurut Masrizal & Efrizal, (1997) volume cairan spermatozoa dapat dilakukan dengan pengenceran melalui penambahan larutan fisiologis.
2.6 Hormon pada Jantan
2.6.1 Testosteron
1996). Testosteron mempunyai efek memacu pertumbuhan dan perkembangan serta aktivitas fungsional organ asesori, sifat pria, vas deferen, penis dan skrotum. Testosteron yang gagal akan menghambat hipothalamus dan hipofise dalam proses spermatogenesis (Mansur & Moeloek, 1983). Menurut Nalbandov (1990) bahwa, fungsi testosteron ada 3 yaitu:
a. Mempertahankan sifat kelamin primer dan sekunder.
b. Mempertahankan proses spermatogenesis untuk memproduksi spermatozoa dalam keadaan cukup.
c. Menjamin maturasi spermatozoa agar mampu mengadakan fertilisasi.
2.6.2 Hormon Gonadotropin
Kelenjar hipofisa anterior mengsekresikan dua hormon gonadotropin yaitu FSH (Follicle Stimulating Hormone), dan LH (Luteinizing Hormone) dan keduanya mempunyai peranan penting dalam mengatur fungsi seksual pria (Syaifuddin, 1996). FSH memiliki reseptor pada sel tubulus seminiferus dan diperlukan dalam spermatogenesis. LH memiliki reseptor pada sel interstisial dan menstimulasi produksi serta sekresi testosteron. LH juga disebut ICSH (Interstisial cell stimulating hormone) atau hormon perangsang sel interstisial pada laki-laki (Sloane, 2003).
Berfungsi dalam pengaturan spermatogenesis yaitu dalam perubahan spermatogonia menjadi spermatosit primer kemudian menjadi spermatosit sekunder yang terjadi dalam tubulus seminiferus yang dirangsang oleh FSH dari kelenjar hipofise anterior di testis. Jadi FSH tampaknya mengawali proses proliferasi spermatogenesis dan testosteron yang berdifusi dari sel interstisial masuk ke dalam tubulus seminiferus tampaknya diperlukan untuk pematangan akhir spermatozoa (Guyton, 1996).
pemeriksaan histologis testis menunjukkan bahwa LH mamalia hanya mampu menstimulasi sel-sel Leydig yang sudah berdiferensiasi, yang ternyata sel-sel tersebut kemudian segera mengalami kelelahan (Nalbandov, 1990).
2.7 Hubungan Testosteron dalam spermatogenesis
Telah diketahui bahwa testosteron merupakan androgen yang secara langsung mempunyai aksi genomik dengan berikatan pada reseptor androgen (RA). Reseptor androgen memiliki famili reseptor inti yang bertindak sebagai ligand-responsive
transcription factor. Pada testis RA ada pada sel Leydig, sel peritubular, dan sel
Sertoli. Testosteron secara bebas berdifusi melalui membran plasma dan mengikat RA membentuk komplek yang kemudian berinteraksi dengan androgen reseptor element (ARE) pada bagian promotor gen target (Gambar 2.7). Transkripsi gen target dapat diinduksi atau ditekan tergantung pada faktor yang berhubungan dengan ikatan
ligand-reseptor complex dengan ARE (Sadate-Ngatchou et al, 2003).
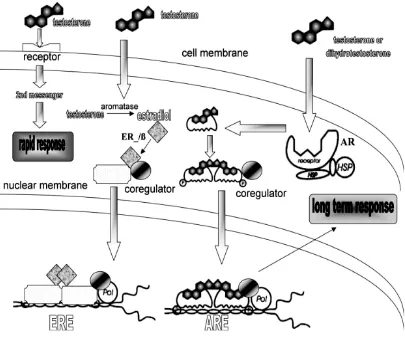
Melalui respon long-term, testosteron mengaktifkan atau menonaktifkan ekspresi gen yang berhubungan dengan perkembangan sel germinal. Seperti peningkatan ekspresi gen protamin 1 dan protein transisi 2 (secara spesifik diekspresikan pada spermatid) terjadi setelah induksi testosteron propionat pada tikus hpg (hypogondal) sehingga meningkatkan kandungan testosteron intratestikular. Selain itu ekspresi gen Pem (gen androgen yang terdapat pada testis dan epididimis) meningkat bersamaan dengan meningkatnya hormon testikular testis (Sadate-Ngatchou et al, 2003). Peningkatan ekspresi gen tersebut mendukung proliferasi dan diferensiasi sel germinal di dalam tubulus seminiferus testis.
Efek nongenomik T dipicu oleh ikatan pada sebuah reseptor membran yang belum dikarakterisasi (nonclassical). Aktivasi second messenger termasuk Ca2+ dan protein kinase, menghasilkan respon cepat secara khas yaitu efek genomik. T melewati membran sel merubah estradiol dengan aromatase yang kemudian terikat
dan mengaktifkan ER dan ERβ. DHT masuk ke sel mengikat dan mengaktifkan AR
(HSP) mereka mengalami perubahan penyesuaian, dimerisasi, dan translokasi ke dalam inti dimana mereka terikat pada tempat spesifik yang diketahui sebagai
estrogen response elements (ERE) atau androgen response element (ARE) berlokasi
dalam DNA gen inti target menghasilkan efek long-term genomic dari testosteron (Sadate-Ngatchou et al, 2003).
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Juli 2009 sampai September 2010 di Laboratorium Klinik Pramita Medan, Laboratorium Kimia Bahan Alam USU dan Laboratorium Struktur Perkembangan Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Alat dan Bahan
Bahan yang digunakan adalah mencit (Mus musculus L) jantan, ekstrak biji Blustru (Luffa aegyptica Roxb.), Testosteron Undekanoat (TU), NaCl 0,9%, Giemsa,
Aquadest, Castrol oil, kertas saring, kertas label, heparin, methanol, FeCl3, MgHCl,
H2SO4(p), NaOH 10%, reagen Meyer, reagen Wagner, pereaksi Bouchard, pereaksi
Dragendorf, CeSO4 1%, reagen Salkowsky (H2SO4(p)), larutan Libermen-Bouchard,
n-heksan, kloroform.
Alat yang digunakan adalah KIT VIDAS Testosteron, neraca timbangan, jarum suntik, jarum gavage, bak bedah, dissecting set, inkubator, kaca arloji, jarum pentul, pisau silet, hemositometer, kamera digital, mikroskop, kounter, hot plate, kain planel, ice box, Erlenmeyer, tabung reaksi, gelas ukur, beaker glass, pipet tetes, rak tabung, sikat tabung, dan tali plastik.
3.3 Prosedur Penelitian
3.3.1 Hewan Percobaan
ekor. Mencit tersebut diperoleh dari Balai Penyidikan Penyakit Hewan Sumatera Utara Medan dan dibagi dalam kelompok perlakuan dan kontrol. Mencit diberi makan dan minum secara ad-libitum. Kandang mencit dijaga kebersihannya dan diatur 12 jam terang - 12 jam gelap. Penanganan hewan percobaan sesuai dengan persyaratan kode etik yang berlaku. Diantaranya penanganan dengan penuh kasih sayang, pemberian makanan yang cukup gizi dan sehat serta memperhatikan kebersihan kandangnya. Sebelum penelitian dilakukan diajukan permohonan untuk mendapatkan
ethical clearance ke Komisi Etik Penelitian Hewan di Wilayah Sumatera Utara
Medan.
3.3.2 Pembuatan Ekstrak Air Biji Blustru
Ekstrak air blustru disiapkan dengan mengumpulkan buah blustru yang berasal dari daerah Sungai Rampah Serdang Bedagai Sumatera Utara. Biji blustru diambil dan dikeringkan dengan inkubator pada suhu 50oC sampai kering. Biji yang telah kering ditimbang kemudian dihaluskan dan dimasukkan dalam bejana yang telah diisi air. Kemudian dipanaskan di atas kompor listrik sampai mendidih. Kemudian dikeringkan dengan evaporator sehingga didapatkan hasil ekstrak dan dilarutkan kembali dengan aquadest sesuai dengan kebutuhan penelitian. Metode merupakan modifikasi dari metode Harborne. Ekstrak air yang telah terbentuk diperiksa kandungan terpenoid, steroid, flavonoid, alkaloid dengan metoda standar dari Harborne, (1987).
3.3.3 Uji Skrining Fitokimia Biji Blustru
Uji skrining fitokimia biji blustru meliputi pemeriksaan senyawa kandungan alkaloida, flavonoida, steroida, dan terpenoida menurut produser yang telah dilakukan oleh Harbone (Harbone, 1987).
a. Uji Flavonoid
tabung ke II ditetesi MgHCl, Tabung III ditetesi H2SO4(p), tabung IV ditetesi NaOH
10%. Kemudian diamati perubahan warna yang terjadi dan dicatat hasilnya.
b. Uji Alkaloid
Biji blustru yang telah dikeringkan kemudian dihaluskan dan dimasukkan dalam Erlenmeyer yang berisi methanol. Kemudian dipanaskan dan disaring. Ekstrak yang telah terbentuk dimasukkan ke dalam 4 buah tabung reaksi. Tabung I ditetesi reagen Meyer, tabung II ditetesi reagen Wagner, Tabung III ditetesi pereaksi Bouchard, tabung IV ditetesi pereaksi Dragendorf. Kemudian diamati endapan yang terjadi dan dicatat hasilnya.
c. Uji Steroid
Biji blustru yang telah dikeringkan kemudian dihaluskan dan dimasukkan dalam Erlenmeyer yang berisi n-heksan. Kemudian dipanaskan dan disaring. Ekstrak yang telah terbentuk dimasukkan ke dalam 3 buah tabung reaksi. Tabung I ditetesi CeSO4
1%, tabung ke II ditetesi reagen Salkowsky (H2SO4(p)), Tabung III ditetesi larutan
Libermen-Bouchard. Kemudian diamati perubahan warna yang terjadi dan dicatat hasilnya.
d. Uji Terpenoid
Biji blustru yang telah dikeringkan kemudian dihaluskan dan dimasukkan dalam Erlenmeyer yang berisi kloroform. Kemudian dipanaskan dan disaring. Ekstrak yang telah terbentuk dimasukkan ke dalam 3 buah tabung reaksi. Tabung I ditetesi CeSO4,
tabung ke II ditetesi reagen Salkowsky (H2SO4(p)), Tabung III ditetesi larutan
Libermen-Bouchard. Kemudian diamati perubahan warna yang terjadi dan dicatat hasilnya.
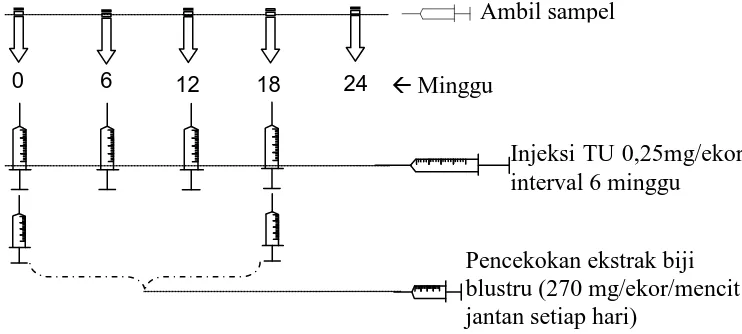
3.3.4 Pemberian Kombinasi Testosteron Undekanoat (TU) dan Ekstrak Biji
Blustru (Luffa aegyptica Roxb).
Injeksi TU 0,25mg/ekor interval 6 minggu Ambil sampel
Pencekokan ekstrak biji blustru (270 mg/ekor/mencit jantan setiap hari)
Minggu
dengan prosedur standar setelah di dapatkan di Balai Penelitian Pertanian Medan) dirancang jumlahnya dengan membandingkan dosis yang diberikan pada manusia. Perbandingan berat relawan (50 kg=50.000 g) dengan mencit adalah (25 g) adalah 2000:1. Pada uji klinik digunakan 500 mg TU, maka dosis penyuntikan pada tiap ekor mencit adalah 1/2000x500 mg TU = 0,25mg TU (Moeloek et al, 2008; Ilyas, 2007). Sedangkan ekstrak biji blustru 270 mg/25 g berat badan mencit (Dian et al,1998; Ilyas, 2003). Interval waktu injeksi intramuskular TU 6 minggu dan pencekokan ekstrak biji blustru setiap hari.
Perlakuan penyuntikan TU dan pencekokan ekstrak biji blustru ditampilkan dalam bentuk skema pada Gambar 3.3.4 berikut. Kondisi penelitian terdiri dari lima (5) bagian perlakuan dan 5 (lima) bagian kontrol.
Gambar 3.3.4 Jadwal kegiatan Pemberian TU+Luffa aegyptica Roxb. Selama
24 Minggu
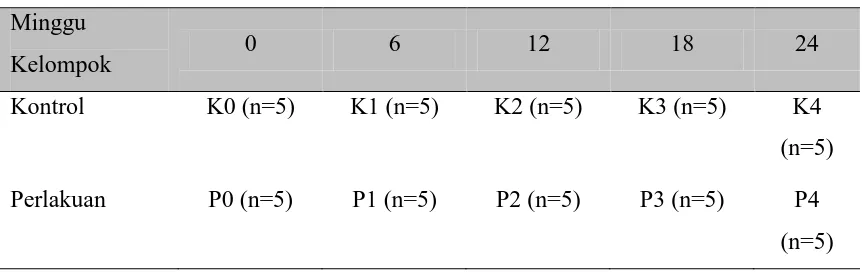
3.3.5 Metode Penelitian
Penelitian ini menggunakan rancangan acak lengkap dengan 5 kelompok perlakuan (P1 s/d P5) dan 5 kelompok kontrol(K1 s/d K5) (Tabel 3.3.5).
Tabel 3.3.5 Model Rancangan Penelitian
Minggu
Kelompok 0 6 12 18 24
Kontrol K0 (n=5) K1 (n=5) K2 (n=5) K3 (n=5) K4
(n=5)
Perlakuan P0 (n=5) P1 (n=5) P2 (n=5) P3 (n=5) P4
(n=5)
Pada Kontrol, K0 sampai K4 merupakan kontrol dari masing-masing perlakuan yang telah dirancang dengan jumlah masing-masing mencit 5 ekor. Sedangkan pada Perlakuan, P0 sampai P4 merupakan penyuntikan TU interval 6 minggu dan pencekokan ekstrak biji blustru 270 mg/25 g berat badan mencit jantan/hari. Catatan; dosis ekstrak biji blustru didasarkan pada dosis optimum penelitian Dian et al. (1998) dan Ilyas (2003) yakni 270 mg/25 g BB mencit. Ulangan ditetapkan dengan rumus (t-1)(n-1) /15 (Frederer, 1963 dalam Ilyas, 2003), dimana t = perlakuan, dan r = ulangan sehingga didapatkan ulangan sebanyak 5 kali. Penggunaan dosis TU didasarkan pada penelitian sebelumnya yang merekomendasikan pemakaiannya yakni 0,25 mg/25 g BB mencit/6 minggu (Moeloek et al, 2008; Ilyas, 2007).
3.4 Penentuan Kadar Testosteron
Mencit jantan yang telah diberi perlakuan dibedah. Kemudian diambil sampel darah dengan menggunakan jarum suntik yang sebelumnya sudah diberi heparin. Darah diambil dan dimasukkan ke dalam box es kemudian dapat diperiksa kadar testosteron di Laboratorium Klinik Pramita Medan. Pengamatan dilakukan pada setiap perlakuan pada kelompok kontrol dan perlakuan. Kadar testosteron diperiksa dengan menggunakan metoda ELFA (Enzyme Link Fluorescent Assay). Solid Phase
Receptacle (SPR) yang digunakan pada pemeriksaan ini merupakan fase solid seperti
Sampel dimasukkan ke dalam well yang berisi Alkaline Phosphate berlabel testosteron (Konjugat). Sample dan konjugat dicampur masuk dan keluar SPR pada waktu tertentu dan kecepatan reaksi tertentu. Antigen akan berikatan dengan antibodi yang telah dilekatkan oleh SPR dan konjugat membentuk ikatan Sandwich.
Komponen yang tidak terikat akan dihilangkan pada saat pencucian. Pada langkah akhir reaksi substrat (4-methyl-umbelliferyl phosphate) akan berputar masuk dan keluar SPR. Enzim konjugat katalisator akan menghidrolisa substrat menjadi
product fluorescent (4-methyl-umbelliferone). Fluoresensi ini diukur pada panjang
gelombang 450 nm. Intenstitasnya sebanding dengan konsentrasi testosteron dalam serum (Ilyas, 2005).
3.5Pengamatan
Cara pengukuran konsentrasi dan kualitas spermatozoa mengikuti standar WHO (1988) dalam Berna et al, (2010) sebagai berikut:
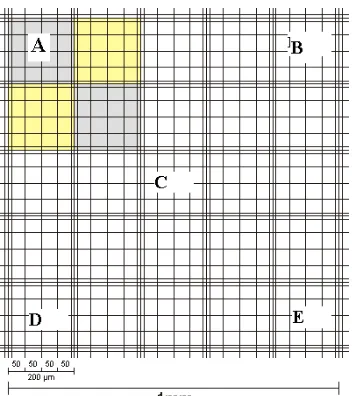
3.5.1 Penentuan Jumlah Spermatozoa
Untuk mendapatkan sperma dalam sekresi cauda epididimis dilakukan menurut Soehadi & Arsyad (1983) dalam Julahir (2008), sebagai berikut: suspensi sperma yang diperoleh dari cauda epididimis terlebih dahulu dihomogenkan dengan NaCl 0,9% 1ml. Selanjutnya diambil sebanyak 1-2 tetes pipet tetes dan dimasukkan ke dalam kotak-kotak hemositometer Improved Neubauer serta ditutup dengan kaca penutup. Dibawah mikroskop cahaya dengan perbesaran 400 kali, hemositometer diletakkan dan dihitung jumlah sperma pada kotak/bidang A,B,C,D,dan E (Gambar 3.5.1). Hasil perhitungan jumlah/ml suspensi sekresi cauda epididimis sebagai berikut:
Jumlah sperma = N/2 x 105 sperma/ml suspensi
Gambar 3.5.1 Kamar Hitung Improved Neubauer (Zaneveld et al, 1977)
3.5.2 Penentuan Motilitas Spermatozoa
Pemeriksaan motilitas spermatozoa dilakukan setelah penghitungan jumlah spermatozoa. Diamati dengan menggunakan mikroskop dengan melihat dan menghitung jumlah spermatozoa yang bergerak cepat, tidak bergerak, dan bergerak lamban (WHO, 1988).
3.5.3 Penentuan Viabilitas spermatozoa
Pemeriksaan viabilitas spermatozoa dilakukan pemberian pewarnaan Giemsa pada hemositometer. Spermatozoa yang hidup tidak berwarna dan yang mati berwarna. Kemudian dilakukan pengamatan dengan mikroskop cahaya pada pembesaran 400x dan dihitung terhadap 100-200 spermatozoa. Sebagai hasilnya dinyatakan dalam bentuk persen hidup yang didapat dari hasil bagi jumlah spermatozoa hidup dengan jumlah total spermatozoa hidup dan mati yang dikalikan dengan 100% (WHO, 1988).
% Sperma hidup =
) / (
100spermatozoa hidup mati hidup a spermatozo
3.5.4 Penentuan Morfologi spermatozoa
Untuk menentukan morfologi sperma, sperma dari cauda epididimis yang ada di hemositometer diberi pewarnaan Giemsa kira 1-2 tetes di sekitar pinggiran cover hemositometer. Kemudian dengan mikroskop cahaya dihitung jumlah 100 sperma, ditentukan persentasi sperma yang normal dan abnormal. Ciri sperma normal yaitu mempunyai bentuk kepala seperti kait pancing dan ekor panjang lurus, sedangkan sperma abnormal mempunyai bentuk kepala tidak beraturan, dapat berbentuk seperti pisang, atau tidak beraturan (amorphous), atau terlalu bengkok, dan ekornya tidak lurus bahkan tidak berekor, atau hanya terdapat ekornya saja tanpa kepala (WHO,1988).
% Sperma Normal =
) /
(
100Spermatozoa normal abnormal Normal
Sperma
x 100 %
3.6 Analisis Statistik
BAB 4
HASIL DAN PEMBAHASAN
Dari penelitian yang telah dilakukan terhadap studi kandungan testosteron plasma, kuantitas dan kualitas spermatozoa mencit (Mus musculus L.) setelah pemberian kombinasi Testosteron Undekanoat (TU) dan ekstrak air biji blustru (Luffa aegyptica Roxb.) diperoleh hasil sebagai berikut:
4.1 Hasil Uji Skrining Fitokimia Biji Blustru (Luffa aegyptica Roxb)
Hasil uji skrining fitokimia biji blustru (Luffa aegyptica Roxb) dapat dilihat pada Tabel 4.1
Tabel 4. 1 Hasil Skrining Fitokimia Biji Blustru (Luffa aegyptica Roxb)
NO Hasil Skrining Fitokimia Senyawa Bahan Alam
Terhadap Biji Blustru(Luffa aegyptica Roxb) Pengamatan
1 Senyawa Flavonoida +
2 Senyawa Alkaloida +++ 3 Senyawa Steroida + 4 Senyawa Terpenoida ++
Keterangan: semakin banyak tanda (+) semakin besar kandungan senyawa yang terdapat pada biji blustru
Berbagai jenis senyawa bioaktif yang terkandung pada tumbuhan, utamanya senyawa-senyawa yang berasal dari golongan alkaloid, flavonoid, terpenoid dan steroid memiliki aktivitas sebagai bahan anti fertilitas. (Farnsworth et al, 1975 dan Chattopadhyay et al, 1983). Blustru sebagai tumbuhan bangsa Cucurbitaceae mengandung bahan yang yang tergolong dalam glikosida triterpen atau kukurbitasin (Okabe et al, 1980) yang dapat menghambat pertumbuhan dan perkembangan sel (West et al, 1971). Kukurbitasin yang digolongkan dalam glikosida triterpen memiliki struktur dasar siklopentan perhidrofenantrena yang juga dimiliki oleh steroid.
4.2 Kadar Testosteron Plasma Mencit
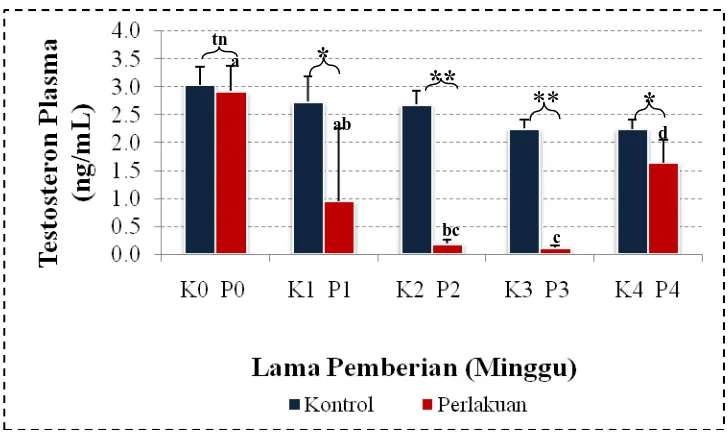
Dari hasil kadar testosteron plasma mencit jantan yang dilakukan diperoleh data dapat dilihat pada Tabel (Lampiran D, hal. 53). Sehingga dapat diperjelas dalam bentuk grafik hubungan antara kadar testosteron plasma dengan waktu pemberian kombinasi Testosteron Undekanoat (TU) dan ekstrak air biji blustru seperti ditunjukkan pada Gambar 4.2.
.
Gambar 4.2 Kadar Testosteron Serum/Plasma Mencit Antara Kontrol dan Perlakuan di Setiap Minggu Perlakuan. Huruf yang sama pada grafik berbeda adalah tidak berbeda nyata pada taraf 5%. Kontrol vs perlakuan (tn= p>0,05;
*
= p<0,05; **= p<0,01).Dari Gambar 4.2 di atas, terlihat bahwa adanya pengaruh pemberian kombinasi TU dan ekstrak biji blustru. Dengan lamanya waktu pemberian kombinasi TU dan ekstrak biji blustru menurunkan kadar testosteron plasma diawali lama pemberian kombinasi minggu ke-6 (K1P1) sampai minggu ke-18 (K3P3). Penurunan kadar testosteron plasma dapat dilihat pada Gambar 4.2 dan mengalami peningkatan kadar testosteron plasma pada minggu ke-24 (K4P4). Data pengamatan kadar testosteron plasma mencit dapat dilihat pada Lampiran D. Hasil pengamatan kadar testosteron plasma mencit setelah dilakukan uji normalitas dan homogenitas varians menunjukkan bahwa data degenerasi tidak berdistribusi normal (P<0,05) dan tidak bervarians homogen (p<0,05). Selanjutnya data tersebut ditransformasi dengan X=√y. Uji normalitas terhadap kadar testosteron plasma yang telah ditransformasi tetap berdistribusi tidak normal (p<0,05). Untuk itu dilanjutkan dengan uji nonparametrik Mann-Whitney dan Wilcoxon. Dari hasil tersebut kelompok perlakuan memberikan pengaruh yang lebih bermakna (p<0,01). Dimana kadar testosteron plasma mencit perlakuan minggu ke-0 (P0) berbeda sangat nyata lebih tinggi terhadap kadar testosteron plasma mencit perlakuan minggu ke-12 (P2), mencit perlakuan minggu ke-18 (P3) dan perlakuan minggu ke-24 (P4). Kadar testosteron mencit perlakuan minggu ke-6 (P1) berbeda sangat nyata lebih tinggi kadar testosteron plasma mencit minggu ke-18 (P3) dan berbeda sangat nyata lebih rendah kadar testosteron plasma mencit perlakuan minggu
a
ab
bc c
d
**
**
*
tn
ke-24 (P4), kadar testosteron plasma mencit perlakuan minggu ke-12 (P2) berbeda sangat nyata lebih rendah terhadap kadar testosteron plasma mencit perlakuan minggu ke-24 (P4) dan kadar testosteron plasma mencit perlakuan minggu ke-18 (P3) berbeda nyata rendah terhadap kadar testosteron plasma mencit perlakuan minggu ke-24 (P4). Dengan kata lain lama waktu pemberian kombinasi TU dan ekstrak air biji blustru memberikan pengaruh terhadap kadar testosteron plasma. Hasil uji statistik juga memperlihatkan bahwa kadar testosteron plasma mencit kontrol minggu ke-0 (K0) tidak berbeda kadar testosteron plasma mencit perlakuan minggu ke-0 (P0), kadar testosteron plasma mencit kontrol minggu ke-6 (K1) berbeda nyata lebih tinggi terhadap kadar testosteron mencit perlakuan minggu ke-6 (P1), kadar testosteron plasma mencit kontrol minggu ke-12 (K2) berbeda sangat nyata lebih tinggi terhadap kadar testosteron plasma mencit perlakuan minggu ke-12 (P2), kadar testosteron plasma mencit kontrol minggu ke-18 (K3) berbeda sangat nyata lebih tinggi terhadap kadar testosteron plasma mencit perlakuan minggu ke-18 (P3) dan kadar testosteron plasma mencit kontrol minggu ke-24 (K4) berbeda nyata lebih tinggi terhadap kadar testosteron plasma mencit perlakuan minggu ke-24 (P4). Hubungan lama pemberian kombinasi TU dan ekstrak air biji blustru terhadap kadar testosteron plasma mencit dapat dilihat pada Gambar 4.2. Pemberian kombinasi TU dan ekstrak air biji blustru yang terus-menerus dapat menyebabkan penurunan kadar testosteron plasma mencit. Menurut Ilyas (2008), bahwa konsentrasi testosteron serum stabil dalam rentang fisiologi minggu pertama setelah pemberian pertama kali. Kadar testosteron melebihi rentang fisiologis dari testosteron enantat dan sipionat. Rentang fisologi dari TU dapat mencapai 12 minggu setelah injeksi. Pola metabolisme TU mengikuti pola testosteron yang menghasilkan dihidrotestosteron (DHT) dan estradiol. Pemberian TU dapat meningkatkan konsentrasi testosteron plasma dan menurunkan konsentrasi gonadotropin. Injeksi kombinasi tersebut terlihat lebih toleran, namun injeksinya masih terlalu sering terasa jika pemakaian dalam waktu yang cukup lama.
sel Sertoli guna memproduksi zat-zat makanan yang diperlukan untuk perkembangan normal sel-sel germinal selama proses spermatogenesis. Menurut Wu et al, (1988), baik FSH, LH, maupun testosteron ketiganya diperlukan untuk mempertahankan dan memelihara
spermatogenesis.Selama proses spermatogenesis, hormon FSH dan testosteron intra-testikuler yang secara sinergis diperlukan untuk proliferasi dan diferensiasi sel-sel germinal sampai terbentuk spermatozoa yang fungsional. Menurut Reddy (2000), bahwa spermatogenesis merupakan proses pembentukan spermatozoa yang dimulai dari spermatogonia, spermatosit, spermatid dan spermatozoa. Pada perkembangan sel germinal ini dibutuhkan beberapa hormon penunjang diantaranya testosteron dan hormon gonadotropin (LH dan FSH).
Pada Gambar 4.2 dapat dilihat terjadinya peningkatan kadar testosteron plasma mencit lama pemberian kombinasi minggu ke-24 (P4). Dengan adanya perbedaan sangat nyata kadar testosteron plasma mencit pada minggu ke 24 dan kadar testosteron plasma mencit minggu ke-18 (Gambar 4.2). maka dapat dikatakan minggu ke-24 merupakan masa pemulihan. Hal ini mungkin disebabkan pada minggu ke-24 mencit perlakuan tidak diberi kombinasi ekstrak biji blustru dan TU. Pada studi Kamischke and Nieschlag (2004) dalam Ilyas (2008), terbukti bahwa kontrasepsi hormonal pria selalu akan memulihkan spermatogenesis setelah penghentian pemberian hormon.
4. 3 Penentuan Jumlah Spermatozoa (Kuantitas)
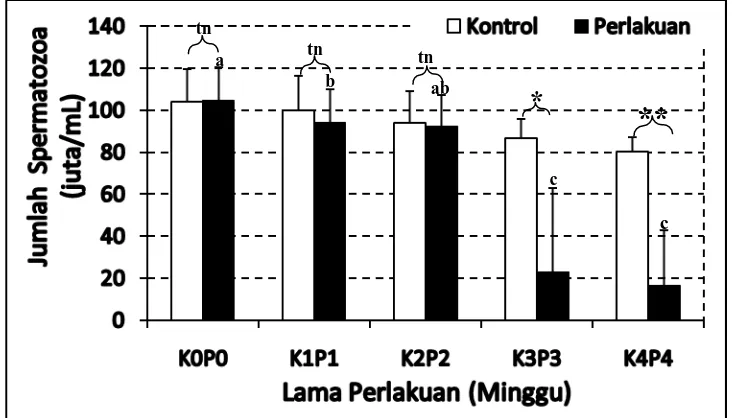
Dari hasil jumlah spermatozoa mencit jantan yang dilakukan diperoleh data yang dapat dilihat pada tabel jumlah spermatozoa mencit (Lampiran E, hal. 57). Sehingga dapat diperjelas dalam bentuk grafik hubungan antara jumlah spermatozoa dengan waktu pemberian kombinasi Testosteron Undekanoat (TU) dan ekstrak air biji blustru seperti ditunjukkan pada Gambar 4.3.
Data pengamatan jumlah spermatozoa mencit dapat dilihat pada Lampiran E. Hasil pengamatan jumlah spermatozoa mencit setelah dilakukan uji normalitas dan homogenitas varians menunjukkan bahwa data degenerasi tidak berdistribusi normal (P<0,05) dan tidak bervarians homogen (p<0,05). Selanjutnya data tersebut ditransformasi dengan X=1/y. Uji normalitas terhadap jumlah spermatozoa mencit yang telah ditransformasi tetap berdistribusi tidak normal (p<0,05). Untuk itu dilanjutkan dengan uji nonparametrik Mann-Whitney dan Wilcoxon.
Gambar 4.3 Jumlah Spermatozoa Mencit Antara Kontrol dan Perlakuan di Setiap Minggu Perlakuan. Huruf yang sama pada grafik berbeda adalah tidak berbeda nyata pada taraf 5%. Kontrol vs perlakuan (tn= p>0,05;
*
= p<0,05; **= p<0,01).Hasil uji statistik bahwa adanya pengaruh yang bermakna (p<0,05) dan pengaruh lebih bermakna (p<0,01) yakni penurunan jumlah spermatozoa antar perlakuan tiap lama pemberian kombinasi. Dimana jumlah spermatozoa mencit perlakuan minggu ke-0 (P0) berbeda sangat nyata lebih tinggi terhadap jumlah spermatozoa mencit perlakuan minggu ke-6 (P1), jumlah spermatozoa mencit perlakuan minggu ke-18 (P3) dan jumlah spermatozoa mencit perlakuan minggu ke-24 (P4). Jumlah spermatozoa mencit perlakuan minggu ke-6 (P1) berbeda sangat nyata lebih tinggi jumlah spermatozoanya terhadap jumlah spermatozoa mencit perlakuan minggu ke-18 (P3) dan jumlah spermatozoa mencit perlakuan minggu ke-24 (P4), jumlah spermatozoa mencit perlakuan minggu ke-12 (P2) berbeda sangat nyata lebih tinggi dari jumlah spermatozoa mencit perlakuan minggu ke-18 dan minggu ke-24 (P3 dan P4) dan
a
b ab
c
**
tn
tn tn
*
jumlah spermatozoa mencit perlakuan minggu ke-18 (P3) tidak memiliki berbeda nyata terhadap jumlah spermatozoa mencit perlakuan minggu ke-24 (P4).
berkurang. Kadar FSH dan testosteron yang rendah akan menyebabkan proses spermatogenesis terganggu, akibatnya jumlah spermatozoa yang dihasilkan menurun.
Menurut Nurhuda et al, (1995), bahwa penurunan jumlah spermatozoa terjadi karena adanya hambatan pada satu tahap perkembangan spermatogenesis. Apabila terjadi hambatan maka akan berpengaruh pada perkembangan berikutnya. Gangguan yang terjadi pada perkembangan sel-sel spermatogenik disebabkan karena adanya bahan aktif yang terdapat ekstrak biji blustru yakni alkaloid yang bersifat sitotoksik terhadap sel-sel yang sedang berkembang. Sel-sel yang sedang aktif membelah lebih sensitif daripada sel yang kurang aktif membelah. Apabila efek bahan aktif ini terjadi pada sel-sel spermatogonium maka perkembangan selanjutnya akan terpengaruh, sehingga spermatogonium yang berkembang menjadi spermatozoa berkurang.
Hal ini sesuai dengan pernyataan Dixit et al, (1978), pemberian ekstrak buah pare dapat mempengaruhi sel-sel spermatogonium sedangkan sel Leydig tidak mengalami perubahan. Selain itu penurunan jumlah spermatozoa disebabkan karena sifat sitotoksik dari bahan aktif yang terdapat dalam ekstrak biji blustru diduga bahwa bahan aktif tersebut mempunyai respon yang tidak sama terhadap sel-sel dalam tubulus seminiferus.
4.4 Kualitas Spermatozoa
Secara keseluruhan kualitas spermatozoa mencit jantan dewasa meliputi motilitas spermatozoa, viabilitas dan morfologi spermatozoa mencit adalah sebagai berikut:
4.4.1 Motilitas Spermatozoa
Hasil pengamatan konsentrasi motilitas spermatozoa mencit diketahui terbagi dalam 3 kategori. Kategori a (spermatozoa bergerak maju/cepat), kategori b (spermatozoa bergerak tetap/lamban), kategori c (spermatozoa tidak bergerak/mati). Menurut Arsyad & Hayati, (1994), kualitas spermatozoa meliputi beberapa aspek yakni salah satunya motilitas spermatozoa dapat dibagi menjadi tiga kriteria (motilitas baik, motilitas kurang baik, tidak motil).
Gambar 4.4.1 Konsentrasi Motilitas Spermatozoa Mencit Antara Kontrol dan Perlakuan di Setiap Minggu Perlakuan. Huruf yang sama pada grafik berbeda adalah tidak berbeda nyata pada taraf 5%. Kontrol vs perlakuan (tn= p>0,05;
*
= p<0,05; **= p<0,01).Motilitas kategori a. Dari Gambar 4.4.1 di atas, terlihat bahwa adanya pengaruh
pemberian kombinasi TU dan ekstrak air biji blustru. Dengan lamanya waktu pemberian kombinasi TU dan ekstrak air biji blustru menyebabkan penurunan konsentrasi motilitas spermatozoa yakni konsentrasi motilitas maju spermatozoa mencit. Penurunan konsentrasi motilitas spermatozoa kategori a dapat dilihat pada Gambar 4.4.1 dan mengalami peningkatan konsentrasinya pada perlakuan 24 minggu. Data motilitas spermatozoa mencit kategori a dapat dilihat pada Lampiran F. Hasil pengamatan konsentrasi motilitas spermatozoa mencit kategori a setelah dilakukan uji normalitas dan homogenitas varians menunjukkan bahwa data degenerasi tidak berdistribusi normal (p<0,05) dan tidak bervarians homogen (p<0,05). Selanjutnya data tersebut ditransformasi dengan X=1/y uji normalitas terhadap motilitas spermatozoa kategori a yang telah ditransformasi tetap berdistribusi tidak normal
biji blustru. Menurut Alfaina (2002), bahwa dengan adanya senyawa alkaloid menyebabkan menurunnya motilitas dan viabilitas sperma.
Menurut Kong et al, (1985) dalam Nisa (2004), penurunan motilitas spermatozoa kemungkinan disebabkan oleh senyawa alkaloid yang diduga dapat mengganggu aktifitas enzim ATP-ase pada membran sel spermatozoa dibagian tengah ekor. Enzim ATP-ase tersebut berfungsi mempertahankan homeostasis internal untuk ion natrium dan kalium. Jika aktivitas enzim ATP-ase terganggu, maka homeostasis ion natrium dan kalium akan terganggu sehingga konsentrasi Na+ intrasel meningkat, gradien Na+ melintasi membran sel akan menurun sehingga pengeluaran Ca2+ juga akan mengalami penurunan (Ganong, 2001). Apabila ion Ca2+ berkurang maka membran akan kehilangan kemampuannya untuk mengangkut bahan-bahan terlarut ke dalam sitoplasma (Salisbury & Ross, (1985) dalam Haryati (2003)). Dengan terganggunya permeabilitas membran sperma akan menyebabkan terganggunya transpor nutrien yang diperlukan oleh spermatozoa untuk pergerakannya.
Menurut Nurhuda et al, (1995) motilitas spermatozoa dipengaruhi faktor eksternal dan internal. Faktor eksternal meliputi viskositas dan pH media. Sedangkan faktor internal adalah sumber energi (Santa & Soehadi, 1982 dalam Nurhuda et al, (1995). Epididimis merupakan organ yang sangat penting dalam menunjang proses pematangan spermatozoa secara fungsional. Di dalam epididimis ini disekresikan zat-zat yang penting dalam menunjang proses pematangan spermatozoa seperti protein. Secara fungsional epididimis sangat bergantung pada hormon testosteron. Hal ini terbukti dengan banyaknya reseptor hormon ini di dalam sel epididimis baik pada fraksi sitosol ataupun pada inti (West et al, (1971) dalam Nurhuda et al, (1995)). Akibat adanya gangguan kerja hormon testosteron akibat bahan aktif ini maka sekresi protein di dalam lumen epididimis akan berkurang, sehingga proses pematangan spermatozoa dalam epididimis akan terganggu.
Motilitas kategori b. Dari Gambar 4.4.1, terlihat bahwa tidak ada pengaruh
spermatozoa hidup merupakan syarat mutlak bagi spermatozoa untuk dapat menghasilkan energi dan melakukan pergerakan. Semen mamalia yang mempunyai fertilitas tinggi ditunjukkan dengan konsentrasi spermatozoa hidup yang tinggi dengan morfologi normal (Martinez et al, 1996 dalam Aditya, 2006). Motilitas akan berlangsung dengan baik jika ditopang oleh banyak hal diantaranya adalah morfologi dari spermatozoa itu sendiri.
Motilitas kategori c. Dari Gambar 4.4.1, terlihat bahwa adanya pengaruh pemberian
kontrol minggu ke-0 (K0) tidak berbeda terhadap konsentrasi motilitas kategori c mencit perlakuan minggu ke-0 (P0), konsentrasi motilitas kategori c spermatozoa mencit kontrol minggu ke-6 (K1) tidak berbeda konsentrasi motilitas kategori c dengan perlakuan (P1), konsentrasi motilitas kategori c spermatozoa mencit kontrol minggu ke-12 (K2) tidak berbeda konsentrasi motilitas kategori c perlakuan (P2), konsentrasi motilitas kategori c spermatozoa mencit minggu ke-18 (K3) berbeda sangat nyata lebih rendah konsentrasi motilitas kategori c spermatozoa mencit perlakuan minggu ke-18 (P3) dan konsentrasi motilitas kategori c spermatozoa mencit kontrol minggu ke-24 (K4) tidak berbeda konsentrasi motilitas kategori c perlakuan minggu ke-24 (P4). Hubungan lama pemberian kombinasi TU dan ekstrak air biji blustru terhadap konsentrasi motilitas spermatozoa mencit kategori c dapat dilihat pada Gambar 4.4.1.
Pemberian kombinasi TU dan ekstrak air biji blustru yang terus-menerus dapat menyebabkan motilitas mati spermatozoa mencit meningkat. Namun pada minggu ke 24 motilitas spermatozoa kategori c menurun konsentrasinya. Menurut Herrero & Ganong (2001) dalam Tirta (2009), spermatozoa dipengaruhi oleh metabolisme karbohidrat sebagai sumber utama energinya. Penghubung utama antara metabolisme karbohidrat dan motilitas spermatozoa adalah ATP, dimana kandungan ATP spermatozoa berkorelasi positif dengan motilitasnya dan penyediaan ATP sangat tergantung pada metabolisme normal fruktosa. Apabila ATP rendah dan terjadi sejak pembentukan spermatid maka spermatozoa yang terbentuk akan kekurangan energi. Dengan demikian dapat dikatakan bahwa terjadinya peningkatan motilitas spermatozoa disebabkan oleh peningkatan metabolisme karbohidrat oleh epitel epididimis yang berfungsi sebagai tempat pematangan spermatozoa sebelum proses ejakulasi.
4.4.2 Viabilitas Spermatozoa
viabilitas spermatozoa mencit dengan waktu pemberian kombinasi TU dan ekstrak air biji blustru (Gambar 4.4.2).
Dari Gambar 4.4.2, terlihat bahwa adanya pengaruh pemberian kombinasi TU dan ekstrak biji blustru. Dengan lamanya waktu pemberian kombinasi TU dan ekstrak biji blustru mampu menurunkan viabilitas spermatozoa mencit pada minggu ke-18 (K3P3) dan meningkat kembali pada lama pemberian kombinasi pada minggu ke-24 (K4P4) (Gambar 4.4.2).
Gambar 4.4.2 Konsentrasi Viabilitas Spermatozoa Mencit Antara Kontrol dan Perlakuan di Setiap Minggu Perlakuan. Huruf yang sama pada grafik berbeda adalah tidak berbeda nyata pada taraf 5%. Kontrol vs perlakuan (tn= p>0,05;
*
= p<0,05; **= p<0,01).Data pengamatan konsentrasi viabilitas spermatozoa mencit dapat dilihat pada Lampiran G. Hasil pengamatan konsentrasi viabilitas spermatozoa mencit setelah dilakukan uji normalitas dan homogenitas varians menunjukkan bahwa data degenerasi tidak berdistribusi normal (P<0,05) dan tidak bervarians homogen (p<0,05). Selanjutnya data tersebut ditransformasi dengan X= y2. Uji normalitas terhadap konsentrasi viabilitas spermatozoa mencit yang telah ditransformasi tetap berdistribusi tidak normal (p<0,05). Untuk itu dilanjutkan dengan uji nonparametrik Mann-Whitney dan Wilcoxon. Dari hasil tersebut perlakuan yang diberikan adanya pengaruh yang bermakna (p<0,05) dan pengaruh yang lebih bermakna (p<0,01). Dimana konsentrasi viabilitas spermatozoa mencit perlakuan minggu ke-0 (P0) berbeda sangat nyata lebih tinggi terhadap konsentrasi viabilitas spermatozoa mencit
a a
bc
b
cd
*
**
*
perlakuan minggu ke-12, minggu ke-18 dan minggu ke-24 (P2, P3 dan P4). Konsentrasi viabilitas spermatozoa mencit perlakuan minggu ke-6 (P1) berbeda sangat nyata lebih tinggi terhadap konsentrasi viabilitas spermatozoa mencit perlakuan minggu ke-12, minggu ke-18 dan minggu ke-24 (P2, P3 dan P4). Konsentrasi viabilitas spermatozoa mencit perlakuan minggu ke-18 (P3) berbeda nyata lebih rendah terhadap konsentrasi viabilitas spermatozoa mencit perlakuan minggu ke-24 (P4). Dengan kata lain lama waktu pemberian kombinasi TU dan ekstrak air biji blustru memberikan pengaruh terhadap konsentrasi viabilitas spermatozoa mencit. Hasil uji statistik juga memperlihatkan konsentrasi viabilitas spermatozoa mencit kontrol minggu ke-0 (K0) tidak berbeda terhadap konsentrasi viabilitas spermatozoa mencit perlakuan (P0), konsentrasi viabilitas spermatozoa mencit kontrol minggu ke-6 (K1) tidak berbeda terhadap konsentrasi viabilitas spermatozoa mencit perlakuan minggu ke-6 (P1), konsentrasi viabilitas spermatozoa mencit kontrol minggu ke-12 (K2) berbeda nyata lebih tinggi terhadap konsentrasi viabilitas spermatozoa mencit perlakuan (P2), konsentrasi viabilitas spermatozoa mencit kontrol minggu ke-18 (K3) berbeda sangat nyata terhadap konsentrasi viabilitas spermatozoa mencit perlakuan minggu 18 (P3) dan konsentrasi viabilitas spermatozoa mencit kontrol minggu ke-24 (K4) berbeda nyata lebih tinggi terhadap konsentrasi viabilitas spermatozoa mencit perlakuan minggu ke-24 (P4). Hubungan lama pemberian kombinasi TU dan ekstrak air biji blustru terhadap viabilitas spermatozoa mencit dapat dilihat pada Gambar 4.4.2.
balik negatif ke hipofisis anterior, yaitu tidak melepaskan FSH dan LH. Penurunan kadar LH menyebabkan gangguanterhadap sekresi testosteron oleh sel Leydig.
Hal ini didukung penelitian yang dilakukan oleh Ashok dan Meenakshi (2004)
dalam Elfira et al, (2010), terhadap tikus putih yang diberi ekstrak kunyit (Curcuma
longa L.), kandungan flavonoid pada kunyit dapat menyebabkan terganggunya sekresi
hormon testosteron. Sehingga dengan adanya penurunan sekresi hormon testosteron akan mengakibatkan kelangsungan hidup spermatozoa di dalam epididimis mengalami penurunan. Terganggunya permeabilitas membran sperma oleh senyawa alkaloid yang terkandung pada rimpang temu putih juga dapat menyebabkan penurunan spermatozoa yang hidup, yang berakibat mengganggu transpor nutrien yang diperlukan spermatozoa untuk daya tahan hidupnya. Sehingga pemberian ekstrak temu
putih selama 35 hari dapat menyebabkan terjadinya penurunan motilitas dan viabilitas spermatozoa mencit.
4.4.3 Morfologi Spermatozoa
Hasil konsentrasi morfologi spermatozoa mencit jantan yang dilakukan diperoleh data yang dapat dilihat pada Tabel konsentrasi morfologi normal spermatozoa mencit (Lampiran H, hal. 77). Sehingga dapat diperjelas dalam bentuk grafik hubungan antara konsentrasi morfologi spermatozoa mencit dengan waktu pemberian kombinasi TU dan ekstrak air biji blustru.