UJI EFEK HIPOGLIKEMIK RENDAMAN BERAS KETAN HITAM PADA TIKUS BETINA YANG DIBEBANI GLUKOSA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh : Maria Riaswati NIM : 058114077
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
UJI EFEK HIPOGLIKEMIK RENDAMAN BERAS KETAN HITAM PADA TIKUS BETINA YANG DIBEBANI GLUKOSA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh : Maria Riaswati NIM : 058114077
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
HALAMAN PERSEMBAHAN
Orang bijak akan selalu bertanya
Orang pintar selalu menjawab semua pertanyaan
Ada empat hal yang tidak bisa kembali dalam hidup manusia :
Batu ketika sudah dilempar, Waktu ketika sudah dilewatkan, Kesempatan ketika sudah hilang, Perkataan ketika sudah terucapkan. (Romo Rudi, OMI)
Karya ini ku persembahkan untuk:
Pelindungku Bunda Maria dan Yesus Kristus yang telah memberikan rahmat berlimpah dan menjadikan semua yang diciptakannya begitu indah
vi PRAKATA
Puji syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas kasih dan penyertaan yang diberikan hingga penulis dapat menyelesaikan skripsi dengan judul “Uji Efek Hipoglikemik Rendaman Beras Ketan Hitam pada Tikus Betina yang Dibebani Glukosa”. Skripsi ini ditulis sebagai salah satu syarat memperoleh gelar sarjana Farmasi di Universitas Sanata Dharma.
Penulis menyadari penulisan skripsi ini tidak mungkin terwujud tanpa bimbingan, bantuan dan pengarahan berbagai pihak. Pada kesempatan ini penulis menghaturkan banyak terima kasih dan penghargaan kepada:
1. Bapak Drs. Mulyono, Apt selaku pembimbing utama, inspirator dan dosen penguji yang selalu memberikan masukan dan semangat hingga terselesaikannya skripsi ini.
2. Dr. Lusiana Kuswibawati, M.Kes. selaku dosen penguji yang telah memberikan saran dalam penulisan skripsi ini.
3. Ipang Djunarko, S.Si, Apt. selaku dosen penguji yang telah memberikan saran dalam penulisan skripsi ini.
4. Bapak Yohanes Dwiatmaka, M.Si sebagai pimpinan laboratorium Farmasi yang telah memberikan izin penggunaan semua fasilitas laboratorium untuk penelitian skripsi ini.
vii
6. Bapak (Yohanes Edi Daru P.) dan mamak (Yustina Tri Andari) atas semua doa, kasih sayang dan pendampingan yang tiada habisnya.
7. Mbak Anggar dan Mas Karlin, adikku Bram dan Agri yang selalu memberi semangat dan penyegaran ketika semangat mulai turun.
8. Mbak Asih sahabat terbaikku, pendengar yang baik dan sang pemberi solusi. 9. Teman terbaikku, Virginia Permatasari yang selalu setia mendampingi tanpa
pamrih selama penelitian dan penulisan skripsi ini. 10.Mbak Gayatri yang sering bareng memberi makan tikus. 11.Lina Chang dan Felisia tempat diskusi dan mencari solusi.
12.Diana Erosita dengan penuh semangat mau ikut ke laboratorium hayati Imono.
13.Teman-teman seperantauan Weni, Darti dan semua warga Flamboyan tempat curhat dan menghibur diri.
14.Teman teman KMPKS Voice yang membuat jiwaku bernyanyi, segar dan bahagia.
15.Staf keamanan kampus III Paingan yang selalu siap direpotkan. 16.Romo Sunu SJ atas segala bantuan dan masukannya.
17.Bapak Aris yang telah memperkenalkan statistika yang sangat berguna dalam penelitian ini.
18.Serta semua pihak yang tidak bisa disebutkan satu per satu
viii
Bak kata pepatah Tiada Gading yang Tak Retak, penulis menyadari karya ini jauh dari kesempurnaan. Oleh karena itu, penulis membuka diri untuk segala masukan, saran dan kritik membangun demi perbaikan penulisan skripsi ini. Penulis berharap hasil penelitian ini bermanfaat bagi perkembangan ilmu farmasi di bidang eksplorasi bahan alam dan obat tradisional dan bagi masyarakat khususnya mereka yang menderita diabetes melitus.
Yogyakarta, Desember 2008
x DAFTAR ISI
HALAMAN JUDUL ... HALAMAN PERSETUJUAN PEMBIMBING ... HALAMAN PENGESAHAN ... HALAMAN PERSEMBAHAN ... PRAKATA ... PERNYATAAN KEASLIAN PENELITIAN ... DAFTAR ISI ... 1. Perumusan masalah ... 2. Keaslian penelitian ... 3. Manfaat penelitian
a. Manfaat teoritis ... b. Manfaat praktis ... B. Tujuan Penelitian ...
xi BAB II. PENELAAHAN PUSTAKA
A. Diabetes Melitus ... B. Metabolisme Karbohidrat ... C. Beras Ketan Hitam ... D. Metode Penetapan Kadar Glukosa
dalam Darah ... E. Obat Antidiabetes Oral... F. Landasan Teori ... G. Hipotesis ...
BAB III. METODE PENELITIAN
A. Jenis dan Rancangan Penelitian ... B. Variabel dan Definisi Operasional
1. Variabel penelitian ... 2. Definisi operasional ... C. Bahan Penelitian ... D. Alat Penelitian ... E. Tata Cara Penelitian
1. Pembuatan glukosa monohidrat 15%b/v ... 2. Pembuatan CMC Na 1%b/v ... 3. Penentuan keseragaman bobot tablet glibenklamid ... 4. Pembuatan suspensi glibenklamid 5 mg%b/v ... 5. Penentuan dosis glibenklamid ...
xii
6. Penentuan waktu serapan stabil/operating time ... 7. Penentuan panjang gelombang serapan maksimum ... 8. Pembuatan persamaan kurva baku ... 9. Penentuan waktu pemberian Glibenklamid ... 10.Pembuatan rendaman beras ketan hitam ... 11.Perlakuan terhadap hewan uji ... 12.Penetapan kadar glukosa darah ... F. Analisis Data ...
BAB IV. HASIL DAN PEMBAHASAN
A. Penentuan Waktu Serapan Stabil ... B. Penetapan Panjang Gelombang
Serapan Maksimum ... C. Persamaan Kurva Baku ... D. Reaksi Pembentukan Warna ... E. Penentuan Waktu Pemberian Glibenklamid ... F. Efek Hipoglikemik
Rendaman Beras Ketan Hitam ...
BAB V. KESIMPULAN DAN SARAN
xiii
DAFTAR PUSTAKA ... LAMPIRAN ... BIOGRAFI ...
49 52 67
xiv
DAFTAR TABEL
Tabel I. Persyaratan Keseragaman Bobot Tablet
Menurut Farmakope Indonesia III ... 23 Tabel II. Data Penetapan Waktu Serapan Stabil
Glukosa Monohidrat ... 30 Tabel III. Hasil Pengukuran Kadar Seri Kurva Baku ... 33 Tabel IV. Pengaruh waktu pemberian glibenklamid 0,45 mg/kg BB
terhadap persentase penurunan LDDK0-300 glukosa darah UTGO tikus ... 35
Tabel V. Rata-rata kadar glukosa darah tikus (mg/dL) terhadap waktu (menit) setelah perlakuan Kontrol negatif (Air suling),kontrol positif
(Glibenklamid), rendaman Beras Ketan Hitam 15;30; dan 60 g
yang ditambahkan 100 ml air suling ... 37
Tabel VI. LDDK0-300 (menit.mg/dL) pada pemberian air suling ... 39 Tabel VII. LDDK0-300 (menit.mg/dL) pada pemberian Glibenklamid
dosis 0,45 mg/Kg BB ... 39
Tabel VIII. LDDK0-300 (menit.mg/dL) pada pemberian rendaman beras ketan hitam konsentrasi 15 g dalam 100 ml air suling... 40 Tabel IX. Kadar glukosa darah tikus pada pemberian rendaman
xv
Tabel X. LDDK0-300 (menit.mg/dL) pada pemberian rendaman
beras ketan hitam konsentrasi 60 g ditambah 100 ml air suling ... 41 Tabel XI. Rata-rata LDDK0-300 pada perlakuan air suling,
Glibenklamid, Rendaman Beras Ketan Hitam
konsentrasi 15%; 30% dan 60% b/v ... 41 Tabel XII. Nilai Luas Daerah di Bawah Kurva (LDDK)0-300
dan persentase penurunan kadar glukosa darah (PKGD
terhadap kontrol air suling ... 43 Tabel XIII. Uji Distribusi Normal Sampel LDDK0-300 ... 43 Tabel XIV. Hasil Uji Post Hoc Antar Kelompok Perlakuan
xvi
DAFTAR GAMBAR
Gambar 1. Pengaruh peningkatan beban metabolik
akibat nutrisi berlebih dan penurunan aktivitas ... 8
Gambar 2. Mekanisme apoptosis sel beta pada patogenesis diabetes melitus tipe 2 ... 9
Gambar 3. Metabolisme karbohidrat ... 12
Gambar 4. Struktur umum golongan sulfonilurea ... 16
Gambar 5. Struktur umum golongan biguanid ... 16
Gambar 6. Kurva hubungan antara waktu inkubasi dan absorbansi glukosa monohidrat ... 31
Gambar 7. Kurva hubungan antara panjang gelombang dan absorbansi ... 32
Gambar 8. Kurva hubungan korelasi antara kadar glukosa monohidrat (mg/dL) vs absorbansi ... 33
Gambar 9. Profil rata-rata kadar glukosa darah vs. Waktu setelah perlakuan kontrol negatif (air suling),kontrol positif (Glibenklamid), Rendaman Beras Ketan Hitam konsentrasi 15; 30; 60 g dalam 100 ml air suling... 38
xvii
DAFTAR LAMPIRAN
Lampiran 1. Keseragaman Bobot Tablet Glibenklamid ... 52
Lampiran 2. Pengukuran Waktu Serapan Stabil/Operating Time ... 53
Lampiran 3. Penetapan Panjang Gelombang Serapan Maksimum ... 54
Lampiran 4. Penimbangan Bahan ... 55
Lampiran 5. Data Penentuan Waktu Pemberian Glukosa Monohidrat ... 56
Lampiran 6. Data kadar glukosa darah dan hasil perhitungan Luas Daerah di Bawah Kurva (LDDK)0-300 ... 58
xviii INTISARI
Beras ketan hitam merupakan salah satu bahan pangan kaya nutrisi dan mengandung komponen kimia alami seperti protoantosianidin, antosianidin, flavonoid, isoflavon, tokostienol, dan fitosterol. Warna hitam pada ketan hitam diakibatkan kandungan antosianin yang tinggi. Saat ini, secara empiris rendaman ketan hitam digunakan dalam pengobatan diabetes. Penelitian ini bertujuan untuk memperoleh informasi mengenai efek hipoglikemik dari rendaman ketan hitam.
Penelitian ini merupakan penelitian eksperimental dengan rancangan acak lengkap pola searah menggunakan tikus Wistar betina umur 2,5-3,5 bulan, berat 150 – 200 g. Pengujian hipoglikemik rendaman beras ketan hitam dilakukan dengan metode uji toleransi glukosa oral, cuplikan darah akan diambil pada menit ke-0, 15, 30, 60, 90, 120, 180, 240 dan 300 setelah pemberian glukosa oral. Kadar glukosa darah akan ditetapkan dengan metode enzimatis menggunakan enzim GOD PAP “Diasys”. Luas Daerah di Bawah Kurva (LDDK)0-300 diperoleh dengan metode Trapezoid lalu dianalisis menggunakan uji statistik ANOVA satu arah dan kemudian dilanjutkan dengan uji Post Hoc Tuckey dengan taraf kepercayaan 95 %.
Hasil penelitian menunjukkan bahwa Rendaman beras ketan hitam dengan berat 15; 30; dan 60 g yang ditambahkan 100 ml air suling mampu menurunkan secara signifikan (p<0,05) kadar glukosa darah berturut–turut 24,97 %; 44,71%; dan 51,59% pada tikus betina yang dibebani glukosa.
Kata kunci : rendaman beras ketan hitam, hipoglikemik, glukosa oral dan metode GOD PAP
Yogyakarta ,...
xix ABSTRACT
Black glutinous rice is one of nutritious food contain of natural chemical component such as protoanthocyanidin, anthocyanidin, flavonoids, isoflavon, tikostineol and fitosterol. The higher level of anthocyanin in Black glutinous rice make it has a black color. Today, empirically the submerged of Black glutinous rice use in treat of diabetes mellitus. This research has been performed to obtain information on the hypoglycemic effect of submerged of Black glutinous rice.
This study is an experimental research with the one-way complete randomized design use Wistar female rats, aged 2,5-3,5 month, weight 150-200 g. The submerged of Black glutinous rice had been tested using oral glucose tolerance test, the submerged samples take on minutes 0, 15, 30, 60, 90, 120, 180, 240 and 300 after giving oral glucose. The blood glucose level determines with enzymatic method use GOD PAP “Diasys”. The Area Under Curve (AUC)0-300 was determinated with Trapezoid method, after that it was analyzed using the one way ANOVA with 95% significance level continued using Post Hoc Tuckey.
1 BAB I
PENGANTAR
A. Latar Belakang
Globalisasi telah berkembang dengan pesat dan mempengaruhi hidup masyarakat. Pola makan yang kurang sehat seperti makanan cepat saji yang kurang serat dan kaya kolesterol, minuman dengan bahan pewarna dan pengawet dapat memicu timbulnya berbagai penyakit salah satunya diabetes melitus.
Diabetes melitus merupakan suatu penyakit yang ditandai dengan kadar glukosa dalam darah lebih dari normal. Menurut kriteria diagnostik Perkumpulan Endokrinologi Indonesia (PERKENI), seseorang dikatakan menderita diabetes jika memiliki kadar gula darah puasa lebih dari 126mg/dL dan pada tes sewaktu lebih dari 200 mg/dL(Soegondo, 2006). Diabetes melitus dapat menyebabkan komplikasi terhadap organ lain, misalnya gangguan pada retina dan ginjal, kerusakan saraf perifer, dan mendorong terjadinya penyakit aterosklerosis pada jantung, kaki dan otak.
Susilowati dan Amiruddin (2008) menyatakan bahwa risiko diabetes melitus meningkat dengan adanya faktor risiko berupa obesitas, hipertensi, kolesterol tinggi, stres serta riwayat diabetes dalam keluarga.
Dalam penanggulangan penyakit diabetes melitus, obat hanya merupakan pelengkap diet dan hanya diberikan apabila pengaturan diet secara maksimal tidak mengendalikan kadar gula darah (Agoes, 1991). Obat hipoglikemik oral dapat menyebabkan efek samping diantaranya prevalensi kematian tinggi untuk glibenklamid yang diberikan pada pasien diabetes melitus dengan penyakit kardiovaskuler, efek diuretik dijumpai pada klorpropamid, acetohexamide, tolazamide dan gliburide (Ediningsih, 2006).
Beras ketan hitam merupakan salah satu bahan pangan kaya komponen kimiawi dan manfaat bagi kesehatan. Akhir-akhir ini rendaman beras ketan hitam secara empiris digunakan masyarakat dalam pengobatan diabetes melitus. Penelitian menyatakan pigmen pada beras ketan hitam berperan dalam pencegahan pengerasan pembuluh nadi, pengobatan pada tekanan darah tinggi dan masalah ginjal. Untuk membuktikan rendaman beras ketan hitam memiliki aktivitas hipoglikemik, maka perlu dilakukan penelitian mengenai efek tersebut pada hewan uji.
1. Perumusan masalah
3
diabetes melitus tipe 2 yang ditandai dengan penurunan kadar glukosa setelah Uji Toleransi Glukosa Oral (UTGO)?
Permasalahan kedua yang ingin diketahui adalah apakah dengan meningkatnya berat beras ketan hitam yang direndam dengan menambahkan 100 ml air suling akan meningkatkan aktivitasnya dalam menurunkan kadar glukosa darah?
2. Keaslian penelitian
Sejauh penelusuran penulis di perpustakaan Universitas Sanata Dharma, penelitian mengenai uji efek hipoglikemik rendaman beras ketan hitam pada tikus betina yang dibebani glukosa belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian mengenai uji efek hipoglikemik rendaman beras ketan hitam diharapkan dapat memberikan manfaat untuk mengembangkan ilmu pengetahuan tentang obat bahan alam sebagai alternatif dalam penanggulangan penyakit diabetes melitus.
B. Tujuan Penelitian
5 BAB II
PENELAAHAN PUSTAKA
A. Diabetes Melitus
Diabetes melitus, penyakit gula, atau penyakit kencing manis diketahui sebagai suatu penyakit yang disebabkan oleh adanya gangguan menahun terutama pada sistem metabolisme karbohidrat, lemak, dan juga protein dalam tubuh (Lanywati, 2001). Dalam keadaan normal, kira-kira 50% glukosa yang dimakan mengalami metabolisme sempurna menjadi karbondioksida dan air, 5% diubah menjadi glikogen dan kira-kira 30-40% diubah manjadi lemak (Suharto dan Handoko, 1999). Gangguan metabolisme karbohidrat disebabkan kurangnya produksi insulin yang diperlukan dalam proses pengubahan gula menjadi tenaga serta sintesis lemak (Lanywati, 2001).
lebih dari 11,1 mmol/L setelah pemberian glukosa oral 75 g ( Rubenstein, Wayne, and Bradley, 2007).
Menurut Lanywati (2001), gejala khas dan klasik pada penyakit diabetes melitus yaitu poliuria, polidipsi dan polipagio.
1. Poliuria (banyak kencing), merupakan gejala umum pada penderita diabetes melitus. Hal ini disebabkan kadar glukosa darah berlebihan, sehingga merangsang tubuh untuk mengeluarkannya melalui ginjal bersama air dan kencing. Gejala ini umumnya terjadi pada malam hari.
2. Polidipsi (banyak minum), merupakan reaksi tubuh akibat banyaknya pengeluaran urin. Untuk menghindari tubuh kekurangan cairan, maka secara otomatis pada penderita akan timbul rasa haus yang menyebabkan timbulnya keinginan untuk minum selama kadar glukosa darah belum terkontrol.
3. Polipagio (banyak makan), terjadi akibat berkurangnya kadar glukosa dalam tubuh meskipun kadar glukosa dalam darah tinggi. Hal ini terjadi karena tubuh berusaha memperoleh tambahan cadangan gula yang berasal dari makanan.
Gejala yang umumnya tampak pada penderita diabetes melitus adalah sebagai berikut
1. adanya perasaan haus yang terus-menerus 2. sering buang air kecil dan dalam jumlah banyak
3. timbul rasa letih yang tidak dapat dijelaskan penyebabnya 4. timbulnya rasa gatal dan peradangan kulit yang menahun
7
2. timbulnya rasa kesemutan/ mati rasa atau sakit pada tangan atau kaki 3. timbulnya luka pada kaki yang tidak kunjung sembuh
4. hilangnya kesadaran diri
(Lanywati, 2001) Hasil penelitian pada tahun 2001 menunjukkan bahwa diabetes melitus tidak hanya disebabkan oleh faktor keturunan (genetik), tetapi juga dipengaruhi oleh beberapa faktor yang multi-kompleks, antara lain kebiasaan hidup dan lingkungan. Kebiasaan hidup misalnya makan yang berlebihan yang menyebabkan kelenjar pankreas harus bekerja lebih keras dalam memproduksi hormon insulin. Jika suatu saat pankreas sudah tidak mampu lagi memenuhi kebutuhan insulin maka glukosa tidak dapat terolah dan masuk ke dalam darah serta urin (Lanywati, 2001).
Menurut Katzung (2002), diabetes melitus dapat diklasifikasikan menjadi empat jenis, yaitu
1. diabetes melitus tipe 1
2. diabetes melitus tipe 2
Diabetes melitus tipe 2 biasanya dialami oleh orang dewasa yang menderita obesitas. Diabetes melitus tipe ini biasanya terjadi akibat resistensi insulin maupun disfungsi sel beta (Lina dan Wijaya, 2005). Resistensi insulin ditunjukkan dengan meningkatnya lipolisis dan produksi asam lemak bebas, peningkatan produksi glukosa hepar, dan penurunan pengambilan glukosa oleh otot (Dipiro at al, 2003). Menurut Lina dan Wijaya (2005), disfungsi sel beta bisa terjadi melalui mekanisme-mekanisme sebagai berikut
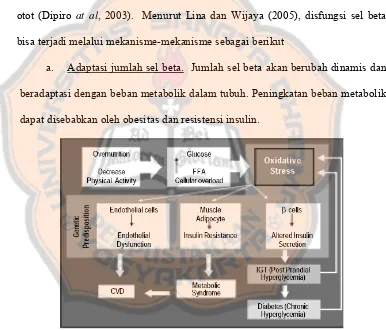
a. Adaptasi jumlah sel beta. Jumlah sel beta akan berubah dinamis dan beradaptasi dengan beban metabolik dalam tubuh. Peningkatan beban metabolik dapat disebabkan oleh obesitas dan resistensi insulin.
Gambar 1. Pengaruh peningkatan beban metabolik akibat nutrisi berlebih dan penurunan aktivitas (Indriyanti, 2005)
9
jumlah islet dapat menurun (akibat timbulnya plak amiloid) dan dapat berubah bentuk.
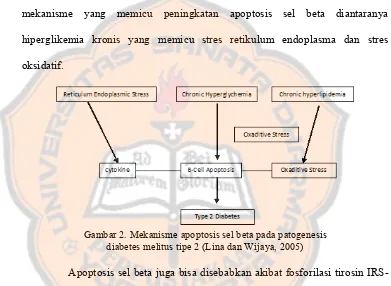
b. Apoptosis sel beta. Apoptosis adalah bentuk kematian sel pada organisme multiseluler yang terjadi saat pergantian sel, perubahan jaringan dan pembuangan sel-sel mati. Selama patogenesis diabetes melitus tipe 2, terdapat mekanisme yang memicu peningkatan apoptosis sel beta diantaranya hiperglikemia kronis yang memicu stres retikulum endoplasma dan stres oksidatif.
Gambar 2. Mekanisme apoptosis sel beta pada patogenesis diabetes melitus tipe 2 (Lina dan Wijaya, 2005)
Apoptosis sel beta juga bisa disebabkan akibat fosforilasi tirosin IRS-2 (Insulin Receptor Substrate IRS-2) yang mengakibatkan peningkatan pertumbuhan dan pertahanan sel beta. Selain itu, IRS-2 juga merupakan bagian untuk fosforilasi serin/threonin yang dapat memberikan efek negatif dari transduksi sinyal IRS yang memicu degradasi IRS akibatnya pertumbuhan sel beta menjadi terhambat yang pada akhirnya menyebabkan kematian sel beta.
regulator sekresi insulin dalam sel beta pankreatik dan juga memicu meningkatnya produksi superoksida melalui rantai transfer elektron. Pembentukan superoksida merupakan suatu hasil dari respirasi seluler mitokondrial akibat terbentuknya elektron yang tidak berpasangan. Elektron tidak berpasangan ini akan bereaksi dengan oksigen membentuk ion superoksida yang merupakan radikal bebas yang sangat reaktif. USP2 yang teraktivasi akan menjadi sarana keluarnya proton yang akan mengganggu proses GSIS (Glucose Stimulated Insulin Secretion) sehingga menurunkan produksi ATP dari glukosa. 3. diabetes gestational
Diabetes melitus tipe ini terjadi pada wanita yang sedang hamil. Biasanya timbul pada trimester kedua (minggu 24-28) dan akan berakhir pada saat bayi lahir. Diabetes ini disebabkan karena tubuh penderita tidak dapat menggunakan glukosa dalam darah dengan normal sehingga kadar glukosa dalam darah lebih tinggi dari seharusnya.
11
B. Metabolisme Karbohidrat
Karbohidrat merupakan senyawa yang terbentuk dari molekul karbon, hidrogen dan oksigen. Sebagai salah satu jenis zat gizi, fungsi utama karbohidrat adalah penghasil energi di dalam tubuh (Irawan, 2007). Karbohidrat akan mengalami proses pencernaan dalam mulut, lambung dan usus menjadi monosakarida. Sebagian besar karbohidrat yang terdapat dalam makanan akan membentuk glukosa, galaktosa ataupun fruktosa setelah dicerna. Senyawa-senyawa ini lalu diangkut ke hepar melalui vena porta hati. Di dalam hati, galaktosa dan fruktosa segera diubah manjadi glukosa (Murray, Granner, Mayes and Rodwell, 2000).
Di dalam tubuh, karbohidrat yang telah terkonversi menjadi glukosa tidak hanya akan berfungsi sebagai sumber energi utama bagi kontraksi otot atau aktivitas fisik tubuh, namun glukosa juga berfungsi sebagai sumber energi bagi sistem saraf pusat termasuk juga untuk kerja otak. Selain itu, karbohidrat yang dikonsumsi juga dapat tersimpan sebagai cadangan energi dalam bentuk glikogen di dalam otot dan hati. Glikogen otot merupakan salah satu sumber energi tubuh saat sedang berolahraga sedangkan glikogen hati dapat berfungsi untuk membantu menjaga ketersediaan glukosa di dalam sel darah dan sistem saraf pusat (Irawan, 2007).
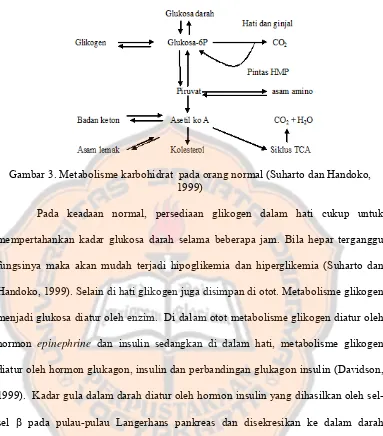
Gambar 3. Metabolisme karbohidrat pada orang normal (Suharto dan Handoko, 1999)
Pada keadaan normal, persediaan glikogen dalam hati cukup untuk mempertahankan kadar glukosa darah selama beberapa jam. Bila hepar terganggu fungsinya maka akan mudah terjadi hipoglikemia dan hiperglikemia (Suharto dan Handoko, 1999). Selain di hati glikogen juga disimpan di otot. Metabolisme glikogen menjadi glukosa diatur oleh enzim. Di dalam otot metabolisme glikogen diatur oleh hormon epinephrine dan insulin sedangkan di dalam hati, metabolisme glikogen diatur oleh hormon glukagon, insulin dan perbandingan glukagon insulin (Davidson, 1999). Kadar gula dalam darah diatur oleh hormon insulin yang dihasilkan oleh sel-sel β pada pulau-pulau Langerhans pankreas dan disekresikan ke dalam darah sebagai reaksi terhadap keadaan hiperglikemia (Murray dkk, 2000).
C. Beras Ketan Hitam
13
aktivitas farmakologi salah satunya adalah aktivitasnya sebagai antioksidan (Aligita, 2007).
Penelitian di China menunjukkan beras ketan hitam itu mempunyai khasiat menyembuhkan berbagai penyakit. Beras ketan hitam saat ini digunakan sebagai obat dan bahan pangan, kadar vitamin, mikroelemen dan asam amino dari beras ketan hitam semuanya lebih tinggi daripada beras biasa. Pigmen pada beras ketan hitam kaya akan aktif flavonoid dan kadarnya lima kali lipat dari pada beras putih dan berperan sangat besar bagi pencegahan pengerasan pembuluh nadi (Anonim, 2008b).
mengatur aktivitas dan/ekspresi enzim yang terlibat dalam jalur metabolisme karbohidrat.
D. Metode Penetapan Kadar Glukosa dalam Darah
Menurut Widowati (1997), secara umum metode penentuan glukosa darah dapat dilakukan dengan beberapa cara yaitu
1. Metode kondensasi gugus amin
Prinsip dari metode ini adalah terjadinya kondensasi aldosa dengan orto toluidin dalam suasana asam dan akan menghasil larutan berwarna hijau
setelah dipanaskan. Penetapan kadar glukosa ditentukan dengan metode spektrofotometri sesuai dengan intensitas warna yang terjadi.
2. Metode reduksi
Prinsip metode ini adalah dengan reaksi oksidasi reduksi menggunakan suatu oksidan ferisianida. Adanya glukosa dalam darah akan mereduksi ferisianida menjadi ferosianida suasana basa dan dengan pemanasan. Kemudian kelebihan garam feri akan dititrasi secara iodometri.
3. Metode pemisahan glukosa
15
4. Metode enzimatik
Penetapan kadar glukosa dapat ditentukan secara enzimatik, rnisalnya dengan penambahan enzim glukosa oksidase (GOD). Dengan adanya oksigen atau udara, glukosa dioksidasi dengan dikatalisis oleh enzim menjadi asam glukonat disertai pembentukan H2O2. Dengan adanya enzim fenoaminoantipirin
peroksidase, H2O2 akan membebaskan O2 yang mengoksidasi akseptor
kromogen yang sesuai serta memberikan warna yang sesuai pula. Penetapan kadar glukosa darah dilakukan berdasarkan intensitas warna yang terjadi dan diukur intensitasnya secara spektrofotometri (Anonim, 2008c).
Pada penelitian ini penetapan kadar glukosa dilakukan dengan metode enzimatik. Enzim biasa digunakan untuk menganalisis suatu bahan dalam suatu campuran. Metode enzimatik merupakan metode yang spesifik, reprodusibel, sensitif, cepat, dan ideal untuk tujuan analisis. Metode enzimatis memiliki sensitifitas dan spesifisitas tinggi sehingga analisis kuantitatif suatu komponen dalam sampel yang kompleks dengan sedikit atau tanpa preparasi dapat dilakukan (Anonim, 2008c).
E. Obat Antidiabetes Oral
Dipiro, Wells dan Schwinghammer (2003) mengelompokkan obat antidiabetes oral menjadi tiga golongan yaitu
1. Golongan sulfonilurea
R1
Gambar 4. Struktur umum golongan sulfonilurea (Ediningsih, 2006) Golongan sulfonilurea utamanya bekerja dengan merangsang sekresi insulin di pankreas selain itu golongan sulfonilurea memiliki efek regulasi terhadap reseptor-reseptor insulin di jaringan sehingga akan memperbesar kepekaan jaringan terhadap insulin (Ediningsih, 2006). Terdapat dua golongan sulfonilurea yaitu generasi pertama (asetohexamide, clorpropamide, talozamide dan tolbutamid) dan generasi kedua (glimepiride, glipizide, glibenklamid, dan gluburide).
Antidiabetes oral golongan sulfonilurea biasanya digunakan pada pasien yang kurus karena obat ini cenderung meningkatkan berat badan. Efek samping obat ini adalah gejala saluran cerna, sakit kepala, dan hipoglikemia yang dapat terjadi tanpa gejala khas (Tjay dan Rahardja, 2002).
2. Golongan biguanid
H2N C C R
NH NH
R
17
Golongan biguanid bekerja dengan meningkatkan sensitifitas terhadap insulin yang terdapat pada sel hati dan otot yaitu golongan biguanid dan tiazolidindion. Suharto dan Hartono (1999) menyatakan golongan biguanid secara in vitro merangsang glikolisis anaerob dan peristiwa itu memungkinkan glukosa lebih banyak masuk ke sel otot. Agoes (1991) menyatakan ada tiga jenis obat golongan ini yaitu metformin, buformin dan fenformin. Namun yang digunakan saat ini adalah metformin karena dua jenis yang lain memiliki efek samping asidosis laktat yang dapat menyebabkan kematian.
3. Penghambat kerja enzim α-glukosidase
Obat yang masuk golongan ini seperti acarbose dan miglitol. Obat-obat ini akan bekerja dengan mengambat enzim α-glukosidase di usus dalam penyerapan amilum. Dengan penghambatan enzim tersebut maka reaksi penguraian polisakarida menjadi monosakarida juga terhambat sehingga glukosa yang dilepaskan lebih lambat dan kecepatan absorspsi ke dalam darah juga berkurang.
F. Landasan Teori
Beras ketan hitam memiliki kandungan alami di antaranya antosianin, protoantosianidin, antosianidin, flavonoid, isoflavon, tokostienol, dan fitosterol. Adanya kandungan antosianin pada beras ketan hitam memungkinkan beras ketan hitam memiliki efek dalam menurunkan kadar glukosa dalam darah.
G. Hipotesis
19 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental dengan menggunakan pola rancangan acak lengkap searah.
B. Variabel dan Definisi Operasional
1. Variabel penelitian
Variabel utama pada penelitian ini adalah berat beras ketan hitam yang ditambahkan dalam 100 ml air suling dan Luas Daerah di Bawah Kurva (LDDK) pada menit ke-0 sampai 300 (Ambarwati, 2002).
a. Variabel bebas.
Variabel bebas dalam penelitian ini adalah berat ketan hitam yang ditambahkan dalam 100 ml air suling. Berat yang digunakan dalam penelitian ini adalah 15 g; 30 g; dan 60 g.
b. Variabel tergantung.
Variabel tergantung adalah Luas Daerah di Bawah Kurva (LDDK) pada rentang waktu menit ke- 0 sampai menit ke 300.
c. Variabel pengacau terkendali.
Umur hewan uji : 2,5 – 3,5 bulan Berat badan : 150-200 g
Galur : Wistar
d. Variabel pengacau tak terkendali
Variabel pengacau tak terkendali dalam penelitian ini adalah kondisi patofisiologi hewan uji.
2. Definisi operasional a. Sampel uji
Sampel uji adalah rendaman beras ketan hitam yang merupakan hasil rendaman beras ketan hitam selama 30 menit dalam 100 ml air suling lalu disaring untuk memisahkan butiran beras ketan hitam dan air rendaman. b. Diabetes Melitus Tidak Tergantung Insulin (DMTTI)
Diabetes melitus tipe ini terjadi akibat tubuh tidak memproduksi insulin dalam jumlah cukup untuk mengolah glukosa. Kenaikan kadar glukosa diinduksi dengan cara pemberian glukosa monohidrat 1,75 g/ Kg BB. c. Luas Daerah di Bawah Kurva (LDDK)
21
C. Bahan Penelitian
1. Hewan uji
Hewan uji yang digunakan adalah tikus berjenis kelamin betina galur Wistar yang berumur 2,5–3,5 bulan, berat badan 150-200 g dengan kondisi sehat. Hewan uji diperoleh dari Laboratorium Hayati Imono Fakultas Farmasi Universitas Sanata Dharma. Banyaknya hewan uji adalah 5 ekor untuk setiap perlakuan.
2. Bahan uji
Bahan uji adalah beras ketan hitam yang diperoleh di salah satu supermarket di Yogyakarta dengan merek Delanggu.
3. Pereaksi Glukosa Oksidase Peroksidase (GOD-PAP) “Diasys”
Pereaksi GOD-PAP berisi bahan-bahan sebagai berikut yaitu: Bufer fosfat pH 7,5 250 mmol/L, Fenol 5 mmol/L, 4-aminoantipirin 0,5 mmol/L, glukosa oksidase lebih dari 10 kU/L dan Peroksidase lebih dari 1 kU/L. 4. Lain-lain
a. Inviclot® Heparin Sodium (Fahrenheit) 5000 IU/ mL sebagai antikoagulan saat pengambilan darah.
b. Glukosa monohidrat p.a (E. Merck) sebagai standar dan larutan baku c. Air suling yang berasal dari laboratorium Farmakologi Universitas Sanata
Dharma.
D. Alat Penelitian
Alat- alat yang digunakan pada penelitian ini adalah sebagai berikut 1. spektrofotometer UV-Vis merek OPTIMA SP 300 Spectrofotometer 2. mikropipet 40 – 200 µL
3. mikropipet 200 – 1000 µL
4. neraca analitik merek Mettler AE 260 Deltarange 5. neraca kasar Mettler Toledo
6. vortex
7. sentrifugator merek Hettich EBA 8S 8. syiring Peroral
9. pengaduk magnetik 10.tabung Evendorf 11.alat-alat gelas
E. Tata Cara Penelitian
1. Pembuatan glukosa monohidrat 15 % b/v
23
2. Pembuatan CMC Na 1 % b/v
Pembuatan CMC Na 1% diawali dengan penimbangan CMC Na sebanyak 1,0 g, lalu bahan dimasukkan dalam labu ukur 100,0 ml dan ditambah air suling hingga tanda lalu dihomogenkan.
3. Penentuan keseragaman bobot tablet glibenklamid
Pengujian keseragaman bobot tablet diawali dengan penimbangan 20 tablet Glibenklamid satu per satu lalu hitung bobot rata-ratanya. Dalam Farmakope Indonesia III (1979), Tablet dikatakan seragam jika memenuhi persyaratan “tidak boleh lebih dari dua tablet yang masing-masing bobotnya menyimpang dari bobot rata-ratanya lebih dari harga yang ditetapkan pada kolom A dan tidak ada satu tablet pun yang bobotnya menyimpang dari bobot rata-ratanya lebih dari harga yang tertera pada kolom B” yang terdapat pada tabel I.
Tabel I. Persyaratan Keseragaman Bobot Tablet Menurut Farmakope Indonesia III
Bobot rata-rata Penyimpangan bobot rata-rata dalam %
A B 25 mg atau kurang
26 mg sampai dengan 150 mg 151 mg sampai dengan 300 mg Lebih dari 300 mg
dengan 5 mg glibenklamid lalu dimasukkan dalam labu ukur 100,0 ml. Kemudian lakukan penambahan CMC Na 1% hingga tanda lalu dihomogenkan.
5. Penentuan dosis glibenklamid
Dosis terapi Glibenklamid adalah 5 mg untuk usia dewasa dengan berat badan 70 kg. Dosis tersebut kemudian dikonversi ke dalam dosis tikus 200 g dengan nilai konversi 0,018.
Konversi dosis = 5 mg x 0,018 = 0,09 mg/ 200g BB tikus = 0, 45 mg/kg BB tikus. 6. Penentuan waktu serapan stabil/ operating time
Penentuan waktu serapan stabil diawali dengan mengambil 100 μL glukosa monohidrat dengan kadar 100 mg %, kemudian ditambahkan 900μL air suling dan 2 mL pereaksi GOD-PAP “Diasys”. Proses selanjutnya adalah mendiamkan larutan pada suhu ruangan lalu mengukur serapannya pada panjang gelombang 500 nm. Pengukuran dilakukan dengan selang waktu 5 menit selama 60 menit. Waktu serapan stabil adalah waktu pendiaman yang menghasilkan serapan yang stabil.
7. Penentuan panjang gelombang serapan maksimum
25
serapannya pada panjang gelombang 490-510 nm dengan interval 2 nm. Panjang gelombang yang dipilih untuk pengukuran selanjutnya adalah yang memiliki serapan maksimum.
8. Pembuatan persamaan kurva baku
Persamaan kurva baku diawali dengan penimbangan seksama 100,0 mg glukosa monohidrat kemudian dimasukkan dalam labu ukur 25,0 ml dan ditambahkan air suling hingga tanda. Untuk memperoleh persamaan dibuat seri kurva baku dengan konsentrasi 12,5 mg%, 25 mg%, 50 mg%, 75 mg% dan 100 mg%. Masing–masing konsentrasi diambil 100 μL dan ditambahkan 900 μL air suling dan 2 ml pereaksi GOD-PAP “Diasys”. Proses selanjutnya adalah mendiamkan larutan pada suhu ruangan selama operating time dan diukur serapannya pada panjang gelombang serapan maksimum. Persamaan kurva baku diperoleh dengan program regresi linear diplotkan antara konsentrasi glukosa monohidrat vs absorbansi sehingga diperoleh persamaan kurva baku.
9. Penentuan waktu pemberian glibenklamid
Tujuan tahap ini adalah untuk melihat pengaruh waktu pemberian terhadap efek penurunan kadar glukosa darah oleh glibenklamid agar saat Uji Toleransi Glukosa Oral (UTGO), glibenklamid sudah memberikan efek penurunan kadar glukosa darah.
didasarkan pada prosentase penurunan harga LDDK0– 300 dari UTGO pada kelompok perlakuan terhadap kontrol, dilakukan dengan cara sebagai berikut: enam tikus dipilih random kemudian masing-masing tikus akan mendapat perlakuan berbeda secara per oral yang terdiri dari:
a. Satu tikus mendapat perlakuan dengan kontrol CMC Na 1% dengan volume pemberian 25 ml/ Kg BB tikus pada menit ke-15 sebelum UTGO.
b. Satu tikus mendapat perlakuan dengan kontrol CMC Na 1% dengan volume pemberian 25 ml/ Kg BB tikus pada menit ke-30 sebelum UTGO.
c. Satu tikus mendapat perlakuan dengan kontrol CMC Na 1% dengan volume pemberian 25 ml/ Kg BB tikus pada menit ke-45 sebelum UTGO.
d. Satu tikus mendapat perlakuan Glibenklamid dosis 0,45 mg/Kg BB pada menit ke-15 sebelum UTGO.
e. Satu tikus mendapat perlakuan Glibenklamid dosis 0,45 mg/Kg BB pada menit ke-30 sebelum UTGO.
f. Satu tikus mendapat perlakuan Glibenklamid dosis 0,45 mg/Kg BB pada menit ke-45 sebelum UTGO.
10.Pembuatan randaman beras ketan hitam
27
dalam gelas beker dan ditambahkan air suling sebanyak 100 ml. Pengadukan dilakukan dengan bantuan pengaduk magnetik selama 30 menit dan disaring dengan bantuan kain kasa sehingga diperoleh air rendaman.
11.Perlakuan terhadap hewan uji
Sebelum perlakuan dilakukan orientasi berat beras ketan hitam yang ditambahkan dalam 100 ml air suling pemberian rendaman beras ketan hitam menggunakan konsentrasi 30 g beras ketan hitam yang direndam dengan menambahkan 100 ml air suling, berat badan hewan uji 150 g dan volume pemberian 5 ml.
Pengambilan cuplikan darah dilakukan sesaat sebelum UTGO sebagai menit ke- 0 dan setelah UTGO pada menit ke- 15, 30, 60, 90, 120, 180, 240 dan 300.
12.Penetapan kadar glukosa darah
Kadar glukosa darah ditetapkan secara spektrofotometri dengan metode enzimatik menggunakan pereaksi glukosa oksidase peroksida “Diasys”. Sampel darah diambil dari vena lateralis ekor dan ditampung dalam tabung Evendorf yang berisi setetes heparin. Langkah selanjutnya adalah mengambil 100 μL darah heparinat dan dimasukkan dalam tabung yang berisi100 μL TCA 15% b/v, divorteks lalu disentrifugasi dengan kecepatan 3000 rpm selama 10 menit untuk mengendapkan protein. Kemudian diambil : Sampel : 100 μL supernatan ditambahkan 900 μL air suling dan 2 mL
pereaksi GOD-PAP “Diasys”
Blangko : 1 mL air suling, 2 tetes heparin dan 100 µL TCA 15% dan 2 ml pereaksi GOD-PAP “Diasys”
Masing-masing tabung Evendorf didiamkan pada suhu ruangan selama operating time. Kemudian pengukuran serapan dilakukan pada panjang gelombang serapan maksimum.
29
kadar glukosa darah selama 300 menit waktu pengamatan. LDDK dihitung dengan metode Trapezoid dengan persamaan:
)
C = kadar glukosa dalam darah (mg/dL)
F. Analisis Data
30 BAB IV
HASIL DAN PEMBAHASAN
A. Penentuan Waktu Serapan Stabil
Penentuan waktu serapan stabil dilakukan untuk mengetahui berapa waktu yang dibutuhkan agar seluruh glukosa dalam cuplikan darah bereaksi sempurna dengan pereaksi GOD-PAP “Diasys”. Pengukuran serapan dilakukan pada panjang gelombang teoritis reaksi yang terdapat dalam lefleat enzim GOD-PAP “Diasys” yaitu 500 nm. Data percobaan dapat dilihat pada tabel II.
Tabel II. Data Penetapan Waktu Serapan Stabil Glukosa Monohidrat Waktu (menit) Absorbansi
31
Gambar 6. Kurva hubungan antara waktu inkubasi dan absorbansi glukosa monohidrat
Dari gambar tersebut tampak bahwa inkubasi menit ke-5 sampai 25 menunjukkan terjadi peningkatan absorbansi yang berarti sedang terjadi reaksi antara glukosa monohidrat dan enzim GOD-PAP. Waktu inkubasi 25 – 40 menit (ditandai garis merah putus-putus) menunjukkan kurva mendatar yang berarti reaksi antara glukosa monohidrat dan pereaksi GOD-PAP berlangsung sempurna. Pada menit 40– 65 tampak kurva menurun yang berarti telah terjadi oksidasi kompleks warna yang menyebabkan penurunan intensitas warna yang ditandai dengan menurunnya absorbansi. Berdasarkan hasil tersebut maka waktu pendiaman pada suhu ruangan dilakukan selama 25 menit agar reaksi berlangsung sempurna dan pengukuran absorbansi dilakukan pada menit ke-25 sampai menit ke-40.
dibanding metode lain misalnya menggunakan metode kondensasi gugus amin yang diganggu oleh asam amino atau metode reduksi yang diganggu oleh senyawa reduktor selain glukosa.
B. Penetapan Panjang Gelombang Serapan Maksimum
Penentuan panjang gelombang serapan maksimum merupakan syarat dalam analisis kuantitatif secara spektrofotometri. Hal ini disebabkan serapan senyawa yang diukur pada panjang gelombang maksimum akan memberikan sensitivitas serapan yang maksimum dan kesalahan pembacaan serapan yang minimum.
Dalam percobaan ini penentuan panjang gelombang maksimum dilakukan dengan mengukur serapan kuinonimin (senyawa berwarna merah) pada daerah panjang gelombang sinar tampak yaitu 490 sampai 510 nm. Hasil percobaan disajikan dalam grafik hubungan antara panjang gelombang dan absorbansi pada gambar 7 di bawah ini.
33
Dari kurva pada Gambar 7 tampak bahwa pada panjang gelombang 504 nm memiliki absorbansi yang paling besar sehingga pengukuran serapan kuinonimin (senyawa berwarna merah) dilakukan pada panjang gelombang tersebut.
C. Persamaan Kurva Baku
Pembuatan kurva baku pada penelitian ini menggunakan lima seri konsentrasi glukosa monohidrat. Tujuannya untuk mendapatkan persamaan regresi linear yang akan digunakan untuk menghitung kadar glukosa dalam darah hewan uji. Data seri kadar kurva baku dapat dilihat pada tabel III.
Tabel III. Hasil Pengukuran Kadar Seri Kurva Baku Kadar (mg/dL) Absorbansi
12,396 0,213
26,03 0,423
51,65 0,644
74,38 0,925
103,3 1,131
Data yang terdapat dalam tabel IV disajikan dalam bentuk kurva hubungan antara kadar gukosa monohidrat (mg/dL) vs absorbansi tampak pada gambar 8.
y=0,01x + 0,129
Persamaan kurva baku diperoleh dengan program regresi linear dengan cara plot antara kadar glukosa monohidrat vs absorbansi. Dari data pada Tabel III diperoleh persamaan y = 0,01x + 0,129 dengan koefisien korelasi 0,9942. Koefisien korelasi pada persamaan (r = 0,9942) lebih besar dari r tabel dengan tiga derajat bebas yaitu 0,840 yang berarti terdapat hubungan korelatif linear antara peningkatan kadar glukosa monohidrat dengan peningkatan absorbansi. Persamaan kurva baku tersebut akan digunakan dalam menghitung kadar glukosa dalam darah.
D. Reaksi Pembentukan Warna
35
Keterangan: GOD = Glukosa oksidase
PAP = phenoaminoantipirin peroksidase
E. Penentuan Waktu Pemberian Glibenklamid
Penentuan waktu pemberian glibenklamid (senyawa pembanding antidiabetik oral) bertujuan untuk mengetahui waktu paling optimum yang dapat menghasilkan persentase penurunan terbesar kadar glukosa darah tikus hasil UTGO yang ditunjukkan dengan nilai LDDK0-300 terhadap kontrol.
Tabel IV. Pengaruh waktu pemberian glibenklamid 0,45 mg/kg BB terhadap persentase penurunan LDDK0-300 glukosa darah UTGO tikus
Waktu
15 13749,75 10485,75 3264 23,74
30 15008,25 11102,25 3906 26,03*
45 15346,25 12401,25 2945,25 19,19
*selisih terbesar
penurunan kadar glukosa darah UTGO terbesar dibandingkan pemberian pada menit ke-15 atau menit ke-45 yaitu 26,03%. Pada uji ini tidak dilakukan replikasi untuk memenuhi syarat statistik dikarenakan tidak cukupnya hewan uji untuk perlakuan yang lain. Hal ini disebabkan hewan uji harus seragam dalam pemeliharaan dan hanya bisa mendapatkan satu perlakuan. Oleh karena itu, peneliti tidak menggunakan hewan uji dari sumber yang lain karena ditakutkan akan menimbulkan bias dalam penelitian ini.
F. Efek Hipoglikemik Rendaman Beras Ketan Hitam
37
Tabel V. Rata-rata kadar glukosa darah tikus (mg/dL) terhadap waktu (menit) setelah perlakuan Kontrol negatif (Air suling), kontrol positif (Glibenklamid), rendaman
Beras Ketan Hitam 15;30; dan 60g ditambah 100 ml air suling,
Waktu
(menit)
kadar glukosa darah rata-rata dalam mg/dL ± SD
kontrol Air
suling kontrol positif perlakuan I perlakuan II perlakuan III
0 79,52 ± 3,49 71,50 ± 0,63 49,38 ± 8,70 50,02 ± 11,14 46,50 ± 11,78
Perlakuan I : rendaman beras ketan hitam 15 g ditambah 100 ml air suling Perlakuan II : rendaman beras ketan hitam 30 g ditambah 100 ml air suling Perlakuan III : rendaman beras ketan hitam 60 g ditambah 100 ml air suling
Gambar 9. Profil rata-rata kadar glukosa darah vs. Waktu setelah perlakuan kontrol negatif (air suling), kontrol positif (Glibenklamid), perlakuan I,II dan III
berturut-turut (Rendaman Beras Ketan Hitam 15; 30; 60 g ditambah 100 ml air suling).
Luas Daerah di Bawah Kurva (LDDK)0-300 yang diperoleh dengan metode Trapezoid akan menggambarkan kadar glukosa darah tikus pada rentang waktu menit ke-0 sampai menit ke-300. Hasil LDDK0-300 akan digunakan untuk membandingkan kemampuan penurunan kadar glukosa darah pada masing-masing perlakuan.
39
Tabel VI. LDDK0-300 (menit.mg/dL) pada pemberian air suling
Interval
30-60 2491,5 2496 2575,5 2521,5 2556 12640,5
60-90 2637 2548,5 2631 2571 2701,5 13089
90-120 2611,5 2592 2632,5 2553 2620,5 13009,5
120-180 5073 4038 5265 5190 5025 24591
180-240 5067 3861 4962 5139 5016 24045
240-300 5181 4926 4851 4989 5196 25143
LDDK0-300 25493,3 23007,8 25397,3 25315,5 25553,3 124767
Rata-rata LDDK0-300 ± SD: 24953,4 ± 1091,43
Tabel VII. LDDK0-300 (menit.mg/dL) pada pemberian Glibenklamid dosis 0,45 mg/Kg BB
LDDK0-300 11067,75 8163,75 9211,5 12913,5 11135,25 52491,75
Tabel VIII. LDDK0-300 (menit.mg/dL) pada pemberian rendaman beras ketan hitam konsentrasi 15 g ditambah 100 ml air suling
Interval
Waktu
Perlakuan
I II III IV V Total
0-15 1125 721,5 770,25 682,5 492,75 3792
15-30 1472,25 1041,75 1007,25 940,5 663 5124,75
30-60 2737,5 2388 2454 1936,5 1689 11205
60-90 2497,5 2226 2238 1873,5 2245,5 11080,5
90-120 2352 2416,5 1869 2094 2025 10756,5
120-180 3906 4575 2730 3387 2718 17316
180-240 3402 3582 3495 3582 3006 17067
240-300 3069 3873 3840 3657 2829 17268
LDDK0-300 20561,25 20823,75 18403,5 18153 15668,25 93609,75
Rata-rata LDDK0-300 ± SD: 18721,95 ± 2094,683
Tabel IX. Kadar glukosa darah tikus pada pemberian rendaman beras ketan hitam konsentrasi 30g ditambah 100 ml air suling
Interval
LDDK0-300 13038 14462,25 14988,75 13820,25 12669,75 68979
41
Tabel X. LDDK0-300 (menit.mg/dL) pada pemberian rendaman beras ketan hitam konsentrasi 60g ditambah 100 ml air suling
Interval
30-60 1531,8 1279,5 1786,5 1453,5 2034 8085,3
60-90 1358,7 1411,5 1467 924 1866 7027,2
90-120 1254 1419 1221 759 1936,5 6589,5
120-180 2363,4 2292 2019 1428 4050 12152,4
180-240 2103,6 2058 1788 1587 2967 10503,6
240-300 1774,8 1554 1491 1701 2340 8860,8
LDDK0-300 11773,35 11307,75 11063,25 9441 16815,75 60401,1
Rata-rata LDDK 0-300 ± SD : 12080,22 ± 2789,078
Rata-rata LDDK0-300 pada masing-masing perlakuan secara ringkas disajikan pada tabel XI di bawah ini.
Tabel XI. Rata-rata LDDK0-300 pada perlakuan air suling, Glibenklamid, Rendaman Beras Ketan Hitam konsentrasi 15; 30 dan 60g ditambah 100 ml air suling Jumlah ( N ) Kelompok Nilai LDDK0-300 ± SD
5 Air suling 24953,4 ± 1091,43
5 Glibenklamid 0,45 mg/kg BB 10498,35 ± 1848,591
5 Perlakuan I 18721,95 ± 2094,683
5 Perlakuan II 13795,8 ± 963,085
5 Perlakuan III 12080,22 ± 2789,078 Keterangan:
Perlakuan I : rendaman beras ketan hitam 15 g ditambah 100 ml air suling Perlakuan II : rendaman beras ketan hitam 30 g ditambah 100 ml air suling Perlakuan III : rendaman beras ketan hitam 60 g ditambah 100 ml air suling
Gambar 10. Diagram Batang Rata-rata LDDK0-300 perlakuan akuades, glibenklamid, rendaman beras ketan hitam konsentrasi 15; 30 dan 60 g ditambah 100 ml air suling
Dari data yang disajikan pada gambar 10 tampak bahwa rata-rata LDDK
0-300
pada perlakuan rendaman beras ketan hitam lebih rendah dibandingkan perlakuan air suling. Kemampuan rendaman beras ketan hitam dalam menurunkan kadar glukosa darah akan meningkat dengan meningkatnya konsentrasi namun tidak memiliki hubungan korelasi linear. Hal ini akan tampak pada persentase penurunan kadar glukosa darah (PKGD) terhadap kontrol air suling untuk rendaman beras ketan hitam yang tampak lebih jelas disajikan pada tabel XII pada halaman 43.
43
Tabel XII. Nilai Luas Daerah di Bawah Kurva (LDDK)0-300 dan persentase penurunan kadar glukosa darah (PKGD) terhadap kontrol air suling Jumlah (N) Kelompok Nilai LDDK0-300 ± SD % PKGD
Perlakuan I : rendaman beras ketan hitam 15 g ditambah 100 ml air suling Perlakuan II : rendaman beras ketan hitam 30 g ditambah 100 ml air suling Perlakuan III : rendaman beras ketan hitam 60 g ditambah 100 ml air suling
Analisis data dilanjutkan dengan statistik untuk membandingkan masing-masing perlakuan apakah memiliki perbedaan yang signifikan atau tidak. Analisis statistik dilakukan dengan menggunakan program SPSS diawali dengan uji distribusi sampel menggunakan Kolmogorov Smirnov dengan taraf kepercayaan 95 %. Hasil uji distribusi sampel menggunakan Kolmogorov Smirnov disajikan dalam tabel XIII.
Dari pengujian distribusi normal menggunakan Kolmogorov-Smirnov suatu sampel dikatakan terdistribusi normal jika nilai p (Asymp Sig (2 tailed))) > 0,05 (Triton, 2006). Hasil analisis pada tabel XIV tampak bahwa p=0,702 yang berarti p>0,05 maka dapat disimpulkan sampel terdistribusi normal. Analisis kemudian dilanjutkan dengan analisis Anova One Way dan analisis Post Hoc untuk mengetahui lebih rinci pasangan kelompok perlakuan yang berbeda signifikan (BS) dan pasangan kelompok perlakuan yang berbeda tidak signifikan (TBS).
Analisis menggunakan Post Hoc terhadap LDDK0-300 akan menunjukkan signifikansi perbedaan pada masing-masing kelompok perlakuan. Hasil uji Post Hoc disajikan pada tabel XIV.
Tabel XIV. Hasil Uji Post Hoc Antar Kelompok Perlakuan dengan Taraf Kepercayaan 95 %
Kelompok I II III IV V
*BS : Berbeda signifikan (p<0,05) BTS : Berbeda tidak signifikan (p>0,05)
Keterangan:
I : kontrol air suling
II : glibenklamid dosis 0,45 mg/kg BB
III : rendaman beras ketan hitam 15 g ditambah 100 ml air suling IV : rendaman beras ketan hitam 30 g ditambah 100 ml air suling V : rendaman beras ketan hitam 60 g ditambah 100 ml air suling
45
terdapat perbedaan yang bermakna. Hal ini menyatakan bahwa rendaman beras ketan 15 g ditambah 100 ml air suling, 30 g ditambah 100 ml air suling dan 60 g ditambah 100 ml air suling memiliki efek menurunkan kadar glukosa darah (hipoglikemik).
Hasil analisis terhadap kontrol positif (glibenklamid dosis 0,45 mg/kg BB) menunjukkan bahwa kelompok perlakuan rendaman beras ketan hitam konsentrasi 15 g ditambah 100 ml air suling terdapat perbedaan bermakna. Namun, pada rendaman beras ketan hitam konsentrasi 30 g ditambah 100 ml air suling dan 60 g ditambah 100 ml air suling terdapat perbedaan yang tidak bermakna. Hal ini menyatakan bahwa rendaman beras ketan hitam pada konsentrasi 30 g ditambah 100 ml air suling dan 60 g ditambah 100 ml air suling mempunyai efek penurunan kadar glukosa yang sama dengan glibenklamid dosis 0,45 mg/kg BB.
hipoglikemik rendaman beras ketan hitam 30 g ditambah 100 ml air suling dan 60 g ditambah 100 ml air suling (44,71% dan 51,59%).
Pada kelompok perlakuan rendaman beras ketan konsentrasi 30 g ditambah 100 ml air suling menunjukkan perbedaan bermakna dengan kontrol negatif (air suling). Perbedaan ini dapat diartikan bahwa kelompok ini memiliki efek hipoglikemik. Hasil analisis terhadap kelompok kontrol positif (glibenklamid dosis 0,45 mg/kg BB) dan rendaman beras ketan hitam konsentrasi 60 g ditambah 100 ml air suling menunjukkan perbedaan yang tidak bermakna artinya efek hipoglikemik rendaman beras ketan hitam konsentrasi 30 g ditambah 100 ml air suling sebesar 44,71% sama dengan efek hipoglikemik kontrol positif (glibenklamid dosis 0,45 mg/kg BB) dan rendaman beras ketan hitam konsentrasi 60 g ditambah 100 ml air suling (57,95% dan 51,79%). Hasil analisis rendaman beras ketan hitam konsentrasi 30 g ditambah 100 ml air suling terhadap rendaman beras ketan hitam konsentrasi 15 g ditambah 100 ml air suling menunjukkan perbedaan bermakna artinya efek hipoglikemik rendaman beras ketan hitam 30 g ditambah 100 ml air suling (44,71%) lebih besar dari pada rendaman beras ketan hitam 15 g ditambah 100 ml air suling (24,97%).
47
hipoglikemik rendaman beras ketan hitam konsentrasi 60 g ditambah 100 ml air suling sebesar 51,59% sama dengan efek hipoglikemik kontrol positif (glibenklamid dosis 0,45 mg/kg BB) dan rendaman beras ketan hitam konsentrasi 30 g ditambah 100 ml air suling (57,95% dan 44,71%). Hasil analisis rendaman beras ketan hitam konsentrasi 60 g ditambah 100 ml air suling terhadap rendaman beras ketan hitam konsentrasi 15 g ditambah 100 ml air suling menunjukkan perbedaan bermakna artinya efek hipoglikemik rendaman beras ketan hitam 60 g ditambah 100 ml air suling (51,59%) lebih besar dari pada rendaman beras ketan hitam 15 g ditambah 100 ml air suling (24,97%).
48 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Dari hasil penelitian yang dilakukan diperoleh kesimpulan sebagai berikut: 1. Rendaman beras ketan hitam memiliki efek hipoglikemik pada tikus betina yang
dibebani glukosa.
2. Dengan taraf kepercayaan 95%, rendaman beras ketan hitam dengan berat 15 g; 30 g; dan 60 g ditambah 100 ml air suling mampu menurunkan kadar glukosa darah tikus berturut–turut 24,97 %; 44,71 %; dan 51,59 %.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut untuk mengidentifikasikan senyawa aktif yang terkandung di dalam rendaman beras ketan hitam yang memiliki efek hipoglikemik pada tikus betina yang dibebani glukosa.
49
DAFTAR PUSTAKA
Agoes A., 1991, Pengobatan Tradisional di Indonesia, Medika, 17 (8); 632.
Aligita,W., 2007, Isolasi Antosianin dari Ketan Hitam (Oriza Sativa L Forma Glutinosa),http://digilib.itb.ac.id/gdl.php?mod=browse&op=read&id=jbptit bpp-gdl-widhyaalig-27652 diakses tanggal 3 November 2008.
Ambarwati, N., 2002, Efek Hipoglikemi Rebusan Biji Buah Makuto Dewo [Phaleria Macrocarpa [Scheff.] Boerl] pada Tikus Diabetes Melitus Tidak Tergantung Insulin [DMTTI], Skripsi, Universitas Sanata Sharma, Yogyakarta.
Anonim, 1979, Farmakope Indonesia, Edisi III, 7, Departemen Kesehatan RI, Jakarta.
Anonim, 2008a, Anthocyanin, http://en.wikipedia.org/wiki/Anthocyanin diakses tanggal 29 Oktober 2008.
Anonim, 2008b, Beras, http://in.wikipedia.org/wiki/beras diakses tanggal 4 April 2008.
Anonim, 2008c, Technical Buletin, http://www.sigma.pdf diakses tanggal 4 April 2008.
Barke, S., 2002, Insulin Resistance & Diabetes,
http://www.snac.ucla.edu/pages/Resources/Handouts/HODiabetesandInsulin Resistance.pdf diakses pada 9 mei 2008.
Cazarolli,L.H., Zanatta, L., Alberton, E.H., Reis, B.F.M.S., Folador, P., Damazio, R.G., Pzzolatti, M.G., Mena B.S.F.R., 2008, Flavonoids: Cellular and Molecular Mechanism of Action in Glucose Homeostasis,
http://www.ingentaconnect.com/content/ben/mrmc/2008 diakses pada
Dipiro, J,T., Wells, B.G., Swhwinghammer, T.L., dan Hamilton, C.W, 2003, Pharmacotheraphy Handbook, 5th Edition, 170-181, Macgraw Hill Companies Inc., New York.
Ediningsih, E., 2006, Oral Hypoglichemic Agent,
http://www.farmako.uns.ac.id/penguasa/barak_upload/materi/oral20%HIPO GLIKEMIK%20AGENTS.pdf diakses pada 25 Januari 2008.
Indriyanti, 2005, Peran Asam Lemak Bebas, Stres Oksidatif dan Keadaan Inflamasi terhadap Kejadian Resistensi Insulin, Forum Diagnosticum,6,4.
Irawan, M.A., 2007, Karbohidrat, http://www.pssplab.com/journal/03.pdf diakses pada 9 Mei 2008.
Katzung, B.G., 2002, Farmakologi Dasar dan Klinik, 689-691, Penerbit Salemba Medika, Jakarta.
Lanywati, E., 2001, Diabetes Melitus: Penyakit Kencing Manis, 7-18, Penerbit Kanisius, Yogyakarta.
Lina, Y dan Wijaya, A., 2005, Mekanisme Molekular Diabetes Tipe 2, Diagnosticum, 2, 5,-7,9-12,14.
Murray, R.,K., Daryl, K.G., Peter, A.M., Victor W.R., 2000, Harper’s Biochemistry, 25th Edition, Appleton and Lange Publisher, United States of America.
Rubenstein,D., Wayne, D., and Bradley, J., 2007, Kedokteran Klinis, Edisi VI, 177, Penerbit Erlangga, Jakarta.
Soegondo, S., 2006, Diabetes The Sillent Killer,
http://www.medicastore.com/diabetes diakses tanggal 9 Mei 2008.
51
Susilowati, A., dan Amiruddin, R., 2008, Faktor Risiko Diabetes Melitus di Rumah Sakit Umum Dr. Wahidin Sudirohusodo Makasar 2007, Medika, 34 (3); 182-184.
Tjai, T.H., dan Rahardja, K., 2002, Obat-Obat Penting, edisi V, cetakan I, 693-713, Penerbit PT. Elex Media Komputindo Gramedia, Jakarta.
Triton, 2006, SPSS 13.0 Terapan, Riset Statistik Parametrik, Edisi I, 79, Penerbit Andi, Yogyakarta.
Widowati , L., Dzulkarnain, B., dan Sa'roni, 1997, Tanaman Obat untuk Diabetes Melitus, Cermin Dunia Kedokteran, 116; 53-54
LAMPIRAN 1
Keseragaman Bobot Tablet Glibenklamid
Tablet Ke- Berat (g) Tablet Ke- Berat (g)
1 0,2040 11 0,2033
2 0,2020 12 0,2011
3 0,1999 13 0,2034
4 0,2042 14 0,2009
5 0,1997 15 0,2024
6 0,2006 16 0,2018
7 0,1986 17 0,2040
8 0,2008 18 0,2009
9 0,2110 19 0,2014
10 0,2034 20 0,2105
Rata-rata 0,2026
53
LAMPIRAN 2
Pengukuran Waktu Serapan Stabil/Operating Time
Waktu (menit) Absorbansi 5 0,487 10 0,524 15 0,646 20 0,675 25 0,880
30 0,880
35 0,880
40 0,880
45 0,856 50 0,856 55 0,834 60 0,833 65 0,834
LAMPIRAN 3
Penetapan Panjang Gelombang Serapan Maksimum
Tampak absorbansi tertinggi pada panjang gelombang 504 nm Panjang Gelombang (nm) Absorbansi
490 0,840
492 0,852
494 0,853
496 0,862
498 0,873
500 0,880
502 0,885
504 0,890
506 0,888
508 0,885
55
LAMPIRAN 4 Penimbangan Bahan
a. Glukosa monohidrat 15 % dengan volume 10 ml larutan
Berat (g) I II III IV V
kertas kosong 0,3955 0,3950 0,3864 0,4056 0,3867 kertas + zat 0,5456 0,5453 0,5366 0,5559 0,5368 kertas + sisa 0,3954 0,4004 0,3865 0,4058 0,3870
Zat 0,1502 1,4490 1,501 1,501 1,4980
b. Glibenklamid 45 mg/kg BB konsentrasi 2,52 mg % Penimbangan glibenklamid dilakukan dengan cara:
Berat kertas kosong = 0, 3955 g Berat kertas + zat = 0, 4978 g Berat kertas + sisa = 0, 3958 g Berat zat = 0, 1020 g c. Beras ketan hitam
Berat (g) Konsentrasi
LAMPIRAN 5
Data Penentuan Waktu Pemberian Glukosa Monohidrat
Kadar glukosa darah (mg/dL) pada tiga waktu induksi glukosa monohidrat
LDDK 0-300 (menit.mg/dL) pada tiga waktu induksi glukosa monohidrat
Waktu Menit ke -15 Menit ke-30 Menit ke-45
(menit) kontrol Perlakuan Kontrol perlakuan Kontrol perlakuan
0-15 984 822 1095 686,25 1079,25 1033,5
15-30 1055,25 861,75 1085,25 783 1111,5 1101
30-60 2071,5 1563 2112 1377 2179,5 2029,5
60-90 1611 1245 1720,5 1159,5 1671 1747,5
90-120 1188 1053 1357,5 1144,5 1131 1428
120-180 2337 1821 2580 2226 2178 2631
180-240 2424 1641 2547 2031 1701 2940
240-300 2079 1479 2511 1695 1350 2436
LDDK 0-300 13749,75 10485,75 15008,25 11102,25 12401,25 15346,5
Selisih 3264 3906 2945,25
waktu
(menit)
Menit ke-15 Menit ke-30 Menit ke-45
kontrol Perlakuan kontrol Perlakuan Kontrol Perlakuan
57
Pengaruh waktu pemberian glibenklamid 0,45 mg/kg BB terhadap persen penurunan LDDK 0-300 glukosa darah pada tikus
Waktu pemberian UTGO (menit)
LDDK 0-300 (mg/dL menit) Selisih LDDK0-300 (mg/dL menit)
% Selisih LDDK0-300 (mg/dL menit) kontrol perlakuan
15 13749,75 10485,75 3264,00 23,74
30 15008,25 11102,25 3906,00 26,03*
45 15346,25 12401,25 2945,25 19,19
LAMPIRAN 6
Data kadar glukosa darah dan hasil perhitungan Luas Daerah di Bawah Kurva (LDDK )0-300
A. Kontrol negatif air suling 25 ml/ kg BB
Kadar glukosa darah (mg/dL)
Waktu Perlakuan
LDDK 0-300 glukosa darah (menit.mg/dL)
Interval
waktu
Perlakuan
I II III IV V Jumlah
0-15 1209 1287 1231,5 1159,5 1211,25 6098,25
15-30 1223,25 1259,25 1248,75 1192,5 1227 6150,75
30-60 2491,5 2496 2575,5 2521,5 2556 12640,5
60-90 2637 2548,5 2631 2571 2701,5 13089
90-120 2611,5 2592 2632,5 2553 2620,5 13009,5
120-180 5073 4038 5265 5190 5025 24591
180-240 5067 3861 4962 5139 5016 24045
240-300 5181 4926 4851 4989 5196 25143
LDDK0-300 25493,3 23007,8 25397,3 25315,5 25553,3 124767
59
B. Kontrol positif Glibenklamid dosis 0,45 mg/kg BB
Kadar glukosa darah (mg/dL) pada
Waktu Perlakuan
LDDK 0-300 glukosa darah (menit.mg/dL)
Interval
Waktu
Perlakuan
I II III IV V Jumlah
0-15 1006,5 1071 1071 1053,75 1062,75 5265
15-30 987,75 939,75 1165,5 1052,25 1006,5 5151,75
30-60 2106 1183,5 1758 1743 1740 8530,5
LDDK0-300 11067,75 8163,75 9211,5 12913,5 11135,25 52491,75
C. Rendaman beras ketan hitam Konsentrasi 15g ditambah 100 ml air suling
Kadar glukosa darah (mg/dL)
Waktu Perlakuan
(menit) I II III IV V Rata-rata
0 53,000 43,100 60,800 51,400 38,600 49,380 15 112,000 53,100 41,900 39,600 27,100 54,740 30 114,300 100,800 107,400 100,800 61,300 96,920 60 98,200 88,400 71,200 43,300 51,300 70,480 90 98,300 90,000 78,000 81,600 98,400 89,260 120 88,500 86,100 46,600 58,000 36,600 63,160 180 56,700 66,400 44,400 54,900 54,000 55,280 240 56,700 53,000 72,100 64,500 46,200 58,500 300 45,600 76,100 55,900 57,400 48,100 56,620
LDDK 0-300 glukosa darah (menit.mg/dL)
Interval
Waktu
Perlakuan
I II III IV V Total
0-15 1125 721,5 770,25 682,5 492,75 3792
15-30 1472,25 1041,75 1007,25 940,5 663 5124,75
30-60 2737,5 2388 2454 1936,5 1689 11205
60-90 2497,5 2226 2238 1873,5 2245,5 11080,5
90-120 2352 2416,5 1869 2094 2025 10756,5
120-180 3906 4575 2730 3387 2718 17316
180-240 3402 3582 3495 3582 3006 17067
240-300 3069 3873 3840 3657 2829 17268
LDDK0-300 20561,25 20823,75 18403,5 18153 15668,25 93609,75
61
D. Rendaman beras ketan hitam Konsentrasi 30 g ditambah 100 ml air suling
Kadar glukosa darah (mg/dL)
Waktu Perlakuan
(menit) I II III IV V Rata -rata
0 36,000 56,700 64,900 44,600 47,900 50,020
15 85,500 96,900 88,400 69,700 81,400 84,380 30 37,600 62,800 46,800 56,300 53,800 51,460 60 51,900 86,100 61,100 68,300 76,000 68,680 90 54,200 56,900 83,200 28,700 52,700 55,140 120 31,500 41,500 50,600 59,700 42,400 45,140 180 24,300 20,000 16,400 20,900 22,200 20,760 240 47,200 50,000 53,200 52,100 31,900 46,880 300 58,300 27,100 44,700 39,900 28,800 39,760
LDDK 0-300 glukosa darah (menit.mg/dL)
Interval
LDDK0-300 13038 14462,25 14988,75 13820,25 12669,75 68979
E. Rendaman beras ketan hitam Konsentrasi 60g ditambah 100 ml air suling
Kadar glukosa darah (mg/dL)
Waktu Perlakuan
(menit) I II III IV V Rata -rata
0 42,400 41,400 39,900 64,700 44,100 46,500
15 43,900 41,600 29,000 40,900 51,700 41,420 30 29,900 47,900 74,200 65,300 68,800 57,220 60 43,800 37,400 44,900 31,600 66,800 44,900 90 31,200 56,700 52,900 30,000 57,600 45,680 120 31,100 37,900 28,500 20,600 71,500 37,920 180 36,500 38,500 38,800 27,000 63,500 40,860 240 34,100 30,100 20,800 25,900 35,400 29,260 300 25,500 21,700 28,900 30,800 42,600 29,900
LDDK 0-300 glukosa darah (menit.mg/dL)
Interval
waktu
Perlakuan
I II III IV V Total
0-15 647,25 622,5 516,75 792 718,5 3297
15-30 739,8 671,25 774 796,5 903,75 3885,3
30-60 1531,8 1279,5 1786,5 1453,5 2034 8085,3
60-90 1358,7 1411,5 1467 924 1866 7027,2
90-120 1254 1419 1221 759 1936,5 6589,5
120-180 2363,4 2292 2019 1428 4050 12152,4
180-240 2103,6 2058 1788 1587 2967 10503,6
240-300 1774,8 1554 1491 1701 2340 8860,8
LDDK0-300 11773,35 11307,75 11063,25 9441 16815,75 60401,1
63
LAMPIRAN 7
Analisis Statistik Menggunakan SPSS 15
One-Sample Kolmogorov-Smirnov Test
Jumlah sampel 30 sampel data
Diketahui nilai probabilitas (Asymp. Sig.(2 tailed)) 0,702. Pengambilan kesimpulan:
One way Anova
Descriptives
LDDK(menit.mg%)
5 24953,44 1091,43197 488,10322 23598,2482 26308,6318 23007,80 25553,30
5 10498,35 1848,59052 826,71481 8203,0217 12793,6783 8163,75 12913,50
5 18721,95 2094,68291 936,77067 16121,0576 21322,8424 15668,25 20823,75 5 13795,80 963,08522 430,70480 12599,9718 14991,6282 12669,75 14988,75 5 12080,22 2789,07842 1247,314 8617,1217 15543,3183 9441,00 16815,75 25 16009,95 5631,49789 1126,300 13685,3839 18334,5201 8163,75 25553,30 Kontrol akuadest
N Mean Std. Deviation Std. Error Lower Bound Upper Bound 95% Confidence Interval for
Mean
Minimum Maximum
Test of Homogeneity of Variances
LDDK0-300(menit.mg%)
6,9E+008 4 172579912,5 48,744 ,000
70810795 20 3540539,735
65
Multiple Comparisons
Dependent Variable: LDDK(menit.mg%) Tukey HSD
14455,090* 1190,049 ,000 10894,0185 18016,1615
6231,49000* 1190,049 ,000 2670,4185 9792,5615
11157,640* 1190,049 ,000 7596,5685 14718,7115
12873,220* 1190,049 ,000 9312,1485 16434,2915
-14455,090* 1190,049 ,000 -18016,1615 -10894,0185
-8223,6000* 1190,049 ,000 -11784,6715 -4662,5285
-3297,4500 1190,049 ,078 -6858,5215 263,6215
-1581,8700 1190,049 ,677 -5142,9415 1979,2015
-6231,4900* 1190,049 ,000 -9792,5615 -2670,4185
8223,60000* 1190,049 ,000 4662,5285 11784,6715
4926,15000* 1190,049 ,004 1365,0785 8487,2215
6641,73000* 1190,049 ,000 3080,6585 10202,8015
-11157,640* 1190,049 ,000 -14718,7115 -7596,5685
3297,45000 1190,049 ,078 -263,6215 6858,5215
-4926,1500* 1190,049 ,004 -8487,2215 -1365,0785
1715,58000 1190,049 ,610 -1845,4915 5276,6515
-12873,220* 1190,049 ,000 -16434,2915 -9312,1485
1581,87000 1190,049 ,677 -1979,2015 5142,9415
-6641,7300* 1190,049 ,000 -10202,8015 -3080,6585
-1715,5800 1190,049 ,610 -5276,6515 1845,4915
(J) perlakuan
(I-J) Std. Error Sig. Lower Bound Upper Bound
95% Confidence Interval
Homogeneous Subsets
Subset for alpha = .05
Means for groups in homogeneous subsets are displayed. Uses Harmonic Mean Sample Size = 5,000.
a.
Keterangan :
67
BIOGRAFI
PENULIS
Penulis Skripsi berjudul “Uji Efek Hipoglikemik Rendaman Beras Ketan Hitam pada Tikus Betina yang Dibebani Glukosa” bernama Maria Riaswati dilahirkan di Pringsewu (Lampung Selatan), 6 Oktober 1987 sebagai putri kedua dari pasangan Yohanes Edi Daru Putranto dan Yustina Tri Andari.
Penulis menyelesaikan pendidikan dasar pada tahun 1999 di SD Negeri No. 47 Kota Jambi. Pendidikan menengah pertama diselesaikan pada tahun 2002 di SLTP Xaverius 2 Jambi. Pendidikan menengah atas diselesaikan di SMA Xaverius 2 Jambi pada tahun 2005. Penulis melanjutkan pendidikan di Fakultas Farmasi Universitas Sanata Dharma tahun 2005-2009.