g
E.d.i.S.i p.e.r.D.a.n.a taHun 2009
z
x
y
1 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - -
STRUKTUR ATOM
A. ATOM & PARTIKEL DALAM ATOM
Atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibagi lagi dengan cara kimia biasa, tetapi masih mempunyai sifat-sifat seperti unsur tersebut.
Atom dibangun oleh partikel-partikel dasar seperti elektron, proton dan neutron. Dalam atom tersusun intil yang terdiri dari proton dan netron.
1. Elektron ( 01 e )
a. Partikel bermuatan negatif.
b. Muatannya = 1,6.10-19 Coulomb, dipakai sebagai satu satuan muatan negatif (-1). c. Massanya = 9,11.10-28 gram atau 0,00055 sma (dapat dianggap sama dengan 0). d. Penemu elektron adalah J.J. Thomson.
2. Proton ( 11p )
a. Partikel bermuatan positif.
b. Muatannya sama dengan elektron tetapi tandanya berlawanan (+1)
c. Massanya = massa 1 atom hidrogen atau 1,00758 sma (dibulatkan = 1 sma). d. Penemu proton adalah Goldstein.
3. Netron ( 01 n )
a. Partikel tak bermuatan atau muatannya = 0 b. Massanya = 1,00893 sma (dibulatkan = 1 sma). c. Penemu netron adalah Chadwich.
B. PERKEMBANGAN MODEL ATOM
1. DEMOKRITUS LEUKIPPOS (400 SM–370 SM)
Menurut Demokritus materi bersifat diskontinu, artinya jika suatu materi dibelah terus-menerus suatu ketika akan diperoleh suatu partikel fundamental (tidak dapat dibagi lagi). Pendapat ini ditolak oleh Aristoteles (384–322 SM), yang berpendapat bahwa materi bersifat kontinu (materi dapat dibelah terus-menerus sampai tidak berhingga). Setelah penemuan hukum kekekalan massa dan perbandingan tetap John Dalton mengajukan teori atom berdasarkan eksperimen yang secara tegas mengatakan mbahwa materi tersusun atas atom-atom.
JOHN DALTON (1803)
John Dalton mengungkapkan bahwa : a. Zat tersusun atas atom-atom.
b. Atom sejenis memiliki sifat yang sama dalam segala hal, sedangkan atom yang berbeda memiliki sifat yang berbeda.
c. Atom tidak dapat diciptakan maupun dimusnahkan
d. Reaksi kimia terjadi karena adanya penggabungan dan pemisahan atom-atom.
e. Jika atom-atom bergabung akan membentuk molekul. Apabila atom-atom yang sama bergabung akan terbentuk molekul unsur, sedangkan jika atom-atom yang berbeda bergabung akan terbentuk molekul senyawa.
Kelebihan
a. Mulai membangkitkan minat terhadap penelitian mengenai model atom b. Dapat menerangkan Hukum Kekekalan Massa ( Hukum Lavoisier ) c. Dapat menerangkan Hukum Perbandingan Tetap ( Hukum Proust ) Kelemahan
a. Tidak dapat menerangkan sifat listrik atom.
b. Pada kenyataannya atom dapat dibagi lagi menjadi partikel yang lebih kecil yang disebut partikel subatomik.
2. J.J THOMSON (1897)
Gambar 1.2 Model atom Dalton Gambar 1.1 Dalton
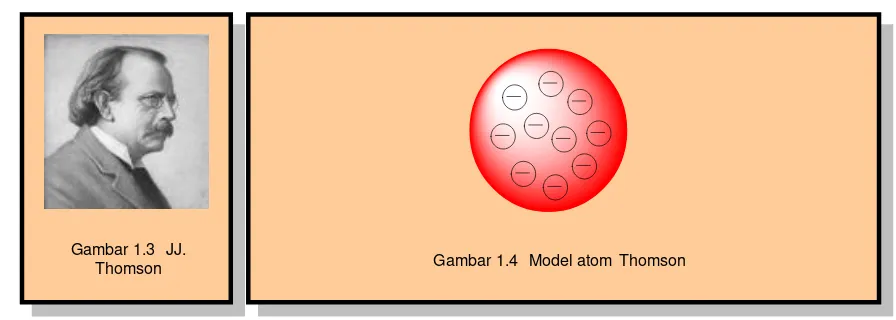
Gambar 1.4 Model atom Thomson Gambar 1.3 JJ.
3 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - - Menurut JJ. Thomson :
a. Atom merupakan bola massif / padat / pejal yang bermuatan positif dan tersebar elektron-elektron yang bermuatan negatif. Jumlah muatan positif sama dengan jumlah muatan negatif.
b. Secara teoritis atom dapat diasumsikan seperti roti kismis.
Kelebihan
a. Dapat menerangkan adanya partikel yang lebih kecil dari atom yang disebut partikel subatomik.
b. Dapat menerangkan sifat listrik atom Kelemahan
Tidak dapat menerangkan fenomena penghamburan sinar alfa pada lempeng tipis emas.
3. RUTHERFORD (1911) (menemukan inti atom)
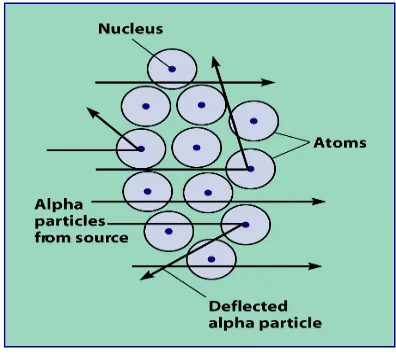
Berdasarkan hasil percobaan hamburan sinar oleh Hans Geiger dan Ernest Marsden sekitar tahun 1909, Rutherford mengemukakan model atom yang dapat menumbangkan model atom Thomson. Sinar yang berasal dari zat radioaktif polonium dikenakan terhadap lempengemas yang tipis, ternyata berkas sinar yang memiliki kecepatan 10.000 mil det-1 hampir semuanya dapat menembus lempeng emas, hanya sebagian kecil yang dibengkokkan dan dipantulkan kembali.
Kesimpulan dari percobaan yang dilakukan Rutherford :
a. Atom terdiri dari inti atom yang bermuatan positif dan dikelilingi elektron yang bermuatan negatif b. Inti atom merupakan pusat massa.
c. Atom bersifat netral karena jumlah muatan inti sama dengan jumlah muatan elektron. d. Atom tersusun atas inti yang sangat kecil dan sebagian besar ruangan dalam atom
merupakan ruangan kosong.
Gambar 1.7 Percobaan Rutherford Gambar 1.5 Rutherford
Kelebihan :
a. Dapat menerangkan fenomena penghamburan sinar alfa oleh lempeng tipis emas. b. Mengemukakan keberadaan inti atom (menemukan inti atom).
Kelemahan :
Bertentangan dengan teori elektrodinamika klasik ( Maxwell ), dimana suatu partikel yang bermuatan listrik apabila bergerak akan memancarkan energi. Elektron yang beredar mengelilingi inti akan kehilangan energi terus menerus, sehingga akhirnya akan membentuk lintasan spiral dan jatuh ke inti.
4. MODEL ATOM NIELS-BOHR (1914) dan MEKANIKA KUANTUM
1. Radiasi elektromagnetik
1. Yang membedakan satu jenis radiasi dengan yang lain adalah panjang gelombang dan frekuensinya. dipisahkan menjadi komponen – komponennya secara sinambung.
5 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - -
Jawaban latihan uji kepahaman anda (Buku paket hal 5 nomor 4)
4. Yang dimaksud dengan :
a. Spektrum kontinu adalah pola yang dihasilkan bila berkas energi atau partikel dipisahkan menjadi komponen – komponennya secara sinambung Contoh : Pelangi
b. Spektrum garis adalah pola yang dihasilkan bila berkas energi atau partikel dipisahkan menjadi komponen – komponennya secara terputus – putus. Contoh : spektrum dari lampu hidrogen
3. Teori Kuantum (paket energi) Max Planck
.
Sinar hijau memiliki gelombang lebih pendek dari sinar jingga (me-ji-ku-hi-bi-ni-u) sehingga energi radiasinya lebih besar daripada sinar jingga, karena menurut Max Planck energi radiasi berbanding terbalik dengan panjang gelombangnya
elektromagnetik mempunyai sifat partikel. Partikel radiasi tersebut dinamakan foton
Jawaban latihan uji kepahaman anda hal 8 nomor 5 - 7
5. Ide pokok dalam teori kuantum Max Planck adalah bahwa radiasi elektromagnet bersifat diskret, artinya suatu benda hanya dapat memancarkan atau menyerap radiasi elektromagnet.
6. Sinar biru memiliki gelombang lebih pendek dari sinar merah sehingga energi radiasinya lebih besar daripada sinar merah, karena menurut Max Planck energi radiasi berbanding terbalik
4. Efek Fotolistrik
Hipotesa dari Max Planck dan Einstein menghasilkan rumusan empiris tentang efek fotolistrik. Efek fotolistrikadalah listrik yang diinduksi oleh cahaya (foton).
(a) (b)
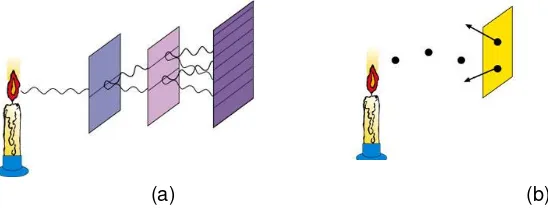
Gambar (a) Teori gelombang cahaya menjelaskan difraksi dan interferensi yang tidak dapat dijelaskan oleh teori kuantum.(b) Teori kuantum menjelaskan efek fotolistrik yang tidak dapat di jelaskan oleh teori gelombang.
Apabila cahaya melalui celah-celah, cahaya berlalu sebagai gelombang, ketika
tiba di layar cahaya berlalu sebagai partikel.
Jawaban latihan uji kepahaman anda hal 10 nomor 8 – 10
8. Apakah yang dimaksud dengan fotolistrik
Fotolistrik adalah listrik yang diinduksi oleh cahaya (foton).
9. Suatu logam menghasilkan fotolistrik dengan cahaya kuning, tetapi tidak dengan cahaya jingga
a. Apakah logam tersebut dapat atau tidak dapat menghasilkan fotolistrik dengan (i) cahaya merah
Tidak dapat, karena sinar merah mempunyai energi yang lebih kecil daripada sinar kuning. Sehingga foton dari sinar merah tidak dapat menyebabkan elektron terlempar keluar. Akibatnya tidak ada arus listrik yang mengalir. (ii)cahaya biru
Dapat, karena sinar biru mempunyai energi yang lebih besar daripada sinar kuning. Sehingga energi foton dari sinar biru cukup untuk dapat menyebabkan elektron terlempar dari permukaan logam. Akibatnya ada arus listrik yang mengalir
b. Apakah kuat arus akan meningkat, berkurang atau tetap, jika intensitas (kuning) yang dikenakan diperbesar?
Jika intensitas sinar kuning yang dikenakan diperbesar, maka kuat arus akan meningkat
c. Bagaimana kuat arus, lebih besar, sama atau lebih kecil, jika yang digunakan adalah cahaya biru dengan intensitas yang sama?
Jika yang digunakan adalah sinar biru dengan intensitas yang sama, maka besarnya kuat arus tersebut adalah sama.
10. Bagaimana Einstein menjelaskan efek fotolistrik?
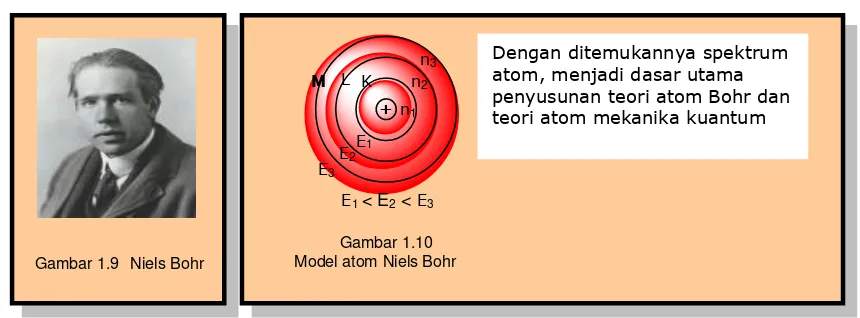
7 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - - 5. Model atom Niels Bohr
Gagasan utama dalam teori atom Niels Bohr adalah bahwa elektron dalam atom hanya dapat beredar pada lintasan-lintasan dengan tingkat energi tertentu yang disebut sebagai kulit atom, dimana pada lintasan tersebut elektron dapat beredar tanpa pemancaran atau penyerapan energi.
Penyerapan atau pemancaran energi terjadi apabila elektron pindah lintasan
Pertimbangan Bohr adalah berdasarkan teori kuantum Max Planck tentang spektrum garis.
Spektrum unsur berupa spektrum garis karena radiasi yang dihasilkan oleh gas yang berpijar (atom yang tereksitasi) hanya terdiri atas beberapa panjang gelombang secara terputus – putus.
Setiap unsur menghasilkan spektrum yang khas karena tingkat energi radiasi yang dipancarkan oleh suatu unsur saat elektron melakukan perpindahan adalah berbeda-beda.
Sekitar tahun 1913 Niels-Bohr mengemukakan model atom yang mampu memperbaiki model atom Rutherford sebagai berikut :
a. Atom terdiri dari inti atom yang bermuatan positif sebagai pusat massa dan elektron-elektron yang bermuatan negatif yang bergerak mengelilingi inti pada tingkat energi tertentu (lintasan elektron/kulit atom/orbit).
b. Atom bergerak pada lintasan tertentu dengan energi tertentu.
c. Selama elektron bergerak pada lintasan stationer tidak memancarkan atau menyerap energi.
d. Penyerapan atau pemancaran energi terjadi apabila elektron pindah lintasan.
Kelebihan :
Menerapkan teori kuantum untuk menjawab kesulitan dalam model atom Rutherford.
Menerangkan dengan jelas garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom hidrogen.
Kelemahan :
Hanya dapat menjelaskan atom yang sangat sederhana (contoh : atom hidrogen). Tidak dapat menerangkan efek Zeeman, yaitu spektrum atom yang lebih rumit jika
6. Hipotesis Louise de Broglie
Louis de Broglie meneliti keberadaan gelombang melalui eksperimen difraksi berkas elektron. Dari hasil penelitiannya inilah diusulkan “materi mempunyai sifat gelombang di samping partikel”, yang dikenal dengan prinsip dualitas.
Louis Victor de Broglie (sifat dualisme elektron). Selain sebagai partikel, elektron bergerak mengelilingi inti bersifat seperti gelombang .
Sifat gelombang dari partikel tersebut dapat dinyatakan dalam persamaan :
= berbentuk cahaya, sedangkan petir menunjukkan sifat pertikel berbentuk suara.
Jawaban Uji Kepahaman Anda Hal 16 : nomor 16-18
16. Ide pokok dari hipotesis Louis de Broglie adalah tentang gelombang materi.
17. Bukti percobaan yang mendukung kebenaran dari hipotesis Louis de Broglie adalah ketika ditemukan bahwa elektron menunjukkan sifat difraksi seperti halnya Sinar X.
Ide pokok dari hipotesis Louis de Broglie adalah tentang gelombang materi
Bukti percobaan yang mendukung kebenaran dari hipotesis Louis de Broglie adalah ketika ditemukan bahwa elektron menunjukkan sifat difraksi seperti halnya Sinar X.
9 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - -
7. Warner Karl Heisenberg
Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantum yang dikenal dengan prinsip ketidakpastianyaitu “Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom”.
Karena elektron bersifat sebagai gelombang maka kedudukan elektron disekeliling inti tidak dapat ditentukan letaknya dengan pasti
8. Erwin Schrodinger (teori kebolehjadian)
Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi
gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
Orbit adalah lintasan berbentuk lingkaran dengan jari – jari tertentu.
Orbital menyatakan suatu daerah dalam ruang (tiga dimensi) dimana terdapat kebolehjadian paling besar menemukan elektron di daerah itu.
Azas ketidakpastian Heisenberg adalah bahwa tidak ada metode eksperimen yang dapat dilakukan untuk menentukan posisi sekaligus kecepatan elektron dengan pasti.
Gambar 1.13
Heisenberg
Ide pokok dalam teori atom mekanika kuantum adalah persamaan gelombang Schrodinger, untuk mendeskripsikan keberadaan electron dalam atom.
Sesuai teori mekanika kuantum, orbit elektron tidak berbentuk lingkaran karena dalam teori mekanika kuantum, posisi elektron tidak dapat dipastikan. Hal yang dapat dikatakan tentang posisi elektron adalah peluang menemukan elektron pada setiap titik dalam ruang di sekitar inti.
Gambar 1.14 Schrodinger
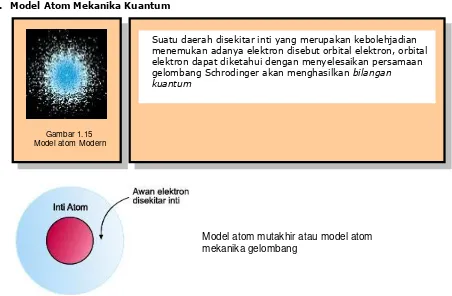
9. Model Atom Mekanika Kuantum
Model atom mutakhir atau model atom mekanika gelombang
Model atom Bohr hanya berlaku pada atom yang tersusun atas inti dan satu elektron, belum dapat menjelaskan intensitas garis spektra. Berdasarkan sifat dualisme partikel gelombang yang dikemukakan oleh Louis de Broglie (1923-1924) dan azas ketaktentuan Heisenberg, sekitar tahun 1926 Heisenberg dan Schrodinger secara terpisah menyusun suatu persamaan gelombang yang digunakan untuk mempelajari perilaku elektron yang berada di sekitar inti atom, yang selanjutnya dikenal model atom mekanika gelombang atau mekanika kuantum, yang didasarkan pada sifat elekron sebagai partikel maupun gelombang. Sampai saat ini persamaan gelombang yang dikembangkan adalah persamaan Schrodinger.
Berdasarkan model atom mekanika gelombang maka kedudukan elektron di sekitar inti atom menjadi tidak tertentu, melainkan hanya suatu kebolehjadian, sehingga istilah orbit pada model atom Niels-Bohr tidak digunakan lagi, tetapi selanjutnya dikenal dengan orbital, yang menyatakan daerah di sekitar inti yang memiliki kebolehjadian paling besar untuk menemukan elektron.
Ringkasan gagasan dari para ahli berkaitan dengan perkembangan teori atom:
a. Ernest Rutherford, menyatakan bahwa atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif.
b. Max Planck, gagasannya tentang efek fotolistrik, dimana cahaya dengan energi yang cukup dapat menyebabkan elektron terlempar dari permukaan logam. Elektron tersebut akan tertarik ke kutub positif (anode) dan menyebabkan aliran listrik melalui rangkaian tersebut.
c. Niels Bohr, menurutnya spektrum garis menunjukkan bahwa elektron dalam atom hanya dapat beredar pada lintasan – lintasan dengan tingkat energi tertentu. Pada lintasan itu elektron dapat beredar tanpa pemancaran atau penyerapan energi. Lintasan elektron tersebut berupa lingkaran dengan jari – jari tertentu yang disebut sebagai kulit atom.
d. Louis de Broglie, mengemukakan hipotesis tentang gelombang materi. Menurut de Broglie, partikel yang bergerak sangat cepat mempunyai ciri – ciri gelombang.
e. Erwin Schrodinger, mengajukan teori atom mekanika kuantum, bahwa kedudukan elektron dalam atom tidak dapat ditentukan dengan pasti, yang dapat ditentukan adalah probabilitas menemukan elektron sebagai fungsi jarak dari inti atom.
f. Werner Heisenberg, mengajukan teori azas ketidakpastian bahwa tidak ada metode eksperimen yang dapat dilakukan untuk menentukan posisi sekaligus kecepatan elektron.
Gambar 1.15 Model atom Modern
11 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - - Latihan 1
Pilihlah jawaban yang paling benar
1. Elektron beredar mengelilingi inti atom pada tingkat-tingkat energi tertentu dengan kecepatan tertentu tanpa menyerap atau membebaskan energi. Pernyataan ini dikemukakan oleh ....
a. Thomson b. Rutherford c. Niels Bohr d. R . Millikan e. Dalton
2. Model atom Rutherford ditunjukkan pada gambar ....
a.
b.
c.
3. Elektron dalam mengelilingi inti tidak akan jatuh ke inti karena a. Elektron selalu bergerak sambil melepas dan menyerap energi
b. Elektron bergerak mengelilingi inti pada lintasan dan jarak tertentu dari inti c. Elektron massanya sangat kecil
d. Energi tolak – menolak antara inti dengan elektron sangat besar e. Elektron bergerak dengan kecepatan sangat tinggi
4. Teori yang menjadi dasar timbulnya teori atom modern adalah a. Penemuan spektrum atom hidrogen
b. Penemuan tabung sinar katode c. Penghamburan sinar alfa d. Penemuan sinar saluran
e. Penemuan teori mekanika gelombang
5. Pernyataan berikut yang merupakan kelemahan teori atom Niels Bohr adalah a. Pada saat mengelilingi inti elektron selalu dalam keadaan stasioner b. Hanya dapat berhasil baik untuk atom yang sederhana seperti hidrogen c. Atom dalam keadaan tereksitasi akan kembali ke keadaan stabil
d. Elektron dapat berpindah ke tingkat energi yang lain e. Elektron berada pada tingkat energi tertentu
6. Pernyataan berikut yang bukan tentang teori atom Dalton adalah…
a. Atom adalah bagian terkecil dari materi yang tidak dapat dibagi lagi b. Atom tidak dapat diciptakan dan tidak dapat dimusnahkan
c. Atom dari unsur yang berbeda dapat bergabung membentuk senyawa
d. Reaksi kimia melibatkan pemisahan atau penggabungan atau penyusunan kembali atom- atom
e. Atom digambarkan sebagai roti kismis
d.
7. Kelemahan model atom Dalton adalah tidak dapat menerangkan… a. Atom berelektron banyak
b. Hubungan larutan senyawa dengan daya hantar listrik c. Elektron tidak jatuh ke inti
d. Susunan muatan positif dalam atom e. Adanya lintasan elektron
8. Konsep inti atom pertama kali dikemukakan oleh… a. Dalton
b. Thomson c. Rutherford d. Niels Bohr e. Max Planck
9. Percobaan spektrum warna dilakukan oleh… a. Dalton
b. Thomson c. Rutherford d. Niels Bohr e. Max Planck
10. Spektrum garis hanya dimiliki oleh… a. Atom-atom berelektron tunggal b. Atom-atom berelektron banyak c. Atom yang berpindah lintasan d. Elektron yang mengelilingi inti atom e. Elektron yang berpindah lintasan
11. Gagasan pokok dari teori atom Niels Bohr adalah tentang a. Gelombang partikel
b. Tingkat-tingkat energi c. Partikel cahaya d. Orbital
e. Asas ketidakpastian
12. Teori atom mekanika gelombang dikemukakan oleh a. Max Planck
b. Niels Bohr
13 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - - C. Bilangan Kuantum
Suatu daerah disekitar inti yang merupakan kebolehjadian menemukan adanya elektron disebut orbital elektron, orbital elektron dapat diketahui dengan menyelesaikan persamaan gelombang Schrodinger akan menghasilkan bilangan kuantum sehingga dengan bilangan kuantum posisi elektron dalam atom dapat diperjelas.
Persamaan model atom Bohr dengan Mekanika Kuantum
Keduanya menjelaskan dalam atom terdapat tingkat-tingkat energi (kulit atom)
Perbedaanmodel atom Bohr dengan Mekanika Kuantum
Model atom Bohr Model atom Mekanika Kuantum
Susunan kulit sederhana Susunan kulit lebih kompleks ( kulit – sub kulit – orbital )
Kedudukan orbital dalam suatu atom ditentukan oleh 3 bilangan kuantum yaitu bilangan kuantum utama (n), bilangan kuantum azimut (l) dan bilangan kuantum magnetik (m)
Kedudukan elektron dalam suatu atom ditentukan oleh 4 bilangan kuantum yaitu bilangan kuantum utama (n), bilangan kuantum azimut (l) dan bilangan kuantum magnetik (m)
Bentuk orbital
Subkulit- subkulit yang diijinkan pada kulit K sampai dengan N
Kulit Nilai n Sub kulit Nilai l yang diijinkan (---- s/d n – 1 )
K 1 1s 0
L 2 2s, 2p 0, 1
M 3 3s, 3p, 3d 0, 1, 2
N 4 4s, 4p, 4d, 4f 0, 1, 2, 3 K = 1 1s
L = 2 2s 2p
M = 3 3s 3p 3d
N = 4 4s 4p 4d 4f
O = 5 5s 5p 5d 5f
P = 6 6s 6p 6d
Q = 7 7s 7p
Nilai l = 0 sampai dengan (n-1)
Diagram berdasarkan urutan tingkat energi dari yang paling rendah (secara teoritis dianggap pada tingkat dasar subkulit g, h, dst. belum terisi elektron ) sebagai berikut :
Orbital s ( Bola pejal )
z
y
x
Orbital d ( 2 balon terpilin )
z
x
y z
y
x
Bilangan
Kerjakan Uji Kepahaman Anda ( disebalik halaman kertas ini )
a. Buku paket halaman 24 nomor 24 sampai dengan 29
17 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - - K = 1 1s
L = 2 2s 2p
M = 3 3s 3p 3d
N = 4 4s 4p 4d 4f
O = 5 5s 5p 5d 5f
P = 6 6s 6p 6d
Q = 7 7s 7p a.g Konfigurasi Elektron
Konfigurasi elektron : suatu gambaran penyebaran elektron dalam suatu atom
1. Aturan Aufbau
Pengisian elektron dimulai dari sub kulit dengan tingkat energi yang rendah ke sub kulit atom dengan tingkat energi yang lebih tinggi
Berikut urutan pengisian elektron berdasarkan kenaikan tingkat energi :
Berilah s mulai nomor 1, p mulai nomor 2, d mulai nomor 3 dan f mulai nomor 4 sehingga :
1s2 / 2 s2 2p6 / 3 s2 3 p6 / 4 s2 3d10 4 p6 / 5s2 4d10 5p6 / 6s2 4f 14 5d10 6p6 /7 s2 5f14 6d 10 7p6
2 He 10 Ne 18 Ar 36 Kr 54 Xe 86 Rn
Untuk memudahkan penyusunan konfigurasi gas mulia, perhatikan skema berikut dan cara mengingatnya :
1s2
2 He 2s2 2p6
10 Ne 3s2 3 p6
18 Ar 4s2 3d10 4 p6
36 Kr 5s2 4d10 5p6
54 Xe 6s2 4f 14 5d10 6p6
86 Rn 7s2 5f14 6d 10 7p6
Konfigurasi elektron pada sub kulit d cenderung penuh (10 e ) atau ½ penuh ( 5 e ) supaya stabil
24 Cr : ( 18Ar ) 4 s2 3 d4 : ( 18Ar ) 4 s1 3 d5
29 Cu : ( 18Ar ) 4 s2 3 d9 : ( 18Ar ) 4 s1 3 d10
s (1x) s p (2x) s d p (2x) s f d p (2x)
2. Aturan Hund
Pengisian elektron dalam suatu orbital 1 elektron mengisi masing-masing orbital dengan arah ke atas baru setelah semua orbital terisi 1 elektron, maka berikutnya elektron mengisi orbital dengan arah yang berlawanan contoh : 3p5 ↑↓ ↑↓ ↑
3. Larangan Pauli
Dalam suatu atom tidak mungkin dalam satu orbital ada 2 elektron dengan keempat bilangan kuantum yang sama
Jika 2 elektron berada dalam satu orbital yang sama, maka mempunyai bilangan kuantum n, l, m yang sama tetapi bilangan kuantum s berbeda yaitu +1/2 dan -1/2
SISTEM PERIODIK UNSUR
Penjelasan Sistem Periodik Unsur Bentuk Panjang
Disusun oleh Moseley dengan dasar kenaikan nomor atom
Golongan : menunjukkan elektron valensi, unsur dalam satu golongan mempunyai sifat kimia sama
Periode : menunjukkan jumlah kulit (lintasan), unsur dalam satu periode mempunyai jumlah lintasan (kulit) yang sama
Kerjakan soal berikut dengan benar
1. Tentukan jumlah proton, netron dan elektron
3919 K : p = n = e =
5224Cr3+ : p = n = e =
8035Br- : p = n = e =
2. 126C 147N 168O 2311Na+ 199F- 3919K 1021Ne 146C
Tentukan pasangan yang merupakan :
a. isotop :
b. isobar :
c. isoton :
d. isoelektron :
e. isodiapher :
3. Tentukan konfigurasi elektron gas mulia/golongan-periode dari atom dengan nomor
atom :
a. 38 : gol : per :
b. 53 : gol : per :
c. 29 : gol : per :
d. 57 : gol : per :
e. 93 : gol : per :
4. Tentukan konfigurasi elektron sesuai sub kulit dan kulit dari ion suatu unsur dengan nomor atom :
a. 55A+ :
b. 82B2+ :
c. 42C3+ :
21 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - - 5. Tentukan nomor atom dari unsur yang terletak dalam :
a. II A – 5 :
b. IA – 4 :
c. VII A – 6 :
d. V B – 4 :
e. I B – 5 :
f. III B – 4 :
g. III B – 6 :
6. Tentukan keempat bilangan kuantum untuk elektron terakhir dari suatu unsur dengan nomor atom :
a. 56 :
n = l = m = s =
b. 35 :
n = l = m = s =
c. 27 :
n = l = m = s =
Tentukan keempat bilangan kuantum untuk elektron terluar dari suatu unsur dengan
nomor atom :
d. 35 :
n = l = m = s =
e. 91 :
n = l = m = s =
7. Tentukan nomor atom dari unsur dengan bilangan kuantum untuk elektron terakhir
a. n = 4 l = 2 m = -1 s = -1/2
b. n = 5 l = 1 m = 0 s = +1/2
c. n = 6 l = 0 m = 0 s = -1/2
d. n = 3 l = 2 m = +2 s = -1/2
e. n = 4 l = 3 m = -2 s = +1/2
1s2 / 2 s2 2p6 / 3 s2 3 p6 /4 s2 3d10 4 p6 / 5s2 4d10 5p6 / 6s2 4f 14 5d10 6p6 / 7 s2 5f14 6d 10 7p6 2 He 10 Ne 18 Ar 36 Kr 54 Xe 86 Rn
NOMOR
KULIT 1( K ) 2 ( L ) 3 ( M ) 4 ( N ) 5 ( O ) 6 ( P ) 7 ( Q )
Jml e max 2 8 18
8. Suatu unsur Ag mempunyai nomor massa 108 dan netron 61 ( Ag ) Tentukan :
a. Proton : elektron :
b. Konfigurasi elektron sesuai sub. kulit pada keadaan dasar : Golongan : periode : blok :
c. Konfigurasi elektron sesuai kulit pada keadaan dasar :
d. Konfigurasi elektron ion Ag :
f. Konfigurasi elektron sesuai kulit ion Ag :
g. Jumlah kulit yang terisi elektron pada keadaan dasar :
h. Jumlah sub. kulit yg terisi elektron pada keadaan dasar :
i. Jumlah elektron tunggal pada keadaan dasar :
j. Jumlah elektron valensi pada keadaan dasar :
Kulit valensi :
k. Jumlah orbital yang terisi pasangan elektron pada keadaan dasar :
l. Jumlah orbital yang terisi elektron pada keadaan dasar :
m. Keempat bilangan kuantum elektron terakhir pada keadaan dasar ( ) : n = l = m = s =
n Keempat bilangan kuantum untuk elektron terluar pada keadaan dasar ( ) : n = l = m = s =
o. Keempat bilangan kuantum untuk elektron terakhir ion Ag ( ) : n = l = m = s =
p. Bilangan oksidasi maksimum :
Menentukan bilangan oksidasi maksimum suatu unsur
Untuk unsur blok d (golongan B) bilangan oksidasi maksimum adalah total semua elektron pada sub kulit s terakhir ditambah elektron tunggal pada sub kulit d yang tidak berpasangan ( s d tunggal)
23 Drs. Susena SMA Karangturi Kimia Kelas XI IPA - - -
i. Suatu atom mempunyai 4 lintasan dan elektron valensi 7 dan terakhir pada sub kulit p. Tentukan nomor atom unsur tersebut
ii. Suatu atom mempunyai 5 lintasan dan elektron valensi 4 terakhir pada sub kulit d. Tentukan nomor atom dari unsur tersebut
iii. Suatu atom mempunyai bilangan kuantum n = 4 l = 2 m = 0 s = -1/2. Tentukan nomor atom unsur tersebut
iv. Suatu atom mempunyai bilangan kuantum n = 5 l = 1 m = 1 s = +1/2. Tentukan nomor atom unsur tersebut
v. Unsur X- mempunyai konfigurasi 2 8 18 8 dan netron = 20. Tentukan nomor atom dan nomor massa
unsur tersebut
9. Suatu unsur Fe mempunyai nomor massa 56 dan nomor atom 26 ( Fe) Tentukan :
a. Proton : elektron : netron :
b. Konfigurasi elektron sesuai sub. kulit pada keadaan dasar : Golongan : periode : blok :
c. Konfigurasi elektron sesuai kulit pada keadaan dasar :
d. Konfigurasi elektron sesuai sub kulit ion Fe3 :
f. Konfigurasi elektron sesuai kulit ion Fe3 :
g. Jumlah kulit yang terisi elektron pada keadaan dasar :
h. Jumlah sub. kulit yg terisi elektron pada keadaan dasar :
i. Jumlah elektron tunggal pada keadaan dasar :
j. Jumlah elektron valensi pada keadaan dasar :
Kulit valensi :
k. Jumlah orbital yang terisi pasangan elektron pada keadaan dasar :
l. Jumlah orbital yang terisi elektron pada keadaan dasar :
m. Keempat bilangan kuantum elektron terakhir pada keadaan dasar ( ) : n = l = m = s =
o. Keempat bilangan kuantum untuk elektron terakhir ion Fe3 ( ) : n = l = m = s =
p. Bilangan oksidasi maksimum :
i. Suatu atom mempunyai 5 lintasan dan elektron valensi 6, terakhir pada sub kulit p. Tentukan nomor atom unsur tersebut
ii. Suatu atom mempunyai 4 lintasan dan elektron valensi 7 terakhir pada sub kulit d. Tentukan nomor atom dari unsur tersebut
iii. Suatu atom mempunyai bilangan kuantum n = 5 l = 1 m = -1 s = -1/2.Tentukan nomor atom unsur tersebut
iv. Suatu atom mempunyai bilangan kuantum n = 4 l = 2 m = 0 s = +1/2. Tentukan nomor atom unsur tersebut
v. Unsur X2+ mempunyai konfigurasi 2 8 8 dan netron = 20. Tentukan nomor atom dan nomor
massa unsur tersebut
10. a. Suatu unsur A bervalensi dua sebanyak 16,8 gram, dilarutkan kedalam HCl berlebih dan diperoleh 6,72 liter gas hidrogen (STP). Jika logam ini memiliki 30 neutron, maka letaknya dalam sistem periodik….
b. Sebanyak 5,2 gram suatu gram trivalen direaksikan dengan larutan HCl dan menghasilkan 3,36
liter gas hidrogen (STP). Jika atom logam tersebut mengandung 28 neutron, maka bilangan kuantum elektron terakhir atom logam itu adalah...
Tugas Mandiri ( PR )
Kerjakan buku paket latihan 1.1 halaman 39-40 nomor 1 sampai dengan 22 (di kertas folio)
Dikumpulkan pada tanggal : Senin, 10 Agustus 2009(nilai tugas)
25
2. Unsur X dengan nomor atom 24 dalam sisitem periodik terletak pada.... a. Golongan IIA, periode 4
b. Golongan VIIA, periode 3 c. Golongan VIIB, periode 4 d. Golongan VIB, periode 4 e. Golongan VIIIB, periode 5
3. Unsur X dengan massa 59, dalam intinya terdapat 31 neutron. Dalam sistem periodik, unsur tersebut terletak pada...
5. Suatu unsur mempunyai konfigurasi elektron : [54Xe] 4f3 6s2. Unsur tersebut dalam sistem periodik termasuk dalam….
6. Perhatikan tabel lambang unsur dan nomor atomnya berikut.
7. Di antara unsur-unsur berikut : 11P, 19Q, 21R, 29S, 35T, pasangan unsur yang termasuk ke dalam sistem periodik terletak pada….
a. Golongan IA, periode 4 b. Golongan IB, periode 4 c. Golongan VB, periode 5
d. Golongan VIA, periode 3 e. Golongan VIB, periode 4
9. Pasangan unsur-unsur di bawah ini yang memiliki elektron valensi yang sama yaitu.... a. 3Li dan 13Al
b. 11Na dan 19K c. 12Mg dan 30Zn
d. 5B dan 21Sc e. 7N dan 17Cl
10. Unsur A, B, C, D, dan E mempunyai konfigurasi elektron sebagai berikut. A : 1s2 2s2 2p6 3s2
B : 1s2 2s2 2p6 3s1 C : 1s2 2s2 2p6 3s2 3p6
D : 1s2 2s2 2p6 3s23p6 3d10 4s2 E : 1s2 2s2 2p6 3s2 3p6 3d10 4p6 4s2
Pasangan yang merupakan unsur-unsur dari satu golongan yang sama adalah… a. A dan B
b. A dan C c. A dan D
d. A dan E e. C dan E
11. Jika atom X yang bernomor atom 19 dituliskan konfigurasinya, maka atom itu memiliki ciri-ciri….
a. Elektron valensinya adalah 9, valensinya 1 b. Elektron valensinya adalah 1, valensinya 1 c. Elektron valensinya adalah 7, valensinya 1 d. Elektron valensinya adalah 2, valensinya 2 e. Elektron valensinya adalah 7, valensinya 2
12. Konfigurasi elektron ion L3+ adalah 1s2 2s2 2p6 3s2 3p6 3d3. Dalam sisitem periodik, atom
Sedangkan jika diketahui data elektronegatifitas, digunakan konsep selisih elektronegatifitas untuk menetukan ikatan kovalen dan ikatan ion
1. Jika dua atom yang berikatan memiliki perbedaan keelektronegatifan kurang dari 1,67 maka ikatannya adalah kovalen
2. Jika dua atom yang berikatan memiliki perbedaan keelektronegatifan lebih dari 1,67 maka ikatannya adalah ion
Perbedaan senyawa ion dan senyawa kovalen
3. Geometri Bentuk Molekul
Teori Domain Elektron
Geometri dapat diramalkan dari teori domain elektron.
Domain elektron adalah kedudukan elektron atau daerah kedudukan elektron. Jumlah domain elektron ditentukan dengan aturan berikut :
1. Setiap satu ikatan ( ikatan tunggal, rangkap 2, rangkap 3, koordinasi) merupakan satu domain.
2. Setiap satu pasang elektron bebas merupakan satu domain
Tentukan jumlah domain elektron atom pusat dalam molekul berikut a. PCl3 b, CH4 c. XeF2
N0 Sifat-sifat Senyawa Ion Senyawa Kovalen
1 Titik didih Sangat tinggi Relatif rendah
2 Volatilitas Sulit menguap Lebih mudah menguap
3 Daya hantar listrik Padat : isolator Padat : isolator
Cair : konduktor Cair : isolator
Larutan : konduktor Larutan : ada yang konduktor
4 Kelarutan dalam air Umumnya larut Umumnya tidak larut
29 Modul Kimia Kelas XI - - - Dasar teori domain elektron adalah sebagai berikut
1. Antar domain akan menyusun diri, sehingga menghasilkan tolakan minimum
2. Domain elektron bebas mempunyai gaya tolak lebih kuat, sehingga akan mengambil posisi yang lebih terbuka.
3. Geometri domain ditentukan oleh seluruh domain (elektron bebas dan elektron ikatan) 4. Geometri molekul hanya ditentukan domain elektron ikatan
Domain
elektron PEB = 0 1 PEB 2 PEB 3 PEB
2
3
4
5
Linier
Trigonal planar Bengkok
Trigonal piramid Bengkok
Trigonal bipiramid Seesaw Bentuk-T Linnier
6
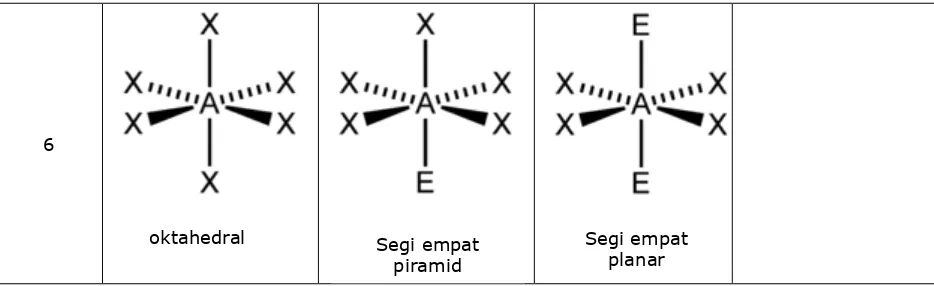
Tabel bentuk Molekul
PE Total PEI PEB Bentuk Molekul Contoh Polar/Non Polar
2 2 0 Linier BeCl2 Non polar
3 3 0 Trigonal planar/ ∆ sama sisi BF3 Non polar
3 2 1 Sudut V SO2 Polar
4 4 0 Tetrahedral CH4 Non polar
4 3 1 Trigonal Piramid NH3 Polar
4 2 2 Sudut V H2O Polar
5 5 0 Trigonal Bipiramid PCl5 Non polar
5 4 1 Tetrahedral Terdistorsi TeCL4 Polar
5 3 2 Huruf T IF3 Polar
5 2 3 Linier XeF2 Non polar
6 6 0 Oktahedral SF6 Non polar
6 5 1 Tetragonal Piramid IF5 Polar
6 4 2 Segiempat Datar/ Bujur sangkar
XeF4 Non polar
Kerjakan soal Uji Kepahaman Anda halaman 52 nomor 50 Uji Kepahaman Anda halaman 53 nomor 51
PEB = 2
PEI Gol
Segi empat piramid
31 Modul Kimia Kelas XI - - - Notasi Tipe Molekul
Seluruh domain dalam suatu pusat dari suatu molekul dinatakan dengan notasi :
AXaEb
E pada senyawa binner berikatan tunggal E pada senyawa binner berikatan rangkap atau gugus pengeliling merupakan unsur VIA ( O atau S )
Keterangan : A = atom pusat
X = jumlah domain elektron ikatan atau jumlah atom yang terikat pada atom pusat E = jumlah domain elektron bebas
Ev = jumlah elektron valensi dari atom pusat
Tentukan tipe molekul senyawa berikut (kerjakan disebalik halaman ini) a. H2O, BF3, SF4, IF3, XeF4, CH4, NCl3
b. SO3, XeO4, POCl3, SO2, XeO3, XeOF4, SOCl2
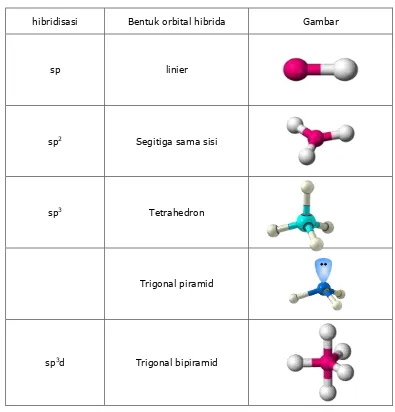
5. Hibridisasi (pembastaran)
hibridisasi Bentuk orbital hibrida Gambar
sp linier
sp2 Segitiga sama sisi
sp3 Tetrahedron
Trigonal piramid
sp3d Trigonal bipiramid
E = 2
)
( Ev X
E =
2 ) 2
sp3d2 oktahedron
Tentukan tipe hibridisasi dalam molekul berikut (kerjakan disebalik halaman ini) a. CH4, NH3, H2O, XeF4
b. ClF3, SF4, IF5, BF3
5. Ikatan antar molekul
Jika pada saat antar atom berikatan membentuk molekul, berikutnya antar molekul yang terbentuk bergabung dengan gaya ikatan tertentu yang meliputi :
a. Gaya dispersi (non dipol-non dipol/dispersi London) b. Gaya dipol-non dipol
c. Gaya dipol-dipol (dipol permanen )
d. Ikatan hidrogen
Jika gaya tarik antar molekul semakin kuat maka titik lebur menjadi lebih tinggi dan semakin tinggi pula titik didih molekul tersebut.
Ikatan Van Der Waals
Gaya Van Der Waals adalah gaya yang sangat lemah antar molekul secara kolektif, meliputi :
a. Gaya dispersi/dispersi london ( molekul non polar – non polar )
Gaya dispersi adalah gaya tarik antar molekul karena adanya polarisasi sesaat
Polarisasi terjadi karena elektron dalam molekul selalu bergerak dari daerah satu ke daerah yang lain
Polarisasi pada suatu molekul mengimbas molekul disekitarnya sehingga menghasilkan gaya tarik-menarik
Contoh : ikatan antar molekul non polar seperti N2, H2, He, O2, Br2 dan I2 dapat terjadi karena elektron pada molekul non polar tersebut dapat berpindah tempat sehingga dapat memiliki dipol sesaat, mengakibatkan terjadi gaya van der waals berupa gaya tarik antar dipol sesaat yang disebut dispersi London. Karena adanya gaya london maka gas nitrogen, hidrogen dan oksigen jika didinginkan dalam tabung bertekanan besar berwujud cair
Ikatan Van Der waals
3
1. Elektron dalam molekul
selalu pindah dari daerah satu ke daerah lain sehingga terjadi polarisasi sesaat.
2. Molekul yang telah terpolar
asasi menginduksi (mengimbas) molekul non polar disekitarnya (ujung + menarik elektron non dipol)
3. Terbentuk molekul-molekul
yang terpolarisasi sesaat sehingga terjadi gaya 1
33 Modul Kimia Kelas XI - - - Polarisabilitas
Polarisabilitas adalah kemampuan suatu molekul untuk dapat mengalami polarisasi sesaat Semakin besar polarisabilitas semakin besar pula gaya dispersinya
Pada molekul yang Mr atau polarisabilitasnya hampir sama, molukul yang bentuknya memanjang mempunyai polarisabilitas lebih besar dibanding molekul yang bentuknya bulat karena ruang untuk terjadinya gaya dispersi pada molekul bentuk panjang lebih luas.
Contoh pentana, lebih polar dari pada neo pentana sehingga titik didih pentana lebih tinggi karena pada pentana ruang untuk terjadinya gaya tarik menarik lebih banyak.
b. Gaya dipole - non dipole ( pada senya polar – non polar )
Gaya antara molekul polar dengan molekul non polar akan menghasilkan gaya dipole-dipole terimbas. Molekul polar akan mengimbas molekul non polar disekitarnya sehingga mengalami polarisasi, mengakibatkan dipole yang berlawanan muatannya saling tarik-menarik.
Interaksi antara molekul dipol dan non dipol terjadi secara induksi.
Contoh : Oksigen (molekul non dipol) dapat larut dalam air (molekul dipol) hal ini disebabkan karena ujung molekul air (dipol) menginduksi oksigen (non dipol) membentuk dipol sesaat
b. Gaya dipole – dipole
Pada senyawa molekul polar mempunyai dipole permanen
Masing-masing molekul akan menyusun diri sedemikian hingga pole-pole (kutub-kutub) yang berlawanan saling berdekatan, mengakibatkan terjadinya gaya tarik-menarik.
Contoh : ikatan antar molekul HCl, antar molekul Molekul bentuk
b. Ikatan Hidrogen
Ikatan hidrogen adalah ikatan antar molekul yang sangat polar dimana terjadi ikatan antara
atom hidrogen dengan pasangan elektron bebas dari unsur yang sangat elektronegatif
N, O dan F membentuk senyawa NH3, H2O dan HF
Senyawa yang mempunyai ikatan hidrogen adalah : R-COOH, R-OH, H2O, HF dan NH3
Ikatan hidrogen antar molekul H2O dapat digambarkan sebagai berikut :
H H H | | |
H––– O ––– H ––– O ––– H ––– O –––
–– H ––– O –––H ––– O–––
H H
6. Urutan menentukan titik didih
I II III
Ikatan hidrogen H2O, HF, NH3,
R-OH
Mr terbesar Polarisabilitas
terbesar
Ada gugus karbonil
35 Modul Kimia Kelas XI - - - Diantara kelompok senyawa dibawah ini, tentukan molekul dengan titik didih tertinggi dalam kelompok tersebut, serta berikan penjelasannya
a. HCl, HBr, HF ,HI
Dari data tersebut, jenis ikatan yang terdapat dalam senyawa X dan Y berturut-turut adalah ... a. kovalen dan hidrogen
b. kovalen non polar dan ion c. ion dan kovalen polar
d. hidrogen dan kovalen non polar e. ion dan kovalen koordinat
2. Perhatikan gambar konfigurasi kulit dari beberapa unsur berikut
Pasangan yang menghasilkan ikatan ion dengan rumus senyawa yang benar adalah a. ED2 a. Semakin besar Mrr titik didih semakin besar b. Semakin kecil Mr, titik didih semakin besar
c. Titik didih HI terkecil karena HI membentuk ikatan hidrogen d. Titik didih HF terbesar karena HF membentuk ikatan hidrogen e. Semakin kecil beda keelektronegatifan, titik didih semakin besar
A B C D E
4. Unsur X terdapat dalam golongan IVA dan unsur Y mempunyai nomor atom 17. Senyawa yang dapat terbentuk dari kedua unsur tersebut adalah XY4. Perhatikan pernyataan berikut :
1. molekul XY4 bersifat non polar 2. X dan Y berikatan kovalen polar
3. antar molekul XY4 terjadi ikatan Van der Waals
4. ada 4 pasang elektron terikat dan 4 pasang elektron bebas Pernyataan yang paling tepat adalah....
5. Tekanan uap jenuh dari beberapa zat diperoleh sebagai berikut :
Zat Tekanan Uap Jenuh (cmHg)
Berdasarkan data di atas, zat yang mempunyai ikatan hidrogen adalah .... a. Zat A
7. Pasangan senyawa di bawah ini yang merupakan senyawa ion adalah… a. KCl dan MgBr2
b. CCl4 dan NH3 c. SO2 dan HCl
d. H2O dan KBr e. KCl dan HCl
8. Unsur X mempunyai nomor atom = 12. Unsur Y mempunyai nomor atom = 17. Senyawa yang terbentuk dari kedua unsur ini mempunyai rumus…
a. XY b. X2Y c. XY2
d. X2Y3 e. XY3
12. Pasangan unsur yang dapat membentuk ikatan kovalen adalah ….
13. Di antara senyawa berikut yang paling polar adalah .... a. HF
b. HCl c. F2
d. HBr e. HI
14. Kelompok senyawa berikut yang ketiganya berikatan ion adalah... a. HCl, NaCl, MgCl2
b. NaCl, MgCl2, KCl c. HCl, H2O, CH4
d. CH4, H2O, KCl e. HBr, KBr, CH4
15. Empat unsur A, B, C, dan D masing-masing mempunyai nomor atom 6, 8, 17, dan 19. Pasangan yang paling ionik adalah…
17. Unsur X yang termasuk golongan oksigen tidak dapat membentuk senyawa atau ion….. a. X 2-gas yang dapat mengeruhkan air barit. Rumus senyawa tersebut adalah….
a. X2SO4 b. XSO4 c. X2CO3
d. XCO3 e. XCl2
19. Suatu senyawa ion mempunyai formula XCl, maka formula oksida X adalah… a. XO
21. Jika unsur A membentuk senyawa stabil A(NO3)2, maka konfigurasi elektron unsur tersebut adalah....
22. Sebuah atom netral X mempunyai konfigurasi elektron sebagai berikut. 1s2 2s2 2p6 3s2
Jika unsur tersebut membentuk hidrida, maka kemungkinan senyawa yang terbentuk adalah…. a. ionik dengan rumus XH2
b. ionik dengan rumus XH c. kovalen dengan rumus XH2
23. Unsur P (nomor atom 15) bersenyawa dengan unsur Cl (nomor atom 17) membentuk PCl3. Banyaknya pasangan elektron bebas pada atom pusat dalam senyawa PCl3 adalah...
a. 0 b. 1 c. 2
d. 3 e. 4
24. Diketahui nomor atom H = 1, C = 6, N = 7, O = 8, P = 15, dan Cl = 17. Senyawa berikut mengikuti aturan oktet, kecuali....
a. CHCl3 b. NH3 c. H2O
d. CH4 e. PCl5
25. Titik didih HF lebih tinggi daripada HCl. Hal ini disebabkan karena antara molekul-molekul HF terdapat ikatan...