UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT INDOFARMA (Persero) Tbk
JALAN INDOFARMA NO 1 CIBITUNG BEKASI
PERIODE 1 APRIL – 31 MEI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
ANONDINI FEBRIAN GANESTIA, S.Farm
1206312832
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
ii
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT INDOFARMA (Persero) Tbk
JALAN INDOFARMA NO 1 CIBITUNG BEKASI
PERIODE 1 APRIL – 31 MEI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
ANONDINI FEBRIAN GANESTIA, S.Farm
1206312832
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
iv
KATA PENGANTAR
Puji syukur atas kehadirat Allah S.W.T, karena rahmat dan hidayah-Nyalah penulis dapat melaksanakan dan menyelesaikan Praktek Kerja Profesi Apoteker di PT Indoofarma (Persero) Tbk. Penyusunan laporan ini tidak lepas dari dukungan moral dan spiritual seluruh pihak yang ada di sekeliling penulis. Oleh karena itu pada kesempatan kali ini penulis ingin mengucapkan terima kasih kepada:
1. Hugo Koen Christanto, S.Farm, Apt untuk bimbingan dalam pengerjaan tugas umum serta pembelajaran selama Praktek Kerja Profesi Apoteker.
2. Ananta Wiguna Firdaus, S.Si, Apt. untuk bimbingan dalam pengerjaan tugas khusus serta pembelajaran selama Praktek Kerja Profesi Apoteker.
3. Dra. Maryati K, M.Si., Apt., selaku pembimbing yang selalu memberikan bimbingan, saran dan wawasan yang sangat berharga selama melakukan Praktek Kerja Profesi Apoteker hingga tersusunnya laporan ini.
4. Prof. Dr. Yahdiana Harahap, MS., Apt., sebagai Dekan Fakultas Farmasi UI yang telah memberi ijin dan kesempatan untuk melakukan Praktek Kerja Profesi Apoteker.
5. Bapak Dr. Harmita, Apt., selaku Ketua Program Profesi Apoteker Fakultas Farmasi UI yang telah memberikan kesempatan untuk melakukan Praktek Kerja Profesi Apoteker.
6. Bapak Supriyadi, selaku koordinato PKPA PT Indofarma (Persero) Tbk atas izin dan kesempatan yang diberikan sehingga terlaksananya Praktek Kerja Profesi Apoteker (PKPA) di PT Indofarma (Persero) Tbk.
7. Lany Marliany, S.Si, Apt, selaku Manajer bidang Strategi Pengembangan Produk Kesehatan (SPPK) atas izin dan kesempatan yang diberikan untuk pelaksanaan PKPA di bidang SPPK
8. Seluruh karyawan di PT Indofarma (Persero) Tbk atas bantuan yang telah diberikan selama masa Praktek Kerja Profesi Apoteker ini.
9. Keluarga yang selalu memberikan dukungan, perhatian, kepercayaan, kasih sayang yang tak ternilai.
v Kerja Profesi Apoteker.
11.Teman – teman Program Praktek Kerja Profesi Apoteker PT Indofarama Angkatan 67 atas persahabatan dan kerjasama selama masa Praktek Kerja Profesi Apoteker.
12. Semua pihak yang tidak dapat disebutkan satu per satu yang telah memberikan bantuan dan dukungan selama Praktek Kerja Profesi Apoteker. Penulis menyadari sepenuhnya bahwa laporan ini tidak luput dari kesalahan dan kekurangan. Oleh karena itu, kritik dan saran yang membangun penulis harapkan demi perbaikan dan penyempurnaan. Penulis berharap laporan ini dapat bermanfaat dalam perkembangan ilmu pengetahuan dan bagi para pembaca.
Penulis
vii
Halaman
HALAMAN SAMPUL ...i
HALAMAN JUDUL ...ii
HALAMAN PENGESAHAN ...iii
KATA PENGANTAR ...iv
DAFTAR ISI ...vi
DAFTAR GAMBAR ...vii
DAFTAR LAMPIRAN ...viii
BAB 1 PENDAHULUAN ...1
1.1 Latar belakang ...1
1.2 Tujuan ...2
BAB 2 TINJAUAN PUSTAKA ...3
2.1 Industri Farmasi ...3
2.2 Cara Pembuatan yang Baik (CPOB) ...4
BAB 3 TINJAUAN KHUSUS PT INDOFARMA (Persero) Tbk ...20
3.1 Sejarah PT Aventis Pharma ...20
3.2 Visi, Misi, Motto dan Logo PT Indofarma (Persero) Tbk ...23
3.3 Nilai Budaya yang Dikembangkan PT Indofarma (Persero) Tbk ...25
3.4 Kebijakan Mutu Perusahaan ...26
3.5 Kedudukan, Fungsi, dan Peranan PT Indofarma (Persero) Tbk ...27
3.6 Lokasi dan Bangunan ...28
3.7 Produk PT Indofarma (Persero) Tbk ...29
3.8 Struktur Organisasi PT Indofarma (Persero) Tbk ...29
BAB 4 PEMBAHASAN ...66
4.1 Tinjauan Umum PT Indofarma (Persero) Tbk ...66
4.2Penerapan CPOB di PT Indofarma (Persero) Tbk ...67
BAB 5 KESIMPULAN DAN SARAN ...77
5.1 Kesimpulan ...77
5.2 Saran...77
viii
Halaman Gambar 1. Logo PT Indofarma (Persero) Tbk ... 24
ix
Halaman
Lampiran 1 Denah Lokasi PT. Indofarma (Persero) Tbk. ... 80
Lampiran 2 Denah lokasi PT. Indofarma (Persero) Tbk. ... 81
Lampiran 3 Struktur Organisasi PT. Indofarma (Persero) Tbk. ... 82
Lampiran 4 Struktur Organisasi Direktorat Produksi ... 83
Lampiran 5 Alur Proses Peluncuran Produk Baru ... 84
Lampiran 6 Alur Proses Pembuatan Sediaan Tablet ... 85
Lampiran 7 Alur Proses Pembuatan Sediaan Kapsul ... 86
Lampiran 8 Alur Proses Produksi Sediaan Cair Oral (Sirup) ... 87
Lampiran 9 Alur Proses Pembuatan Sediaan Serbuk ... 88
Lampiran 10 Alur Proses Produksi Sediaan Salep ... 89
Lampiran 11 Alur Proses Produksi Sediaan Sirup Kering ... 90
Lampiran 12 Alur Pengolahan Produk Jadi Herbal Bentuk Cair ... 91
Lampiran 13 Alur Pengolahan Produk Herbal Bentuk Solid ... 92
Lampiran 14 Alur Proses Produksi Sediaan β-Laktam ... 93
Lampiran 15 Alur Proses Produksi Sediaan Steril ... 94
Lampiran 16 Alur Proses Produksi Sediaan Steril Aseptis (dibawah LAF) ... 95
Lampiran 17 Alur Produk dalam Pengemasan ... 96
Lampiran 18 Sistem Informasi Dalam Perencanaan Produksi dan Pengendalian Persediaan ... 97
Lampiran 19 Skema Peran PPPP/PPIC... 98
Lampiran 20 Sistem Pengolahan Air PT.Indofarma (Persero) Tbk... 99
Lampiran 21 Instalasi Pengolahan Air di PT.Indofarma (Persero) Tbk. 100
x
Lampiran 24 Sistem Informasi Perencanaan Produksi dan Pengendalian
Persediaan ... 103
Lampiran 25 Skema Peran PPPP/PPIC 104
Lampiran 26 Bagan Sistem Pengolahan Air PT Indofarma (Persero)
Tbk ... 105 Lampiran 27 Bagan Sistem Pengaturan Udara PT Indofarma (Persero)
Tbk ... 106 Lampiran 28 Tabel Instalasi Penolahan Air di PT Indofarma (Persero)
Tbk ... 107 Lampiran 29 Bagan Sistem Instalasi Penngolahan Air Limbah (PAL)
1.1. Latar Belakang
Kesehatan adalah salah satu hak asasi manusia yang dijamin pemeliharaannya dalam undang-undang. Berdasarkan Undang-Undang Republik Indonesia No. 36 tahun 2009 tentang kesehatan, yang dimaksud dengan sehat adalah keadaan sejahtera dari badan dan jiwa yang memungkinkan setiap orang hidup produktif secara sosial dan ekonomi. Pembangunan kesehatan adalah segala upaya yang diarahkan guna mencapai kesadaran, kemauan, dan kemampuan masyarakat untuk hidup sehat. Upaya kesehatan meliputi upaya peningkatan kesehatan (promotif), pencegahan penyakit (preventif), penyembuhan penyakit (kuratif), dan pemulihan kesehatan (rehabilitatif).
Penyelenggaraan upaya kesehatan memerlukan sarana pendukung. Berdasarkan Undang-Undang Republik Indonesia No. 36 tahun 2009 pasal 56, salah satu sarana kesehatan adalah pabrik obat atau pabrik farmasi. Pabrik atau industri farmasi adalah sarana untuk melaksanakan pekerjaan kefarmasian berupa pembuatan obat, pengendalian mutu, penyimpanan dan pengelolaan, serta distribusi obat.
Industri farmasi sebagai produsen obat memiliki tanggung jawab untuk menjamin tersedianya sediaan farmasi yang memenuhi persyaratan mutu, khasiat dan keamanan. Hal-hal yang mempengaruhi mutu sediaan farmasi antara lain bahan awal yang digunakan, peralatan dan fasilitas yang digunakan, sumber daya manusia yang terlibat dalam proses produksi, proses produksi, dan lingkungan produksi. Kesemua aspek tersebut diatur dalam Cara Pembuatan Obat yang Baik (CPOB), yang harus diterapkan oleh industri farmasi.
Salah satu industri farmasi yang memiliki peranan dalam upaya kesehatan, dan yang telah memenuhi persyaratan CPOB, adalah PT. Indofarma (Persero) Tbk. Dalam melakukan upaya kesehatan, Indofarma merupakan produsen utama obat generik berlogo (OGB) untuk menjamin tersedianya obat-obatan yang memenuhi syarat mutu, khasiat, dan keamanan serta harga yang terjangkau. Indofarma juga sebagai Teaching Factory yang terbuka memiliki
Universitas Indonesia tugas untuk menyelenggarakan pendidikan dan pelatihan, salah satunya adalah program Praktik Kerja Profesi Apoteker (PKPA) bagi calon apoteker sebagai bekal pengetahuan untuk terjun ke dunia kerja di bidang industri farmasi.
1.2. Tujuan
PKPA di industri farmasi bertujuan untuk:
1. Memahami tugas, wewenang, dan tanggung jawab apoteker di industri farmasi
2. Memahami penerapan ilmu kefarmasian di industri farmasi 3. Memahami penerapan Cara Pembuatan Obat yang Baik (CPOB).
3 Universitas Indonesia BAB 2
TINJAUAN UMUM
2.1. Industri Farmasi
2.1.1. Pengertian Industri Farmasi
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang memproduksi suatu produk obat yang telah melalui seluruh tahap proses pembuatan, sistem fisiologis atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi. Industri bahan baku adalah industri yang memproduksi bahan baku dimana bahan baku tersebut adalah seluruh bahan, baik berkhasiat ataupun tidak berkhasiat.
2.1.2. Persyaratan Industri Farmasi
Perusahaan industri farmasi wajib memperoleh izin usaha industri farmasi, karena itu industri tersebut wajib memenuhi persyaratan yang telah ditetapkan oleh Menteri Kesehatan. Persyaratan industri farmasi tercantum dalam Surat Keputusan Menteri Kesehatan RI No. 245//Menkes/SK/V/1990 adalah sebagai berikut:
a. Industri farmasi merupakan suatu perusahaan umum, badan hukum berbentuk Perseroan Terbatas atau Koperasi.
b. Memiliki rencana investasi.
c. Memiliki Nomor Pokok Wajib Pajak (NPWP).
d. Industri farmasi obat jadi dan bahan baku wajib memenuhi persyaratan CPOB sesuai dengan ketentuan SK Menteri Kesehatan No.43/Menkes/SK/II/1988.
e. Industri farmasi obat jadi dan bahan baku wajib mempekerjakan secara tetap sekurang-kurangnya dua orang Apoteker warga negara Indonesia masing-masing sebagai penanggung jawab
Universitas Indonesia produksi dan penanggung jawab pengawasan mutu sesuai dengan persyaratan CPOB.
f. Obat jadi yang diproduksi oleh industri farmasi hanya dapat diedarkan setelah memperoleh izin edar sesuai dengan ketentuan perundang-undangan yang berlaku.
2.1.3. Izin Usaha Industri Farmasi
Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan wewenang pemberian izin dilimpahkan kepada Badan Pengawas Obat dan Makanan (BPOM). Izin ini berlaku seterusnya selama industri tersebut berproduksi dengan perpanjangan izin setiap 5 tahun, sedangkan untuk industri farmasi Penanaman Modal Asing (PMA) masa berlakunya sesuai dengan ketentuan dalam Undang- Undang No. 1 Tahun 1967 tentang PMA dan pelaksanaannya.
2.2. Cara Pembuatan Obat yang Baik (CPOB)
CPOB merupakan pedoman yang harus diterapkan dalam seluruh rangkaian proses di industri farmasi dalam pembuatan obat jadi, sesuai dengan keputusan Menteri Kesehatan RI No. 43/Menkes/SK/II/1988 tentang Cara Pembuatan Obat yang Baik. Pedoman CPOB bertujuan untuk menghasilkan produk obat yang senantiasa memenuhi persyaratan mutu yang telah ditetapkan sesuai dengan tujuan penggunaannya.
Obat yang berkualitas adalah obat jadi yang benar-benar dijamin bahwa obat tersebut:
- Mempunyai potensi atau kekuatan untuk dapat digunakan sesuai tujuannya.
- Memenuhi persyaratan keseragaman, baik isi maupun bobot. - Memenuhi syarat kemurnian.
- Memiliki identitas dan penandaan yang jelas dan benar.
- Dikemas dalam kemasan yang sesuai dan terlindung dari kerusakan dan kontaminasi.
Universitas Indonesia Perkembangan yang sangat pesat dalam teknologi farmasi menyebabkan perubahan-perubahan yang sangat cepat pula dalam konsep serta persyaratan CPOB. Konsep CPOB yang bersifat dinamis yang memerlukan penyesuaian dari waktu ke waktu mengikuti perkembangan teknologi di bidang farmasi. Aspek-aspek yang merupakan cakupan CPOB tahun 2006 meliputi 12 aspek yang dibicarakan. Aspek-aspek tersebut adalah:
1. Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk mencapai tujuan ini melalui suatu “kebijakan mutu” yang memerlukan partisipasi dan komitmen dari semua jajaran departemen di dalam perusahaan, para pemasok dan para distributor. Manajemen mutu yang didesain secara menyeluruh dan diterapkan secara benar diperlukan untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan.
Unsur dasar manajemen mutu adalah:
1) Suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya.
2) Tindakan sistematis diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut Pemastian Mutu.
Quality Assurance (QA) adalah suatu konsep yang luas yang
mencakup semua aspek yang secara kolektif maupun individual mempengaruhi mutu dari konsep desain hingga produk tersebut sampai kepada konsumen.
Universitas Indonesia
Quality Control (QC) adalah bagian dari CPOB yang
berhubungan dengan pengambilan sampel, spesifikasi dan pengujian serta dengan organisasi, dokumentasi dan prosedur pelulusan yang memastikan bahwa pengujian yang diperlukan dan relevan telah dilakukan dan bahwa bahan yang belum diluluskan tidak digunakan serta produk yang belum diluluskan tidak dijual atau dipasok sebelum mutunya dinilai dan dinyatakan memenuhi syarat. Setiap industri farmasi hendaklah mempunyai fungsi pengawasan mutu (QC) yang independen dari bagian lain.
2. Personalia
Jumlah personil di semua tingkat harus memadai serta memiliki pengetahuan, keterampilan dan kemampuan yang sesuai dengan tanggung jawabnya. Kesehatan mental dan fisik yang baik harus dimiliki personil agar mampu melaksanakan tugas secara profesional dan hendaklah memiliki sikap dan kesadaran tinggi untuk mewujudkan CPOB.
Dalam pedoman CPOB dipersyaratkan bahwa bagian produksi dan pengawasan mutu dipimpin oleh orang yang berlainan yang tidak saling bertanggung jawab satu terhadap yang lain. Hal ini bertujuan untuk mencegah timbulnya penilaian yang tidak obyektif terhadap produk yang dibuat. Keduanya tidak boleh mempunyai kepentingan lain di luar organisasi pabrik, yang dapat menghambat atau membatasi tanggung jawabnya atau yang dapat menimbulkan pertentangan kepentingan pribadi atau finansial. Manajer produksi memiliki wewenang dengan tanggung jawab penuh untuk mengelola produksi obat, sedangkan manajer pengawasan mutu berwenang untuk meluluskan bahan awal, produk antara, produk ruahan dan obat jadi bila produk tersebut sesuai spesifikasinya, atau menolak bila bahan awal, produk antara, produk ruahan dan obat jadi bila produk tersebut tidak sesuai spesifikasi.
Universitas Indonesia 3. Bangunan dan Fasilitas
a. Bangunan
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan, konstruksi serta letak yang memadai agar memudahkan pelaksanaan kerja, pembersihan dan pemeliharaan, tiap sarana kerja hendaklah memadai sehingga setiap resiko terjadi kekeliruan, pencemaran silang dan berbagai kesalahan lain yang dapat menurunkan mutu obat dapat dihindarkan. Hal-hal yang perlu diperhatikan antara lain: a) Lokasi bangunan hendaklah dapat mencegah terjadinya pencemaran dari lingkungan sekelilingnya seperti pencemaran udara, tanah dan air maupun kegiatan di sekitarnya.
Permukaan bagian dalam harus licin, bebas dari keretakan dan sambungan terbuka serta mudah dibersihkan dan didesinfeksi. Lantai terbuat dari bahan kedap air, permukaan rata yang memudahkan proses pembersihan secara cepat dan efisien. Dinding kedap air dan mudah dicuci. Sudut dinding hendaklah berbentuk lengkungan. Bangunan hendaklah mendapatkan penerangan yang efektif dan mempunyai ventilasi yang sesuai.
Penataan ruangan disesuaikan dengan tujuan penggunaan, seperti ruang steril dipisahkan dari ruang produksi lain serta dirancang secara khusus. Ruangan khusus diperlukan bagi kegiatan pembukaan kemasan, pencucian, pengolahan dan penutupan wadah, ruangan penyangga udara dan pergantian pakaian steril.
Adanya perbedaan kelas pemisahan ruang di dalam bangunan produksi, misalnya ruang untuk bahan baku, kamar ganti pakaian dan pengolahan produksi.
Tersedianya sarana penyimpanan dengan kondisi khusus, misalnya: suhu, kelembaban dan keamanan tertentu. Pencampuran hendaklah dihindari dalam proses penyimpanan.
Universitas Indonesia
Kondisi bangunan diperiksa secara teratur dan dilakukan perbaikan bila diperlukan.
Lubang pemasukan dan pengeluaran udara serta pipa dipasang sedemikian rupa untuk mencegah timbulnya pencemaran produk.
b) Bangunan dirancang dengan baik sehingga dapat terpelihara dan berfungsi sebagaimana mestinya:
c) Saluran air limbah hendaklah cukup besar dan mempunyai bak kontrol serta ventilasi yang baik.
d) Tenaga listrik, suhu, kelembaban dan ventilasi harus tepat supaya tidak mengakibatkan dampak yang merugikan baik secara langsung ataupun tidak langsung terhadap produk selama proses pembuatan dan penyimpanan.
b. Fasilitas
a) Sistem Tata Udara/Air Handling System (AHS)
Suatu perusahaan akan menghasilkan suatu produk yang berkualitas jika memenuhi faktor-faktor kritis salah satunya yaitu kondisi lingkungan tempat di mana produk tersebut diproduksi. Kondisi lingkungan yang kritis terhadap kualitas produk antara lain, cahaya, suhu, kelembaban relative (RH), kontaminasi mikroba dan kontaminasi partikel. Sebagai upaya untuk mengendalikan kondisi lingkungan tersebut, maka setiap industri farmasi diwajibkan untuk mempunyai Sistem Tata Udara atau Air Handling System/AHS. AHS sering disebut juga HVAC (Heating,
Ventilating, and Air Conditioning). AHS atau HVAC berfungsi mengontrol
suhu ruangan, kelembaban, tingkat kebersihan sesuai dengan kelas ruangan yang dipersyaratkan, tekanan udara dan sebagainya. Pada dasarnya, penggunaan AHU/HVAC tergantung dari jenis produk yang dibuat dan tingkat kelas ruang yang digunakan, misal ruang produksi steril, beta laktam, non steril, sefalosporin dan sebagainya.
Universitas Indonesia
Air Handling Unit (AHU) merupakan seperangkat alat/unit sistem
yang dapat mengontrol suhu, kelembaban, tekanan udara, tingkat kebersihan (jumlah partikel/mikroba), pola aliran udara, jumlah pergantian udara, dan sebagainya di ruang produksi sesuai dengan persyaratan ruangan yang telah ditentukan. AHU terdiri dari alat yang masing-masing memiliki fungsi yang berbeda, antara lain:
a) Cooling Coil/evaporator, berfungsi mengontrol suhu dan RH
udara yang akan didistribusikan ke ruang produksi.
b) Static Pressure Fan/Blower, berfungsi untuk menggerakkan
udara di sepanjang sistem distribusi udara yang terhubung dengannya.
c) Filter, untuk mengendalikan dan mengontrol jumlah partikel dan
mikroorganisme serta partikel asing yang mengkontaminasi udara yang masuk ke dalam ruang produksi.
d) Ducting, sebagai saluran tertutup tempat mengalirnya udara.
Ducting merupakan sebuah sistem saluran udara yang
menghubungkan blower dengan ruangan produksi, yang terdiri dari saluran udara yang masuk dan saluran udara yang keluar dari ruangan produksi dan masuk kembali ke AHU.
e) Dumper, merupakan bagian dari ducting AHU yaitu sebagai
pengatur jumlah/debit udara yang dipindahkan ke dalam ruangan produksi.
2. Pengolahan Air/Water System
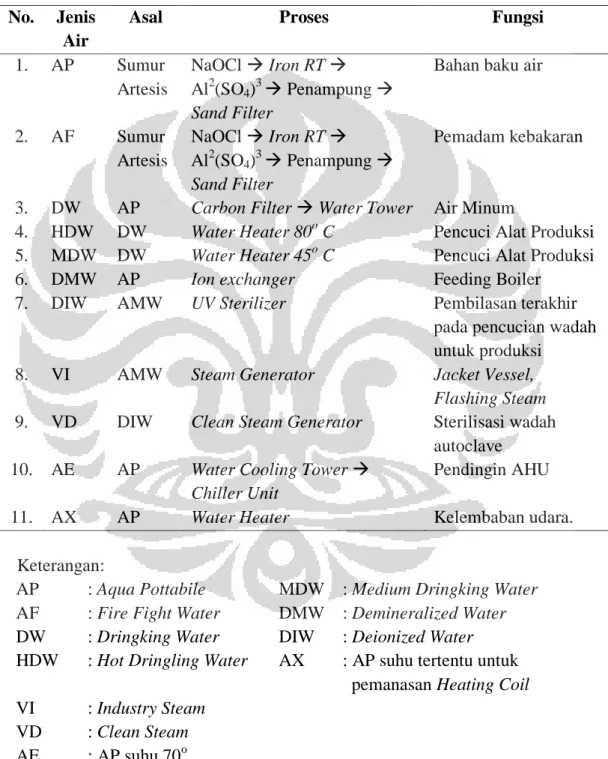
Air merupakan salah satu aspek kritis (vital) dalam pelaksanaan c-GMP. Tujuan dari sistem pengelolaan air untuk produksi adalah untuk menghilangkan cemaran sesuai dengan standar kualitas yang ditetapkan. Kualitas air yang digunakan untuk produksi, tergantung dari persyaratan air yang digunakan untuk produk yang dibuat. Spesifikasi air dalam farmakope yang sesuai dengan rekomendasi internasional meliputi jenis-jenis air berupa drinking water/potable water, purified water (PW), highly purified water (HPW), dan water for injection (WFI).
Universitas Indonesia
Drinking water/potable water (air minum) harus memiliki
spesifikasi yang sesuai dengan regulasi (WHO, ISO, dan agensi nasional atau regional). Air jenis ini disediakan di bawah tekanan positif yang berkesinambungan dan melalui free plumbing system untuk mencegah kontaminasi. Drinking water/potable water dapat berasal dari sistem pengairan umum atau sumber alam, di mana kualitas sumbernya mempengaruhi penanganan yang dibutuhkan.
Purified water (PW) atau air murni disiapkan dari sumber air minum dan harus memiliki spesifikasi yang sesuai untuk kemurnian kimia dan mikrobiologi. Air jenis ini harus terlindungi dari rekontaminasi dan proliferasi mikroba.
Highly purified water (HPW) disiapkan dari sumber air minum dengan spesifikasi hanya dari European Pharmacopoiea. Kualitas air ini memiliki standar yang sama dengan water for injection (WFI) yang meliputi batas endotoksin, tetapi metode penanganan yang dipertimbangkan lebih tidak ketat dibandingkan distilasi. HPW disiapkan melalui kombinasi beberapa metode, termasuk reverse osmosis (RO), ultrafiltrasi (UF), dan deionisasi (DI).
Water for injection (WFI) disiapkan dari sumber air minum. Berdasarkan farmakope internasional dan Eropa, langkah pemurnian akhir harus distilasi. WFI bukan air steril, bukan pula bentuk sediaan akhir, tetapi merupakan produk akhir intermediat yang penting.
4. Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki rancangan bangunan dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dengan tepat sehingga mutu setiap produk obat terjamin secara seragam dari bets ke bets serta untuk memudahkan pembersihan dan perawatannya.
Universitas Indonesia 1) Rancang Bangun dan Konstruksi
a. Peralatan yang digunakan tidak bereaksi atau menimbulkan akibat terhadap bahan yang diolah.
b. Peralatan hendaklah mudah dibersihkan baik bagian dalam maupun bagian luarnya.
c. Peralatan yang digunakan untuk menimbang, mengukur, menguji dan mencatat hendaklah diperiksa ketelitiannya secara teratur serta ditara menurut program dan prosedur yang tepat, hasil pemeriksaannya dicatat dan disimpan dengan baik. d. Penyaring untuk cairan tidak boleh melepaskan serat ke dalam
produk dan tidak boleh mengandung asbes.
2) Pemasangan dan Penempatan
a. Peralatan hendaklah ditempatkan pada posisi yang tepat untuk memperkecil pencemaran silang antar bahan. Peralatan ditempatkan dengan jarak yang cukup renggang untuk memberikan keleluasaan kerja.
b. Peralatan utama diberi nomor pengenal yang dipakai pada semua perintah dan catatan pembuatan bets untuk menunjukkan unit atau alat tertentu.
c. Semua pipa, tangki, selubung hendaknya diberikan pelekat untuk memperkecil kehilangan energi.
d. Saluran pipa yang menggunakan uap bertekanan hendaknya dilengkapi dengan peralatan uap dan saluran pembuangan yang berfungsi dengan baik.
e. Sistem penunjang hendaknya divalidasi untuk memastikan fungsinya sesuai tujuannya.
3) Pemeliharaan
a. Peralatan hendaknya dirawat sesuai jadwal yang tepat agar berfungsi dengan baik dan mencegah pencemaran.
Universitas Indonesia c. Catatan pelaksanaan pemeliharaan pemakaian peralatan utama hendaklah dicatat dalam buku harian dan catatan untuk peralatan yang digunakan khusus untuk satu produk saja dapat dimasukkan ke catatan produksi bets produk tertentu.
5. Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan setiap hal yang merupakan sumber pencemaran produk. Sumber pencemaran hendaknya dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu.
6. Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi).
Prinsip utama produksi adalah:
- Adanya keseragaman atau homogenitas dari bets ke bets. - Proses produksi dan pengemasan senantiasa menghasilkan
produk yang seidentik mungkin (dalam batas syarat mutu) baik bagi bets yang sudah diproduksi maupun yang akan diproduksi.
Prosedur produksi dibuat oleh penanggung jawab produksi bersama dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang dihasilkan memenuhi spesifikasi yang dibutuhkan. Mutu produk yang dihasilkan sangat ditentukan oleh bahan awal, proses produksi, personil, dan sistem tervalidasi.
Universitas Indonesia Penyimpanan tergantung dari kestabilan bahan awal. Ruangan penyimpanan hendaklah tersedia dengan suhu yang berbeda-beda. CPOB mempersyaratkan klasifikasi ruangan berdasarkan suhu menjadi lima jenis, yaitu:
- Suhu ruangan: 15 – 30oC
- Suhu ruangan yang dikendalikan: < 25 oC - Sejuk: 8 – 15oC
- Dingin: 2 – 8oC - Beku: < 0oC
Tekanan udara dalam ruangan yang memiliki resiko lebih tinggi terhadap suatu produk hendaklah selalu lebih tinggi daripada ruangan lain. Bila suatu pintu dibuka, tekanan atau hembusan udara dari arah ruangan yang beresiko tinggi hendaklah cukup mampu untuk menciptakan arus udara ke arah ruang yang beresiko lebih rendah untuk menghindarkan pencemaran balik.
7. Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari cara pembuatan obat yang baik untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Pengawasan mutu hendaklah mencakup semua kegiatan analitis yang dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini juga mencakup uji stabilitas, program pemantauan lingkungan, pengujian yang dilakukan dalam rangka validasi, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan, produk serta metode pengujiaannya.
Laboratorium pengawasan mutu hendaklah terpisah secara fisik dari ruang produksi. Laboratorium untuk pengawasan selama proses mungkin lebih memudahkan apabila letaknya di daerah tempat pemprosesan atau pengemasan dimana dilakukan pengujian fisik seperti penimbangan dan uji monitoring lainnya secara periodik.
Universitas Indonesia Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan. Personil pengawasan mutu hendaklah memiliki akses ke area produksi untuk melakukan pengambilan sampel dan investigasi bila diperlukan.
8. Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri dilakukan secara indepeden dan rinci oleh petugas yang kompeten dari perusahaan. Inspeksi diri dilakukan secara rutin dan disamping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Inspeksi meliputi personil, bangunan, penyimpanan, bahan awal, obat jadi, produksi, pengawasan mutu, dokumentasi dan pemeliharaan gedung serta peralatan. Manajemen hendaklah membentuk tim inspeksi diri yang paling sedikit terdiri dari tiga anggota yang berpengalaman dalam bidangnya masing-masing dan memahami CPOB. Anggota tim dapat dibentuk dari dalam atau luar perusahaan. Tiap anggota hendaklah independen dalam melakukan inspeksi dan evaluasi. Inspeksi diri dapat dilakukan perbagian perusahaan dan dilakukan minimal 1 tahun sekali.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau
Universitas Indonesia independen, atau tim yang dibentuk khusus oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
9. Penanganan Keluhan, Penarikan Kembali Produk dan Produk Kembalian
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari rantai distribusi karena keputusan bahwa produk tidak layak lagi untuk diedarkan.
Produk kembalian adalah obat jadi yang telah keluar dari industri atau beredar, yang kemudian dikembalikan ke industri karena kerusakan, daluwarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang dapat menimbulkan keraguan identitas, mutu, keamanan obat serta kesalahan administratif yang menyangkut jumlah dan jenis.
Keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat, dapat bersumber dari dalam maupun dari luar industri, dan memerlukan penanganan serta pengkajian secara teliti. Keluhan atau informasi yang bersumber dari dalam industri antara lain dari bagian produksi, pengawasan mutu, gudang dan pemasaran, sementara dari luar industri antara lain dapat berasal dari pasien, dokter, paramedik, klinik, rumah sakit, apotek, distributor.
10. Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan merupakan bagian yang esensial dari pemastian mutu. Sistem dokumentasi yang dirancang atau digunakan hendaklah mengutamakan tujuannya, yaitu menentukan, memantau dan mencatat seluruh aspek produksi serta pengendalian dan pengawasan mutu. Dokumentasi sangat penting untuk memastikan bahwa setiap petugas mendapat instruksi secara rinci dan jelas mengenai bidang tugas yang harus dilaksanakannya sehingga memperkecil resiko terjadinya kekeliruan yang biasanya timbul karena mengandalkan komunikasi lisan.
Universitas Indonesia Dokumentasi dalam hal pengawasan mutu meliputi dua hal, yaitu: a. Prosedur pengawasan mutu dan metode pengujian. Selain itu, prosedur dalam pengawasan yang terpenting adalah prosedur pengambilan contoh untuk pengujian.
b. Catatan dan laporan hasil pengujian.
Catatan tentang pengujian hasil stabilitas biasanya diadakan tersendiri. Laporan hasil pengujian dapat berupa sertifikat analisis.
11. Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Q A .
12. Kualifikasi dan Validasi 1) Kualifikasi
Kualifikasi adalah kegiatan pembuktian bahwa perlengkapan, fasilitas atau sistem yang digunakan dalam suatu proses/sistem akan selalu bekerja sesuai dengan kriteria yang diinginkan dan konsisten. Validasi/kualifikasi mesin, peralatan produksi dan sarana penunjang terdiri dari 4 tingkatan, yaitu: a) Kualifikasi Rancangan (Design Qualification)
Kualifikasi rancangan adalah unsur pertama dalam melakukan validasi terhadap fasilitas, sistem atau peralatan baru. Tujuannya adalah untuk menjamin dan mendokumentasikan sistem, peralatan atau bangunan yang akan dipasang atau dibangun sesuai dengan ketentuan atau spesifikasi yang
Universitas Indonesia diatur dalam ketentuan CPOB yang berlaku. Kualifikasi ini dilakukan sebelum instalasi (pemasangan) alat/mesin/prasarana produksi.
b) Kualifikasi Instalasi (Installation Qualification)
Kualifikasi instalasi bertujuan untuk menjamin dan mendokumentasikan sistem atau peralatan yang diinstalasi sesuai dengan spesifikasi yang tertera pada dokumen pembelian, manual alat yang bersangkutan dan pemasangannya dilakukan memenuhi spesifikasi yang telah ditetapkan. Kualifikasi instalasi dilakukan pada waktu instalasi (pemasangan terbaru), modifikasi atau pemindahan alat yang bersangkutan.
c) Kualifikasi Operasional (Operational Qualification)
Kualifikasi Operasional bertujuan untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja (beroperasi) sesuai dengan spesifikasi yang diinginkan. Kualifikasi operasional dilakukan setelah kualifikasi instalasi (pemasangan baru), modifikasi atau pemindahan alat yang bersangkutan.
d) Kualifikasi Kinerja (Performance Qualification)
Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja sesuai dengan spesifikasi yang diinginkan dengan cara menjalankan sistem sesuai dengan tujuan penggunaan.
Universitas Indonesia 2) Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Kegiatan validasi secara keseluruhan hendaklah direncanakan. Kegiatan validasi meliputi kualifikasi (personil, peralatan dan sistem), kalibrasi (instrumen dan alat ukur) dan validasi (prosedur dan proses).
a) Validasi Metode Analisis
Validasi Metode Analisa untuk membuktikan bahwa semua metode analisa (cara/prosedur pengujian) yang digunakan dalam pengujian maupun pengawasan mutu senantiasa mencapai hasil yang diinginkan secara konsisten (terus-menerus). Validasi metode analisa menguji atau memvalidasi prosedur tetap (protap) pengujian yang bersangkutan. Protap tersebut bisa dibuat oleh bagian pengawasan mutu, apabila protap belum dibuat, maka harus dibuat terlebih dahulu, baru divalidasi.
b) Validasi Proses Produksi Tujuannya adalah:
- Memberikan dokumentasi secara tertulis bahwa prosedur produksi yang berlaku dan digunakan dalam proses produksi rutin (batch processing record) senantiasa mencapai hasil yang diinginkan secara terus-menerus.
- Mengidentifikasi dan mengurangi masalah yang terjadi selama proses produksi dan memperkecil kemungkinan terjadinya proses ulang.
- Meningkatkan efektivitas dan efisiensi proses produksi.
Universitas Indonesia c) Validasi Proses Pengemasan
Tujuannya adalah:
- Memberikan dokumentasi secara tertulis bahwa prosedur pengemasan yang berlaku dan digunakan dalam proses pengemasan rutin (batch packaging record) sesuai dengan persyaratan rekonsiliasi yang telah ditentukan secara konsisten.
- Operator yang melakukan proses pengemasan kompeten serta mengikuti prosedur pengemasan yang telah ditentukan.
- Tidak terjadi mix up (campur-baur) antarproduk maupun antarbets pada proses pengemasan yang dilakukan.
d) Validasi Pembersihan Tujuannya adalah:
- Memberikan dokumentasi secara tertulis bahwa prosedur pembersihan yang berlaku dan digunakan sudah tepat dan dapat dilakukan berulang-ulang (reliable and reproducible).
- Peralatan/mesin yang dibersihkan tidak terkena pengaruh negatif karena efek pembersihan.
- Operator yang melakukan pembersihan kompeten, mengikuti prosedur pembersihan dan peralatan pembersihan yang telah ditentukan.
- Cara pembersihan menghasilkan tingkat kebersihan yang telah ditetapkan, misalnya sisa residu, kadar kontaminan dan sebagainya.
20 Universitas Indonesia BAB 3
TINJAUAN KHUSUS PT. INDOFARMA (Persero) Tbk.
3.1. Sejarah dan Perkembangan PT. Indofarma (Persero) Tbk.
PT. Indofarma (Persero) Tbk., merupakan Badan Usaha Milik Negara (BUMN) yang berada di bawah Departemen Kesehatan, berdiri pada tahun 1918 berupa unit produksi kecil dari Rumah Sakit Pusat Pemerintah Belanda dengan kegiatan pembuatan salep dan pemotongan kain kasa pembalut yang dilakukan di
Centrale Burgelijke Zienkeninriching (CBZ), yang sekarang dikenal dengan
Rumah Sakit Dr. Cipto Mangunkusumo di Jakarta.
Pada tahun 1931, pabrik berkembang dengan bertambahnya jenis produksi, yaitu obat suntik dan tablet. Sejalan dengan itu pada tahun 1935, lokasi pabrik dipindahkan ke Jalan Tambak No. 2 Manggarai, Jakarta sehingga dikenal dengan sebutan ”Pabrik Obat Manggarai”.
Semenjak berakhirnya penjajahan Belanda dan masuknya Jepang ke Indonesia, pada tahun 1942 pabrik obat Manggarai diambil alih dan dikelola oleh perusahaan farmasi Jepang (Takeda). Selama masa tersebut kegiatan produksi tidak banyak mengalami perkembangan. Pada saat penyerahan kedaulatan dari pemerintah Jepang kepada pemerintah Republik Indonesia pada tahun 1950, Pabrik Obat Manggarai diambil alih oleh pemerintah Indonesia yaitu Departemen Kesehatan melalui Direktorat Jenderal Farmasi. Pada tahun 1960-1967, pabrik tersebut berada di bawah naungan Badan Perlengkapan Kesehatan (Baperkes), di samping dua badan lain, yaitu Depo Farmasi Pusat dan Lembaga Farmakoterapi, pada perkembangan selanjutnya disebut Lembaga Farmasi Nasional kemudian menjadi Pusat Pemeriksaan Obat dan Makanan (PPOM).
Pada tanggal 14 Februari 1967, melalui Surat Keputusan Menteri Kesehatan RI No. 008/III/AM/67, nama Pabrik Obat Manggarai diubah menjadi Pusat Produksi Farmasi Departemen Kesehatan dan ditetapkan sebagai unit operatif setingkat Direktorat Jenderal Farmasi. Tugas pokok dari pabrik ini adalah memproduksi obat-obatan berdasarkan pesanan dari Departemen Kesehatan RI. Pada tahun 1969-1975 pabrik direnovasi dan tahun 1975 dikeluarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 125/IV/KAB/BU/75
Universitas Indonesia tentang Struktur Organisasi Departemen Kesehatan yang merupakan pelaksanaan lebih lanjut dari Keputusan Presiden Republik Indonesia No. 44 dan 45 tahun 1974. Namun pabrik farmasi Departemen Kesehatan ini tidak tercakup dalam keputusan tersebut sehingga statusnya tidak jelas. Hal ini berlangsung hingga tahun 1978.
Dengan adanya kebijaksanaan pemerintah tanggal 15 November 1978 dalam hal ekonomi dan keuangan, harga obat mendadak melambung tinggi sehingga persediaan obat terutama di puskesmas mengalami kekosongan karena sulit mendapatkan obat. Peristiwa ini menyadarkan pemerintah untuk menyediakan peralatan dan sarana yang dibutuhkan agar dapat mengendalikan mekanisme pengadaan obat dalam jumlah yang cukup serta memenuhi persyaratan mutu, keamanan dan distribusi yang merata serta harga terjangkau sesuai kemampuan dan daya beli masyarakat. Maka pabrik farmasi ini diaktifkan kembali sesuai dengan fungsinya, berdasarkan SK Menteri Kesehatan Republik Indonesia No. 418/MenKes/SK/XII/78 tanggal 6 Desember 1978.
Pada tahun 1979, pabrik ini ditetapkan sebagai Pusat Produksi Farmasi Departemen Kesehatan Republik Indonesia. Dalam keputusan tersebut disebutkan pula bahwa Pusat Produksi Farmasi bertugas membantu usaha pemerintah dalam meningkatkan kesejahteraan masyarakat di bidang kesehatan, yaitu memproduksi obat-obat untuk rumah sakit pemerintah dan Pusat Kesehatan Masyarakat. Obat-obatan yang dimaksud bersifat essensial, artinya bahwa obat tersebut banyak dibutuhkan oleh masyarakat. Untuk memenuhi kebutuhan tersebut, maka diputuskan untuk didirikannya sebuah pabrik yang sekaligus untuk memperluas pelayanan Pusat Produksi Farmasi Departemen Kesehatan. Pada tahun 1980 mulai dilakukan studi kelayakan untuk pembangunan pabrik ini.
Pada tanggal 11 Juli 1981, berdasarkan PP No. 20 tahun 1981, Pusat Produksi Farmasi diubah menjadi Perusahaan Umum dengan nama Indonesia (Perum Indofarma) yang direalisasikan pada tanggal 1 April 1988 dengan mulai dibangunnya pabrik modern berkapasitas besar dilahan seluas 20 hektar sesuai dengan konsep dan persyaratan CPOB yang berlokasi di Cibitung, Bekasi dengan bantuan alat dan teknologi dari Italia.
Universitas Indonesia Mulai pertengahan tahun 1991, hampir seluruh kegiatan produksi telah menempati lokasi di Cibitung, kecuali sediaan steril. Tanggal 31 Januari 1995 fasilitas produksi steril diresmikan oleh Menteri Kesehatan RI dengan dana pembangunan seluruhnya ditanggung oleh Perum Indofarma.
Pada tanggal 2 Januari 1996 Perum Indonesia Farma diubah menjadi Perseroan Terbatas Indofarma [PT. Indofarma (Persero)] melalui PP No. 34 tanggal 20 September 1995. Perubahan status ini bertujuan untuk mengantisipasi perubahan dan menigkatkan daya saing. Pada tahun tersebut juga dilakukan akuisisi PT. Riasima Abadi Farma yang merupakan produsen bahan baku farmasi, serta dilakukan renovasi pada bidang Litbang pada tahun 1996-1997. Tahun 1999 dibangun Extraction Plant dan selesai awal tahun 2000. Bisnis distribusi dan perdagangan produk farmasi dan alat kesehatan dipisah tahun 2000 ke anak perusahaan yang baru dibentuk, PT. Indofarma Global Medika (IGM) sebagai distributor dan pemasaran produk farmasi termasuk alat kesehatan dengan 28 cabang di seluruh Indonesia. Pengembangan ini sekaligus memungkinkan Indofarma memfokuskan diri pada bisnis inti di bidang produksi dan pemasaran produk-produk farmasi. Tahun 2000 dibangun pabrik makanan bayi di Lippo Cikarang Industrial Estate Jawa Barat.
Pada tahun 2000 unit produksi memperoleh sertifikat ISO 9002 dan pada tahun 2001 ditingkatkan lagi menjadi ISO 9001 untuk seluruh unit produksi termasuk unit produksi Herbal Medicine dan Litbang.
Mulai tanggal 17 April 2001, PT. Indofarma melakukan penawaran saham perdana kepada masyarakat dan mendaftarkan seluruh saham perusahaan di Bursa Efek Indonesia dengan kode saham INAF. Status Indofarma selanjutnya berubah menjadi PT. Indofarma (Persero) Tbk.
Manajemen PT. Indofarma (Persero) Tbk. yakin bahwa kunci keberhasilan untuk memenangkan persaingan di era globalisasi adalah operational excellence. Guna memperkuat struktur bisnis, pada tahun 2007 PT. Indofarma (Persero) Tbk. mengoptimalkan fungsi bisnis yang ada melalui restrukturisasi lanjutan yang memberikan otonomi luas kepada IGM. Perkembangan yang terjadi setelah hal tersebut inilah yang membuat PT. Indofarma (Persero) Tbk. pada tahun 2008 secara konsolidasian meraih penjualan bersih sebesar Rp 1.273,11
Universitas Indonesia milyar dengan laba bersih Rp 6,67 milyar ditengah pasar OGB yang belum kondusif.
Saat ini PT. Indofarma (Persero) Tbk., memproduksi sekitar 218 produk obat. Dari portofolio perusahaan yang cukup lengkap ini, 38 produk adalah obat dengan nama dagang termasuk didalamnya 6 jenis obat herbal yang telah diterima oleh masyarakat luas, seperti Prolipid, Prouric dan Biovision.
Untuk meletakkan fondasi bisnis yang kuat, manajemen terus berupaya menerapkan Tata Kelola Perusahaan yang Baik (Good Coorporate Governance/ GCG). Upaya lain yang tak kalah penting yaitu, manajemen membangun kompetensi personil yang profesional melalui program pengembangan sumber daya manusia yang terarah, agar mampu membawa PT. Indofarma (Persero) Tbk., memasuki era perdagangan bebas sebagai perusahaan farmasi terkemuka di kawasan ASEAN.
3.2. Visi, Misi, Motto, dan Loggo PT. Indofarma (Persero) Tbk. 1) Visi PT. Indofarma (Persero) Tbk.
Menjadi perusahaan yang berperan secara signifikan pada perbaikan kualitas hidup manusia dengan memberi solusi terhadap masalah kesehatan dan kesejahteraan masyarakat.
2) Misi PT. Indofarma (Persero) Tbk.
Menyediakan produk dan layanan berkualitas dengan harga terjangkau untuk masyarakat.
Melakukan penelitian dan pengembangan produk yang inovatif dengan prioritas untuk mengobati penderita penyakit dengan tingkat prevalensi tinggi.
Mengembangkan kompetensi sumber daya manusia sehingga memiliki kepedulian, profesionalisme dan kewirausahaan yang tinggi.
Universitas Indonesia 3) Motto PT. Indofarma (Persero) Tbk.
Motto PT. Indofarma (Persero) Tbk., adalah Insan Indofarma dalam menjalankan visi dan misi tersebut yaitu “dilandasi ketakwaan kepada Tuhan Yang Maha Esa, kita tingkatkan kualitas kesehatan bangsa”.
Insan Indofarma memiliki nilai-nilai inti yang telah disepakati bersama dan dianut serta mencerminkan budaya korporat yang membentuk filosofi bisnis dan budaya kerja “Compassionate, Professional, Entrepreneurship “ disingkat “CPE”, untuk mewujudkan visi dan misi perseroan.
4) Logo PT. Indofarma (Persero) Tbk.
Gambar 1. Logo PT. Indofarma (Persero) Tbk.
Perusaahaan memiliki logo “INF” yang melambangkan kependekan nama perusahaan (Indofarma). Logo tanpa bingkai menggambarkan pengabdian perseroan di bidang kesehatan masyarakat. Warna biru melambangkan sifat pengabdian perseroan yang tidak terbatas untuk kesehatan masyarakat. Keluasan pengabdian diperluas dengan gradasi warna yang mewakili dimensi yang luas. Upaya pelayanan perseroan pada masyarakat tersirat pada ritme dari garis luas dan lengkung. Kesatuan garisnya memberikan kesan melindungi dan saling mendukung, artinya perseroan siap melindungi masyarakat dari penyakit dan mendukung masyarakat untuk mewujudkan kesehatan. Posisi miring melambangkan dinamika perseroan yaitu tidak terpaku pada konvensi-konvensi yang sudah ada, mengikuti perkembangan jaman dan inovatif tetapi mengikuti gerak laju teknologi.
Universitas Indonesia 3.3. Nilai Budaya yang Dikembangkan PT. Indofarma (Persero) Tbk.
Untuk mewujudkan visi dan misi PT. Indofarma (Persero) Tbk., memiliki inti yang telah disepakati bersama dan dianut, serta mencerminkan budaya korporat, dalam hal ini adalah budaya PT. Indofarma (Persero) Tbk. Nilai – nilai ini membentuk filosofi bisnis dan budaya kerja ”Compassionate, Professional,
Entrepreneurship ” yang disingkat ”CPE”.
Professional memiliki arti yaitu senantiasa bekerja secara profesional yang dilandasi integritas, komitmen dan selalu berupaya memberikan hasil yang terbaik. Nilai inti profesional dijabarkan dalam bentuk :
1. Integrity sebagai input, mengandung pengertian satunya pikiran, kata, dan perbuatan dengan selalu mengatakan kebenaran dan mengikuti aturan yang berlaku, dengan memegang teguh prinsip-prinsip etika sehingga menjadi insan Indofarma yang mandiri.
2. Commitment sebagai proses, mengandung pengertian bahwa insan
Indofarma memiliki komitmen yang kuat dalam menjalankan pekerjaan sesuai keahlian, pengetahuan, dan ketentuan yang berlaku.
3. Strive for excellent sebagai output, mengandung pengertian bahwa insan Indofarma senantiasa berupaya memberikan yang terbaik bagi stake holder’s perseroan dengan bekerja secara efektif, efisien, dan akurat.
Entrepreneurship memiliki arti bahwa insan Indofarma senantiasa
memiliki jiwa kewirausahaan berdasarkan pemikiran jauh ke depan, inovatif, dan fokus terhadap kepuasan pelanggan. Nilai Entrepreneurship dijabarkan dalam bentuk :
a) Visionary sebagai input , mengandung pengertian bahwa insan Indofarma
memiliki pandangan jauh ke depan disertai kemampuan untuk menyesuaikan diri terhadap perubahan lingkungan.
b) Innovation sebgai proses, mengandung pengertian bahwa insan
Indofarma memiliki penyesuaian diri terhadap perubahan diwujudkan dengan menciptakan produk baru, proses atau metode baru dan melakukan perbaikan dalam lingkup tanggung jawabnya.
Universitas Indonesia
c) Customer focus sebagai output, mengandung pengertian bahwa insan
Indofarma memberikan yang terbaik dan perhatian penuh terhadap pelanggan dan stakeholder’s perseroan dengan berorientasi hasil namun tetap mengutamakan proses dan memberikan perhatian penuh terhadap pelanggan.
Compassionate berarti insan Indofarma memiliki rasa peduli terhadap sesama, yang dijabarkan dalam bentuk :
a) Respect to people sebagai input , mengandung pengertian bahwa insan Indofarma menghormati perbedaan pendapat dan peduli terhadap sesama, baik individu, rekan kerja (atasan, bawahan, setingkat) mitra kerja maupun
stakeholder’s secara umum.
b) Cooperative sebagai proses, mengandung pengertian bahwa insan
Indofarma selalu bekerja sama dalam suatu sinergi yang harmonis dengan mengedepankan rasa tanggung jawab dan suasana kekeluargaan.
c) Fairness (keadilan) mengandung pengertian adanya kesetaraan di dalam
memenuhi hak-hak stakeholder’s yang timbul berdasarkan perjanjian dan peraturan perundang-undangan yang berlaku. Nilai ini diwujudkan dengan
meritocarcy (sejajar/sama kedudukannya), keterbukaan (saling terbuka)
dalam setiap pengambilan keputusan sesuai batasan, ketentuan dan perundangan yang berlaku.
3.4. Kebijakan Mutu Perusahaan
Kebijakan mutu yang ditetapkan oleh perusahaan, yaitu :
1) Mutu dijadikan prioritas pertama demi kepuasan pelanggan eksternal dan internal.
2) Mutu mencakup seluruh kegiatan perusahaan, mulai dari penelitian dan pengembangan, produksi sampai pemasaran.
3) Mutu dibangun dalam Sistem Manajemen Mutu (TQM) terpadu oleh semua pihak melalui perencanaan, pelaksanaan, dan pengendalian yang efektif dan efisien.
Universitas Indonesia 4) Mutu terutama ditentukan oleh faktor manusia, oleh karena itu pendidikan dan pelatihan bagi karyawan terus dikembangkan sesuai kebutuhan dan perkembangan ilmu pengetahuan dan teknologi.
5) Mutu selalu dijaga dan ditingkatkan sesuai kebutuhan pelanggan dengan memperhatikan kemampuan daya saing melalui proses yang menekan biaya mutu.
3.5. Kedudukan, Fungsi, dan Peranan PT. Indofarma (Persero) Tbk
1) Kedudukan
PT. Indofarma (Persero) Tbk., adalah sebagai suatu Badan Usaha Milik Negara (BUMN) yang memproduksi obat-obat esensial dan merupakan produsen obat generik berlogo yang terbesar di Indonesia.
2) Fungsi
PT. Indofarma (Persero) Tbk., sebagai suatu BUMN mempunyai fungsi antara lain sebagai berikut :
a. Menyelenggarakan kemanfaatan umum di bidang farmasi dalam arti yang seluas-luasnya terutama dalam bidang pengadaan produk farmasi yang sangat diperlukan oleh sarana kesehatan pemerintah maupun masyarakat umum.
b. Mendapatkan keuntungan berdasarkan prinsip pengelolaan perusahaan untuk membiayai serta mengembangkan perusahaan dan untuk disumbangkan bagi pembangunan nasional sesuai dengan kemampuan perusahaan.
c. Memperluas pemerataan penyediaan obat khususnya bagi masyarakat golongan menengah ke bawah.
d. Mencukupi kebutuhan obat yang dibutuhkan bagi Puskesmas dan Rumah Sakit Pemerintah serta penyediaan obat di desa untuk mendukung Pos Pelayanan Terpadu (POSYANDU).
e. Sebagai Price Leader terhadap obat-obat yang beredar di masyarakat melalui program Obat Generik Berlogo.
f. Meningkatkan penerapan CPOB sebagaimana direkomendasikan oleh WHO sebagai hasil produksi berstandar internasional.
Universitas Indonesia
3) Peranan
Peranan PT. Indofarma (Persero) Tbk., antara lain dapat dilihat dari setiap kebijakan yang operasional maupun arah pengembangan perusahaan, yaitu:
a. Andalan utama produsen obat esensial bermutu, dengan demikian PT. Indofarma (Persero) Tbk., merupakan pemasok terbesar obat esensial dan menggunakan sebagian besar kapasitas produksinya untuk memproduksi obat esensial.
b. Adanya motto perusahaan yaitu “Untuk Kehidupan yang Lebih Baik”, yang artinya bahwa PT. Indofarma (Persero) Tbk., akan selalu berusaha meningkatkan derajat kesehatan masyarakat menjadi lebih baik. PT. Indofarma (Persero) Tbk., sebagai Badan Usaha Milik Negara membantu memenuhi upaya kesehatan yang bersifat menyeluruh dan terpadu termasuk pemerataan penyediaan obat yang bermutu dengan harga yang terjangkau.
c. PT. Indofarma (Persero) Tbk., menjadi tempat pelatihan tenaga farmasis dan profesi lain dalam rangka meningkatkan kualitas sumber daya manusia di industri farmasi.
3.6. Lokasi dan Bangunan
Pabrik dan kantor pusat PT. Indofarma (Persero) Tbk., terletak di Jalan Indofarma No. 1, Desa Gandasari, Kecamatan Cikarang Barat-Bekasi, dengan luas tanah 2.000.000 m2 dan luas bangunan 28.035 m2 yang terdiri dari : kantor pusat 20 m2, pusat pelatihan 750 m2, kantin 300 m2, koperasi 60 m2, poliklinik dan apotek 196 m2, masjid 441 m2, laboratorium 1.440 m2, unit produksi utama 9.921 m2, unit produksi β laktam 1.440 m2, unit produksi parenteral 2.330 m2, unit produsi obat tradisional dan gudang 5.250 m2, bangunan utilities 898 m2, gudang bahan kimia 216 m2, instalasi pengolahan limbah cair 204 m2, instalasi limbah padat 44 m2, menara air 100 m2, cylinder gas chamber 66 m2, rumah jaga 128 m2, lapangan 1.548 m2, unit penelitian dan pengembangan 700 m2. Sistem tata ruang produksi non steril dibagi dua, yaitu kelas empat (black area) dan kelas tiga (grey area). Kelas empat meliputi gudang, koridor yang menghubungkan gudang produk jadi dan daerah pengemasan sekunder. Daerah ini ditandai dengan
Universitas Indonesia lantai yang di cat epoksi agar kotoran tidak mudah melekat dan dinding mudah dibersihkan. Kelas tiga merupakan daerah yang terkait langsung dengan proses produksi, misalnya daerah proses, pengemasan primer, hingga koridor yang berhubungan.
3.7. Produk PT. Indofarma (Persero) Tbk
Produk yang dihasilkan oleh PT. Indofarma (Persero) Tbk., antara lain sebagai berikut :
1) Produk Ethical (OGB, Lisensi, Nama Dagang)
PT. Indofarma (Persero) Tbk memproduksi obat generic ethical sebagai produk utama di samping memproduksi obat dengan nama dagang dan lisensi. Saat ini PT. Indofarma (Persero) Tbk mulai memperluas target pasar dengan memproduksi obat branded generic atau obat generik dengan nama dagang namun harganya terjangkau, yang merupakan program pemerintah untuk penyediaan obat bagi masyarakat.
2) OTC (Over The Counter) dan Herbal Medicines
Dalam rangka mengembangkan sumber daya alam di Indonesia, PT. Indofarma (Persero) Tbk., telah mengembangkan Obat Asli Indonesia (OAI) seperti Prolipid, Pro Uric, Probagin, dan lainnya. Selain itu, diproduksi pula makanan kesehatan (suplement food) seperti Biovision, Bioprost, dan lain-lain. Obat OTC yang diproduksi antara lain Bioralit 200ml Serbuk, OBH INDO Plus Sirop, ProfluTablet, Indo Obat Asma, Indo Obat Batuk Berdahak, Indo Obat Batuk Cair, Indo Obat Batuk dan Flu, Indo Obat Cacing, Indo Obat Cacing Anak, Indo Obat Flu, Indo Obat Maag, Indo Obat Penurun Panas, Indo Obat Penurun Panas Anak, Indo Obat Sakit Kepala, Indo Obat Tambah darah.
3.8. Struktur Organisasi PT. Indofarma (Persero) Tbk
PT. Indofarma (Persero) Tbk., dipimpin oleh seorang Direktur Utama yang dibantu oleh empat orang direktur, yaitu Direktur Produksi, Direktur Umum dan SDM, Direktur Pemasaran, serta Direktur Keuangan. Masing – masing direktur mengepalai direktoratnya dan membawahi bidang – bidang yang
Universitas Indonesia dipimpin oleh manajer, tiap – tiap bidang yang dipimpin oleh manajer membawahi beberapa seksi. Selain itu ada beberapa bagian yang langsung bertanggung jawab kepada Direktur Utama yaitu Corporate Secretary, Strategic
Business Development, Manajemen Resiko, Compliance & GCG Staf Ahli,
Sarana Pengawas Internal (SPI) dan Supply Chain Management (SCM). Struktur organisasi di PT. Indofarma (Persero) Tbk dapat dilihat pada lampiran
3.8.1. Direktorat Produksi
Direktorat Produksi PT. Indofarma (Persero) Tbk., membawahi delapan bidang dimana setiap bidang dipimpin oleh seorang manajer yang dibantu oleh asisten manajer dan supervisor. Kedelapan bidang tersebut adalah :
1. Bidang Produksi I
Bidang produksi I dipimpin oleh seorang manajer yang membawahi empat seksi, yaitu seksi Solid I bertanggung jawab dalam pembuatan massa tablet dan pembuatan sediaan kapsul, seksi Solid II bertanggung jawab dalam pencetakan tablet atau filling kapsul, seksi pengemasan bertanggung jawab dalam pengemasan, dan seksi herbal dan makanan bertanggung jawab dalam ekstraksi dan pengolahan bahan herbal.
Proses produksi tablet di produksi I dilakukan dengan metode vertical closed system, yaitu sistem vertikal tertutup dimana proses produksi dilakuakan dengan memanfaatkan gaya gravitasi. Metode ini dilaksanakan di produksi I karena bentuk bangunan memungkinkan metode tersebut dilakukan (3 lantai) dan produksinya besar sehingga efisiensi tenaga tercapai. Keuntungan sistem ini adalah dapat meminimalkan terjadinya kontaminasi silang, bets dapat dibuat dalam kapasitas besar, efisiensi dari segi waktu, tenaga, tempat maupun energi.
Bidang produksi I akan melaksanakan kegiatan berdasarkan surat Perintah Pengolahan (PP) yang dikeluarkan oleh bagian Perencanaan Produksi Dan Pengendalian Persediaan (PPPP) yang disertai dengan Catatan Produksi Bets (CPB). CPB merupakan dokumen yang berisi semua prosedur dan persyaratan yang harus dipenuhi selama proses
Universitas Indonesia produksi dan segala sesuatu yang menyimpang yang teramati dicatat pada dokumen tersebut. PP disetujui oleh Manajer Produksi setelah dilakuakan pengecekan antara PP dengan Rencana Produksi Bulanan (RPB) dan Rencana Produksi Mingguan (RPM). PP yang telah disetujui oleh Manajer Produksi I akan digunakan sebagai Bon Permintaan Bahan Awal (BPBA) kepada bagian Logistik Bahan Awal (LBA). Di gudang, bahan yang diminta, disiapkan dan diserahkan ke bidang produksi I setelah dilakukan penimbangan oleh petugas dispensing disaksikan oleh petugas IPC. Bahan dari gudang yang telah diserahkan dari LBA ke seksi Solid I akan diproses sampai menjadi produk antara. Seksi Solid II akan mengolah produk antara menjadi produk ruah. Setelah produk ruah dinyatakan memenuhi syarat oleh bagian Quality Control (QC) dengan dikeluarkannya Laporan Analisis Memenuhi Syarat (LA MS), ke bagian seksi Solid II akan membuat Bukti Penyerahan Produk Ruahan (BPPR) kepada seksi Pengemasan dan PPPP akan mengeluarkan Perintah Kemas (PK). Bagian pengemasan akan membuat bon permintaan bahan pengemas ke bagian LBA sesuai dengan kebutuhan pengemasan. Sebelum proses pengemasan dimulai, dilakukan persiapan bahan pengemasan yaitu coding nomor registrasi, nomor bets, serta tanggal kadaluarsa di kemasan sekunder. Setelah proses pengemasan selesai baru kemudian diperoleh produk jadi.
Proses pengemasan yang dilakukan bidang produksi I meliputi stripping, blistering, dan bottling. Produk jadi dalam kemasan sekunder akan dikemas ke dalam karton yang telah disablon sesuai isinya dan diserahkan ke bagian logistik bahan jadi dengan membuat Bukti Penyerahan Produk Jadi (BPPJ). Produk jadi yang telah dikemas dalam karton akan dikarantina untuk diperiksa secara random tentang kelengkapan penandaan dan dokumentasinya. Produk jadi yang memenuhi syarat akan didistribusikan dan diambil contoh pertinggal (retained
sample) untuk tiap betsnya sebagai bahan penelusuran apabila ada keluhan
dikemudian hari. Setiap penyimpangan pada proses produksi akan dicatat dalam catatan penyimpangan produksi.
Universitas Indonesia 1) Seksi Solid I
a) Pembuatan massa tablet
Tugas seksi penyediaan massa meliputi persiapan, pengolahan, penyiapan bahan awal, dan pembuatan massa. Bahan aktif dan bahan penolong dimasukkan ke dalam alat penampung (bin). Bahan dalam bin kemudian dibawa dengan forklift dan siap diproses mixing dengan menggunakan mesin Azo-Thumbler di lantai 3 atau Diosna di lantai 2. Tahap berikutnya pengolahan massa dengan beberapa metode yaitu metode cetak langsung (Direct compression) atau granulasi basah (Wet Granulation). Adapun alur proses pembuatan sediaan tablet dapat dilihat pada lampiran 8.
b) Pembuatan Sediaan Kapsul
Kelembaban udara ruangan produksi kapsul hendaknya 50-60% karena cangkang kapsul dapat mengabsorpsi air. Alur proses pembuatan sediaan kapsul dapat dilihat pada lampiran 11.
2) Seksi Solid II
Seksi solid II bertugas mencetak massa tablet atau massa kapsul sampai menjadi produk ruah yang lulus uji dan siap dikemas, yang dilakukan di lantai dua. Tahapan yang dilakukan:
i. Mempersiapkan mesin ii. Mengoperasikan mesin iii. Menimbang produk ruahan
iv. Pemberian label, nama produk, nomor bets, jumlah dan tanggal pencetakan
v. Karantina produk ruah menunggu pemeriksaan dari bidang pemastian mutu
vi. Mencatat semua kegiatan yang dilakukan dalam catatan produksi bets
Pemeriksaan kualitas produk antara dan produk ruah oleh petugas IPC dilakukan selama proses berlangsung agar produk yang dihasilkan senantiasa memenuhi persyaratan mutu yang ditetapkan.
Universitas Indonesia Produk ruah yang lolos uji selanjutnya diserahkan ke bidang pengemasan (seksi pengemasan) untuk dikemas menjadi produk jadi. Dokumentasi pada bidang produksi I antara lain meliputi catatan produksi bets, protap kegiatan proses produksi, uraian tugas karyawan dan catatan produktivitas mesin.
3) Seksi Pengemasan
Suatu produk dapat dikatakan produk jadi bila telah melewati tahap pengemasan. Definisi pengemasan menurut pedoman CPOB tahun 2006 adalah bagian dari siklus produksi yang dilakukan terhadap produk ruah untuk menghasilkan produk jadi.
Pengemasan berkaitan dengan stabilitas obat berkaitan dengan stabilitas obat yang berfungsi melindungi obat terhadap kelembaban, iklim, dan benturan. Selain itu kemasan juga mempengaruhi daya tarik produk terhadap konsumen.
Jika ditinjau dari waktu dikeluarkannya PP dan PK, dikenal dua proses yaitu in line process dan non in line process. In line process yaitu proses dimana hasil produksi langsung dikemas dalam wadah pengemasnya, PP dan PK dikeluarkan bersamaan. Jadi mulai dari bahan awal sampai menjadi produk dalam kemasan akhir, proses tidak terputus. Proses ini diterapkan dalam sirup cair, sirup kering, salep dan oralit. Sedangkan pada proses produksi I non in line process dimana PP dan PK tidak dikeluarkan bersamaan. Setelah PP dikeluarkan, dilakukan penyiapan bahan awal sampai menjadi produk yang siap dikemas. Produk ini dikarantina menunggu released dari QC. Proses ini diterapkan dalam pembuatan kapsul, tablet, dan produk steril.
Pengemas merupakan terminal akhir produksi sebelum dipasarkan, sehingga suatu produk harus memenuhi syarat – syarat pengemasan yang baik, yaitu :
Dapat melindungi produk
Inert, spesifik bahan pengemasnya
Harus aman, tidak mudah dibuka oleh anak – anak
Universitas Indonesia Tujuan dilakukan perubahan kemasan adalah :
Untuk memberikan proteksi obat yang lebih baik
Untuk memberikan image (kesan) baru
Membedakan produk tersebut dari produk lainnya
Promosi
Sumber informasi
PK oleh bidang pengemasan digunakan sebagai bon permintaan bahan pengemasan yang diajukan ke bagian LBA. Bahan pengemasan dari gudang bila berupa karton akan dilakukan penyablonan yang berisi nama produk, nomor bets, expired date, sedangkan untuk etiket dan kotak akan dilakukan coding (pemberian kode) meliputi nomor bets, expired date dan lain – lain.
Produk ruah yang akan dikemas dan bahan kemas yang akan diterima dari gudang pengemasan semuanya sudah diluluskan oleh bidang pemastian mutu / Quality Assurance (QA). Proses pengemasan dapat berupa pengisian ke botol, stripping, blistering dan sachetting. Jenis pengemasan yang digunakan disesuaikan dengan sifat produk ruah dan permintaan pasar. Sebelum dilakukan proses pengemasan, jalur pengemasan harus telah dibersihkan (line clearance) untuk mencegah terjadinya mixed-up label dan selama proses pengemasan dilakukan IPC, misalnya uji kebocoran strip, blister, dan sachet sebanyak empat lempeng strip atau blister selama 15 menit.
Selanjutnya dilakukan proses dokumentasi untuk bidang pengemasan meliputi catatan produksi bets, papan penandaan, catatan sanitasi, catatan produksi harian yang terdiri dari kontrol harian mesin, pengepakan dan laporan bulanan.
4) Seksi Herbal dan Makanan
Bahan baku obat tradisional yang digunakan berasal dari dalam maupun luar negeri. Seksi herbal ini bertugas menyiapkan formula dan proses pembuatan produk baru sediaan herbal dan makanan, mendesain formula, merancang metode pembuatan, pengembangan bahan substitusi dan reformulasi atau reproses. Sistem produksi berupa horizontal closed