LAMPIRAN
Lampiran 1. Tata letak bangunan di PT. Indofarma (Persero) Tbk.
Keterangan: A. Head office B. Training center C. Cafetaria D. Koperasi
E. Poliklinik dan apotek F. Masjid
G. Laboratorium (QC dan Litbang) H. Gedung Produksi β-laktam
I. Gedung produksi (I dan serbuk, salep, sirup)
J. Gedung produksi II K. Gedung produksi steril L. Gedung produksi herbal
M. Gudang
Lampiran 2. Bagan sistem pengolahan air PT. Indofarma (Persero) Tbk.
Produksi Utilities Umum
Zenoit untuk mengikat Mg & Ca sebelum dipanaskan. NaCl untuk
regenerasi
Kamar Mandi
Humidity AHU
Menara Air Resin Penukar
Anion
Lampiran 3. Bagan sistem pengaturan udara PT. Indofarma (Persero) Tbk.
Udara luar (fresh air)
Udara balik (return air)
Pre Filter
Medium Filter
Cooling coil
Blower
Ruang produksi non steril
HEPA Filter
Cooling coil
Blower
Ruang produksi
Lampiran 4. Bagan sistem instalasi pengolahan air limbah (IPAL) PT. Indofarma (Persero) Tbk.
Limbah cair β-laktam, sebelum memasuki bak penampungan limbah, ditampung di bak penampung khusus untuk memecahkan cincin β-laktamnya dengan menggunakan NaOH dan dinetralkan dengan HCl.
Keterangan: 1. Bak Pertama 2. Bak Penyaringan 3. Bak Aerasi 4. Bak Penenang 5. Bak Aerasi 6. Bak Penenang 7. Bak Penenang 8. Bak Penenang 9. Bak Penenang Akhir
2
6 7
5 9
2 4
1 8
DAFTAR PUSTAKA
Anonim. (2009). Petunjuk Operasional Penerapan Cara Pembuatan Obat yang Baik. Jakarta: Badan Pengawasan Obat dan Makanan RI.
Anonim. (1988). Keputusan Mentri Kesehatan Republik Indonesia No. 43/Menkes/SK/II/1988 tentang Pedoman CPOB. Departemen Kesehatan Republik Indonesia. Jakarta.
Anonim. (1988). Keputusan Mentri Kesehatan Republik Indonesia No. 1799/Menkes/PER/XII/2010 tentang Industri Farmasi. Departemen Kesehatan Republik Indonesia. Jakarta.
Badan POM RI.(2006). Pedoman Cara Pembuatan Obat yang Baik. Jakarta: Badan Pengawas Obat dan Makanan RI.
Bidang LBA. (2010). Tata Cara Pelaksanaan pada Bidang Logistik Bahan Awal. Penyaji Teddy. S. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang Litbang. (2010). Peran, Fungsi Bidang Litbang Produk. Penyaji Hugo. K. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang Pengadaan. (2010). Mekanisme dan Pelaksanaan Pengadaan Bahan di Indofarma. Penyaji Tim Pengadaan. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang PKBL. (2010). Pelaksanaan Program Kemitraan dan Bina Lingkungan. Penyaji Nurhadi. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang PPPP. (2010). Peran, Fungsi dan Manajemen PPIC. Penyaji Tim PPPP. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang Produksi I. (2010). Tinjauan Umum dan Mekanisme Produk pada Bidang Produksi I. Penyaji Eni. R. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang SBD. (2010). Strategi, Pengembangan Produk dan Bisnis. Penyaji Rahmat. R. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang SDM. (2010). Kebijakan, Penanganan SDM beserta Problematikanya. Penyaji Baharuddin. Cibitung: PT. Indofarma (Persero) Tbk.
Bidang Teknik dan Pemeliharaan. (2010). Operasional Bidang Teknik dan Utilities. Penyaji Arif. B. Cibitung: PT. Indofarma (Persero) Tbk.
BAB III
RUANG LINGKUP PT. INDOFARMA (Persero) Tbk.
PT. Indofarma (Persero) Tbk. merupakan perusahaan farmasi yang memproduksi obat generik etikal sebagai produk utama disamping memproduksi obat dengan nama dagang, lisensi, OTC, herbal medicine dan alat kesehatan. Dalam menjalankan perusahaan, PT. Indofarma (Persero) Tbk. menitik beratkan kegiatan kepada nilai inti perusahaan, yaitu profesional, kewirausahaan dan kepedulian. Dari segi profesional, perusahaan menjunjung tinggi integritas, komitmen seluruh insan dan kepurnaan. Dari segi kewirausahaan, dimana perusahaan berpandangan visioner, inovasi untuk pertumbuhan dan fokus kepada pelanggan. Dari segi kepedulian, perusahaan menghargai sikap dan pandangan orang lain, kerja sama tim serta kesetaraan atas kesempatan dan penghargaan.
Gambar 3.1 Struktur Organisasi PT. Indofarma (Persero) Tbk.
Direktorat
3.1 Direktorat Produksi
Direktorat Produksi PT. Indofarma (Persero) Tbk. membawahi tujuh bidang dimana setiap bidang dipimpin oleh seorang manager yang dibantu oleh asisten manager dan supervisor.
3.1.1 Bidang Production Planning and Inventory Control (PPIC) atau Perencanaan Produksi dan Pengendalian Persediaan (PPPP)
peranan strategis dalam peningkatan efisiensi dan produktifitas, proses pabrikasi, pengendalian persediaan sehingga diharapkan dapat menghasilkan produk dengan mutu, harga, jumlah dan waktu serta pelayanan yang tepat.
Seksi perencanaan dan pengendalian mempunyai dua fungsi. Fungsi perencanaan merupakan landasan utama dalam penentuan permintaan marketing dan langkah-langkah yang diperlukan untuk memastikan tercapainya permintaan tersebut. Fungsi pengendalian, merupakan alat manajemen untuk memastikan tersedianya bahan awal, produk ruah dan produk jadi untuk terpenuhinya permintaan marketing, serta pengaturan agar tidak terjadi over stock atau out of stock.
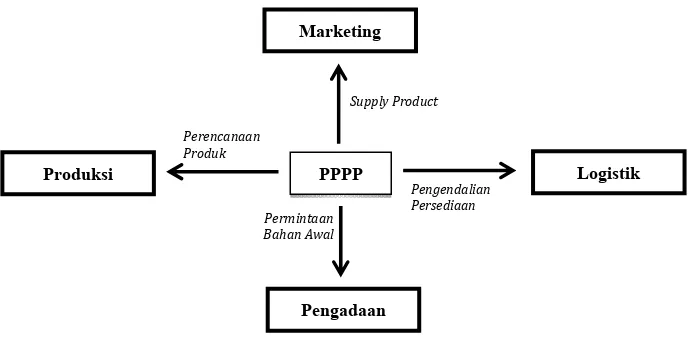
Hubungan kerja PPPP dengan berbagai bidang lain dapat dilihat pada gambar 3.2 di bawah ini:
Gambar 3.2 Hubungan Kerja Bidang PPPP dengan Bidang lain di PT. Indofarma (Persero) Tbk.
Alur proses perencanaan dimulai dari bidang pemasaran menyerahkan rencana penjualan satu tahun kepada bidang PPPP, PPPP kemudian membuat rencana produksi satu tahun serta rencana kebutuhan satu tahun dan disetujui Direktur Produksi. Rencana tersebut digunakan sebagai dasar pembuatan Rencana Kerja dan Anggaran Perusahaan (RKAP) yang disusun setiap tahun kemudian dijabarkan dalam Konsep Rencana Produksi Periodik (KRPP) dan Konsep Rencana
Kedatangan Bahan (KRKB) perkuartal. Rencana Produksi Bulanan (RPB) dibuat berdasarkan KRPP dan KRKB. Rencana Produksi Bulanan (RPB) ini digunakan untuk menyiapkan Perintah Pengolahan (PP) dan Perintah Kemas (PK).
Alur proses pengendalian bahan dimulai dari diterbitkannya perintah pengolahan sekaligus berlaku sebagai bon permintaan bahan ke gudang penyimpanan bahan baku dan bahan penolong. Bukti Penyerahan Produk Ruah (BPPR) kemudian diterbitkan, selanjutnya keluar PK dan Bukti Penyerahan Produk Jadi (BPPJ). Bidang Produksi membuat Rencana Produksi Mingguan (RPM) berdasarkan PP dan PK yang selanjutnya digunakan sebagai pedoman proses produksi. Proses produksi dilaporkan dalam bentuk laporan produksi dan ditujukan antara lain kepada bidang PPPP sebagai informasi untuk fungsi pengendalian produksi. Bidang Pengadaan kemudian memberikan informasi kemajuan proses pengadaan kepada PPPP untuk fungsi pengendalian bahan. Alur proses pengendalian ditunjukkan pada gambar 3.3 di bawah ini:
Gambar 3.3 Alur Proses Pengendalian Produksi Tugas PPPP dalam pengendalian bahan adalah:
Monitoring kedatangan bahan sampai dengan bahan tersebut bisa digunakan
untuk proses produksi.
Memantau inventory bahan (terutama bahan yang dipakai banyak item)
Analisa terhadap perubahan pasar, disain produk dan kemasan, kegagalan produk
dan kerusakan bahan, nilai persediaan
Monitoring kemajuan dan kendala pengadaan bahan
Koordinasi problem solving
3.1.2 Produksi I
Proses produksi tablet di produksi I dilakukan dengan metode vertical closed system, yaitu sistem vertikal tertutup dimana proses produksi dilakukan dengan memanfaatkan gaya gravitasi. Metode ini dilaksanakan diproduksi I karena bentuk bangunan produksi utama memungkinkan untuk diterapkan metode tersebut (3 lantai) dan produksinya besar sehingga efisiensi tenaga tercapai. Keuntungan sistem ini adalah dapat meminimalkan terjadinya kontaminasi silang, bets dapat dibuat dalam kapasitas besar, efisiensi dari segi waktu, tenaga, tempat maupun energi.
bahan pengemasan yaitu coding nomor bets, manufacturing date, HET (Harga Eceran Tertinggi), tanggal kadaluarsa di kemasan sekunder dilakukan sebelum proses pengemasan dimulai. Produk jadi diperoleh setelah proses pengemasan selesai.
Proses pengemasan yang dilakukan bidang produksi I meliputi stripping, blistering dan bottling. Produk jadi dalam kemasan sekunder akan dikemas ke dalam karton yang telah disablon sesuai isinya dan diserahkan ke bagian logistik bahan jadi dengan membuat BPPJ. Produk jadi yang telah dikemas dalam karton akan dikarantina untuk diperiksa secara random tentang kelengkapan penandaan dan dokumentasinya. Produk jadi yang memenuhi syarat akan didistribusikan dan diambil contoh pertinggal (retained sample) untuk tiap betsnya sebagai bahan penelusuran apabila ada keluhan di kemudian hari. Setiap penyimpangan pada proses produksi akan dicatat dalam catatan penyimpangan produksi.
1. Pembuatan Massa Tablet
Tahap pertama dalam proses produksi adalah pembuatan massa. Seksi ini bertugas dalam persiapan pengolahan, penyiapan bahan awal, dan pembuatan massa. Sebelum ditimbang, beberapa jenis bahan tertentu diberi perlakuan praformulasi yang dilakukan oleh bagian dispensing seperti pengeringan dan pengayakan dengan ukuran mesh tertentu untuk memperkecil ukuran partikel.
lantai III atau mixer diosna di lantai II. Tahap berikutnya pengolahan massa dengan beberapa metode, yaitu
1) Metode cetak langsung (direct compress)
Tahap berikutnya massa kemudian diproses menjadi produk ruahan dengan mesin cetak di lantai II dengan cara sebagai berikut :
a) Massa dari mesin diosna ditampung dalam tong atau bin kemudian dibawa ke lantai III.
b) Massa dialirkan ke hopper mesin cetak di lantai II dengan dilewatkan
loading station melalui pipa stainless steel yang dilengkapi kain tunnel. c) Pencetakan tablet.
2) Metode granulasi basah (wet granulation)
Tahap pembuatannya sebagai berikut :
a) Hasil pencampuran bahan awal dilakukan proses pengadukan basah dengan bahan pengikat dan dibuat granul sesuai yang dikehendaki menggunakan mixer battagion (kapasitas 400-600 L) di lantai II. Granul basah ditampung dalam basket fluid bed dryer di lantai I selanjutnya dikeringkan dengan fluid bed dryer zanchetta sampai kadar air tertentu. b) Granul kering diayak dengan granulator.
c) Granulat dibawa ke lantai II untuk ditimbang ulang.
d) Proses pencampuran akhir dengan menambahkan bahan lubrikan dan disintegran menggunakan mixer diosna kemudian ditampung dalam bin dan dicek homogenitasnya oleh IPC.
e) Bin yang berisi massa tablet dibawa ke lantai III dan ditempatkan pada
loading station, dialirkan melalui pipa stainless steel yang dilengkapi kain
2.Pembuatan Sediaan Kapsul
Produksi kapsul dilakukan dalam ruangan dengan kelembaban udara 50 – 60% karena cangkang kapsul mudah dipengaruhi oleh kelembaban. Alur proses pembuatan sediaan kapsul adalah sebagai berikut :
1) Bahan yang telah memenuhi syarat ditimbang di dispensing lantai III. 2) Bahan dilewatkan melalui mesin penyedot vakum (azo) yang dilengkapi
ayakan berputar (rotatif sieve) dimasukkan ke dalam bin, dialirkan ke
mixerdiosna di lantai II melalui loading station.
3) Massa hasil pengadukan selanjutnya dipindahkan ke lantai III. Petugas IPC akan melakukan pemeriksaan terhadap massa tersebut mengenai homogenitas dan kadarnya.
4) Selanjutnya dialirkan ke hopper mesin pengisi kapsul (capsule filling machine) di lantai II melalui loading station.
5) Kapsul dibersihkan melalui proses polishing.
6) Produk ruahan dikarantina untuk menunggu hasil analisis dari bidang pemastian mutu. Produk yang telah memenuhi syarat dapat dikemas.
3. Bagian pengemasan
Suatu produk dapat dikatakan produk jadi bila telah melewati tahap pengemasan. Definisi pengemasan menurut pedoman CPOB Departemen Kesehatan Republik Indonesia tahun 2006 adalah bagian dari siklus produksi yang dilakukan terhadap produk ruah untuk menghasilkan produk jadi. Pengemasan berkaitan dengan stabilitas obat yang berfungsi melindungi obat terhadap kelembaban, iklim dan benturan. Kemasan juga mempengaruhi daya tarik produk terhadap konsumen.
produksi langsung dikemas dalam wadah pengemasnya, PP dan PK dikeluarkan bersamaan, jadi mulai dari bahan awal sampai menjadi produk dalam kemasan akhir, proses tidak terputus. Proses ini diterapkan dalam sirup cair, sirup kering, salep dan serbuk. Non in line process dimana PP dan PK tidak dikeluarkan bersamaan. PP dikeluarkan, kemudian dilakukan penyiapan bahan awal sampai menjadi produk yang siap dikemas. Produk ini dikarantina menunggu released dari QC. Proses ini diterapkan dalam pembuatan kapsul, tablet dan produk steril.
PK oleh bidang pengemasan digunakan sebagai bon permintaan bahan pengemasan yang diajukan ke bagian LBA. Bahan pengemasan dari gudang bila berupa karton akan dilakukan penyablonan yang berisi nama produk, nomor bets, expired date (ED), sedangkan untuk etiket dan kotak akan dilakukan coding (pemberian kode) meliputi nomor bets, ED, HET (Harga Eceran Tertinggi), manufacturing date.
Jalur pengemasan harus telah dibersihkan (line clearance) sebelum dilakukan proses pengemasan, IPC dilakukan selama proses pengemasan, misalnya uji kebocoran strip, blister, dan sachet sebanyak empat lempeng strip atau blister selama 15 menit. Proses dokumentasi selanjutnya dilakukan untuk bidang pengemasan meliputi Catatan Pengolahan Bets, papan penandaan, catatan sanitasi, catatan produksi harian yang terdiri dari kontrol harian mesin, pengepakan dan laporan bulanan.
3.1.3 Seksi Herbal
berawal “Pro”, misalnya Prolipid, Probagin dan Prouric. Obat tradisional yang bahan baku yang diimpor nama produknya berawalan “Bio”, misalnya Biovision, Bioginko dan lain-lain.
Kegiatan produksi diseksi herbal meliputi sortasi, pencucian simplisia, ekstraksi, formulasi dan pengemasan. Bahan baku dipenuhi dengan cara membeli langsung dari supplier, melalui petani binaan atau bekerja sama dengan institusi lain. Bahan baku tersebut harus memenuhi spesifikasi yang ditetapkan oleh PT. Indofarma (Persero) Tbk. seperti kadar air (lebih kecil dari 10%), kadar sari larut dalam air dan kadar sari larut dalam alkohol (tergantung simplisia) mengacu kepada buku resmi yang ditetapkan yaitu Materia Medika Indonesia.
Sistem produksi sesuai dengan CPOTB (Cara Pembuatan Obat Tradisional yang Baik). Produksi herbal di PT. Indofarma (Persero) Tbk berupa horizontal close system dengan menggunakan metode ekstraksi berupa maserasi, perkolasi dan gabungan keduanya. Pengeringan ekstrak menggunakan tiga metode yaitu spray dryer, dehumidifier, dan vaccum dryer. Proses pengolahan ekstrak dimulai dari perajangan kemudian ekstraksi (penyarian), pengentalan, pengeringan kering yang kemudian menghasilkan ekstrak kering.
3.1.4 Produksi II
Bidang produksi II dipimpin oleh seorang manager. Bidang ini membawahi tiga seksi, yaitu seksi β-laktam, seksi salep, sirup, serbuk dan seksi produksi steril. Bidang produksi II bertugas untuk memastikan tersedianya produk tablet, kapsul dan sirup kering β-laktam, salep, sirup, serbuk dan produk steril sesuai target dengan cara merencanakan, mengkoordinasi dan mengendalikan aktivitas pengolahan, pengemasan dan kegiatan terkait. Produksi sediaan β-laktam, salep dan sirup menggunakan horizontal closed system dimana penyiapan bahan awal sampai produk akhir diproses dalam lantai yang sama, karena sediaan yang diproduksi dalam jumlah yang relatif kecil. Bidang ini membawahi tiga seksi, yaitu:
A. Seksi Sediaan β-laktam
Seksi sediaan β-laktam bertugas memproduksi sediaan antibiotika yang mempunyai inti β-laktam. Bentuk sediaannya berupa tablet, kapsul dan sirup kering. Gedung dan fasilitas produksi β-laktam secara fisik dipisahkan dari produksi lain (non β-laktam). Pemisahan ini dilakukan sebagai tindakan pengamanan untuk mencegah terjadinya kontaminasi silang dengan produk lain.
Arus keluar-masuk menggunakan air locked system untuk menghindari terjadinya kontaminasi silang. Air locked system mempunyai tekanan udara lebih rendah dari ruangan lainnya. Pengendalian udara dilakukan dengan sistem Air Handling Unit (AHU), dimana gedung β-laktam terpisah dari gedung non β-laktam.
washer, air shower dan ruang penyangga. Lantai, dinding dan langit-langit dilapisi oleh bahan epoksi untuk memudahkan pembersihan.
Proses pengolahan tablet, kapsul dan sirup kering sama dengan proses pada produksi I dan II, tetapi dilakukan dengan cara horizontal closed system. Bahan penolong yang berasal dari gudang utama hanya boleh masuk ruang penyangga dan selanjutnya diambil oleh orang yang berada di dalam ruang produksi.
B. Seksi sediaan salep, sirup dan serbuk
Seksi sediaan salep, sirup dan serbuk memproduksi sediaan sirup cair, suspensi, salep kulit, krim.
B.1 Produksi sediaan salep
Alur proses produksi sediaan salep kulit adalah sebagai berikut: 1. Penimbangan bahan awal yang telah lulus uji
2. Pelelehan basis di dalam vessel atau pelelehan (tanpa pengaduk)
3. Basis dipindahkan ke dalam vessel yang dilengkapi pengaduk melalui pompa dengan filter, kemudian dilakukan pengeringan basis. Massa basis selanjutnya didinginkan dan dilakukan pemeriksaan kadar air oleh bagian IPC.
4. Bahan aktif, penolong dan pengawet ditambahkan ke dalam massa basis sambil diaduk.
5. Massa salep dihomogenkan dengan menggunakan homogenizer dan kemudian divakumkan untuk mengusir udara yang terperangkap.
dengan penimbangan 20 tube setiap 15 menit dan dibuat peta kendalinya. Petugas IPC akan melakukan sampling untuk diuji.
B.2 Produksi sediaan sirup cair dan sirup kering
Sirup yang diproduksi oleh bidang produksi II ada dua macam, yaitu sirup cair dan sirup kering.
Sediaan sirup cair
Tahap-tahap produksi sediaan sirup cair:
a. Pembuatan sirup cair diawali dengan pemeriksaan air/DIW (Deionized Water Systems) yang akan digunakan sebagai bahan baku.
b. Dispensing bahan-bahan awal yang telah dinyatakan memenuhi syarat. c. Pembuatan larutan bahan dalam DIW dan pembuatan suspensi induk.
d. Pencampuran larutan bahan dan suspensi induk dalam vessel yang dilengkapi pengaduk, kemudian dilakukan sirkulasi dengan menggunakan pompa, flavouring agent ditambahkan pada suhu massa suspensi 40ºC kemudian dilakukan pengecekan oleh IPC terhadap massa suspensi.
e. Massa suspensi yang telah lulus uji dialirkan ke filling machine melalui pompa. Filling machine dilengkapi dengan mesin peniup udara kering, mesin penutup botol dan mesin penempel etiket. Pengawasan terhadap keseragaman bobot dilakukan selama proses pengisian, dengan pemeriksaan bobot 6 botol setiap 15 menit dan dibuat peta kendalinya. Petugas IPC akan melakukan sampling untuk diuji.
f. Pengemasan ke dalam wadah pengemas sekunder dan tersier.
Sediaan sirup kering
a. Proses diawali dengan pengayakan dan granulasi.
b. Penimbangan kemudian pencampuran dengan bahan tambahan didalam diosna. c. Dilanjutkan dengan pengisian dan pengemasan. Kontrol oleh IPC dilakukan
pada semua proses.
Untuk pembuatan sirup kering ini, kelembaban udara diatur sedemikian rupa sehingga kurang dari 50%, menggunakan alat dehumiditifier. Massa sirup kering yang telah memenuhi syarat dimasukkan kedalam botol, pengisian sirup kering ini masih dilakukan secara manual. Botol ditutup setelah dilakukan pengisian, diberi etiket dan dikemas.
C. Seksi sediaan steril
Ruang produksi steril dibagi menjadi beberapa kelas sesuai dengan persyaratan CPOB. Pembagian ini berdasarkan derajat kebersihannya yaitu:
Ruang kelas I (white area atau ruang kritis) merupakan ruang kelas di bawah LAF
(Laminar Air Flow) yang dilengkapi dengan HEPA-filter berefisiensi 99,997%.
Ruang kelas II, sama dengan ruang kelas I tetapi tanpa laminar air flow (LAF).
Ruangan ini digunakan untuk pengisian, penimbangan, pembuatan larutan dan penyaringan.
Ruang kelas III (grey area), ruangan ini digunakan untuk pencucian.
Ruang kelas IV (black area) dengan persyaratan harus bersih secara visual.
Lay out bahan, barang dan karyawan dilakukan untuk mencapai kualitas ruangan yang memenuhi persyaratan jumlah cemaran dan partikel.
Sanitasi ruangan dan peralatan secara berkala juga dilakukan, sanitasi dilakukan secara harian, mingguan dan bulanan. Sanitasi harian meliputi pembersihan lantai dan dinding dengan dipel. Sanitasi mingguan dilakukan setiap jumat malam dengan pemberian gas formaldehida dan setiap senin pagi dilakukan evakuasi untuk menghilangkan gas tersebut dengan penyedotan udara ruangan. Tekanan udara antara ruangan dikendalikan untuk mencegah terjadinya kontaminasi silang.
3.1.5 Bidang Penelitian dan Pengembangan (Litbang) Produk
Bagian ini dipimpin oleh seorang manager (apoteker). Bagian Penelitian dan Pengembangan Produk bertugas meneliti dan mengembangkan produk serta mengoptimasi proses sesuai dengan CPOB.
Tugas bagian pengembangan produk meliputi: 1. Penelitian produk baru
2. Optimasi produk yang meliputi optimasi formula termasuk optimasi proses dan substitusi bahan.
3. Pengembangan metode analisis.
4. Penyiapan dokumen registrasi lokal dan ekspor 5. Disain kemasan
6. Mengorganisasi uji klinis obat dan penelitian ketersediaan hayati yang bekerja sama dengan instansi lain.
7. Mengadakan kerja sama di bidang penelitian dengan instansi lain seperti LIPI dan Perguruan Tinggi.
9. Menyiapkan instruksi tertulis yang rinci untuk setiap pemeriksaan analisis. 10. Menetapkan tanggal kadaluarsa dan batas waktu penggunaan bahan awal dan
obat jadi berdasarkan data stabilitas dan kondisi penyimpanan.
Kegiatan lainnya adalah membuat publikasi ilmiah dengan mengelola perpustakaan. Bagian pengembangan produk harus mengembangkan produk-produk baru, sehingga dapat dipertimbangkan oleh direksi. Proses pengembangan formula tersebut meliputi studi pustaka, penetapan spesifikasi produk, seleksi bahan baku aktif dan penolong, trial dan error, scalling up ke skala produksi dan uji stabilitas.
3.1.6 Bidang Pengawasan Mutu (QC)
Bidang QC di PT. Indofarma (Persero) Tbk. mempunyai 3 seksi yaitu seksi pengujian bahan awal dan bahan pengemas, seksi pengujian mikrobiologi, IPC dan pengujian produk.
A. Seksi Pengujian Bahan Awal dan Bahan Pengemas A.1 Seksi Pengujian Bahan Awal
Pemeriksaan bahan awal dimulai dari gudang, yaitu bahan masuk digudang dikarantina, disampling dan diuji oleh QC untuk menentukan bahan tersebut memenuhi syarat (diterima) atau tidak memenuhi syarat (ditolak). Seksi pengujian bahan awal melakukan pengujian bahan baku, air dan bahan pengemas.
Bahan baku dimulai dari kegiatan sampling sampai dengan pengujiannya.
Dicek label dari pabrik yang meliputi berat bersih, nomor lot, tanggal
pembuatan, ED dan logistik.
Dicek label karantina digudang meliputi nama barang, nomor kode, nomor
Sampel diidentifikasi secara fisika atau organoleptis meliputi bau, rasa dan
warna.
Sampel diidentifikasi secara kimia seperti pengujian kadar.
Uji lain, antara lain meliputi tes kemurnian, pH dan kadar air.
Air digunakan oleh bidang produksi yang pengujiannya meliputi pH,
kandungan mineral dan cemaran mikroorganisme. A.2 Seksi Bahan Pengemas
Pengemas berhubungan dengan stabilitas obat yang berfungsi melindungi obat terhadap kelembaban, iklim dan benturan. Kemasan juga mempengaruhi daya tarik konsumen terhadap produk.
Bahan pengemas dibedakan menjadi tiga macam, yaitu:
a. Bahan pengemas primer, bahan pengemas yang langsung berhubungan dengan produk seperti tube, botol, ampul, stripping dan blister.
b. Bahan pengemas sekunder, bahan pengemas yang tidak berhubungan langsung dengan produk obat, tapi berhubungan dengan pengemas primer seperti dus ampul dan kotak botol.
c. Bahan pengemas tersier, bahan pengemas yang berhubungan langsung dengan pengemas sekunder misalnya karton.
B. Seksi Pengujian Mikrobiologi
C. Seksi IPC dan Pengujian Produk
Tugas seksi IPC dan pengujian produk meliputi pengujian terhadap produk antara dan produk ruahan.
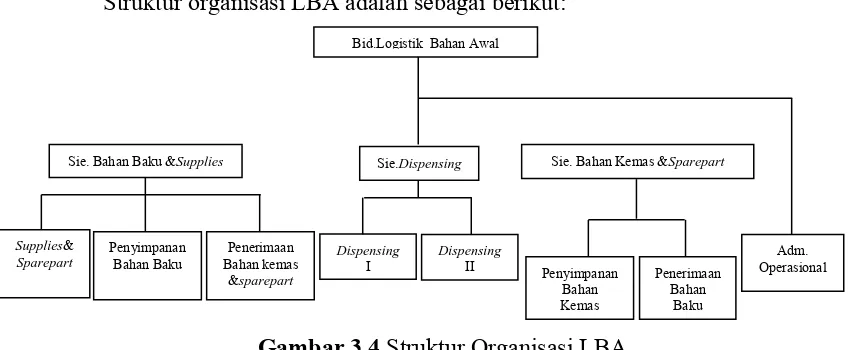
3.1.7 Bidang Logistik Bahan Awal (LBA)
Kedudukan bidang LBA berada dibawah Direktur Produksi, dipimpin oleh seorang manager. Bidang LBA dibagi menjadi 3 seksi, yaitu: seksi bahan baku dan supplies, seksi bahan pengemas dan spare part dan seksi dispensing, masing-masing seksi dipimpin oleh asisten manager.
Struktur organisasi LBA adalah sebagai berikut:
Gambar 3.4 Struktur Organisasi LBA
Kegiatan utama dari bidang LBA adalah penerimaan barang, penyimpanan barang, pengeluaran barang dan sistem komputer. Pengeluaran barang di gudang LBA berdasarkan prinsip FEFO (First Expired First Out) atau FIFO (First In First Out).
3.1.8 Teknik dan Pemeliharaan
Bidang Teknik PT. Indofarma (Persero) Tbk. melakukan pengawasan dan pemeliharaan terhadap semua fasilitas dan peralatan pabrik untuk menjaga kelancaran proses produksi. Bidang teknik ini berperan dalam memperbaiki, merawat dan merekayasa mesin peralatan produksi, peralatan laboratorium, peralatan kantor dan alat-alat telekomunikasi.
Penerimaan
Sie. Bahan Baku &Supplies
Adm. Sie. Bahan Kemas &Sparepart
PT. Indofarma (Persero) Tbk. sudah mengikuti perubahan sesuai CPOB 2006, yakni bangunan, sarana penunjang dan peralatan digabung menjadi satu bagian karena ketiga aspek tersebut memiliki hubungan yang sangat erat satu sama lain sebagai satu kesatuan penunjang proses produksi. PT. Indofarma (Persero) Tbk. sangat memperhatikan tata letak ruang dimaksudkan untuk menghindari terjadinya kontaminasi silang produk selama proses produksi obat berlangsung. Hal yang menjadi perhatian cukup serius antara lain perbedaan tekanan udara, sistem penghisap debu dan sistem penyaringan udara serta sirkulasi udara di dalam daerah proses produksi.
1. Air Handling Unit
Suhu yang ada di ruangan produksi solid maupun semisolid sama yaitu 18-26ºC, untuk kelembaban udara di ruangan solid diatur 40-70% sedangkan untuk ruangan produksi semisolid & liquid tidak disyaratkan. Suhu di ruangan produksi tablet effervescent diatur sama seperti ruangan produksi lainnya, namun yang membedakan yaitu pangaturan kelembaban udara dimana pada ruangan produksi ini kelembaban udaranya harus <35% (dalam range 20-35%). Hal ini dilakukan dengan tujuan mengoptimalkan kondisi lingkungan dimana produk tablet effervescent dibuat karena akan mempengaruhi kualitas dari tablet tersebut. Oleh karena itu, peranan HVAC terhadap kualitas produk sangat erat kaitannya.
2. Water System
Water system merupakan sistem pengolahan air yang akan digunakan untuk produksi. Air merupakan salah satu aspek penting (vital) dalam pelaksanaan c-GMP. Tujuan dari sistem pengelolaan air untuk produksi adalah untuk menghilangkan cemaran sesuai dengan standar kualitas yang ditetapkan. Kualitas air yang digunakan untuk produksi, tergantung dari persyaratan air yang digunakan produk yang dibuat.
serta menghilangkan bau dan rasa air tersebut sehingga air yang dihasilkan jernih, tidak berasa dan tidak berbau.
Air disirkulasikan selama 24 jam dengan suhu 80ºC dengan tujuan mencegah pertumbuhan bakteri. Air dipanaskan satu minggu sekali hingga suhu 90-95ºC selama kurang lebih 3 jam dengan tujuan sanitasi. Air masuk kedalam tangki utama dipompa dengan penambahan ozon, kemudian disalurkan ke dalam tangki yang lain. Air dari masing-masing tangki didistribusikan ke masing-masing gedung yang sesuai dengan fungsi tangki masing-masing yang terlebih dahulu dilalui ke ozon detector yakni melalui sinar UV 364 nm untuk memecah ion ozon, ion ozon tidak boleh sampai terdistribusi kedalam gedung produksi karena ozon bersifat radikal bebas. Air kemudian didistribusikan ke masing-masing gedung sesuai kebutuhannya dan siap digunakan untuk kegiatan produksi.
3.2 Direktorat Riset dan Pemasaran
PT. Indofarma (Persero) Tbk. berusaha memasyarakatkan obat generik bermutu namun terjangkau harganya melalui upaya-upaya pemasaran misalnya melalui promosi sosial (Social promotion). PT. Indofarma (Persero) Tbk. adalah satu-satunya perusahaan farmasi yang mempunyai Medical Sales Representative untuk obat generik. PT.Indofarma (Persero) Tbk. memproduksi obat dalam skala besar yang memungkinkan dapat menurunkan biaya produksi sehingga harga jualpun dapat ditekan.
3.2.1 Bidang Logistik Produk Jadi (LPJ)
menolak pengiriman barang, mengkoordinasi penerimaan barang, menetapkan sistem penyimpanan barang, menetapkan lokasi penyimpanan produk jadi di dalam gudang, dan mengesahkan Surat Pengantar Barang (SPB) berdasarkan Sales Order (SO).
3.3 Direktorat Keuangan dan Sumber Daya Manusia (SDM)
Lima bidang yang terdapat pada direktorat keuangan dan SDM yaitu: bidang keuangan, bidang akuntansi, bidang anggaran & pengendalian keuangan, SDM dan bidang umum. Bidang-bidang tersebut masing-masing dipimpin oleh seorang manager.
Bidang umum bertanggung jawab dalam pelayanan operasional, pelayanan rumah tangga serta keselamatan dan kesehatan kerja dan analisis mengenai dampak lingkungan (K3 dan Amdal). Manajemen lingkungan bertanggung jawab dalam menganalisa dampak lingkungan seperti pengolahan air limbah melalui Instalasi Pengolahan Limbah (IPAL), pengolahan asap dan lain sebagainya yang dapat membahayakan keselamatan lingkungan sekitar perusahaan, karena yang akan merasakan dampak pertama kali adalah masyarakat sekitar sehingga masyarakat menjadi sangat terganggu akan keberadaan perusahaan tersebut. PT. Indofarma (Persero) Tbk. melakukan tindakan-tindakan ramah lingkungan sebagai wujud tanggung jawab dari perusahaan, salah satunya pengolahan terhadap limbah yang diproduksi. Limbah yang dihasilkan berupa limbah cair dan padat. Limbah tersebut harus ditangani dengan sebaik-baiknya untuk menjaga kelestarian lingkungan. IPAL berfungsi untuk mencegah pencemaran lingkungan oleh produksi.
Penanganan limbah berdasarkan jenisnya yaitu: a) Limbah Padat
Limbah tersebut dipilah-pilah sebelum dimasukkan dalam proses selanjutnya, sebagian dibakar di incenerator dan didaur ulang oleh pihak kedua diluar pabrik, sedangkan yang dibakar adalah semua jenis limbah padat yang sudah terkontaminasi dengan bahan baku atau proses produksi, seperti plastik, karton, kemasan primer dan sebagainya. Limbah padat yang masih dapat didaur ulang diserahkan penanganannya pada koperasi pegawai Indofarma.
b) Limbah Cair
Untuk menangani limbah cair di Indofarma dipisah atas 3 bagian, yaitu: 1) Saluran Air Limbah Produksi
Upaya pengelolaan limbah cair yang telah dilakukan ialah dengan memisahkan saluran pembuangan, antara buangan produksi dengan limbah cair dari sanitasi/domestik dan air hujan, sehingga masing-masing menempati satu saluran khusus.
Limbah cair yang berasal dari pencucian alat-alat dan ruang produksi obat, sisa produksi dan sisa pereaksi kimia pada kegiatan QC yang mengandung zat-zat yang bersifat toksik dan mengandung antibiotika dialirkan melalui saluran khusus sebelum diolah pada satu unit IPAL.
Khusus untuk produksi β-laktam sebelum dialirkan ke IPAL, dilakukan pre-threatment terlebih dahulu yang meliputi:
a) Air cucian mesin dari proses produksi β-laktam dikumpulkan pada drum yang telah disediakan
b) Dilakukan penambahan NaOH sambil diaduk sampai diperoleh pH 12-13.
d) Kemudian pada larutan di atas ditambahkan HCl sambil dikocok sampai diperoleh pH netral
e) Larutan dengan pH netral tersebut dialirkan ke saluran limbah yang telah disediakan menuju IPAL.
2) Saluran Air Limbah Rumah Tangga
Air yang berasal dari kamar mandi termasuk kloset dimasukkan kedalam septic tank untuk mengendapkan kotoran yang berupa partikel padat dan airnya dialirkan kerembesan yang terletak dibelakang pabrik.
3) Saluran Air Hujan
Air hujan yang turun dilokasi pabrik dialirkan melalui inspection fit agar partikel padatnya, seperti tanah, pasir dan lumpur dapat tertampung, sebelum air tersebut dialirkan ke sungai belakang pabrik.
c) Limbah Gas
Upaya pengelolaan yang dilakukan untuk menangani limbah gas dan partikulat dari hasil pembakaran solar di boiler ialah dengan menyalurkan melalui cerobong asap sebanyak 2 buah. Gas buang dan partikel hasil pembakaran obat dilakukan upaya pengelolaan pada incenerator menggunakan satu buah burner (alat pembakar). Debu yang berasal dari β-laktam dilakukan penyaringan debu dalam ruangan tersendiri. Udara hasil penyedotan dibuang ke udara bebas melalui cerobong dengan ketinggian 2 m dari atap.
Non Direktorat
Risk Management merupakan suatu sistem pengelolaan resiko yang dihadapi oleh perusahaan secara komprehensif untuk tujuan meningkatkan nilai perusahaan disusun berdasarkan faktor-faktor, antara lain faktor eksternal (perekonomian, fluktuasi nilai tukar, persaingan usaha, harga bahan baku dan tuntutan konsumen) dan faktor internal (keuangan perusahaan, dampak lingkungan dan produk yang rusak). Good Corporate Governance (GCG) atau tata kelola perusahaan yang baik menurut Kementrian BUMN adalah suatu proses dan struktur yang digunakan oleh perusahaan BUMN untuk meningkatkan keberhasilan usaha dan akuntabilitas perusahaan.
PT. Indofarma (Persero) Tbk. berupaya meningkatkan efektifitas produksi, antara lain dengan cara dibentuknya bidang Supply Chain Management (SCM) yang menjadi jembatan antara perencanaan produksi, marketing dan distribusi. Harapan ditingkatkannya fungsi SCM ini adalah kualitas stok dapat diperbaiki, dimana yang akan diproduksi adalah yang betul-betul dibutuhkan oleh pasar, sehingga dapat dipastikan stok yang ada digudang obat jadi PT. Indofarma (Persero) Tbk. adalah stok yang sesuai kebutuhan pasar.
Bidang Pemastian Mutu terdiri dari: A. Seksi Pengendalian Sistem
B. Seksi Kalibrasi, Kualifikasi dan Validasi
C. Seksi Pengendalian Proses dan Evaluasi Pasca Produksi D. Training sistem
A.Seksi Pengendalian Sistem
manajemen mutu menurut CPOB dan ISO (International Organization for Standarization) yang digunakan PT. Indofarma (Persero) Tbk.
Tugas dari bidang ini adalah:
1. Pengembangan manajemen sistem mutu, seperti manajemen CPOB, ISO, CPOTB dan audit internal.
2. Pengelolaan inspeksi diri (CPOB dan ISO). 3. Pengelolaan dan perencanaan training mutu.
B. Seksi Kalibrasi, Kualifikasi dan Validasi
Seksi kalibrasi, kualifikasi dan validasi bertugas untuk melakukan proses validasi, kualifikasi dan validasi, baik pada peralatan maupun bangunan sehingga proses produksi dapat berjalan dengan lancar.
Tugas tersebut meliputi:
Kualifikasi: Mesin untuk produksi dan alat-alat laboratorium. Kalibrasi: Semua alat ukur yang digunakan untuk produksi dan QC.
Validasi: Proses metode analisis, pembersihan sistem (AHU, water
system)
C. Seksi Pengendalian Proses dan Evaluasi Pasca Produksi Tugas dari masing-masing bagian adalah:
Seksi pengendalian proses: mengkoordinir pengendalian perubahan, antara
lain: change control, deviasi proses dan pemeriksaan kebenaran dan kelengkapan serta mengelola CPB.
BAB IV PEMBAHASAN
PT Indofarma Tbk. sebagai salah satu industri farmasi milik pemerintah (BUMN), merupakan sarana penunjang pelayanan kesehatan yang memiliki peranan cukup besar bagi masyarakat dalam menyediakan obat yang bermutu, terdistribusi merata dan dengan harga yang terjangkau oleh masyarakat. Untuk mendapatkan mutu produk yang berkualitas secara konsisten maka pemerintah mengeluarkan SK Menkes RI No. 43/Menkes/SK/11/88 tentang Pedoman Cara Pembuatan Obat yang Baik (CPOB), yang menyangkut seluruh aspek produksi dan pengawasan mutu.
Dengan dikeluarkannya SK tersebut, maka PT Indofarma (Persero) Tbk. berkewajiban melaksanakan CPOB pada semua aspek produksi mulai dari personalia, bangunan, peralatan, sanitasi dan higiene, produksi, pengawasan mutu, inspeksi diri, penanganan keluhan terhadap produk, penarikan kembali obat, dan obat kembalian, dokumentasi, sistem pengelolaan lingkungan
4.1 Manajemen mutu
dilakukan dalam rangka validasi, penanganan sampel tertinggal, menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya.
Selama proses produksi, bidang Manajemen Mutu melakukan pengujian yang meliputi proses produksi, kondisi ruangan, peralatan, hasil produksi, dan pengawasan terhadap limbah hasil proses produksi. Setelah proses produksi, bidang Pemastian Mutu memastikan bahwa selama penyimpanan dan proses distribusi berjalan, produk tetap dalam keadaan utuh, baik secara fisik maupn aktivitasnya. Pengujian mutu dilakukan dari awal yaitu mulai barang masuk sampai menjadi produk jadi. Selama proses produksi berlangsung, bidang Pengawasan Mutu melakukan In Process Control (IPC) untuk menjamin mutu produk yang dihasilkan. Tiap proses produksi mengikuti protap yang ditentukan oleh perusahaan dan data-datanya tertuang dalam
batch record (catatan bets).
Bidang Manajemen Mutu juga menerapkan CPOB, dimana selama pengujian produk, bidang Pemastian Mutu berusaha membangun mutu ke dalam produk dengan menerapkan sistem manajemen mutu terpadu dengan keyakinan bahwa mutu adalah tanggung jawab semua pihak sesuai fungsinya masing-masing. Selain itu untuk memastikan bahwa proses produksi dan pengujian yang dilakukan akan memberikan hasil yang meyakinkan. Kalibrasi dilakukan sebelum validasi, dan keduanya dilakukan secara berkala.
4.2 Personalia
tanggung jawab karyawan, PT Indofarma (Persero) Tbk. menyelenggarakan program pendidikan dan pelatihan secara teratur bagi seluruh karyawan.
Materi pendidikan dan pelatihan yang diberikan sesuai dengan bidang pekerjaan masing-masing karyawan, disamping materi umum mengenai LK3 (Lingkungan, Keselamatan dan Kesehatan kerja) dan 5R (Ringkas, Rapi, Resik, Rawat, Rajin) serta mengenai CPOB. Hal ini dilakukan untuk menambah pengetahuan karyawan. Selain itu secara rutin dilakukan perputaran dan perpindahan posisi untuk menghindari kejenuhan bekerja disatu bidang serta memberikan kesempatan untuk menguasai bidang lain.
Salah satu faktor pendukung dalam perusahaan adalah sumber daya manusia. Untuk kesejahteraan karyawan telah disediakan sarana olah raga, kesenian, koperasi, poliklinik, apotek dan kantin. Perusahaan juga melakukan evaluasi terhadap karyawan sehingga karyawan akan selalu berusaha untuk meningkatkan kemampuannya. Dalam hal produktivitas kerja, pada setiap produksi dilakukan pengukuran man hour dengan tujuan mengetahui kapasitas kerja karyawan sehingga dapat diperkirkan kapan dan berapa lama suatu proses produksi dan diselesaikan dengan jumlah karyawan dan kapasitas mesin yang ada. Untuk mendukung hal ini suatu metode baru telah dicoba pada lini pengemasan yaitu menyesuaikan dengan tepat jumlah pekerja yang dibutuhkan disesuaikan dengan kapasitas out put mesin sehingga dapat diperoleh produktivitas optimal.
4.3 Bangunan dan Fasilitas
ruangan dalam produksi berbentuk lengkung dengan dinding dicat epoksi dan lantai dicat minyak, sehingga mempermudah dalam pembersihan, lantaipun permukaannya menjadi licin dan rata.
Produksi obat β-laktam dilaksanakan di dalam ruang/gedung produksi II yang terpisah dengan produk lain dimana produksi ini dilengkapi dengan AHU. Buffer room pada gedung β-laktam juga menerapkan Air Lock System, dimana tekanan udara ruang tersebut lebih negatif (kecil) dibandingkan udara luar. Hal ini dilakukan untuk mencegah agar kotoran atau debu yang dihasilkan dari produksi β-laktam tidak mencemari lingkungan luar ruangan yang dapat menyebabkan terjadinya kontaminasi silang ataupun reaksi hipersensitivitas bagi karyawan lain.
Bangunan dan fasilitas di ruang produksi steril telah memenuhi persyaratan CPOB dan dibuat sedemikian rupa sehingga mudah dibersihkan. Ruang produksi steril walaupun termasuk dalam produksi II, memiliki persyaratan khusus yang dibagi menjadi 4 kelas, yaitu kelas I, II, III dan IV yang masing-masing dipisahkan oleh ruang antara dan dilengkapi dengan sistem air lock, air shower dan system AHU yang berperan dalam mengatur suhu, kelembaban, tekanan, sirkulasi udara dan jumlah partikel. Ruang kelas I dilengkapi dengan LAF dan HEPA Filter.
Ruang produksi herbal belum memenuhi persyaratan Cara Pembuatan Obat Tradisional yang Baik (CPOTB). Ruang produksi herbal hanya memproduksi jamu dalam jumlah yang tidak terlalu besar, tetapi produksi herbal sekarang sedang melengkapi segala keperluan persyaratan CPOTB tersebut.
4.4 Peralatan
persyaratan CPOB yaitu diatur untuk menjamin keleluasaan kerja operator dan mencegah terjadinya kekeliruan atau kontaminasi silang antar bahan selama produksi. Alat-alat dilakukan kalibrasi secara berkala untuk menjamin keseragaman mutu produk dari waktu ke waktu, setiap alat diberi nomor identitas dan catatan waktu kapan kalibrasi dilaksanakan dan kapan harus dikalibrasi kembali sehingga fungsi alat selalu terkontrol dengan baik. Mesin produksi memiliki seorang operator untuk setiap mesin yang bertanggung jawab atas kelancaran fungsi mesin. Operator ini sebelumnya ditraining khusus mengenai CPOB dan tanggung jawabnya serta berkoordinasi dengan bagian teknik dalam perawatan mesin tersebut.
Peralatan produksi yang dimiliki oleh PT. Indofarma (Persero) Tbk. telah memiliki protap yang ditulis dengan rinci untuk pembersihan dan sanitasi peralatan dan prosedur ini diletakkan di ruangan alat itu berada, sehingga operator dapat mengerjakan prosedur ini dengan tepat dan benar. Peralatan yang digunakan setelah produksi harus segera dibersihkan baik bagian luar maupun bagian dalam sesuai dengan protap yang ada. Kebersihan alat diperiksa sebelum dipakai, untuk memastikan bahwa seluruh produk atau bahan dari bets sebelumnya telah dihilangkan. Proses pembersihan jika telah dilaksanakan, maka operator harus menulis apa yang sudah dilaksanakan dan catatan ini disimpan sebagai dokumen dan memberikan label bersih pada alat. Prosedur pembersihan ini secara rutin divalidasi pada periode-periode tertentu sehingga selalu sesuai dengan ketentuan CPOB.
4.5 Sanitasi dan Higiene
personil PT. Indofarma menjalani pemeriksaan kesehatan secara rutin untuk menjaga kesehatannya karena kesehatan sangat mempengaruhi mutu produk.
Sanitasi dan higiene pada bangunan harus memiliki toilet dengan ventilasi yang baik dan tempat cuci tangan, loker, ruang makan yang memadai, kantong sampah yang tersedia dan dapat diganti setiap hari. Setiap bagian produksi memiliki toilet, tempat cuci tangan dan ruang istirahat yang terpisah dari ruang produksi. Setiap bangunan harus dibersihkan setiap hari tiga kali untuk menjaga kebersihan. Peralatan dibersihkan sesudah produksi baik bagian dalam maupun luar sesuai dengan protab. Sebelum dipakai kebersihan diperiksa lagi untuk memastikan bahwa seluruh produk atau bahan dari bets sebelumnya telah dihilangkan dan ditandai bahwa peralatan telah bersih. Peralatan juga harus dibersihkan setiap selesai pemakaian. Pembersihan harus dilakukan sesuai dengan protab yang ditetapkan.
Dalam CPOB dikenal tiga jenis penyebab kontaminasi yaitu bahan kimia, mikroba, dan partikel asing. Untuk menghindari kontaminsi dari bahan kimia dibuat aturan-aturan agar personel tidak berinteraksi secara langsung dengan produk karena selain dapat mengkontaminasi produk, bahan kimia pun dapat mengkontaminsi karyawan. Untuk mencegah kontaminasi dari karyawan terhadap produk atau dari produk terhadap karyawan, maka setiap karyawan yang berada diruang produksi harus menggunakan pakaian kerja yang disediakan lengkap dengan penutup kepala, masker, sarung tangan dan sepatu karet. Prosedur sanitasi dan higiene dievaluasi secara berkala untuk memastikan bahwa prosedur yang bersngkutan masih cukup efektif dan selalu memenuhi persyaratan.
pelindung tersebut meliputi baju khusus ruang produksi, masker, topi, penutup rambut, sarung tangan dan sepatu khusus ruang produksi untuk menghindari terjadinya pencemaran potensial. Setiap karyawan juga dilarang bersentuhan langsung dengan produk baik produk ruahan maupun produk jadi untuk menghindari tercemarnya produk maka harus memakai sarung tangan. Setiap karyawan dilarang merokok, minum, makan atau membawa makanan dan minuman di ruang produksi, laboratorium, dan area lain untuk menghindari tercemarnya produk.
4.6 Produksi
Bagian Produksi melaksanakan proses produksi mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang senantiasa menjamin menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan ijin pembuatan dan ijin edar. Bagian produksi merupakan bagian yang utama dalam kegiatan menghasilkan dan menambah kegunaan dari barang dan jasa. Proses produksi di PT. Indofarma (Persero) Tbk. melibatkan semua bagian yang berada dibawah direktur produksi yang juga dibantu oleh Bidang Penelitian dan Pengembangan Produk. Proses produksi dilakukan berpedoman pada Perintah Pengolahan (PP) dan Catatan Produksi Batch yang dikeluarkan oleh PPPP, dimana formula dan proses telah divalidasi melalui pelaksanaan trial produksi dari Litbang. Sistem penomoran batch dan lot diterapkan untuk memudahkan pengendalian selama produksi berlangsung dan penelusuran kembali apabila ada keluhan produk dari konsumen.
a. Bidang Produksi I
menggunakan bin yang terbuat dari stainless steel 316. Penggunaan sistem ini memberikan banyak keuntungan antara lain menghemat lahan yang dibutuhkan, karena bangunan dibuat bertingkat, menghemat waktu dan penggunaan tenaga manusia, mengurangi kemungkinan terjadinya kontaminasi, serta memungkinkan untuk mengolah produk dengan ukuran batch yang besar. Proses pengemasan berada dibawah bidang ini untuk memudahkan koordinasi karena besarnya volume produksi.
b. Bidang Produksi II
Bidang produksi II dipimpin oleh seorang manager produksi. Bidang ini membawahi 3 seksi yaitu seksi salep-sirup-serbuk, seksi β-laktam, dan seksi produk steril. Pelaksanaan proses produksi di bidang produksi II menggunakan system
vertical closed system yang diterapkan untuk produksi oralit. Sedangkan untuk produksi sediaan β-laktam, sediaan steril, sediaan salep sirup menggunakan
horizontal closed system.
Seksi produk steril membawahi sub seksi produk steril I yang bertanggungjawab terhadap proses produksi sediaan steril dan sub seksi produk steril II yang bertanggung jawab dalam proses pengemasan produk termasuk pemeriksan kejernihan sediaan ampul dan pencetakan label. Lini pengemasan pada produk steril dibagi menjadi tiga yaitu pengemasan ampul, vial, dan obat tetes mata.
c. Produksi Herbal
Produksi Herbal secara keseluruhan telah mengacu pada Cara Pembuatan Obat Tradisional yang Baik (CPOTB), baik bangunan, personalia, peralatan, dan proses produksinya. PT. Indofarma (Persero) Tbk. sudah mempunyai pusat ekstraksi yang digunakan sebagai sarana pengolahan obat dari bahan alam yang modern meliputi unit ekstraksi, destilasi dan produksi yang dilengkapi fasilitas produksi dengan peralatan yang modern. Bahan baku simplisia yang digunakan untuk pembuatan obat tradisional belum sepenuhnya diproduksi sendiri oleh Indofarma, sebagian dipenuhi dengan cara membeli langsung dari supplier, melalui petani binaan, atau bekerja sama dengan institusi lain (universitas, petani, dan sebagainya). Pembentukan petani binaan dimaksudkan agar simplisia yang dihasilkan dapat terjamin mutunya dan sekaligus dimaksudkan untuk mengembangkan ekonomi kerakyatan.
d. Bidang Pengadaan (Procurement)
Jadwal Kedatangan Barang (JKB) dilakukan berdasarkan jadwal produksi dan kapasitas gudang yang tersedia.
e. Bidang Logistik Bahan Awal
Gudang penyimpanan dijaga dan dipelihara sedemikian rupa sehingga barang-barang terlindung dari pengaruh yang merugikan karena perubahan temperatur dan kelembaban, adanya debu, bau serta binatang yang masuk. Bidang LBA PT. Indofarma (Persero) Tbk. melakukan pemisahan terhadap bahan yang berbahaya dan sensitive dengan adanya gudang solvent dan gudang β-laktam yang letaknya terpisah dengan gudang utama. Kegiatan penerimaan dan pengeluaran barang sudah diatur sedemikian rupa sehingga mengikuti system FIFO (First In First Out) dan FEFO (First Expired First Out).
f. Bidang PPPP
Perencanaan produksi harus dilakukan sebaik mungkin dengan mempertimbangkan variabel-variabel yang mempengaruhi sehingga tidak terjadi penimbunan atau kekurangan stok barang. Penyusunan rencana produksi tahunan oleh PPPP dilakukan sesuai permintaan marketing yang kemudian dibuat dalam rencana produksi bulanan. PPPP harus dapat menyusun rencana dengan menyesuaikan permintaan marketing yang berdasarkan kebutuhan pasar dan bidang produksi dengan mempertimbangkan anggaran, persediaan bahan baku, jadwal, kapasitas produksi dan peralatan yang tersedia. Fungsi PPPP akan optimal jika didukung dengan sumber daya manusia yang menguasai pengetahuan dan keterampilan di bidang sistem informasi.
g. Bidang Litbang
yang luas dan fleksibel. Pada negara-negara industri, peranan Litbang sangat besar dalam pengembangan dan penemuan produk baru melalui suatu riset yang terencana. Bidang Litbang di PT. Indofarma (Persero) Tbk. dituntut untuk melakukan efisiensi formula produk baru dan yang sudah exist yang meliputi proses pembuatan, stabilitas sediaan, penampilan fisik, dan bentuk kemasan sehingga dapat bersaing dengan produk lain dan optimasi atau pengembangan metode analisis bahan awal dan produk jadi sehingga dapat bersaing dengan produk lain.
Peran bidang Litbang sangat penting dalam mendukung kegiatan operasional dan pengembangan perusahaan. Produk utama PT. Indofarma (Persero) Tbk. merupakan obat-obat generik, bidang Litbang sangat dibutuhkan untuk mampu membuat formula yang efektif dan efisien bagi produk-produk yang akan dibuat, yang biasanya berupa me too produk. Kendala utama yang dihadapi yaitu pasokan bahan baku yang terbatas sehingga tidak mencukupi skala produksi PT. Indofarma (Persero) Tbk. yang sangat besar. Dalam keadaan seperti itu, dibutuhkan adanya alternatif produsen bahan baku agar produk yang dibutuhkan tetap dapat dibuat dan tetap memenuhi persyaratan.
Disini peran bidang Litbang dibutuhkan untuk melakukan substitusi bahan agar produk yang dihasilkan tetap memenuhi persyaratan. Selain menghasilkan obat generik, saat ini PT. Indofarma (Persero) Tbk. telah melakukan pengembangan ke arah produk fitofarmaka sehingga bagi bidang Litbang merupakan suatu tantangan untuk dapat terus melakukan inovasi dan pengembangan produk-produk baru.
4.7 Pengawasan Mutu
dengan tugas utamanya berkaitan dengan pemeriksaan bahan awal, pengujian mikrobiologi, IPC, dan pengujian produk jadi.
a. Seksi Pengujian Bahan Awal
Seksi pengujian Bahan Awal melakukan pengujian bahan baku, air dan bahan pengemas.
b. Seksi Pengujian Mikrobiologi
Uji mikrobiologi bertujuan mengetahui sejauh mana suatu produk atau penunjang produksi (bahan awal, peralatan, operator, ruangan) telah memenuhi syarat mikrobiologi.
c. Seksi IPC dan Pengujian Produk
Tugas seksi IPC dan Pengujian Produk yaitu melakukan pengujian terhadap produk antara dan produk ruahan.
4.8 Inspeksi Diri dan Audit Mutu
4.8.1 Inspeksi Diri
Inspeksi meliputi personil, bangunan, penyimpanan, bahan awal, obat jadi, produksi, pengawasan mutu, dokumentasi dan pemeliharaan gedung serta peralatan.
4.8.2 Audit Mutu
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu.
Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
4.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
4.10 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi manajemen yang meliputi spesifikasi, prosedur, metode dan instruksi, perencanaan, pelaksanaan, pengendalian serta evaluasi seluruh rangkaian pembuatan obat. Dokumentasi sangat penting untuk memastikan setiap operator mendapatkan instruksi secara rinci dan jelas mengenai bidang tugas yang dilaksanakan, sehingga memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Sistem dokumentasi hendaklah menggambarkan riwayat lengkap dari setiap bets atau lots yang bersangkutan. Sistem dokumentasi juga digunakan dalam pemantauan dan pengendalian contohnya pada kondisi lingkungan, perlengkapan dan personalia.
CPOB mensyaratkan dokumen-dokumen sebagai berikut: spesifikasi bahan baku, bahan pengemas, produk antara dan obat jadi, dokumen produksi, dokumen pengawasan mutu, dokumen penyimpanan dan distribusi, dokumen pemeliharaan, pembersihan dan pemantauan kondisi ruangan dan peralatan, dokumen keluhan terhadap obat, penarikan kembali obat, obat kembalian dan pemusnahan obat. Peralatan khusus, prosedur dan catatan inspeksi diri dan pedoman catatan pelatihan CPOB bagi karyawan PT. Indofarma (Persero) Tbk. telah melengkapi semua dokumen yang disyaratkan CPOB.
4.11 Pembuatan dan Analisa Secara Kontrak
lain dalam pengadaan bahan untuk produksi, selalu diawasi oleh bagian QA. Tiap bahan yang diterima disertai sertifikat analisis dan tiap wadah yang telah diperiksa diberi tanda pelulusan.
4.12 Kualifikasi dan Validasi
Semua perangkat keras dan lunak yang digunakan dalam proses pembuatan obat hendaknya divalidasi. Kegiatan validasi meliputi kualifikasi (personil, peralatan dan sistem), kalibrasi (instrumen dan alat ukur) dan validasi (prosedur dan proses). Perlunya dilakukan kualifikasi dan validasi untuk menjaga konsistensi produk, prosedur dan sistem bisa terhadap fasilitas, peralatan dan proses yang akan mempengaruhi mutu produk.
Komponen/proses yang dikualifikasi dan divalidasi di PT. Indofarma (Persero) Tbk, antara lain konstruksi dan desain bangunan dan fasilitas, peralatan dan sarana penunjang, metode analisis, kalibrasi instrumen, bahan awal dan bahan pengemas, proses produksi, prosedur pengolahan induk dan prosedur pengemasan induk, prosedur pembersihan, sistem komputerisasi dan personil.
4.13 Sistem Pengelolaan Limbah
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Setelah mengikuti Pelatihan Praktek Kerja Profesi Apoteker (PPKPA) selama satu bulan di PT. Indofarma (Persero) Tbk. dapat disimpulkan bahwa:
a. Apoteker yang ada di PT. Indofarma (Persero) Tbk. memiliki peranan yang besar dalam proses kegiatannya, terlihat dari struktur perusahaan yang menggambarkan sebagian besar posisi berbagai bidang dijabat oleh apoteker. Secara umum PT Indofarma (Persero) Tbk. telah menerapkan prinsip-prinsip CPOB dalam aspek kegiatan produksinya dengan baik untuk menjamin mutu obat yang dihasilkan senantiasa memenuhi kepastian mutu dan kepuasan konsumen, memperkecil resiko kesalahan dalam memproduksi obat serta mempermudah pengawasan proses produksi.
b. Pengelolaan PT. Indofarma (Persero) Tbk. tidak hanya melibatkan profesi farmasi saja, melainkan bekerja sama dengan profesi lain seperti teknik, marketing, akuntansi, dan bidang lain selain farmasi.
5.2 Saran
Adapun saran untuk PT Indofarma (Persero) Tbk. :
a. PT Indofarma (Persero) Tbk. diharapkan agar kedepan terus meningkatkan mutu produk baik generik, branded dan herbal dengan terus menerapkan pedoman CPOB dan CPOTB.
BAB II
TINJAUAN UMUM DI PT. INDOFARMA (Persero) Tbk.
2.1 Sejarah dan Perkembangan PT. Indofarma (Persero) Tbk.
PT. Indofarma (Persero) Tbk. merupakan Badan Usaha Milik Negara (BUMN) yang berada di bawah Departemen Kesehatan, berdiri pada tahun 1918 berupa unit produksi kecil dari Rumah Sakit Pusat Pemerintah Belanda dengan kegiatan pembuatan salep dan pemotongan kain kasa pembalut yang dilakukan di Centrale Burgelijke Zienkeninrichring (CBZ), yang sekarang dikenal dengan Rumah Sakit Dr. Cipto Mangunkusumo di Jakarta. Tahun 1931, pabrik berkembang dengan bertambahnya jenis produksi, yaitu tablet dan injeksi. Tahun 1935, lokasi pabrik dipindahkan ke Jalan Tambak No. 2 Manggarai, Jakarta sehingga dikenal dengan sebutan ”Pabrik Obat Manggarai”.
Perusahaan diambil alih oleh Jepang dan dikelola di bawah Manajemen Takeda setelah terjadi pergantian penjajah sekitar tahun 1942. Perusahaan ini diambil alih oleh Indonesia setelah merdeka dan dinasionalisasi pada tahun 1950. Pengelolaan diserahkan kepada Departemen Kesehatan Indonesia.
lebih lanjut dari Keputusan Presiden Republik Indonesia No. 44 dan 45 tahun 1974, namun pabrik farmasi Departemen Kesehatan ini tidak tercakup dalam keputusan tersebut sehingga statusnya tidak jelas. Hal ini berlangsung hingga tahun 1978.
Tahap selanjutnya, pada tahun 1979 pabrik ini mulai memproduksi obat-obat esensial untuk pelayanan masyarakat, status Pabrik Obat Manggarai diubah menjadi Pusat Produksi Farmasi yang bersifat Nirlaba dan masih di bawah Departemen Kesehatan. Tahun 1981 pemerintah meningkatkan status perusahaan menjadi Perusahaan Umum Indonesia Farma disingkat Perum Indofarma.
Tonggak penting lain perjalanan bisnis Indofarma terjadi pada tahun 1988 dengan membangun pabrik modern berkapasitas besar dilahan seluas 20 Hektar dikawasan Cibitung, Bekasi dengan bantuan alat dan teknologi dari Italia. Tahun 1991, seluruh proses produksi di Manggarai, Jakarta, dipindahkan ke Cibitung kecuali sediaan steril. Tanggal 31 Januari 1995 fasilitas produksi steril diresmikan oleh Menteri Kesehatan Republik Indonesia dengan dana pembangunan seluruhnya ditanggung oleh Perum Indofarma.
Tahun 2001 Indofarma melakukan penawaran saham perdana kepada masyarakat dan mendaftarkan seluruh saham perusahaan di bursa efek Jakarta dan bursa efek Surabaya, serta resmi menjadi sebuah perusahaan terbuka dengan nama PT. Indofarma (Persero) Tbk. Produksi Indofarma terus berkembang dengan struktur permodalan yang lebih kuat, sehingga bukan hanya membuat obat-obat esensial dan generik, melainkan juga obat dengan nama dagang baik etikal maupun OTC, obat tradisional (herbal) dan makanan kesehatan.
Manajemen Indofarma yakin bahwa kunci keberhasilan untuk memenangkan persaingan diera globalisasi adalah operational execellence. Tahun 2007 perusahaan mengoptimalkan fungsi bisnis yang ada melalui restrukturisasi lanjutan yang memberikan otonomi luas kepada IGM guna memperkuat struktur bisnis terutama dalam hal penggarapan penjualan institusi. Indofarma dapat lebih memfokuskan pada kegiatan produksi sedangkan IGM pada kegiatan distribusi dan trading produk farmasi dan alat kesehatan.
Perseroan senantiasa berupaya menetapkan tata kelola perusahaan yang baik (Good Corporate Governance / GCG) guna meletakkan fondasi bisnis yang kuat. Tanggal 22 Februari 2007 organ utama perseroan telah bersama-sama menandatangani pernyataan komitmen implementasi GCG. Perseroan juga berupaya membangun kompetensi personal yang profesional melalui program pengembangan sumber daya manusia yang terarah, agar mampu membawa perseroan memasuki era perdagangan bebas sebagai perusahaan farmasi terkemuka dikawasan ASEAN.
2.2 Visi, Misi, Motto dan Logo PT. Indofarma (Persero) Tbk.
Visi
Menjadi perusahaan yang berperan secara signifikan pada perbaikan kualitas hidup manusia dengan memberi solusi terhadap masalah kesehatan dan kesejahteraan masyarakat.
Misi
Menyediakan produk dan layanan berkualitas dengan harga terjangkau untuk
masyarakat.
Melakukan penelitian dan pengembangan produk yang inovatif dengan
prioritas untuk mengobati penderita penyakit dengan tingkat prevalensi tinggi.
Mengembangkan kompetensi sumber daya manusia sehingga memiliki
kepedulian, profesionalisme dan kewirausahaan yang tinggi. Motto
Motto PT. Indofarma (Persero) Tbk. adalah insan Indofarma dalam menjalankan visi dan misi tersebut yaitu “dilandasi ketakwaan kepada Tuhan Yang Maha Esa, kita tingkatkan kualitas kesehatan bangsa”.
Logo
Gambar 2.1 Logo PT. Indofarma (Persero) Tbk.
Logo tanpa bingkai warna biru: Pengabdian INF yang tidak terbatas untuk
Warna biru melambangkan sifat pengabdian perseroan yang tidak terbatas
untuk kesehatan masyarakat. Keluasan pengabdian diperluas dengan gradasi warna yang mewakili dimensi yang luas.
Ritme garis lurus dan lengkung: Upaya-upaya pelayanan perseroan pada
masyarakat. Kesatuan garisnya memberikan kesan melindungi dan saling mendukung, artinya perseroan siap melindungi masyarakat dari penyakit dan mendukung masyarakat untuk mewujudkan kesehatan.
Posisi miring: Dinamika INF, tidak terpaku konvensi lama, mengikuti
perkembangan zaman dan inovatif tetapi mengikuti gerak laju teknologi.
2.3 Lokasi dan Fasilitas Produksi PT. Indofarma (Persero) Tbk.
Seluruh fasilitas produksi farmasi dan obat herbal dirancang sesuai konsep CPOB dan dibangun diatas tanah seluas ± 20 hektar di Cibitung, Bekasi, Jawa Barat. Pabrik lainnya yaitu pabrik makanan bayi seluas ± 0,25 hektar di Cikarang.
Pabrik dan kantor pusat PT. Indofarma (Persero) Tbk terletak di Jalan Indofarma No. 1, Desa Gandasari, Kecamatan Cikarang Barat-Bekasi, dengan luas tanah 2.000.000 m2 dan luas bangunan 28.035 m2 yang terdiri dari: kantor pusat 20 m2, pusat pelatihan 750 m2, kantin 300 m2, koperasi 60 m2, poliklinik dan apotek 196 m2, masjid 441 m2, laboratorium 1.440 m2, unit produksi utama 9.921 m2, unit produksi β laktam 1.440 m2, unit produksi parenteral 2.330 m2, unit produsi obat tradisional
Sistem tata ruang produksi non steril dibagi dua, yaitu kelas empat dan kelas tiga. Kelas empat meliputi gudang, koridor yang menghubungkan gudang produk jadi dan daerah pengemasan sekunder. Daerah ini ditandai dengan lantai yang dicat epoksi agar kotoran tidak mudah melekat dan dinding mudah dibersihkan. Kelas tiga merupakan daerah yang terkait langsung dengan proses produksi, misalnya daerah proses pengolahan, pengemasan primer, hingga koridor yang berhubungan.
2.3.1 Produk PT. Indofarma (Persero) Tbk.
Produk yang dihasilkan oleh PT. Indofarma (Persero) Tbk antara lain sebagai berikut:
A. Produk Etikal (OGB, Lisensi, Generik dengan Nama Dagang)
PT. Indofarma (Persero) Tbk memproduksi obat generic ethical sebagai produk utama di samping memproduksi obat dengan nama dagang dan lisensi. Saat ini PT. Indofarma (Persero) Tbk mulai memperluas target pasar dengan memproduksi obat branded generic atau obat generik dengan nama dagang namun harganya terjangkau, yang merupakan program pemerintah untuk penyediaan obat bagi masyarakat.
B. OTC dan Herbal Medicines
C. Alat Kesehatan
Selain memproduksi obat, anak perusahaan PT. Indofarma (Persero) Tbk juga bekerjasama dengan SD (Standart Diagnostic) untuk memasarkan diagnostic kit. Alat kesehatan tersebut disalurkan dari Standart Diagnostic Inc.
2.4 Cara Pembuatan Obat yang Baik (CPOB)
Cara Pembuatan Obat yang Baik (CPOB) merupakan suatu konsep dalam industri farmasi mengenai prosedur atau langkah-langkah yang dilakukan dalam suatu industri farmasi untuk menjamin mutu obat jadi, yang diproduksi dengan menerapkan “GMP” dalam seluruh aspek dan rangkaian kegiatan produksi sehingga obat yang dihasilkan senantiasa memenuhi persyaratan mutu yang ditentukan sesuai dengan tujuan penggunaannya.
Perkembangan yang sangat pesat dalam teknologi farmasi menyebabkan perubahan-perubahan yang sangat cepat pula dalam konsep serta persyaratan CPOB. Konsep CPOB yang bersifat dinamis yang memerlukan penyesuaian dari waktu ke waktu mengikuti perkembangan teknologi dibidang farmasi. Aspek-aspek yang merupakan cakupan CPOB tahun 2006 meliputi 12 aspek yang dibicarakan.
2.4.1 Manajemen Mutu
diterapkan secara benar diperlukan untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan.
Sistem pemastian mutu hendaklah didukung dengan tersedianya personil yang kompeten, bangunan dan sarana serta peralatan yang cukup dan memadai. Tambahan tanggung jawab hukum hendaklah diberikan kepada kepala bagian manajemen mutu (Pemastian Mutu).
Pemastian Mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan
tujuan pemakaiannya.
2.4.2 Personalia
Jumlah personil di semua tingkat harus memadai serta memiliki pengetahuan, keterampilan dan kemampuan yang sesuai dengan tanggung jawabnya. Kesehatan mental dan fisik yang baik harus dimiliki personil agar mampu melaksanakan tugas secara profesional dan hendaklah memiliki sikap dan kesadaran tinggi untuk mewujudkan CPOB.
2.4.3 Bangunan dan Fasilitas
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan, konstruksi serta letak yang memadai agar memudahkan pelaksanaan kerja, pembersihan dan pemeliharaan, tiap sarana kerja hendaklah memadai sehingga setiap resiko terjadi kekeliruan, pencemaran silang dan berbagai kesalahan lain yang dapat menurunkan mutu obat dapat dihindarkan.
rata dan memungkinkan pembersihan secara cepat dan efisien. Dinding juga hendaklah kedap air dan memiliki permukaan yang mudah dicuci. Sudut-sudut antara dinding, lantai dan langit-langit dalam daerah-daerah kritis hendaklah berbentuk lengkungan.
Untuk mencegah terjadinya pencemaran yang berasal dari lingkungan dan sarana, maka perlu:
1. Ruang terpisah yang dirancang khusus disiapkan untuk menghindari kontaminasi.
2. Kelas A atau kelas 100, berada di bawah aliran udara laminer dan memiliki efisiensi saringan udara akhir sebesar 99.995%.
3. Kelas B atau kelas 100, merupakan ruangan steril, kelas ini adalah lingkungan latar belakang untuk zona kelas A dan memiliki efisiensi saringan udara akhir sebesar 99.995%.
4. Kelas C atau kelas 10.000, merupakan ruangan steril dan memiliki efisiensi saringan udara sebesar 99.95%.
5. Kelas D atau kelas 100.000, adalah ruangan bersih dan memiliki efisiensi saringan udara sebesar 99.95% bila menggunakan sistem resirkulasi ditambah make-up air (10-20% fresh air) atau efisiensi saringan udara 90% bila menggunakan sistem single pass (100% fresh air).
6. Kelas E adalah ruangan umum dan memiliki efisiensi saringan udara sebesar 99.95% bila menggunakan sistem resirkulasi ditambah make-up air (10-20% fresh air) atau 90% bila menggunakan sistem single pass (100% fresh air). 2.4.4 Peralatan
ditempatkan dengan tepat sehingga mutu setiap produk obat terjamin secara seragam dari bets ke bets serta untuk memudahkan pembersihan dan perawatannya. Persyaratan peralatan menurut CPOB sebaiknya dirawat secara teratur melalui program perawatan untuk mencegah cacat fungsi atau kontaminasi yang dapat mengubah identitas, kualitas atau kemurnian suatu produk.
2.4.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan setiap hal yang merupakan sumber pencemaran produk. Sumber pencemaran hendaknya dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu.
2.4.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi).
Prinsip utama produksi adalah:
- Adanya keseragaman atau homogenitas dari bets ke bets.
- Proses produksi dan pengemasan senantiasa menghasilkan produk yang seidentik mungkin (dalam batas syarat mutu) baik bagi bets yang sudah diproduksi maupun yang akan diproduksi.
ditentukan oleh bahan awal, proses produksi, personil dan sistem tervalidasi.
Penyimpanan tergantung dari kestabilan bahan awal. Ruangan penyimpanan hendaklah tersedia dengan suhu yang berbeda-beda. Tekanan udara dalam ruangan yang memiliki resiko lebih tinggi terhadap suatu produk hendaklah selalu lebih tinggi dari pada ruangan lain. Bila suatu pintu dibuka, tekanan atau hembusan udara dari arah ruangan yang beresiko tinggi hendaklah cukup mampu untuk menciptakan arus udara kearah ruang yang beresiko lebih rendah untuk menghindarkan pencemaran balik.
2.4.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari cara pembuatan obat yang baik untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Pengawasan mutu hendaklah mencakup semua kegiatan analitis yang dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini juga mencakup uji stabilitas, program pemantauan lingkungan, pengujian yang dilakukan dalam rangka validasi, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan, produk serta metode pengujiaannya.
Laboratorium pengawasan mutu hendaklah terpisah secara fisik dari ruang produksi. Laboratorium untuk pengawasan selama proses mungkin lebih memudahkan apabila letaknya didaerah tempat pemprosesan atau pengemasan dimana dilakukan pengujian fisik seperti penimbangan dan uji monitoring lainnya secara periodik.