LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI
DI
PT. KIMIA FARMA (PERSERO) Tbk PLANT MEDAN
DISUSUN OLEH :
FAIZAL AMRI HARAHAP, S.Farm 093202021
PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Lembar Pengesahan
LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT.KIMIA FARMA (PERSERO) Tbk
PLANTMEDAN
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Apoteker
pada Fakultas Farmasi Universitas Sumatera Utara Medan
Disusun oleh:
Faizal Amri Harahap, S. Farm. 093202021
PT.KIMIA FARMA (PERSERO) Tbk
PLANTMEDAN
Pembimbing,
Drs. Zulfadli, Apt.
Asisten Manager
Fakultas Farmasi
Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kepada Allah SWT yang telah melimpahkan rahmat dan karunia-Nya,
sehingga penulis dapat menyelesaikan Praktek Kerja Profesi (PKP) di Industri Farmasi PT.
Kimia Farma (Persero) Tbk. Plant Medan.
Praktek Kerja Profesi ini merupakan salah satu syarat yang diwajibkan bagi mahasiswa
tingkat Apoteker di Fakultas Farmasi Universitas Sumatera Utara dalam menyelesaikan studinya.
Laporan Praktek Kerja Profesi ini disusun berdasarkan materi yang disampaikan oleh pihak
Industri PT. Kimia Farma (Persero) Tbk. Plant Medan dan tinjauan langsung ke lapangan.
Dalam pelaksanaan dan penyusunan Laporan Praktek Kerja Profesi (PKP) ini penulis
banyak menerima bimbingan, dukungan, dan bantuan dari berbagai pihak. Pada kesempatan ini,
penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Hendra Farma Johar, M.Si, Apt. selaku Manager PT. Kimia Farma (Persero) Tbk.
Plant Medan, yang telah berkenan memberikan fasilitas kepada Kami untuk
melaksanakan Praktek Kerja Profesi.
2. Bapak Drs. Zulfadli, Apt. selaku asisten Manager PT. Kimia Farma (Persero) Tbk. Plant
Medan yang telah memberikan bimbingan dan pengarahan kepada Kami selama
melaksanakan Praktek Kerja Profesi.
3. Bapak Heru Khoerudin, S.Si., Apt. selaku asisten Manager PT. Kimia Farma (Persero)
Tbk. Plant Medan yang telah memberikan bimbingan dan pengarahan kepada Kami
selama melaksanakan Praktek Kerja Profesi.
5. Bapak, Drs. Wiryanto, M.Si, Apt. selaku Koordinator Program Pendidikan Profesi
Apoteker Fakultas farmasi USU Medan.
6. Seluruh staf dan karyawan PT. Kimia Farma (Persero) Tbk. Plant Medan atas bantuan
dan kerjasama yang diberikan selama Latihan Kerja Profesi di PT.Kimia Farma (Persero)
Tbk. Plant Medan.
7. Kedua Orang Tua yang telah memberikan cinta dan kasih sayang, motivasi baik moril
maupun materi kepada penulis dalam penyelesaian laporan ini.
Penulis menyadari sepenuhnya bahwa laporan masih jauh dari sempurna dan terdapat
kekurangan baik dalam penyampaian, bahasa dan kata maupun dalam hal penyajian. Untuk itu
diharapkan saran dan kritik yang membangun demi kesempurnaan laporan ini.
Akhirnya Penulis berharap semoga tulisan ini dapat memberikan manfaat bagi kita
semua.
Medan, 31 Mei 2010
DAFTAR ISI
LEMBAR JUDUL……… i
LEMBAR PENGESAHAN………. ii
KATA PENGANTAR………. iii
DAFTAR ISI……… v
DAFTAR GAMBAR………... ix
DAFTAR LAMPIRAN……… x
DAFTAR TABEL ………... xi
RINGKASAN………... xii
BAB I PENDAHULUAN ……….. 1
1.1 Latar Belakang ……….. 1
1.2 Tujuan ………... 2
1.3 Manfaat ... 2
BAB II TINJAUAN UMUM ………...…………. 3
2.1 Tinjauan PT. Kimia Farma (Persero) Tbk …….……... 3
2.1.2 Visi dan Misi Perusahaan ………. 5
2.1.2.1 Visi Perusahaan ………. 5
2.1.2.2 Misi Perusahaan ……… 5
2.1.3 Lokasi dan Sarana Produksi Plant Medan ...………... 6
2.1.4 Cara Pembuatan obat yang baik (CPOB) ...… 7
2.1.4.1 Manajemen Mutu (Pemastian Mutu) .... 7
2.1.4.2 Personalia …...………. 9
2.1.4.3 Bangunan ……….….. 10
2.1.4.4 Peralatan ………..….. 12
2.1.4.5 Sanitasi dan Higiene ………...….. 13
2.1.4.5.1 Personalia ………... ... 13
2.1.4.5.2 Bangunan ……… 14
2.1.4.5.3 Peralatan ………...…. 14
2.1.4.6 Produksi ……… 15
2.1.4.6.1 Bahan Awal ……… 15
2.1.4.6.3 Pencemaran ……….... 16
2.1.4.6.4 Sistem Penomoran Bets & Lot. 17
2.1.4.6.5 Penimbangan & Penyerahan …. 17
2.1.4.6.6 Pengembalian ... 17
2.1.4.6.7 Pengolahan ……….. 17
2.1.4.6.8 Pengawasan Selama Proses … 18
2.1.4.6.9 Pengemasan ………. 18
2.1.4.6.10 Penyimpanan Bahan Awal,
Produk Antara, Produk Ruahan
dan Obat Jadi ……… 19
2.1.4.7 Pengawasan Mutu ……….. 19
2.1.4.8 Inspeksi Diri ……….... 21
2.1.4.9 Penanganan Keluhan & Penarikan
Kembali Produk Yang Beredar ………… 23
2.1.4.10 Dokumentasi ……… 24
2.1.4.11 Pembuatan dan Analisis Berdasarkan
Kontrak ……….... 24
BAB III KEGIATAN DI INDUSTRI FARMASI ………. 26
3.1 Aspek Personalia ……… 26
3.2 Struktur Organisasi ……….. 26
3.3 Sediaan-sediaan obat yang diproduksi PT. Kimia Farma
(Persero) Tbk. Plant Medan ……….. 26
3.4 Kegiatan Industri PT. Kimia Farma (Persero)
Tbk. PlantMedan ……….. 27
3.4.1 Perencanaan Produksi Dan Pengendalian
Inventori (PPPI) ………. 27
3.4.2 Produksi ………. 29
3.4.3 Pengawasan Mutu ………. 36
3.4.3.1 Pemeriksaan Mutu Bahan Baku dan
Bahan Pengemas ……….. 37
3.4.3.2 Pengawasan Selama Proses
(In Process Control/IPC) ………. 38
3.4.3.3 Pengawasan dalam Proses Pengemasan .. 39
3.4.5 Penerimaan Barang ……… 40
3.4.6 Pengeluaran Barang ……… 40
3.4.7 Pengolahan Limbah ……… 41
3.4.7.1 Pengolahan Limbah Cair ……… 41
3.4.7.2 Pengolahan Limbah Padat ……….. 42
3.4.8 Administrasi dan Keuangan ……….. 43
BAB IV PEMBAHASAN……… 45
4.1 Aspek Personalia ………. 45
4.2 Aspek Bangunan ………. 45
4.3 Aspek Produksi ………. 46
4.4 Aspek Pengawasan Mutu ………. 47
4.5 Aspek Pengolahan Limbah ……….. 48
BAB V KESIMPULAN DAN SARAN ……….. 49
5.1 Kesimpulan ……… 49
5.2 Saran ……….. 49
DAFTAR GAMBAR
Gambar 1. Pengolahan Limbah Cair PT.Kimia Farma (Persero) Tbk. Plant
DAFTAR LAMPIRAN
Lampiran 1. Bagan Proses Pembuatan Krim………... 51
Lampiran 2. Bagan Proses Pembuatan Tablet………...….. 52
Lampiran 3. Bagan Proses Pembuatan Kapsul………...……. 53
DAFTAR TABEL
Tabel 1. Tabel Hasil Analisis Limbah Cair PT.Kimia Farma (Persero) Tbk.Plant
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di industri farmasi PT. Kimia Farma
(Persero) Tbk. Plant Medan yang merupakan salah satu program dalam pendidikan profesi
apoteker, yang bertujuan agar mahasiswa/mahasiswi mengetahui dan memahami tugas dan
fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi
dunia kerja yang sesungguhnya. Mahasiswa juga diharuskan dapat memperoleh wawasan dan
pengetahuan yang lebih luas, memahami penerapan CPOB di PT. Kimia Farma (Persero) Tbk.
Plant Medan, serta mengetahui gambaran tentang situasi dan kondisi kerja di PT. Kimia Farma
(Persero) Tbk. Plant Medan.
PKP di industri farmasi PT. Kimia Farma (Persero) Tbk. Plant Medan dilaksanakan pada
tanggal 03 Mei 2010 hingga 31 Mei 2010. Kegiatan yang dilakukan selama PKP di industri
antara lain membuat catatan kegiatan harian yang berisi absensi, pengamatan kegiatan produksi,
laboratorium Quality Control (QC), gudang bahan baku, gudang bahan kemasan, dan gudang
obat jadi, sistem pengolahan air untuk produksi, sistem pengaturan udara, dan sistem
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di industri farmasi PT. Kimia Farma
(Persero) Tbk. Plant Medan yang merupakan salah satu program dalam pendidikan profesi
apoteker, yang bertujuan agar mahasiswa/mahasiswi mengetahui dan memahami tugas dan
fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi
dunia kerja yang sesungguhnya. Mahasiswa juga diharuskan dapat memperoleh wawasan dan
pengetahuan yang lebih luas, memahami penerapan CPOB di PT. Kimia Farma (Persero) Tbk.
Plant Medan, serta mengetahui gambaran tentang situasi dan kondisi kerja di PT. Kimia Farma
(Persero) Tbk. Plant Medan.
PKP di industri farmasi PT. Kimia Farma (Persero) Tbk. Plant Medan dilaksanakan pada
tanggal 03 Mei 2010 hingga 31 Mei 2010. Kegiatan yang dilakukan selama PKP di industri
antara lain membuat catatan kegiatan harian yang berisi absensi, pengamatan kegiatan produksi,
laboratorium Quality Control (QC), gudang bahan baku, gudang bahan kemasan, dan gudang
obat jadi, sistem pengolahan air untuk produksi, sistem pengaturan udara, dan sistem
BAB I
PENDAHULUAN
1.1 Latar Belakang
Obat adalah suatu zat yang dimaksudkan untuk dipakai dalam diagnosis, mengurangi rasa
sakit, serta mengobati atau mencegah penyakit. Salah satu upaya yang dilakukan pemerintah
untuk menjamin tersedianya obat yang bermutu, aman dan berkhasiat yaitu dengan
mengharuskan setiap industri farmasi untuk menerapkan Cara Pembuatan Obat yang Baik
(CPOB).
Cara Pembuatan Obat yang baik (CPOB) adalah pedoman pembuatan obat bagi industri
farmasi di Indonesia yang bertujuan untuk menjamin mutu obat yang dihasilkan senantiasa
memenuhi persyaratan mutu yang telah ditentukan dan sesuai dengan tujuan penggunaannya.
Mutu suatu obat tidak dapat ditentukan berdasarkan pemeriksaan produk akhir saja, melainkan
harus dibentuk ke dalam produk selama keseluruhan proses pembuatan. CPOB mencakup
seluruh aspek produksi mulai dari personalia, dokumentasi, bangunan, peralatan, manajemen
mutu, produksi, sanitasi dan higiene, pengawasan mutu, penanganan keluhan, penarikan obat dan
obat kembalian, validasi dan kualifikasi serta analisis kontrak.
Personalia, yang salah satunya adalah apoteker dalam industri farmasi memegang
peranan penting untuk menjamin mutu obat yang dihasilkan. Kedudukan apoteker juga diatur
dalam CPOB, yaitu sebagai penanggung jawab produksi, pengawasan mutu dan pemastian mutu.
Sehingga, dibutuhkan apoteker yang memiliki wawasan, pengetahuan, keterampilan, dan
pengetahuan dan pengalaman praktis yang cukup, yang salah satunya dapat diperoleh melalui
kegiatan Praktek Kerja Profesi di industri farmasi. Dalam pelaksanaan Praktek Kerja Profesi di
industri, Fakultas Farmasi bekerja sama dengan PT. Kimia Farma (Pesero) Tbk. Plant Medan
yang berlokasi di Jalan Tanjung Morawa Km 9 Medan sebagai salah satu industri farmasi di
Indonesia.
1.2 Tujuan
Melalui Latihan Kerja Profesi di industri farmasi ini diharapkan calon apoteker
mengetahui tugas dan fungsi apoteker di industri farmasi, yakni bidang penelitian dan
pengembangan, pengawasan mutu dan bagian produksi serta penerapan CPOB sehingga setelah
Latihan Kerja Profesi ini para calon apoteker mampu mengelola industri farmasi sesuai CPOB.
1.3 Manfaat
Adapun manfaat Praktek Kerja Profesi Apoteker di industri farmasi Medan adalah:
1. Mengetahui, memahami tugas dan tanggung jawab apoteker dalam menjalankan
pekerjaan kefarmasian di industri farmasi.
2. Mendapatkan pengalaman praktis mengenai pekerjaan kefarmasian di industri
farmasi.
BAB II
TINJAUAN UMUM INDUSTRI FARMASI
2.1 Tinjauan PT. Kimia Farma (Persero) Tbk.
2.1.1 Sejarah Perusahaan.
PT. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk
sebagai Perusahaan Perseroan pada tanggal 16 Agustus 1971. Sejak berdirinya hingga sekarang
ini PT. Kimia Farma (Persero) Tbk. telah mengalami beberapa perubahan, yaitu:
Periode I (1957-1959)
Periode ini adalah periode dimana pemerintah melaksanakan nasionalisasi perusahaan
farmasi milik bangsa Belanda yang ada di Indonesia. Program nasionalisasi ini dikoordinasi oleh
Badan Pengambil Alihan Perusahaan Farmasi (BAPPHAR). Adapun perusahaan farmasi milik
Belanda tersebut yaitu:
1. NV. Rathkamp dan NV Bavosta di Jakarta
2. NV. Bandoengsche Kinine Febriek di Bandung
3. NV. Ordeneming Iodium Watadakon di Mojokerto
4. NV. Industri Tella di Surabaya
5. CV. Apotek Malang di Malang
Periode II (1960-1968)
Periode ini adalah periode pembentukan Perusahaan Negara Farmasi (PNF) dan
perusahaan-perusahaan farmasi milik Belanda yang telah dinasionalisasikan sebelumnya. PNF
ini berdasarkan PP.No.60/1961 dibawah koordinasi Badan Pimpinan Umum Farmasi Negara
sebagai peleburan BAPPHAR yang bernaung dibawah Departemen Kesehatan.
Perusahaan-perusahaan yang didirikan adalah:
1. PNF. Radja Farma (ex. Rathkamp) di Jakarta
2. PNF. Nurani Farma (ex. Van Gorkom) di Jakarta
3. PNF. Nakula Farma (ex. Bavosta) di Jakarta
4. PNF. Bhinneka Kina Farma di Bandung
5. PNF. Sari Husada (ex. Sari Delle) di Yogyakarta
6. PNF. Kasa Husada (ex. Varbanstaffen)
7. PNF. Biofarma (ex. Pasteur Institute) di Bandung
Periode III (1969-1970)
Untuk meningkatkan efisiensi setiap BUMN, dikeluarkan Intruksi Presiden No. 17/1967
sehingga Departemen Kesehatan melebur perusahaan-perusahaan milik negara tersebut kedalam
perusahaan negara farmasi dan alat-alat Kesehatan Bhinneka Kimia Farma dan PNF Kasa
Husada di Surabaya dirubah menjadi Perusahaan Umum dan Perusahaan Daerah, kemudian PN
Periode IV (1971-2001)
Periode IV dimulai tahun 1971 ditandai dengan dikeluarkannya PP No.116 tahun 1971
yang berlaku sejak tanggal 19 maret 1971. Perusahaan Negara Farmasi dan alat-alat kesehatan
Bhinneka Kimia Farma setelah melalui proses audit dinyatakan lulus untuk menjadi Perseroan
Terbatas (PT) yang selanjutnya disahkan pada tanggal 16 Agustus 1971 sebagai PT. Kimia
Farma (Persero) dengan akta notaris dan diumumkan dalam berita negara.
Periode V (2001-sekarang)
Pada periode ini tepatnya tanggal 28 juni 2001 PT. Kimia Farma (Persero) menjadi
Perusahaan Terbuka (Tbk) dengan nama PT. Kimia Farma (Persero) Tbk dimana untuk
privatisasi tahap I saham yang lepas adalah sebanyak 9% dengan rincian 3% untuk program
Kepemilikan Saham Karyawan dan Manajemen (KSKM) PT. Kimia Farma, dan sebanyak 6%
untuk masyarakat umum.
Pada tanggal 4 januari 2003 PT. Kimia Farma membentuk 2 anak perusahaan yaitu:
1. PT. Kimia Farma Health & Care
2. PT. Kimia Farma Trading & Distribution Sedangkan pabrik sebagai Holding Company.
2.1.2 Visi dan Misi Perusahaan
2.1.2.1 Visi Perusahaan
2.1.2.2 Misi Perusahaan
PT. Kimia Farma (Persero) Tbk. mempunyai misi:
1. Mengembangkan industri kimia dan farmasi dengan melakukan penelitian dan
pengembangan produk yang inovatif.
2. Mengembangkan bisnis pelayanan kesehatan terpadu yang berbasis jaringan distribusi
dan jaringan apotek.
3. Meningkatkan sumber daya manusia dan mengembangkan sistem informasi perusahaan.
Misi ini diwujudkan melalui strategi corporate:
1. Meningkatkan sinergi antar unit usaha dengan menggunakan salah satu unit usaha yang
kuat untuk menarik unit usaha lain.
2. Meningkatkan efektifitas pemasaran dengan penyusunan program pemasaran yang lebih
fokus dan perluasan cakupan daerah pemasaran yang ada.
3. Memperkuat struktur bisnis distribusi dengan melakukan intensifikasi dan ekstensifikasi
kegiatan distribusi.
4. Melakukan difersifikasi dan pengembangan produk, baik yang berasal dari
pengembangan sendiri maupun kerja sama dengan pihak luar.
5. Melakukan pengembangan usaha yang terkait dengan pelayanan kesehatan yang
dilakukan sendiri, kerja sama dengan pihak luar ataupun melalui akuisisi.
6. Mengembangkan sumber daya manusia untuk memperoleh sumber daya manusia yang
mempunyai komitmen-komitmen tinggi, melalui pelatihan dan pendidikan yang
7. Mengembangkan sistem dan prosedur operasi ditunjang dengan sistem ilmu teknologi
yang memadai untuk peningkatan efisiensi dan menuju operasional excellence. 2.1.3 Lokasi dan Sarana Produksi Plant Medan
PT. Kimia Farma (Persero) Tbk. Plant Medan terletak di jalan Tanjung Morawa km 9
dengan luas 20.269 m2 yang terdiri dari:
1. Ruang perkantoran
2. Ruang laboratorium pengawasan mutu
3. Ruang produksi tablet
4. Ruang produksi kapsul
5. Ruang produksi krim/salep
6. Ruang penimbangan sentral
7. Ruang sampling
8. Gudang bahan baku
9. Gudang bahan kemas
10.Gudang etiket
11.Gudang obat jadi
12.Bangunan penunjang seperti tempat pencucian, dapur, mushola, dan tempat olah raga.
Kontruksi bangunan PT. Kimia Farma (Persero) Tbk. Plant Medan telah dibuat sesuai
dengan persyaratan CPOB dimana dinding dan langit-langit memiliki permukaan licin dan tidak
terdapat sambungan. Lantai dan dinding di dalam ruangan produksi dilapisi dengan epoksi, ruang produksi untuk masing-masing bentuk sediaan terletak terpisah. Sistem pengaturan udara pada
2.1.4 Cara Pembuatan Obat Yang Baik (CPOB)
2.1.4.1 Manajemen Mutu (Pemastian Mutu)
Pemastian mutu merupakan suatu konsep luas yang mencakup semua hal baik secara
tersendiri maupun secara kolektif yang akan mempengaruhi mutu dari obat yang dihasilkan.
Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan
bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya. Karena itu
pemastian mutu mencakup CPOB ditambah dengan faktor lain diluar pedoman ini seperti desain
dan pengembangan produk. Sistem pemastian mutu yang benar dan tepat bagi industri farmasi
hendaklah memastikan bahwa:
a) Desain dan pengembangan obat dilakukan dengan cara yang memperhatikan persyaratan
CPOB dan cara berlaboratorium yang baik.
b) Semua langkah produksi dan pangendalian diuraikan secara jelas dan CPOB diterapkan.
c) Tanggung jawab manajerial diuraikan dengan jelas dalam uraian jabatan.
d) Pengaturan disiapkan untuk pembuatan, pasokan dan penggunaan bahan awal dan
pengemas yang benar.
e) Semua pengawasan terhadap produk antara dan pengawasan selama proses (in-process
controls) lain serta validasi yang diperlukan dilakukan.
f) Pengkajian terhadap semua dokumen yang terkait dengan proses pengemasan dan
pengujian bets dilakukan sebelum memberikan pengesahan pelulusan untuk distribusi.
Penilaian hendaklah meliputi semua faktor yang relevan termasuk kondisi pembuatan,
hasil pengujian dan/atau pengawasan selama proses, pengkajian dokumen produksi
pemenuhan persyaratan dari spesifikasi produk jadi dan pemeriksaan produk dalam
kemasan akhir.
g) Obat tidak dijual atau dipasok sebelum kepala bagian manajemen mutu (pemastian
mutu) menyatakan bahwa tiap bets produksi dibuat dan dikendalikan sesuai dengan
persyaratan yang tercantum dalam izin edar dan peraturan lain yang berkaitan dengan
aspek produksi, pengawasan mutu dan pelulusan produk.
h) Tersedia pengaturan yang memadai untuk memastikan bahwa sedapat mungkin produk
disimpan, didistribusikan dan selanjutnya ditangani sedemikian rupa agar mutu tetap
dijaga selama masa edar/simpan obat.
i) Tersedia prosedur inspeksi diri dan audit mutu yang secara berkala mengevaluasi
efektivitas dan penerapan sistem pemastian mutu.
j) Pemasok bahan awal dan pengemas dievaluasi dan disetujui untuk memenuhi spesifikasi
mutu yang telah ditentukan oleh perusahaan.
k) Penyimpangan dilaporkan, diselidiki dan dicatat.
l) Tersedia sistem persetujuan terhadap perubahan yang berdampak pada mutu produk.
m) Prosedur pengolahan ulang dievaluasi dan disetujui.
n) Evaluasi mutu produk berkala dilakukan untuk verifikasi konsistensi proses dan
memastikan perbaikan proses yang berkesinambungan.
2.1.4.2 Personalia
Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi
dan urusan mutu dipimpin oleh apoteker yang berlainan dan tidak saling bertanggung jawab satu
supervisor yang terlatih dan memiliki keterampilan teknis serta pengalaman dalam bidang yang
berkaitan dengan bidangnya.
Manajer produksi, urusan mutu haruslah seorang apoteker terdaftar ditentukan oleh
Otoritas pengawasan Obat (OPO) yang telah menjalani pelatihan-pelatihan yang relevan dengan
tugas dan tanggung jawabnya. Manajer produksi dan Manajer urusan mutu memiliki wewenang
dan tanggung jawab penuh dalam mutu obat yang dihasilkan.
Setiap karyawan yang langsung ikut serta dalam kegiatan pembuatan obat dan yang
karena tugasnya harus memasuki daerah pembuatan obat, hendaklah diberikan pelatihan yang
sesuai dengan tugasnya maupun pelatihan CPOB. Pelatihan hendaknya dilaksanakan secara
berkesinambungan dengan program tertulis yang disetujui oleh manajer produksi dan manajer
pengawasan mutu. Pelatihan khusus diberikan kepada karyawan yang bekerja di daerah steril, di
daerah bersih, atau bagi mereka yang bekerja menggunakan bahan yang beresiko tinggi, toksis
atau yang menimbulkan alergi. Pelatihan hendaknya diberikan oleh orang yang cakap. Dokumen
pelatihan harus disimpan dengan baik dan efektifitas program pelatihan hendaknya dinilai secara
berkala.
2.1.4.3 Bangunan
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan kontruksi serta
letak yang memadai agar memudahkan dalam melaksanakan kerja, pembersihan dan
pemeliharaan yang baik. Tiap sarana kerja hendaklah memadai, sehingga setiap resiko terjadinya
kekeliruan, pencemaran silang dan berbagai kesalahan lain yang dapat menurunkan mutu obat,
Lokasi bangunan hendaklah sedemikian rupa untuk mencegah terjadinya pencemaran
dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah dan air maupun dari kegiatan
didekatnya. Apabila bangunan itu terletak pada tempat yang tidak sesuai, tindakan yang efektif
hendaklah diambil untuk mencegah pencemarannya.
Dalam menentukan rancang bangun dan penataan gedung hendaklah dipertimbangkan
hal-hal berikut:
1. Kesesuaian dengan kegiatan lain, yang mungkin dilakukan dalam sarana yang sama atau
dalam sarana yang berdampingan.
2. Pencegahan terjadinya penggunaan kawasan produksi sebagai lalu lintas umum bagi
karyawan atau bahan ataupun sebagai tempat penyimpanan kecuali untuk
bahan-bahan yang sedang dalam proses.
Untuk kegiatan-kegiatan berikut diperlukan daerah tertentu yaitu:
1. Penerimaan bahan
2. Karantina barang masuk
3. Penyimpanan bahan awal dan bahan pengemas
4. Penimbangan dan penyerahan bahan atau produk
5. Pengolahan
6. Pencucian peralatan
7. Penyimpanan peralatan
8. Penyimpanan produk ruahan
9. Pengemasan
11.Pengiriman produk
12.Laboratorium pengawasan mutu
Bangunan hendaklah mendapatkan penerangan, suhu, kelembaban dan ventilasi yang
tepat agar tidak mengakibatkan dampak yang merugikan baik secara langsung maupun tidak
langsung terhadap produk selama proses pembuatan dan penyimpanan.
2.1.4.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah didesain dan dikonstruksi
sesuai dengan tujuannya, memiliki rancang bangun dan kontruksi yang tepat. Permukaan
peralatan yang bersentuhan langsung dengan bahan atau produk tidak boleh bereaksi karena
dapat merubah identitas, mutu dan kemurnian produk yang dihasilkan, tidak boleh mencemari
produk, harus mudah dibersihkan baik bagian dalam maupun bagian luar mesin/alat tersebut.
Peralatan yang digunakan untuk menimbang, mengukur, dan menguji harus diperiksa
ketelitiannya secara teratur serta dikalibrasi menurut program dan prosedur yang tepat.
Pemasangan dan penempatan alat harus dapat mencegah terjadinya kontaminasi silang
dan cukup renggang untuk memberikan keleluasaan kerja. Saluran air, uap, udara bertekanan
atau hampa udara harus dipasang dengan baik sehingga mudah dicapai selama kegiatan
berlangsung.
Peralatan hendaknya dirawat menurut jadwal agar tetap berfungsi dengan baik dan
mencegah pencemaran terhadap produk. Catatan mengenai pelaksanaan, pemeliharaan dan
pemakaian suatu peralatan utama hendaklah dicakup dalam buku yang menunjukkan tanggal,
waktu, kekuatan dan nomor bets atau lot produk yang diolah dengan peralatan tersebut serta
2.1.4.5 Sanitasi dan Higiene
2.1.4.5.1 Personalia
1. Tiap personil yang masuk ke area pembuatan hendaklah mengenakan pakaian pelindung
yang sesuai dengan kegiatan yang dilaksanakannya.
2. Semua karyawan hendaklah menjalani pemeriksaan kesehatan, baik pada waktu diterima
bekerja maupun selama bekerja.
3. Setiap karyawan hendaklah menerapkan higiene pribadi yang baik.
4. Karyawan yang menderita suatu penyakit atau mempunyai luka terbuka, yang dapat
merugikan kualitas produk, hendaklah dilarang untuk menangani bahan dan produk
sampai dia sembuh kembali.
5. Semua personil hendaklah diperintahkan dan didorong untuk melaporkan kepada atasan
langsung tiap keadaan yang menurut penilaian mereka dapat merugikan produk.
6. Dihindarkan persentuhan langsung antara tangan dengan bahan baku, produk antara dan
produk ruahan.
7. Karyawan harus mencuci tangan terlebih dahulu sebelum memasuki ruangan produksi.
8. Merokok, makan, minum, mengunyah, meletakkan tanaman, menyimpan makanan dan
minuman hanya diperbolehkan ditempat-tempat tertentu saja.
9. Peraturan higiene perorangan hendaklah diberlakukan bagi setiap orang yang memasuki
2.1.4.5.2 Bangunan
1. Rancang bangun gedung harus memudahkan untuk pelaksanaan sanitasinya.
2. Tersedianya toilet dalam jumlah yang cukup dengan ventilasi yang baik.
3. Tersedia tempat penyimpanan barang milik pribadi yang memadai.
4. Fasilitas penyiapan makanan dibatasi daerah khusus, harus terpelihara dan bersih.
5. Harus tersedia tempat sampah yang cukup yang terletak diluar bangunan produksi, jangan
biarkan sampah menumpuk dimana-mana.
6. Rodentisida, insektisida, bahan fumigasi dan bahan pembersih lain yang digunakan pada
sanitasi tidak boleh mencemari peralatan, bahan baku, bahan pengemas, produk dalam
proses dan produk jadi. Adanya peraturan tertulis untuk pemakaian rodentisida,
insektisida, bahan fumigasi dan bahan pembersih lain yang disusun dan dipatuhi untuk
mencegah pencemaran.
7. Harus mempunyai prosedur tetap sanitasi, meliputi cara-cara sanitasi, jadwal pelaksanaan
sanitasi dan penanggung jawab pelaksanaan sanitasi.
2.1.4.5.3 Peralatan
1. Setelah peralatan digunakan harus segera dibersihkan baik bagian dalam maupun luarnya
sesuai prosedur yang telah ditetapkan.
2. Hindari penggunaan sikat dan udara bertekanan, gunakan vakum atau cara basah.
3. Pembersihan peralatan yang dapat dipindah-pindahkan hendaklah dilakukan diruang
terpisah dari ruang produksi.
2.1.4.6 Produksi
Produksi obat hendaklah dilakukan dan diawasi oleh personil yang berkompeten,
dilaksanakan mengikuti prosedur yang telah ditetapkan agar selalu diperoleh obat jadi yang
memenuhi spesifikasi yang ditentukan. Prosedur produksi hendaklah dibuat oleh penanggung
jawab produksi bersama-sama dengan penanggung jawab pengawasan mutu. Setiap
penyimpangan prosedur yang telah ditetapkan hendaknya dicatat pada catatan bets dan bila perlu
proses produksi setiap bets sebelumnya dievaluasi kembali.
2.1.4.6.1 Bahan awal
1. Pengadaan bahan awal hendaklah hanya dari pemasok yang telah disetujui dan memenuhi
spesifikasi yang relevan.
2. Setiap pemasukan, pengeluaran dan sisa bahan harus dilakukan pencatatan.
3. Bahan awal yang diterima hendaklah dikarantina sampai disetujui dan diluluskan untuk
pamakaian oleh kepala bagian pengawasan mutu.
4. Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan hendaklah memenuhi
spesifikasi bahan awal yang sudah ditetapkan yang diberi label dengan nama yang
dinyatakan dalam spesifikasi.
5. Bahan awal yang mengalami kerusakan oleh suhu disimpan ditempat yang suhu udaranya
diatur.
6. Persediaan bahan awal diperiksa dalam selang waktu tertentu untuk meyakinkan bahwa
wadahnya tertutup rapat, bertanda yang benar dan dalam kondisi yang baik, pemeriksaan
7. Semua bahan awal yang tidak memenuhi syarat ditandai dengan jelas, ditempatkan
terpisah dan secepatnya dikembalikan kepemasok atau dimusnahkan.
2.1.4.6.2 Validasi Proses
Semua prosedur produksi hendaklah divalidasi dengan tepat. Validasi dilaksanakan
menurut prosedur yang telah ditentukan dan catatan hasilnya harus disimpan. Program dan
dokumentasi validasi hendaklah membuktikan kecocokan bahan yang dipakai, kehandalan
peralatan dan sistem serta kemampuan petugas pelaksanaan.
Perubahan penting dalam proses, peralatan atau bahan hendaklah disertai dengan validasi
ulang, untuk menjamin bahwa perubahan tersebut akan tetap menghasilkan produk yang
memenuhi spesifikasi yang telah ditentukan.
2.1.4.6.3 Pencemaran
Pencemaran silang hendaklah dihindari dengan tindakan teknis atau pengaturan yang
tepat, seperti:
• Produksi di dalam gedung terpisah.
• Tersedia ruang penyangga udara dan penghisap udara.
• Memakai pakaian pelindung yang sesuai.
2.1.4.6.4 Sistem penomoran bets dan lot.
Penomoran bets dan lot diperlukan secara rinci untuk memastikan bahwa produk antara,
produk ruahan, dan produk jadi dapat dikenali dengan nomor bets atau lot tertentu. Sistem
penomoran ini hendaknya menjamin bahwa nomor bets dan lot yang sama tidak digunakan
secara berulang.
2.1.4.6.5 Penimbangan dan penyerahan
Penimbangan dan penyerahan bahan awal, produk antara, produk ruahan dan produk jadi
harus dilakukan dan didokumentasikan sesuai dengan prosedur yang telah ditetapkan. Sebelum
dilakukan penimbangan harus dilakukan pemeriksaan kebenaraan penandaan termasuk label
pelulusan dari bagian pengawasan mutu. Untuk menghindari terjadinya kontaminasi silang, dan
hilangnya identitas maka bahan awal, produk antara, dan produk ruahan yang ada di daerah
penyerahan hanya boleh untuk satu bets saja.
2.1.4.6.6 Pengembalian
Bahan awal, bahan pengemas, produk antara dan produk ruahan yang dikembalikan ke
gudang penyimpanan hendaklah didokumentasikan dengan benar dan tidak dikembalikan ke
gudang penyimpanan kecuali memenuhi spesifikasi yang telah ditetapkan.
2.1.4.6.7 Pengolahan
• Semua bahan yang dipakai di dalam pengolahan hendaklah di periksa terlebih
dahulu.
• Peralatan yang sudah dibersihkan hendaklah diberi penandaan yang sesuai.
• Semua kegiatan pengolahan dan kejadian diluar prosedur hendaklah dilaporkan.
2.1.4.6.8 Pengawasan Selama Proses
Prosedur pengawasan selama proses harus dipatuhi seperti pengambilan contoh, frekuensi
pengambilan contoh, dan jumlah yang diambil untuk pemeriksaan. Hasil pengujian pengawasan
selama proses harus dicatat dan didokumentasikan.
Pengawasan mutu selama proses produksi (IPC) dilakukan untuk:
1. Semua parameter produk, volume atau jumlah isi produk hendaklah diperiksa pada saat
awal dan selama proses pengolahan atau pengemasan.
2. Kemasan akhir hendaklah diperiksa selama proses pengemasan dengan selang waktu
yang teratur untuk memastikan spesifikasi produk.
2.1.4.6.9 Pengemasan
Kegiatan pengemasan berfungsi membagi-bagi dan mengemas produk ruahan menjadi
produk jadi. Proses pengemasan hendaklah dilaksanakan dibawah pengawasan ketat untuk
menjaga identitas, keutuhan, dan kualitas barang yang sudah dikemas. Sebelum kegiatan
pengemasan dimulai hendaklah dilakukan pemeriksaan untuk memastikan bahwa peralatan dan
ruang kerja dalam keadaan bersih dan bebas dari produk dan sisa produk lain atau dokumen yang
tidak diperlukan untuk kegiatan yang dilakukan. Sebelum menempatkan bahan pengemas pada
jalur pengemasan hendaklah diadakan pemeriksaan kesiapan jalur pengemasan yang
Pada penyelesaian proses pengemasan produk yang sudah dikemas hendaklah diperiksa
dengan teliti untuk memastikan bahwa produk obat tersebut sesuai dengan persyaratan dalam
prosedur pengemasan induk. Hanya obat jadi yang berasal dari satu bets pengemasan saja yang
boleh ditempatkan pada satu palet. Bila ada karton yang tidak penuh maka jumlah yang ada
didalamnya hendaklah dituliskan pada karton tersebut.
2.1.4.6.10 Penyimpanan Bahan Awal, Produk Antara, Produk Ruahan, dan
Obat Jadi
Semua bahan hendaklah disimpan secara rapi dan teratur untuk mencegah resiko
tercampur-baur atau pencemaran serta memudahkan pemeriksaan dan pemeliharaan. Semua
bahan ini disimpan dengan jarak yang cukup terhadap bahan lainnya maupun terhadap dinding,
tidak diletakkan di lantai, dan dalam kondisi lingkungan yang sesuai. Penyimpanan diluar
gudang diperbolehkan bagi bahan yang dikemas dalam wadah kedap yang mutunya tidak
terpengaruh oleh suhu dan kondisi lain.
Setiap bahan awal, produk antara, produk ruahan, dan obat jadi yang disimpan di area
gudang hendaklah mempunyai kartu stok.
2.1.4.7 Pengawasan Mutu
Pengawasan mutu adalah bagian yang penting dari cara pembuatan obat yang baik agar
tiap obat yang dibuat memenuhi persyaratan mutu yang sesuai dengan tujuan penggunaannya.
Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan
keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi
Pengawasan mutu meliputi semua fungsi analisa yang dilakukan laboratorium termasuk
pengambilan contoh, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan, dan
obat jadi. Pengawasan mutu juga meliputi program uji stabilitas, pemantauan lingkungan kerja,
validasi, dokumentasi suatu bets, program penyimpanan contoh dan penyusunan serta
penyimpanan spesifikasi yang berlaku dari tiap bahan dan produk termasuk metode
pengujiannya.
Bagian pengawasan mutu melaksanakan tugas pokok sebagai berikut:
a. Menyusun dan merevisi prosedur pengawasan dan spesifikasi.
b. Menyiapkan prosedur tertulis yang rinci untuk melakukan seluruh pemeriksaan,
pengujian dan analisis.
c. Menyusun program dan prosedur pengambilan sampel secara tertulis.
d. Memastikan pemberian label yang benar pada wadah bahan dan produk.
e. Menyimpan contoh pertinggal untuk rujukan dimasa mendatang.
f. Meluluskan atau menolak tiap bets bahan awal, produk antara, produk ruahan atau
produk jadi.
g. Mengevaluasi stabilitas semua obat jadi secara berlanjut, bahan awal jika diperlukan, dan
menyiapkan intruksi mengenai cara penyimpanan bahan awal dan obat jadi di pabrik
berdasarkan data stabilitas yang ada.
h. Menetapkan masa simpan bahan awal dan produk jadi berdasarkan data stabilitas serta
kondisi penyimpanannya.
i. Berperan atau membantu pelaksanaan program validasi.
k. Menyimpan catatan analitis dari hasil pengujian semua sampel yang diambil.
l. Melakukan evaluasi produk jadi kembalian dan menetapkan apakah produk tersebut
dapat diluluskan atau diolah ulang atau harus dimusnahkan.
m. Ikut serta dalam program inspeksi diri bersama bagian lain dalam perusahaan.
n. Memberikan rekomendasi untuk pembuatan obat oleh pihak lain atas dasar kontrak
setelah diadakan evaluasi terhadap kontraktor yang bersangkutan dinilai mampu
membuat obat yang memenuhi standart mutu yang ditetapkan.
2.1.4.8 Inspeksi Diri
Tujuan inspeksi diri adalah untuk melakukan penilaian apakah seluruh aspek produksi
dan pengendaliaan mutu senantiasa memenuhi persyaratan CPOB. Program inspeksi diri
hendaklah dirancang untuk mencari kelemahan dalam pelaksanaan CPOB dan untuk menetapkan
tindakan perbaikannya. Inspeksi diri ini hendaklah dilaksanakan secara teratur. Tindakan
perbaikan yang disarankan hendaklah dilaksanakan. Untuk pelaksanaan inspeksi diri ditunjuk
tim inspeksi yang mampu menilai secara objektif pelaksanaan CPOB. Prosedur dan catatan
mengenai inspeksi diri hendaklah dibuat.
Untuk mendapatkan standart inspeksi diri yang minimal dan seragam maka disusun
daftar pemeriksaan selengkap mungkin. Daftar pemeriksaan hendaklah meliputi pertanyaan
mengenai hal-hal berikut:
1. Personalia.
2. Bangunan termasuk fasilitas untuk personil.
3. Perawatan bangunan dan peralatan.
5. Peralatan.
6. Pengolahan dan pengawasan selama proses.
7. Pengawasan mutu.
8. Dokumentasi.
9. Sanitasi dan higiene.
10.Program validasi.
11.Kalibrasi alat atau sistem pengukuran.
12.Prosedur penarikan kembali obat jadi.
13.Penanganan keluhan.
14.Pengawasan label.
15.Hasil inspeksi diri sebelumnya dan tindakan perbaikan.
Manajemen hendaklah membentuk tim inspeksi diri yang paling sedikit terdiri dari 3
(tiga) anggota yang berpengalaman dalam bidangnya masing-masing dan memahami CPOB.
Anggota tim dapat dibentuk dari dalam atau dari luar perusahaan. Tiap anggota hendaklah bebas
dalam memberikan penilaian atas hasil inspeksi.
2.1.4.9 Penanganan Keluhan terhadap produk penarikan kembali produk dan produk kembalian
Keluhan dan laporan yang berkaitan dengan kemungkinan terjadi kerusakan obat
hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis.
Penarikan kembali produk dari peredaran dapat mengakibatkan penundaan atau
Keluhan
• Hendaknya ditunjuk personil yang bertanggung jawab untuk menangani keluhan dan
memutuskan tindakan yang akan dilakukan bersama staf yang memadai.
• Hendaknya tersedia prosedur tertulis yang merinci penyelidikan dan tindak lanjut yang
sesuai termasuk penarikan kembali produk.
Penarikan kembali produk
• Hendaknya ditunjuk personil yang bertanggung jawab melaksanakan dan mengkoordinasi
penarikan kembali produk.
• Hendaknya tersedia prosedur tertulis yang diperiksa secara berkala untuk mengatur
segala tindakan penarikan kembali.
Produk Kembalian
• Industri Farmasi hendaknya menyiapkan prosedur penahanan, penyelidikan dan
pengujian produk kembalian serta pengambilan keputusan apakah produk kembalian
dapat diproses ulang atau harus dimusnahkan setelah dilakukan evaluasi secara kritis.
2.1.4.10 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi manajemen yang
meliputi spesifikasi, prosedur, metode dan instruksi, catatan dan laporan serta jenis dokumentasi
lain yang diperlukan dalam perencanaan, pelaksanaan, pengendalian, serta evaluasi seluruh
rangkaian kegiatan pembuatan obat. Sistem dokumentasi hendaklah menggambarkan riwayat
lengkap dari setiap bets atau lot suatu produk sehingga memungkinkan penyelidikan serta
Sistem dokumentasi diperlukan pula dalam pemantauan dan pengendalian, misalnya kondisi
lingkungan, perlengkapan dan personalia.
2.1.4.11 Pembuatan dan analisis berdasarkan kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan
dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau
pekerjaan dengan mutu yang tidak memuaskan. Kontrak harus menyatakan secara jelas prosedur
pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian
manajemen mutu.
2.1.4.12 Validasi
Validasi adalah tindakan pembuktian yang didokumentasi dengan cara-cara yang sesuai
bahwa tiap bahan, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan
dalam produksi dan pengawasan mutu akan senantiasa mencapai hasil yang diinginkan.
Cara-cara pelaksanaan validasi terbagi empat yaitu:
1. Validasi Prospektive
Adalah validasi berdasarkan pada perolehan data perdana sesuai protokol validasi yang
direncanakan. Validasi ini berlaku untuk produk yang belum beredar.
2. Validasi Concurrent
Adalah validasi yang berdasarkan data otentik yang diperoleh dan dikumpulkan dari
3. Validasi Retrospektive
Adalah validasi yang berdasarkan data otentik yang diperoleh dan dikumpulkan dari
proses yang sudah dilaksanakan dan dinilai menurut prinsip statistik. Validasi ini berlaku
pada produk yang sudah beredar.
4. Validasi Ulang
Adalah validasi yang dilakukan bila ada perubahan bahan baku, proses pembuatan, dan
BAB III
KEGIATAN DI INDUSTRI FARMASI
3.1 Aspek Personalia
PT. Kimia Farma (Persero) Tbk. Plant Medan memiliki personalia sebanyak 71 orang
dengan berbagai pendidikan, keterampilan, dan kemampuan sesuai dengan bidang tugasnya
masing-masing.
3.2 Struktur Organisasi
PT. Kimia Farma (Persero) Tbk. Plant Medan dipimpin oleh seorang Plant Manager
yang membawahi:
1. Bagian perencanaan produksi dan pengendalian inventori.
2. Bagian produksi dengan 2 supervisor.
- Supervisor produksi
- Supervisor pengemasan
3. Bagian pemastian mutu.
4. Supervisor tekhnik dan pemeliharaan.
5. Supervisor umum dan personalia.
6. Supervisor keuangan.
7. Supervisor akutansi.
3.3Sediaan-sediaan obat yang diproduksi PT. Kimia Farma (Persero) Tbk. Plant Medan 1. Antalgin tablet 500 mg (1000 tablet/botol)
2. Antalgin tablet 500 mg strip 10 x10
3. Betamethason 0,1% krim
4. Betason krim
5. Betason-N krim
6. Calcium tablet 500 mg (1000 tablet/botol)
7. Dexocort 0,2% krim
8. Ekstrak belladone tablet 10 mg
9. Fitocassol krim
10.Fungoral krim
11.Gentamisin 0,1% salep
12.Hidrocortison 2,5% krim
13.Parasetamol tablet 500 mg strip 10 x 10
14.Undecyl salep
15.Vitamin B komplek tablet (1000 tablet/botol)
16.Glyceryl guaiacolate 100 mg (1000 tablet/botol)
3.4 Kegiatan Industri PT Kimia farma (Persero)Tbk. Plant Medan
Adapun kegiatan di industri PT Kimia farma (Persero)Tbk. Plant Medan adalah:
3.4.1 Perencanaan Produksi Dan Pengendalian Inventori (PPPI) Tugas dan fungsi dari PPPI yaitu:
2. Mengontrol jalannya pembuatan obat.
3. Merencanakan pengiriman obat jadi.
4. Melakukan stok opname ke gudang pada tiap akhir triwulan.
Dasar perencanaan adalah pesanan yang berasal dari direktorat pemasaran di Jakarta per
triwulan. Dari jumlah pesanan tersebut dikonversikan per bets karena tiap produk memiliki
ukuran bets yang berbeda.
Untuk pemesanan bahan, PPPI memperhatikan stok bahan baku yang ada di gudang, stok
produk ruahan atau setengah jadi dari stok produk jadi di gudang, sehingga dapat diketahui
beberapa bahan yang akan dipesan.
Setelah semua jumlah bahan yang diperlukan untuk produksi dihitung, maka PPPI
mengeluarkan Surat Permintaan Pembelian Bahan (SPPB) ditujukan kepada bagian pembelian.
Pembelian ada dua cara yaitu: secara terpusat di Jakarta dan secara lokal di Medan. Bagian
pembelian ini akan memilih pemasok yang paling murah tetapi memenuhi spesifikasi bahan yang
diminta, kemudian bagian pembelian menerbitkan surat pemesanan (Purchase Order/ PO) dan
ditandatangani pimpinan. Dibuat tembusan satu lembar arsip pesanan kebagian gudang agar
disiapkan tempatnya.
Bahan pesanan yang datang diterima oleh bagian gudang dimana bagian gudang akan
memeriksa kecocokan nomor pesanan, jumlah, spesifikasi bahan yang diminta pada arsip
pesanan dengan bahan yang akan diantarkan. Bahan tersebut akan dikarantina dan diberi label
kuning sementara bagian gudang membuat surat permohonan periksa ke bagian pengawasan
memenuhi syarat akan diberi label hijau disertai Hasil Pemeriksaan Laboratorium (HPL), jika
tidak memenuhi syarat akan diberi label merah dan HPL serta dikembalikan ke pihak pemasok.
Setelah semua bahan yang dipesan lengkap, maka PPPI membuat Surat Perintah Kerja
(SPK) ke bagian produksi yang ditandatangani pimpinan. Pada SPK tersebut ditulis No. SPK,
nama sediaan, No Bets, dan kapan obat tersebut diharapkan siap diproduksi. SPK dari PPPI yang
dikirim kebagian produksi dilampiri catatan pengolahan bets, catatan pengemasan bets, Surat
Perintah Pengeluran Bahan Baku (SPPBB) dan Bahan Pengemasan (SPPBK). SPK dibuat
rangkap 4 dengan distribusi ke produksi, gudang, laboratorium dan arsip.
Obat jadi yang telah siap diproduksi dan dikemas kemudian dikirim ke gudang
penyimpanan obat jadi. Setelah dilakukan finished pack analysis oleh petugas pengawasan mutu. Obat jadi tersebut akan dikirimkan oleh PPPI ke Unit Logistik Sentral (ULS) Jakarta, maka PPPI
membuat surat kebagian gudang untuk menyiapkan obat jadi tersebut untuk dikirimkan ke
Jakarta akan dilakukan stock opname. Pada bahan yang telah di stock opname akan diberi label stock opname yang dituliskan tanggal dilakukan stock opname, nama bahan dan jumlahnya.
3.4.2 Produksi
Produksi adalah semua kegiatan pembuatan mulai dari penerimaan bahan awal,
pengolahan sampai dengan menghasilkan obat jadi. Kegiatan produksi ini dilakukan di area
terkendali dan tidak berhubungan langsung dengan bagian gudang ataupun perkantoran.
Tugas dari bagian produksi PT kimia Farma (Persero) Tbk. Plant Medan:
1. Melaksanakan pembuatan obat sesuai dengan surat perintah kerja (SPK) dari bagian
pengemasan, sampai pengiriman obat jadi ke gudang obat jadi sesuai dengan prosedur
tertulis yang telah ditetapkan (Protap).
2. Melaksanakan dokumentasi atas semua tindakan yang dilakukan selama proses
pengolahan dan pengemasan dengan berpedoman pada protap.
Sebelum dimulainya kegiatan produksi, petugas yang terlibat dalam kegiatan produksi
ataupun yang memasuki area produksi harus memakai pakaian bersih, masker, penutup
kepala, dan mencuci tangan menggunakan antiseptik yang tersedia sebelum memakai
sarung tangan.
Hal-hal yang harus diperhatikan sebelum memulai kegiatan produksi:
1. Ruang produksi harus tetap terjaga kebersihan, dimana kegiatan pembersihan dilakukan
tiap pagi sebelum dimulai kegiatan produksi dan sore hari sesudah selesai kegiatan
produksi.
2. Temperatur dan kelembaban tiap ruangan produksi diatur sedemikan rupa menggunakan
Air Handling System (AHS) yaitu AC sentral.
3. Peralatan yang digunakan harus dipastikan selalu dalam keadaan bersih sebelum dan
sesudah dilakukan kegiatan produksi.
4. Ruangan Produksi harus mendapat penerangan dan pertukaran udara yang cukup agar
kegiatan produksi berjalan lancar.
Produksi dilaksanakan setelah adanya SPK dari bagian PPPI ke bagian produksi, dan
dilakukan produksi sesuai dengan protap yang telah ditetapkan serta mendokumentasi setiap
Setelah adanya perintah produksi dari PPPI, bagian produksi untuk meminta bahan baku
ke bagian gudang dengan surat perintah pengeluaran bahan baku dan bahan pengemas, petugas
gudang melakukan penimbangan atau penyerahan bahan sesuai dengan yang ditulis pada
SPPBB/SPPBK tersebut. Selama produksi berlangsung, dibuat laporan proses produksi mulai
dari penimbangan bahan sampai pengemasan yang bertujuan untuk dokumentasi, sehingga bila
terjadi kekeliruan ataupun kesalahan pada proses produksi, dapat segera diketahui pada proses
dimana kesalahan tersebut terjadi dan diambil tindakan untuk mengatasi permasalahan tersebut.
Laporan proses produksi memuat nama sediaan, No bets, besar bets, tahapan proses,
operator, tanggal, jam, hasil, pengawasan yang berguna untuk mengetahui berapa lama waktu
yang dibutuhkan untuk menghasilkan suatu bets sediaan. Laporan proses produksi ini diisi oleh
petugas yang melakukan suatu tahapan proses produksi dan diketahui oleh supervisor produksi.
Selama proses produksi berlangsung dilakukan pengawasan dalam proses (In Process
Control/IPC). IPC yang dilakukan ada 2 macam, yaitu:
1. Dilakukan oleh pihak produksi, yaitu setiap 15 menit sekali dilakukan pemeriksaan
keseragaman bobot.
2. Dilakukan oleh pihak pengawasan mutu, antara lain: uji kekerasan, waktu hancur,
disolusi, friabilitas, keseragaman bobot dan kadar zat berkhasiat untuk tablet
sedangkan untuk krim dilakukan uji pH, stabilitas dan homogenitas.
Obat yang telah selesai diproduksi akan dilakukan pengemasan primer dibagian produksi
yang selanjutnya diserahkan kebagian pengemasan sekunder melalui pass box untuk dilakukan pengemasan sekunder sampai dihasilkan obat jadi. Obat jadi yang telah selesai dikemas,
dilakukan finished pack analysis. Obat jadi yang lulus pemeriksaan selanjutnya diserahkan ke gudang penyimpanan obat jadi.
Bagian Produksi pada PT Kimia Farma (Persero) Tbk. Plant Medan terdiri dari:
1. Jalur Produksi Krim
Jalur penyimpanan krim terpisah dari jalur produksi yang lain dimana pada jalur produksi ini
terdiri dari beberapa ruangan yang telah diatur suhu, kelembaban dan tekanan dengan AHS.
Adapun ruangan pada jalur produksi krim terdiri dari:
a. Ruangan penimbangan
Pada ruangan ini dilengkapi dengan beberapa alat timbangan digital, lemari asam, dust
collector, Air Handling System (AHS). Bahan – bahan yang telah ditimbang akan
ditempatkan pada staging area untuk kemudian diambil oleh petugas produksi lain untuk
dilakukan proses produksi selanjutnya. Ruangan dipakai untuk menimbang bahan sediaan
krim, tablet, kapsul.
b. Ruangan pencampuran
Pada ruangan ini dilengkapi dengan 2 unit double jacket tank untuk memanaskan fase air
dan fase minyak, ultraturrax untuk mencampur bahan aktif dengan bahan dasar krim,
mixer untuk pengadukan sehingga diperoleh produk ruahan. Alat-alat tersebut
dibersihkan setiap pagi hari sebelum digunakan dan sore hari sesudah selesai digunakan.
Bila tidak ada kegiatan produksi maka pembersihan dilakukan seminggu sekali. Selama
c. Ruangan pengisian
Ruangan untuk melakukan pengisian sediaan krim ada 2 yaitu:
• Ruangan pengisian I
Dilengkapi dengan mesin pengisian krim Elemech dengan kapasitas 2400 tube/jam
dan neraca digital untuk IPC oleh operator.
• Ruang pengisian II
Dilengkapi dengan mesin pengisian krim pharmech dengan kapasitas 200-900 tube/
jam dan neraca digital untuk IPC oleh operator.
Sebelum pengisian krim, tube kosong yang telah dibersihkan dibagian pengemasan
dimasukkan ke pass box, dibawa oleh petugas produksi keruang pengisian dan
disusun kemesin pengisian yang telah dimasukkan massa krim kemudian dilakukan
pengisian. Setiap 15 menit dilakukan pemeriksaan bobot oleh operator dan pada awal
dan akhir pengisian dilakukan pemeriksaan oleh bagian pengawasan mutu.
d. Ruangan karantina
Pada ruang ini disimpan produk ruahan untuk menunggu pemeriksaan laboratorium.
Produk ruahan yang telah selesai diperiksa oleh bagian pengemasan melalui pass box
untuk dilakukan pengemasan sekunder.
2. Jalur Produksi tablet
Jalur produksi tablet terletak terpisah dari jalur produksi krim untuk menghindari
diatur suhu, kelembaban dan tekanan dengan AHS, juga dilengkapi dengan dust collector sentral. Adapun ruangan pada jalur produksi tablet terdiri dari:
a. Ruangan pencampuran
Semua bahan tambahan dan bahan aktif dimasukkan kedalam super mixer dan dicampur
hingga homogen, pengecualian untuk bahan pelicin dan bahan pencampur luar. Massa di
atas digranulasi dengan menggunakan alat rotary wet granulator sehingga didapat granul basah. Untuk selanjutnya granul basah tersebut dipindah keruang pengeringan.
b. Ruang pengeringan
Granul basah yang dihasilkan dikeringkan di dalam oven dengan suhu 50-60oC selama 10
jam (tergantung pada bahan yang akan dikeringkan). Kapasitas oven tersebut 450kg/hari.
Setelah kering dilakukan pemeriksaan laboratorium dan selanjutnya dipindahkan
keruangan granulasi untuk pengayakan.
c. Ruang granulasi
Massa granul yang telah dikeringkan digranulasi dengan alat communiting fitz mill,
kemudian keruang pencampuran akhir.
d. Ruang Pencampuran akhir
Massa yang telah digranulasi dimasukkan kedalam alat v-mixer dan ditambahkan dengan bahan pelicin dan bahan penghancur luar. Hasil yang diperoleh kemudian dilakukan
e. Ruang pencetakan
Ruang untuk pencetakan ada 5, masing-masing terdapat 1 alat cetak dan juga terdapat
dust collector, neraca digital, dan AHS. Setiap 15 menit operator harus memeriksa keseragaman bobot. Bagian pengawasan mutu di dalam ruang produksi melakukan
pemeriksaan/pengujian terhadap produk ruahan yang meliputi: pemerian, friabilitas,
waktu hancur, kekerasan tablet, disolusi dan keseragaman bobot.
f. Ruang sortir
Tablet yang dihasilkan disortir oleh petugas dari debu dan juga untuk bentuk tablet yang
tidak bagus/pecah kemudian dipindahkan keruangan pengemasan.
g. Ruang pengemasan
Tablet yang telah diluluskan oleh bagian pengawasan mutu dibawa ke ruang pengemasan
primer dan dikemas dalam kantong plastik. Tiap kantong berisi 1000 tablet dengan
menggunakan mesin penghitung dan diberi silika gel. Juga dilakukan pengemasan
kedalam bentuk strip menggunakan mesin strip. Setelah selesai dilakukan pengemasan
primer dipindahkan keruangan pengemasan sekunder melalui pass box untuk dilakukan
pengemasan sekunder.
3. Jalur Produksi kapsul
Sediaan kapsul yang diproduksi oleh PT. Kimia Farma (Persero)Tbk. PlantMedan adalah
kloramfenikol kapsul. Seperti jalur produksi krim dan tablet, jalur produksi kapsul juga terletak
terpisah untuk menghindari terjadinya kontaminasi silang. Pada jalur produksi kapsul juga
terdapat beberapa ruangan dimana setiap ruangan tersebut diatur suhu, kelembaban dan tekanan
Adapun ruangan pada unit kapsul terdiri dari:
a. Ruang pengeringan
Bahan pengisi (Avicel) dikeringkan terlebih dahulu didalam oven selama ±12 jam pada
suhu 85oC. Setelah itu semua bahan dipindahkan keruang pencampuran.
b. Ruang pencampuran
Pada ruang ini dilakukan pencampuran bahan aktif, bahan pengisi dan bahan tambahan
lainnya dengan menggunakan alat V-mixer selama ±15 menit. Setelah homogen, massa
disimpan di ruang karantina menunggu pemeriksaan oleh bagian pengawasan mutu dan
kemudian dipindahkan keruang pengisian kapsul.
c. Ruang pengisian kapsul
Massa yang telah homogen dimasukkan kemesin pengisian kapsul. Pada awal, akhir
pengisian dilakukan pengisian laboratorium dan setiap 15 menit dilakukan pemeriksaan
keseragaman bobot oleh operator. Setelah itu dipindahkan keruang seleksi kapsul.
Dikemas dan diluluskan oleh bagian pengawasan mutu selanjutnya dikirim kegudang
penyimpanan
3.4.3 Pengawasan Mutu
Pengawasan mutu adalah semua pengawasan yang dilakukan selama pembuatan dan
dirancang untuk menjamin agar produk obat yang dihasilkan senantiasa memenuhi spesifikasi,
identifikasi, kekuatan kemurnian dan karakteristik lain yang telah ditetapkan. Pengawasan mutu
merupakan bagian yang paling penting dari Cara Pembuatan Obat Yang Baik (CPOB) agar tiap
Tanggung jawab pengawasan mutu:
1. Memastikan bahan awal memenuhi spesifikasi yang telah ditetapkan untuk identitas,
kekuatan, kemurnian, kualitas dan keamanan.
2. Memastikan tahapan produksi obat telah dilaksanakan sesuai prosedur yang telah
ditetapkan dan telah divalidasi.
3. Memastikan semua pengawasan selama proses dan pemeriksaan selama laboratorium
terhadap suatu bets obat telah dilaksanakan dan bets tersebut memiliki spesifikasi yang
ditetapkan sebelum didistribusi.
4. Memastikan suatu bets obat memenuhi persyaratan mutu selama waktu peredaran yang
ditetapkan. Setiap bahan baku yang dikarantina dilakukan pengujian oleh bagian
pengawasan mutu yang mencakup: spesifikasi, identitas, kualitas, kekuatan/potensi dan
persyaratan lain yang ditentukan.
3.4.3.1 Pemeriksaan Mutu Bahan Baku dan Bahan Pengemas
Bahan baku dan bahan pengemas datang dari pemasok kebagian gudang, kemudian
petugas laboratorium melakukan sampling dan pemeriksaan terhadap:
1. Bahan baku dan bahan tambahan
a) Pemeriksaan organoleptis, meliputi bentuk, warna, bau dan rasa.
b) Pemeriksaan kimia, meliputi pemeriksaan kualitatif, kuantitatif dan pH.
c) Pemeriksaan fisika, meliputi titik lebur, kelarutan dan berat jenis.
2. Bahan pengemas
a) Pemeriksaan kemasan, meliputi ukuran dan kebocoran wadah.
3.4.3.2 Pengawasan Selama Proses (In Process Control/IPC)
Tujuan dilakukan pengawasan selama berlangsungnya proses pengolahan yaitu untuk
mencegah terlanjur diproduksinya obat yang tidak memenuhi spesifikasi. Laboratorium
pengujian IPC terletak di area produksi. Pengawasan ini dilakukan dengan cara mengambil
contoh dan mengadakan pemeriksaan dan pengujian terhadap produk yang dihasilkan pada
tahap-tahap tertentu dari proses pengolahan.
Pengawasan dalam proses pengolahan dilaksanakan oleh 2 pihak, yaitu:
1. Bagian produksi, yang menjamin bahwa mesin dan peralatan produksi serta proses
yang digunakan akan menghasilkan produk yang memenuhi spesifikasi yang
ditetapkan.
2. Bagian pengawasan mutu, yang meyakinkan bahwa produk yang dihasilkan pada
tahap tertentu telah memenuhi spesifikasi yang ditetapkan sebelum dilanjutkan proses
berikutnya. Bagian pengawasan mutu menentukan apakah tahap lanjutan dari proses
pengolahan dapat dilaksanakan berdasarkan hasil pengujian yang diakukan.
Pengawasan dalam proses pengolahan (IPC) hendaklah meliputi pengujian parameter
kualitas antara lain:
a. Tablet: pemerian, kadar air, bobot rata-rata, bobot satuan, kadar bahan aktif,
kekerasan, friabilitas, waktu hancur dan disolusi.
b. Kapsul: pemerian, bobot rata-rata, bobot satuan, kadar bahan aktif, waktu hancur dan
disolusi.
3.4.3.3 Pengawasan dalam Proses Pengemasan
Pengawasan dalam proses pengemasan hendaklah meliputi pemeriksaan parameter
kualitas antara lain:
a. Kerapatan tutup wadah seperti tutup botol dan tube.
b. Jumlah satuan produk dalam kemasan.
c. Kebenaran dan kebersihan bahan pengemas yang dipakai.
d. Kerapian pengemas, penulisan nomor bets, tanggal kadaluarsa.
e. Kebocoran produk yang dikemas dalam strip.
3.4.4 Gudang
Gudang masih berada di area produksi tetapi tidak berhubungan langsung dengan bagian
produksi. Di gudang terbagi atas beberapa ruangan dimana ruangan tersebut saling berhubungan
dan dilengkapi AC untuk menjaga suhu dan kelembaban ruangan. Adapun ruangan di gudang
antara lain:
a) Ruang karantina bahan obat.
b) Ruang penyimpanan bahan pembantu yang telah diluluskan bagian pengawasan mutu.
c) Ruang penyimpanan bahan baku yang telah diluluskan bagian pengawasan mutu.
d) Ruang penyimpanan kapsul kosong.
e) Ruang penyimpanan obat jadi.
f) Ruang penyimpanan bahan pengemasan dan etiket.
g) Ruang penyimpanan aluminium foil.
3.4.5 Penerimaan Barang
Bahan pesanan yang masuk dari pemasok kebagian gudang akan diperiksa kesesuaian
nomor pesanan, jenis, jumlah bahan sesuai dengan surat pesanan oleh petugas gudang dan
dikarantina terlebih dahulu dan diberi label kuning, kemudian bagian gudang membuat surat
permohonan periksa kebagian pengawasan mutu untuk melakukan pemeriksaan terhadap bahan
tersebut. Bila bahan memenuhi syarat akan diberi label hijau disertai hasil pemeriksaan
laboratorium (HPL), jika tidak memenuhi syarat akan diberi label merah dan HPL serta
dikembalikan kepihak pemasok ataupun dimusnahkan. Bahan baku yang telah diluluskan oleh
bagian pengawasan mutu akan disimpan di ruang penyimpanan bahan baku dan dicatat kedalam
kartu stok, begitu juga dengan bahan pembantu.
3.4.6 Pengeluaran Barang
Bahan-bahan akan dikeluarkan bagian gudang kebagian produksi untuk ditimbang setelah
adanya surat perintah pengeluaran bahan baku dan bahan pengemasan dari PPPI. Tiap bahan
yang dikeluarkan akan dicatat ke kartu stock oleh petugas gudang. Setelah obat jadi selesai
diproduksi dan dikemas, bagian gudang akan menyimpan obat jadi di ruang penyimpanan obat
jadi dan akan mengeluarkannya untuk dikirim setelah adanya intruksi dari PPPI.
Bahan-bahan yang ada di gudang akan dilakukan pemeriksaan ulang sesuai dengan jenis
3.4.7 Pengolahan Limbah
3.4.7.1 Pengolahan Limbah Cair
Gambar 1. Denah bak pengolahan limbah cair PT. Kimia Farma (perseo) Tbk. Plant Medan
Keterangan A = Saluran masuk E = Bak Aerasi
B = Bak penampung F = Bak Aerasi
C= Mesin pompa G = Bak Sedimentasi
D = Bak Netralisasi H = Bak Biokontrol
Sumber limbah cair berasal dari air cucian di ruang produksi dan air cucian alat-alat di
laboratorium.
Proses pengolahan limbah cair yaitu:
1) Limbah cair yang dikeluarkan ditampung dalam bak penampungan (B) selanjutnya
dipompakan dengan mesin pompa ke bak netralisasi (D).
3) Pada bak aerasi (E) dilakukan aerasi dengan menggunakan aerator yang bertujuan untuk
menginjeksikan udara kedalam bak tersebut supaya bakteri aerob yang terdapat dalam
bak tersebut dapat melakukan penguraian bahan-bahan organik yang terdapat dalam
limbah cair tersebut. Selanjutnya juga dialirkan ke bak aerasi (F) dengan mendapatkan
perlakuan yang sama. Lalu dialirkan ke bak sedimentasi (G).
4) Pada bak sedimentasi (G), limbah cair tersebut didiamkan/diendapkan beberapa hari
selanjutnya dialirkan ke bak biokontrol (H).
5) Pada bak biokontrol, dilakukan pengujian terhadap hasil pengolahan limbah cair tersebut
berupa nilai BOD (Biological Oxygen Demand) dan COD (Chemical Oxygen Demand)
bila telah memenuhi syarat nilai BOD dan COD maka limbah cair yang telah diolah
tersebut dapat dibuang ke lingkungan. Air buangan (limbah) digunakan menyiram
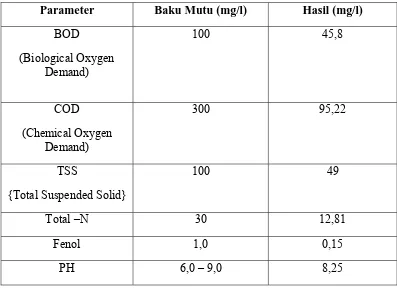
Tabel 1. Hasil Analisis Limbah Cair PT Kimia Farma (Persero) Tbk. Pant Medan
Tanggal 22 Februari 2010 oleh Sucofindo
Parameter Baku Mutu (mg/l) Hasil (mg/l) BOD
3.4.7.2 Pengolahan Limbah Padat
Sumber limbah padat berasal dari:
a. Debu yang pada dust collector di ruang produksi.
b. Debu yang berasal dari vacum cleaner yang digunakan untuk membersihkan
ruangan produksi, alat produksi.
c. Wadah, etiket yang rusak dari bagian pengemasan. Untuk tube sebelum
d. Bahan-bahan yang tidak memenuhi spesifikasi ataupun yang telah rusak yang
berasal dari bagian gudang.
Semua limbah padat tersebut dibakar oleh petugas dan sisa pembakaran tersebut
dibuang ketempat pembuangan akhir.
3.4.8 Administrasi dan Keuangan
Keuangan di PT. Kimia Farma (Persero)Tbk. Plant Medan dipusatkan kekantor pusat
yang ada di Jakarta. Oleh sebab itu membayar gaji karyawan ataupun pembayaran faktur atas
pembelian bahan-bahan baku, bahan kemasan, biaya umum dan biaya pemeliharaan harus dibuat
surat permintaan droping uang kekantor pusat Jakarta.
Setelah dilakukan pemesanan bahan baku oleh bagian pembelian ke pemasok, maka
pemasok akan mengirimkan bahan baku tersebut disertai faktur masuk. Pembelian bahan baku
tersebut dicatatkan kedalam buku pembelian.
Pembayaran Faktur ada 2 macam yaitu:
1. Secara tunai, dibagi atas 2 macam yaitu:
a. Untuk pembelian dalam jumlah sedikit (<5 juta), pembayaran dilakukan dengan uang
kas, dan dicatatkan kedalam buku kas (dokumen 1).
b. Untuk pembelian dalam jumlah banyak (>5 juta), pembayaran dilakukan dengan cek giro,
dan dicatatkan kedalam buku bank.
2. Secara Kredit.
Tenggang waktu pembayaran yang diberikan untuk pembelian secara kredit bervariasi
tergantung pada pemasok, akan tetapi berkisar 2 minggu sampai 1 bulan.
Produk jadi akan dikirim ke Unit Logistik Sentral Jakarta dengan membuka faktur keluar
(Nota Penyerahan Intern/NPI). PT Kimia Farma (Persero) Tbk. Plant Medan tidak dapat
melakukan penjualan kepihak luar, tetapi di perbolehkan mengirim produk jadi tersebut ke PBF
di Medan dan sekitarnya dengan faktur atas nama Unit Logistik Sentral Jakarta untuk
menghemat biaya transportasi. Pembayaran atas penjualan (pelunasan faktur) diterima oleh
kantor pusat Jakarta dan dicatatkan ke dalam buku penjualan.
Setiap pembelian bahan-bahan baku dicatat dalam buku pembelian dikenai pajak
pertambahan nilai (PPN) yang disebut PPN masukan dan dicatat dalam buku PPN masukan dan
setiap penjualan obat jadi catat dalam buku penjualan dikenai PPN keluaran dan dicatat dalam
buku PPN keluaran. Untuk PT Kimia Farma (Persero) Tbk. Plant Medan tidak berhak
mengeluarkan PPN keluaran karena masih satu NPWP (Nomor Pokok Wajib Pajak) dengan yang
ada di Jakarta. Pajak-pajak lain yang dibayarkan oleh PT Kimia Farma (Persero) Tbk. Plant
Medan adalah : - pajak penghasilan 21
- pajak penghasilan 23
BAB IV
PEMBAHASAN
4.1Aspek Personalia
PT. Kimia farma (Persero) Tbk. Plant Medan memiliki personalia sebanyak 71 orang
dengan berbagai tingkat pendidikan, keterampilan, dan kemampuan sesuai dengan bidang
tugasnya masing-masing.
PT. Kimia Farma (Persero) Tbk. Plant Medan terdiri dari 3 bagian yaitu produksi,
pemastian mutu dan PPPI. Setiap bagian dikepalai oleh seorang asisten manager.
Pemisahan fungsi antara produksi, pengawasan mutu dan pemastian mutu di PT. Kimia
Farma (Persero) Tbk. Plant Medan sudah dilaksanakan, dimana masing-masing fungsi tersebut
sudah dikepalai oleh seorang apoteker.
4.2 Aspek Bangunan
PT. Kimia Farma (Persero) Tbk. Plant Medan telah dilengkapi dengan sistem tata udara
dengan menggunakan AC sentral yang dilengkapi dengan saringan udara awal (pre-filter,
medium filter dan HEPA filter) sehingga dapat mencegah pencemaran dari udara sekitarnya.
Rancang bangun, ukuran dan penataan ruangan serta konstruksi bangunan dibuat
sedemikian rupa sehingga memudahkan pelaksanaan produksi, pembersihan dan
pemeliharaannya. Permukaan bagian dalam ruang proses produksi (dinding, lantai dan