ENZYMATIC FUEL CELL (EFC) MENGGUNAKAN BIOANODA
KOMPOSIT KARBON-NANOPARTIKEL POLIANILIN YANG
TERAMOBILISASI Glucose Oxidase (GOD)
SURIANTY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul Enzymatic Fuel
Cell (EFC) menggunakan bioanoda komposit karbon-nanopartikel polianilin
yang teramobilisasi Glucose Oxidase (GOD) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Surianty
RINGKASAN
SURIANTY. Enzymatic Fuel Cell (EFC) menggunakan bioanoda komposit karbon-nanopartikel polianilin yang teramobilisasi Glucose Oxidase (GOD) dibimbing oleh Akhiruddin Maddu dan Laksmi Ambarsari
Nanopartikel Polianilin merupakan salah satu polimer konduktif yang bisa digunakan sebagai matriks dalam pembuatan bioanoda dalam aplikasi biofuel cell. Polianilin dapat disintesis melalui metode polimerisasi
interfacial antar muka sistem dua fasa larutan organik/air. Produk berupa
endapan polianilin dan dilakukan pemurnian melalui filtrasi. Serbuk polianilin dikarakterisasi dengan SEM, untuk melihat struktur morfologi yang berpori dari permukaan polianilin, hasil analisis diperoleh partikel dengan ukuran sekitar 60 nm. Karakterisasi TEM untuk melihat lapisan paling tipis sampel (polianilin), dan terlihat morfologi polianilin membentuk kelompok atau mengagregasi seperti serat dengan ukuran diameter partikel rata-rata 60-80 nm. Kristalinitas polianilin dengan XRD, memperlihatkan struktur kristal parsial atau semikristalin dari polianilin dengan ukuran rata-rata kristal 10,4 nm. Umumnya pola difraksi yang melebar mengindikasikan urutan struktur kristalinitas polianilin nanokristal. Analisis FTIR mengindikasikan bahwa polianilin yang diperoleh merupakan bentuk polianilin konduktif atau emeraldine salt (ES).
Penambahan polianilin pada elektroda pasta karbon teramati pada kurva voltamogram. Puncak oksidasi terjadi pada potensial 0,4 V dan 0,6 V, sedangkan puncak reduksi pada -0,1 V dan 0,8 V walaupun tidak terlihat begitu tajam.
Penggunaan enzim glucose oxidase dalam bentuk larutan kurang ekonomis, karena enzim tersebut tidak dapat dimanfaatkan kembali. Untuk efisiensi penggunaan enzim dalam analisis maupun dalam proses produksi, maka dikembangkan teknik amobilisasi enzim. Amobilisasi enzim dilakukan pada elektroda anoda sebagai penghasil elektron. Polianilin (nanopartikel PANI) dengan ukuran partikel yang kecil namun luas permukaannya besar, digunakan sebagai matriks yang dapat mengikat enzim bebas dan mampu menjaga stabilitas aktivitas katalitik enzim dengan lebih baik sehingga dapat digunakan sebagai bahan elektroda yang akan digunakan pada proses reaksi anoda pada EFC.
Enzymatic fuel cell merupakan teknologi elektrokimia yang
mengkonversi energi kimia menjadi listrik. Energi penggerak yang sering disebut enzymatic fuel cell ini merupakan enzim glucose oxsidase yang berperan sebagai biokatalisis. Hasil pengamatan diperoleh bahwa konsentrasi glukosa rendah (0,25 M) menghasilkan nilai arus yang tinggi (5,05 μA), namun peningkatan konsentrasi glukosa (0,50 M; 0,75 M; 1 M) menurunkan nilai arus yang dihasilkan (2,45 μA; 1,69 μA; 1,35 μA). Hal yang sama terjadi pada pengamatan nilai tegangan, dengan konsentrasi glukosa rendah (0,25 M) menghasilkan nilai tegangan yang tinggi 60,8 mV, namun nilai tegangan menurun (20,3 mV; 20,8 mV; 15,4 mV) dengan bertambahnya konsentrasi glukosa (0,50 M; 0,75 M; 1 M). Nilai rapat daya
(power density) maksimum diperoleh 0,39 μW/cm2, pada konsentrasi glukosa rendah (0,25 M) dengan peningkatan konsentrasi glukosa (0,50 M;
0,75 M; 1 M) menurunkan nilai rapat daya (0,071 μW/cm2, 0,044 μW/cm2, 0,026 μW/cm2
). Jadi dapat dikatakan konsentrasi glukosa yang rendah menghasilkan energi listrik yang maksimum baik arus, tegangan dan rapat daya. Jadi nilai rapat daya (power density) maksimum yang diperoleh pada penelitian ini sebesar 0,39 μW/cm2.
SUMMARY
SURIANTY. Enzymatic Fuel Cell (EFC) used carbon-polyaniline nanoparticle composite bioanoda with amobolized Glucose Oxidase (GOD). Supervised by AKHIRUDDIN MADDU and LAKSMI AMBARSARI
.
Polyaniline nanoparticles is one of the conductive polymer which used as a matrix in the manufacture bioanoda in biofuell cell applications. Polyaniline was synthesized by the interfacial polymerization method interfacial two-phase system of organic solvent or water. Products such as polyaniline precipitate was collected and purified by filtrating. The powder was characterized by SEM for morphology structure analyzing of polyaniline surface porous, the analyzing result of particle size was 60 nm. Characterization of TEM showed the thinnest layer of the sample, the morphologically formed groups or aggregations such as fiber to the size of the average particle diameter of 60-80 nm. The crystallinity of X-ray diffraction results showed partial or semi-crystalline structure of polyaniline with an average crystal size was 10.4 nm. Generally, the diffraction pattern indicates that extends sequence crystallinity of polyaniline nanocrystal structure. FTIR analysis indicated that the sample obtained was a conductive polyaniline forms or emeraldine salt (ES).
Polyaniline addition on carbon paste electrode observed in voltammogram curve. The oxidation peak in potential 0,4 and 0,6 V, and the reduction peak was seen at -0,1 and 0,8, although it does not look so sharp.
The using of glucose oxidase enzyme in solution is less economical, because the enzyme can not be used repeatedly. For using efficiently of enzymes in analyzing and production process, the enzyme immobilization technique was developed. Immobilization of enzymes were applied to produce electron. Polyaniline (PANI nanoparticles) with nanoscale structures with small particle size which had a large surface area, used as a matrix be able to bind the enzyme free and able to maintain the stability of the catalytic activity of the enzyme better. It can be used as an electrode material for anode reaction process on the EFC.
Enzymatic fuel cell is an electrochemical technology converted chemical energy into electricity. The driving force is called enzymatic fuel cells are from glucose oxidase enzyme as a bio-catalyst. It also has a high specificity for glucose substrate. The observation result by lower concentration of glucose (0.25 M) produced higher current (5,05 μA). Increasing of glucose concentration( 0,50 M; 0,75M; 1 M) decresed of current results (2,45 μA; 1,69 μA; 1,35 μA). The same thing happens on observations of potential, with a low glucose concentration (0.25 M) produces a high voltage value of 60.8 mV, but decrease voltage value (20.3 mV; 20.8 mV; 15.4 mV) with increasing concentrations of glucose (0.50 M, 0.75 M, 1 M) The value obtained maximum power density was 0.39 μW/cm2
at low glucose concentrations (0,25 M) with increasing concentrations of glucose (0.50 M, 0.75 M, 1 M) decresed the value of the
power density (0.071 μW/cm2, 0.044 μW/cm2, 0.026 μW/cm2). The glucose with lower concentration can produced maximum electrical by current, voltage and power density. The values obtained maximum power density was 0.39 μW/cm2.
Keywords : polyaniline, electroda bioanoda, dan enzymatic fuel cell
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biofisika
ENZYMATIC FUEL CELL (EFC) MENGGUNAKAN BIOANODA
KOMPOSIT KARBON-NANOPARTIKEL POLIANILIN YANG
TERAMOBILISASI Glucosa Oxidase (GOD)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
SURIANTY
Judul Tesis : Enzymatic Fuel Cell (EFC) menggunakan bioanoda komposit karbon-nanopartikel polianilin dengan Glucose Oxidase (GOD) teramobilisasi
Nama : Surianty NIM : G751110121
Disetujui oleh Komisi Pembimbing
Dr. Akhiruddin Maddu, S.Si, M.Si Ketua
Dr. dra. Laksmi Ambarsari, M.S Anggota
Diketahui oleh
Ketua Program Studi Biofisika
Dr. Agus Kartono, M.Si
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc. Agr Tanggal Ujian : 6 Februari 2014 Tanggal Lulus :
Judul Tesis
Nama NIM
Enzymatic Fuel Cell (EFC) menggunakan bioanoda komposit karbon-nanopartikel polianilin yang teramobilisasi Glucose
Oxidase (OOD) : Surianty : 0751110121 Disetujui oleh Komisi Pembimbing . /
Dr. Akhiruddin Maddu, S.Si, M.Si Dr. dra. Laksmi Ambarsari, M.S
Ketua Anggota
Diketahui oleh
Ketua Program Studi Biofisika
Dr. Agus Kartono M.Si
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah
subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat
menyelesaikan penelitian yang berjudul “Enzymatic Fuel Cell (EFC) menggunakan bioanoda komposit karbon-nanopartikel polianilin yang teramobilisasi Glucose oxidase (GOD)”. Penelitian ini merupakan salah satu persyaratan dalam menyelesaikan studi di Program Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Dr. Akhiruddin Maddu, SSi, M.Si dan Dr. dra. Laksmi Ambarsari, M.S yang telah membimbing penulis menyelesaikan penelitian dan karya ilmiah ini. Penulis juga menyampaikan penghargaan kepada Dr Tony Ibnu Sumaryada selaku dosen penguji luar komisi pada ujian tesis, dan seluruh staf Program Studi Biofisika. Terima kasih juga penulis sampaikan kepada semua staf di Pusat Penelitian dan Pengembangan Keteknikan Hutan dan Pengolahan Hasil Hutan Kementerian Kehutanan RI, yang telah memberikan izin tempat untuk melakukan penelitian, staf Laboratorium Pusat Studi dan Biofarmaka yang telah membantu dalam penelitian ini
Terima kasih juga penulis sampaikan kepada semua pihak yang telah ikut membantu dan berkontribusi dalam berbagai hal selama penyelesaian penelitian dan karya ilmiah. Terima kasih pula kepada teman-teman Biofisika atas bantuan dan kebersamaannya, kepada pihak-pihak lainnya yang tidak dapat penulis sebutkan satu persatu. Penulis menyampaikan terima kasih dan rasa hormat setinggi-tingginya kepada orang tua dan keluarga besar tercinta atas doa, pengorbanan, pengertian dan dukungan moril yang tidak ternilai selama ini
Akhirnya, semoga karya ilmiah ini dapat memberikan manfaat bagi penulis, civitas akdemika, peneliti, pemerintah dan semua pihak yang terkait, sehingga mampu memperkaya hasanah keilmuan di masa mendatang.
Bogor, Februari 2014
DAFTAR ISI
Nomor Halaman DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi 1 PENDAHULUANLatar Belakang 1 Error! Bookmark not defined.
Tujaan Penelitian 1
Ruang Lingkup Penelitian 2
Hipotesa 2
2 SINTESIS NANOPARTIKEL POLIANILIN
Pendahuluan 3
Metode 4
Hasil dan Pembahasan 5
Simpulan 11
3 PEMBUATAN ELEKTRODA BIOANODA
Pendahuluan 11
Metode 13
Hasil dan Pembahasan 14
Simpulan 18
4 KINERJA ENZYMATIC FUEL CELL
Pendahuluan 18
Metode 21
Hasil dan Pembahasan 22
Simpulan 24
5. PEMBAHASAN UMUM 24
6. SIMPULAN DAN SARAN 27
DAFTAR PUSTAKA 27
LAMPIRAN 31
DAFTAR TABEL
Nomor Halaman
1 FTIR Polianilin fase garam emeraldine dibandingkan dengan data
referensi (Angelopoulos, 1998) 11
2 Perbandingan Hasil Penelitian (Yin Song, Florida International
University) 26
DAFTAR GAMBAR
Nomor Halaman
Halaman
1 Reaksi proton-deprotonasi polianilin 4
2 Proses polimerisasi interfacial polianilin 6
3 A. Citra SEM polianilin 6
B. Permukaan nanoserat polianilin (Maddu 2008) 7
4 A. Citra TEM polianilin 8
B. Citra TEM polianilin Jiaxing (2003) 8
5 Pola difraksi polianilin 9
6 Spektrum FTIR polianilin 10
7 Skema Pembuatan elektroda pasta karbon 13
8 Kurva voltamogram EPK dan EPKT 15
9 Mekanisme pengikatan enzim-substrat (Shelley, 2012) 16 10 Struktur 3D Glucose Oxidase (sumber. pdb. org) 17
11 Elektroda bioanoda 18
12 Prinsip kerja Fuell Cell (Sundmacher, 2007) 19
13 Prinsip kerja EFC 20
14 Rangkain alat EFC 21
15 Kinerja EFC pada variasi konsentrasi glukosa. A Pengukuran arus
listrik, B Pengukuran Tegangan, C Pengukuran power density 22 16 Pengaruh konsentrasi substrat terhadap arus maksimum yang
dihasilkan 24
DAFTAR LAMPIRAN
Nomor Halaman
Halaman
1. Data XRD polianilin 32
2. Data kuat arus dan tegangan pada variasi konsentrasi 32
1 PENDAHULUAN
Latar Belakang
Dewasa ini kehidupan manusia tidak pernah lepas dari kebutuhan energi. Di Indonesia penggunaan energi terus mengalami lonjakan hebat, apabila hal ini tidak diiringi oleh usaha peningkatan produksi energi dikhawatirkan Indonesia akan mengalami krisis energi. Kebutuhan energi listrik diperkirakan terus bertambah sebesar 4,6 % setiap tahunnya, dan akan mencapai tiga kali lipat pada tahun 2030 (Departemen Energi dan Sumber Daya Mineral, 2010). Fakta menunjukkan bahwa pemanfaatan minyak bumi dan bahan bakar fosil lainnya masih mendominasi sebagai penghasil energi. Sedangkan cadangan minyak bumi di Indonesia hanya sekitar 3,7 miliar barel dan diperkirakan akan habis dalam waktu 24 tahun, oleh karena itu perlu dikembangkan upaya untuk menghasilkan sumber energi alternatif yang berkesinambungan.
Biofuel cell merupakan salah satu teknologi alternatif yang
prospektif untuk dikembangkan. Biofuell cell terbagi atas Microbial Fuel
cell (MFC) dan Enzymatic Fuel Cell (EFC) dengan mikroba dan enzim
sebagai biokatalis, menarik minat banyak peneliti digunakan untuk mengoksidasi bahan bakar dengan glukosa dan pati sebagai sumber hidrokarbon. Enzymatic fuel cell (EFC) menggunakan sistem elektrokimia yang bekerja dengan mengkonversi energi kimia menjadi energi listrik. EFC memiliki komponen yang tersusun atas anoda, katoda, dan elektrolit menggunakan enzim sebagai katalisnya yang dapat menghasilkan efisiensi tinggi dan emisi polutan yang rendah (Neto et al. 2011; Steele 2001).
Saat ini pengembangan EFC banyak ditujukan untuk penggunaan khusus seperti perangkat implan, sensor, penghantaran obat, keping mikro, dan cadangan listrik portabel (Kim et al. 2006). Penggunaan pati dalam EFC dapat dipasangkan pada perangkat elektronik, menghasilkan power density sebesar 50 μW/cm2
pada suhu 25oC, (Chung-Mu et al.2009). Kinerja elektroda pada EFC bergantung pada transfer pergerakan elektron, stabilitas dan produk (elektron yang dihasilkan). Elektroda sebagian besar terbuat dari emas, tembaga, platina ataupun karbon. Meskipun elektroda emas pada struktur berlapis telah menunjukkan transfer elektron yang efisien dalam berbagai aplikasi, tetapi ada beberapa keterbatasan antara lain jumlah enzim pada elektroda dibatasi hanya pada permukaan (Katz & Willner, 2003). Kitosan memiliki ikatan yang sangat kuat, tetapi memiliki waktu respon yang lambat, membatasi penerapannya dalam perangkat bioelektronika (Subhan et al. 1996).
Matriks polimer konduktif dapat menjadi solusi mengatasi keterbatasan ini, untuk memaksimalkan kinerja sel banyak upaya dilakukan dengan menggunakan struktur nano seperti nanopartikel, nanofibers, dan nanokomposit sebagai bahan elektroda untuk EFC. Luas permukaan yang besar memungkinkan banyak enzim yang terjerap (teramobil), sehingga bisa meningkatkan kerapatan daya dari sel EFC (Nagel et al. 2007).
2
PANI sebagai matriks pendukung dapat digunakan pada proses amobilisasi dari enzim seperti glucose oxidase (Xian. Y 2006). PANI merupakan polimer konduktif yang sangat menjanjikan karena mudah disintesis, monomernya murah dan memiliki stabilitas yang lebih baik dibandingkan polimer konduktif yang lain seperti polipirol (PPy), politiofena dan poli (p-fenilena) (Vebrian, 2011). Pengembangan bahan polimer konduktif nanostruktur sangat intensif dilakukan dengan tujuan untuk meningkatkan kinerjanya dalam berbagai aplikasi. Polianilin nanostruktur merupakan bahan polimer konduktif yang dapat digunakan sebagai sensor gas dan biosensor (Maddu 2008). Matriks yang digunakan diharapkan dapat mengikat enzim bebas dan mampu menjaga stabilitas aktivitas katalitik enzim dengan lebih baik sehingga dapat digunakan sebagai bahan elektroda yang akan digunakan pada proses reaksi anoda pada EFC.
Amobilisasi enzim dilakukan pada elektroda anoda sebagai media transfer produk (elektron) dari permukaan enzim ke permukaan elektroda. Salah satu metode imobilisasi enzim adalah dengan pengikatan silang (cross
linking) menggunakan matriks penyangga, pereaksi bifungsional glutaraldehid .
Pada penelitian ini akan dibuat Enzymatic Fuel Cell (EFC) menggunakan bioanoda komposit karbon-nanopartikel polianilin yang teramobilisasi Glucosa Oxidase (GOD) sehingga dapat membangkitkan listrik.
Tujuan Penelitian
Penelitian ini bertujuan membuat Enzymatic Fuel Cell (EFC) menggunakan bioanoda komposit karbon-nanopartikel polianilin yang teramobilisasi Glucosa Oxidase (GOD) sehingga dapat membangkitkan listrik.
Ruang lingkup Penelitian
Ruang lingkup penelitian ini adalah: 1. Sintesis nanopartikel polianilin
2. Pembuatan elektroda bioanoda 3. Fabrikasi Enzymatic Fuel Cell (EFC)
Hipotesis
Enzymatic Fuel Cell (EFC) menggunakan bioanoda komposit
karbon-nanopartikel polianilin yang teramobilisasi Glucosa Oxidase (GOD) dapat membangkitkan listrik.
3
1 SINTESIS NANOPARTIKEL POLIANILIN
Pendahuluan
Polianilin (PANI) adalah salah satu bahan polimer konduktif, sangat unik yaitu dapat mengalami perubahan sifat listrik dan optik yang dapat balik (reversible) melalui reaksi redoks dan doping-dedoping atau protonasi-deprotonasi sehingga sangat potensial dimanfaatkan pada berbagai aplikasi seperti sensor kimia khususnya sensor gas, piranti elektrokromik, sel fotovoltaik, polimer dan baterai sekunder. Nanoserat polianilin, misalnya, sangat efektif sebagai sensor kimia (gas) karena memiliki luas permukaan terekspose jauh lebih besar sehingga proses difusi molekul gas ke dalam struktur nanoserat polianilin berlangsung lebih cepat dan kedalaman penetrasi molekul gas atau uap kimia ke dalam nanoserat jauh lebih besar yang akan meningkatkan sensitivitas dan responsivitas sensor.
Berdasarkan tingkat oksidasinya, polianilin dapat disintesis dalam beberapa bentuk isolatifnya yaitu leucomeraldine base (LB) yang tereduksi penuh, emeraldine base (EB) yang teroksidasi setengah dan pernigraniline
base (PB) yang teroksidasi penuh. Dari tiga bentuk ini, EB yang paling
stabil dan juga paling luas diteliti karena konduktivitasnya dapat diatur dari 10-10 S/cm hingga 100 S/cm melalui doping, sedangkan bentuk LB dan PB tidak dapat dibuat konduktif. Bentuk EB dapat dibuat konduktif dengan doping asam protonik seperti HCl, dimana proton-proton ditambahkan ke situs-situs –N=, sementara jumlah elektron pada rantai tetap. Bentuk konduktif dari EB disebut emeraldine salt (ES).
Bentuk dasar EB berubah menjadi ES melalui reaksi oksidasi dengan asam-asam protonik seperti HCl, sebaliknya bentuk ES dapat dikembalikan menjadi bentuk EB melalui reaksi reduksi dengan agen reduktan seperti NH4OH, seperti ditunjukkan pada Gambar 1. Kedua proses ini disebut juga proses protonasi-deprotonasi atau doping-dedoping. Kedua bentuk emeraldine memiliki sifat listrik yang berkebalikan, EB yang isolatif dan ES yang konduktif atau semikonduktif. Derajat konduktivitas emeraldine ini bergantung pada tingkat doping yang diberikan, yaitu jumlah proton (H+) yang didopingkan ke dalam struktur emeraldine. Sifat optiknya juga berbeda untuk kedua bentuk emeraldine, yaitu EB berwarna biru sedangkan ES berwarna hijau sehingga karakteristik absorpsi optiknya berbeda. Sifat listrik (konduktivitas) dan optik (indeks bias dan absorpsivitas) emeraldine dapat divariasikan melalui reaksi oksidasireduksi oleh agen-agen oksidan dan reduktan. Karakteristik ini dapat dimanfaatkan untuk sensor kimia (Maddu 2008).
Akhir-akhir ini pengembangan bahan polimer konduktif nanostruktur (nanoparticle, nanowire, nanotube, nanofiber) sangat intensif dilakukan dengan tujuan untuk meningkatkan kinerjanya dalam berbagai aplikasi. Polianilin nanostruktur adalah salah satu yang luas diteliti, khususnya bentuk nanoserat (nanofiber) yang banyak dikembangkan sebagai sensor kimia khususnya sensor gas.
4
Gambar 1 Reaksi protonasi-deprotonasi polianilin
Metode polimerisasi interfasial merupakan metode kimia yang relatif sangat sederhana dan lebih murah. Dalam penelitian ini nanoserat polianilin disintesis dengan metode polimerisasi interfasial karena mudah dilakukan dan relatif murah.
Bahan dan Metode
Bahan
Bahan-bahan yang digunakan untuk sintesis nanoserat polianilin adalah monomer anilin, ammonium peroxydisulphide (NH)4S2O8 sebagai oksidan atau inisiator polimerisasi, HCl sebagai doping sumber proton (H+), toluena sebagai fasa organik dan akuades sebagai fasa air (aquoeus).
Metode
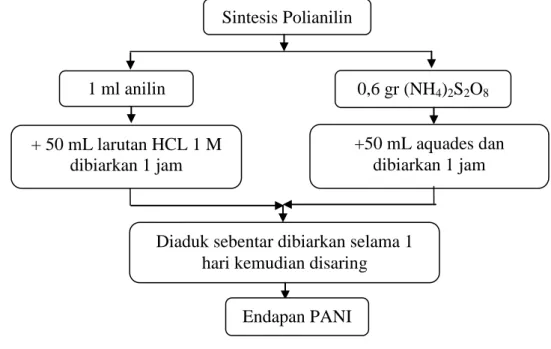
Dalam penelitian ini, nanopartikel polianilin disintesis dengan metode polimerisasi interfasial sistem dua fasa larutan organik/air (aqueous) dengan mengadopsi metode yang telah dikembangkan oleh Maddu (2008). Langkah-langkah yang dilakukan dijelaskan berikut ini. Pertama, dibuat dua larutan secara terpisah, yaitu larutan toluena 50 ml yang ditambahkan 1 ml monomer anilin 1 M sebagai fasa organik dan larutan HCl 1 M sebanyak 50 ml yang ditambahkan 0,6 g oksidan (NH)4S2O8 sebagai fasa air (aqueous). Kedua larutan dicampurkan ke dalam satu wadah kimia tanpa diaduk, kedua larutan terpisah karena berbeda fasa, larutan toluena-anilin berada di atas dan larutan HCl-(NH)4S2O8 berada di sebelah bawah. Sesaat setelah pencampuran, dengan cepat polimerisasi mulai berlangsung pada batas (interface) fasa organik dan fasa air. Proses ini dibiarkan sepanjang malam untuk memberikan waktu terjadi polimerisasi lengkap. Produk berupa endapan polianilin dikumpulkan dan dimurnikan melalui filtrasi, kemudian dibilas dengan akuades beberapa kali. Selanjutnya dikeringkan hingga akhirnya diperoleh bubuk polanilin.
Karakterisasi
Karakterisasi yang dilakukan meliputi uji morfologi luas permukaan dengan SEM (scanning elektron mikroskopi), melihat citra ukuran bentuk
5 morfologi lapisan paling tipis sampel dengan Transmission Electron
Microscopy (TEM), uji kristalografi dengan XRD (X-ray diffraction), uji
gugus fungsional polianilin dengan spektroskopi FTIR.
Diagram alir sintesis nanopartikel PANI sebagai berikut:
Hasil dan Pembahasan
Proses Polimerisasi
Proses polimerisasi terbentuk pada batas antaramuka (interface) antara fasa organik yang mengandung anilin dan fasa air yang mengandung oksidan dan dopan proton. Saat kedua larutan anilin toluena dan HCl-(NH)4S2O8 dicampurkan ke dalam satu wadah gelas kimia, kedua larutan terpisah karena berbeda fasa, larutan anilin-toluena berada di atas dan larutan HCl-(NH)4S2O8 berada di sebelah bawah. Sesaat setelah pencampuran, dengan cepat berlangsung polimerisasi anilin pada batas kedua fasa larutan dan berdifusi ke sebelah bawah (fasa air) seperti terlihat pada Gambar 2A. Mula-mula terbentuk polianilin berwarna biru karena belum terprotonisasi dan berubah menjadi hijau setelah bereaksi dengan HCl sehingga polianilin terprotoniasi di dalam fasa air. Pada saat yang sama, warna lapisan organik di sebelah atas berubah warna menjadi oranye kemerahan akibat pembentukan oligomer anilin. Proses ini dibiarkan sepanjang malam untuk memberikan waktu terjadi polimerisasi lengkap. Produk berupa endapan polianilin berwarna hijau gelap terkumpul pada bagian bawah wadah, dikumpulkan dan dimurnikan melalui filtrasi, kemudian dibilas dengan akuades beberapa kali. Selanjutnya dikeringkan hingga akhirnya diperoleh bubuk polanilin, seperti terlihat pada Gambar 2B.
Sintesis Polianilin 0,6 gr (NH4)2S2O8 +50 mL aquades dan dibiarkan 1 jam + 50 mL larutan HCL 1 M dibiarkan 1 jam
Diaduk sebentar dibiarkan selama 1 hari kemudian disaring
Endapan PANI 1 ml anilin
6
Gambar 2A. Proses polimerisasi interfasial polianilin pada (a) 5s; (b) 10s; (c) 20s; (d) 1min; (d) 5min; (e) 1h, B. Polianilin bubuk
Dalam polimerisasi interfasial, PANI terbentuk di lapisan antarmuka lalu berimigrasi ke lapisan air. Saat PANI mulai berimigrasi ke lapisan air, polimerisasi mengalami terminasi. Oleh karena itu, PANI yang terbentuk lebih berupa nanoserat. Hal ini berlawanan dengan sintesis PANI dengan metode pencampuran langsung dimana PANI yang terbentuk masih dikelilingi oleh jenis monomer dan oksidan. Bahkan bila dengan proses polimerisasi metode standar, nanoserat yang awal terbentuk bisa menjadi pusat nukleasi, yang akan mengalami pertumbuhan menjadi partikel granular yang tidak teratur, sehingga sulit untuk mengamati partikel nanoserat bila ada yang terbentuk. Oleh karena itu polimerisasi interfasial merupakan metode yang efektif untuk menekan pertumbuhan sekunder PANI (Jiaxing dan Kaner, 2003)
Scanning Electron Microscopy (SEM)
SEM merupakan suatu mikroskop elektron yang mampu menghasilkan gambar beresolusi tinggi dengan perbesaran 20 sampai 100.000 kali dari sebuah permukaan sampel. Gambar yang dihasilkan SEM memiliki karakteristik penampilan tiga dimensi, dan dapat digunakan untuk menentukan struktur permukaan dari sampel.
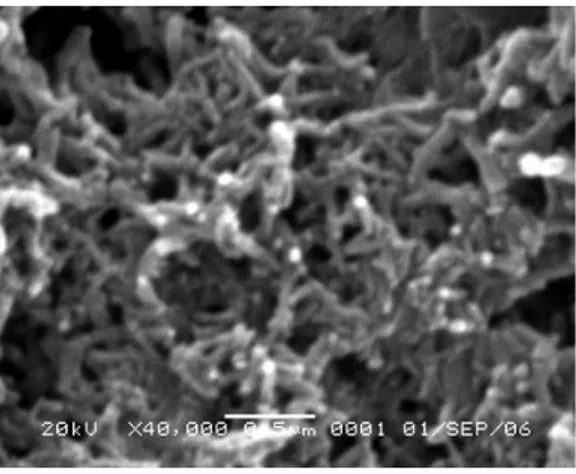
Gambar 3A. Citra SEM permukaan polianilin
Citra SEM permukaan polianilin ditunjukan pada Gambar 3A. dengan perbesaran 40000 kali menunjukkan bahwa PANI memiliki struktur
7 nano, dengan diameter partikel sekitar 60 nm. Pada gambar juga tampak bahwa PANI berpori atau berongga. Pori-pori PANI yang berukuran nano memberikan luas permukaan yang memungkinkan untuk bereaksi lebih cepat dengan senyawa lain (Virji, 2004), Sebagai material konduktif dengan ukuran partikel kecil dan luas permukaan yang besar bisa menfasilitasi transfer elektron dalam bahan elektroda.
Gambar 3B ini memperlihatkan struktur nano polianilin berbentuk serat dengan diamater beberapa puluh nanometer dan panjang beberapa ratus nanometer serta sangat berpori (highly porous). Pada gambar ini juga dapat diamati dengan jelas nanoserat-nanoserat ini saling bersilangan membentuk struktur yang sangat berpori yang memungkinkan molekul-molekul gas dapat menembus lebih dalam dan berinteraksi dengan hampir seluruh serat-serat polianilin. Akibatnya, semua serat polianilin dapat berkontribusi terhadap proses sensing dengan sensitivitas yang lebih baik (Maddu, 2008).
Gambar 3B Permukaan nanoserat polianilin, Maddu (2008)
Transmission Electron Microscopy (TEM)
Transmission Electron Microscopy (TEM) merupakan suatu tehnik
mikroskopi yang bekerja dengan prinsip menembakkan elektron ke lapisan tipis sampel, yang selanjutnya informasi tentang komposisi struktur dalam sampel tersebut dapat terdeteksi dari analisa sifat tumbukan, pantulan maupun fase sinar elektron yang menembus lapisan tipis tersebut. TEM merupakan instrumen mikroskopi elektron yang memiliki resolusi perbesaran paling tinggi yaitu hingga perbesaran 106. Instrumen ini digunakan untuk mengkarakterisasi nanomaterial sehingga diperoleh tampilan gambaran dalam skala nanometer dan juga dapat menentukan lokasi atom–atom dalam sampel.
8
Gambar 4A. Citra TEM polianilin
Citra TEM (Gambar 4A) memberikan informasi visual dari ukuran, bentuk, dispersitas, struktur, dan morfologi nanopartikel polianilin (PANI) yang dibuat. Karakterisitik kualitatif nanopartikel PANI tampak membentuk kelompok atau agregasi dengan distribusi yang ukurannya relatif seragam yang terlihat seperti serat yang bergerombol. Tampak ukuran agregasi terkecil sekitar 70,5 nm atau dengan diameter rata-rata antara 60-80 nm Dalam polimerisasi interfasial ada beberapa faktor yang mempengaruhi ukuran partikel PANI yang dihasilkan yaitu konsentrasi dopan, jenis dopan, konsentrasi monomer, dan jumlah inisiator (Bitao Su et al. 2007). Berdasarkan penelitian yang dilakukan oleh Jiaxing dan Kaner (2003) dengan menggunakan larutan asam HCL menghasilkan diameter nanoserat sekitar 30 nm Gambar 4B.
9
Karakterisasi XRD (X-Ray Diffraction)
Karakterisasi XRD dilakukan untuk mengetahui apakah polianilin yang terbentuk kristalin atau tidak Pola difraksi (difraktogram) sampel nanopartikel polianilin pada Gambar 5 memperlihatkan puncak tajam difraksi pada dua puncak 20,08o dan 25,62o. Pola difraksi sinar X ini menunjukkan bahwa struktur semi kristal polianilin memiliki 2 puncak yang tajam muncul pada sudut 2θ=20,08o dan 2θ= 25,62o yang bersesuaian dengan bidang kristal PANI (020), (200), ini diakibatkan oleh periodisitas yang sejajar dan tegak lurus terhadap cincin benzoid dan quinoid rantai polimer polianilin. Umumnya pola difraksi yang melebar mengindikasikan urutan struktur kristalinitas polianilin nanokristal (Rahy et al. 2008). Ukuran kristal rata-rata PANI pada penelitian ini adalah 10,4 nm. Hasil ini tidak jauh berbeda dengan analisis XRD PANI, Srinivas et al. (2012) dengan 2 puncak tajam yang muncul pada sudut 2θ=21,10o dan 2θ=23,59o mendapatkan ukuran rata-rata kristal PANI 8,67 nm.
Ukuran kristal dihitung dengan persamaan Debye-Scherrer :
dengan σ adalah ukuran kristal, λ adalah panjang gelombang sumber sinar– X (Cu K adalah 0,154059). Nilai yang digunakan adalah setengah nilai puncak difraksi (dalam radian), nilai puncak maksimum disebut FWHM (full width at half maximum) dan adalah sudut difraksi Bragg.
2 derajat) 0 20 40 60 80 100 In te n si ta s (a .u ) 0 20 40 60 80 100 120 140 25,62 20,08
Gambar 5 Pola difraksi polianilin
Spektum Inframerah
Karakterisasi FTIR dilakukan dengan menggunakan alat Shimadzu Ir Perstige-21. FTIR (Fourier Transform Infra Red) spektrometer merupakan alat yang digunakan untuk analisis berdasarkan pengukuran intensitas infra
10
merah terhadap bilangan gelombang. Korelasi antara posisi serapan panjang gelombang dengan struktur kimia digunakan untuk mengidentifikasi gugus fungsi pada sampel. Atom-atom dalam molekul selalu mengalami vibrasi. Getaran atom dalam molekul (frekuensi getaran) dapat digambarkan dalam tingkat energi vibrasi. Jika suatu molekul menyerap radiasi inframerah, maka molekul tersebut akan tereksitasi ke tingkatan yang lebih tinggi, sehingga frekuensi radiasi yang diserap haruslah sama dengan frekuensi molekul atau atom bergetar.Ada dua jenis getaran yang terjadi yaitu getaran ulur (stretching vibration) dan getaran tekuk (bending vibration). Stretching
vibration adalah atom-atom berisolasi pada arah sumbu ikatan tanpa
mengubah sudut ikatan, sedangkan bending vibration getaran atom menghasilkan perubahan sudut ikatan.
Gambar 6. Spektrum FTIR Polianilin
Berdasarkan hasil karakterisasi dengan FTIR terlihat bahwa PANI yang dihasilkan merupakan PANI bentuk emeraldine salt atau emeraldine terprotonasi. Spektrum FTIR polianilin dapat dilihat pada Gambar 6. Spektrum FTIR polianilin disajikan pada daerah 500 cm-1 sampai dengan 4000 cm-1. Berdasarkan data FTIR tersebut, terlihat munculnya puncak serapan pada 1489 cm-1 dengan intensitas 93,5 % memperlihatkan adanya cincin-cincin benzoid sebagai backbone PANI. Pita serapan pada 1296 cm-1 menandakan terjadinya stretching (vibrasi ulur) dari C-N aromatik kedua dengan intensitas 94%. Munculnya out of plane bending C-H pada bilangan gelombang 818 dengan intensitas 96,1% menunjukkan adanya para-subtitusi yang mengindikasikan telah terjadi kopling kepala-ekor selama polimerisasi anilin (Maddu, 2008). Adanya puncak tajam serapan yang muncul pada 1134 cm-1 dengan intensitas 91%, dikarenakan terjadinya deformasi benzene juga mengidentifikasikan terbentuknya emeraldine salt pada daerah ini, diyakini sebagai puncak karakteristik kondisi ES yang menandakan bahwa PANI telah didoping dengan HCL sebagai sumber proton. Pada bentuk
leucomeraldine, semua nitrogen berbentuk amina. polianilin dalam bentuk
11 Tabel 1 FTIR Polianilin fase garam emeraldine dibandingkan
dengan data referensi (Ibrahim et all, 2005)
Eksperimen (cm-1 ) Referensi (cm-1 ) Vibrasi (cm-1 ) 818 800,53 C-H bending 1134 1122,67 C-H bending 1242 1236 C-N streching 1296 1290,49 C-N streching 1489 1473,75 C=C benzoid 1558 1560 C=C kuinoid Simpulan
Nanopartikel polianilin telah berhasil dibuat melalui metode
interfacial polymerization. PANI dikarakterisasi dengan menggunakan, Scanning Electron Microscopy ( SEM ), Transmission Electron Microscopy
(TEM) menunjukkan morfologi nanostruktur dengan pori-pori ukuran nano antara 60-80 nm. Hasil difraksi sinar-X memperlihatkan struktur kristal parsial atau semikristalin dari polianilin dengan rata-rata ukuran kristal 10,4 nm. Hasil uji FTIR mengindikasikan bahwa sampel polianilin yang diperoleh merupakan bentuk polianilin konduktif atau emeraldine salt (ES).
2 PEMBUATAN ELEKTRODA BIOANODA
Pendahuluan
Berbagai upaya dilakukan untuk mengembangkan pembuatan elektroda sebagai biosensor ataupun biofuel cell dengan respon yang cepat dan akurat dengan memperhatikan sifat kedua material komposit. Bahan dan luas permukaan elektroda mampu mempengaruhi jumlah tegangan yang
12
dihasilkan karena setiap bahan elektroda memiliki tingkat potensial elektroda (E°) yang berbeda-beda, kombinasi bahan anoda dan katoda akan menghasilkan beda potensial. Elektroda alternatif yang biasa digunakan adalah elektroda padat yang dimodifikasi dengan senyawa pengompleks. Elektroda padat memiliki rentang potensial anoda yang lebih luas. Elektroda berbasis karbon sekarang ini sangat berkembang dalam bidang elektroanalisis karena memiliki beberapa keunggulan, yaitu rentang potensial yang luas, arus latar rendah, murah, inert, dan cocok digunakan untuk bermacam-macam sensor (Wang, 1994).
Pasta karbon merupakan elektroda murah, permukaannya dapat diperbaharui, permukaannya berpori dan dapat dibuat dalam bentuk yang kecil, sehingga modifikasi elektroda pasta karbon banyak dipilih sebagai elektroda pengganti raksa (Wang, 1994; Raoof, et al., 2004). Elektroda pasta karbon dapat dimodifikasi dengan mencampurkan modifier sebagai salah satu bahan elektroda (bulk modified). Salah satu elektroda pasta karbon yang telah dimodifikasi secara kimia di antaranya adalah elektroda pasta karbon termodifikasi polianilin sebagai penyimpan energi secara elektrokimia (Zhu J 2012).
Kombinasi polianilin (PANI) dengan bahan organik atau anorganik lain dapat menghasilkan material baru yang tidak hanya meningkatkan sifat mekanik tetapi juga sifat lain tergantung material yang ditambahkan (Phang 2008). Penambahan PANI pada karbon dilakukan agar tidak ada ruang kosong antara partikel grafit yang satu dengan yang lainnya, sehingga PANI yang ditambahkan masuk dalam rongga kosong antara partikel grafit, hal ini meningkatkan konduktivitas listrik pada elektroda yang dibuat karena jalannya elektron tidak terputus. Grafit pada komposit berfungsi sebagai penguat dan memperkecil gesekan serta meningkatkan ketahanan aus (Gradiniar 2013). Komposit elektroda pasta karbon telah banyak digunakan untuk aplikasi elektroanalitik sejak diperkenalkan oleh Adams pada tahun 1958, karena sifat konduktif, terbarukan dan untuk fabrikasi secara elektrokimia sangat sederhana dan murah (Colak 2012).
Teknologi amobilisasi enzim dalam matriks polimer (polianilin) dengan polimerisasi pada elektrokimia merupakan suatu langkah yang menjanjikan dalam ilmu pengetahuan, karena sederhana, cepat, handal dan murah. Ammobilisasi hanya melibatkan penerapan potensial yang sesuai pada elektroda dalam pelarut yang cocok terhadap monomer dan enzim. Polimer konduktif memiliki kemampuan untuk mentransfer elektron yang dihasilkan oleh reaksi reduksi oksidasi dari analat sehingga dapat terbaca di potensiostat (Vebrian, 2011).
Glukosa oksidase merupakan salah satu enzim yang dapat digunakan sebagai katalis dalam enzymatic fuel cell. Glukosaoksidase juga memiliki spesifitas tinggi terhadap glukosa (Ahmad et al. 2007). Ada beberapa keuntungan dari elektroda enzim, seperti penentuan analit secara mudah dalam campuran yang kompleks, penggunaan volume sample yang kecil dan pemulihan enzim untuk penggunaan berulang kali (Ozdemir, 2010).
13
Bahan dan Metode Bahan
Alat dan instrumen yang akan digunakan adalah eDAQ Potensiostat – Galvanostat yang dilengkapi perangkat lunak Echem v2.1.0. Bahan yang digunakan dalam penelitian ini adalah enzim glucose oxidase, bovine serum albumin (BSA), larutan buffer fosfat pH 5 dan glutaraldehide (2% b/v), KCL, grafit, nujol, tabung kaca (diameter 1 cm dan panjang 3 cm) dan kawat tembaga.
Metode
Penelitian ini terdiri dari beberapa tahap percobaan yaitu: pembuatan elektroda pasta karbon (EPK), pembuatan elektroda pasta karbon termodifikasi (EPKT) polianilin, pengukuran elektrokimia (EPK dan EPKT) secara voltametrik siklik dan amobilisasi enzim.
Pembuatan Elektroda Pasta Karbon (EPK)
Pembuatan elektoda ini mengacu pada Ozlem Colak et al (2012). EPK dibuat dengan mencampurkan 0.6 g grafit dan 400μL nujol lalu dicampur dengan mortar dan diaduk selama 30 menit hingga membentuk pasta yang homogen. Sebuah tabung gelas yang terbuat dari kaca dengan diameter 1 cm dan panjang 3 cm digunakan sebagai badan elektroda, selanjutnya di sambungkan dengan kawat tembaga sebagai penghubung elektroda ke sumber listrik dimasukkan ke dalam tabung hingga tersisa ruang kosong sekitar 0,7 cm pada ujung tabung.
Pasta dimasukkan ke ujung tabung hingga penuh dan padat. Permukaan elektroda dihaluskan menggunakan ampelas halus dan kertas minyak hingga licin dan berkilau. (Gambar 7).
14
Pembuatan Elektroda Pasta Karbon Termodifikasi (EPKT) Polianilin
Polianilin, serbuk grafit dan nujol dicampur hingga membentuk pasta homogeny. Sebuah tabung gelas dengan diameter 1 cm dan panjang 3 cm digunakan sebagai badan elektroda. Kawat tembaga sebagai penghubung electroda ke sumber listrik dimasukkan ke dalam tabung hingga tersisa ruang kosong sekitar 0,7 cm pada ujung tabung hingga padat. Permukaan elektroda dihaluskan menggunakan ampelas halus dan kertas minyak hingga licin dan berkilau.
Pengukuran Elektrokimia
Karakterisasi dilakukan dengan menggunakan alat potensiostat /galvanostat eDAQ potensiostat dan computer beserta perangkat lunak pengolah data E.chem.untuk melihat voltametri siklik bentuk kurva voltamogram dari EPK dan EPKT. Voltametri merupakan salah satu metode elektroanalitik yang didasarkan oksidasi-reduksi pada permukaan elektroda. Percobaan voltametri siklik dilakukan dalam larutan elektrolit KCL 3 M. Respon arus diamati pada selang potensial -5-10 V dengan scan rate 100 mV/s menggunakan platina sebagai elektroda bantu dan Ag/AgCl sebagai elektodra refensi dan elektroda kerja dari elektroda EPK dan EPKT yang dibuat.
Amobilisasi Enzim
Amobilisasi dilakukan berdasarkan metode Ozlem Colak et al (2012) dengan cara crosslinking dengan menggunakan pereaksi glutaraldehid. Amobilisasi enzim dilakukan dengan mencampurkan 37μL enzim glucose
oxidase, I mg bovine serum albumin (BSA), 63 μL larutan buffer fosfat pH
5 dan 30 μL glutaraldehide (2%b/v). Semua larutan dicampur dalam tabung Eppendorf sampai homogen dengan total volume larutan sebanyak 130 μL. Kemudian larutan tersebut diteteskan ke elektoda pasta karbon termodifikasi (EPKT), dibiarkan hingga larutan enzim yang teramobil dipastikan terjerap (teramobil) pada pasta karbon-polianilin. Elektroda ini yang disebut bioanoda, kemudian elektroda ini dikeringkan dan disimpan di suhu ruang dan dicuci dengan larutan buffer fosfat (0,1 M) pH 5 sebanyak 3 kali untuk menghilangkan kelebihan enzim yang tidak teramobil.
Hasil dan Pembahasan Karakteristik Elektrokimia
Cyclic voltammetry adalah suatu teknik analisis kualitatif dan
kuantitatif yang dapat memberikan informasi dengan cepat dalam mengkarakterisasi reaksi yang terjadi di dalam sel elektrokimia. Pada cyclic
voltammetry respon arus diukur sebagai fungsi potensial (voltase), dimana
15 reduksi dan oksidasi dapat teramati dengan baik. Karakteristik cyclic
voltammetry tergantung beberapa faktor yaitu laju reaksi transfer elektron,
kereaktifan spesi elektroaktif, dan scan rate voltase (Wijaya, 2008). Spesi yang semula dioksidasi pada sapuan potensial awal (forward scan) akan direduksi setelah sapuan potensial balik (reverse scan).
Besarnya potensial puncak yang dihasilkan dipengaruhi oleh kinetika transfer elektron. Jika kinetika transfer elektron berlangsung lambat maka besarnya pemisahan potensial puncak akan lebih besar dan akan meningkat sesuai dengan peningkatan scan rate. Apabila potensial puncak yang dihasilkan tidak berubah dengan bertambahnya scan rate, reaksi reduksi oksidasi tersebut bersifat reversible. Sebaliknya jika potensialnya berubah dengan perubahan scan rate maka reaksi redoks tersebut bersifat
irreversible.
Gambar 8 memperlihatkan kurva voltamogram dari EPK dan EPKT dengan scan rate 100 mV/s dalam larutan KCL 3 M dengan rentang potensial yang digunakan -5–10 V menggunakan Pt sebagai elektroda bantu dan Ag/AgCl sebagai elektroda refensi dan elektroda kerja dari elektroda EPK dan EPKT. Terlihat bahwa terdapat dua puncak oksidasi pada EPK yaitu puncak oksidasi pertama pada potensial -0,2 V, puncak oksidasi ke dua tidak jelas terlihat karena puncak arus yang ditunjukkan terlalu kecil yaitu pada potensial 0,38 V sedangkan pada puncak reduksi terlihat pada potensial -0,5 V dan 0,3 V. Untuk EPKT terlihat pada potensial 0,5 V puncak oksidasi dan puncak reduksi terlihat pada -0,1 V walaupun tidak terlihat begitu tajam. Terlihat bahwa kurva yang di tampilkan lebih luas dan lebih miring.
Gambar 8. Voltamogram EPK dan EPKT
Hasil pengukuran secara cyclic voltammetry berupa voltamogram. Bentuk yang spesifik dan dipengaruhi oleh variabel analit pada potensiostat yang digunakan sebagai dasar analisis. Puncak arus yang terbentuk pada
-0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 -120 -100 -80 -60 -40 -20 0 20 40 60 80 100 120 Aru s ( A) Tegangan (V) EPK EPKT
16
voltamogram adalah representatif pergerakan elektron yang berkala dari reaksi yang terjadi di permukaan elektroda (Zhang , 2014).
Menurut Jiahua Zhu (2012) pada elektroda grafit menunjukkan nilai densitas arus sangat rendah karena sifat non konduktif dan luas permukaan yang rendah (16,30 m2/g). Setelah ditambahkan dengan polianilin luas permukaan secara signifikan meningkat menjadi 29,26 m2/g dengan puncak pada kedua kurva oksidasi dan reduksi tidak teramati dan malah menjadi lebih luas dan lebih miring. Ini dimungkin karena aglomerasi polianilin yang secara signifikan meningkatkan ketahanan difusi ion elektrolit ke dalam bahan elektroda
PANI sebagai material konduktif bisa menfasilitasi transfer elektron dalam bahan elektroda dan dapat mengurangi hambatan internal untuk mendapatkan kinerja lebih tinggi. Dengan struktur lebih luas dan lebih miring elektroda komposit PANI dan karbon bisa meningkatkan difusi ion dari elektrolit ke elektroda sehingga bisa meningkatkan efisiensi transfer ion dalam elektroda komposit.
Elektroda Bioanoda
Enzim secara biokimia merupakan suatu kelompok protein yang berperan sangat penting dalam proses aktivitas biologis. Berperan sebagai biokatalisator di dalam sel dan bersifat khas (spesifik). Bagian enzim terpenting adalah sisi aktif dari enzim yang akan mengikat substrat spesifik membentuk kompleks enzim-substrat. Selama reaksi katalisis berlangsung, struktur enzim tidak berubah baik sebelum dan sesudah reaksi (Gambar 9), (Shelley, 2012)
Gambar 9 mekanisme pengikatan enzim-substrat (Shelley, 2012) Glukosa oksidase merupakan salah satu enzim yang dapat digunakan sebagai katalis dalam enzymatic fuel cell. Lee et al. (2011) menyatakan bahwa daya yang dapat dihasilkan oleh glukosa oksidase dalam sistem fuel
cell mencapai 190 μW/cm2. Angka ini cukup tinggi dibandingkan daya
yang dihasilkan oleh enzim lain, misalnya glukosa dehidrogenase yang hanya menghasilkan 9.3 μW/cm2. Glukosa oksidase juga memiliki spesifitas tinggi terhadap glukosa (Restu, 2007). Hal ini sangat menguntungkan karena glukosa merupakan substrat yang jumlahnya melimpah serta aman untuk digunakan. Glukosa oksidase diproduksi oleh
17 banyak mikroorganisme salah satunya Aspergillus niger. Glucose oxidase (β-D-glukosa: oxygen 1-oxidoreductase, EC 1.1.3.4) adalah enzim yang mengkatalisis oksidasi ß-D-glukosa menjadi D-glukonolakton oleh Flavin
Adenine Dinucleotide (FAD) sebagai gugus prostetiknya. FAD selanjutnya
memindahkan elektron yang berasal dari glukosa menuju molekul oksigen, dan mereduksi hidrogen peroksida. D-glukonolakton yang dihasilkan kemudian dihidrolisis secara non enzimatik menjadi asam glukonat. (gambar 10) (Yamaguchi et al, 2007).
Gambar 10 struktur 3D Glukosa Oksidase (sumber: pdb.org)
Kelemahan dari enzim adalah sifat enzim yang tidak stabil (rentan terhadap pH dan suhu ekstrem), biaya isolasi maupun pemurnian yang tinggi dan penggunaan enzim kembali terutama enzim (soluble/enzim dalam bentuk larutan). Untuk mengatasi kekurangan dalam hal penggunaan enzim maka dilakukan teknik amobilisasi enzim yaitu enzim yang secara fisik dibuat menjadi tidak bebas bergerak (amobil), sehingga enzim dapat digunakan secara berulang dan dapat dikendalikan kapan enzim harus kontak dengan substrat (Harlander, 2000).
Metode amobilisasi diketahui sangat beragam. Pemilihan metode amobilisasi bergantung pada sifat-sifat enzim yang digunakan. Salah satu metode yang telah banyak digunakan adalah pengikatan silang yang didasarkan pada pembentukan ikatan intermolekuler/kovalen antar molekul enzim dengan menggunakan pereaksi multi atau bifungsional (glutaraldehid), sehingga menghasilkan jaringan protein tiga dimensi yang stabil dan tidak larut dalam air. Amobilisasi enzim ini dapat dipakai berulang dan stabilitasnya lebih terjaga, mudah dipisahkan dari produk karena enzimnya tidak larut/teramobil.
Pembuatan elektroda bioanoda komposit karbon-nanopartikel polianilin yang teramobilisasi glucose oxidase dilakukan pada EPKT yang telah siap digunakan. Selanjutnya enzim glucose oxidase yang di amobil dalam matriks pengikat silang glutaraldehid diteteskan pada permukaan EPKT (Gambar 11). Pencucian dilakukan setelah semua enzim teramobil terserap dalam EPKT. Agar penyerapan sempurna maka tetesan enzim teramobil dibiarkan 12-16 jam dalam lemari es (suhu 4oC). Setelah semua enzim teramobil teserap dan bioanoda dalam keadaan kering, selanjutnya dilakukan pencucian pada permukaan bioanoda, dengan tujuan untuk
18
menghilangkan sisa enzim teramobil yang tidak terserap pada EPKT. Bioanoda tersebut dapat disimpan dalam buffer fosfat pH 5 dalam lemari pendingin suhu 40C dan siap untuk digunakan dalam percobaan selanjutnya.
Gambar 11 Elektroda bioanoda
Simpulan
Telah dibuat elektroda bioanoda komposit karbon-nanopartikel Polianilin yang teramobilisasi Glucose oxidase (GOD) yang akan digunakan pada sistem EFC. Studi elektrokimia menunjukkan bahwa elektroda nanokomposit polianilin pasta karbon bisa meningkatkan efisiensi transfer ion dalam elektroda komposit. Voltamogram yang didapat elektroda nanokomposit PANI-pasta karbon terlihat pada potensial 0,5 V puncak oksidasi dari anilin, dan pada puncak reduksi terlihat pada -0,1 V. Puncak pada kedua kurva oksidasi dan reduksi hampir tidak teramati dengan jelas.
4 KINERJA ENZYMATIC FUEL CELL Pendahuluan
Fuel cell merupakan teknologi elektrokimia yang secara kontinu
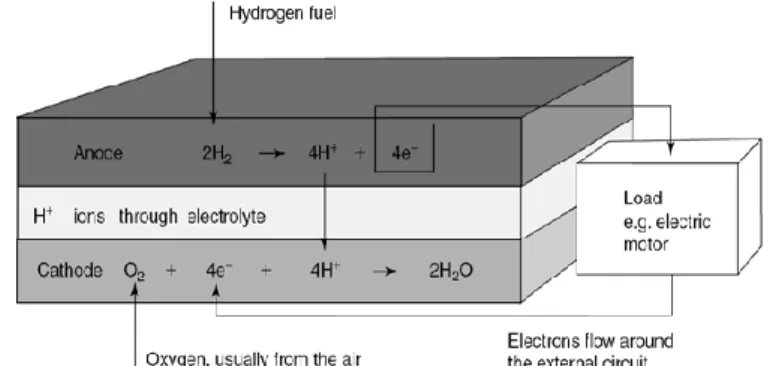
mengkonversi energi kimia menjadi energi listrik dan menggunakan suatu substrat sebagai bahan bakarnya. Prinsip keja fuel cell adalah suatu sel dengan dua elektroda yang dipisahkan oleh elektrolit dan dihubungkan melalui sirkuit eksternal. Untuk menghasilkan energi listrik maka perlu perancangan alat pendukung yang terditi atas: dua buah elektroda, yaitu anoda dan katoda yang dipisahkan oleh Proton Exchange Membran (PEM) sebuah polimer yang permeable yang hanya meloloskan ion proton. Anoda berperan sebagai tempat terjadinya pemecahan hidrogen (H2) menjadi
19 proton dan elektron (listrik). Katoda berperan sebagai tempat terjadinya reaksi penggabungan proton, elektron dan oksigen untuk membentuk air. Elektrolit adalah media untuk mengalirkan ion (Gambar 12).
Gambar 12 Prinsip kerja fuel cell (Sundmacher, 2007)
Biofuel cell atau fuel cell berbasis biologi memiliki konsep yang
sangat berbeda dengan fuel cell pada umumnya. Fuel cell berbasis biologi menggunakan biokatalis untuk mengkonversi bahan kimia menjadi energi listrik. Prinsip kerjanya mengubah sumber bahan bakar dengan mengkonversi energi biokimia menjadi energi listrik melalui proses metabolisme mikroba yang melibatkan sistem enzim. Energi penggerak biofuel cell adalah reaksi redoks dari substrat glukosa. Energi kimia dapat diubah menjadi energi listrik dengan adanya pasangan reaksi oksidasi substrat dengan reaksi reduksi suatu oksidator pada permukaan antara anoda dan katoda. Adanya perbedaan potensial oksidasi pada kedua elektroda menyebabkan elektron dapat mengalir dari anoda ke katoda (gambar 13) (Logan, 2006).
Secara ekonomis biofuel cell merupakan sistem yang relatif lebih murah dan ramah lingkungan. Keunggulan sistem ini dibandingkan dengan fuel cell kimia lain meliputi temperature operasional yang sedang, tidak memerlukan katalis yang mahal. Pada perkembangan selanjutnya, biofuel cell dibagi menjadi dua macam yaitu Microbial Fuel Cell (MFC) dan
Enzymatic Fuel Cell (EFC). MFC memanfaatkan sel mikroorganisme
sedangkan EFC memanfaatkan biomolekul enzim pada proses konversi bahan bakar menjadi energi listrik. MFC menggunakan sel utuh mikroorganisme tanpa harus mengisolasi enzim terlebih dahulu (Shukla et
al, 2004).
Enzymatic Fuel Cell (EFC) prinsip kerjanya mirip dengan fuel cell.
Representasi dari EFC seperti telihat pada gambar 13. Pada anoda terjadi reaksi oksidasi (melepaskan elektron) yang dihasilkan dari glukosa sebagai substratnya. sedangkan katoda terjadi reaksi reduksi (menerima elektron).
20
Gambar 13 Prinsip kerja Enzymatic fuel cell (Zebda, Institut Européen des Membranes)
Anoda : C6H12O6 C6H10O6 + 2e- + 2H+ Katoda : ½ O2 + 2e- + 2H+ C6H10O6 + H2O Overall : C6H12O6 + ½ O2 C6H10O6 + H2O
Dari reaksi diatas atom hidrogen terpecah menjadi 2 H+ dan 2 e- proton mengalir melalui membran sedangkan elektron tidak dapat menembus membran karena membran yang digunakan adalah membran permeable yang hanya bisa meloloskan proton (muatan positif) dan elektron (muatan negatif) tidak bisa melewati membran tersebut, sehingga elektron hanya menumpuk pada anoda. Sedangkan pada katoda terjadi penumpukkan ion bermuatan positif (proton). Apabila anoda dan katoda dihubungkan dengan sebuah penghantar listrik maka akan terjadi pengaliran elektron dari anoda ke katoda sehingga terdapat arus listrik yang akan diukur besar arusnya sebagai output dari sistem EFC. Elektron yang mengalir ke katoda akan bereaksi dengan proton dan oksigen pada katoda membentuk air.
Kompartemen anoda berisikan material organic yaitu glukosa. Penggunaan glukosa sebagai sumber karbon dapat meningkatkan elektrisitas hingga 89% (Rabaey, 2003). Pada kompartemen katoda,terdapat larutan elektrolit yang bersifat konduktif kalium ferrisianida (K3Fe(CN)6) dikenal sangat baik sebagai akseptor elektron dalam sistem EFC. K3Fe(CN)6 merupakan spesies elektroaktif yang mampu menangkap elektron dengan baik dengan harga potensial reduksi standar +3,6 V. Keuntungan terbesar dalam penggunaan kalium ferrisianida adalah dihasilkannya overpotensial yang rendah bila menggunakan elektroda karbon. Akan tetapi kerugian terbesar adalah terjadinya proses reoksidasi yang tidak sempurna oleh oksigen sehingga larutannya harus diganti secara teratur. Kinerja jangka panjang ferrisianida dalam sistem EFC dipengaruhi oleh efisiensi difusinya melewati PEM menuju ruang katoda (Logan, 2006).
Kinerja EFC dapat dipengaruhi oleh beberapa hal menurut Lim et al.
(2005), faktor-faktor yang berpengaruh antara lain kecepatan degradasi
substrat, kecepatan transfer elektron ke anoda dan transfer proton dalam larutan. Faktor lainnyanya adalah komponen penyusun EFC, seperti elektroda (anoda dan katoda) dan membrane penukar proton, serta kelengkapan membran.
21
Bahan dan Metode Bahan
Bahan yang digunakan dalam EFC ini adaah reaktor dual chamber, membran, kawat tembaga, buffer phosfat, glukosa, aquades, kalium ferisianida (K3Fe(CN)6), pH meter, kabel dan jepit buaya, mikroamperemeter, voltmeter.
Metode
EFC pada penelitian ini menggunakan reaktor dual chamber, yaitu terdapat dua buah kompartemen (anoda-katoda),diantara kedua kompartemen terdapat lubang dengan diameter 3 cm untuk dipasangkan membran pemisah yang dapat mengalirkan proton, kemudian elektroda bioanoda dipasang di ruang anoda dan elektroda kawat tembaga ada katoda, dihubugkan dengan rangkaian kabel pada alat digital multimeter. Kemudian diukur arus listrik dan tegangan. Instrumen pengukur kuat arus dan tegangan yang digunakan yaitu mikroampere dan voltmeter (Gambar 14).
Gambar 14 Rangkaian alat EFC
Prosedur kerja yang dilakukan adalah: disiapkan reaktor dual chamber EFC dengan volume masing-masing 50 ml. Pada kompartemen anoda diisi dengan larutan yang terdiri dari 5 ml glukosa yang divariasikan konsentrasi molar (0,25; 0,50; 0,75; 1) 25 mL buffer phosfat 0,1M pH 7,0 dan 10 mL aquades. Sedangkan pada kompartemen katoda diisi dengan 25 mL larutan kalium ferrisianida 0,1 M dan 25 mL buffer fosfat 0,I M pH 7,0 seperti pada Gambar 15. Diamati nilai arus listrik dan tegangan yang tertera pada layar digital multimeter hingga stabil dan dicatat Dari data kuat arus dan tegangan, dapat diperoleh nilai rapat daya (μW/cm2
), yaitu daya per satuan luas permukaan elektroda. Rapat daya (Power density) dapat dihitung menggunakan persamaan 2 berikut (Momoh et al. 2010).
22
Hasil dan Pembahasan
Pada eksperimen ini dilakukan pengukuran kuat arus dan tegangan pada konsentrasi glukosa yang berbeda-beda, dengan menggunakan rangkaian EFC (Gambar 15). Berdasarkan data yang diperoleh nilai kuat arus maksimum dicapai pada konsentrasi glukosa 0,25 M setelah menit ke 100 yaitu 5,05 μA, sedangkan kuat arus maksimum untuk konsentrasi 0,50 M adalah 2,45 μA, untuk konsentrasi 0,75 adalah 1,69 μA dan 1,35 μA untuk konsentrasi 1 M. Selain kuat arus pada percobaan ini juga dilihat pengaruh konsentrasi glukosa terhadap tegangan atau beda potensial antara elektroda anoda dan katoda. Nilai tegangan menurun seiring dengan bertambahnya konsentrasi glukosa, dimana nilai tegangan maksimum sebesar 60,8 mV dicapai, setelah menit ke 90 saat konsentrasi glukosa 0,25 M, sedangkan tegangan maksimum untuk konsentrasi 0,50 M adalah 20,3 mV, untuk konsentrasi 0,75 M adalah 20,8 mV dan 15,4 mV untuk konsentrasi 1 M.
(A) (B)
(C)
Gambar 15 Kinerja EFC pada variasi konsentrasi glukosa. A Pengukuran arus listrik, B Pengukuran Tegangan, C Pengukuran power density -20 0 20 40 60 80 100 120 140 160 180 200 0 1 2 3 4 5 0,25 M 0,50 M 0,75 M 1 M Arus ( A) Waktu (menit) -20 0 20 40 60 80 100 120 140 160 180 200 0 10 20 30 40 50 60 70 0,25 M 0,50 M 0,75 M 1 M T e g a n g a n (mV) Waktu (menit) -20 0 20 40 60 80 100 120 140 160 180 200 0,0 0,1 0,2 0,3 0,4 0,25 M 0,50 M 0,75 M 1 M Pow e r d e n si ty ( W /cm 2) Waktu (menit)
23 Setelah diperoleh nilai kuat arus dan tegangan, dapat dihitung rapat daya (power density) yang dihasilkan per luas permukaan elektroda. Dengan menggunakan persamaan (1) (Momoh et al, 2010), diperoleh hasil bahwa nilai power density maksimum sebesar 0,39 μW/cm2 dicapai pada saat konsentrasi 0,25 M, sedangkan power density untuk konsentrasi 0,50 adalah 0,071 μW/cm2
, untuk konsentrasi 0,75 M adalah 0,044 μW/cm2 dan untuk konsentrasi 1 M adalah 0,026 μW/cm2.
Menurut Trinh et al, (2009) penurunan kuat arus disebabkan oleh kehadiran hidrogen hasil reaksi substrat di sel anoda. Semakin lama konsentrasi hidrogen ini akan meningkat dan akhirnya menutupi seluruh permukaan elektroda di anoda sehingga proses transfer elektron dari substrat ke elektroda menjadi terhalang. Untuk mempertahankan kuat arus pada level yang tinggi, keberadaan hidrogen di anoda harus dihilangkan.
Guerrero-Larrosa (2010) menjelaskan bahwa pada awal pengukuran konsentrasi substrat masih cukup untuk menghasilkan nilai tegangan yang stabil. Kenaikan tegangan disebabkan oleh meningkatnya kecepatan proses reaksi elektrokimia pada EFC. Lapisan yang menempel pada membrane dari substrat sehingga mengakibatkan terjadinya kekurangan proton di katoda sehingga perbedaan potensial yang dihasilkan pun kecil. Penurunan tegangan juga diakibatkan oleh menurunnya aktivitas kalium ferisianida sebagai akseptor elektron di katoda. Semakin lama digunakan, konsentrasi Fe(CN)63- akan menurun akibat peristiwa reoksidasi yang tidak sempurna oleh oksigen. Selain itu konsentrasi buffer fosfat pada kedua kompartemen juga mengalami penurunan. Hal ini mengakibatkan berkurangnya kekuatan ion dan konduktivitas larutan sehingga menyebabkan menurunnya energi listrik (Rengaraj et al, 2011)
Nilai potensial anoda umumnya ditentukan oleh beberapa faktor, antara lain konversi substrat dan laju transfer eletron dan proses amobilisasi enzim pada elektroda anoda. Sedangkan nilai potensial di katoda hanya ditentukan oleh jenis akseptor elektron yang digunakan. Dengan meningkatnya kecepatan nilai arus dan tegangan yang dihasilkan pada awal pengukuran berhubungan dengan laju aktivitas enzim dengan bertambahnya waktu akan menyebabkan berkurangnya produksi energi listrik.
Selain itu meningkatnya kecepatan nilai arus dan tegangan yang dihasilkan pada awal pengukuran berhubungan dengan laju kecepatan reaksi yang terjadi pada EFC, dengan bertambahnya waktu akan menyebabkan berkurangnya produksi energi listrik.
Pada Gambar 16 memperlihatkan pengaruh konsentrasi substrat terhadap arus maksimum yang dihasilkan menunjukkan bahwa konsentari terendah 0,25 M menghasilkan arus maksimum 5,05 µA, kemudian diikuti konsentrasi substrat 0,50 M menghasilkan 2,45 µA, konsentrasi 0,75 M menghasilkan nilai arus maksimum 1,69 µA dan konsentrasi 1 M menghasilkan nilai arus maksimum 1,35 µA. Dapat dikatakan semakin rendah konsentrasi glukosa, nilai arus maksimum yang dihasilkan semakin besar. Berdasarkan hasil yang diperoleh dapat disimpulkan bahwa semakin tinggi konsentrasi glukosa, semakin kecil kemampuan elektroda untuk dapat menghasilkan listrik, atau dapat dikatakan pula bahwa konsentrasi glukosa
24
(0,25 M) merupakan konsentrasi optimum dalam menghasilkan energi listrik.
Gambar 16 Pengaruh konsentrasi substrat terhadap arus maksimum yang dihasilkan
Rendahnya konsentrasi substrat (glukosa) menunjukkan bahwa bioanoda yang membawa/mengandung enzim glukosa oksidase teramobil mempunyai sensitifitas yang tinggi terhadap substrat. Untuk meningkatkan kinerja dari EFC masih perlu dilakukan optimasi terhadap parameter lainnya, seperti pH, suhu. Menurut (Lehninger et al. 2004 beberapa faktor yang mempengaruhi aktivitas enzim adalah pH, suhu, dan konsentrasi substrat dan enzim, serta keberadaan aktivator dan inhibitor.
Simpulan
Energi listrik yang dihasilkan pada sistem EFC memiliki nilai rapat daya maksimum 0,39 μW/cm2 yang dicapai saat konsentrasi glukosa terkecil 0,25 M.
6 PEMBAHASAN UMUM
Pada penelitian ini dibuat EFC dengan mengimobilisasi enzim
Glucose oxidase (GOD) pada elektroda anoda menggunakan matriks
polimer polianilin (PANI) dengan metode ikatan silang (crosslinking) via glutaraldehid dengan glukosa sebagai sumber hidrokarbon sehingga dapat membangkitkan energi listrik.
Kinerja elektroda pada EFC bergantung pada transfer pergerakan elektron, stabilitas dan produk (elektron yang dihasilkan). Elektroda sebagian besar terbuat dari emas, tembaga, platina ataupun karbon. Meskipun elektroda emas pada struktur berlapis telah menunjukkan transfer
0,25 0,50 0,75 1,00 1,25 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0 5,5 Aru s Ma ksi mu m =im a x ( A) Konsentrasi (M)
25 elektron yang efisien dalam berbagai aplikasi, tetapi ada beberapa keterbatasan antara lain jumlah enzim pada elektroda dibatasi hanya pada permukaan (Katz & Willner, 2003). Kitosan memiliki ikatan yang sangat kuat, tetapi memiliki waktu respon yang lambat, membatasi penerapannya dalam perangkat bioelektronika (Subhan et al. 1996). PANI merupakan polimer konduktif yang sangat menjanjikan karena mudah disintesis, monomernya murah dan memiliki stabilitas yang lebih baik dibandingkan polimer konduktif yang lain seperti polipirol (PPy), politiofena dan poli (p-fenilena) (Sahadi 2011).
Nanopartikel polianilin merupakan salah satu polimer konduktif yang bisa digunakan sebagai matriks dalam pembuatan bioanoda dalam aplikasi biofuel cell. Polianilin dapat disintesis melalui metode polimerisasi interfacial antar muka sistem dua fasa larutan organik/air. Produk berupa endapan polianilin dikumpulkan dan dimurnikan melalui filtrasi, kemudian dibilas dengan akuades beberapa kali. Selanjutnya dikeringkan dan diperoleh bubuk polanilin. Bubuk ini kemudian dikarakterisasi dengan SEM memperlihatkan struktur morfologi yang berpori dari permukaan polianilin dengan ukuran partikel sekitar 60 nm. Karakterisasi TEM untuk melihat morfologi lapisan paling tipis sampel, nampak membentuk kelompok atau mengagregasi seperti serat dengan ukuran diameter partikel rata-rata 60-80 nm. Untuk melihat kristalinitas dari polianilin digunakan XRD, hasil difraksi sinar-X memperlihatkan struktur kristal parsial atau semikristalin dari polianilin dengan ukuran rata-rata kristal adalah 10,4 nm. Umumnya pola difraksi yang melebar mengindikasikan urutan struktur kristalinitas polianilin nanokristal. Analisis FTIR mengindikasikan bahwa sampel polianilin yang diperoleh merupakan bentuk polianilin konduktif atau
emeraldine salt (ES).
Penambahan polianilin pada elektroda pasta karbon teramati pada kurva voltamogram secara voltametrik siklik. Puncak oksidasi terjadi pada potensial 0,4 V dan 0,6 V, sedangkan puncak reduksi pada -0,1 V dan 0,8 V, dengan luas permukaan secara signifikan meningkat. Puncak pada kedua oksidasi dan reduksi tidak terlihat begitu tajam.
Menurut Jiahua Zhu (2012) pada elektroda grafit menunjukkan nilai densitas arus sangat rendah karena sifat non konduktif dan luas permukaan yang rendah (16,30 m2/g). Setelah ditambahkan dengan polianilin luas permukaan secara signifikan meningkat menjadi 29,26 m2/g dengan puncak pada kurva kedua oksidasi dan reduksi tidak teramati dan malah menjadi lebih luas dan lebih miring. Ini dimungkin karena aglomerasi polianilin yang secara signifikan meningkatkan ketahanan difusi ion elektrolit ke dalam bahan elektroda
Amobilisasi enzim dilakukan pada elektroda anoda sebagai media transfer produk (elektron) dari permukaan enzim ke permukaan elektroda. Penggunaan enzim glucose oxsidase dalam bentuk larutan kurang ekonomis, karena enzim tersebut tidak dapat dimanfaatkan kembali dalam penggunaannya. Untuk efisiensi penggunaan enzim dalam analisis maupun dalam proses produksi, maka dapat dikembangkan teknik amobilisasi enzim. Amobilisasi enzim dilakukan pada elektroda anoda sebagai media transfer produk (elektron) dari permukaan enzim ke permukaan elektroda. Polianilin
26
(nanopartikel PANI) dengan ukuran partikel yang kecil namun luas permukaannya besar, digunakan sebagai matriks yang dapat mengikat enzim bebas dan mampu menjaga stabilitas aktivitas katalitik enzim dengan lebih baik sehingga dapat digunakan sebagai bahan elektroda yang akan digunakan pada proses reaksi anoda pada EFC.
Enzymatic fuel cell merupakan teknologi elektrokimia yang
mengkonversi energi kimia menjadi listrik. Energi penggerak yang sering disebut enzymatic fuel cell ini merupakan enzim glucose oxsidase yang berperan sebagai biokatalisis. Glucose oxidase juga memiliki spesifitas tinggi terhadap substrat glukosa. Hasil pengamatan diperoleh bahwa konsentrasi glukosa rendah (0,25 M) menghasilkan nilai arus yang tinggi (5,05 μA), namun peningkatan konsentrasi glukosa (0,50 M; 0,75 M; 1 M) menurunkan nilai arus yang dihasilkan (2,45 μA; 1,69 μA; 1,35 μA). Hal yang sama terjadi pada pengamatan nilai tegangan, dengan konsentrasi glukosa rendah (0,25 M) menghasilkan nilai tegangan yang tinggi 60,8 mV, namun nilai tegangan menurun (20,3 mV; 20,8 mV; 15,4 mV) dengan bertambahnya konsentrasi glukosa (0,50 M; 0,75 M; 1 M). Nilai rapat daya
(power density) maksimum diperoleh 0,39 μW/cm2, pada konsentrasi glukosa rendah (0,25 M) dengan peningkatan konsentrasi glukosa (0,50 M; 0,75 M; 1 M) menurunkan nilai rapat daya (0,071 μW/cm2, 0,044 μW/cm2, 0,026 μW/cm2
). Jadi nilai rapat daya (power density) maksimum yang diperoleh pada penelitian ini sebesar 0,39 μW/cm2., masih kecil jika dibandingkan dengan penelitian sebelumnya (Tabel 2)
Tabel 2 Perbandingan Hasil Penelitian
(Yin Song, Florida International University)
Fuel Enzim Elektroda Elektron
Transfer Power density (μW/ cm2) Referensi Ethanol/ H2O2 QHADH/
AOx Pt DET 30 Ramanavicius
et al. (2008)
Glucose/
O2
GOD/ laccase
Graphite MET 50 Chung-Mu YU
et al (2009)
Glucose/
O2
GDH/NB Glass Carbon
/SWNTs DET 100 Saleh et al.
(2011)
Berdasarkan hasil yang diperoleh dapat disimpulkan bahwa semakin tinggi konsentrasi glukosa,semakin kecil kemampuan elektroda untuk dapat