LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KALBE FARMA Tbk.
KAWASAN INDUSTRI DELTA SILICON
JL. M. H. THAMRIN BLOK A3-1, LIPPO CIKARANG, BEKASI
PERIODE 18 JULI –16 SEPTEMBER 2011
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
SARAH NAZILIA ISLAMIDIENA, S.Farm.
1006835513
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DANILMUPENGETAHUANALAM
PROGRAM PROFESI APOTEKER – DEPARTEMENFARMASI
DEPOK
JANUARI 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KALBE FARMA Tbk.
KAWASAN INDUSTRI DELTA SILICON
JL. M. H. THAMRIN BLOK A3-1, LIPPO CIKARANG, BEKASI
PERIODE 18 JULI –16 SEPTEMBER 2011
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
SARAH NAZILIA ISLAMIDIENA, S.Farm.
1006835513
ANGKATAN LXXIII
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM PROFESI APOTEKER – DEPARTEMEN FARMASI
DEPOK
JANUARI 2012
iii
Segala puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat melaksanakan Praktek Kerja Profesi Apoteker di PT. Kalbe Farma Tbk. pada periode 18 Juli – 16 September 2011. Kegiatan Praktek Kerja Profesi Apoteker (PKPA) ini dilaksanakan sebagai salah satu syarat untuk meraih gelar Apoteker, dengan tujuan untuk meningkatkan pemahaman dan mengaplikasikan ilmu yang telah diperoleh selama perkuliahan. Dalam ruang yang terbatas ini, dengan segala kerendahan hati, penulis ingin menyampaikan terima kasih dan rasa hormat kepada:
1. Agung Martupa, S.Farm., Apt. selaku supervisor Process Validation yang telah menyempatkan waktu untuk memberikan arahan dan bimbingan selama menjalankan PKPA di bagian Quality Assurance PT. Kalbe Farma Tbk.
2. Drs. Umar Mansur, M.Sc. selaku pembimbing dari Departemen Farmasi UI yang selalu sabar dan mendukung penulis.
3. Sumarti, S.Si., Apt. selaku Quality Assurance Manager PT. Kalbe Farma Tbk. atas kesempatan yang diberikan untuk dapat menambah pengetahuan dan pengalaman di bidang industri farmasi terutama mengenai Quality Assurance.
4. Prof. Dr. Yahdiana Harahap, Apt., M.S. selaku ketua Departemen Farmasi FMIPA UI
5. Dr. Harmita, Apt selaku ketua Program Profesi Apoteker Universitas Indonesia.
6. Hendry Hermanto, S.Farm., Apt.selaku supervisor Process Validation; Nurulhuda Sofianingrum, S.Farm., Apt., selaku supervisor Post Marketing; Willia Indarwati, S.Farm., Apt., selaku supervisor Cleaning Validation; Clara Sinta, S.Farm., Apt., selaku supervisor Audit Proses; Rosa Lusia W. selaku supervisor Infrastructure Validation; Dwitiya K. R., S.Farm., Apt. selaku supervisor Change Control and Compliance, serta semua pihak yang tidak
iv
7. Seluruh staf dan karyawan PT. Kalbe Farma Tbk. yang telah membantu selama pelaksanaan Praktek Kerja Profesi Apoteker.
8. Seluruh staf pengajar dan tata usaha program Profesi Apoteker UI atas bantuan yang telah diberikan kepada penulis.
9. Keluargaku tercinta Papah, Mamah, Shifa, Syamsul, dan Shafaa atas semua dukungan, kasih sayang, perhatian, kesabaran, dorongan, semangat dan doa yang tidak henti-hentinya.
10. Rekan-rekan PKPA di PT. Kalbe Farma Tbk. yang telah berbagi ilmu, pengalaman, dan juga menghibur selama pelaksanaan PKPA.
11. Seluruh sahabatku dan teman Apoteker Angkatan 73, Departemen Farmasi, FMIPA UI atas dukungan dan kerja sama selama ini.
12. Semua pihak yang telah memberikan bantuan kepada penulis selama penyusunan laporan ini.
Akhir kata, penulis berharap Allah SWT berkenan membalas segala kebaikan semua pihak yang telah membantu. Tak ada gading yang tak retak, penulis pun menyadari penelitian dan penyusunan laporan PKPA ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan kritik dan saran untuk kesempurnaan laporan PKPA ini. Semoga laporan PKPA ini memberikan manfaat bagi pengembangan ilmu pengetahuan dalam dunia farmasi khususnya dan masyarakat pada umumnya
Penulis 2012
v
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2 TINJAUAN PUSTAKA ... 3
2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik ... 6
BAB 3 TINJAUAN KHUSUS PT. KALBE FARMA Tbk. ... 22
3.1 Sejarah PT. Kalbe Farma Tbk. ... 22
3.2 Visi dan Misi PT. Kalbe Farma Tbk. ... 26
3.3 Struktur Organisasi PT. Kalbe Farma Tbk. ... 27
3.4 Tinjauan Usaha PT. Kalbe Farma Tbk. ... 28
3.5 Lokasi dan Tata Ruang PT. Kalbe Farma Tbk. ... 30
3.6 Departemen-Departemen di PT. Kalbe Farma Tbk. Site Cikarang 32 3.7 Pengolahan Purified Water ... 69
3.8 Pengolahan Limbah ... 71
BAB 4 PEMBAHASAN ... 76
4.1 Manajemen Mutu ... 77
4.2 Personalia ... 81
4.3 Bangunan dan Fasilitas ... 84
4.4 Peralatan ... 88
4.5 Sanitasi dan Hygiene ... 90
4.6 Produksi ... 94
4.7 Pengawasan Mutu ... 97
4.8 Inpeksi Diri dan Audit Mutu ... 99
4.9 Penanganan Keluhan terhadap Obat, Penarikan Kembali dan Obat Kembalian ... 101
4.10 Dokumentasi ... 104
4.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 106
vi
vii
Gambar 3.1 Logo PT. Kalbe Farma Tbk. ... 25
Gambar 3.2 Struktur organisasi PT. Kalbe Farma Tbk. site Cikarang ... 27
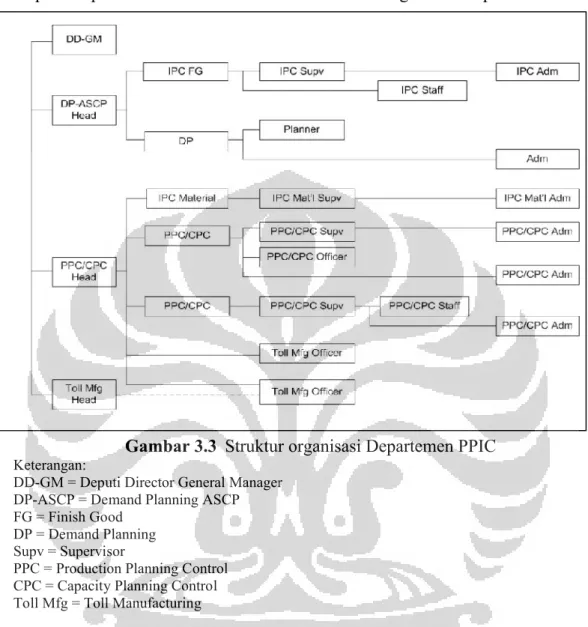
Gambar 3.3 Struktur organisasi Departemen PPIC ... 33
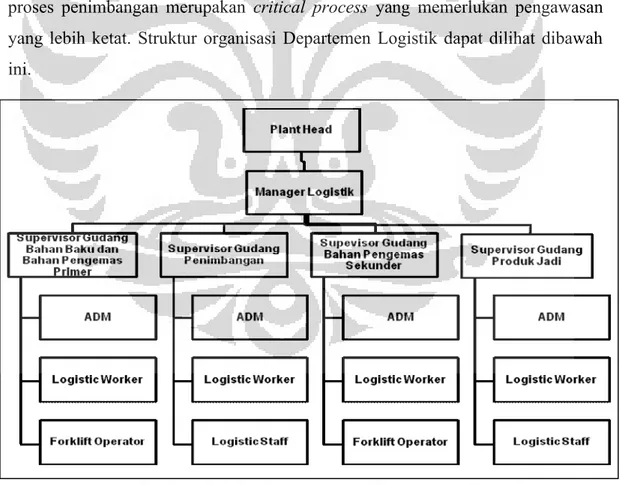
Gambar 3.4 Struktur organisasi Departemen Logistik ... 35
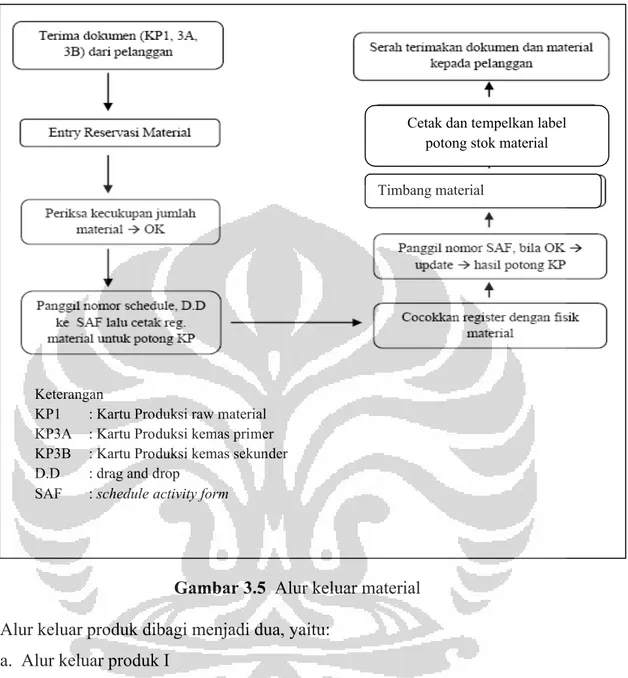
Gambar 3.5 Alur keluar material ... 42
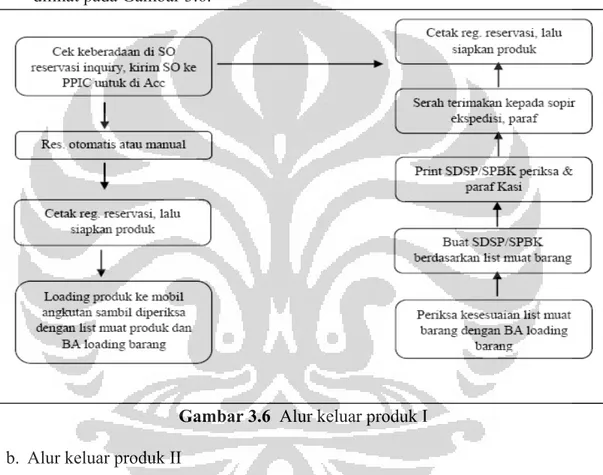
Gambar 3.6 Alur keluar produk I ... 43
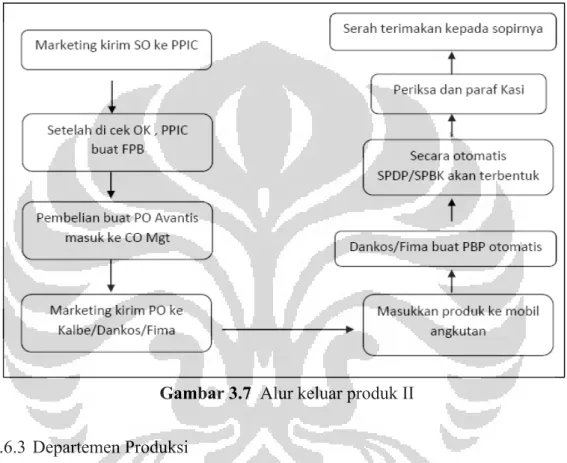
Gambar 3.7 Alur keluar produk II ... 44
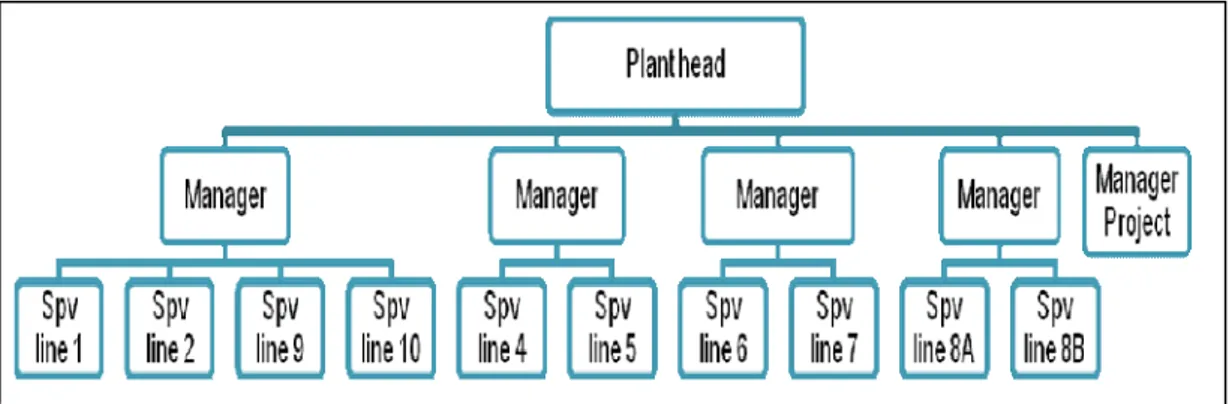
Gambar 3.8 Struktur organisasi Departemen Produksi ... 45
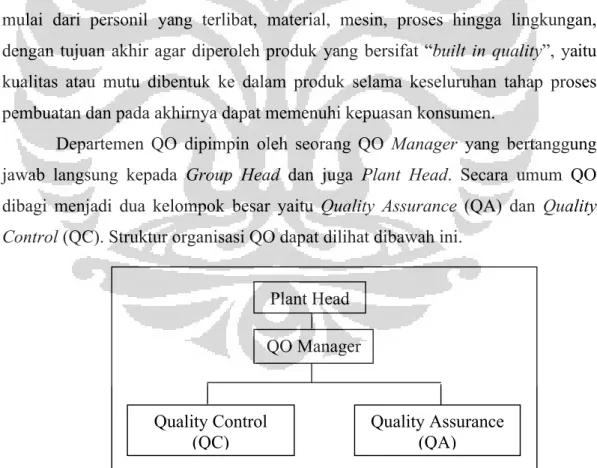
Gambar 3.9 Struktur organisasi Departemen Quality Operation (QO) ... 47
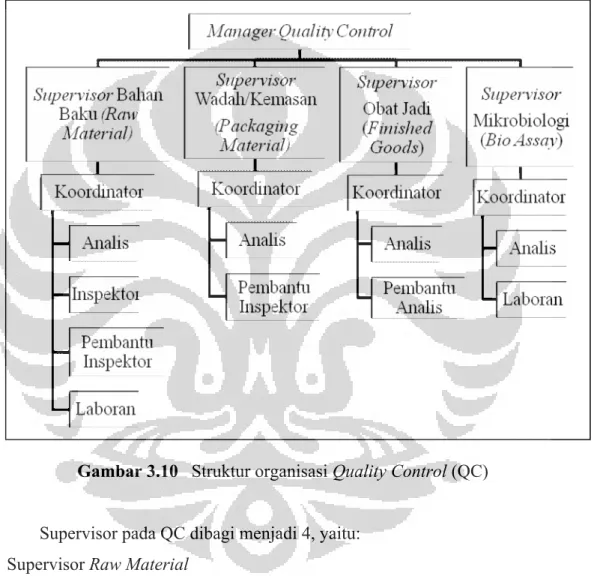
Gambar 3.10 Struktur organisasi Quality Control (QC) ... 48
Gambar 3.11 Struktur organisasi Quality Assurance (QA) ... 50
Gambar 3.12 Struktur organisasi Departemen Quality System (QS) ... 57
Gambar 3.13 Struktur organisasi Departemen R&D ... 60
Gambar 3.14 Struktur organisasi Departemen Process Development ... 62
Gambar 3.15 Struktur organisasi Departemen Teknik ... 66
Gambar 3.16 Alur proses purified water ... 71
1 Universitas Indonesia 1.1 Latar Belakang
Kebutuhan masyarakat akan produk obat yang berkualitas menjadikan industri farmasi sebagai produsen obat bersaing untuk menghasilkan obat yang bermutu. Mutu obat sebagai suatu parameter mencakup berbagai aspek, yaitu aman (safety), berkhasiat (efficacy), dan dapat diterima oleh konsumen (acceptable). Mutu obat harus dibentuk sejak awal mulai dari penanganan bahan awal, proses produksi (pengolahan dan pengemasan), penyimpanan hingga distribusi obat.
Salah satu langkah yang dilakukan pemerintah dalam upaya menjamin mutu obat yang beredar di pasaran tetap baik adalah dengan mengeluarkan Surat Keputusan Menteri Kesehatan RI No.43/Menkes/SK/11/1988 tanggal 2 Februari 1988. Keputusan ini mewajibkan seluruh industri farmasi di Indonesia untuk menerapkan Cara Pembuatan Obat yang Baik (CPOB). Cara Pembuatan Obat Yang Baik (CPOB) adalah pedoman pembuatan obat bagi industri farmasi di Indonesia yang bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan, dan sesuai dengan tujuan penggunaannya. CPOB menyangkut keseluruhan aspek produksi dan pengendalian mutu. Semua industri farmasi harus menerapkan CPOB dalam seluruh aspek dan rangkaian kegiatan pembuatan obat. Pelaksanaan CPOB merupakan tanggng jawab semua pihak yang terlibat dalam pembuatan obat (Badan Pengawas Obat dan Makanan Republik Indonesia, 2006).
Apoteker memegang peranan penting dalam penerapan CPOB di industri farmasi. Seorang apoteker harus mempunyai pengetahuan dan keterampilan yang baik untuk menjamin pelaksanaan CPOB sesuai dengan persyaratan yang telah ditentukan. Apoteker juga dituntut memilki pengetahuan tentang cara produksi obat yang meliputi perencanaan produksi, proses produksi, pengawasan dalam proses produksi, pengetahuan di bidang pengawasan mutu, serta ilmu-ilmu lain yang mendukung.
Untuk menghasilkan tenaga apoteker yang profesional tidak hanya menjadi tanggung jawab pihak perguruan tinggi farmasi saja. Dibutuhkan dukungan dan peran aktif dari berbagai pihak, seperti organisasi profesi, pemerintah, rumah sakit dan industri farmasi dalam rangka pemberian bekal yang menyeluruh secara teori dan praktek sebagai aplikasi ilmu dan teknologi kefarmasian.
Dalam rangka membina apoteker di bidang industri farmasi, PT. Kalbe Farma Tbk. membuka kesempatan bagi calon apoteker untuk melakukan Praktek Kerja Profesi Apoteker (PKPA). Pelaksanaan PKPA di PT. Kalbe Farma Tbk. berlangsung dari tanggal 18 Juli sampai dengan 16 September 2011. Kegiatan ini memberikan kesempatan kepada mahasiswa untuk memperoleh wawasan, pengalaman yang bermanfaat, dan wacana yang luas mengenai peran apoteker dalam produksi obat serta melihat penerapan CPOB di industri farmasi.
1.2 Tujuan
Tujuan dari PKPA yang diselenggarakan oleh Program Profesi Apoteker Departemen Famasi FMIPA UI bekerja sama dengan PT. Kalbe Farma Tbk. adalah:
a. Memperoleh pengetahuan dan wawasan penerapan CPOB di industri farmasi. b. Memahami fungsi dan peran apoteker dalam industri farmasi.
3 Universitas Indonesia 2.1 Industri Farmasi
Berdasarkan Peraturan Menteri Kesehatan Republik Indonesia No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi, industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Industri farmasi dapat melakukan kegiatan proses pembuatan obat dan/atau bahan obat untuk semua tahapan dan/atau sebagian tahapan. Pembuatan obat adalah seluruh tahapan kegiatan dalam menghasilkan obat, yang meliputi pengadaan bahan awal dan bahan pengemas, produksi, pengemasan, pengawasan mutu dan pemastian mutu sampai diperoleh obat untuk didistribusikan. (Kementerian Kesehatan, 2010).
Industri farmasi untuk melaksanakan proses industrinya harus memenuhi ketentuan yang ditetapkan oleh pemerintah. Menurut peraturan Menteri Kesehatan Republik Indonesia No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi, usaha industri farmasi wajib memenuhi persyaratan sebagai berikut:
a. Setiap pendirian Industri Farmasi wajib memperoleh izin industri farmasi dari Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan.
b. Industri Farmasi yang membuat obat dan/atau bahan obat yang termasuk dalam golongan narkotika wajib memperoleh izin khusus untuk memproduksi narkotika sesuai dengan ketentuan peraturan perundang-undangan.
Persyaratan untuk memperoleh izin industri farmasi terdiri atas: a. berbadan usaha berupa perseroan terbatas,
b. memiliki rencana investasi dan kegiatan pembuatan obat, c. memiliki Nomor Pokok Wajib Pajak,
d. memiliki secara tetap paling sedikit 3 (tiga) orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi dan pengawasan mutu,
e. komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
Untuk memperoleh izin industri farmasi diperlukan persetujuan prinsip yang berlaku selama 3 (tiga) tahun. Permohonan persetujuan prinsip diajukan secara tertulis kepada Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan. Dalam hal permohonan persetujuan prinsip dilakukan oleh Industri Penanaman Modal Asing atau Penanaman Modal Dalam Negeri, pemohon harus memperoleh Surat Persetujuan Penanaman Modal dari instansi yang menyelenggarakan urusan penanaman modal sesuai ketentuan peraturan perundang-undangan. Persetujuan prinsip diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan setelah pemohon memperoleh persetujuan Rencana Induk Pembangunan (RIP) dari Kepala Badan Pengawasan Obat dan Makanan. Dalam hal permohonan persetujuan prinsip telah diberikan, pemohon dapat langsung melakukan persiapan, pembangunan, pengadaan, pemasangan dan instalasi peralatan termasuk produksi percobaan dengan memperhatikan ketentuan perundang-undangan.
Setiap pendirian industri farmasi wajib memenuhi ketentuan sebagaimana diatur dalam peraturan perundang-undangan di bidang tata ruang dan lingkungan hidup. Industri Farmasi wajib memenuhi persyaratan CPOB yang dibuktikan dengan sertifikat CPOB. Sertifikat CPOB berlaku selama 5 (lima) tahun sepanjang memenuhi persyaratan. Ketentuan mengenai persyaratan dan tata cara sertifikasi CPOB diatur oleh Kepala Badan Pengawasan Obat dan Makanan. Selain wajib memenuhi ketentuan yang telah disebutkan, Industri Farmasi juga wajib melakukan farmakovigilans.
Izin usaha industri farmasi diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan dengan rekomendasi dari kepala Badan Pengawasan Obat dan Makanan (Badan POM). Izin ini berlaku seterusnya selama perusahaan industri farmasi tersebut berproduksi dan memenuhi ketentuan peraturan perundang-undangan. Industri Farmasi yang akan melakukan perubahan bermakna terhadap pemenuhan persyaratan CPOB, baik untuk perubahan kapasitas dan/atau fasilitas produksi wajib melapor dan mendapat persetujuan sesuai ketentuan perundang-undangan. Untuk industri farmasi Penanaman Modal
Universitas Indonesia Asing (PMA) masa berlakunya sesuai dengan ketentuan dalam UU No. 1 tahun 1967 tentang Penanaman Modal Asing dan peraturan pelaksanaannya.
Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri wajib:
a. Menyampaikan laporan industri secara berkala mengenai kegiatan usahanya yaitu sekali dalam enam bulan, meliputi jumlah dan nilai produksi setiap obat atau bahan obat yang dihasilkan serta sekali dalam satu tahun.
b. Melaksanakan upaya keseimbangan dan kelestarian sumber daya alam serta pencegahan timbulnya kerusakan dan pencemaran terhadap lingkungan hidup akibat kegiatan Industri Farmasi yang dilakukannya;
c. Melaksanakan upaya yang menyangkut keamanan dan keselamatan alat, bahan baku dan bahan penolong, proses serta hasil produksinya termasuk pengangkutannya dan keselamatan kerja;
d. Melakukan Analisa Mengenai Dampak Lingkungan (AMDAL) yang berlaku bagi jenis-jenis industri yang telah ditetapkan dan kewajiban untuk melakukannya setelah memperoleh Izin Usaha Industri Farmasi.
Pelanggaran terhadap ketentuan yang tercantum dalam peraturan Menteri Kesehatan Republik Indonesia No. 1799/Menkes/Per/XII/2010 tentang Industri Farmasi dapat dikenakan sanksi administratif berupa:
a. peringatan secara tertulis (diberikan oleh Kepala BPOM).
b. larangan mengedarkan untuk sementara waktu dan/atau perintah untuk penarikan kembali obat atau bahan obat dari peredaran bagi obat atau bahan obat yang tidak memenuhi standar dan persyaratan keamanan, khasiat, atau mutu (diberikan oleh Kepala BPOM).
c. perintah pemusnahan obat atau bahan obat jika terbukti tidak memenuhi persyaratan keamanan, khasiat atau mutu (diberikan oleh Kepala BPOM). d. penghentian sementara kegiatan (diberikan oleh Kepala BPOM).
e. pembekuan izin industri farmasi (diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala BPOM).
f. pencabutan izin industri farmasi (diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala BPOM).
Izin usaha industri farmasi dapat dicabut dalam hal :
a. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi melakukan pemindahtanganan hak milik Izin Usaha Industri Farmasi dan perluasan tanpa memiliki izin sesuai dengan ketentuan dalam Surat Keputusan ini; dan atau
b. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi tidak menyampaikan informasi industri farmasi secara berturut-turut 3 (tiga) kali atau dengan sengaja menyampaikan informasi yang tidak benar; dan atau c. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi
melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis terlebih dahulu dari menteri; dan atau
d. Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi dengan sengaja memproduksi Obat Jadi atau Bahan Baku Obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku, obat palsu; dan atau
e. Tidak dipenuhinya ketentuan dalam Izin Usaha Industri Farmasi yang ditetapkan dalam Surat Keputusan.
2.2 Cara Pembuatan Obat yang Baik (CPOB)
CPOB merupakan bagian dari sistem pemastian mutu dan seluruh aspek produksi yang berfungsi sebagai pedoman yang sangat penting tidak hanya bagi industri farmasi dan regulator, tetapi juga bagi konsumen dalam memenuhi kebutuhannya akan pengobatan yang aman, berkhasiat dan berkualitas. CPOB bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya.
Pedoman CPOB diterbitkan pertama kali pada tahun 1988, kemudian pada tahun 1989 diterbitkan Petunjuk Operasional Penerapan yang memberikan penjelasan dalam penjabaran sehingga Pedoman CPOB dapat diterapkan secara efektif. Sejalan dengan perkembangan ilmu pengetahuan dan teknologi di bidang farmasi, Pedoman CPOB dan Petunjuk Operasional Penerapan CPOB ini telah direvisi pada tahun 2001. Untuk mengantisipasi era globalisasi dan harmonisasi dalam bidang farmasi, terutama pemenuhan terhadap persyaratan dan standar
Universitas Indonesia produk farmasi global terkini, Pedoman CPOB Edisi 2001 direvisi kembali menjadi Pedoman CPOB yang dinamis pada tahun 2006. Pedoman CPOB edisi 2006 memuat 12 elemen yaitu: Manajemen Mutu, Personalia, Bangunan dan Fasilitas, Peralatan, Sanitasi dan Hygiene, Produksi, Pengawasan Mutu, Inspeksi Diri dan Audit Mutu, Penanganan Keluhan terhadap Produk Penarikan Kembali Produk dan Produk Kembalian, Dokumentasi, Pembuatan dan Analisis Berdasarkan Kontrak, serta Kualifikasi dan Validasi.
2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar, dan tidak menimbulkan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah, atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu kebijakan mutu yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen dalam perusahaan, para pemasok, dan distributor.
Unsur dasar manajemen mutu adalah suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya dan tindakan sistematis untuk mendapatkan kepastian dengan tingkat kepercayaan tinggi, sehingga produk atau jasa pelayanan yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut pemastian mutu. Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan penggunaanya. Sedangkan pengawasan mutu merupakan bagian dari CPOB yang berhubungan dengan pengambilan sampel, spesifikasi dan pengujian, serta dengan organisasi, dokumentasi dan prosedur pelulusan yang memastikan bahwa pengujian yang diperlukan dan relevan telah dilakukan dan bahwa bahan yang belum diluluskan tidak digunakan serta produk yang belum diluluskan tidak dijual atau dipasok sebelum mutunya dinilai dan dinyatakan memenuhi syarat. Setiap industri farmasi hendaklah mempunyai fungsi pengawasan mutu. Pengawasan mutu secara menyeluruh juga mempunyai tugas lain, antara lain menetapkan, melakukan validasi dan menerapkan semua prosedur
pengawasan mutu; mengevaluasi, mengawasi, dan menyimpan baku pembanding; memastikan kebenaran label wadah bahan dan produk; memastikan bahwa stabilitas dari zat aktif dan obat jadi dipantau; mengambil bagian dalam investigasi keluhan yang terkait dengan mutu produk; dan ikut mengambil bagian dalam pemantauan lingkungan.
Di dalam manajemen mutu terdapat pengakajian mutu produk yang dilakukan secara berkala terhadap semua obat terdaftar, termasuk produk ekspor, dengan tujuan untuk membuktikan konsistensi proses, kesesuaian dari spesifikasi bahan awal, bahan pengemas, dan obat jadi, untuk melihat tren dan mengidentifikasi perbaikan yang diperlukan untuk produk dan proses.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pengawasan mutu yang memuaskan dan pembuatan obat yang benar. Oleh karena itu, industri farmasi hendaklah mempunyai personil yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai untuk melaksanakan semua tugas. Jumlah personil di setiap tingkatan hendaklah cukup serta memiliki pengetahuan, keterampilan, dan kemampuan sesuai dengan tugasnya. Personalia dalam industri farmasi hendaklah memiliki juga kesehatan mental dan fisik yang baik sehingga mampu melaksanakan tugasnya secara profesional. Personalia hendaklah mempunyai sikap dan kesadaran tinggi untuk mewujudkan CPOB dan memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai hygiene yang berkaitan dengan pekerjaan. Tiap personil tidak dibebani tanggung jawab yang berlebihan untuk menghindari risiko terhadap mutu obat. Tugas spesifik dan kewenangan diri personil pada posisi penanggung jawab hendaklah dicantumkan dalam uraian tugas tertulis.
Industri farmasi harus memiliki struktur organisasi. Struktur organisasi perusahaan diatur sedemikian rupa sehingga personil kunci yang mencakup kepala bagian produksi, kepala bagian penggunaan mutu dan kepala bagian menajemen mutu harus independen satu terhadap yang lain, dipimpin oleh orang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain dan diberi wewenang penuh dan sarana yang memadai untuk melaksanakan tugasnya.
Universitas Indonesia Hendaklah personil tidak mempunyai kepentingan lain di luar organisasi yang dapat menghambat dan membatasi kewajibannya dalam melaksanakan tanggungjawab atau yang dapat menimbulkan konflik kepentingan pribadi dan finansial. Kepala bagian produksi, pengawasan mutu dan manajemen mutu hendaklah seorang apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugas secara profesional, dimana masing-masing kepala bagian memiliki tanggung jawab bersama dalam menerapkan semua aspek yang berkaitan dengan mutu yang berdasarkan peraturan BPOM.
Pelatihan diberikan kepada seluruh personil yang tugasnya berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk personil teknik, perawatan dan petugas kebersihan) dan dibagi personil lain yang kegiatannya dapat berdampak pada mutu produk. Pelatihan mengenai CPOB hendaklah dilakukan secara berkesinambungan dengan frekuensi yang memadai untuk menjamin agar para karyawan terbiasa dengan persyaratan CPOB yang berkaitan dengan tugasnya. Pelatihan berkesinambungan diberikan dan dinilai secara berkala. Program pelatihan disetujui kepala bagian masing-masing dan catatan pelatihan disimpan. Setelah mengadakan pelatihan, prestasi karyawan hendaklah dinilai untuk menentukan karyawan tersebut telah memiliki kualifikasi yang memadai untuk melaksanakan tugas yang diberikan kepadanya. Pelatihan spesifik hendaklah diberikan kepada personil yang bekerja di area dimana pencemaran merupakan bahaya. Pengunjung dan personil yang tidak mendapat pelatihan hendaklah diberikan pelatihan oleh orang yang terkualifikasi.
Catatan karyawan mengenai CPOB sebaiknya disimpan dan efektivitas program pelatihan hendaklah dinilai secara berkala. Setelah mengadakan pelatihan, prestasi karyawan dinilai untuk menentukan apakah mereka telah memiliki kualifikasi yang memadai untuk melaksanakan tugas yang diberikan kepadanya.
2.2.3 Bangunan dan fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki ukuran, rancangan bangunan, konstruksi, letak serta disesuaikan dengan kondisi yang memadai agar memudahkan pelaksanaan operasi yang benar; pembersihan, sanitasi, dan pemeliharaan yang efektif. Tiap sarana kerja dibuat memadai sehingga dapat memperkecil risiko terjadinya kekeliruan, pencemaran silang, dan berbagai kesalahan lain yang dapat menurunkan mutu obat.
Adapun syarat-syarat bangunan dan fasilitas menurut CPOB adalah sebagai berikut:
a. lokasi bangunan hendaklah sedemikian rupa untuk mencegah terjadinya pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah dan air maupun dari kegiatan di dekatnya;
b. bangunan dan fasilitas hendaklah dikonstruksi, dilengkapi dan dirawat dengan tepat agar memperoleh perlindungan maksimal dari pengaruh cuaca, banjir, rembesan melalui tanah serta masuk dan bersarangnya binatang kecil, tikus, burung, serangga atau hewan lainnya;
c. dalam menentukan rancang bangun dan tata letak hendaklah dipertimbangkan hal-hal sebagai berikut: kesesuaian dengan kegiatan lain, yang mungkin dilakukan dalam sarana yang sama atau dalam sarana yang berdampingan; d. tata letak ruang yang sedemikian rupa untuk memungkinkan kegiatan produksi
dilaksanakan di daerah yang letaknya diatur secara logis dan berhubungan mengikuti urutan tahap produksi dan menurut kelas kebersihan yang disyaratkan; luasnya ruang kerja yang memungkinkan penempatan peralatan dan bahan secara teratur dan logis serta terlaksananya kegiatan, kelancaran arus kerja, komunikasi dan pengawasan yang efektif; pencegahan penggunaan kawasan industri sebagai lalu lintas umum;
e. daerah pengolahan produk steril dipisahkan dari daerah produksi lain serta dirancang dan dibangun secara khusus;
f. obat yang mengandung golongan penisilin dan sefalosporin diproduksi dalam suatu bangunan yang terpisah dilengkapi peralatan pengendali udara;
Universitas Indonesia g. permukaan bagian dalam ruangan (dinding, lantai dan langit-langit) hendaklah
licin, bebas dari keretakan dan sambungan yang terbuka serta mudah dibersihkan dan bila perlu mudah didesinfeksi. lantai dan dinding di daerah pengolahan dibuat dari bahan kedap air, permukaannya rata dan memungkinkan pembersihan secara cepat dan efisien. sudut-sudut antara dinding, lantai dan langit-langit dalam daerah-daerah kritis hendaklah dibentuk lengkungan;
h. saluran air limbah hendaklah cukup besar dan mempunyai bak kontrol serta ventilasi yang baik;
i. bangunan memiliki penerangan yang efektif dan mempunyai ventilasi dengan fasilitas pengendali udara.
2.2.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, sehingga mutu yang dirancang bagi tiap produk obat terjamin secara seragam dari batch ke batch dan memudahkan pembersihan dan perawatannya. Permukaan peralatan yang bersentuhan dengan bahan baku, produk antara, produk ruahan atau obat jadi tidak boleh menimbulkan reaksi, adisi atau absorpsi yang dapat mempengaruhi identitas, mutu atau kemurnian di luar dari batas yang telah ditentukan.
Peralatan sebaiknya dapat dibersihkan dengan mudah, baik bagian dalam maupun bagian luar, serta tidak boleh menimbulkan akibat yang merugikan terhadap produk. Pemasangan dan penempatan peralatan diatur sedemikian rupa sehingga proses produksi dapat berjalan secara efektif dan efisien. Peralatan hendaklah dirawat menurut jadwal yang tepat supaya tetap berfungsi dengan baik dan mencegah terjadinya pencemaran yang dapat mengubah identitas, mutu atau kemurnian produk. Peralatan yang rusak harus dikeluarkan dari area produksi dan pengawasan mutu, atau setidaknya diberi penandaan yang jelas.
2.2.5 Sanitasi dan Hygiene
Tingkat sanitasi dan hygiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan hygiene meliputi personil,
bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat merupakan sumber kontaminasi produk. Sumber kontaminasi potensial hendaklah dihilangkan melalui suatu program sanitasi dan hygiene yang menyeluruh dan terpadu. Sanitasi dan hygiene yang diatur dalam pedoman CPOB terbaru adalah terhadap personalia, bangunan dan peralatan. Prosedur sanitasi dan hygiene hendaklah divalidasi dan dievaluasi secara berkala untuk cukup efektif dan selalu memenuhi persyaratan.
2.2.6 Produksi
Produksi obat hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi). Produksi obat membutuhkan sarana gedung produksi-pengemasan-penyimpanan, material yang memenuhi persyaratan, peralatan yang terkualifikasi dan terkalibrasi, personalia yang terlatih dan berkualitas, proses produksi yang tervalidasi dan dokumen produksi yang sah yang dapat ditelusuri. Mutu suatu obat tidak hanya ditentukan oleh hasil analisa terhadap produk akhir melainkan juga oleh mutu yang dibangun selama tahapan proses produksi sejak pemelihan bahan awal, penimbangan, proses produksi personalia, bangunan, peralatan kebersihan, dan hygiene sampai dengan pengemasan.
Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten. Prosedur produksi dibuat oleh penanggung jawab produksi bersama dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang dihasilkan memenuhi spesifikasi yang telah ditentukan. Prosedur kerja standar hendaklah tertulis, mudah dipahami dan dipatuhi oleh karyawan produksi, serta didokumentasikan. Dokumentasi setiap langkah dilakukan dengan cermat, tepat dan ditangani oleh karyawan yang melaksanakan tugas.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang penting dari CPOB untuk memastikan bahwa produk yang dibuat senantiasa konsisten dan mempunyai mutu yang sesuai dengan tujuan penggunaannya. Keterlibatan dan tanggung
Universitas Indonesia jawab semua pihak yang berkepentingan dalam seluruh rangkaian pembuatan adalah mutlak untuk mencapai sasaran mutu yang ditetapkan mulai dari saat obat dibuat sampai pada distribusi obat jadi. Pengawasan mutu hendaklah mencakup semua kegiatan analisis yang dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini juga mencakup uji stabilitas, program pemantauan lingkungan, pengujian yang dilakukan dalam rangka validasi, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya.
Tiap personil yang bertugas melakukan kegiatan laboratorium hedaklah memiliki pendidikan, mendapat pelatihan dan pengalaman yang sesuai untuk memungkinkan pelaksanaan tugas dengan baik. Personil hendaklah memakai pakaian pelindung dan alat pengaman seperti masker, kacamata pelindung, dan sarung tangan tahan asam atau basa sesuai tugas yang dilaksanakan. Peralatan, instrument dan perangkat lunak terkait hendaklah dikualifikasi atau divalidasi, dirawat dan dikalibrasi dalam selang waktu yang telah ditetapkan dan dokumentasinya disimpan. Prosedur pengujian hendaklah divalidasi dengan memperhatikan fasilitas dan peralatan yang ada sebelum prosedur tersebut digunakan dalam pengujian rutin.
Pengambilan sampel merupakan kegiatan penting dimana hanya sebagian kecil saja dari satu batch yang diambil. Keabsahan kesimpulan secara keseluruhan tidak dapat didasarkan pada pengujian yang dilakukan terhadap sampel yang tidak mewakili satu batch. Mutu suatu batch bahan awal dapat dinilai dengan mengambil dan menguji sampel yang representatif. Jumlah yang diambil untuk menyiapkan sampel representatif hendaklah ditentukan secara statistik dan dicantumkan dalam pola pengambilan sampel. Pengambilan sampel hendaklah dilakukan sedemikian rupa untuk mencegah kontaminasi atau efek lain yang berpengaruh tidak baik terhadap mutu. Semua alat pengambil sampel yang bersentuhan dengan bahan hendaklah bersih.
Sampel pertinggal dengan identitas yang lengkap yang mewakili tiap batch bahan awal dan produk hendaklah disimpan hingga satu tahun setelah
tanggal kadaluarsa. Jumlah sampel pertinggal sekurang-kurangnya dua kali dari jumlah sampel yang dibutuhkan untuk pengujian lengkap, kecuali untuk uji sterilitas. Program uji stabilitas hendaklah dirancang untuk menilai karakteristik stabilitas obat dan untuk menentukan kondisi penyimpanan yang sesuai dan tanggal kadaluarsa. Studi stabilitas hendaklah dilakukan pada produk baru (biasanya dilakukan pada batch pilot), kemasan baru yang berbeda dari standar yang telah ditetapkan, serta pada produk yang mengalami perubahan formula, metode pengolahan, atau sumber bahan awal dan bahan pengemas primer.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian Pengawasan Mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan sebelum produk disetujui untuk didistribusikan. Pengawasan mutu terkait dengan cara berlaboratorium, pengawasan mutu yang baik, yang meliputi aspek bangunan dan fasilitas, organisasi dan personal, peralatan, pereaksi dan media, baku pembanding, spesifikasi dan metoda pengujian, data, pelaporan, dan ketelusuran.
2.2.8 Inspeksi Diri dan Audit Mutu
Inspeksi diri bertujuan untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan Cara Pembuatan Obat yang Baik (CPOB). Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Inspeksi diri hendaklah dilakukan secara rutin dan pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Inspeksi diri meliputi seluruh aspek yang tercantum dalam CPOB, yaitu antara lain personalia, bangunan termasuk fasilitas untuk personil, perawatan bangunan dan peralatan, penyimpanan bahan awal, bahan pengemas dan obat jadi, peralatan, pengolahan dan pengawasan selama proses, pengawasan mutu, dokumentasi, sanitasi dan hygiene, program validasi dan revalidasi, kalibrasi alat
Universitas Indonesia atau sistem pengukuran, prosedur penarikan kembali obat jadi, penanganan keluhan, pengawasan label, hasil inspeksi diri sebelumnya dan tindakan perbaikan. Inspeksi diri dilakukan oleh suatu tim, yang terdiri dari tiga anggota yang berpengalaman dalam bidangnya masing-masing dan memahami CPOB. Anggota tim tersebut dapat dibentuk baik dari dalam atau dari luar perusahaan, tetapi tiap anggota hendaklah bersifat independen dalam melakukan inspeksi. Inspeksi diri dapat dilakukan per bagian sesuai dengan kebutuhan perusahaan, namun inspeksi diri yang menyeluruh dilakukan minimal satu kali dalam setahun. Frekuensi inspeksi diri hendaklah tertulis dalam prosedur tetap inspeksi diri. Setelah inspeksi diri selesai dilaksanakan, perlu ada laporan inspeksi diri dan evaluasi laporan serta tindakan perbaikan.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan.
2.2.9 Penanganan Keluhan terhadap Produk Penarikan Kembali Produk dan Produk Kembalian
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif.
Penarikan kembali produk dapat berupa satu atau beberapa bets atau seluruh bets produk tertentu dari semua peredaran distribusi. Hal ini dilakukan bila terdapat produk yang tidak memenuhi persyaratan kualitas (cacat mutu) bila ada laporan mengenai reaksi yang merugikan yang serius serta beresiko terhadap kesehatan. Penarikan kembali ini dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut. Penarikan kembali produk dilakukan oleh personil yang bertanggung jawab untuk melaksanakan dan mengkoordinasikan penarikan kembali produk dan hendaklah ditunjang oleh staf yang memadai untuk
menangani semua aspek penarikan kembali sesuai dengan tingkat urgensinya. Personil tersebut hendaklah independen terhadap bagian penjualan dan pemasaran. Keputusan penarikan kembali produk dapat diprakarsai oleh industri farmasi atau atas perintah Otoritas Pengawasan Obat, serta secara intern hendaklah datang dari Kepala Bagian Manajemen Mutu (Pemastian Mutu) dan manajemen perusahaan.
Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, kadaluarsa, atau alasan lain misalnya kondisi wadah yang dapat menimbulkan keraguan akan identitas, mutu, jumlah dan keamanan obat yang bersangkutan. Berdasarkan hasil evaluasi, produk kembalian dapat dikategorikan sebagai berikut:
a. Produk kembalian yang masih memenuhi spesifikasi dan karena itu dapat dikembalikan ke dalam persediaan;
b. Produk kembalian yang dapat diproses ulang;
c. Produk kembalian yang tidak memenuhi spesifikasi dan tidak dapat diproses ulang.
Produk kembalian yang tidak dapat diolah ulang hendaklah dimusnahkan. Prosedur pemusnahan bahan atau pemusnahan produk yang ditolak hendaklah disiapkan. Prosedur ini mencakup tindakan pencegahan terhadap pencemaran lingkungan dan penyalahgunaan bahan atau produk oleh orang yang tidak mempunyai wewenang. Pemusnahan produk harus didokumentasikan, mencakup berita acara pemusnahan yang diberi tanggal dan ditandatangani oleh personil yang melaksanakan dan personil yang menyaksikan pemusnahan.
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, Dokumen Produksi Induk/Formula Pembuatan, prosedur, metode dan instruksi, laporan dan catatan
Universitas Indonesia harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu. Dokumen spesifikasi yang diperlukan yaitu spesifikasi bahan awal, bahan pengemas dan produk jadi yang disahkan dengan benar dan diberi tanggal; jika perlu tersedia juga spesifikasi bagi produk antara dan produk ruahan. Spesifikasi bahan awal dan bahan pengemas mencakup deskripsi bahan, petunjuk pengambilan sampel dan pengujian atau prosedur rujukan, persyaratan kualitatif dan kuantitatif dengan batas penerimaan, kondisi penyimpanan dan tindakan pengamanan, serta batas waktu penyimpanan sebelum dilakukan pengujian kembali. Spesifikasi produk antara dan produk ruahan hendaklah tersedia apabila produk tersebut dibeli atau dikirim, atau apabila data dari produk antara digunakan untuk mengevaluasi produk jadi. Spesifikasi produk antara dan produk ruahan hendaklah mirip dengan spesifikasi bahan awal atau produk jadi sesuai keperluan. Spesifikasi produk jadi mencakup nama produk yang ditentukan dan kode referan (kode produk), formula/komposisi atau rujukan, deskripsi bentuk sediaan dan uraian mengenai kemasan, termasuk ukuran kemasan, petunjuk pengambilan sampel dan pengujian atau prosedur rujukan, persyaratan kualitatif dan kuantitatif dengan batas penerimaan, kondisi penyimpanan dan tindakan pengamanan khusus, serta masa edar atau simpan.
Dokumen yang termasuk dalam dokumen produksi adalah Dokumen Produksi Induk, Prosedur Produksi Induk dan Catatan Produksi Bets. Dokumen Produksi Induk berisi formula produksi dari suatu produk dalam bentuk sediaan dan kekuatan tertentu, tidak tergantung dari ukuran bets. Prosedur Produksi Induk terdiri dari dua dokumen, yaitu Prosedur Pengolahan Induk dan Prosedur Pengemasan Induk. Masing-masing prosedur tersebut berisi prosedur pengolahan dan prosedur pengemasan yang rinci untuk suatu produk dengan bentuk sediaan, kekuatan dan ukuran bets spesifik. Catatan Produksi Bets, terdiri dari Catatan Pengolahan Bets dan Catatan Pengemasan Bets, yang berisi semua data dan informasi yang berkaitan dengan pelaksanaan produksi dari suatu bets produk.
Dokumen Produksi Induk, Prosedur Pengolahan Induk dan Prosedur Pengemasan Induk (Formula Pembuatan, Instruksi Pengolahan dan Instruksi Pengemasan) menyatakan seluruh bahan awal dan bahan pengemas yang digunakan serta menguraikan semua operasi pengolahan dan pengemasan.
Prosedur berisi cara untuk melaksanakan operasi tertentu, misalnya pembersihan, berpakaian, pengendalian lingkungan, pengambilan sampel, pengujian dan pengoperasian peralatan, sedangkan catatan menyajikan riwayat tiap bets produk, termasuk distribusinya dan semua keadaan yang relevan yang berpengaruh pada mutu produk akhir. Prosedur dan catatan mencakup penerimaan, pengambilan sampel, pengujian dan lain-lain. Menurut CPOB, hendaklah tersedia prosedur tertulis dan catatan penerimaan untuk tiap pengiriman tiap bahan awal, bahan pengemas primer dan bahan pengemas cetak. Selain itu, hendaklah tersedia prosedur tertulis untuk pengambilan sampel yang mencakup personil yang diberi wewenang mengambil sampel, metode dan alat yang harus digunakan, jumlah yang harus diambil dan segala tindakan pengamanan yang harus diperhatikan untuk menghindarkan kontaminasi terhadap bahan atau segala penurunan mutu. Pengujian bahan dan produk yang diperoleh dari tiap tahap produksi juga memerlukan prosedur tertulis yang menguraikan metode dan alat yang harus digunakan dalam pengujian.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak dilakukan jika suatu perusahan membuat produk di perusahaan lain atau sebaliknya. Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dengan penerima kontrak harus dibuat secara jelas dalam hal tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh Kepala Bagian Manajemen Mutu (Pengawasan Mutu).
Universitas Indonesia 2.2.12 Kualifikasi dan Validasi
Validasi adalah tindakan pembuktian dan dokumentasi bahwa seluruh proses, prosedur atau metode memberikan hasil yang konsisten dan terpercaya. Validasi dibagi empat, yakni validasi pembersihan, validasi metode analisis, validasi proses dan validasi ruangan.
2.2.12.1 Perencanaan validasi
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV). RIV sekurang-kurangnya memuat:
a. Kebijakan validasi
b. Struktur organisasi kegiatan validasi
c. Ringkasan fasilitas, sistem, peralatan dan proses yang akan divalidasi
d. Format dokumen: format protokol dan laporan validasi, perencanaan dan jadwal pelaksanaan
e. Pengendalian perubahan
f. Acuan dokumen yang digunakan 2.2.12.2 Dokumentasi
Protokol validasi tertulis hendaklah dibuat untuk merinci kualifikasi dan validasi yang akan dilakukan. Protokol hendaklah diuji dan disetujui oleh kepala bagian manajemen mutu. Setelah kualifikasi selesai dilaksanakan hendaklah diberikan persetujuan tertulis untuk dapat melaksanakan tahap kualifikasi dan validasi selanjutnya.
2.2.12.3 Kualifikasi
Kualifikasi didefinisikan sebagai tindakan pembuktian dan dokumentasi bahwa seluruh sistem dan peralatan dipasang dengan sesuai, bekerja dengan baik dan memberikan hasil yang diharapkan. Kualifikasi diklasifikasikan menjadi empat, yaitu kualifikasi desain, kualifikasi instalasi, kualifikasi operasional dan kualifikasi kinerja. KD (kualifikasi desain) adalah suatu tindakan untuk memastikan bahwa desain hendaklah memenuhi ketentuan CPOB dan didokumentasikan. KI (kualifikasi instalasi) adalah suatu tindakan untuk memastikan bahwa peralatan atau sistem penunjang terpasang baik sesuai dengan
spesifikasi yang ditentukan untuk peralatan atau sistem penunjang tersebut. KO (kualifikasi operasional) adalah suatu tindakan untuk memastikan bahwa peralatan atau sistem penunjang telah dapat dioperasikan dengan baik sesuai spesifikasi yang ditentukan. KK (kualifikasi kinerja) adalah suatu tindakan untuk memastikan bahwa peralatan dan sistem penunjang dapat memberikan kinerja atau sesuai dengan spesifikasi yang ditentukan.
2.2.12.4 Validasi proses
Pada umumnya validasi proses dilakukan sebelum produk dipasarkan (validasi prospektif). Dalam keadaan tertentu, jika hal diatas tidak memungkinkan, validasi dapat juga dilakukan selama proses produksi rutin dilakukan (validasi konkuren). Proses yang sudah berjalan hendaklah juga divalidasi (validasi retrospektif). Fasilitas, sistem, dan peralatan yang digunakan hendaklah dievaluasi secara berkala untuk verifikasi bahwa fasilitas, sistem, peralatan dan proses tersebut masih bekerja dengan baik.
Untuk validasi prospektif, 3 (tiga) batch berurutan yang memenuhi parameter yang disetujui dapat diterima telah memenuhi persyaratan validasi proses. Untuk validasi konkuren, produksi rutin dapat dimulai tanpa lebih dahulu menyelesaikan program validasi.
Validasi retrospektif hanya dapat dilakukan untuk proses yang sudah mapan, namun tidak berlaku jika terjadi perubahan formula produk, prosedur pembuatan atau peralatan. Batch yang dipilih untuk validasi retrospektif hendaklah mewakili seluruh batch yang dibuat selama periode pengamatan, termasuk yang tidak memenuhi spesifikasi, dan hendaklah dalam jumlah yang cukup untuk menunjukkan konsistensi proses. Validasi retrospektif memerlukan data dari 10 (sepuluh) sampai 30 (tiga puluh) batch berurutan untuk menilai konsistensi proses, tetapi jumlah batch yang lebih sedikit dimungkinkan bila dapat dijustifikasi.
2.2.12.5 Validasi pembersihan
Validasi pembersihan hendaklah dilakukan untuk konfirmasi efektivitas prosedur pembersihan. Penentuan batas kandungan residu suatu produk, bahan pembersih dan pencemaran mikroba, secara rasional hendaklah didasarkan pada
Universitas Indonesia bahan yang terkait dengan proses pembersihan. Biasanya validasi prosedur pembersihan dilakukan hanya untuk permukaan alat yang bersentuhan langsung dengan produk. Hendaklah dipertimbangkan juga bagian alat yang tidak bersentuhan langsung dengan produk. Validasi prosedur pembersihan hendaklah dilakukan dengan melaksanakan prosedur tiga kali berurutan dengan hasil yang memenuhi syarat untuk membuktikan bahwa metode tersebut telah tervalidasi. 2.2.12.6 Pengendalian perubahan
Hendaklah tersedia prosedur tertulis yang merinci langkah yang diambil jika ada usul perubahan terhadap bahan awal, komponen produk, peralatan proses, lingkungan kerja, metode produksi atau pengujian ataupun perubahan yang berpengaruh terhadap mutu atau reprodusibilitas proses. Semua usul perubahan yang dapat mempengaruhi mutu produk atau reprodusibilitas proses hendaklah secara resmi diajukan didokumentasikan dan disetujui.
2.2.12.7 Validasi metode analisis
Tujuan validasi metode analisis adalah untuk mengetahui bahwa metode analisis sesuai dengan tujuan penggunaannya. Validasi metode analisis umumnya dilakukan terhadap uji identifikasi, uji kuantitatif kandungan impurities, uji batas impurities, dan uji kuantitatif zat aktif dalam sampel bahan atau obat atau komponen tertentu dalam obat. Metode analisis lain seperti uji disolusi untuk obat atau penentuan ukuran partikel untuk bahan baku aktif hendaklah juga divalidasi. 2.2.12.8 Uji Identifikasi
Uji identifikasi bertujuan untuk memastikan identitas analit dalam sampel. Uji ini biasanya dilakukan dengan membandingkan karakteristik sampel (misalnya spektrum, profil kromatogram). Pengujian kemurnian (impurity) dapat dilakukan melalui uji kuantitatif atau uji batas kemurnian (impurity) dalam sampel. Tujuannya untuk merefleksikan secara tepat karakteristik kemurnian dari sampel. Penetapan kadar bertujuan untuk menentukan kadar analit dalam sampel. Validasi ulang mungkin diperlukan saat ada perubahan sintesis bahan aktif, perubahan komposisi produk jadi, dan perubahan metode analisis.
PT. KALBE FARMA Tbk.
3.1 Sejarah PT. Kalbe Farma Tbk.
PT. Kalbe Farma Tbk. didirikan pada tanggal 10 September 1966 di sebuah garasi rumah di Jalan Simpang I No. 1, Tanjung Priok, Jakarta Utara oleh seorang farmakolog bernama dr. Boenjamin Setiawan. Nama Kalbe menunjuk pada nama para pemegang saham awal yaitu Khow Sioe Tjiang, Liem Lian Kiok, dan Boenjamin Setiawan. Tujuan pendirian PT. Kalbe Farma Tbk. adalah untuk berpartisipasi dalam pembangunan nasional pada umumnya dan meningkatkan kesejahteraan serta derajat kesehatan masyarakat pada khususnya yang tercermin dalam motto perusahaan PT. Kalbe Farma Tbk. yaitu “Mengabdikan Ilmu untuk Kesehatan dan Kesejahteraan”. Pada tanggal 24 Desember 1966 PT. Kalbe Farma Tbk. baru memperoleh ijin produksi dari Direktorat Jenderal Pengawasan Obat dan Makanan (DitJen POM) dan pada awal tahun 1967 PT. Kalbe Farma Tbk. mulai melaksanakan produksinya. Produk pertama yang dihasilkan oleh PT. Kalbe Farma Tbk. adalah gel untuk luka dengan merek Bioplacenton®.
Pada bulan April 1972 PT. Kalbe Farma Tbk. melakukan perluasan usaha dengan memindahkan kegiatan usahanya ke lokasi yang lebih luas di Jalan Ahmad Yani, Pulomas, Jakarta Timur. Kemudian pada tanggal 15 Agustus 1974, berdasarkan surat Keputusan Badan Koordinasi Penanaman Modal No. 352/BKPM/VII/74/PMDN, PT. Kalbe Farma Tbk. memperoleh status PMDN. Tahun 1976 unit perkantoran yang baru mulai digunakan dan tahun 1978 didirikan gedung Sediaan Padat Non-Steril (SPNS). Sejak tahun 1980 aktivitas distribusi produk dipisahkan dari kegiatan industrinya dengan didirikannya PT. Enseval Putra Megatrading sebagai distributor tunggal PT. Kalbe Farma Tbk. Tahun 1994, PT. Kalbe Farma Tbk. membangun pabrik baru di kompleks industri Delta Silicon (Cikarang). Semua jalur produksi dipindahkan secara bertahap dari Pulomas ke Cikarang pada tahun 1997 sampai dengan tahun 1998. Pabrik baru tersebut diresmikan pada tanggal 17 Desember 1998 bersamaan dengan
Universitas Indonesia diterimanya sertifikat ISO 9001 yang lebih menekankan pada kepuasan pelanggan terhadap produk yang dihasilkan. Pabrik baru PT. Kalbe Farma Tbk. memiliki luas area 105.130 m2dengan luas bangunan sekitar 41.027 m2.
Pada tanggal 30 Juli 1991, PT. Kalbe Farma Tbk. untuk pertama kali tercatat di Bursa Efek Jakarta dan Surabaya dengan tujuan memberikan kesempatan kepada masyarakat umum untuk ikut memiliki industri ini sekaligus menanamkan sahamnya di PT. Kalbe Farma Tbk. Dalam rangka memperkuat persaingan bisnis industri farmasi PT. Kalbe Farma Tbk. melakukan akuisisi perusahaan seperti PT. Bintang Toedjoe (1990), Dankos Laboratories (1992), Hexpharm Jaya (1993), Saka Farma (1997), Merek Dagang Woods® (1997), Baxter Kalbe (1999), dan PT. Erbapharma Internasional (2000). Untuk mendukung proses produksi dan mencegah ketergantungan kebutuhan bahan pengemas, PT. Kalbe Farma Tbk. melakukan akuisisi terhadap perusahaan packaging, yaitu PT. Avesta Continental Pack yang memproduksi bahan kemas fleksibel termasuk blister dan strip obat padat, juga untuk industri makanan, agrokimia, dan industri kosmetik. Bahan pengemasan sekunder seperti dus, corg box, dan master box disuplai oleh PT. Kageo, sedangkan sebagian kecil kemasan lain (kemasan primer tertentu) masih bergantung pada produk impor. PT. Kalbe Farma Tbk. menyadari bahwa pengembangan pasar farmasi tidak dapat hanya bergerak sendiri karena adanya keterbatasan dalam hal teknologi, pengetahuan, serta modal. Oleh karena itu, PT. Kalbe Farma Tbk. mulai menerapkan metode perjanjian lisensi dengan beberapa perusahaan farmasi dunia seperti Pharmacia Corporation, Daiichi Pharmaceutical, Fujisawa Pharmaceutical, dan Pfizer, Inc.
PT. Kalbe Farma Tbk. dan anak perusahaannya telah menyelesaikan perencanaan strategis secara menyeluruh untuk periode tahun 2000-2002 pada bulan September 2000. Secara umum dapat dijelaskan bahwa usaha farmasi akan difokuskan pada kategori obat tertentu melalui unit usaha tertentu, seperti induk perusahaan PT. Kalbe Farma Tbk. akan berkonsentrasi pada bidang kardiovaskular, onkologi, anti infeksi, saluran pencernaan, dan susunan saraf pusat; Baxter Kalbe akan terfokus pada kebutuhan rumah sakit; induk Dankos akan terfokus pada bidang saluran pernafasan, saluran pencernaan, kulit dan anti
infeksi; Bintang Toedjoe dan Saka Farma akan terfokus pada obat OTC; dan Hexpharm Jaya akan terfokus pada obat generik dan obat kombinasi sederhana.
Pada tahun 2000, PT. Kalbe Farma Tbk. memiliki sekitar 1.400 tenaga pemasaran yang tersebar di 52 cabang perwakilan dan memiliki tugas melayani kebutuhan di seluruh provinsi di Indonesia sehingga dapat memungkinkan PT. Kalbe Farma Tbk. menguasai target pasar sekitar 12,8% dari total pasar farmasi Indonesia. Pada saat ini PT. Kalbe Farma Tbk. telah memasuki 28 negara termasuk empat kantor perwakilan Kalbe di Srilanka, Malaysia, Myanmar, Vietnam, dan Afrika Selatan yang menyumbangkan 9% dari penjualan tahunan. Pasar internasional utama berasal dari Nigeria, Malaysia, Singapura, Srilanka, Myanmar, Afrika Selatan, dan Zimbabwe.
Di akhir tahun 2004, PT. Kalbe Farma Tbk. berhasil melakukan integrasi sertifikat ISO 9001 (Sistem Quality Management) versi 2000, sertifikat ISO 14001 (Sistem Manajemen Lingkungan), dan OHSAS 18001/SMK3 (Sistem Manajemen Kesehatan dan Keselamatan Kerja) setelah menyelesaikan audit ketiga sistem tersebut secara bersamaan pada bulan Oktober 2004.
Pada bulan November 2005, PT. Kalbe Farma Tbk. melakukan penggabungan tiga perusahaan yaitu PT. Enseval Putra Megatrading, PT. Dankos Laboratories Tbk., dan PT. Kalbe Farma Tbk. Alasan dan tujuan dilakukannya kebijakan penggabungan tiga perusahaan tersebut agar secara operasional kinerja perusahaan menjadi lebih efisien, hemat biaya, daya tarik terhadap investor lebih besar, dan peluang akses kepada lembaga pendanaan juga lebih besar.
Pada tahun 2006, PT. Kalbe Farma Tbk. berhasil mencatat laba bersih sebesar Rp 677 miliar atau bertumbuh sebesar 8,06% jika dibandingkan dengan laba bersih tahun 2005 sebesar Rp 626 miliar. Pada bulan Maret 2007, PT. Kalbe Farma Tbk. melakukan perubahan logo perusahaan, dengan tag line yang baru yaitu ilmu pengetahuan untuk memperkaya kehidupan (Life Enriching Science). Logo perusahaan yang baru dapat dilihat pada gambar berikut :
Universitas Indonesia Gambar 3.1 Logo PT. Kalbe Farma Tbk.
Helix DNA yang asli sebagai simbol komitmen Kalbe yang tertuang dalam motto “mengabdikan ilmu untuk kesehatan dan kesejahteraan”, menggambarkan helix tersebut sebagai dua orang mengandung makna sebagai gambaran fokus Perseroan terhadap masyarakat, kepedulian, dan rasa berbagi. Warna hijau sejak awal telah disosialisasikan oleh Kalbe sejak Perseroan berdiri dan melambangkan kehidupan, pertumbuhan, dan inovasi.
Produk-produk OTC yang dihasilkan oleh PT. Kalbe Farma Tbk. dan anak perusahaannya antara lain adalah produk-produk seperti Cerebrofort®, Cerebrovit®, Procold®, Neo-Entrostop®, Kalpanax®, Promag®, Xon-Ce®, Woods®, Handy Clean®, Extra Joss®, Waisan®, Puyer No.16®, Fiber®, Fatigon®, Mixadin®, Mixagrip®, Sakatonik ABC®, Sakatonik ABG®, Sakatonik Liver®, Sakatonik Ginseng®, dan Flugan®. Makanan kesehatan yang dihasilkan PT. Kalbe Farma Tbk. antara lain adalah Milna®, Hepatisol®, Peptisol®, Femafit®, Chil Mil®, dan masih banyak lagi produk kesehatan makanan yang dikelola oleh PT. Sang Hyang Perkasa (SHP).
PT. Kalbe Farma, Tbk. memulai program Direct to Consumer sebagai upaya untuk memberikan layanan yang memiliki nilai tambah bagi konsumen dalam meraih kualitas hidup yang lebih baik. Tujuannya untuk memberikan informasi tentang produk-produk Kalbe kepada komunitas yang dilayani. Kegiatan lain yang dilakukan adalah dengan mengadakan seminar umum untuk meningkatkan kesadaran publik tentang pola penyakit dan membangun database untuk penggunaan obat bebas.
3.2 Visi dan Misi PT. Kalbe Farma Tbk.
Visi PT. Kalbe Farma Tbk. adalah ”Menjadi perusahaan perawatan kesehatan Indonesia terbaik dimotori oleh inovasi, nama dagang yang kuat, dan manajemen yang kuat”. Untuk mencapai visi tersebut, PT. Kalbe Farma Tbk. menetapkan misi perusahaan yakni “Meningkatkan kesehatan untuk kehidupan yang lebih baik”. Misi tersebut terfokus pada tiga elemen utama, yaitu:
a. Konsumen
PT. Kalbe Farma Tbk. mampu menyediakan produk berkualitas dengan harga murah dan terjangkau, mudah diperoleh, serta dengan pelayanan yang prima untuk menyenangkan hati pelanggan agar menjadi pilihan pertama konsumen. b. Sumber Daya Manusia (SDM)
PT. Kalbe Farma Tbk. mampu mewujudkan SDM yang sesuai dengan kualifikasi dan tuntutan pekerjaan, memiliki dedikasi tinggi, inovatif, berorientasi pada pelayanan dan kualitas, serta pengembangan SDM melalui proses belajar yang berkelanjutan dan lingkungan kerja yang sehat dan mendukung.
c. Proses dan Kualitas
PT. Kalbe Farma Tbk. mampu meningkatkan kecepatan dan efisiensi proses kerja melalui sistem dan prosedur kerja yang rapi sesuai dengan perencanaan, usaha, pemeriksaan, dan aksi (plan, do, check, and action/PDCA). Visi dan misi tersebut didukung oleh nilai-nilai utama yakni gigih untuk mencapai yang terbaik, inovasi, kerjasama yang kokoh, lincah, memberikan pelayanan terbaik kepada pelanggan, serta integritas. Dalam mencapai visi dan misi tersebut, PT. Kalbe Farma Tbk. memiliki moto “The Scientific Pursue of Health For A Better Life” (Mengabdikan Ilmu Untuk Kesehatan dan Kesejahteraan).
Visi dan misi tersebut turut didukung oleh core values (Kalbe Panca Sradha), yaitu:
a. Trust is the glue of life
Saling percaya adalah perekat diantara kami b. Mindfulness is the foundation of our action
Universitas Indonesia c. Innovation is the key to our success
Inovasi adalah kunci keberhasilan kami d. Strive to be the best
Bertekad untuk menjadi yang terbaik
e. Interconnectedness is a universal way of life Saling keterkaitan adalah panduan hidup kami
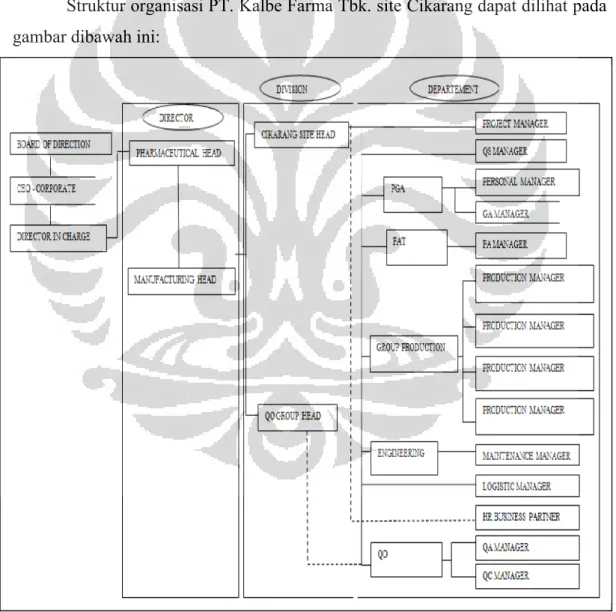
3.3 Struktur Organisasi PT. Kalbe Farma Tbk.
Struktur organisasi PT. Kalbe Farma Tbk. site Cikarang dapat dilihat pada gambar dibawah ini:
3.4 Tinjauan Usaha PT. Kalbe Farma Tbk.
3.4.1 Divisi Produk Kesehatan
Terdapat tiga jenis produk kesehatan yang ditawarkan oleh PT. Kalbe Farma Tbk. yaitu obat bebas, produk nutrisi dan produk minuman energi. Produk obat bebas ditujukan untuk keluarga yang diperkirakan memiliki keterbatasan untuk memperoleh layanan kesehatan profesional. Sedangkan, produk nutrisi yang ditawarkan adalah produk-produk yang digunakan untuk mendukung kesehatan dengan sasaran pasar masyarakat di semua kelompok usia, seperti susu bayi dan anak-anak, ibu hamil dan menyusui, beberapa kebutuhan khusus kaum manula serta biskuit dan sereal bayi. Produk minuman energi yang ditawarkan didominasi oleh Extra Joss®dengan sasaran konsumen adalah kaum pekerja.
Di negara berkembang dengan populasi yang tinggi seperti Indonesia produk obat bebas berperan penting dalam rumah tangga yang disebabkan oleh adanya keterbatasan dalam memperoleh pelayanan kesehatan yang profesional. Saat ini PT. Kalbe Farma Tbk. telah menempati posisi puncak dalam beberapa sub-segmen pasar dengan merek terkemuka yang menjadi andalan keluarga. Pencapaian ini membuat Kalbe menjadi produsen obat bebas terbesar di Indonesia.
Beberapa merek yang menjadi pemimpin masing-masing kategori produk adalah Promag® (obat sakit maag), Neo-Entrostop® (anti-diare), Woods® dan Komix® (obat batuk), Procold® dan Mixagrip® (obat flu), Fatigon®, Cerebrovit® dan Cerebrofort® (multivitamin). Produk nutrisi PT. Kalbe Farma Tbk. telah memperoleh posisi pasar yang kuat di industri. Beberapa produk nutrisi andalan PT. Kalbe Farma Tbk. adalah Prenagen®(nutrisi kehamilan), Milna® (biskuit dan sereal bayi), BMT®, Chil Mil®, Chil Kid®dan Chil School®(susu bayi dan balita). Selain itu, PT. Kalbe Farma Tbk. menyediakan special clinical food, Diabetasol®, yang telah mendominasi pasar. Awalnya produk ini diproduksi dengan perjanjian subkontrak dengan pihak ketiga. Sekarang diproduksi oleh pabrik baru Kalbe Morinaga yang mulai beroperasi pada April 2007.
Universitas Indonesia 3.4.2 Divisi Obat Etikal
PT. Kalbe Farma Tbk. memiliki produk dalam beragam kategori terapi yang terdiri dari obat-obatan berlisensi, generik bermerek dan generik yang berjumlah lebih dari 280 jenis obat. Pada saat ini, PT. Kalbe Farma Tbk. merupakan produsen obat etikal terbesar di Indonesia. Pada tahun 2007, PT. Kalbe Farma Tbk. memperkenalkan lebih dari 30 produk obat etikal baru. Selama ini, PT. Kalbe Farma Tbk. mengandalkan inovasi dalam riset dan pengembangan untuk memproduksi produk obat generik bermerek, juga menjalin aliansi strategis dengan produsen farmasi dengan reputasi internasional untuk produk yang masih dilindungi paten.
Sejak tahun 2004, PT. Kalbe Farma Tbk. melakukan teknik baru dalam pengembangan produk, dengan dibentuknya Innogene Kalbiotech yang bergerak di bidang riset bioteknologi. Setelah dua tahun beroperasi, Kalbe memperkenalkan produk pertamanya yaitu Kalsolac®, obat dalam bentuk cairan steril yang digunakan pada fase pemulihan pasca bedah jantung dan cedera otak traumatis. Untuk fase pemulihan pasca-bedah jantung, obat ini dipasarkan di Indonesia dengan merek Totilac®. Untuk indikasi cedera otak traumatis dilakukan pengujian pada hewan di Amerika Serikat pada tahun 2007 seiring dengan pengurusan paten. Produk lainnya adalah TheraCIM®, antikanker antibodi monoklonal yang digunakan untuk mengobati kanker otak serta kanker hidung dan tenggorokan.
Kalbe Vision yang khusus bergerak dalam pengembangan dan pemasaran produk perawatan mata yang inovatif telah memperkenalkan solusi menyeluruh untuk tindakan operasi katarak yang terdiri dari Rayner® Intraocular Lens (IOL), Lipimix® tetes mata sekali pakai yang digunakan pasien setelah tindakan operasi katarak dan LASIK serta untuk pasien yang mengalami erosi kornea. Selain itu, diperkenalkan Vitadrop®, tetes mata bervitamin dan bebas pengawet untuk mengatasi rasa kering, iritasi, serta ketidaknyamanan yang disebabkan pemakaian lensa kontak dan lingkungan, NutriVision® nutrisi super antioksidan untuk memelihara kesehatan mata serta mencegah penyakit mata degeneratif.
3.4.3 Divisi Distribusi dan Kemasan
Bisnis distribusi dan kemasan Kalbe Grup telah berangsur-angsur mengalami perubahan orientasi dan skala bisnisnya sehingga tidak hanya memenuhi kebutuhan internal Grup. Divisi Distribusi Kalbe mengelola 40 pusat distribusi di seluruh Indonesia, mencakup lebih dari 1 juta outlet. Kalbe telah dipercaya untuk menangani distribusi produk-produk prinsipal non-afiliasi meliputi produsen farmasi, produk kesehatan serta diagnostik dan instrumen medis dan bahan baku kimia. Pada tahun 2007, divisi distribusi melakukan upaya peningkatan pelayanan dan diversifikasi bisnis dengan membentuk Klinik Mitrasana di Kawasan Industri Jababeka 2, sebuah fasilitas kesehatan ekonomis yang terdiri dari klinik, farmasi, laboratorium dan mini market. Divisi kemasan Kalbe menyediakan berbagai jenis kemasan dari bahan fleksibel dan kertas bagi produsen obat, kosmetik, nutrisi dan produk kesehatan lain di Indonesia.
3.5 Lokasi dan Tata Ruang PT. Kalbe Farma Tbk.
PT. Kalbe Farma Tbk. terletak di Kawasan Industri Delta Silicon Jalan M.H. Thamrin Blok A3-1, Lippo Cikarang, Bekasi. Bangunan ini terdiri dari gedung kantor, gedung produksi, teknik, gudang dan sarana pendukung seperti pengolahan limbah, lapangan parkir, koperasi dan kantin. PT. Kalbe Farma Tbk. memiliki kantor pemasaran produk lokal yang terletak di Gedung Enseval Jalan Letjen Suprapto, Cempaka Putih, Jakarta dan kantor pemasaran produk ekspor di Kawasan Industri Pulo Gadung. Bangunan PT. Kalbe Farma Tbk. terdiri dari dua bagian yaitu bangunan kantor dan bangunan pabrik.
3.5.1. Bangunan Kantor
Gedung kantor PT. Kalbe Farma Tbk. terdiri dari empat lantai yaitu: a. Lantai 1 meliputi bagian Operasional Cikarang, bagian Sumber Daya Manusia
dan Pengembangan, Personalia dan Umum, Departemen Process Development, Akuntansi, ruang perpustakaan dan kantin.
b. Lantai 1½ meliputi Departemen Production Planning and Inventory Control Pusat, bagian veteriner, bagian Teknologi Informasi.
Universitas Indonesia c. Lantai 2 meliputi Lantai 2 Departemen Keuangan dan Pemasaran serta bagian
hukum atau legal.
d. Lantai 3 meliputi Departemen R&D Bagian Pengembangan Operasional Cikarang dengan laboratorium Formulasi dan laboratorium Analytical Development, Departemen Pemastian Mutu, Bagian Quality Control dengan Laboratorium Quality Control.
e. Lantai 4 meliputi ruangan penyimpanan sampel uji stabilitas. 3.5.2. Bangunan Pabrik
Gedung produksi terdiri dari tiga lantai yang masing-masing lantai dipisahkan oleh ruang yang disebut mezanin, yaitu ruang khusus untuk penempatan fasilitas utilitas seperti penyedot udara, pipa-pipa, kabel listrik, dan lain-lain. Tiap lantai terdiri dari line-line produksi dengan jumlah total 10 line, yaitu line 1, 2, 4, 5, 6, 7, 8A, 8B, 9 dan 10. Pembagian ruangan pada gedung produksi adalah sebagai berikut:
a. Lantai dasar, digunakan untuk ruang produksi line 9 dan 10, gudang alkohol, Departemen Teknik dan ruang loker karyawan.
b. Lantai 1, digunakan untuk ruang produksi line 1, line 2, line 4, line 5, gudang bahan baku dan wadah, gudang kemas dan gudang obat jadi.
c. Lantai 2, digunakan untuk ruang produksi line 6, line 7 dan line 8 (A, B). Ruang produksi di PT. Kalbe Farma Tbk. dicat dengan cat epoksi agar mudah dibersihkan, dibuat melengkung (tidak memiliki sudut) agar tidak menjadi tempat berkumpulnya debu, serta jendelanya dibuat miring dengan maksud agar mudah dibersihkan dan juga tidak menjadi tempat berkumpulnya debu. Ruangan dalam produksi dibagi menjadi tiga area berdasarkan perbedaan tekanan udara. Tujuan dari pembedaan tekanan ini yaitu untuk mencegah terjadinya kontaminasi silang. Ketiga area tersebut antara lain:
a. Black area (black area)
Area ini meliputi ruang kepala bagian, ruang kepala seksi (kasi), ruang pengemas sekunder, koridor yang menghubungkan gudang obat jadi dan ruang pengemas sekunder, ruang ganti pakaian black area dengan pakaian grey area dan ruang antara black area. Perlengkapan yang digunakan berupa baju dan celana