UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI INDUSTRI FARMASI LANDSON PT. PERTIWI AGUNG
JALAN DDN SUKADANAU CIKARANG BARAT BEKASI
PERIODE 9 SEPTEMBER-7 NOVEMBER 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
SITI DZATIR ROHMAH, S.Farm.
1306502850
ANGKATAN LXXIX
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI INDUSTRI FARMASI LANDSON PT. PERTIWI AGUNG
JALAN DDN SUKADANAU CIKARANG BARAT BEKASI
PERIODE 9 SEPTEMBER-7 NOVEMBER 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
SITI DZATIR ROHMAH, S.Farm.
1306502850
ANGKATAN LXXIX
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI INDUSTRI FARMASI LANDSON PT. PERTIWI AGUNG
JALAN DDN SUKADANAU CIKARANG BARAT BEKASI
PERIODE 9 SEPTEMBER – 7 NOVEMBER 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
SITI DZATIR ROHMAH, S.Farm.
1306502850
ANGKATAN LXXIX
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT karena atas rahmat dan karunia-Nya penulis dapat melaksanakan Praktek Kerja Profesi Apoteker (PKPA) di Landson PT. Pertiwi Agung dan menyelesaikan laporan PKPA ini. Pelaksanaan PKPA dan penulisan laporan PKPA ini diajukan dalam rangka memenuhi salah satu syarat untuk memperoleh gelar Apoteker pada Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia. Pada penulisan laporan ini, penulis mendapat arahan, bantuan, dan bimbingan dari berbagai pihak. Oleh karena itu, penulis ingin menyampaikan terima kasih kepada :
1. Bapak Dr. Mahdi Jufri, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Indonesia.
2. Bapak Dr. Hayun, M.Si, Apt.,selaku Ketua Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia
3. Ibu Rika Sofiani, S.Farm. Apt. dan ibu Verawaty, S.Farm., Apt. selaku pembimbing dari Landson PT. Pertiwi Agung yang telah berbagi ilmu kepada penulis serta membimbing penulis selama pelaksanaan PKPA di Landson PT. Pertiwi Agung dan selama penyusunan laporan ini.
4. Bapak Sutriyo, M.Si., Apt. selaku pembimbing dari Universitas Indonesia yang telah bersedia meluangkan waktunya membimbing penulis selama penyusunan laporan ini.
5. Seluruh direksi, manajer, apoteker, staf, dan karyawan di Landson PT. Pertiwi Agung terutama Departemen Research and Development atas bimbingan, kerjasama dan informasi yang diberikan selama penulis melaksanakan kegiatan PKPA.
6. Seluruh staf pengajar dan bagian Tata Usaha program Profesi Apoteker Fakultas Farmasi Universitas Indonesia, atas ilmu, dukungan, dan bantuan yang telah diberikan kepada penulis selama ini.
7. Kedua orang tua, keluarga dan orang-orang terdekat penulis yang selama ini tidak pernah berhenti memberikan dukungan dan doa.
8. Seluruh rekan sesama Apoteker Angkatan 79 Fakultas Farmasi Universitas Indonesia, atas kerja sama, dukungan, semangat, dan persahabatan yang telah terjalin selama menempuh pendidikan di program profesi apoteker.
9. Semua pihak yang tidak dapat disebutkan satu per satu, atas bantuan dan dukungan yang telah diberikan kepada penulis selama penyusunan laporan ini.
Penulis menyadari bahwa masih terdapat kekurangan dan ketidaksempurnaan di dalam laporan ini. Oleh karena itu, penulis terbuka untuk menerima saran dan kritik yang membangun untuk memperbaiki penulisan laporan penulis ke depannya. Semoga laporan ini dapat bermanfaat, baik bagi diri penulis maupun pihak lain yang terlibat dan membaca laporan ini.
Penulis
ABSTRAK
Nama : Siti Dzatir Rohmah, S.Farm
NPM : 1306502850
Program Studi : Profesi Apoteker
Judul : Laporan Praktek Kerja Profesi Apoteker di Industri Farmasi Landson PT. Pertiwi Agung Jalan DDN Sukadanau Cikarang Barat Bekasi Periode 9 September-7 November 2014
Kesehatan adalah keadaan sehat, baik secara fisik, mental, spiritual maupun sosial yang memungkinkan setiap orang untuk hidup produktif secara sosial dan ekonomis. Industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Agar obat yang dihasilkan berkualitas, mempunyai efikasi yang baik, bermutu, dan aman serta konsisten maka dibutuhkan suatu pedoman bagi industri farmasi yaitu Cara Pembuatan Obat yang Baik (CPOB). Praktek Kerja Profesi Apoteker di Landson PT. Pertiwi Agung bertujuan agar calon apoteker dapat mengetahui, memahami, dan mampu menerapkan tugas dan tanggung jawab apoteker di Industri Farmasi. Selain itu, melalui praktek kerja ini diharapkan calon apoteker memahami tentang penerapan Cara Pembuatan Obat yang Baik (CPOB) di Industri.
Kata Kunci : Industri Farmasi, Cara Pembuatan Obat yang Baik, Praktek Kerja Profesi Apoteker
Tugas Umum : xiv + 106 halaman ; 23 lampiran Tugas Khusus : v + 38 halaman ; 6 lampiran Daftar Acuan Tugas Umum : 3 (2010 - 2014)
ABSTRACT
Name : Siti Dzatir Rohmah, S.Farm
NPM : 1306502850
Study Program : Apothecary Profession
Title : Pharmacist Internship Report at Landson PT. Pertiwi Agung Jalan DDN Sukadanau Cikarang Barat Bekasi Periods of September 5th-November 7th 2014
Health is good health, physically, mentally, spiritually and socially to enable more people to live socially and economically productive. Pharmaceutical Industry is an entity that has a permit from the Minister Health to the manufacture of drugs or drug ingredients. In order for the resulting drug quality, have good efficacy, quality, safe and consistent, every pharmaceutical industry need a guide that called Good Manufacturing Practices (GMP). Pharmacist internship at Landson PT. Pertiwi Agung aims to know and understand the role and responsibility of Pharmacist in Pharmacy Industry. In addition trough this Internship a future pharmacist also could understand the application of Good Manufacturing Practice (GMP).
Keywords : Pharmaceutical Industry, Good Manufacturing Practices, Pharmacist Internship Program
General Assigment : xiv + 106 pages ; 23 appendices Special Assigment : v + 38 pages ; 6 appendices Bibliography of General Assigment : 3 (2010 - 2014)
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERNYATAAN BEBAS PLAGIARISME... iv
HALAMAN PENGESAHAN ...v
KATA PENGANTAR ... vi
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH... viii
ABSTRAK ... ix
ABSTRACT...x
DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR LAMPIRAN ... xiv
BAB 1. PENDAHULUAN ...1
1.1 Latar Belakang ... 1
1.2 Tujuan ...2
BAB 2. TINJAUAN UMUM ...3
2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik...6
2.2.1. Manajemen Mutu ...6
2.2.1.1 Pemastian Mutu...7
2.2.1.2 Pengawasan Mutu ...7
2.2.1.3 Pengkajian Mutu Produk...7
2.2.1.4 Manajemen Resiko Mutu ...8
2.2.2 Personalia ...8
2.2.3 Bangunan dan Fasilitas ...9
2.2.4 Peralatan ...9
2.2.5 Sanitasi dan Higiene...10
2.2.5.1 Higiene Perorangan ...11
2.2.5.2 Sanitasi Bangunan dan Fasilitas...11
2.2.5.3 Pembersihan dan Sanitasi Peralatan...12
2.2.6 Produksi...12
2.2.7 Pengawasan Mutu ...13
2.2.8 Inspeksi Diri, Audit Mutu, dan Audit dan Persetujuan Pemasok ...15
2.2.9 Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk ...15
2.2.10 Dokumentasi ...17
2.2.11 Pembuatan dan Analisa Berdasarkan Kontrak ...17
2.2.12 Kualifikasi dan Validasi ...17
BAB 3. TINJAUAN KHUSUS LANDSON PT. PERTIWI AGUNG ... 19
3.2 Profil Landson PT. Pertiwi Agung... 20
3.2.1 Visi ... 20
3.2.2 Misi ... 20
3.2.3 Nilai-Nilai ... 20
3.2.4 Kebijakan Mutu dan Sasaran Mutu ... 21
3.3 Struktur Organisasi ... 21
3.4 Pengembangan Usaha Landson PT. Pertiwi Agung ... 21
3.5 Produk Landson PT. Pertiwi Agung ... 22
3.6 Kegiatan Industri Landson PT. Pertiwi Agung ... 23
3.6.1 Departemen Research and Development (R & D) ... 23
3.6.2 Departemen Produksi ... 25
3.6.3 Departemen PPIC ... 30
3.6.3.1 Gudang ... 31
3.6.3.2 Alur Penerimaan Bahan Baku dan Bahan Pengemas... 32
3.6.3.3 Alur Pengeluaran Bahan Baku dan Bahan Pengemas... 34
3.6.3.4 Alur Penerimaan Produk Jadi ... 35
3.6.3.5 Alur Pengeluaran Produk Jadi... 35
3.6.4 Divisi QM (Quality Management) ... 36
3.6.4.1 Departemen QA (Quality Assurance)... 36
3.6.4.2 Departemen QC (Quality Control) ... 42
3.6.4.3 Dossier... 46
3.6.5 Departemen Engineering ... 48
3.6.6 Divisi HRD (Human Resources Development) ... 54
BAB 4. PEMBAHASAN ... 60
4.1 Manajemen Mutu (Quality Management) ... 60
4.2 Personalia... 62
4.3 Bangunan dan Fasilitas ... 63
4.4 Peralatan ... 65
4.5 Sanitasi dan Higiene ... 66
4.6 Produksi ... 67
4.7 Pengawasan Mutu ... 69
4.8 Inspeksi Diri, Audit Mutu dan Persetujuan Pemasok ... 70
4.9 Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk ... 71
4.10 Dokumentasi... 72
4.11 Pembuatan dan Analisa Berdasarkan Kontrak ... 74
4.12 Kualifikasi dan Validasi ... 75
BAB 5. KESIMPULAN DAN SARAN ... 78
5.1 Kesimpulan... 78
5.2 Saran ... 78
DAFTAR ACUAN ... 80
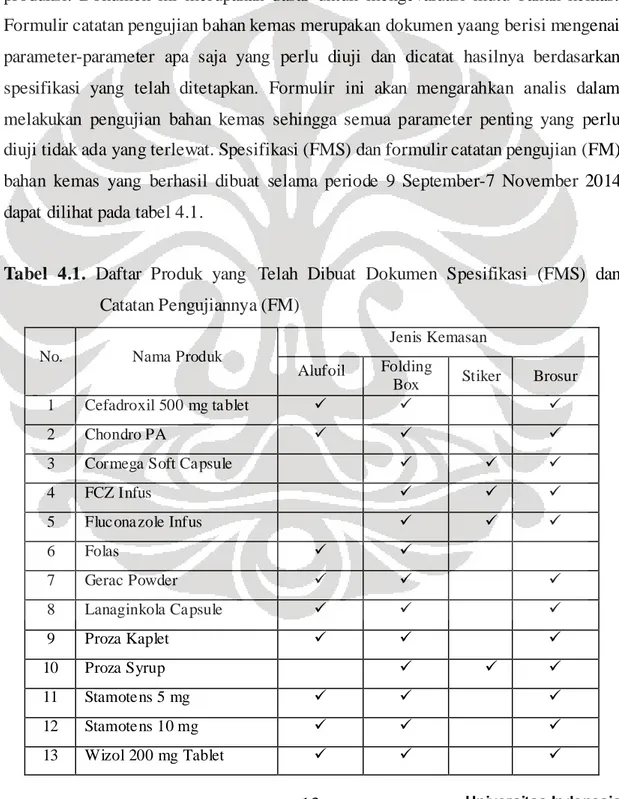
DAFTAR TABEL
DAFTAR LAMPIRAN
Lampiran 1. Struktur Organisasi Umum Landson PT. Pertiwi Agung ...81
Lampiran 2. Daftar Produk Landson PT. Pertiwi Agung...82
Lampiran 3. Struktur Organisasi Departemen R & D ...86
Lampiran 4. Alur Pembuatan Produk Baru ...87
Lampiran 5. Struktur Organisasi Departemen Produksi ...88
Lampiran 6. Alur Proses Pembuatan Tablet dengan Metode Granulasi Basah ...89
Lampiran 7. Alur Proses Pembuatan Kapsul Keras ...90
Lampiran 8. Alur Proses Pembuatan Sirup ...91
Lampiran 9. Alur Proses Pembuatan Serbuk Effervescent ...92
Lampiran 10. Alur Proses Pembuatan Kapsul Lunak (Soft Capsule) ...93
Lampiran 11. Struktur Organisasi Departemen PPIC ...94
Lampiran 12. Alur Penerimaan Barang dari Gudang Bahan Baku dan Pengemas ...95
Lampiran 13. Alur Pengeluaran Barang dari Gudang Bahan Baku dan Pengemas...96
Lampiran 14. Alur Penerimaan Produk Jadi ...97
Lampiran 15. Alur Pengeluaran Produk Jadi ...98
Lampiran 16. Struktur Organisasi Divisi Quality Management ...199
Lampiran 17. Alur Proses Usulan Dokumen Baru/Dokumen...100
Lampiran 18. Struktur Organisasi Departemen Engineering ...101
Lampiran 19. Alur Sistem HVAC di Landson PT. Pertiwi Agung...102
Lampiran 20. Alur Pengolahan Purified Water di Landson PT. Pertiwi Agung ...103
Lampiran 21. Alur Pengolahan Limbah Cair Tidak Berbahaya ...104
Lampiran 22. Struktur Organisasi Divisi Human Resources Development ...105
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Kesehatan merupakan salah satu faktor yang berpengaruh terhadap kualitas dan produktivitas sumber daya manusia dalam rangka memperoleh kesejahteraan hidup. Derajat kesehatan yang tinggi akan meningkatkan produktivitas dan daya saing bangsa dalam ketatnya persaingan dunia sehingga kesehatan merupakan salah satu hal yang mendukung tercapainya tujuan pembangunan nasional. Pembangunan kesehatan di Indonesia secara keseluruhan bertujuan untuk meningkatkan kesadaran, kemauan dan kemampuan hidup sehat bagi setiap orang agar terwujud kesehatan yang optimal. Pembangunan kesehatan memerlukan sarana kesehatan yang mendukung upaya kesehatan secara optimal, diantaranya harus didukung oleh pengadaan obat yang bermutu, berkhasiat dan aman, serta penyediaan obat yang makin merata dengan harga yang terjangkau oleh masyarakat
Industri farmasi merupakan salah satu elemen yang berperan penting dalam mewujudkan kesehatan nasional melalui aktivitasnya dalam menghasilkan suatu produk obat. Tingginya kebutuhan akan obat dalam dunia kesehatan dan aktivitas obat yang mempengaruhi fungsi fisiologis tubuh manusia menuntut industri farmasi agar mampu memproduksi obat yang bermutu, berkhasiat dan aman. Berdasarkan hal tersebut, untuk menjamin kualitas ketersediaan obat, pemerintah sebagai pembuat kebijakan mengeluarkan SK Kepala Badan Pengawas Obat dan Makanan nomor : HK.00.05.3.02152 tahun 2002 tentang penerapan pedoman cara pembuatan obat yang baik yang harus diterapkan di setiap industri farmasi.
Cara Pembuatan Obat yang Baik merupakan suatu pedoman mutu bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan dipersyaratkan dalam izin edar serta spesifikasi produk. Mutu suatu obat tidak dapat ditentukan darri pemeriksaan produk akhir saja tetapi harus dibentuk ke dalam produk selama keseluruhan proses pembuatan. Proses penerapan CPOB dilakukan mulai dari tahap pembelian dan pemasukan bahan awal, proses pembuatan, bangunan, peralatan, personalia sampai dihasilkan produk obat yang siap dipasarkan.
Pelaksanaan pedoman CPOB di industri farmasi membutuhkan peranan seorang Apoteker. Apoteker dalam industri farmasi memegang peranan penting untuk menjamin mutu obat yang dihasilkan. Kedudukan apoteker juga diatur dalam CPOB yaitu sebagai penanggung jawab produksi, pengawasan mutu dan pemastian mutu sehingga seorang apoteker dituntut untuk mempunyai wawasan, pengetahuan yang luas dan pengalaman praktis yang memadai serta kemampuan dalam memimpin agar dapat mengatasi permasalahan-permasalahan yang ada di industri farmasi. Dalam rangka mencapai tujuan tersebut, program studi profesi apoteker Universitas Indonesia mengadakan kerja sama dengan Landson PT. Pertiwi Agung yang telah memperoleh sertifikat CPOB untuk memberikan kesempatan kepada calon apoteker melaksanakan Praktek Kerja Profesi Apoteker (PKPA) yang dilaksanakan mulai 9 September sampai 7 November 2014.
1.2. Tujuan
Praktek Kerja Profesi Apoteker Fakultas Farmasi Universitas Indonesia bertujuan untuk :
a. Mengerti peranan, tugas dan tanggung jawab apoteker di industri farmasi.
b. Memperoleh wawasan, pengetahuan, keterampilan dan pengalaman praktis untuk melakukan pekerjaan kefarmasian di industri.
BAB 2
TINJAUAN PUSTAKA
2.1. Industri Farmasi
Menurut PerMenKes No 1799/MENKES/PER/XII/2010 tentang Industri Farmasi, yang dimaksud dengan industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Fungsi industri farmasi adalah pembuatan obat/bahan obat, pendidikan & pelatihan dan penelitian & pengembangan. Setiap pendirian Industri Farmasi wajib memperoleh izin Industri Farmasi dari Direktur Jenderal pada Kementerian Kesehatan yang tugas dan tanggung jawabnya di bidang pembinaan kefarmasian dan alat kesehatan. Persyaratan untuk memperoleh izin industri farmasi, yaitu :
a. Berbadan usaha berupa perseroan terbatas
b. Memiliki rencana investasi dan kegiatan pembuatan obat c. Memiliki NPWP
d. Memiliki secara tetap 3 orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi dan pengawasan mutu e. Komisaris dan direksi tidak pernah terlibat, baik langsung dan tidak langsung
dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian. Agar dapat memperoleh izin usaha industri farmasi, diperlukan tahap persetujuan prinsip. Permohonan persetujuan prinsip diajukan kepada Direktur Jenderal dengan tembusan kepada Kepala Badan dan Kepala Dinas Kesehatan Provinsi setelah sebelumnya mengajukan permohonan Rencana Induk Pembangunan (RIP) kepada kepala Badan Pengawas Obat dan Makanan. Persetujuan prinsip diberikan kepada industri farmasi untuk dapat langsung melakukan persiapan dan usaha pembangunan, pengadaan, pemasangan instalasi, peralatan dan lain-lain yang diperlukan, termasuk produksi percobaan dengan memperhatikan ketentuan perundang-undangan di bidang obat. Persetujuan prinsip tersebut berlaku selama jangka waktu 3 tahun dan selama jangka waktu tersebut, perusahaan yang bersangkutan harus menyampaikan laporan informasi kemajuan pembangunan fisik setiap 6 bulan sekali kepada Direktur Jenderal pada Kementerian Kesehatan yang tugas dan tanggung jawabnya di bidang pembinaan kefarmasian dan alat kesehatan
dengan tembusan kepada Kepala Badan Pengawas Obat dan Makanan (Badan POM) dan Kepala Dinas Kesehatan Provinsi.
Persyaratan agar mendapatkan persetujuan prinsip, yaitu :
a. Fotokopi akta pendirian badan hukum yang sah sesuai ketentuan peraturan perundang-undangan
b. Fotokopi KTP/identitas direksi dan komisaris perusahaan c. Susunan direksi dan komisaris
d. Pernyataan direksi dan komisaris tidak pernah terlibat pelanggaran peraturan perundang-undangan di bidang farmasi
e. Fotokopi sertifikat tanah/bukti kepemilikan
f. Fotokopi Surat Izin Tempat Usaha berdasarkan Undang-Undang Gangguan (HO) g. Fotokopi Surat Tanda Daftar Perusahaan
h. Fotokopi Surat Izin Usaha Perdagangan i. Fotokopi NPWP
j. Persetujuan lokasi dari pemerintah daerah provinsi k. Persetujuan RIP dari Kepala Badan
l. Rencana investasi dan kegiatan pembuatan obat
m. Surat asli pernyataan kesediaan bekerja penuh dari masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu
n. Fotokopi surat pengangkatan bagi masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu.
Setelah selesai melaksanakan tahap persetujuan prinsip, dapat dilakukan permohonan izin usaha industri. Permohonan diajukan kepada Direktur Jenderal Kementerian Kesehatan dengan tembusan kepada Kepala BPOM dan Kepala Dinas Kesehatan Provinsi setempat. Izin industri farmasi berlaku untuk seterusnya selama industri farmasi bersangkutan masih berproduksi dan memenuhi ketentuan peraturan perundang-undangan. Surat permohonan izin industri farmasi harus ditandatangani oleh direktur utama dan apoteker penganggung jawab pemastian mutu dengan kelengkapan yaitu :
a. Fotokopi persetujuan prinsip Industri Farmasi
b. Surat persetujuan penanaman modal untuk industri farmasi dalam rangka Penanaman Modal Asing (PMA) atau Penanaman Modal Dalam Negeri (PMDN)
c. Daftar peralatan dan mesin yang digunakan d. Jumlah tenaga kerja dan kualifikasinya
e. Fotokopi sertifikat upaya Pengelolaan Lingkungan dan Upaya Pemantauan Lingkungan /Analisis Mengenai Dampak Lingkungan
f. Rekomendasi kelengkapan administratif izin industri farmasi dari Kepala Dinas Kesehatan Provinsi
g. Rekomendasi Pemenuhan CPOB dari Kepala BPOM. h. Daftar pustaka wajib seperti Farmakope edisi terakhir
i. Surat asli pernyataan kesediaan bekerja penuh dari masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu
j. Fotokopi surat pengangkatan bagi masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu dari pimpinan perusahaan k. Fotokopi ijazah dan STRA dari masing--masing apoteker penanggung jawab
produksi, pengawasan mutu dan pemastian mutu
l. Surat pernyataan komisaris dan direksi tidak pernah terlibat, baik langsung maupun tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
Industri farmasi yang melakukan penambahan kapasitas produksi atau penambahan bentuk sediaan tidak memerlukan izin perluasan. Izin perluasan diperlukan apabila perusahaan yang bersangkutan akan menambah luas area produksi. Izin usaha industri farmasi berlaku untuk seterusnya selama perusahaan industri farmasi yang bersangkutan berproduksi. Permohonan izin usaha industri farmasi dapat diajukan setelah pembangunan fisik industri farmasi selesai dan perusahaan siap melaksanakan kegiatan produksi komersial.
Pencabutan izin usaha industri farmasi dilakukan jika industri farmasi melakukan hal-hal berikut :
a. Pemindahtanganan hak milik izin usaha industri farmasi dan perluasan usaha tanpa memiliki izin.
b. Tidak menyampaikan laporan mengenai perkembangan industri selama tiga kali berturut-turut atau menyampaikan informasi yang tidak benar.
c. Melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis terlebih dahulu.
d. Dengan sengaja memproduksi obat jadi atau bahan baku obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku.
e. Tidak memiliki ketentuan dalam izin usaha industri farmasi.
2.2. Cara Pembuatan Obat yang Baik
CPOB adalah pedoman untuk pemastian mutu yang memastikan bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu obat yang sesuai dengan tujuan pengguanaan dan dipersyaratkan dalam izin edar dan spesifikasi produk. CPOB mencakup seluruh aspek produksi dan pengawasan mutu. Cara Pembuatan Obat yang Baik bertujuan menjamin bahwa obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. Dalam Pedoman CPOB tahun 2012, terdapat dua belas aspek yang harus dipenuhi dalam penerapan CPOB.
2.2.1.Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan sistem Pemastian Mutu yang didesain secara menyeluruh dan diterapkan secara benar serta menginkorporasi Cara Pembuatan Obat yang Baik termasuk Pengawasan Mutu dan Manajemen Risiko Mutu. Hal ini hendaklah didokumentasikan dan dimonitor efektivitasnya.
Unsur dasar manajemen mutu adalah suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya dan tindakan sistematis yang diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut Pemastian Mutu. Semua bagian sistem Pemastian Mutu hendaklah
didukung dengan ketersediaan personil yang kompeten, bangunan dan sarana serta peralatan yang cukup dan memadai. Tambahan tanggung jawab legal hendaklah diberikan kepada kepala Manajemen Mutu (Pemastian Mutu).
2.2.1.1. Pemastian Mutu
Pemastian Mutu adalah suatu konsep luas yang mencakup semua hal, baik secara tersendiri maupun secara kolektif, yang akan memengaruhi mutu dari obat yang dihasilkan. Pemastian Mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya. Karena itu Pemastian Mutu mencakup CPOB ditambah dengan faktor lain di luar Pedoman ini, seperti desain dan pengembangan produk.
2.2.1.2. Pengawasan Mutu
Pengawasan Mutu adalah bagian dari CPOB yang berhubungan dengan pengambilan sampel, spesifikasi dan pengujian, serta dengan organisasi, dokumentasi dan prosedur pelulusan yang memastikan bahwa pengujian yang diperlukan dan relevan telah dilakukan dan bahwa bahan yang belum diluluskan tidak digunakan serta produk yang belum diluluskan tidak dijual atau dipasok sebelum mutunya dinilai dan dinyatakan memenuhi syarat. Setiap industri farmasi hendaklah mempunyai fungsi Pengawasan Mutu. Fungsi ini hendaklah independen dari bagian lain. Sumber daya yang memadai hendaklah tersedia untuk memastikan bahwa semua fungsi Pengawasan Mutu dapat dilaksanakan secara efektif dan dapat diandalkan.
2.2.1.3. Pengkajian Mutu Produk
Pengkajian mutu produk secara berkala hendaklah dilakukan terhadap semua obat terdaftar, termasuk produk ekspor, dengan tujuan untuk membuktikan konsistensi proses, kesesuaian dari spesifikasi bahan awal, bahan pengemas dan produk jadi, untuk melihat tren dan mengidentifikasi perbaikan yang diperlukan untuk produk dan proses. Pengkajian mutu produk secara berkala biasanya dilakukan tiap tahun dan didokumentasikan.
2.2.1.4. Manajemen Risiko Mutu
Manajemen risiko mutu adalah suatu proses sistematis untuk melakukan penilaian, pengendalian dan pengkajian risiko terhadap mutu suatu produk. Hal ini dapat diaplikasikan secara proaktif maupun retrospektif.
2.2.2.Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB serta memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaannya.
Personil Kunci mencakup kepala bagian Produksi, kepala bagian Pengawasan Mutu dan kepala bagian Manajemen Mutu (Pemastian Mutu). Posisi utama terse but dijabat oleh personil yang memiliki jam kerja penuh (purnawaktu). Kepala bagian Produksi dan kepala bagian Manajemen Mutu (Pemastian Mutu) / kepala bagian Pengawasan Mutu harus independen satu terhadap yang lain. Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi, pengawasan mutu, manajemen mutu (pemastian mutu) dipimpin oleh orang yang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Kepala bagian Produksi hendaklah seorang apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dalam bidang pembuatan obat dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugasnya secara profesional. Kepala bagian Pengawasan Mutu hendaklah seorang apoteker terkualifikasi dan memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugasnya secara profesional. Kepala bagian Manajemen Mutu (Pemastian Mutu) hendaklah seorang apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan
keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugasnya secara profesional.
Industri farmasi hendaklah memberikan pelatihan bagi seluruh personil yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk personil teknik, perawatan dan petugas kebersihan), dan bagi personil lain yang kegiatannya dapat berdampak pada mutu produk.
2.2.3.Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat termasuk area produksi, laboratorium, area penyimpanan, koridor dan lingkungan sekeliling bangunan hendaklah memiliki desain, konstruksi, letak yang memadai serta harus disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Bangunan dan fasilitas hendaklah dirawat dengan cermat, dibersihkan dan didesinfeksi sesuai prosedur tertulis secara rinci. Kondisi bangunan hendaklah ditinjau secara teratur dan diperbaiki bila perlu. Tindakan perbaikan dan perawatan terhadap bangunan dan fasilitas dilakukan hati-hati agar kegiatan tersebut tidak mempengaruhi mutu obat pasokan.
Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadi kekeliruan, pencemaran silang dan kesalahan lain, serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindarkan pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat. Letak bangunan diatur sedemikian rupa untuk menghindari pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah, air serta dari kegiatan industri lain yang berdekatan. Apabila letak bangunan tidak sesuai, hendaklah diambil tindakan pencegahan yang efektif terhadap pencemaran tersebut. Agar kondisi tersebut dapat dicapai maka bangunan untuk Industri farmasi harus mengikuti ketentuan Cara Pembuatan Obat yang Baik (CPOB).
2.2.4.Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat,
agar mutu obat terjamin sesuai desain serta seragam dari bets-ke-bets dan untuk memudahkan pembersihan serta perawatan agar dapat mencegah kontaminasi silang, penumpukan debu atau kotoran dan, hal-hal yang umumnya berdampak buruk pada mutu produk. Peralatan hendaklah didesain dan dikonstruksikan sesuai dengan tujuannya. Permukaan peralatan yang bersentuhan dengan bahan awal, produk antara, atau produk jadi tidak boleh menimbulkan reaksi, adisi, atau absorbsi yang dapat mempengaruhi identitas, mutu atau kemurnian di luar batas yang ditentukan.
Peralatan hendaklah didesain sedemikian rupa agar mudah dibersihkan. Peralatan tersebut hendaklah dibersihkan sesuai prosedur tertulis yang rinci serta disimpan dalam keadaan bersih dan kering. Peralatan pencucian dan pembersihan yang digunakan harus dipilih dengan seksama agar tidak menjadi sumber pencemaran. Peralatan hendaklah ditempatkan sedemikian rupa untuk memperkecil kemungkinan terjadinya pencemaran silang antar bahan di area yang sama. Peralatan hendaklah dipasang sedemikian rupa untuk menghindari risiko kekeliruan atau pencemaran. Letak peralatan satu sama lain juga harus di atur pada jarak yang cukup untuk menghindari kesesakan serta memastikan tidak terjadi kekeliruan dan campur baur produk.
Perawatan peralatan dilakukan sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat mempengaruhi identitas, mutu, atau kemurnian produk. Pelaksanaan perawatan dan pemakaian suatu peralatan didokumentasikan secara rapi dalam sebuah buku yang menunjukkan tanggal, waktu, produk, kekuatan dan nomor setiap bets atau lot yang diolah dengan alat tersebut.
2.2.5.Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, bahan pembersih dan desinfeksi, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu. Selain itu, prosedur sanitasi dan hygiene hendaknya divalidasi dan dievaluasi secara berkala untuk memastikan bahwa prosedur yang diterapkan cukup efektif dan memenuhi
persyaratan. Sanitasi dan higiene yang diatur dalam pedoman CPOB terbaru adalah terhadap perorangan, bangunan dan fasilitas serta peralatan.
2.2.5.1.Higiene Perorangan
Prosedur higiene perorangan termasuk persyaratan untuk mengenakan pakaian pelindung hendaklah diberlakukan bagi semua personil yang memasuki area produksi, baik karyawan purna waktu, paruh waktu, atau bukan karyawan yang berada di area pabrik, misalnya karyawan kontraktor, pengunjung, anggota manajemen senior dan inspektur. Semua personil hendaklah menjalani pemeriksaan kesehatan pada saat direkrut. Industri harus bertanggung jawab agar tersedia instruksi yang memastikan bahwa keadaan kesehatan personil yang dapat mempengaruhi mutu produk diberitahukan kepada manajemen industri. Sesudah pemeriksaan kesehatan awal hendaklah dilakukan pemeriksaan kesehatan kerja dan kesehatan personil secara berkala.
Semua personil hendaklah dihindarkan persentuhan langsung antara tangan operator dengan bahan awal, produk antara dan produk ruahan yang terbuka dan juga dengan bagian peralatan yang bersentuhan dengan produk. Merokok, makan, minum, mengunyah, memelihara tanaman, menyimpan makanan, minuman, bahan untuk merokok, atau obat pribadi hanya diperbolehkan di area tertentu dan dilarang dalam area produksi, laboratorium, area gudang dan area lain yang mungkin berdampak terhadap mutu produk.
2.2.5.2.Sanitasi Bangunan dan Fasilitas
Bangunan yang digunakan untuk pembuatan obat hendaklah didesain dan dikonstruksi dengan tepat untuk memudahkan sanitasi yang baik. Disamping itu, juga tersedia sarana toilet dalam jumlah yang cukup dengan ventilasi yang baik dan tempat cuci bagi personil yang letaknya mudah diakses dari area pembuatan. Hendaklah disediakan sarana yang memadai untuk penyimpanan pakaian personil dan milik pribadinya ditempat yang tepat. Penyiapan, penyimpanan dan konsumsi makanan dan minuman harus dibatasi di area khusus, misalnya kantin. Pedoman CPOB juga mewajibkan adanya prosedur sanitasi tertulis. Prosedur tersebut menunjukkan penanggung jawab untuk sanitasi serta menguraikan dengan cukup
rinci mengenai jadwal, metode, peralatan, dan bahan pembersih yang harus digunakan untuk pembersihan sarana dan bangunan.
2.2.5.3.Pembersihan dan Sanitasi Peralatan
Setelah digunakan, peralatan hendaklah dibersihkan baik bagian luar maupun bagian dalam sesuai dengan prosedur yang telah ditetapkan, serta dijaga dan disimpan dalam kondisi yang bersih. Pembersihan dan penyimpanan peralatan yang dapat dipindah-pindahkan dan penyimpanan bahan pembersih hendaklah dilaksanakan dalam ruangan yang terpisah dari ruangan pengolahan. Metode pembersihan dengan cara vakum atau cara basah lebih dianjurkan. Udara bertekanan dan sikat hendaklah digunakan dengan hati-hati dan sedapat mungkin dihindari karena menambah risiko pencemaran produk. Prosedur tertulis yang cukup rinci untuk pembersihan dan sanitasi peralatan serta wadah yang digunakan dalam pembuatan obat hendaklah dibuat, divalidasi dan ditaati. Prosedur ini hendaklah dirancang agar pencemaran peralatan oleh agens pembersih atau sanitasi dapat dicegah. Prosedur ini setidaknya meliputi penanggungjawab pembersihan, jadwal, metode, peralatan dan bahan yang dipakai dalam pembersihan serta metode pembongkaran dan perakitan kembali peralatan yang mungkin diperlukan untuk memastikan pembersihan yang benar terlaksana.
2.2.6.Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar. Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten. Penanganan bahan dan produk jadi, seperti penerimaan dan karantina, pengambilan sampel, penyimpanan, penandaan, penimbangan, pengolahan, pengemasan dan distribusi hendaklah dilakukan sesuai dengan prosedur atau instruksi tertulis dan bila perlu dicatat. Aspek produksi mencakup spesifikasi bahan awal, validasi proses (pembersihan, sterilisasi, dan lainnya), prosedur tetap, sistem penomoran bets/lot produk ruahan atau produk jadi, penimbangan dan penyerahan
bahan baku obat, pengembalian bahan baku obat, pengolahan bahan baku menjadi produk obat jadi, monitoring, dan dokumentasi.
Penimbangan dan penyerahan bahan baku, bahan pengemas, produk antara dan produk ruahan dianggap suatu bagian dari siklus produksi dan memerlukan dokumentasi dan rekonsiliasi yang lengkap. Sebelum melakukan penimbangan dilakukan pemeriksaan kebenaran penandaan bahan baku termasuk label pelulusan. Kapasitas, ketepatan dan ketelitian alat timbangan dan alat ukur yang digunakan harus sesuai dengan jumlah bahan yang ditimbang. Semua prosedur produksi hendaknya divalidasi dengan tepat, sesuai dengan prosedur yang telah ditentukan dan catatan hasilnya hendaknya didokumentasikan. Perubahan yang penting dalam proses, baik itu penggantian alat maupun penggantian asal bahan baku, hendaknya dilakukan validasi ulang. Hal ini untuk menjamin bahwa perubahan tersebut akan tetap menghasilkan produk yang memenuhi spesifikasi yang telah ditentukan.
2.2.7.Pengawasan Mutu
Pengawasan Mutu merupakan bagian yang esensial dari Cara Pembuatan Obat yang Baik untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi. Pengawasan Mutu mencakup pengambilan sampel, spesifikasi, pengujian serta termasuk pengaturan, dokumentasi dan prosedur pelulusan yang memastikan bahwa semua pengujian yang relevan telah dilakukan, dan bahan tidak diluluskan untuk dipakai atau produk diluluskan untuk dijual, sampai mutunya telah dibuktikan memenuhi persyaratan. Pengawasan Mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan Pengawasan Mutu dari Produksi dianggap hal yang fundamental agar Pengawasan Mutu dapat melakukan kegiatan dengan memuaskan.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum
didistribusikan. Bagian pengawasan mutu hendaklah memiliki tugas pokok sebagai berikut :
a. Menyusun dan merevisi prosedur pengawasan dan spesifikasi.
b. Menyiapkan prosedur tertulis yang rinci untuk melakukan seluruh pemeriksaan, pengujian, dan analisis.
c. Menyusun program dan prosedur pengambilan sampel secara tertulis. d. Memastikan pemberian label yang benar pada wadah bahan dan produk. e. Menyimpan sampel pertinggal untuk rujukan dimasa mendatang.
f. Meluluskan atau menolak tiap bets bahan awal, produk antara, produk ruahan atau produk jadi.
g. Melakukan evaluasi stabilitas semua produk jadi secara berkelanjutan dan bahan awal jika diperlukan, serta menetapkan kondisi penyimpanan bahan dan produk berdasarkan data stabilitasnya.
h. Menetapkan masa simpan bahan awal dan produk jadi berdasarkan data stabilitas serta kondisi penyimpanannya.
i. Berperan atau membantu pelaksanaan program validasi.
j. Menyiapkan baku sekunder sesuai dengan prosedur pengujian yang berlaku dan menyimpan baku pembanding tersebut pada kondisi yang tepat.
k. Menyimpan catatan analitis dari hasil pengujian semua sampel yang diambil. l. Melakukan evaluasi produk jadi kembalian dan menetapkan apakah produk
tersebut dapat diluluskan atau diolah ulang atau harus dimusnahkan.
m. Ikut serta dalam program inspeksi diri bersama dengan bagian lain dari perusahaan.
n. Memberikan rekomendasi kegiatan pembuatan obat berdasarkann kontrak setelah melakukan evaluasi kemampuan penerima kontrak yang bersangkutan untuk membuat produk yang memenuhi persyaratan mutu yang ditetapkan perusahaan.
Personil pengawasan mutu hendaklah memiliki akses ke area produksi untuk pengambilan sampel dan penyelidikan yang diperlukan. Personil, bangunan dan fasilitas, serta peralatan laboratorium hendaklah sesuai untuk segala jenis tugas yang ditentukan dan skala kegiatan pembuatan obat.
2.2.8.Inspeksi Diri, Audit Mutu dan Audit & Persetujuan Pemasok
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan yang dapat mengevaluasi penerapan CPOB secara obyektif. Inspeksi diri hendaklah dilakukan secara rutin dan, di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari system manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan.
Kepala Bagian Manajemen Mutu (Pemastian Mutu) hendaklah bertanggung jawab bersama bagian lain yang terkait untuk memberi persetujuan pemasok yang dapat diandalkan memasok bahan awal dan bahan pengemas yang memenuhi spesifikasi yang telah ditentukan. Hendaklah dibuat daftar pemasok yang disetujui untuk bahan awal dan bahan pengemas. Daftar pemasok hendaklah disiapkan dan ditinjau ulang. Hendaklah dilakukan evaluasi sebelum pemasok disetujui dan dimasukkan ke dalam daftar pemasok atau spesifikasi. Evaluasi hendaklah mempertimbangkan riwayat pemasok dan sifat bahan yang dipasok. Jika audit diperlukan, audit tersebut hendaklah menetapkan kemampuan pemasok dalam pemenuhan standar CPOB. Semua pemasok yang telah ditetapkan hendaklah dievaluasi secara teratur.
2.2.9.Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat harus dikaji dengan teliti sesuai dengan prosedur tertulis.
Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat d ari peredaran secara cepat dan efektif. Keluhan terhadap obat mencakup keluhan terhadap mutu (keadaan fisik, kimia, dan biologi), reaksi yang merugikan (alergi, toksisitas, reaksi fatal dan reaksi medis lain) atau masalah efek terapeutik (tidak berkhasiat). Semua keluhan dan laporan keluhan hendaklah diteliti dan dievaluasi dengan cermat, kemudian diambil tindak lanjut yang sesuai, dan dibuatkan laporan.
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran. Penarikan kembali produk dilakukan apabila ditemukan produk yang cacat mutu atau bila ada laporan mengenai reaksi yang merugikan yang serius serta berisiko terhadap kesehatan. Penarikan kembali produk dari peredaran dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut. Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, kadaluarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang menimbulkan keraguan akan identitas, mutu, jumlah, dan keamanan obat yang bersangkutan. Tindakan penarikan kembali produk hendaklah dilakukan segera setelah diketahui ada produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan. Pedoman dan prosedur penarikan kembali terhadap produk hendaklah dibuat untuk memungkinkan embargo dan penarikan dapat dilakukan dengan cepat dan efektif dari seluruh mata rantai distribusi. Produk yang ditarik kembali hendaklah diberi identifikasi dan disimpan terpisah di area yang aman sementara menunggu keputusan terhadap produk tersebut. Perkembangan dari proses penarikan kembali hendaklah dicatat dan dibuat laporan akhir, termasuk rekonsiliasi antara jumlah produk yang dikirim dan yang ditemukan kembali. Industri farmasi hendaklah menyiapkan prosedur untuk penahanan, penyelidikan dan pengujian produk kembalian serta pengambilan keputusan apakah produk kembalian dapat diproses ulang atau harus dimusnahkan setelah dilakukan evaluasi kritis. Penanganan produk kembalian dan tindak lanjutnya hendaklah didokumentasikan dan dilaporkan. Bila produk harus dimusnahkan, dokumentasi hendaklah mencakup berita acara pemusnahan yang diberi tanggal dan ditandatangani oleh personil yang melaksanakan dan menyaksikan pemusnahan.
2.2.10.Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil risiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, Dokumen Produksi Induk/Formula Pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
Dokumen hendaklah didesain, disiapkan, dikaji, dan didistribusikan dengan cermat. Dokumen hendaklah dikaji ulang secara berkala dan dijaga agar selalu up to date. Semua perubahan yang dilakukan terhadap pencatatan pada dokumen hendaklah ditandatangani dan diberi tanggal. Perubahan hendaklah memungkinkan pembacaan informasi semula. Dimana perlu, alasan perubahan hendaklah dicatat. Pencatatan hendaklah dibuat atau dilengkapi pada tiap langkah yang dilakukan dan sedemikian rupa sehingga semua aktivitas yang signifikan mengenai pembuatan obat dapat ditelusuri. Catatan pembuatan hendaklah disimpan selama paling sedikit satu tahun setelah tanggal daluwarsa produk jadi.
2.2.11.Pembuatan dan Analis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindarkan kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara Pemberi Kontrak dan Penerima Kontrak harus dibuat secara jelas yang menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (Pemastian Mutu).
2.2.12.Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat
memengaruhi mutu produk hendaklah divalidasi. Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen setara. Protokol validasi tertulis hendaklah dibuat untuk merinci kualifikasi dan validasi yang akan dilakukan. Protokol hendaklah dikaji dan disetujui oleh kepala bagian Pengawasan Mutu. Protokol validasi hendaklah merinci langkah kritis dan kriteria penerimaan. Hendaklah dibuat laporan yang mengacu pada protokol kualifikasi dan/atau protokol validasi yang memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi, kesimpulan dan rekomendasi perbaikan. Tiap perubahan terhadap rencana yang ditetapkan dalam protokol hendaklah didokumentasikan dengan pertimbangan yang sesuai. Pendekatan dengan kajian risiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Prosedur tertulis yang merinci langkah yang diambil hendaklah tersedia jika ada usul perubahan terhadap bahan awal, komponen produk, peralatan proses, lingkungan kerja (atau pabrik), metode produksi atau berpengaruh terhadap mutu atau reprodusibilitas proses. Prosedur pengendalian perubahan hendaklah memastikan bahwa data pendukung cukup untuk menunjukkan bahwa proses yang diperbaiki akan menghasilkan suatu produk sesuai mutu yang diinginkan dan konsisten dengan spesifikasi yang telah ditetapkan. Semua usul perubahan yang dapat mempengaruhi mutu produk atau reprodusibilitas proses hendaklah secara resmi diajukan, didokumentasikan dan disetujui. Kemungkinan dampak perubahan fasilitas, sistem dan peralatan terhadap produk hendaklah dievaluasi, termasuk analisis resiko serta ditentukan kebutuhan dan cakupan untuk melakukan kualifikasi dan validasi ulang.
BAB 3
TINJAUAN KHUSUS
LANDSON PT. PERTIWI AGUNG
3.1. Sejarah Landson PT. Pertiwi Agung
PT. Pertiwi Agung atau yang dikenal dengan nama Landson merupakan salah satu industri farmasi yang berada di Indonesia. Istilah Landson berasal dari nama pendirinya, yakni Mr. Lou yang kemudian dikelola bersama dengan putranya atau dalam Bahasa Inggris disebut Son sehingga menjadi Mr. Lou and Son dengan singkatan Landson. Perusahaan ini dirintis pada tanggal 26 Oktober 1967 dengan lokasi awal di Jalan Pangeran Jayakarta, Jakarta Pusat.
Pada tahun 1984 manajemen PT. Pertiwi Agung diambil alih oleh kelompok usaha “Menjangan Sakti Group” (Mensa Group) di bawah pimpinan Bapak Sudharta. Mensa Group sendiri merupakan kelompok usaha di bidang farmasi dan kosmetik, antara lain perusahaan branding (Otto dan Landson), import dan perdagangan bahan baku farmasi, kosmetik dan juga pakan hewan serta pendistribusian obat melalui Mensa Bina Sukses (MBS).
Dalam rangka meningkatkan citra serta kinerja perusahaan, maka dilakukan perubahan struktur organisasi sehingga terbentuklah tim manajemen yang terdiri dari para profesional. Tim manajemen ini kemudian bertugas untuk meningkatkan kualitas produk yang diproduksi oleh perusahaan, memperkuat keuangan serta memperluas pemasaran produk. Tugas-tugas tersebut kemudian diimplementasikan menjadi berbagai usaha perbaikan yang berkesinambungan, antara lain dengan memperluas jangkauan produk yang tadinya hanya memproduksi obat-obatan kemudian memproduksi suplemen makanan dan obat-obat tradisional yang sukses membuat pasar tersendiri.
Pencapaian-pencapaian yang telah diraih menjadi dorongan tersendiri bagi PT. Pertiwi Agung untuk terus meningkatkan fasilitas serta kapasitas produksinya, dengan kata lain perusahaan memerlukan area yang lebih luas untuk mendirikan bangunan dengan lay out yang mengacu pada standar yang ditetapkan dalam Cara Pembuatan Obat yang Baik (CPOB). Oleh karena itu, pada tahun 1993 dibangunlah pabrik baru di Jalan Departemen Dalam Negeri (DDN), Sukadanau, Cibitung,
Cikarang Barat dengan luas pabrik 1,285 Ha dan luas bangunan 3500 m2. Proses pembangunan diselesaikan pada tahun 1994 dan pada 22 Juli 1994 PT. Pertiwi Agung mendapatkan sertifikat CPOB dari Direktorat Jenderal Pengawasan Obat dan Makanan (Dirjen POM) Departemen Kesehatan Republik Indonesia. Selain itu, PT. Pertiwi Agung juga mendapatkan sertifikat ISO 9001:2000 pada Maret 2003 dan diperbaharui menjadi ISO 9001:2008 pada Maret 2009.
Saat ini Landson PT. Pertiwi Agung sudah menjalankan sistem oracle, yakni sebuah sistem komputerisasi yang diharapkan dapat mempermudah pelaksanaan operasional perusahaan dan dapat meningkatkan efisiensi, kinerja karyawan serta mutu perusahaan. Berdasarkan uraian di atas, dapat dilihat bahwa PT. Pertiwi Agung merupakan perusahaan yang memiliki manajemen mutu yang baik dan menghasilkan produk sesuai dengan standar CPOB dan GMP (Good Manufacturing Process) sehingga mampu bersaing di pasar farmasi Indonesia dan dikenal di pasar global.
3.2. Profil Landson PT. Pertiwi Agung
3.2.1.Visi
Visi dari Landson PT. Pertiwi Agung adalah “Kami akan menjadi salah satu perusahaan terkemuka (one of the leading companies) di Indonesia dan dikenal di pasar global dalam bidang produk kesehatan.”
3.2.2.Misi
Misi dari Landson PT. Pertiwi Agung adalah “Menyediakan produk kesehatan bermutu, terpercaya dan bermanfaat untuk senantiasa meningkatkan kualitas hidup masyarakat.”
3.2.3.Nilai-nilai
Nilai-nilai dari Landson PT. Pertiwi Agung adalah sebagai berikut : 1. Selalu menjunjung tinggi setiap komitmen : Meeting Commitment.
2. Mengutamakan keseimbangan hubungan usaha dan hubungan jangka panjang : Ensuring Balance & Lasting Relationship.
3. Menumbuh kembangkan upaya-upaya inovatif : Nurturing Inovation. 4. Selalu berusaha mencapai yang terbaik : Striving for Excellence.
5. Mengusahakan perbaikan yang berkesinambungan: Assuring Continuous Improvement.
3.2.4.Kebijakan Mutu dan Sasaran Mutu
Dalam rangka implementasi ISO 9001:2008, Landson PT. Pertiwi Agung menetapkan kebijakan dan sasaran mutu yang bertujuan untuk menjamin bahwa perusahaan senantiasa menghasilkan produk yang berkualitas. Kebijakan mutu dari Landson PT. Pertiwi Agung yaitu perusahaan memiliki komitmen untuk :
1. Mencapai kualitas dan pelayanan yang terbaik bagi dunia kesehatan sesuai CPOB dan ISO 9000.
2. Melaksanakan penelitian dan pengembangan produk yang berkesinambungan. 3. Memberi perhatian terhadap kepuasan pelanggan.
Sasaran mutu dari Landson PT. Pertiwi Agung yaitu :
1. Meluncurkan produk baru yang berkualitas 100% dari rencana tahunan. 2. Proses ulang maksimal 2,0%, zero scrap dan zero recall.
3. Employee Turn Over Rate maksimal 10,0% per tahun. 4. Back Orders maksimal 2,0% dari total sales.
5. Jumlah keluhan pelanggan maksimal 5 kasus dalam 1 tahun.
3.3. Struktur Organisasi
Landson PT. Pertiwi Agung dipimpin oleh President Director yang dibantu oleh Managing Director. Managing Director ini membawahi Plant Director, Commercial Director, Finance & Accounting Director, Quality Operational (QO) Manager, Human Resources (HR) Manager, Informatica Technic (IT) Manager serta Demand Planner. Struktur organisasi di Landson PT. Pertiwi Agung dapat dilihat pada lampiran 1.
3.4. Pengembangan Usaha Landson PT. Pertiwi Agung
Beberapa langkah yang ditempuh oleh PT. Pertiwi Agung untuk mengembangkan dan meningkatkan usahanya, yaitu :
1. Internal Product Development, mengembangkan produk-produk yang sudah ada serta memproduksi produk-produk baru berdasarkan usulan dari bagian marketing oleh bagian R & D.
2. Export, yaitu suatu langkah pengembangan usaha dengan melakukan kerjasama pemasaran produk ke beberapa Negara di luar negeri. Landson PT. Pertiwi Agung melakukan eksport ke beberapa negara di Asia seperti Singapura, Malaysia, Mongolia, Nigeria, Papua Nugini, Filipina, Myanmar, Afrika, serta di beberapa negara lainnya seperti Hongkong, Mongolia. Produk-produk jadi dari Landson PT. Pertiwi Agung lebih banyak di export ke Negara Nigeria.
3. Toll Manufacturing (makloon), ada 2 macam, yaitu :
a. Toll in, merupakan salah satu bentuk kerja sama usaha di mana produk obat dari industri lain diproduksi di Landson PT. Pertiwi Agung. Kegiatan ini merupakan tanggung jawab dari departemen PPIC. Kerjasama toll in dilakukan oleh karena adanya keterbatasan sarana dan prasarana dari pabrik luar dalam memproduksi produk obat tersebut.
b. Toll out, merupakan salah satu bentuk kerja sama usaha di mana produk obat dari Landson PT. Pertiwi Agung diproduksi di industri lain yang memiliki fasilitas produksi sesuai persyaratan. Kegiatan ini dilakukan karena adanya keterbatasan sarana dan prasarana Landspn PT. Pertiwi Agung. Kegiatan toll out juga dapat menghemat dana investasi untuk produksi, baik untuk alokasi dana bangunan, peralatan, sarana dan prasarana penunjang, dan lain-lain.
3.5. Produk Landson PT. Pertiwi Agung
Landson PT. Pertiwi Agung, memproduksi produk obat ethical yang dipasarkan melalui resep-resep dokter, produk food supplement dan obat herbal tradisional. Produk-produk Landson PT. Pertiwi Agung tersedia dalam berbagai sediaan yaitu tablet, kapsul, soft kapsul, krim, sirup, salep, serbuk effervescent, dan injeksi. Saat ini, proses produksi untuk sediaan krim, salep dan injeksi masih dibuat di luar perusahaan (toll out). Daftar produk yang diproduksi oleh Landson PT. Pertiwi Agung dapat dilihat pada lampiran 2.
3.6. Kegiatan Industri Landson PT. Pertiwi Agung
Kegiatan produksi di Landson PT. Pertiwi Agung dilakukan oleh beberapa divisi dan departemen yang berada di bawah Plant Director.
3.6.1.Departemen Research and Development (R & D)
Departemen Research and Development (R & D) adalah departemen yang bertanggung jawab terhadap penelitian dan pengembangan dalan aspek bahan baku, formula, maupun kemasan yang digunakan. Departemen R & D dipimpin oleh seorang manajer yang merupakan seorang apoteker. Manager ini membawahi beberapa assistan manager dan asisstant manager membawahi beberapa supervisor. Struktur organisasi Departemen R & D dapat dilihat pada lampiran 3. Secara umum tugas dari Departemen R & D adalah sebagai berikut :
1. Melakukan pengembangan (inovasi) produk yang sudah ada (existing product) dan merencanakan formula baru (new product). Produk yang akan dikembangkan oleh R&D merupakan produk-produk yang sedang menjadi trend di pasaran yang sesuai dengan permintaan bagian Busines Development (marketing).
2. Melakukan evaluasi dan perbaikan terhadap produk yang sudah berada di pasaran, mencakup perbaikan formula, perbaikan bentuk sediaan, metode analisis, kekuatan/dosis dan perbaikan kemasan primer maupun sekunder yang kemudian diinformasikan kepada departemen pengawasan mutu dan departemen produksi.
3. Berkoordinasi dengan departemen QC dalam menentukan metode analisa yang tepat untuk bahan baku, bahan kemas dan juga produk jadi.
4. Berkoordinasi dengan departemen QM dalam menentukan standarisasi bahan baku, bahan kemas, produk jadi serta stabilitas obat.
5. Menjadi koordinator bagi uji Bioekivalensi (BE) produk yang dilakukan di luar Landson PT. Pertiwi Agung.
Departemen R&D terdiri dari lima bagian, yaitu Existing Product Formulation Development, New Product Formulation Development, Analytical Development, Packaging Development dan Technical Service. Tugas dari masing-masing bagian tersebut antara lain :
1. Formulation Development (Existing Product dan New Product)
a. Koordinasi dengan semua bagian yang terkait dalam pelaksanaan seluruh kegiatan formulasi produk baru lokal supaya produksi baru yang diusulkan oleh bussiness development dapat terealisasi dan melakukan improvement produk existing.
b. Memastikan semua trial yang dilakukan dalam proses pengembangan formula produk baru lokal dan existing dilakukan dengan cara dan metode yang baik dan benar agar menghasilkan formula produk yang berkualitas dan tepat waktu. c. Membuat dan menyusun catatan pengolahan bets trial dan master untuk
dipergunakan dalam proses produksi.
d. Bertanggung jawab atas alat atau mesin yang digunakan di bagian formulasi dan menyediakan suku cadang untuk memperlancar kegiatan pengembangan produk di bagian formulasi.
2. Analytical development
a. Melakukan koordinasi pengembangan dan validasi metode analisa, pengujian produk baru, produk existing dan uji stabilitas produk jadi sesuai dengan fasilitas dan peralatan yang dimiliki perusahaan.
b. Bertanggung jawab atas pelaksanaan analisa sesuai dengan prosedur yang berlaku.
c. Mengembangkan validasi metode analisa untuk bahan baku dan produk jadi agar didapatkan metode pemeriksaan yang valid.
d. Menyusun metode pemeriksaan dan spesifikasi bahan baku dan produk jadi untuk pemeriksaan oleh bagian QC, pelaksanaan uji stabilitas, pelaksanaan transfer metode analisa ke departemen QC.
e. Melaksanakan uji bioavailabilitas (BA) atau bioekuivalensi (BE). 3. Packaging Development
a. Menyiapkan rancangan desain kemasan sesuai dengan perencanaan sistem kemasan yang sudah ditetapkan.
b. Memastikan dan memonitor pembuatan desain dan standar kemasan yang dibuat sesuai dengan basic material, sistem kemasan primer atau sekunder, dan spesifikasi yang sudah ditetapkan.
d. Menyusun prosedur pengujian untuk kemasan dan menyusun prosedur pengemasan produk.
4. Technical Service
Bagian ini bertugas sebagai penghubung antara Departemen R & D dan Departemen Produksi. Tujuannya untuk menangani masalah-masalah di produksi yang berkaitan dengan Departemen R & D.
Alur kegiatan Departemen R & D dalam membuat produk yaitu dimulai dari Formulir Usulan Produk Baru (FUPB) yang diiisi oleh bagian marketing (bussiness development), R & D, dan bagian lain yang terkait. Apabila FUPB disetujui, maka bagian pengembangan formulasi mencari studi literatur serta membuat produk reference (produk paten yang telah beredar). Bagian analisa mencari studi literatur untuk analisa dan membuat formulir permintaan sampel ke bagian procurement. Kemudian bagian procurement membeli produk reference dan mencari supplier bahan baku. Setelah dipilih supplier bahan baku kemudian dilakukan analisa terhadap bahan baku, bila memenuhi spesifikasi dan disetujui maka dilanjutkan dengan trial formulasi. Dari hasil trial formulasi dilakukan analisa dan dipilih formulasi yang memenuhi syarat. Formula yang memenuhi syarat ini akan direlease untuk selanjutnya dibuat protokol stabilitas, validasi, dan dokumen validasi proses. Bagian pengembangan kemasan membuat desain kemasan yang diajukan ke bagian marketing (business development). Apabila telah disetujui maka didaftarkan (registrasi) oleh bagian marketing (business development) ke BPOM untuk mendapatkan nomor registrasi. Alur pembuatan produk baru dapat dilihat pada lampiran 4.
3.6.2.Departemen Produksi
Departemen Produksi merupakan departemen yang bertugas untuk melaksanakan proses produksi sesuai dengan kaidah dan persyaratan CPOB untuk menghasilkan produk yang bermutu, aman, efektif dan acceptable, sehingga dapat diterima pasar dan memberikan kepuasan kepada pelanggan serta bertanggung jawab atas keseluruhan proses produksi obat dari perencanaan, pengolahan hingga pengemasan. Dalam menjalankan suatu proses produksi, departemen produksi bekerjasama dengan :
1. Divisi HRD dalam penyediaan dan peningkatan kualitas SDM.
2. Departemen R&D dalam penentuan formulasi produk atau pengembangan produk existing dan desain kemasan serta melakukan trial produk baru.
3. Departemen Engineering dalam penyediaan dan perbaikan ruang alat atau mesin produksi, penyediaan purified water, pengaturan tata udara ruang produksi dan pengaturan sistem pembuangan limbah.
4. Divisi Quality Management dalam hal pengawasan mutu obat agar diperoleh produk yang memenuhi persyaratan spesifikasi yang telah ditentukan.
5. Departemen PPIC dalam perencanaan dan penyediaan bahan baku dan pengemas, penyimpanan bahan baku, pengemas dan obat jadi.
Departemen Produksi dipimpin oleh seorang manajer produksi yang bertanggung jawab langsung kepada Plant Manager. Susunan organisasi departemen produksi dapat dilihat pada lampiran 5. Manager produksi dibantu asisten manager dan supervisor yang mempunyai tugas dan tanggung jawab :
1. Memimpin dan mengarahkan secara teknis dan administratif semua pelaksanaan tugas pengelolaan dan pengemasan
2. Bertanggung jawab terhadap jalannya proses produksi dari awal pembuatan sampai produk jadi
3. Membuat anggaran tahunan dan laporan bulanan produksi
4. Bersama supervisor produksi membuat rencana produk mingguan berdasarkan target bulanan dari PPIC
5. Mengontrol proses pengolahan produksi dari awal pembuatan hingga produk jadi yang memenuhi persyaratan GMP dan CPB/CKB
6. Memonitor dan mengontrol pelaksanaan CPOB
7. Memeriksa CPB dan CKB dan menjamin produksi dijalankan sesuai prosedur tersebut
8. Bertanggung jawab atas pelatihan dan pengembangan karyawannya, serta menjaga disiplin, dan melakukan evaluasi tahunan atas karyawannya
9. Melakukan koordinasi untuk produk Toll in Manufacturing
Jenis bentuk sediaan yang diproduksi di Landson PT. Pertiwi Agung adalah tablet, sirup kering, serbuk effervescent, sirup, hard capsule dan juga soft capsule. Selain itu, Landson PT. Pertiwi Agung juga memproduksi bentuk sediaan krim,
salep, sediaan injeksi yang dikerjakan oleh industri lain (toll out) karena belum tersedianya sarana dan fasilitas yang dibutuhkan untuk produksi sediaan tersebut di Landson PT. Pertiwi Agung. Kegiatan produksi meliputi semua kegiatan pembuatan mulai dari penerimaan bahan awal, pengolahan sampai dengan pengemasan untuk menghasilkan produk jadi. Landson PT. Pertiwi Agung membagi area produksi menjadi 2 bagian yaitu grey area (kelas E) dan black area (kelas F). Grey area khusus untuk proses pencampuran, granulasi, cetak, pengemasan primer. Sedangkan black area digunakan untuk proses pengemasan sekunder.
Seluruh proses produksi diawali dengan penyusunan jadwal atau rencana produksi setiap hari berdasarkan Target Produksi Bulanan yang diberikan oleh Departemen PPIC. Target Produksi Bulanan ini dibuat berdasarkan Production Planning and Rolling Forecast (PPRF). Penentuan PPRF ini ditentukan oleh Departemen PPIC berdasarkan kesepakatan bersama antara pabrik dan pihak marketing yang selalu diitinjau setiap bulannya di dalam meeting bulanan. Target Produksi Bulanan tersebut oleh bagian produksi di-breakdown menjadi Rencana Produksi Mingguan (RPM). Departemen PPIC kemudian melakukan preparasi dan penimbangan bahan baku dan bahan kemas yang diperlukan untuk keperluan produksi selama 1 minggu tersebut supaya proses produksi berjalan dengan lancar. Rencana Produksi Mingguan ini didistribusikan ke seluruh departemen yang tujuannya agar departemen yang terkait dapat melakukan pengaturan dan penyusunan jadwal kerja dari karyawan.
Proses produksi dilaksanakan berdasarkan CPB dan CKB, yang diawali dengan penimbangan bahan baku di ruang penimbangan. Proses penimbangan dilakukan oleh seorang operator dan diawasi oleh seorang petugas In Process Control (IPC). Bahan baku yang telah ditimbang, diberi label identitas yang meliputi keterangan tentang nama bahan, jumlah dan nama produk yang akan dibuat, sedangkan bahan pengemas diserahkan langsung ke bagian pengemasan. Bahan baku yang telah ditimbang diproses sesuai CPB (Catatan Pengolahan Batch) yang memuat keterangan lengkap mengenai nama produk, nomor batch, besar batch, tanggal pengolahan, komposisi/formula produk, spesifikasi produk, peralatan yang dipergunakan, penimbangan bahan, langkah-langkah dalam proses pengolahan, dan hasil yang seharusnya dicapai dari proses tersebut. Khusus penimbangan bahan baku,