LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT SYDNA FARMA
JL. RC. VETERAN NO. 89 BINTARO JAKARTA SELATAN
PERIODE 1 JULI – 29 AGUSTUS 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
SRIWULANTYA, S.Farm.
1306502876
ANGKATAN LXXIX
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT SYDNA FARMA
JL. RC. VETERAN NO. 89 BINTARO JAKARTA SELATAN
PERIODE 1 JULI – 29 AGUSTUS 2014
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
SRIWULANTYA, S.Farm.
1306502876
ANGKATAN LXXIX
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Esa, yang senantiasa melimpahkan karunia dan rahmat-Nya, sehingga dapat terselesaikannya Laporan Praktek Kerja Profesi Apoteker (PKPA) di PT Sydna Farma yang dilaksanakan dari tanggal 1 Juli sampai 29 Agustus 2014. Laporan ini disusun sebagai salah satu syarat memenuhi kurikulum Program Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Indonesia. Pada kesempatan ini penulis menyampaikan terima kasih kepada :
1. Bapak Dr. Mahdi Jufri, M.Si. selaku Dekan Fakultas Farmasi UI.
2. Bapak Dr. Hayun, M.Si. Apt. selaku Ketua Program Profesi Apoteker Fakultas Farmasi UI.
3. Ibu Dra. Nony Shilviani, Apt. Selaku Manajer Pabrik PT Sydna Farma yang telah memberikan kesempatan untuk melakukan PKPA di PT Sydna Farma, serta selaku pembimbing yang telah memberikan bimbingan, pengarahan pelatihan, ilmu dan saran kepada penulis selama penyusunan laporan PKPA. 4. Ibu Dra. Maryati Kurniadi, M.Si., Apt. selaku pembimbing dari Fakultas
Farmasi yang telah memberikan ilmu, bimbingan, dan nasehat yang bermanfaat kepada penulis selama penyusunan laporan PKPA.
5. Ibu Arzuliana Zulkati, S.Si., Apt. Manajer Pemastian Mutu PT Sydna Farma yang telah memberikan bimbingan, pengarahan, ilmu dan saran kepada penulis selama penyusunan laporan PKPA.
6. Bapak Wisnu Hercahya, S.Si., Apt. Selaku Manajer Pengawasan Mutu PT Sydna Farma yang telah memberikan bimbingan, pengarahan, ilmu dan saran kepada penulis selama penyusunan laporan PKPA.
7. Seluruh Manajer, Supervisor, dan Staff PT Sydna Farma yang telah membantu dalam pelaksanaan praktek kerja profesi dan penyusunan laporan ini.
8. Seluruh dosen dan staff tata usaha Fakultas Farmasi UI atas ilmu dan bantuan yang diberikan selama penulis menjalani pendidikan di Program Profesi Apoteker.
menyelesaikan pendidikan profesi Apoteker dengan sebaik mungkin.
10. Rekan-rekan PKPA di PT Sydna Farma yang telah berbagi ilmu, pengalaman dan juga menghibur selama pelaksanaan PKPA.
11. Seluruh sahabat dan teman-teman Program Profesi Apoteker, Fakultas Farmasi UI selaku teman seperjuangan yang telah memberikan dukungan dan semangat.
Penulis menyadari bahwa laporan ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun dari pembaca. Akhir kata, penulis barharap semoga laporan dapat bermanfaat bagi kita semua.
Penulis
Nama : Sriwulantya, S.Farm.
NPM : 1306502876
Program Studi : Profesi Apoteker
Judul : Laporan Praktek Kerja Profesi Apoteker di PT Sydna Farma Jl. RC. Veteran No. 89 Bintaro Jakarta Selatan Periode 1 Juli – 29 Agustus 2014
Praktek Kerja Profesi Apoteker bertujuan untuk meningkatkan pengetahuan dan wawasan tentang segala aspek industri farmasi yang berhubungan dengan Cara Pembuatan Obat yang Baik (CPOB), serta mengetahui dan memahami tugas dan tanggung jawab seorang Apoteker di dalam industri farmasi yang diharapkan dapat menjadi bekal untuk menghadapi dunia kerja yang sesungguhnya. Tugas khusus bertujuan untuk memahami pentingnya kualifikasi kinerja pada mesin dan peralatan yang digunakan dalam proses produksi maupun analisis, serta mampu melaksanakan kualifikasi kinerja dan menyusun laporan kualifikasi autoklaf Hirayama HV-50 pada laboratorium analisis mikrobiologi di PT Sydna Farma.
Kata kunci : PT Sydna Farma, CPOB, Kualifikasi Tugas umum : vii+ 85 halaman; 6 lampiran Tugas Khusus : iii+ 18 halaman; 1 lampiran Daftar Acuan Tugas Umum : 27 (2006-2014) Daftar Acuan Tugas Khusus : 10 (2007-2014)
Name : Sriwulantya, S.Farm.
NPM : 1306502876
Study Program : Apothecary Profession, Pharmacy Faculty
Title : Pharmacist Internship Report at PT Sydna Farma Jl. RC. Veteran No. 89 Bintaro, South Jakarta Periods of July 1st - August 29th 2014
Praktek Kerja Profesi Apoteker (PKPA) aims to increase knowledge and insight on all aspects of the pharmaceutical industry associated with the Good Manufacturing Practice (GMP), and to know and understand the duties and responsibilities of a pharmacist in the pharmaceutical industry and is expected to be beneficial to face the world of work in the future. Specific task aims to understand the importance of qualifying performance on machines and equipment used in the production process and analysis, and able to carry out qualification and performance qualification autoclave compiling reports Hirayama HV-50 in laboratory microbiological analysis in PT Sydna Farma.
Key Words: PT Sydna Farma, CPOB, Qualifications General Assignment: vii+ 85 pages; 6 appendices Specific Assignment: iii+ 18 pages; 1 appendices Bibliography of General Assignment: 27 (2006-2014) Bibliography of Specific assignment: 10 (2007-2014)
DAFTAR ISI
Hal
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
BAB 1 PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2 TINJAUAN UMUM 2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 6
BAB 3 TINJAUAN KHUSUS 3.1 Profil PT Sydna Farma ... 27
3.2 Lokasi dan Saran Produksi ... 27
3.3 Visi dan Misi ... 29
3.4 Niali Utama PT Sydna Farma ... 29
3.5 Organisasi dan tata Kerja ... 30
3.6 Produk PT Sydna Farma ... 52
BAB 4 PEMBAHASAN 4.1 Penerapan CPOB di Industri ... 53
4.2 Manajemen Mutu ... 54
4.3 Personalia ... 54
4.4 Bangunan dan Failitas ... 55
4.5 Peralatan ... 63
4.6 Sanitasi dan Higiene ... 64
4.7 Produksi ... 66
4.8 Pengawasan Mutu ... 67
4.9 Inspeksi Diri dan Audit Mutu ... 68
4.10 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalia ... 69
4.11 Dokumentasi ... 69
4.12 Pembuatan dan Analisis Berdasarkan Kontrak ... 70
4.13 Kualifikasi dan Validasi ... 71
BAB 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 72
5.2 Saran ... 72
DAFTAR GAMBAR
Hal
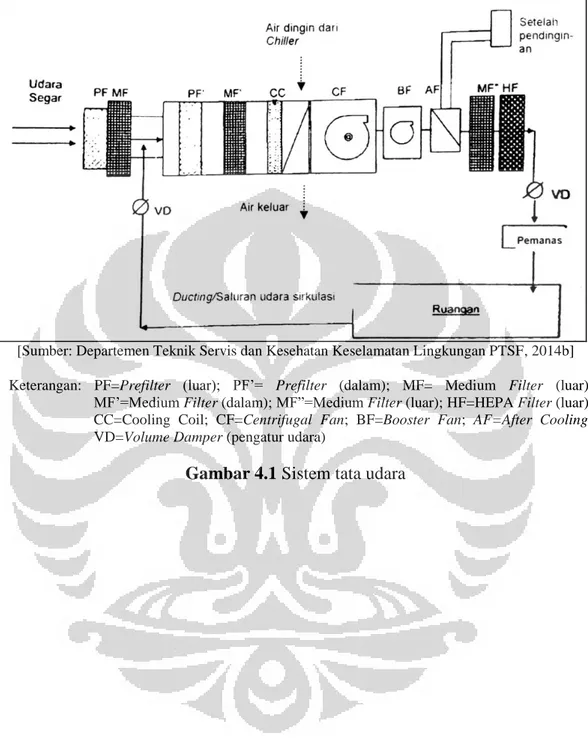
Gambar 4.1 Sistem Tata Udara ... 75
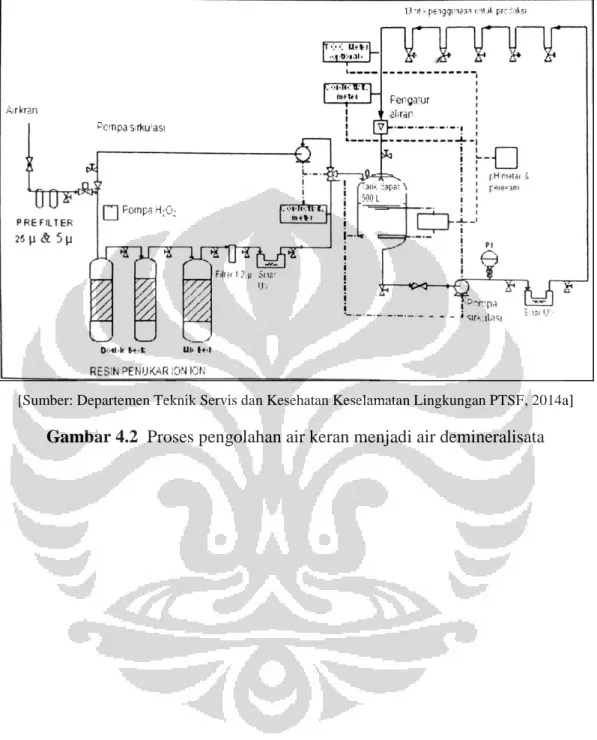
Gambar 4.2 Proses Pengolahan Air Keran Menjadi Air Demineralisata ... 76
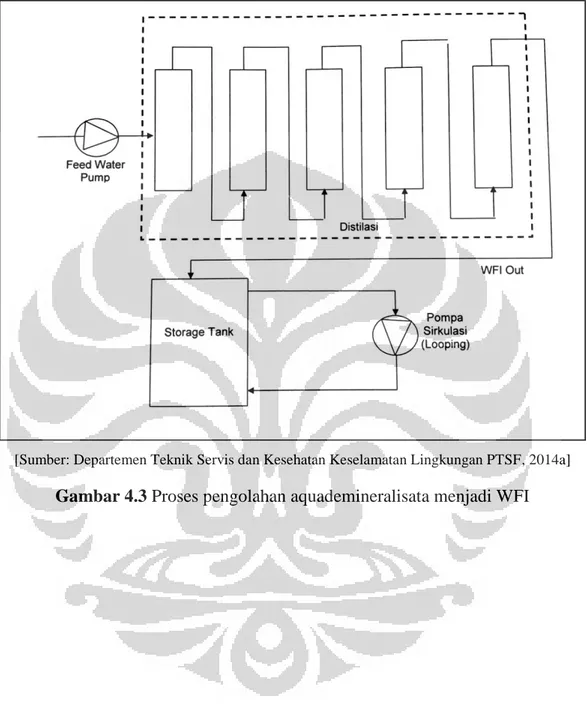
Gambar 4.3 Proses Pengolahan Aquademineralisata Menjadi WFI ... 77
DAFTAR LAMPIRAN
Hal Lampiran 1. Bagan Struktur Organisasi Pabrik PT Sydna Farma ... 80 Lampiran 2. Bagan Struktur Organisasi Departemen Pengadaan PT Sydna
Farma ... 81 Lampiran 3. Bagan Struktur Organisasi Departemen Produksi PT Sydna
Farma ... 82 Lampiran 4. Bagan Struktur Organisasi Departemen Pemastian Mutu PT
Sydna Farma ... 83 Lampiran 5. Bagan Struktur Organisasi Departemen Pengawasan Mutu PT
Sydna Farma ... 84 Lampiran 6. Bagan Struktur Organisasi Departemen Teknik Servis dan
PENDAHULUAN 1.1 Latar Belakang
Industri farmasi merupakan salah satu industri yang dikontrol dan diawasi dengan ketat oleh pemerintah dan Badan Pengawasan Obat dan Makanan (BPOM). Pengontrolan tersebut ditinjau dari segi perizinan, produksi, peredaran, maupun kualitas obat yang diedarkan. Hal tersebut dilakukan agar industri farmasi menghasilkan produk yang memenuhi syarat mutu sehingga terwujud kesehatan nasional.
Penerapan CPOB merupakan salah satu upaya yang dilakukan oleh industri farmasi untuk meningkatkan kualitas obat yang diproduksinya. CPOB adalah pedoman pembuatan obat bagi industri farmasi di Indonesia yang bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan mutu yang ditetapkan dan sesuai dengan tujuan penggunaannya. Melalui pedoman CPOB semua aspek yang berhubungan dengan produksi dan pengendalian mutu obat diperhatikan dan ditentukan sedemikian rupa sehingga tujuannya tercapai. Menurut CPOB, tidaklah cukup bila obat jadi hanya sekedar lulus dari serangkaian pengujian, tetapi yang penting adalah bahwa mutu harus dibentuk ke dalam produk tersebut (BPOM, 2012). CPOB menyangkut berbagai aspek mulai dari manajemen mutu, personalia, bangunan dan fasilitas, peralatan dan higienis, produksi, pengawasan mutu, inspeksi diri, audit mutu dan persetujuan pemasok, penanganan keluhan terhadap obat dan penarikan kembali obat serta obat kembalian, dokumentasi, pembuatan dan analisis berdasarkan kontrak, serta kualifikasi dan validasi (BPOM, 2012).
Seorang apoteker di industri farmasi mempunyai peranan dan tanggung jawab penting untuk menerapkan aspek-aspek yang tercantum dalam CPOB tersebut, antara lain sebagai penanggung jawab produksi, penanggung jawab pengawasan dan pemastian mutu. Untuk mencapai peran dan tanggung jawab tersebut, apoteker dituntut memiliki pengetahuan dan keterampilan yang memadai. Namun, pemahaman melalui teori yang didapat dari perkuliahan saja masih kurang mencukupi, maka calon apoteker perlu dibekali dengan
pengetahuan dan pemahaman yang komprehensif antara teori dengan prakteknya secara langsung.
Program Profesi Apoteker Farmasi Universitas Indonesia bekerja sama dengan PT Sydna Farma dalam meyelenggarakan Praktek Kerja Profesi Apoteker (PKPA) bagi para calon Apoteker guna memberikan perbekalan, pengetahuan, pemahaman dan gambaran singkat peran dan tanggung jawab Apoteker di industri farmasi. Pelaksanaan praktek kerja berlangsung dari 1 Juli – 29 Agustus 2014. Dengan adanya praktek kerja ini diharapakan mahasiswa calon Apoteker dapat mengambil manfaat dan ilmu sebanyak mungkin agar nantinya dapat diterapkan secara nyata di dunia kerja.
1.2 Tujuan
Tujuan dari Praktek Kerja Profesi Apoteker Universitas Indonesia di industri farmasi PT Sydna Farma adalah:
a. Meningkatkan pengetahuan dan wawasan tentang segala aspek industri farmasi yang berhubungan dengan Cara Pembuatan Obat yang Baik (CPOB).
b. Melihat secara langsung proses produksi obat serta penerapan CPOB di PT Sydna Farma.
c. Mengetahui dan memahami tugas dan tanggung jawab seorang Apoteker di dalam industri farmasi yang diharapkan dapat menjadi bekal untuk menghadapi dunia kerja yang sesungguhnya.
BAB 2
TINJAUAN UMUM 2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Berdasarkan Surat Keputusan Menteri Kesehatan No.1799/Menkes/Per/XII 2010 tentang Industri Farmasi, industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat dan bahan obat. Definisi dari obat jadi menurut Surat Kepmenkes No.245/MenKes/SK/V/1990 adalah sediaan atau paduan bahan-bahan yang siap digunakan untuk mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi, sedangkan yang dimaksud dengan bahan baku obat adalah bahan baik yang berkhasiat maupun yang tidak berkhasiat yang digunakan dalam pengolahan obat dengan standar mutu sebagai bahan farmasi. Proses pembuatan obat dan/atau bahan obat hanya dapat dilakukan oleh industri farmasi. Industri farmasi dapat melakukan kegiatan proses pembuatan obat dan/atau bahan obat untuk semua tahapan kegiatan dalam menghasilkan obat, yang meliputi pengadaan bahan awal dan bahan pengemas, produksi, pengemasan, pengawasan mutu dan pemastian mutu sampai diperoleh obat untuk didistribusikan (Kementrian Kesehatan Republik Indonesia, 2010).
2.1.2 Persyaratan Usaha Industri Farmasi
Perusahaan industri farmasi wajib memperoleh izin usaha industri farmasi. Usaha industri farmasi wajib memenuhi persyaratan sebagai berikut (Kementrian Kesehatan Republik Indonesia, 2010):
a. Setiap pendirian industri farmasi wajib memperoleh izin industri farmasi dari Direktur Jenderal Bina Kefarmasiaan dan Alat Kesehatan.
b. Industri farmasi yang membuat obat dan/atau bahan obat yang termasuk dalam golongan narkotika wajib memperoleh izin khusus untuk memproduksi narkotika sesuai dengan ketentuan peraturan perundang-undangan.
Adapun persyaratan untuk memperoleh izin industri farmasi, antara lain: a. Berbadan usaha berupa perseroan terbatas
b. Memiliki rencana investasi dan kegiatan pembuatan obat c. Memilik Nomor Pokok Wajib Pajak
d. Memiliki secara tetap paling sedikit 3 (tiga) orang apoteker Warga Negara Indonesia, masing-masing sebagai penanggung jawab pemastian mutu, produksi dan pengawasan mutu.
e. Komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
2.1.3 Izin Usaha Industri Farmasi
Untuk memperoleh izin usaha industri farmasi diperlukan persetujuan prinsip yang berlaku selama 3 (tiga) tahun. Permohonan persetujuan prinsip diajukkan kepda Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan. Dalam hal permohonan persetujuan prinsip dilakukan oleh industri Penanaman Modal Asing (PMA) atau Penanaman Modal Dalam Negeri (PMDN), pemohon harus memperoleh surat persetujuan penanaman modal dari instansi yang menyelenggarakan urusan penanaman modal sesuai ketentuan peraturan perundang-undangan. Persetujuan prinsip diberikan olek Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan setelah pemohon memperoleh persetujuan Rencana Induk Pembangunan (RIP) dari Kepala BPOM. Dalam hal permohonan persetujuan prinsip telah diberikan, pemohon dapat langsung melakukan persiapan, pembagunan, pengadaan, pemasangan dan instalasi peralatan termasuk produksi percobaan dengan memperhatikan ketentuan perundang-undangan.
Setiap pendirian industri farmasi wajib memenuhi ketentuan sebagaimana diatur dalam peraturan perundang-undangan di bidang tata ruang dan lingkungan hidup. Industri farmasi wajib memenuhi persyaratan CPOB yang dibuktikan dengan sertifikat CPOB. Sertifikat CPOB berlaku selama 5 (lima) tahun sepanjang memenuhi persyaratan. Ketentuan mengenai persyaratan dan tata cara sertifikasi CPOB diatur oleh Kepala BPOM. Izin usaha industri farmasi diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan dengan rekomendasi
dari kepala BPOM. Izin ini berlaku seterusnya selama perusahaan industri farmasi tersebut berproduksi dan memenuhi ketentuan peraturan perundang-undangan. Industri farmasi yang akan melakukan perubahan bermakna terhadap pemenuhan persyratan CPOB baik untuk perubahan kapasitas dan/atau fasilitas produksi wajib melapor dan mendapat persetujuan sesuai dengan perundang-undangan. Untuk industri farmasi PMA, masa berlakunya sesuai dengan ketentuan dalam UU No. 1 tahun 1967 tentang Penanaman Modal Asing dan peraturan pelaksanaannya.
Perusahaan industri farmasi yang telah mendapat Izin Usaha Industri wajib:
a. Menyampaikan laporan industri secara berkala mengenai kegiatan usahanya, yaitu sekali dalam enam bulan, meliputi jumlah dan nilai produksi setiap obat atau bahan obat yang dihasilkan serta sekali dalam satu tahun.
b. Melaksanakan upaya keseimbangan dan kelestarian sumber daya alam serta pencegahan timbulnya kerusakan dan pencemaran terhadap lingkungan hidup akibat kegiatan industri farmasi yang dilakukannya. c. Melaksanakan upaya yang menyangkut keamanan dan keselamatan alat,
bahan baku dan bahan penolong, proses serta hasil produksinya termasuk pengangkutannya dan keselamatan kerja.
d. Melakukan Analisa Mengenai Dampak Lingkungan (AMDAL) yang berlaku bagi jenis-jenis industri yang telah ditetapkan dan kewajiban untuk melakukannya setelah memperoleh Izin Usaha Industri Farmasi.
2.1.4 Pelanggaran Industri Farmasi
Pelanggaran terhadap ketentuan yang tercantum dalam peraturan Menteri Kesehatan Republik Indonesia No.1799/Menkes/Per/XII/2010 tentang Industri Farmasi dapat dikenakan sanksi administratif berupa:
a. Peringatan secara tertulis (diberikan oleh Kepala BPOM).
b. Larangan mengedarkan untuk sementara waktu dan/atau perintah untuk penarikan kembali obat atau bahan obat dari peredaran bagi obat atau
bahan obat yang tidak memenuhi standar dan persyaratan keamanan, khasiat, atau mutu (diberikan oleh Kepala BPOM).
c. Perintah pemusnahan obat atau bahan obat jika terbukti tidak memenuhi persyaratan keamanan, khasiat atau mutu (diberikan oleh Kepala BPOM). d. Penghentian sementara kegiatan (diberikan oleh Kepala BPOM).
e. Pembekuan izin industri farmasi (diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala BPOM).
f. Pencabutan izin industri farmasi (diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala BPOM).
2.1.5 Pencabutan Izin Usaha industri Farmasi
a. Perusahaan Industri Farmasi yang telah mendapatkan Izin Usaha Industri Farmasi melakukan pemindah tanganan hak milik Izin Usaha Industri Farmasi dan memperluas tanpa memiliki izin sesuai dengan ketentuan dalam Surat Keputusan ini.
b. Perusahaan Industri Farmasi yang telah mendapatkan Izin Usaha Industri Farmasi tidak menyampaikan informasi industri farmasi secara berturut-turut 3 (tiga) kali atau dengan sengaja menyampaikan informasi yang tidak benar.
c. Perusahaan Industri Farmasi yang telah mendapatkan Izin Usaha Industri Farmasi melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis terlebih dahulu dari menteri.
d. Perusahaan Industri Farmasi yang telah mendapatkan Izin Usaha Industri Farmasi dengan sengaja memproduksi Obat Jadi atau Bahan Baku Obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku, obat palsu. e. Tidak dipenuhinya ketentuan dalam Izin Usaha Industri Farmasi yang
ditetapkan dalam Surat Keputusan
2.2 Cara Pembuatan Obat yang Baik (CPOB)
Secara prinsip, CPOB bertujuan untuk mejamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. CPOB mencakup seluruh aspek produksi dan pengendalian mutu.
Pada pembuatan obat, pengedalian menyeluruh adalah sangat esensial untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Pembuatan secara sembarangan tidak dibenarkan bagi produk yang digunakan untuk menyelamatkan jiwa atau memulihkan atau memelihara kesehatan. Suatu produk tidak hanya lulus dari serangkaian pengujian tapi yang lebih adalah bahwa mutu harus dibentuk dalam produk tersebut. Mutu obat tergantung pada bahan awal, bahan pengemas, proses produksi, dan pengendalian mutu, bangunan, peralatan yang dipakai dan personel yang terlibat.
Tidaklah cukup bila produk jadi hanya sekedar lulus dari serangkaian pengujian, tetapi yang lebih penting adalah bahwa mutu harus dibentuk ke dalam produk tersebut. Mutu obat tergantung pada bahan awal, bahan pengemas, proses produksi, dan pengendalian mutu, bangunan, peralatan yang dipakai dan personel yang terlibat. Pedoman ini juga dimaksudkan untuk digunakan oleh industri farmasi sebagai dasar pengembangan aturan internal sesuai kebutuhan. Pemastian mutu suatu obat tidak hanya mengandalkan pada pelaksanaan pengujian tertentu saja, namun hendaklah dibuat dalam kondisi yang dikendalikan dan dipantai secara cermat. CPOB merupakan pedoman yang bertujuan untuk memastikan agar mutu obat yang dihasilkan sesuai persyaratan dan tujuan penggunaannya, bila perlu dapat dilakukan penyesuaian pedoman dengan syarat bahwa standar mutu obat yang telah ditentukan tetap tercapai. CPOB adalah bagian dari Pemastian Mutu yang memastikan bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan dipersyaratkan dalam izin edar dan spesifikasi produk. CPOB mencakup Produksi dan Pengawasan Mutu. Persyaratan dasar dari CPOB adalah :
a. Semua proses pembuatan obat dijabarkan dengan jelas, dikaji secara sistematis berdasarkan pengalaman dan terbukti mampu secara konsisten menghasilkan obat yang memenuhi persyaratan mutu yang telah ditetapkan.
b. Tahap proses yang kritis dalam pembuatan, pengawasan proses dan sarana penunjang serta perubahan yang signifikan divalidasi. Tersedia semua
sarana yang diperlukan dalam CPOB termasuk: personel terkualifikasi dan terlatih, bangunan dan sarana dengan luas memadai, peralatan dan sarana penunjang yang sesuai, bahan, wadah dan label yang benar, prosedur dan instruksi yang disetujui, tempat penyimpanan dan transportasi yang memadai.
c. Prosedur dan instruksi ditulis dalam bentuk instruksi dengan bahasa yang jelas, tidak bermakna ganda, dapat diterapkan secara spesifik pada sarana yang tersedia.
d. Operator memperoleh pelatihan untuk menjalankan prosedur secara benar. e. Pencatatan dilakukan secara manual atau dengan alat pencatat selama
pembuatan yang menunjukkan bahwa semua langkah yang dipersyaratkan dalam prosedur dan instruksi yang ditetapkan benar-benar dilaksanakan dan jumlah serta mutu produk yang dihasilkan sesuai dengan yang diharapkan. Tiap penyimpangan dicatat secara lengkap dan diinvestigasi. f. Catatan pembuatan termasuk distribusi yang memungkinkan penelusuran
riwayat bets secara lengkap, disimpan secara komprehensif dan dalam bentuk yang mudah diakses.
g. Penyimpanan dan distribusi obat yang dapat memperkecil risiko terhadap mutu obat.
h. Tersedia sistem penarikan kembali bets manapun dari peredaran.
i. Keluhan terhadap produk yang beredar dikaji, penyebab cacat mutu diinvestigasi serta dilakukan tindakan perbaikan yang tepat dan pencegahan pengulangan kembali keluhan.
2.2.1 Menejemen Mutu (Quality Management)
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbukan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Menejemen bertanggung jawab untuk pencapaian tujuan ini melalui “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor.
Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan system Pemastian Mutu yang didesain secara menyeluruh dan diterapkan secara benar serta menginkoporasi Cara Pembuatan Obat yang Baik termasuk Pengawasan Mutu dan Manajemen Resiko Mutu. Untuk dasar manajemen mutu adalah :
a. Suatu infrastruktur atau sistem yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya.
b. Tindakan sistematis yang diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang ditetapkan. Keseluruhan tindakan tersebut disebut Pemastian Mutu
Semua bagian sistem Pemastian Mutu hendaklah didukung dengan ketersediaan personel yang kompeten, bangunan dan saran serta peralatan yang cukup dan memadai. Tambahan tanggung jawab legal hendaklah diberikan kepada Menejemen Mutu (Pemastian Mutu).
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapaan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu, industri farmasi bertanggung jawab untuk menyediakan personel yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personel hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personel hendaklah memahami prinsip CPOB serta memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenal hygiene yang berkaitan dengan pekerjaannya.
Industri farmasi hendaknya memiliki personel yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai. Tiap personel hendaklah tidak dibebani tanggung jawab yang berlebihan untuk menghindari risiko terhadap mutu obat. Industri farmasi juga harus memiliki struktur organisasi. Tugas spesifik dan kewenangan dari personel pada posisi penanggung jawab hendaklah dicantumkan dalam uraian tugas tertulis. Hendaklah aspek penerapan CPOB tidak
ada yang terlewatkan ataupun tumpang tindih dalam tanggung jawab yang tercantum dalam uraian tugas.
Personel kunci mencakup kepala bagian produksi, kepala bagian pengawasan mutu, kepala bagian manajemen mutu (pemastian mutu). Posisi utama tersebut dijabat oleh personel purna waktu. Kepala bagian produksi dan kepala bagian manajemen mutu (pemastian mutu)/kepala bagian pengawasan mutu harus independen satu terhadap yang lain.
Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi, pengawasan mutu, manajemen mutu (pemastian mutu) dipimpin oleh orang yang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Masing-masing personil hendaklah diberi wewenang penuh dan sarana yang memadai yang diperlukan untuk dapat melaksanakan tugasnya secara efektif. Hendaklah personil tersebut tidak mempunyai kepentingan lain di luar organisasi yang dapat menghambat atau membatasi kewajibannya dalam melaksanakan tanggung jawab atau yang dapat menimbulkan konflik kepentingan pribadi atau finansial.
Industri farmasi hendaklah memberikan pelatihan bagi seluruh personel yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk personel teknik, perawatan dan petugas kebersihan), dan bagi personel lain yang kegiatannya dapat berdampak pada mutu produk. Disamping pelatihan dasar dalam teori dan praktek CPOB, personel baru hendaklah mendapat pelatihan sesuai dengan tugas yang diberikan. Pelatihan berkesinambungan hendaklah juga diberikan, dan efektivitas penerapannya hendaklah dinilai secara berkala. Hendaklah tersedia program pelatihan yang disetujui kepala bagian masing-masing dan catatan pelatihan hendaklah disimpan.
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi, dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya
kekeliruan, pencemaran silang dan kesalahan lain, dan memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Adapun syarat-syarat bangunan dan fasilitas menurut CPOB adalah sebagai berikut :
a. Letak bangunan hendaklah sedemikian rupa untuk menghindari terjadinya pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah dan air serta kegiatan insustri lainnya yang berdekatan.
b. Bangunan dan fasilitas hendaklah didesain, dikontruksi, dilengkapi dan dirawat sedemikian agar memperoleh perlindungan maksimal terhadap pengaruh cuaca, banjir, rembesan dari tanah serta masuk dan bersarangnya serangga, burung, binatang pengerat, kutu atau hewan lain.
c. Desain dan tata letak ruang hendaklah memastikan kompatibilitas dengan kegiatan produksi lain yang mungkin dilakukan di dalam sarana yang sama atau sarana yang berdampingan dan pencegahan area produksi dimanfaatkan sebagai jalur lalu lintas bagi personel dan bahan atau produk, atau sebagai tempat penyimpanan bahan atau produk selain yang sedang diproses.
d. Tata letak ruang produksi sebaiknya dirancang sedemikian rupa untuk memungkinkan kegiatan produksi dilakukan di area yang saling berhubungan antara satu ruangan dengan ruangan lain mengikuti urutan tahap produksi dan menurut kelas kebersihan yang dipersyaratkan; luasnya area kerja dan area penyimpanan bahan atau produk yang sedang dalam proses hendaknya memadai untuk memungkinkan penempatanan peralatan dan bahan secara teratur dan sesuai dengan alur proses, sehingga dapat memperkecil risiko terlewat atau salah melaksanakan tahapan proses produksi atau pengawasan. e. Daerah pengolahan produk steril dipisahkan dari daerah produksi lain serta
dirancang dan dibangunan secara khusus.
f. Obat yang mengandung golongan penisilin dan sefalosporin diproduksi dalam suatu bangunan yang terpisah dilengkapi peralatan pengendali udara.
g. Permukaan dinding, lantai dan langit-langit bagian dalam ruangan di mana terdapat bahan baku dan bahan pengemas primer, produk antara atau produk ruahan yang terpapar ke lingkungan hendaklah halus, bebas retak dan sambungan yang terbuka, tidak melepaskan partikulat, serta memungkinkan pelaksanaan pembersihan (bila perlu disinfeksi) yang mudah dan efektif. h. Saluran pembuangan air hendaklah cukup besar dan dilengkapi bak kontrol
untuk mencegah alir balik.
i. Area produksi hendaklah mendapat penerangan yang memadai, terutama di mana pengawasan visual dilakukan pada saat proses berjalan.
2.2.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan kontruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets lain dan untuk memudahkan pembersihan serta perawatan agar dapat mencegah dari kontaminasi silang, penumpukan debu atau kotoran dan, hal-hal yang umumnya berdampak buruk pada mutu produk. Peralatan manufaktur hendaklah didesain, ditempatkan dan dirawat sesuai dengan tujuannya. Permukaan peralatan yang bersentuhan dengan bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi atau absorpsi yang dapat mempengaruhi identitas, mutu atau kemurnian di luar batas yang ditentukan.
Peralatan manufaktur hendaklah didesain sedemikian rupa agar mudah dibersihkan, serta tidak boleh menimbulkan akibat yang merugikan terhadap produk. Pemasangan dan penempatan peralatan diatur sedemikian rupa sehingga proses produksi dapat berjalan secara efektif dan efisien. Peralatan hendaklah dirawat menurut jadwal yang tepat supaya tetap berfungsi dengan baik dan mencegah terjadinya pencemaran yang dapat mengubah identitas, mutu atau kemurnian produk. Peralatan yang rusak harus dikeluarkan dari area produksi dan pengawasan mutu, atau setidaknya diberi penandaan yang jelas.
Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat mempengaruhi identitas, mutu atau kemurnian produk.
Kegiatan perbaikan dan perawatan hendaklah tidak menimbulkan risiko terhadap mutu produk.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan hygiene meliputi personel, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat merupakan sumber kontaminasi produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan hygiene yang menyeluruh dan terpadu.
Pembersihan mesin dapat mencegah adanya kontaminasi terhadap produk. Tiap kali sebelum dipakai, kebersihan peralatan diperiksa untuk memastikan bahwa semua produk atau bahan dari bets sebelumnya telah dihilangkan. Metode pembersihan dengan cara vakum atau cara basah lebih dianjurkan. Penggunaan udara bertekanan dan sikat sedapat mungkin dihindari karena dapat menambah risiko pencemaran produk. Pembersihan dan sanitasi perlatan serta wadah yang digunakan dalam pembuatan obat hendaklah tercakup dalam suatu prosedur tertulis yang cukup rinci.
Penerapan higiene perorangan meliputi pemeriksaan kesehatan, menjaga kebersihan diri, memakai alat pelindungan diri dengan baik, menjaga kesehatan dan bebarapa peraturan lain di area produksi. Semua personel hendaklah menjalani pemeriksaan kesehatan pada saat direkrut. Selain itu, hendaklah dilakukan juga pemeriksaan kesehatan kerja dan kesehatan personel secara berkala.
2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar. Produksi obat membutuhkan sarana gedung produksi, pengemasan, penyimpanan. Material yang memenuhi
persyaratan, peralatan yang terkualifikasi dan terkalibrasi, personalia yang terlatih dan berkualitas. Proses produksi yang tervalidasi dan dokumen produksi yang sah yang dapat ditelusuri. Mutu suatu obat tidak hanya ditentukan oleh hasil analisa terhadap produk akhir melainkan juga oleh mutu yang dibangun selama tahapan proses produksi sejak pemilihan bahan awal, penimbangan, proses produksi, personalia, bangunan, peralatan kebersihan, dan higienis sampai dengan pengemasan.
Produksi hendaklah dilakukan dan diawasi oleh personel yang kompeten. Prosedur produksi dibuat oleh penanggung jawab produksi bersama dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang dihasilkan memenuhi spesifikasi yang telah ditentukan. Prosedur kerja standar hendaklah tertulis, mudah dipahami dan dipatuhi oleh karyawan produksi, serta didokumentasikan. Dokumentasi setiap langkah dilakukan dengan cermat, tepat dan ditangani oleh karyawan yang melaksanakan tugas.
Hal-hal yang perlu diperhatikan dalam produksi adalah: a. Pengadaan Bahan Awal
Pengadaan bahan awal hendaklah hanya dari pemasok yang telah disetujui dan memenuhi spesifikasi yang relevan. Semua penerimaan, pengeluaran dan jumlah bahan tersisa hendaklah dicatat. Catatan hendaklah berisi keterangan mengenai pasokan, nomor batch/lot, tanggal penerimaan, tanggal pelulusan, dan tanggal kadaluarsa.
b. Validasi Proses
Studi validasi hendaklah memperkuat pelaksanaan CPOB dan dilakukan sesuai dengan prosedur yang telah ditetapkan. Hasil validasi dan kesimpulan hendaklah dicatat. Hendaklah secara kritis dilakukan revalidasi secara periodik untuk memastikan bahwa proses dan prosedur tetap mampu mencapai hasil yang diinginkan.
c. Pencegahan Pencemaran Silang
Tiap tahap proses, produk dan bahan hendaklah dilindungi terhadap pencemaran mikroba dan pencemaran lain. Risiko pencemaran silang ini dapat timbul akibat tidak terkendalinya debu, uap, percikan atau organisme
dari bahan atau produk yang sedang diproses, dari sisa yang tertinggal pada alat dan pakaian kerja operator. Tingkat risiko pencemaran ini tergantung dari jenis pencemar dan produk yang tercemar.
d. Sistem Penomoran Bets/Lots
Hendaklah tersedia sistem yang menjelaskan secara rinci penomoran bets/lot dengan tujuan untuk memastikan bahwa tiap bets/lot produk antara, produk ruahan atau produk jadi dapat diidentifikasi. Sistem penomoran bets/lot hendaklah menjamin bahwa nomor bets/lot yang sama tidak dipakai secara berulang.
e. Penimbangan dan Penyerahan
Penimbangan dan penyerahan bahan awal, bahan pengemas, produk antara dan produk ruahan dianggap sebagai bagian dari siklus produksi dan memerlukan dokumentasi yang lengkap. Hanya bahan awal, bahan pengemas, produk antara dan produk ruahan yang telah diluluskan oleh pengawasan mutu dan masih belum daluarsa yang boleh diserahkan.
f. Pengembalian
Semua bahan awal dan bahan pengemas yang dikembalikan ke gudang penyimpanan hendaklah didokumentasikan dengan benar dan rekonsiliasi. g. Operasi Pengolahan Produk Antara dan Produk Ruahan
Semua bahan yang dipakai di dalam pengolahan hendaklah diperiksa sebelum dipakai. Semua peralatan yang dipakai dalam pengolahan hendaklah diperiksa sebelum digunakan. Peralatan hendaklah dinyatakan bersih secara tertulis sebelum digunakan. Semua kegiatan pengolahan hendaklah dilaksanakan mengikusi prosedur yang tertulis. Tiap penyimpangan hendaklah dilaporkan. Semua produk antara hendaklah diberi label yang benar dan dikarantina sampai diluluskan oleh bagian pengawasan mutu. h. Kegiatan Pengemasan
Kegiatan pengemasan berfungsi mengemas produk ruahan menjadi produk jadi. Pengemasan hendaklah dilaksanakan di bawah pengendalian yang ketat untuk menjaga identitas, keutuhan dan mutu produk akhir yang dikemas. Semua kegiatan pengemasan hendaklah dilaksanakan sesuai dengan instruksi yang diberikan dan menggunakan bahan pengemas yang tercantum dalam
prosedur pengemasan induk. Rincian pelaksanaan pengemasan hendaklah dicatat dalam catatan pengemasan batch.
i. Pengawasan Selama Proses
Pengawasan selama proses hendaklah mencakup :
1) Semua parameter produk, volume atau jumlah isi produk diperiksa pada saat awal dan selama proses pengolahan atau pengemasan.
2) Kemasan akhir diperiksa selama proses pengemasan dengan selang waktu yang teratur untuk memastikan kesesuaiannya dengan spesifikasi dan memastikan semua komponen sesuai dengan yang ditetapkan dalam prosedur pengemasan induk.
j. Bahan dan Produk yang Ditolak, Dipulihkan dan Dikembalikan
Bahan dan produk yang ditolak hendaklah diberi penandaan yang jelas dan disimpan terpisah di “area terlarang” (restricted area). Bahan atau produk tersebut hendaklah dikembalikan kepada pemasoknya atau, bila dianggap perlu, diolah ulang atau dimusnahkan. Bets yang mengandung produk pulihan hanya boleh diluluskan setelah semua bets asal produk pulihan yang bersangkutan telah dinilai dan dinyatakan memenuhi spesifikasi yang ditetapkan. Produk yang dikembalikan dari peredaran dan telah lepas dari pengawasan industri pembuat hendaklah dimusnahkan. Produk tersebut dapat dijual lagi, diberi label kembali atau dipulihkan ke bets berikut hanya bila tanpa keraguan mutunya masih memuaskan setelah dilakukan evaluasi secara kritis oleh kepala bagian Manajemen Mutu (Pemastian Mutu) sesuai prosedur tertulis.
k. Karantina dan Penyerahan Produk Jadi
Karantina produk jadi merupakan tahap akhir pengendalian sebelum penyerahan ke gudang dan siap untuk didistribusikan. Sebelum diluluskan untuk diserahkan ke gudang, pengawasan yang ketat hendaklah dilaksanakan untuk memastikan produk dan catatan pengolahan batch memenuhi semua spesifikasi yang ditentukan. Prosedur tertulis hendaklah mencantumkan cara penyerahan produk jadi ke area karantina, cara penyimpanan sambil
menunggu pelulusan, persyaratan yang diperlukan untuk memperoleh pelulusan, dan cara pemindahan selanjutnya ke gudang produk jadi.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang penting dari CPOB untuk memastikan bahwa produk yang dibuat senantiasa konsisten dan mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi obat jadi. Pengawasan mutu hendaklah mencakup semua kegiatan analisis yang dilakukan di laboratoriun, termasuk pengambilan sampel, spesifikasi, pengujian serta termasuk pengaturan, dokumentasi dan prosedur pelulusan yang memastikan bahwa semua pengujian yang relevan telah dilakukan dan bahan tidak diluluskan untuk dipakai atau produk diluluskan untuk dijual, terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk.
Tiap personel yang bertugas melakukan kegiatan laboratorium hendaklah memiliki pendidikan, mendapat pelatihan dan pengalaman yang sesuai untuk memungkinkan pelaksanaan tugas dengan baik. Personel hendaklah memakai pakaian pelindung dan alat pengaman seperti masker, kacamata pelindung, dan sarung tangan tahan asam atau basa sesuai tugas yang dilaksanakan. Peralatan, instrumen dan perangkat lunak terkait hendaklah dikualifikasi dan divalidasi, dirawat dan dikalibrasi dalam selang waktu yang telah ditetapkan dan dokumentasinya disimpan. Prosedur pengujian hendaklah divalidasi dengan memperhatikan fasilitas dan peralatan yang ada sebelum prosedur tersebut digunakan dalam pengujian rutin.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan yang digunakan dalam produksi dan produk yang disetujui sebelum didistribusikan. Personel pengawasan mutu hendaklah memiliki akses ke area produksi untuk pengambilan sampel dan penyelidikan yang diperlukan.
Personel, bangunan dan fasilitas, serta peralatan laboratorium hendaklah sesuai untuk segala jenis tugas yang ditentukan dan skala kegiatan pembuatan obat.
2.2.8 Inspeksi Diri, Audit Mutu dan Audit & Persetujuan Pemasok
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi kriteria CPOB (Badan Pengawas Obat dan Makanan, 2012).
Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan yang dapat mengevaluasi penerapan CPOB secara objektif (Badan Pengawas Obat dan Makanan, 2012). Inspeksi diri dilakukan oleh suatu tim, yang terdiri dari tiga anggota yang berpengalaman dalam bidangnya masing-masing dan memahami CPOB serta bersifat independen dalam melakukan inspeksi (Badan Pengawas Obat dan Makanan, 2006). Anggota tim hendaklah dipilih dari bagian-bagian produksi, pengawasan mutu, pemastian mutu, penelitian dan pengembangan teknik (Badan POM, 2009).
Untuk memperoleh standar inspeksi diri hendaklah dibuat daftar periksa selengkap mungkin sebagai rujukan untuk tim inspeksi diri dalam melakukan tugasnya. Daftar periksa ini hendaklah diperbaharui secara berkala agar selalu mengikuti dan meliputi perubahan, peraturan pemerintah dan kebijakan perusahaan (Badan Pengawas Obat dan Makanan, 2009).
Dengan melakukan inspeksi diri dapat diketahui kekurangan atas pemenuhan CPOB, baik yang kritis, yang berdampak besar maupun yang berdampak kecil. Penilaian terhadap kekurangan tersebut dapat dikategorikan berdasarkan tingkat kekritisannya, antara lain (Badan Pengawas Obat dan Makanan, 2009).
a. Kritis (C) yaitu kekurangan yang mempengaruhi mutu obat dan dapat mengakibatkan reaksi fatal terhadap kesehatan konsumen sampai kematian.
b. Berdampak besar (M) yaitu kekurangan yang mempengaruhi mutu obat tetapi tidak berdampak fatal terhadap kesehatan konsumen.
c. Berdampak kecil (m) yaitu kekurangan yang kecil pengaruhnya terhadap mutu obat dan tidak berdampak terhadap kesehatan konsumen.
Inspeksi diri hendaklah dilakukan secara rutin dan pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif (Badan Pengawas Obat dan Makanan, 2012).
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkannya. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau suatu tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak (Badan Pengawas Obat dan Makanan, 2012). Hendaklah dibuat daftar pemasok yang disetujui untuk bahan awal dan bahan pengemas. Semua pemasok yang telah ditetapkan hendaklah dievaluasi secara teratur.
2.2.9 Penanganan Keluhan terhadap Produk dan Penarikan Kembali Produk
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif (Badan Pengawas Obat dan Makanan, 2012).
Keluhan dan informasi yang berasal dari dalam industri antara lain dapat dari bagian produksi, bagian pengawasan mutu, bagian gudang dan bagian pemasaran, sementara dari luar industri antara lain dapat berasal dari pasien, dokter, paramedis, klinik, rumah sakit, apotek, distributor dan Otoritas Pengawas Obat (Badan Pengawas Obat dan Makanan, 2009).
Penanganan keluhan dan laporan suatu produk termasuk hasil evaluasi dari penyelidikan serta tindak lanjut yang dilakukan hendaklah dicatat dan dilaporkan kepada manajemen atau bagian yang terkait. Catatan keluhan hendaklah dikaji secara berkala untuk mengindetifikasi hal yang spesifik atau masalah yang berulang terjadi, yang memerlukan perhatian dan kemungkinan penarikan kembali produk dari peredaran. Badan POM hendaklah diberitahukan apabila industri farmasi mempertimbangkan tindakan yang terkait dengan kemungkinan kesalahan pembuatam, kerusakan produk, pemalsuan atau segala hal lain yang serius mengenai mutu produk (Badan Pengawas Obat dan Makanan, 2012).
Penarikan kembali produk adalah suatu proses penarikan dari satu atau beberapa bets atau seluruh bets produk tertentu dari rantai distribusi karena keputusan bahwa produk tidak layak lagi untuk diedarkan. Keputusan ini dapat bersumber dari OPO atau dari industri (Badan Pengawas Obat dan Makanan, 2009). Penarikan kembali produk dilakukan oleh personel yang bertanggung jawab untuk melaksanakan dan mengkoordinasikan penarikan kembali produk dan hendaklah ditunjang oleh staf yang memadai untuk menangani semua aspek penarikan kembali sesuai dengan tingkat urgensinya. Personel tersebut hendaklah independen terhadap bagian penjualan dan pemasaran (Badan Pengawas Obat dan Makanan, 2012).
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personel menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil risiko terjadi kesalahan tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, dokumen produksi induk atau formula pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
Dokumen hendaknya didesain, disiapkan, dikaji dan didistribusikan dengan cermat kemudian ditandatangani dan diberi tanggal oleh personel yang sesuai dan diberi wewenang. Dokumen yang diperlukan antara lain:
a. Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu. Hendaklah tersedua spesifikasi bahan awal, spesifikasi bahan pengemas, spesifikasi produk antara dan produk ruahan, serta spesifikasi produk jadi.
b. Dokumen Produksi Induk, Prosedur Pengolahan Induk dan Prosedur Pengemasan Induk (Formula Pembuatan, Instruksi Pengolahan dan Instruksi Pengemasan), menyatakan seluruh bahan awal dan bagan pengemas yang digunakan serta menguraikan semua operasi pengolahan dan pengemasan.
c. Prosedur berisi cara untuk melaksanakan operasi tertentu, misalnya pembersihan, berpakaian, pengendalian lingkungan, pengambilan sampel, pengujian, dan pengoperasian peralatan.
d. Catatan menyajikan pengolahan dan pengemasan bets.
e. Prosedur dan catatan: penerimaan, pengambilan sampel, pengujian dan lain-lain.
Spesifikasi bahan awal dan bahan pengemas mencakup deskripsi bahan, petunjuk pengambilan sampel dan pengujian atau prosedur rujukan, persyaratan kualitatif dan kuantitatif dengan batas penerimaan, kondisi penyimpanan dan tindakan pengamanan, serta batas waktu penyimpanan sebelum dilakukan pengujian kembali. Spesifikasi produk antara dan produk ruah hendaklah tersedia apabila produk tersebut dibeli atau dikirim, atau apabila data dari produk antara digunakan untuk mengevaluasi produk jadi. Spesifikasi produk antara dan produk ruahan hendaklah mirip dengan spesifikasi bahan awal atau produk jadi sesuai keperluan. Spesifikasi produk jadi mencakup nama produk yang ditentukan dan kode produk, formula atau komposisi atau rujukan, deskripsi bentuk sediaan dan uraian mengenai kemasan, termasuk ukuran kemasan, petunjuk pengambilan sampel dan pengujian atau prosedur rujukan, persyaratan kualitatif dan kuantitatif
dengan batas penerimaan, kondisi penyimpanan dan tindakan pengamanan khusus, serta masa edar atau simpan.
Dokumen produksi terdiri dari:
a. Dokumen Produksi Induk yang berisi formula produksi dari suatu produk dalam bentuk sediaan dan kekuatan tertentu, tidak tergantung dari ukuran bets.
b. Prosedur Produksi Induk terdiri dari Prosedur Pengolahan Induk dan Prosedur Pengemasan Induk yang masing-masing berisi prosedur pengolahan dan prosedur pengemasan yang rinci untuk suatu produk dengan bentuk sediaan, kekuatan dan ukuran bets spesifik. Prosedur Produksi Induk dipersyaratkan divalidasi sebelum mendapat pengesahan untuk digunakan.
c. Catatan Produksi Bets terdiri dari Catatan Pengolahan Bets dan Catatan Pengemasan Bets, yang berisi semua data dan informasi yang berkaitan dengan pelaksanaan produksi dari suatu bets produk.
Menurut CPOB, hendaklah tersedia prosedur tertulis dan catatan penerimaan untuk tiap pengiriman tiap bahan awal, bahan pengemas primer dan bahan pengemas cetak. Selain itu, hendaklah tersedia prosedur tertulis untuk pengambilan sampel yang mencakup personel yang diberi wewenang mengambil sampel, metode dan alat yang harus digunakan, jumlah yang harus diambil dan segala tindakan pengamanan yang harus diperhatikan untuk menghindarkan kontaminasi terhadap bahan atau segala penurunan mutu. Pengujian bahan dan produk yang diperoleh dari tiap tahap produksi juga memerlukan prosedur tertulis yang menguraikan metode dan alat yang harus digunakan dalam pengujian.
2.2.11 Pembuatan dan Analisis berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dengan penerima kontrak harus dibuat secara jelas dalam hal tanggung jawab dan kewajiban masing-masing pihak.
Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh Kepala Bagian Manajemen Mutu (Pemastian Mutu).
Pemberi kontrak bertanggung jawab untuk menilai kompetensi Penerima Kontrak dalam melaksanakan pekerjaan atau pengujian yang diperlukan dan memastikan bahwa prinsip dan pedoman CPOB diikuti. Pemberi Kontrak hendaklah menyediakan semua informasi yang diperlukan kepada Penerima Kontrak untuk melaksanakan pekerjaan kontrak secara benar sesuai izin edar dan persyaratan legal lain. Pemberi Kontrak hendaklah memastikan bahwa semua produk yang diproses dan bahan yang dikirimkan oleh Penerima Kontrak memenuhi spesifikasi yang ditetapkan atau produk telah diluluskan oleh kepala bagian Manajemen Mutu (Pemastian Mutu).
Penerima Kontrak harus mempunyai gedung dan peralatan yang cukup, pengetahuan dan pengalaman, dan personel yang kompeten untuk melakukan pekerjaan yang diberikan oleh Pemberi Kontrak dengan memuaskan. Pembuatan obat berdasarkan kontrak hanya hanya dapat dilakukan oleh industri farmasi yang memiliki sertifikat CPOB yang diterbitkan oleh Badan POM. Penerima Kontrak hendaklah memastikan bahwa semua produk dan bahan yang diterima sesuai dengan tujuan penggunaannya.
Kontrak hendaklah dibuat antara pemberi kontrak dan penerima kontrak dengan menetapkan masing-masing pihak yang berhubungan dengan produksi dan pengendalian mutu produk. Aspek teknis dari kontrak hendaklah dibuat oleh personel yang kompeten dan memiliki pengetahuan di bidang teknologi farmasi, analisis dan CPOB.
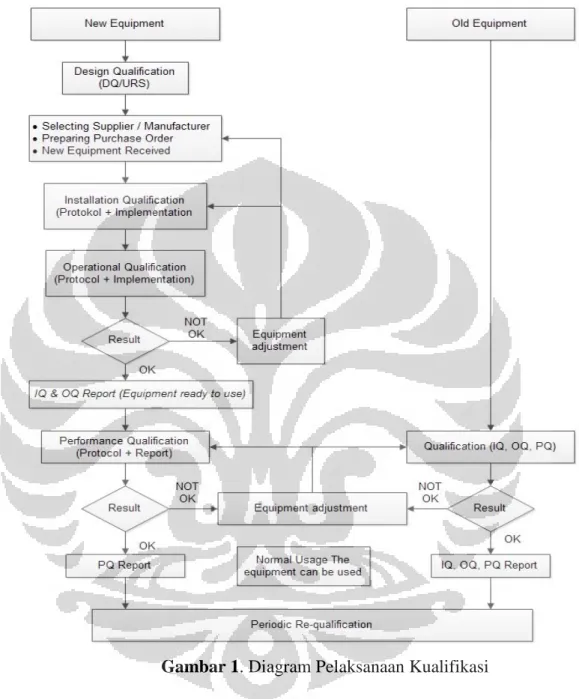
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang diperlukan sebagai bukti pengendalian terhadapa aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian risiko digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen yang setara. RIV hendaklah merupakan dokumen yang singkat, tepat dan jelas. RIV hendaklah mencakup sekurang-kurangnya data sebagai berikut: kebijakan validasi; struktur organisasi kegiatan validasi; ringkasan fasilitas, sistem peralatan dan proses yang akan divalidasi; format dokumen: format protokol dan laporan validasi, perencanaan dan jadwal pelaksanaan; pengendalian perubahan; dan acuan dokumen yang digunakan.
Protokol validasi hendaklah merinci langkah kritis dan kriteria penerimaan. Laporan harus dibuat mengacu pada protokol kualifikasi dan/atau protokol validasi dan memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi, kesimpulan dan rekomendasi perbaikan. Tiap perubahan terhadap rencana yang ditetapkan dalam protokol hendaklah didokumentasikan dengan pertimbangan yang sesuai.
Kualifikasi terdiri dari:
a. Kualifikasi Desain
Kualifikasi desain adalah unsur pertama dalam melakukan validasi terhadap fasilitas, sistem atau peralatan baru.
b. Kualifikasi Instalasi
Kualifikasi Instalasi (KI) hendaklah dilakukan terhadap fasilitas, sistem dan peralatan baru atau yang dimodifikasi. KI hendaklah mencakup, tapi tidak terbatas pada hal berikut: instalasi peralatan, pipa dan sarana penunjang dan instrumentasi hendaklah sesuai dengan spesifikasi dan gambar teknik yang didesain; pengumpulan dan penyusunan dokumen pengoperasian dan perawatan peralatan dari pemasok; ketentuan dan persyaratan kalibrasi; dan verifikasi bahan konstruksi.
c. Kualifikasi Operasional
Kualifikasi operasional hendaklah dilakukan setelah kualifikasi instalasi selesai dilaksanakan dikaji dan disetujui. Kualifikasi operasional hendaklah mencakup, tapi tidak terbatas pada hal berikut: pengujian yang perlu dilakukan berdasarkan pengetahuan tentang proses, sistem dan
peralatan; dan pengujian yang meliputi satu atau beberapa kondisi yang mencakup batas operasional atas dan bawah, yang dikenal sebagai worst
case (kondisi terburuk).
d. Kualifikasi Kinerja
Pengujian yang menggunakan bahan baku, bahan pengganti yang memenuhi spesifikasi atau produk simulasi yang dilakukan berdasarkan pengetahuan tentang proses, fasilitas, sistem dan peralatan dan uji yang meliputi satu atau beberapa kondisi yang mencakup batas operasional atas dan bawah.
Validasi terdiri dari: a. Validasi Proses
Pada umumnya kegiatan validasi proses dilakukan sebelum produk dipasarkan (validasi prospektif). Dalam hal tertentu, jika hal di atas tidak memungkinkan, validasi dapat juga dilakukan selama proses produksi rutin dilakukan (konkuren). Proses yang sudah berjalan, hendaklah juga divalidasi (validasi retrospektif).
b. Validasi Pembersihan
Validasi pembersihan biasanya dilakukan hanya untuk permukaan alat yang bersentuhan dengan produk. Interval waktu antara penggunaan alat dan pembersihan hendaklah divalidasi demikian juga antara pembersihan dan penggunaan kembali. Validasi prosedur pembersihan hendaklah dilakukan dengan melaksanakan prosedur tiga kali berturut-turut dengan hasil yang memenuhi syarat untuk membuktikan bahwa metode tersebut telah tervalidasi.
c. Validasi Ulang
Fasilitas, sistem, peralatan dan proses termasuk proses pembersihan hendaklah dievaluasi secara berkala untuk konfirmasi keabsahannya. Jika tidak ada perubahan yang signifikan terhadap status validasi, peninjauan
dengan bukti bahwa fasilitas, sistem, peralatan dan proses memenuhi persyaratan yang ditetapkan akan kebutuhan revalidasi.
d. Validasi Metode Analisis
Validasi metode analisis dilakukan untuk mengetahui bahwa metode analisis sesuai dengan tujuan penggunaannya. Validasi metode analisis umumnya dilakukan pada uji identifikasi, uji kuantitatif kandungan impuritas (impurity), uji batas impuritas dan uji kuantitatif zat aktif dalam sampel bahan aktif obat atau obat atau kompenen tertentu dalam obat.
TINJAUAN KHUSUS PT SYDNA FARMA
3.1 Profil PT Sydna Farma
PT Sydna Farma merupakan perusahaan industri farmasi yang bergerak dalam produksi obat jadi. Status kepemilikan perusahaan PT Sydna Farma berubah dari Penanaman Modal Asing (PMA) atas nama Organon menjadi Penanaman Modal Dalam Negeri (PMDN), setelah beralih kepemilikan kepada PT United Dico Citas pada akhir Desember 2006. PT Sydna Farma mulai beroperasi pada tanggal 1 Januari 2007.
PT Sydna Farma memiliki 3 sertifikat CPOB yaitu sertifikat SPV (Small
Volume Parenteral), tablet non hormon seks dan tablet hormon seks. PT Sydna
Farma menjalankan produksi kontrak (Toll in) untuk beberapa produk obat jadi dari industri farmasi lainnya. PT Sydna Farma juga memiliki lisensi dari NV Organon (Schering Plough/MSD) untuk tetap memproduksi dan memasok produk-produk Organon tertentu.
PT Sydna Farma telah berhasil mengembangkan produk sendiri yang dikembangkan oleh departemen penelitian dan pengembangan. Produk sendiri tersebut adalah produk copy yang tetap berfokus pada produk obat hormonal, atas dasar pertimbangan pengalaman PT Sydna Farma yang telah lama menangani proses produksi obat hormonal. Produk tersebut adalah Sydnaginon® dengan komposisi levonogestrel 0,15 mg dan etinilestradiol 0,03 mg. Selain itu, ada pula produk non hormon yang kembangkan yaitu Sydnatron-8® yang merupakan injeksi ondansentron 8 mg dalam ampul 4 ml dan Sydnatron- 4® yang merupakan injeksi ondansentron 4 mg dalam ampul 2 ml.
3.2 Lokasi dan Sarana Produksi
PT Sydna Farma berlokasi di Jl. R.C Veteran No. 89, Bintaro, Jakarta Selatan. Luas seluruh area pabrik yang dimiliki PT Sydna Farma adalah 22.000 m2, dengan rincian panjang 192 m dan lebar 118 m. Bangunan pabrik PT Sydna
Farma menempati area dengan luas tanah 3.600 m2, dengan rincian panjang 72 m dan lebar 50 m, sedangkan bangunan kantor menempati area dengan luas tanah 600 m2.
Konstruksi bangunan PT Sydna Farma dibangun pertama kali pada tahun 1973 dan renovasi keseluruhan diselesaikan pada tahun 1995. Beberapa bagian pabrik, baru dibangun pada tahun 1994. Perbaikan area pabrik tahap 1 dilakukan pada area non hormon seks dan selesai pada tahun 2008. Perbaikan area pabrik tahap 2 pada area hormon seks dilakukan pada akhir tahun 2008 dan selesai pada semester 1 tahun 2009. Perbaikan area parenteral dilaksanakan pada tahun 2010. Perbaikan-perbaikan tersebut dilakukan dengan tujuan untuk memenuhi ketentuan CPOB terkini.
Area PT Sydna Farma memiliki sumber air tersendiri untuk mensuplai seluruh kebutuhan operasional pabrik. Sumber air tersebut terdiri dari 2 buah sumur yang berada dalam area pabrik. Sumber energi listrik untuk kebutuhan operasional pabrik disuplai oleh Perusahaan Listrik Negara (PLN) dengan didukung generator diesel bila terjadi pemadaman listrik.
3.2.1 Area Gudang
Area gudang pabrik terdiri atas area-area penyimpanan yang berbeda sesuai dengan status barang yaitu karantina, lulus, dan ditolak. Penyimpanan untuk barang yaitu diruang main storage dan barang yang membutuhkan kondisi khusus, tersedia gudang dingin (cold storage), gudang kering (dry storage),
solvent storage, estrogen storage dan control room temperature sesuai dengan
persyaratan penyimpanan barang tersebut.
3.2.2 Area QC
Area QC meliputi laboratorium utama yang dilengkapi dengan sarana pendukung berupa compressed air, nitrogen dan DMW. Laboratorium mikrobiologi terletak di dalam laboratorium utama yang terpisah, dilengkapi dengan LAF cabinet untuk operasional pada kondisi kelas 100.
3.2.3 Area Produksi
Area produksi terbagi atas empat bagian besar yaitu area parenteral, area tablet non-estrogen, area tablet estrogen dan area pengemasan sekunder. Ruangan produksi tersebut terbagi menjadi beberapa kelas ruangan seperti kelas 100.000, kelas 10.000 dan kelas 100 (area parenteral), masing-masing ruang produksi dilengkapi dengan manometer dan termohigrometer untuk memantau suhu, kelembapan udara dan tekanan ruangan.
Area produksi sediaan padat (tablet) estrogen dan non-estrogen terpisah dan masing-masing area memiliki sistem pengendalian udara (Air Handling
Unit/AHU), ruang ganti pakaian (gowning), ruang antar kelas kebersihan atau material air lock (MAL).
3.3 Visi dan Misi PT Sydna Farma
3.3.1 Visi
Visi PT Sydna Farma adalah menjadi industri farmasi tingkat dunia yang berbasis pada pengembangan ilmu pengetahuan dalam dunia farmasi dengan sistem operasional yang unggul dalam memastikan kualitas yang tertinggi, keamanan dan efektivitas produk dengan sistem kerja yang efisien (Sydna Farma, 2011).
3.3.2 Misi
Misi PT Sydna Farma adalah selalu berusaha menyediakan obat-obatan untuk meningkatkan kualitas hidup manusia.
3.4. Nilai Utama PT Sydna Farma
PT Sydna Farma memiliki nilai-nilai utama yang menjadi nilai dasar perusahaan, yaitu (Sydna Farma, 2011):
a. Kualitas dari Pelayanan
PT Sydna Farma selalu berupaya untuk mencari serta mencapai melebihi harapan pelanggan.
b. Kualitas Lingkungan Kerja
PT Sydna Farma selalu menyediakan lingkungan kerja yang kondusif secara terus menerus untuk membantu perkembangan pekerja, pengetahuan, dan harmoni pekerja serta kesejahteraan bagi para pemegang sahamnya.
c. Kemitraan
Semangat dari kerja tim dan kolaborasi yang baik akan selalu menjadi dasar bisnis perusahaan.
d. Integritas
Selalu mengedepankan prisip-prinsip kebenaran, keadilan, ketekunan berdedikasi dan kesetiaan akan megarahkan semua kegiatan sehari-hari semua karyawan.
3.5 Organisasi dan Tata Kerja
PT Sydna Farma dikepalai oleh seorang direktur. Sedangkan pabrik PT Sydna Farma dikepalai oleh seorang manajer pabrik. Manajer pabrik bertanggung jawab langsung kepada direktur. Manajer pabrik membawahi 5 departemen yaitu Departemen Pengadaan/Suplay Chain, Departemen Produksi, Departemen Pemastian Mutu, Departemen Pengawasan Mutu, dan Departemen Teknis Servis dan Kesehatan, Keselamatan Lingkungan. Sedangkan bagian administrasi langsung dibawahi oleh manajer pabrik.
3.5.1 Departemen Pengadaan/Supply Chain
Departemen Pengadaan atau Supply Chain dikepalai oleh manajer Supply
Chain yang membawahi 3 bagian yaitu perencanaan (planning), gudang
(warehouse) dan pembelian barang (purchasing). Penjelasan mengenai bagian-bagian tersebut adalah sebagai berikut:
3.5.1.1 Bagian Perencanaan (Planning)
Tugas pokok bagian perencanaan adalah: a. Membuat perencanaan kegiatan produksi
Perencanaan kegiatan produksi dibuat berdasarkan jadwal kebutuhan produk yang diberikan oleh Organon dan perusahaan yang melakukan toll-in di
PT Sydna Farma, untuk kemudian dikonfirmasi dan didiskusikan dengan departemen produksi dengan memperhatikan kapasitas mesin dan jumlah serta ketersediaan personel di departemen produksi. Perencanaan produksi dibuat untuk kurun waktu satu tahun ke depan. Berdasarkan perencanaan ini dibuat kegiatan produksi bulanan. Rencana produksi bulanan diberikan kepada departemen produksi untuk dirinci menjadi rencana mingguan.
b. Melakukan kontrol persediaan material di gudang
Bagian perencanaan bertugas untuk memastikan bahwa bahan untuk keperluan kegiatan produksi dan pengemasan tersedia dalam jumlah yang cukup pada waktu yang dibutuhkan dan dengan spesifikasi yang sesuai. Persediaan gudang diusahakan jumlahnya selalu tepat, tidak lebih dan tidak kurang. Tugas ini didukung oleh sistem komputer yang dimiliki oleh PT Sydna Farma yaitu sistem Axapta. Karena sebagian besar perencanaan PT Sydna Farma berdasarkan permintaan customer (perusahaan pemberi lisensi dan perusahaan yang melakukan toll-in), maka dalam melakukan pengontrolan persedian Supply Chain menerapkan prinsip tergantung pada pesanan costumer. Selain itu, Supply Chain bersikap proaktif dalam mencari informasi-informasi yang dibutuhkan sehingga kebijakan yang diambil adalah berdasarkan data yang akurat dan aktual.
3.5.1.2 Gudang (warehouse)
Bagian gudang diawasi oleh supervisor gudang, gudang juga membawahi bagian penimbangan. Bagian gudang bertugas memberikan pelayanan penerimaan dan pengeluaran barang. Bahan-bahan tersebut adalah bahan baku, bahan pengemas, produk setengah jadi, dan produk jadi. Pelayanan gudang bersifat internal dan eksternal.
a. Pelayanan Internal
Pelayanan internal terbagi atas pelayanan penerimaan dan pengeluaran barang. Pelayanan penerimaan barang dibuat berdasarkan surat penyerahan barang (Product Delivery Sheet) untuk obat jadi. Bagian gudang juga menerima barang sisa atau rusak dari bagian produksi dan pengemasan berdasarkan Tanda Terima Penyerahan Barang (TTPB) yang kemudian barang-barang tersebut akan
dibuang sebagai limbah. Pelayanan pengeluaran barang dari gudang dibuat berdasarkan Surat Pesanan Barang (Material Requisition Sheet) dari bagian-bagian lain yang membutuhkan. Untuk melayani pesanan tersebut, bagian-bagian gudang terlebih dahulu memiliki kartu stok guna mengetahui persediaan barang. Untuk barang-barang yang perlu ditimbang, bagian gudang (petugas bagian penimbangan) juga bertugas melakukan penimbangan di ruang penimbangan dengan didampingi oleh seorang wakil dari bagian produksi yang membutuhkan barang tersebut.
b. Pelayanan Eksternal
Pelayanan eksternal juga terbagi atas pelayanan penerimaan dan pengeluaran barang yang meliputi penerimaan bahan baku dan bahan pengemas dari pemasok dan pengeluaran barang berupa obat jadi ke distributor. Dalam proses penerimaan barang, bagian gudang akan mendapatkan Surat Pesanan Pembelian (Purchase Order) dari bagian pembelian barang. Jika ada pemasok datang dengan membawa barang yang dipesan, bagian gudang akan mencocokan barang dengan Surat Pesanan Pembelian kemudian melakukan pemeriksaan fisik dan administrasi dari barang dengan melihat daftar periksa penerimaan barang. Jika terdapat cacat fisik pada kemasan barang. Bagian gudang akan membuat Berita Acara Pemeriksaan yang nantinya akan ditindaklanjuti oleh bagian pembelian. Untuk barang yang direject, bagian gudang akan memberitahukan bagian pembelian yang nantinya akan mengeluarkan Return Order kepada pihak gudang dan Surat Pengantar Barang ke pemasok yang dilampiri Result of Analysis dari QC.
Dalam proses pengeluaran barang, bagian gudang akan menerima perintah pengiriman (delivery order) dari customer yang berisi daftar obat jadi yang dipesan oleh distributor. Selanjutnya, bagian gudang akan mengirimkan obat jadi yang diminta ke distributor dengan disertai bukti pengeluaran berupa Delivery
Note. Pengeluaran barang yang selain untuk penjualan dilakukan dengan Warehouse Delivery Voucher. Semua transaksi di bagian gudang didokumentasikan dalam program Axapta.