BAHAN AJAR KIMIA UMUM
BAHAN AJAR KIMIA UMUM
Eva Pratiwi Pane, S.Pd., M.Pd.
BAHAN AJAR KIMIA UMUM
© Penerbit Perkumpulan Rumah Cemerlang Indonesia (PRCI)
Penulis:
Eva Pratiwi Pane, S.Pd., M.Pd.
Editor: Fine Eirene Siahaan, S.Pd., M.Pd.
Cetakan Pertama: Desember 2021 Cover: Rusli Tata Letak: Tim Kreatif PRCI Hak Cipta 2021, pada Penulis. Diterbitkan pertama kali oleh:
Perkumpulan Rumah Cemerlang Indonesia ANGGOTA IKAPI JAWA BARAT Pondok Karisma Residence Jalan Raflesia VI D.151 Panglayungan, Cipedes Tasikmalaya – 085223186009 Website: www.rcipress.rcipublisher.org E-mail: [email protected]
Copyright © 2021 by Perkumpulan Rumah Cemerlang Indonesia All Right Reserved
- Cet. I –: Perkumpulan Rumah Cemerlang Indonesia, 2021
; 14,8 x 21 cm ISBN: 978-623-5847-53-5 Hak cipta dilindungi undang-undang Dilarang memperbanyak buku ini dalam bentuk dan dengan cara apapun tanpa izin tertulis dari penulis dan penerbit Undang-undang No.19 Tahun 2002 Tentang Hak Cipta Pasal 72
Undang-undang No.19 Tahun 2002 Tentang Hak Cipta Pasal 72
Barang siapa dengan sengaja melanggar dan tanpa hak melakukan perbuatan sebagaimana dimaksud dalam pasal ayat (1) atau pasal 49 ayat (1) dan ayat (2) dipidana dengan pidana
penjara masing-masing paling sedikit 1 (satu) bulan dan/atau denda paling sedikit Rp.1.000.000,00 (satu juta rupiah), atau pidana penjara paling lama 7 (tujuh) tahun dan/atau
denda paling banyak Rp.5.000.000.000,00 (lima miliar rupiah).
Barang siapa dengan sengaja menyiarkan, memamerkan, mengedarkan, atau menjual kepada umum suatu ciptaan atau barang hasil pelanggaran hak cipta terkait sebagai dimaksud pada ayat (1) dipidana dengan pidana penjara paling lama 5 (lima) tahun dan/atau denda paling
banyak Rp.500.000.000,00 (lima ratus juta rupiah).
KATA PENGANTAR
Puji syukur kami panjatkan kepada Tuhan telah memberikan rahmat serta karunia-Nya kepada kami sehingga kami berhasil menyelesaikan Buku dengan judul Bahan Ajar Kimia Umum sesuai yang ditargetkan. Buku ini berisikan tentang apa saja yang berkaitan dengan kimia umum dan tentunya disusun menurut sudut pandang pengajar karena buku ini diharapkan dapar membantu pengajaran tentang Kimia Umum. Kami menyadari bahwa Buku ini masih jauh dari sempurna, oleh karena itu kritik dan saran dari semua pihak yang bersifat membangun selalu kami harapkan demi kesempurnaan buku ini.
Akhir kata, kami sampaikan terima kasih kepada semua pihak yang telah berperan serta dalam penyusunan Buku ini dari awal sampai akhir. Semoga Tuhan senantiasa meridhoi segala usaha kita. Amin.
Desember, 2021
Penulis
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ...ii
DAFTAR TABEL ... vii
DAFTAR GAMBAR ...ix
BAB I PENGENALAN ILMU KIMIA ... 11
A. Hakikat Ilmu Kimia ... 11
B. Metode Imiah ... 17
1. Pengamatan (Observasi) ... 18
2. Hipotesis ... 19
3. Percobaan ... 20
4. Menarik Kesimpulan ... 20
5. Membuat Laporan ... 21
C. Penggolongan Materi ... 22
D. Sifat Fisis dan Kimia Materi ... 30
E. Pengukuran ... 33
BAB II HUKUM DASAR KIMIA ... 39
A. Hukum-Hukum Dasar Kimia ... 39
B. Persamaan Reaksi ... 45
C. Massa Atom Relatif (Ar) ... 47
D. Massa Molekul Relatif (Mr) ... 48
BAB III STOIKIOMETRI ... 49
A. Konsep Mol ... 49
B. Kemolaran ... 52
C. Rumus Kimia ... 56
D. Perhitungan Kimia ... 59
BAB IV STRUKTUR ATOM... 65
A. Teori Atom ... 65
1. Teori Atom Dalton ... 65
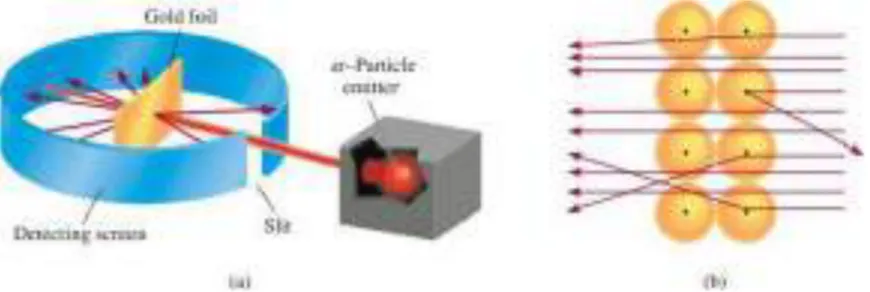
2. Teori Atom Thomson ... 66
3. Teori Atom Rutherford... 67
B. Partikel Dasar Atom ... 69
1. Elektron ... 69
2. Proton ... 70
3. Neutron ... 71
C. Nomor Atom, Nomor Massa dan Isotop ... 72
D. Molekul dan Ion ... 74
E. Penamaan Senyawa ... 75
F. Bilangan Kuantum ... 81
1. Bilangan Kuantum Utama (n) ... 81
2. Bilangan Kuantum Momentum Sudut / Azimut (l) ... 81
3. Bilangan Kuantum Magnetik (ml) ... 82
4. Bilangan Kuantum Spin Elektron (ms) ... 83
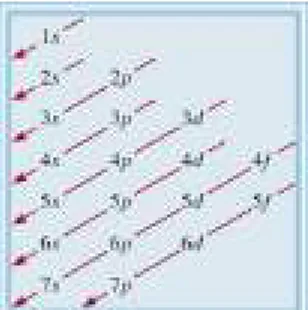
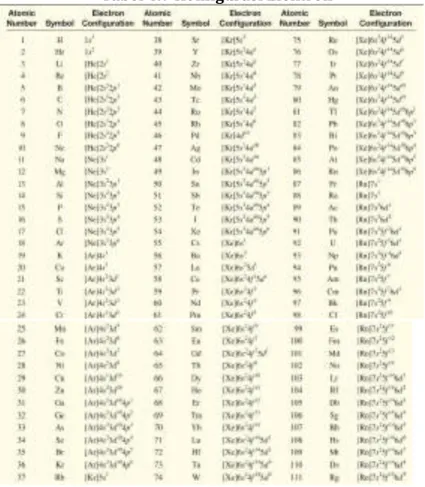
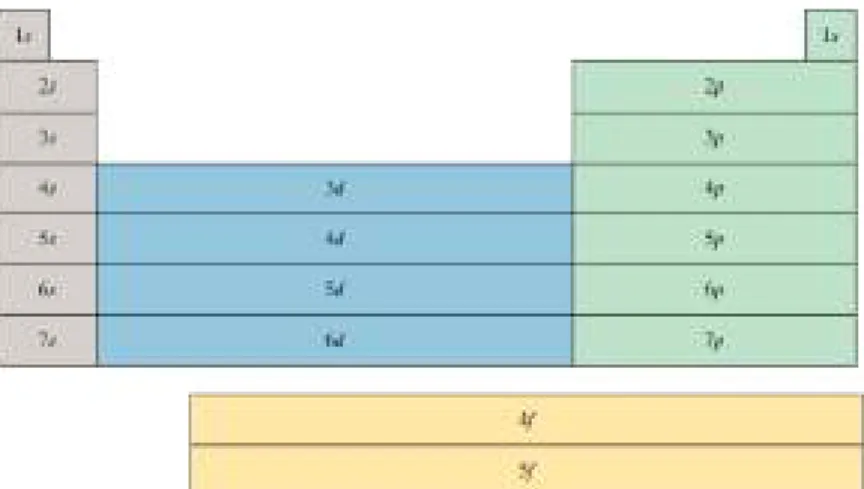
G. Konfigurasi Elektron ... 84
1. Prinsip Pengisian Elektron (Prinsip Aufbau) ... 84
2. Prinsip Larangan Pauli ... 85
3. Aturan Hund ... 87
BAB V SISTEM PERIODIK UNSUR ... 93
A. Perkembangan Sistem Periodik ... 93
B. Penggolongan Periodik Unsur-Unsur ... 97
C. Sifat Periodik Unsur ... 100
BAB VI IKATAN KIMIA ... 107
A. Lambang Titik Lewis ... 107
B. Ikatan Kovalen ... 108
C. Penulisan Rumus Lewis ... 110
D. Muatan Formal ... 111
E. Konsep Resonansi ... 112
F. Teori Tolakan Pasangan Elektron Valensi ... 113
BAB VII KIMIA LARUTAN ... 119
A. Jenis Larutan ... 119
B. Satuan Konsentrasi ... 119
1. Fraksi Mol (X) ... 119
2. Kemolaran (M) ... 120
3. Kemolalan (m) ... 120
C. Sifat Koligatif Larutan ... 121
1. Penurunan Tekanan Uap ... 121
2. Kenaikan Titik Didih ... 122
3. Penurunan Titik Beku ... 125
4. Tekanan Osmotik ... 127
BAB VIII ASAM DAN BASA ... 131
A. Teori Asam Basa ... 131
1. Basa ... 132
2. Garam ... 133
B. pH Larutan Asam dan Basa ... 133
1. Larutan Asam dan Basa Kuat ... 134
2. Larutan Asam dan Basa Lemah ... 138
BAB IX TERMODINAMIKA ... 139
A. Pengertian Termodinamika ... 139
B. Hukum Pertama Termodinamika ... 143
C. Entalpi ... 146
BAB X TERMOKIMIA ... 151
A. Jenis-Jenis Kalor ... 151
1. Kalor Pembentukan ... 151
2. Kalor Penguraian ... 152
3. Kalor Penetralan ... 152
4. Kalor Reaksi ... 152
B. Kalor Reaksi ... 152
BAB XI KIMIA ORGANIK ... 157
A. Pengertian Kimia Organik ... 157
1. Keistimewaan Atom Karbon ... 158
2. Rumus Senyawa Organik ... 159
B. Hidrokarbon ... 160
C. Alkana ... 161
1. Rumus Molekul Alkana... 161
2. Sifat Fisika Alkana ... 162
3. Sifat Kimia Alkana ... 163
4. Halogenasi ... 163
5. Pembakaran ... 163
6. Isomer alkana ... 164
7. Tata nama alkana ... 165
8. Sikloalkana ... 167
D. Alkena ... 168
1. Rumus umum alkena ... 168
2. Sifat Fisika Alkena ... 169
3. Tatanama Alkena menurut IUPAC ... 170
4. Isomer ... 170
5. Pembuatan Alkena ... 171
E. Alkuna ... 172
1. Rumus Umum Alkuna ... 173
2. Tatanama Alkuna ... 174
3. Isomer ... 175
F. Hidrokarbon Aromatis ... 175
G. Gugus Fungsional Dan Turunan Hidrokarbon ... 178
1. Alkil halida ... 180
2. Alkohol ... 181
3. Eter ... 182
4. Aldehida ... 182
5. Keton ... 182
6. Asam Karboksilat ... 183
7. Ester ... 184
8. Amida ... 185
9. Amina ... 185
10. Merkaptan ... 186
H. Reaksi-reaksi Organik ... 186
1. Reaksi Substitusi ... 186
2. Reaksi Adisi ... 187
3. Reaksi Eliminasi ... 189
4. Reaksi Redoks ... 189
5. Reaksi Penataan Ulang ... 190
6. Kondensasi ... 191
7. Polimer ... 192
8. Polimer kondensasi ... 192
9. Polimer Adisi ... 193
DAFTAR PUSTAKA ... 195
DAFTAR TABEL
Tabel 4.1 Massa dan Muatan Partikel Subatom... 72 Tabel 4.2 Tata Nama “-ida” untuk Beberapa Anion
Monoatomik yang Umum Menurut Letaknya dalam Tabel Periodik ... 75 Tabel 4.3 Nama dari Beberapa Kation dan Anion Anorganik
yang Umum ... 77 Tabel 4.4 Beberapa Asam Sederhana ... 79 Tabel 4.5 Nama-nama Anion Okso dan Anion Okso yang
Mengandung Klorin ... 80 Tabel 4.6 Hubungan Antara Bilangan Kuantum dan Orbital
Atom ... 84 Tabel 4.7 Konfigurasi Elektron ... 90 Tabel 5.1 Sistem Periodik Mendeleev ... 93 Tabel 5.2 Sifat eka-silikon yang diramal Mendeleev
dibandingkan germanium ... 95 Tabel 5.3 Energi Ionisasi (kJ/mol) untuk 20 Unsur Pertama
... 103 Tabel 5.4 Perkiraan perubahan entalpi untuk atom atau anion
... 105 Tabel 6.1 Susunan Pasangan Elektron disekitar Atom Pusat
(A) dalam suatu Molekul dan Geometri ... 115 Tabel 7.1 Konstanta Kenaikan Titik Didih dan Konstanta
Penurunan Titik Beku untuk Beberapa Cairan yang Umum ... 126 Tabel 8.1 Beberapa asam yang Umum ... 132 Tabel 8.2 Kriteria Larutan Asam, Basa dan Netral ... 134 Tabel 8.3 Kekuatan Relatif Pasangan Asam-Basa Konjugat 135 Tabel 9.1 Kalor penguapan dan titik didih beberapa unsur dan senyawa ... 149 Tabel 9.2 Kapasitas kalor molar (cp) beberapa zat ... 150
Tabel 10.1 Kalor Pembentukan Standar Zat Kimia (250C, 1
atm) ... 154
Tabel 10.2 Energi Ikatan ... 155
Tabel 10.3 Energi Pengatoman Beberapa Unsur ... 156
Tabel 11.1 Beberapa senyawa alkana ... 161
Tabel 11.2 Sifat – Sifat Fisika Beberapa Senyawa Alkana .... 162
Tabel 11.3 Jumlah Isomer Untuk Senyawa Golongan Alkana ... 165
Tabel 11.4 Rumus Molekul Beberapa Senyawa Alkena ... 168
Tabel 11.5 Beberapa gugus fungsional penting dalam senyawa organik ... 179
DAFTAR GAMBAR
Gambar 1.1 (a) Struktur tiga dimensi dan dua dimensi air dan Struktur tiga dimensi dan (b) dua dimensi
metanol ... 12
Gambar 1.2 Langkah umum metode ilmiah ... 18
Gambar 1.3 Perbedaan Molekul Zat Padat, Cair dan Gas ... 23
Gambar 1.4 Penggolongan Materi ... 24
Gambar 2.1 Reaksi dari gas hidrogen dan gas oksigen membentuk uap air ... 43
Gambar 2.2 Reaksi Pembakaran ... 44
Gambar 3.1 Pembuatan larutan dengan molaritas tertentu .. 53
Gambar 3.2 Rumus molekul dan rumus struktur dan model untuk empat molekul yang umum ... 57
Gambar 4.1 Model Atom Thomson ... 67
Gambar 4.2 Model Atom Rutherford ... 68
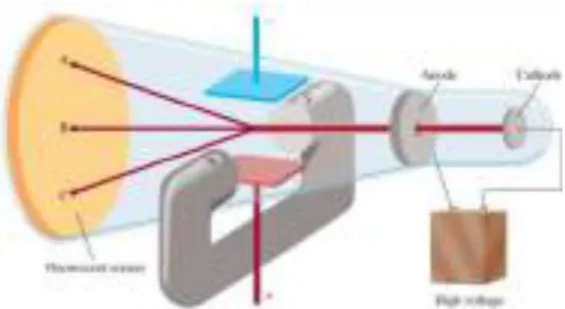
Gambar 4.3 Tabung sinar katoda. Sinar mengalir dari katoda (-) ke anoda (+) ... 70
Gambar 4.4 Urutan pengisian subkulit dalam atom berelektron banyak ... 84
Gambar 4.5 Klasifikasi golongan unsur-unsur dalam tabel periodik menurut jenis subkulit terluar yang terisi dengan elektron ... 91
Gambar 5.1 Sistem Periodik Modern ... 97
Gambar 5.2 Konfigurasi elektron pada keadaan dasar. Agar sederhana, hanya ditampilkan konfigurasi kulit terluar. ... 98
Gambar 5.3 Jari-jari atom (dalam pikometer) unsur golongan utama... 100
Gambar 6.1 Lambang titik Lewis untuk unsur golongan utama dan gas mulia. ... 108
Gambar 7.1 Diagram fasa kenaikan titik didih dan penurunan titik beku larutan berair ... 123 Gambar 7.2 Tekanan ismotik. ... 128 Gambar 9.1 Tiga sistem yang diwakili oleh air dalam botol 140 Gambar 9.2 Pemuaian gas melawan tekanan luar konstan . 142 Gambar 11.1 Struktur CH4, CCl4 dan CH3Cl ... 158
BAB I PENGENALAN ILMU KIMIA
A. Hakikat Ilmu Kimia
Ilmu kimia berasal dari bahasa arab, yaitu al-kimia yang artinya perubahan materi, oleh ilmuwan Arab Jabir Ibnu Hayyan. Ini berarti ilmu kimia secara singkat diartikan sebagai ilmu yang mempelajari rekayasa materi, yaitu mengubah materi menjadi materi lain.
Hakikat ilmu kimia adalah bahwa benda itu bisa mengalami perubahan bentuk maupun susunan partikelnya menjadi bentuk lain sehingga terjadi deformasi, perubahan letak susunan ini mempengaruhi sifat–sifat yang berbeda dengan wujud yang semula.
Secara lengkapnya ilmu kimia adalah bagian ilmu pengetahuan alam, mempelajari komposisi, struktur zat kimia, dan perubahan-perubahan yang dialami materi dalam proses-proses alamiah maupun dalam eksperimen yang direncanakan. Komposisi (susunan) zat menyatakan perbandingan unsur membentuk zat itu. Contohnya air dan etanol. Di dalam satu molekul air terdapat dua atom hidrogen dan satu atom oksigen, sedangkan dalam molekul etanol terdapat dua atom karbon, enam atom hidrogen dan satu atom oksigen. Dengan demikian, rumus senyawa air dan etanol adalah H2O dan C2H5OH.
Struktur zat kimia, yang sesungguhnya menggambarkan letak atom-atom dalam ruang (tiga dimensi). Struktur air dan metanol yang telah disederhanakan adalah :
(a) (b)
Gambar 1.1 (a) Struktur tiga dimensi dan dua dimensi air dan Struktur tiga dimensi dan (b) dua dimensi metanol
Perubahan-perubahan suatu zat kimia sering mengalami perubahan baik secara alami maupun perlakuan manusia. Zat diidentifikasi dari sifat-sifatnya dan dari susunannya. Warna, titik leleh, titik didih, viskositas, kerapatan, kalor jenis dan kekerasan merupakan sifat-sifat fisika. Sifat fisika suatu keadaan dimana tidak mengakibatkan pembentukan zat baru/tanpa mengubah susunan atau identitas suatu zat.
Sebagai contoh, kita dapat mengukur titik leleh es dengan memanaskan es balok dan mencatat suhunya ketika es berubah menjadi air. Air berbeda dengan es hanya dari penampilannya dan tidak dari susunannya, sehingga perubahan itu merupakan perubahan fisika; kita dapat membekukan air untuk memperoleh esnya kembali. Sifat kimia adalah kecendrungan dari suatu zat untuk mengalami perubahan kimia. Misalnya, sifat kimia dari air adalah akan bereaksi secara hebat dengan natrium dan akan menghasilkan gas hidrogen dan suatu zat yang disebut natrium hidroksida. Apabila kita perhatikan sifat kimia ini, maka terlihat bahwa air dan natriumnya mengalami perubahan disebut perubahan kimia dan menghasilkan zat.
Setelah kita perhatikan sifat kimia ini, air dan natriumnya hilang diganti oleh zat lain.
Peran ilmu kimia dalm kehidupan sehari-hari, antara lain:
1. Bidang pertanian. llmu kimia di dalam bidang pertanian dimanfaatkan untuk membuat pupuk dan pestisida.
2. Bidang kedokteran. Di bidang ini banyak dijumpai manfaatnya, seperti obat-obatan.
3. Bidang pangan. Bermanfaat bagi manusia. penggunaan mikroorganisme/bakteri pada makanan, contoh pembuatan kecap, tempe, dan yoghurt.
4. Bidang industri. Penerapan ilmu Kimia di bidang industri, untuk membuat mesin-mesin besar yang membutuhkan logam baik.
5. Bidang arkeologi. Dalam bidang arkeologi, ilmu kimia dibutuhkan untuk menentukan umur fosil.
6. Bidang hukum. Untuk membuktikan tindak kejahatan seseorang maka dibutuhkan pemeriksaan DNA. Pasalnya, struktur DNA setiap individu akan berbeda sehingga dapat digunakan untuk mengidentifikasi seseorang.
Ilmu kimia juga berperan dalam menyelesaikan masalah global yaitu masalah yang dihadapi oleh seluruh dunia, seperti yang menyangkut masalah dalam bidang lingkungan hidup, kedokteran, geologi, biologi dan lain-lain, ataupun untuk meningkatkan Sumber Daya Manusia (SDM). Sebagai contoh, masalah global dalam hal lingkungan hidup dan krisis energi:
1. Bahan Bakar. Saat ini bahan bakar dunia, berupa minyak bumi, batu bara, gas alam yang berasal dari fosil. Fosil merupakan sumber daya alam yang tidak dapat diperbaharui, karena fosil terbentuk dari organisme yang terkubur beberapa jutaan tahun lalu. Bahan bakar tersebut akan habis dan manusia harus dapat mencari sumber energi alternatif, untuk mengatasi krisis enegri tersebut. Dalam hal ini ilmu kimia sangat berperan.
Contoh sumber energi alternatif misalnya alkohol, energi nuklir, geoternal (panas bumi) atau energi matahari yang tak terbatas.
2. Teknologi Biogas. Ternak-ternak di pedesaan dapat menimbulkan masalah lingkungan, karena kotorannya yang berserakan dapat menimbulkan bau yang tidak enak, kotoran ternak juga merusak pemandangan di desa, bahkan dapat menjadi sumber penularan penyakit.
Dengan teknologi biogas, permasalahan tersebut, dapat diatasi, dimana kotoran hewan tersebut diolah hingga bermanfaat bagi manusia. Pembuatan biogas menggunakan bahan baku kotoran hewan/ternak yang dibubur halus menjadi butiran kecil dan dicampur air.
Hasil teknologi biogas tersebut dapat digunakan sebagai sumber energi, misalnya untuk lampu penerangan maupun untuk memasak.
3. Program Langit Biru. Program Langit Biru artinya program yang bertujuan untuk meminimalisasikan polusi udara akibat dari pemanfaatan energi. Polusi udara tersebut diakibatkan dari emisi gas buang yang ditimbulkan dari pemanfaatan energi. Transportasi merupakan salah satu penyebab polusi udara. Emisi gas buang tersebut misalnya Karbon Monoksida (CO), Hidrokarbon, Nitrogen Oksida, Sulfur dioksida, Timah hitam (Pb) dan debu. Jenis dan jumlah pencemaran ini dipengaruhi oleh beberapa faktor jenis energi, jenis kendaraan, umur kendaraan, ukuran mesin dan perawatan kendaraan tersebut.
Cabang-cabang ilmu kimia, antara lain:
1. Ilmu Kimia Fisika. Cabang ilmu Kimia Fisika menjadi bagian dari ilmu kimia yang mempelajari tentang sebuah zat dalam skala mikroskopik, atomik, dan sub atomik pada sistem kimia dengan memakain hukum dan konsep fisika.
Biasanya, hal-hal yang dipelajari di dalamnya mengenai
prinsip dan konsep fisika seperti pergerakan, gaya, energi, waktu, statistika dan lainnya.
2. Kimia Analitik. Pengertian Bidang Kimia Analitik adalah cabang dari ilmu kimia yang mempelajari tentang cara memisahkan dan mengindentifikasi sebuah zat penyusun dalam suatu bahan tertentu serta menentukan kadarnya secara spesifirk. Oleh karena-nya, kimia analitik dibedakan menjadi dua bagian pokok, yakni analisis kualitatif dan analisis kuantitatif. Secara umum, Kimia Analitik meliputi proses dalam identifikasi zat tertentu, melakukan pengelompokan zat, dan pembentukan zat baru.
Setelahnya akan dilakukan analisis agar jelas dan terang mengenai zat yang sedang diteliti.
Memahami apa itu ilmu kimia analitik tentu akan bersinggungan dengan fokus penelitian dan pengembangan diri pada desain eksperiman. Tak hanya itu saja, konsep tentang pengukuran kimia, pembuatan teknik baru, tentu menjadi salah satu pokok bahasan yang cukup intens diterapkan.
3. Kimia Organik. Cabang dalam Kimia Organik merupakan ilmu yang akan memberikan pembelajaran tentang sintesis dan sifat-sifat senyawa organik. Secara umum, senyawa organik yang dimaksud adalah terdiri dari senyawa-senyawa hidrokarbon dan turunannya. Bidang Kimia Organik memiliki peranyang amat vital dalam sintesis senyawa, analisa gugus karbon dan penelitian yang berhubungan dengan atom karbon sejenisnya.
Materi dasar yang akan dipelajari dalam Kimia Organik yakni tentang Hidrokarbon, serta tata nama senyawa hidrokarbon. Jika kamu berkuliah di jurusan kimia, maka pembelajaran akan terikat pada beberapa senyawa organik halogen dan beberapa hidrokarbon lainnya.
4. Kimia Anorganik. Salah satu cabang ilmu dalam kimia yang akan berguna untuk kehidupan manusia adalah Kimia Anorganik. Di dalamnya, kamu akan belajar tentang sintesis dan sifat-sifat senyawa anorganik seperti garam, mineral, logam, serta senyawa organometalik. Tak hanya itu saja, bidang satu ini juga akan mempelajari tentang pembentukan kristal, pemisahan senyawa anorganik, pelapisan materialm dan masih banyak lagi. Karena kegunaan dan pengertian apa itu ilmu kimia anorganik yang memiliki cakupan yang luas, bidang ini kerap dipakai untuk keperluan industri. Seperti dalam industri cat, gelas dan kaca, industri tekstil, plastik dan lainnya.
5. Biokimia. Pengertian cabang ilmu biokimia yakni cabang ilmu kimia yang mempelajari segala proses kimiawi dalam tubuh makhluk hidup, kemudian menganalisis senyawa- senyawa yang terlibat dalam reaksi tersebut. Bidang ini erat kaitannya dengan komponen kimia sel, pembuatan obat, penelitian genetik, penelitian rangkaian reaksi dalam tubuh manusia dan hewan, penelitian enzim, serta penelitian lain dalam kaitan ilmu kimia dan biologi. Secara umum, biokimia mempelajari tentang struktur, fungsi, dan interaksi biologis secara lebih detail. Unsur tersebut didapat dari suatu makromolekul: karbohidrat, asam nukleat, lemak baik, dan protein. Dalam aplikasinya, biokimia merupakan topik yang cukup dekat kaitannya dengan ilmu botani, medisinal, hingga biologi molekular ketika meneliti zat dan sel hidup. Adapun fokus penelitian biokimia yang dilakukan beberapa tahun terakhir yakni berkaitan dengan kondisi suatu molekul yang dapat mempercepat proses kimiawi dalam suatu makhluk hidup.
6. Kimia Lingkungan. Kimia lingkungan adalah studi ilmiah terhadap fenomena kimia dan biokimia yang terjadi di
alam. Bidang ilmu ini dapat didefinisikan sebagai studi terhadap sumber, reaksi, transpor, efek, dan nasib zat kimia di lingkungan udara, tanah, dan air; serta efek aktivitas manusia terhadapnya. Kimia lingkungan adalah ilmu antardisiplin yang memasukkan ilmu kimia atmosfer, akuatik, dan tanah, dan juga sangat bergantung dengan kimia analitik, ilmu lingkungan, dan bidang-bidang ilmu lainnya.
7. Kimia Farmasi. Kimia farmasi merupakan suatu disiplin ilmu gabungan kimia dan farmasi yang terlibat dalam desain, isolasi sintesis, analisis , identifikasi, pengembangan bahan-bahan alam dan sintetis yang digunakan sebagai obat-obat farmasetika, yang dapat digunakan untuk terapi. Bidang ini juga melakukan kajian terhadap obat yang sudah ada, berupa sifat kimiafisika, struktur, serta hubungan struktur dan aktivitas.
B. Metode Imiah
Metode ilmiah adalah metode untuk melakukan penelitian untuk memperoleh pengetahuan secara sistematis berdasarkan bukti fisik.
Langkah-langkah membuat metode ilmiah, antara lain:
Metode ilmiah (scientific method) merupakan suatu pendekatan sistematik untuk melakukan penelitian. Sebagai contoh, seorang kimiawan yang tertarik untuk mengukur panas yang dihasilkan ketika gas hidrogen terbakar di udara, akan mengikuti prosedur ilmiah tertentu. Langkah pertama yang harus dilakukannya adalah mendefinisikan masalah secara cermat dan hati-hati. Langkah berikutnya adalah mencakup pelaksanaan percobaan, melakukan pengamatan, dan mencatat informasi atau data.
Data penelitian yang diperoleh dapat berupa data kualitatif, yaitu berupa data hasil-hasil pengamatan umum tentang sistem (objek penelitian), ataupun data kuantitatif, yaitu berupa angka-angka yang diperoleh melalui pengukuran terhadap sistem.
Setelah data diperoleh, maka langkah selanjutnya adalah penafsiran (interpretasi). Pada tahapan ini, ilmuwan berusaha menjelaskan fenomena yang teramati. Berdasarkan data yang diperoleh, peneliti merumuskan hipotesis. Percobaan lanjutan dirancang untuk menguji kebenaran hipotesis, dan prosesnya dimulai dari awal kembali. Jadi langkah umum dalam metode ilmiah adalah melakukan pengamatan (observasi), merumuskan hipotesis, melakukan percobaan, menarik kesimpulan dan membuat laporan.
Gambar 1.2 Langkah umum metode ilmiah 1. Pengamatan (Observasi)
Saat melakukan pengamatan, kita melakukan percobaan dalam kondisi yang dikendalikan agar didapat data yang konstan atau sama apabila percobaan diulang. Data yang diperoleh dapat berupa data kualitatif ataupun kuantitatif.
Sebagai contoh, kita mengamati reaksi antara asam klorida
(HCl) 0.01 M dengan magnesium hidroksida (Mg(OH)2) 0.01 M. Jika data yang kita catat adalah fakta bahwa reaksi antara asam klorida dengan magnesium hidroksida terbentuk endapan garam, maka data yang diperoleh adalah data kualitatif. Namun, apabila data yang dicatat adalah volume asam klorida 0.01 M, volume magnesium hidroksida 0.01 M, waktu yang diperlukan sampai endapan terbentuk, dan berat endapan yang terbentuk, maka data yang diperoleh adalah data kuantitatif.
Dalam sains, data kuantitatif memiliki nilai lebih dibandingkan dengan data kualitatif, karena data kuantitatif mengandung lebih banyak informasi. Data yang diperoleh kemudian disusun sedemikian rupa sehingga ditemukan suatu hal yang menarik, seperti keteraturan, kecenderungan atau perbedaan. Tujuannya adalah untuk mencari gambaran umum tentang gejala yang diamati sehingga mudah dipahami.
Dalam sains, suatu pernyataan matematis atau pernyataan verbal yang ringkas tentang hubungan antara fenomena- fenomena yang selalu sama dalam keadaan yang sama, disebut hukum. Contohnya hukum kekekalan massa (Law of concervation of matter), yang menyatakan “Pada saat reaksi kimia, massa zat-zat yang bereaksi adalah sama dengan massa produk-reaksi”.
2. Hipotesis
Hukum umumnya diungkapkan dalam bentuk pernyataan atau hubungan antara suatu besaran dengan besaran lain, tetapi tidak berisi penjelasan mengapa demikian. Penjelasan yang diharapkan adalah penjelasan yang dapat diterima oleh akal sehat dan telah teruji kebenarannya. Oleh karena itu, diperlukan suatu dugaan sementara yang disebut hipotesis.
Merumuskan hipotesis merupakan pekerjaan yang cukup sulit dalam metode ilmiah, karena ada banyak kemungkinan jawaban untuk menjawab suatu masalah. Hipotesis yang dirumuskan akan menentukan jenis percobaan dan hasil percobaan akan mempengaruhi keberhasilan dalam menemukan teori. Oleh karena itu, merumuskan hipotesis memerlukan pengetahuan, logika, dan penalaran, sebab suatu hipotesis harus didasarkan pada teori yang telah mapan.
3. Percobaan
Kebenaran suatu hipotesis diuji dengan melakukan percobaan di laboratorium. Data yang diperoleh kadang kala sesuai dengan hipotesis yang telah dirumuskan, tetapi mungkin juga tidak. Apabila data yang diperoleh tidak sesuai dengan hipotesis, berarti ada kemungkinan terdapat kesalahan pada percobaan atau hipotesis yang dirumuskan keliru.
Pada percobaan, kesulitan sering muncul dalam merancang dan melakukan percobaan yang cocok dan layak.
Karena untuk melakukan suatu percobaan diperlukan peralatan yang lengkap, dana, tenaga dan waktu yang banyak.
Kesalahan dalam merumuskan suatu hipotesis akan mengakibatkan percobaan yang dilakukan sia-sia.
4. Menarik Kesimpulan
Hipotesis yang telah teruji kebenarannya setelah melakukan percobaan berulang-ulang, dapat dijadikan dasar untuk menarik kesimpulan umum yang disebut teori.
Seandainya hipotesis tidak terbukti akan menjadi dasar untuk melahirkan teori baru, dan mungkin dapat mengkoreksi teori- teori sebelumnya. Akhirnya pengamatan, hukum, dan teori membentuk lingkaran yang selalu berputar.
Menarik kesimpulan untuk mendapatkan suatu teori adalah puncak kegiatan dalam metode ilmiah. Disini diperlukan penalaran untuk mengkaji sesuatu yang abstrak.
5. Membuat Laporan
Membuat laporan merupakan langkah terakhir dalam metode ilmiah. Laporan penelitian berfungsi sebagai informasi bagi ahli lain mengenai hasil temuan. Disamping itu, laporan juga berguna untuk mendapatkan saran dan koreksi jika diperlukan. Laporan hasil penelitian, biasanya diterbitkan dalam bentuk jurnal ilmiah.
Hasil ini ditulis secara sistematis dan lengkap, mulai dari tahap pertama sampai tahap yang paling akhir. Metode ilmiah memiliki lima karakteristik yang dibagi berdasarkan sifatnya, yaitu:
1. Bersifat kritis dan analitis. Peneliti dengan rinci melakukan observasi dan eksperimen untuk mendapatkan hasil yang relevan dan akurat.
2. Bersifat logis. Langkah-langkah yang dilakukan peneliti dapat dijelaskan dengan logis, bukan berdasarkan firasat atau hal yang lain yang tidak bisa dijelaskan dengan logika.
3. Bersifat obyektif. Hasil penelitian yang didapat harus obyektif, dalam arti hasil tersebut hanya bisa dilakukan oleh peneliti dan bukan hasil rekayasa.
4. Bersifat empiris. Hasil penelitian didapatkan dari kejadian nyata yang benar-benar terjadi, bukan karangan atau opini.
5. Bersifat konseptual. Berfokus pada hal-hal yang berkaitan dengan konsep-konsep suatu fenomena, bagaimana fakta tersebut terjadi, dan kaitan diantaranya.
C. Penggolongan Materi
Materi adalah segala sesuatu yang menempati ruang dan mempunyai massa. Pada prinsipnya, semua materi dapat berada dalam tiga wujud: padat, cair dan gas. Padatan adalah benda yang kaku dengan bentuk yang pasti. Cairan tidak serigid padatan dan bersifat fluida, yaitu dapat mengalir dan mengambil bentuk sesuai wadahnya. Seperti cairan, gas bersifat fluida, tetapi tidak seperti cairan, gas dapat mengembang tanpa batas.
Ketiga wujud materi ini dapat berubah dari wujud yang satu menjadi wujud yang lain. Dengan pemanasan, suatu padatan akan meleleh dan menjadi cairan. Pemanasan lebih lanjut akan mengubah cairan menjadi gas. Di sisi lain, pendinginan gas akan mengembunkannya menjadi cairan.
Pendinginan lebih lanjut akan membuatnya menjadi padat.
Secara fisika, berdasarkan wujudnya, materi dapat dikelompokkan menjadi tiga, yaitu padat, cair dan gas.
1. Zat padat. Sifat yang dimiliki oleh zat padat adalah mempunyai bentuk dan volume tertentu, partikel-partikel zat padat mempunyai energi yang sangat rendah, jarak partikelnya sangat rapat sehingga partikelnya tidak dapat bergerak bebas. Jika zat padat dipanaskan, terjadi penambahan energi yang menyebabkan partikel- partikelnya bervibrasi (bergetar). Jika suhu dinaikkan maka getaran semakin cepat sehingga terjadi proses pemuaian dan jarak partikelnya semakin merenggang dan menjauh, yang menyebabkan perubahan fase padat mulai mencair.
2. Zat cair. Sifat yang dimiliki oleh zat cair adalah mempunyai volume tertentu, tetapi tidak memiliki bentuk yang tetap. Jarak antar partikelnya lebih renggang, memiliki energi yang lebih besar daripada zat padat, dan
partikelnya dapat bergerak bebas. Bila dilakukan pemanasan, getaran antar partikelnya semakin cepat, ikatan antar partikelnya semakin lemah sehingga partikelnya dapat bergerak bebas dan saling menjauh satu sama lain. Jika pemanasan terus dilakukan maka akan terjadi perubahan zat cair menjadi gas.
3. Gas. Molekul zat gas selalu bergerak, ikatan dari antarpartikel semakin lemah dan semakin menjauh sehingga jarak antarpartikel semakin besar karena bergerak sangat bebas dan mempunyai susunan tidak beraturan. Keadaan akan semakin menjauhkan molekul satu dengan lainnya dan bergerak bebas di mana keadaan tersebut akan terjadi bila suhu dinaikkan.
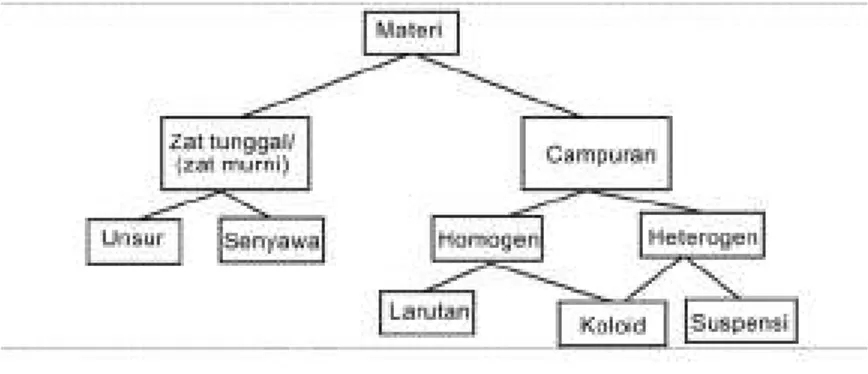
Gambar 1.3 Perbedaan Molekul Zat Padat, Cair dan Gas Secara kimia, materi dapat dikelompokkan ke dalam zat tunggal dan campuran. Zat tunggal dapat dibedakan menjadi dua golongan, yaitu unsur dan senyawa. Sedangkan campuran dikelompokkan menjadi campuran homogen dan heterogen.
Hubungan antara unsur, senyawa dan berbagai golongan materi lainnya dirangkum dalam Gambar 1.4.
Gambar 1.4 Penggolongan Materi 1. Zat Tunggal atau Zat Murni
Dari bagan di atas diketahui bahwa materi dikelompokkan menjadi dua, yaitu zat tunggal (zat murni) dan campuran. Zat tunggal adalah bentuk materi yang memiliki komposisi yang tetap dan sifat yang khas. Contohnya, air, emas, oksigen, dan garam dapur. Zat tunggal dapat dibedakan dengan zat tunggal lainnya dengan melihat komposisinya dan dapat diidentifikasi melalui penampakannya, baunya, rasanya, dan sifat lainnya.
Zat tunggal dapat dikelompokkan menjadi unsur dan senyawa.
a. Unsur
Unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zat- zat lain dengan reaksi kimia biasa (bukan reaksi nuklir). Alam semesta ini mengandung unsur yang sangat banyak, tetapi yang baru diketahui dan dipelajari oleh para ahli adalah sebanyak 118 macam unsur dimana diantaranya lebih dari 22 unsur adalah merupakan unsur buatan. Daftar dari nama-nama unsur tersebut dapat diketahui dalam Daftar Periodik Unsur-unsur Sistem Berkala.
Unsur dapat dikelompokkan menjadi 2 bagian, yaitu unsur logam dan unsur non logam. Contoh unsur logam adalah besi, emas, perak, alumunium, tembaga, natrium, kalium, dan
magnesium. Unsur-unsur logam tersebut memiliki sifat- sifat, seperti semua unsur logam berupa zat padat (kecuali raksa yang berwujud cair), merupakan penghantar listrik dan panas yang baik, memiliki titik leleh dan titik lebur yang tinggi, dapat ditempa dan memiliki kilap khusus dipermukaannya.
Sedangkan unsur non logam tidak memiliki sifat-sifat tersebut. Contoh unsur non logam adalah oksigen, nitrogen, belerang, karbon, klorin dan iodium.
Unsur-unsur dapat diberi nama berdasarkan nama penemunya, tempat atau sifat unsur tersebut. Unsur-unsur yang diberi nama berdasarkan nama penemunya misalnya curium (ditemukan oleh Piere dan Marie Curie), mendelium (ditemukan oleh Mendeleev), dan Einstenium (ditemukan oleh Albert Einsten). Unsur-unsur yang diberi nama sesuai dengan nama tempat misalnya Californium (dari kata California), Europium (dari kata Eropa), dan Francium (Prancis). Unsur-unsur yang diberi nama berdasarkan sifatnya, contohnya manganese (bersifat magnet), astatin (dari kata ”astatos” yang berarti tidak stabil) dan kalsium (dari bahasa Latin ”Calx” yang artinya kapur).
Para ahli kimia bersepakat untuk menggunakan simbol atau lambang untuk memudahkan penulisan unsur. Penulisan lambang unsur ditemukan oleh Jons Jacob Berzellius 1813.
Unsur dilambangkan dengan satu, dua atau tiga huruf. Huruf pertama dari lambang unsur selalu ditulis dengan huruf kapital dan huruf kedua atau ketiga ditulis dengan huruf kecil.
Contoh penulisan lambang unsur cobal dilambangkan dengan Co. Nama dan lambang unsur lainnya misalnya B Boron (B), Berilium (Be), Barium (Ba), Bismuth (Bi), Bromium (Br) dan Berkelium (Bk), Mendelevium (Md), Einstenium (Es), Germanium (Ge), Polonium (Po), Ameresium (Am),
Californium (Cf), Curium (Cm), Nobelium (No), Plutonium (Po), Neptunium (Np).
Jika huruf kedua dari suatu lambang adalah huruf besar maka lambang tersebut bukanlah lambang unsur, melainkan lambang senyawa.
b. Senyawa
Senyawa adalah zat kimia yang terbentuk dari dua atau lebih unsur. Oleh karena itu, senyawa dapat diuraikan menjadi zat lain yang lebih sederhana melalui proses kimia.
Perhatikan contoh berikut: molekul air yang memiliki rumus kimia H2O merupakan suatu senyawa yang tersusun dari 2 buah atom hidrogen dan 1 buah atom oksigen.
Molekul air dihasilkan dari reaksi antara gas hidrogen dan gas oksigen, menurut persamaan reaksi berikut:
2H2(g) + O2(g) → 2H2O(g)
Melalui proses elektrolisis, molekul air yang terbentuk dari reaksi tersebut dapat diuraikan kembali menjadi gas hidrogen dan gas oksigen.
2H2O(c) → 2H2(g) + O2(g)
Sifat zat yang menyusun senyawa berbeda dengan sifat senyawa yang terbentuk. Pada contoh di atas, gas oksigen dan gas hidrogen berwujud gas dan mudah terbakar, sedangkan air berwujud cair dan digunakan untuk memadamkan api.
Hal lain yang harus diperhatikan ketika membahas tentang senyawa adalah bahwa senyawa terbentuk dari unsur-unsurnya dengan perbandingan yang tetap.
Berdasarkan hasil eksperimen yang dilakukannya, Joseph Louis Proust menyatakan bahwa perbandingan massa unsur-
unsur yang menyusun suatu senyawa adalah tetap. Postulat tersebut dikenal sebagai hukum perbandingan tetap. Sebagai contoh, perbandingan massa gas hidrogen dengan massa gas oksigen dalam air adalah 1:8, di mana rumus air adalah H2O, massa atom (MA) H = 2 × MA, Hidrogen (1) sedangakan O = 1
× massa oksigen 16). Jadi, 2 : 16 = 1 : 8.
Senyawa kimia dapat dikelompokkan menjadi dua, yaitu senyawa yang berasal dari benda tak hidup yang disebut senyawa anorganik dan senyawa yang berasal dari benda hidup yang disebut senyawa organik.
2. Campuran
Campuran adalah gabungan dua zat tunggal atau lebih dengan perbandingan sembarangan. Contohnya udara, minuman ringan, susu, semen, dll. Udara merupakan campuran gas, tersusun dari nitrogen, oksigen, argon, uap air dan karbon dioksida. Campuran dapat pula terjadi antar senyawa, contohnya air dengan alkohol, atau antara unsur dengan senyawa, contohnya nitrogen dengan uap air.
Campuran tidak memiliki susunan yang tetap.
Campuran dapat dibagi dua, yaitu campuran yang homogen dan heterogen. Ketika sesendok gula dilarutkan dalam air, setelah pengadukan yang cukup lama, susunan dari campurannya di seluruh bagian larutan akan sama. Larutan ini disebut campuran homogen. Dengan kata lain campuran homogen adalah penggabungan dua zat tunggal atau lebih yang semua partikelnya menyebar merata sehingga membentuk satu fasa. Yang disebut satu fasa adalah zat yang sifat dan komposisinya sama antara satu bagian dengan bagian yang lain didekatnya.
Campuran heterogen adalah penggabungan yang tidak merata antara dua zat tunggal atau lebih shingga
perbandingan komponen yang satu dengan yang lainnya tidak sama di berbagai bagian bejana, contohnya, minyak dan air.
Apabila kita mengambil sampel dari sebagian campuran minyak dan air akan kita dapatkan bahwa sebagian campuran akan mempunyai sifat minyak, sedangkan sebagian lain mempunyai sifat air. Jadi, campuran ini terdiri dari dua fasa yaitu minyak dan air. Apabila campuran kita kocok, maka minyaknya akan tersebar (terdispersi) sebagai butir-butir halus yang jika dikumpulkan akan merupakan satu fasa. Hal ini karena masing-masing butir minyak tersbut mempunyai sifat dan komposisi seperti minyak pada butir lain.
Campuran dapat dipisahkan melalui peristiwa fisika atau kimia. Pemisahan secara fisika tidak mengubah zat selama pemisahan. Teknik pemisahan campuran bergantung pada jenis, wujud dan sifat komponen yang terkandung didalamnya. Jika komponen berwujud padat dan cair, misalnya pasir dan air, dapat dipisahkan dengan saringan.
Campuran homogen, seperti alkohol dalam air, tidak dapat dipisahkan dengan saringan, karena partikelnya lolos dalam pori-pori kertas saringan dan selaput semipermiabel.
Campuran seperti itu dapat dipisahkan dengan cara fisika, yaitu destilasi, rekristalisasi, ekstraksi dan kromatografi.
1. Destilasi. Dasar pemisahan destilasi adalah perbedaan titik didih dua cairan atau lebih. Jika campuran dipanaskan maka komponen yang titik didihnya lebih rendah akan menguap lebih dulu. Contohnya, memisahkan campuran air dan alkohol. Titik didih air dan alkohol masing-masing 1000C dan 780C. jika campuran dipanaskan (dalam labu destilasi) dan suhu diatur sekitar 780C, maka alkohol akan menguap sedikit demi sedikit.
Uap itu mengembun dalam pendinginan dan akhirnya didapat cairan alkohol murni.
2. Rekristalisasi. Teknik pemisahan rekristalisasi berdasarkan perbedaan titik beku komponen. Perbedaan harus cukup besar, sebaiknya komponen yang dipisahkan berwujud padat dan cair pada suhu kamar. Contohnya, garam dapat dipisahkan dari air karena garam berupa padatan. Air garam bila dipanaskan perlahan dalam bejana terbuka, maka air akan menguap sedikit demi sedikit. Pemanasan dihentikan saat larutan tepat jenuh.
Jika dibiarkan akhirnya terbentuk Kristal garam secara perlahan. Setelah pengkristalan sempurna, garam dapat dipisahkan dengan menyaring.
3. Ekstraksi. Pemisahan dengan cara ekstraksi berdasarkan perbedaan kelarutan komponen dalam pelarut yang berbeda. Campuran dua komponen (misalkan A dan B) dimasukkan dalam pelarut X dan Y. Syarat pelarut ini tidak dapat bercampur, seperti air dan minyak. Semuanya dimasukkan ke dalam corong pisah dan dikocok agar bercampur dan kemudian didiamkan sampai pelarut X dan Y memisah kembali. Kini zat A dan B berada dalam kedua pelarut X dan Y, tetapi perbandingan tidak sama.
Misalkan A lebih banyak larut di X, sedangkan B lebih banyak di Y. akhirnya A dan B telah terpisah walaupun tidak sempurna. Kedua pelarut dapat dipisahkan dengan membuka kran corong perlahan-lahan dan ditampung dalam bejana yang bersih.
4. Kromatografi. Kromatografi adalah teknik pemisahan campuran dalam berbagai wujud, baik padat, cair maupun gas. Dasar kromatografi adalah perbedaan daya serap satu zat dengan zat lainnya. Jika komponen campuran (misalnya A, B dan C) dialirkan dengan suatu pelarut melalui padatan tertentu, maka A, B dan C akan bergerak dengan kecepatan berbeda, karena daya serap
padatan itu terhadap komponen tidak sama. Cairan atau pelarut yang membawa komponen bergerak disebut eluen atau fasa bergerak, sedangkan padatan yang menyerap komponen disebut adsorben atau fasa tetap.
Syarat eluen harus dapat melarutkan semua komponen dan dapat mengalir, maka harus berupa cairan atau gas.
Eluen dapat merupakan zat murni atau campuran, misalnya eter atau alkohol 50%. Komponen yang diserap paling kuat oleh adsorben akan mengalir paling lambat (yaitu A) dan sebaliknya, yang diserap paling lemah (yaitu B) akan mengalir paling cepat, sedangkan daya serap terhadap C berada di antara A dan B. Semakin lama proses mengalir semakin jauh jarak antara komponen dan semakin sempurna pemisahan, tetapi diperlukan tabung yang panjang serta eluen dan adsorben yang banyak.
D. Sifat Fisis dan Kimia Materi
Setiap materi memiliki sifat tertentu yang khas, yang memudahkannya untuk dikenali dan dibedakan dengan zat lainnya. Sifat materi dapat dikelompokkan menjadi dua, yaitu sifat fisika dan sifat kimia.
Tiap zat misalnya air, gula, garam, perak atau tembaga, memiliki seperangkat sifat atau karakteristik yang membedakannya dari semua zat lain dan memberinya identitas unik. Baik gula maupun garam berwarna putih, padat, kristalin, larut dalam air dan tak berbau. Tetapi gula manis, bila dipanaskan dalam belanga akan meleleh dan menjadi coklat. Gula terbakar di udara. Garam asin, baru meleleh setelah dipanasi sehingga membara, tak menjadi coklat betapapun dipanasi, tidak terbakar di udara meskipun akan menghasilkan nyala kuning bila dipanasi di dalam nyala.
Ada dua macam sifat materi, yaitu sifat intensif dan sifat ekstensif. Sifat intensif tidak bergantung pada jumlah materi yang diukur. Sifat intensif seperti suhu, titik didih, titik beku, indeks bias, kerapatan dan rumus senyawa. Suhu adalah sifat intensif, bayangkan kita memiliki dua gelas air yang suhunya sama. Jika kita mencampurkan air itu, maka suhu air akan tetap sama dengan suhunya ketika masih terpisah.
Sifat ekstensif yang terukur bergantung pada seberapa banyak materi yang diukur. Massa, panjang, mol dan volume adalah sifat-sifat ekstensif. Semakin banyak materi, semakin besar massanya. Nilai-nilai dari sifat ekstensif yang sama dapat dijumlahkan. Misalnya, dua keping uang logam mempunyai massa gabungan yang merupakan jumlah dari massa masing-masing keping uang itu, dan volume yang ditempati air dalam dua gelas merupakan jumlah dari volume air di tiap gelas tersebut.
Sifat fisika suatu materi dapat dilihat dan diukur secara langsung, yang termasuk sifat fisika misalnya warna, bau, kerapatan, titik leleh, titik beku, kelenturan, dan kekuatan.
Sifat kimia ialah sifat yang berhubungan dengan kemampuan sebuah zat untuk bereaksi atau berubah menjadi zat lain.
Untuk mengukur dan mengamati sifat kimia hanya dapat dilakukan melalui reaksi. Contohnya, gas hidrogen dapat berubah menjadi air jika direaksikan dengan gas oksigen.
Setelah gas hidrogen dan gas oksigen bereaksi, dihasilkan zat baru, yaitu air yang sifatnya berbeda dengan sifat zat pembentuknya.
Untuk membedakan antara sifat fisika dan sifat kimia, contohnya kita lihat pada besi. Besi memiliki titik leleh sebesar 1000◦C. Titik leleh tersebut disebut sebagai sifat fisika, sedangkan kemampuan besi untuk berubah menjadi karat besi disebut dengan sifat kimia.
Beberapa sifat fisika yang terdapat dalam suatu benda sebagai berikut:
1. Wujud berbagai zat yang berada di alam dibagi ke dalam 3 (tiga) jenis, yaitu zat padat, zat cair, dan zat gas. Setiap zat dapat berubah bentuk apabila mengalami perubahan suhu. Namun, perubahan yang terjadi pada suatu zat tidak akan menghasilkan zat baru.
2. Ukuran sifat fisika dari suatu benda yang mudah untuk diamati adalah ukurannya. Adanya perbedaan ukuran setiap benda, menjadikan kemudahan dalam membedakan antar benda satu dengan yang lainnya.
Sebagai contoh, pasir dan batu memiliki ukuran yang berbeda, sehingga mudah untuk dibedakan jenisnya.
3. Bentuk aktivitas dari manusia maupun makhluk hidup lainnya dapat menyebabkan terjadinya sifat fisik suatu benda pada bentuknya. Sebagai contoh, plat besi yang dapat dibentuk sehingga menghasilkan pisau. Kemudian, kayu yang diolah akan menghasilkan sebuah kursi atau meja.
4. Volume adalah sifat fisis yang dimiliki oleh benda. Adanya sifat tersebut, memungkinkan manusia untuk memanfaatkan suatu benda. Sebagai contoh dengan diketahuinya volume benda, manusia dapat menempatkan sesuai dengan volumenya. Hal tersebut terjadi dalam perilaku pengepakkan barang ke dalam kardus.
Beberapa sifat kimia yang terdapat dalam suatu benda sebagai berikut:
1. Warna yang berubah. Perubahan warna yang terjadi dalam suatu benda, masuk ke dalam sifat kimia. Hal tersebut dapat terjadi karena adanya perubahan suhu sehingga mempengaruhi warna suatu benda. Sebagai contoh dari
perubahan warna benda, terjadi pada buah yang menjadi matang.
2. Perubahan suhu. Perubahan suhu (temperatur) dalam suatu benda dapat terjadi dan masuk ke dalam sifat kimia suatu benda. Perubahan suhu pada suatu benda dapat dimanfaatkan di kehidupan sehari-hari, sebagai contoh, proses perubahan suhu terjadi pada proses pembuatan tempe yang diberi air. Suhu pada tempe akan berubah.
3. Terjadinya gas. Pada proses perubahan kimia suatu benda, dapat menghasilkan adanya gas. Sebagai contoh, proses percampuran logam seng ke dalam tabung yang berisi larutan asam sulfat. Percampuran tersebut, akan menghasilkan seng sulfat dan gelembung-gelembung gas.
4. Berkarat. Terjadinya karat pada suatu benda, disebabkan karena adanya reaksi antara logan dan oksigen. Berkarat masuk ke dalam sifat kimia lantara menghasilkan sebuah zat yang bersifat baru.
Beberapa zat yang berada di alam memiliki sifat kimia beracun. Sifat tersebut, dapat dimanfaatkan manusia untuk membasmi hama yang menyusahkan. Beberapa contoh zat- zat beracun tersebut seperti insektisida, pestisida, dan herbisida.
E. Pengukuran
Pengukuran adalah penentuan besaran, dimensi, atau kapasitas, biasanya terhadap suatu standar atau satuan pengukuran. Pengukuran tidak hanya terbatas pada kuantitas fisik, tetapi juga dapat diperluas untuk mengukur hampir semua benda yang bisa dibayangkan, seperti tingkat ketidakpastian, atau kepercayaan konsumen.
Pengukuran adalah kegiatan membandingkan suatu besaran yang diukur dengan alat ukur yang digunakan sebagai satuan. Dalam fisika dan teknik, pengukuran
merupakan aktivitas yang membandingkan kuantitas fisik dari objek dan kejadian dunia-nyata. Alat pengukur adalah alat yang digunakan untuk mengukur benda atau kejadian tersebut. Seluruh alat pengukur terkena error peralatan yang bervariasi. Bidang ilmu yang mempelajari cara-cara pengukuran dinamakan metrologi.
Fisikawan menggunakan banyak alat untuk melakukan pengukuran mereka. Ini dimulai dari alat yang sederhana seperti penggaris dan stopwatch sampai ke mikroskop elektron dan pemercepat partikel. Instrumen virtual digunakan luas dalam pengembangan alat pengukur modern.
Pengukuran adalah kegiatan membandingkan suatu besaran yang diukur dengan alat ukur yang digunakan sebagai satuan.
Contoh : Mengukur panjang meja dengan pensil.
Panjang pensil digunakan sebagai satuan.
Hasil : panjang meja = 5 pensil.
Besaran adalah sesuatu yang dapat diukur dan dapat dinyatakan dengan angka.
Satuan adalah pembagi dalam suatu pengukuran.
Satuan baku adalah satuan yang digunakan untuk melakukan pengukuran dengan hasil yang sama atau tetap untuk semua pengukuran.
Satuan tidak baku adalah satuan yang digunakan untuk melakukan pengukuran dengan hasil tidak sama untuk orang yang berlainan.
Pengukuran adalah proses pemberian angka- angka atau label kepada unit analisis untuk merepresentasikan atribut- atribut konsep. Proses ini seharusnya cukup dimengerti orang walau misalnya definisinya tidak dimengerti. Hal ini karena antara lain kita sering kali melakukan pengukuran.
Dalam ilmu pengetahuan, pengukuran adalah proses mendapatkan besarnya suatu kuantitas, seperti panjang atau massa, relatif ke unit pengukuran, seperti meter atau satu kilogram. Sebuah pengukuran menjawab pertanyaan umum, “berapa banyak?”, Seperti dalam berapa kilometer, atau milimeter, atau gigahertz. Seperti pengukuran pada dasarnya adalah tentang penghitungan, pengukuran dilakukan dalam jumlah dan kuantitatif, dibandingkan dengan lain pengamatan yang mungkin dibuat dalam kata-kata dan kualitatif. Istilah pengukuran juga dapat digunakan untuk mengacu ke hasil spesifik yang diperoleh dari proses pengukuran.
Pengertian pengukuran dalam Ilmu Pengetahuan Alam:
1. Dalam fisika. Dalam fisika dan teknik, pengukuran merupakan aktivitas yang membandingkan kuantitas fisik dari objek dan kejadian dunia-nyata. Alat pengukur adalah alat yang digunakan untuk mengukur benda atau kejadian tersebut. Seluruh alat pengukur terkena error peralatan yang bervariasi. Bidang ilmu yang mempelajari cara-cara pengukuran dinamakan metrologi.
Fisikawan menggunakan banyak alat untuk melakukan pengukuran mereka. Ini dimulai dari alat yang sederhana seperti penggaris dan stopwatch sampai ke mikroskop elektron dan pemercepat partikel. Instrumen virtual digunakan luas dalam pengembangan alat pengukur modern.
2. Dalam kimia. Seperti halnya dalam fisika pengertian pengukuran dalam kimia adalah pengukuran sifat kimia yang dapat teramati oleh fisik maupun tidak. Pengukuran dalam kimia tidak harus berupa data kuantitatif saja namun dapat berupa data kualitatif. Misalnya menentukan asam, basa atau garam suatu zat menggunakan kertas lakmus.
Dalam kimia pengukuran sangat penting karena kesalahan dalam pengukuran dapat mengakibatkan reaksi yang berbeda. Sehingga kesalahan pengukuran harus diminimalisir karena pengaruhnya sangat besar.
3. Dalam biologi. Pengukuran dalam biologi adalah suatu kegiatan pengukuran suatu variabel yang berhubungan dengan makhluk hidup dengan menggunakan suatu instrument untuk mendapatkan data yang berupa angka- angka. Pengukuran ini dapat berupa pengukuran langsung dan pengukuran tidak langsung.
Pemodelan yang ditujukan untuk mengukur dimensi- dimensi yang membentuk sebuah faktor atau variabel tersebut disebut Measurement Model atau Model Pengukuran. Measurement model berkaitan dengan sebuah faktor. Karenanya, analisis yang dilakukan sebenarnya sama dengan analisis faktor, dalam konteks apakah indikator yang digunakan dapat mengkonfirmasi faktor. Model pengukuran digunakan untuk mengukur suatu variabel yang yang tidak langsung dapat diketahui (pengukuran tidak langsung).
Metode pengukuran adalah cara yang digunakan untuk memperoleh data kuantitatif dari suatu variabel. Metode dapat berupa penggunaan alat ukur untuk mengetahui besaran kuantitatif maupun dengan cara menggunakan suatu model pengukuran. Dalam suatu pengukuran dapat digunakan lebih dari satu metode untuk mengurangi nilai ketidak pastian hasil pengukuran. Untuk itu metode yang digunakan harus disesuaikan dengan tujuan dan variable yang akan diukur agar hasil yang didapatkan akurat.
Berikut adalah contoh metode pengukuran menggunakan suatu instrument/alat pengukuran:
1. Pengukuran panjang. Ada tiga alat ukur panjang yang umum digunakan, mistar, jangka sorong, dan mikrometer sekrup.
2. Pengukuran massa dan waktu. Massa diukur dengan neraca. Neraca yang biasa dipakai di laboratorium adalah waktu secara prinsip dapat diukur oleh kejadian yang berulang secara teratur, misalnya detak jantung, getaran pegas, rotasi bumi, dan revolusi bumi. Selang waktu singkat seperti catatan waktu lomba lari dengan stopwatch. Stopwatch analog memiliki ketelitian 0,1 sekon dan stopwatch digital memiliki ketelitian 0,01 sekon.
3. Pengukuran luas dan volume. Pengukuran luas termasuk pengukuran tidak langsung. Luas benda dapat diukur dengan menggunakan rumus.
BAB II HUKUM DASAR KIMIA
A. Hukum-Hukum Dasar Kimia
Di dalam perhitungan dalam kimia, terdapat beberapa hukum-hukum dasar kimia, antara lain :
1. Hukum Kekekalan Massa
Pada tahun 1774, Lavoiser memanaskan timah dengan oksigen dalam wadah tertutup. Dengan menimbang secara teliti, ia berhasil membuktikan bahwa dalam reaksi itu tidak terjadi perubahan massa. Perubahan ini menjadi dasar Hukum Kekekalan Massa, yang berbunyi: “Pada reaksi kimia, massa zat pereaksi sama dengan massa zat hasil reaksi”
Dengan kata lain dapat dinyatakan: “Materi tidak dapat diciptakan atau dimusnahkan”.
2. Hukum Perbandingan Tetap
Proust meneliti perbandingan massa unsur-unsur dalam senyawa. Misalkan: air, berapakah perbandingan massa hidrogen dan oksigen. Bila direaksikan 10 gram oksigen ternyata diperlukan 0,125 gram hidrogen. Sesuai dengan hukum Lavoiser akan terbentuk 10,125 gram air.
Oksigen + hidrogen air
10 gram 0,125 gram 10,125 gram
atau 8 1 9
Sebaliknya, jika 100 gram air diuraikan ternyata menghasilkan 88,9 gram oksigen dan 11,1 gram hidrogen.
Air oksigen + hidrogen 100gram 88,9 gram 11,1 gram
atau 9 8 1
Untuk membentuk air diperlukan oksigen dan hidrogen dengan perbandingan yang tetap yaitu 8 : 1. Dengan kata lain, air mengandung oksigen dan hidrogen dengan perbandingan massa 8 dan 1. Demikian juga jika direaksikan 28 gram besi (Fe) akan diperlukan 16 gram belerang (S) dan akan terbentuk 44 gram besi belerang atau :
Besi + Belerang besi belerang
28 gram 16 gram 44 gram
atau 7 gram 4 gram 11 gram
Besi + Belerang besi belerang
14 gram 8 gram 22 gram
atau 7 gram 4 gram 11 gram
Jadi, perbandingan massa besi dan belerang dalam reaksi di atas adalah sama walaupun jumlah massanya di ubah.
Berdasarkan percobaan di atas, Proust merumuskan pernyataan yang disebut Hukum Perbandingan Tetap “Dalam suatu zat kimia murni, perbandingan massa unsur-unsur dalam tiap- tiap senyawa adalah tetap”.
Contoh:
Hasil pemeriksaan garam dari Madura dan Cirebon menghasilkan data sebagai berikut:
Massa garam Massa Natrium Massa Klor Madura 0,2925 gram 0,1150 gram 0,1775 gram Cirebon 1,7750 gram 0,6900 gram 1,0650 gram
Tunjukan bahwa garam mempunyai perbandingan unsur yang tetap!
Jawab:
Garam madura:
% Na = 0,1150
0,2925 x 100% = 39,3%
% Na = 0,1775
0,2925 x 100% = 60,7%
Garam Cirebon:
% Na = 0,6900
1,7750 x 100% = 39,3%
% Na = 1,0650
1,7750 x 100% = 60,7%
Maka perbandingan massa atom natrium dan klor adalah sama, walaupun garam berasal dari daerah yang berbeda.
3. Hukum Perbandingan Berganda
John Dalton tertarik mempelajari dua unsur yang dapat membentuk lebih dari satu senyawa, seperti tembaga dengan oksigen, karbon dengan oksigen, belerang dengan oksigen, fosfor dengan klor. Perbandingan massa kedua unsur tersebut adalah:
a. Tembaga dengan oksigen membentuk dua senyawa tembaga oksida
Tembaga oksida Tembaga Oksigen Tembaga : Oksigen
CuO 88,8% 11,2% 1 : 1,33
Cu2O 79,9% 20,1% 1 : 2,67
b. Karbon dengan oksigen membentuk dua senyawa karbon oksida
Karbon oksida Karbon Oksigen Karbon : Oksigen
CO 42,8% 57,2% 1 : 1,33
CO2 27,3% 72,7% 1 : 2,67
c. Sulfur dengan oksigen dapat membentuk dua senyawa oksigen yaitu sulfur dioksida (I) dan sulfur trioksida (II)
Senyawa Belerang Oksigen Belerang : Oksigen
I 50% 50% 1 : 1
II 40% 60% 1 : 1,5
Dari ketiga contoh di atas massa Tembaga, Karbon dan Sulfur adalah sama. Angka perbandingan atom oksigen yaitu:
Tembaga oksida 0,126 : 0,252 = 1 : 2 Karbon oksida 1,33 : 2,67 = 1 : 2 Belerang oksida 1 : 1,5 = 2 : 3 maka perbandingan oksigen dalam bilangan bulat dan sederhana.
Berdasarkan percobaan di atas, Dalton menarik kesimpulan yang disebut Hukum Perbandingan Berganda
“Bila dua unsur dapat membentuk lebih dari satu senyawa, apabila masaa salah satu unsur dalam kedua senyawa sama, maka massa dari unsur yang lain berada dalam perbandingan bulat dan sederhana”
Contoh:
Raksa dan klor membentuk dua macam senyawa. Dalam senyawa pertama 0,66 gram raksa bergabung dengan 0,118 gram klor, sedangkan dalam senyawa kedua 1,00 gram raksa bergabung dengan 0,355 gram klor. Apakah data ini sesuai dengan hukum perbandingan berganda?
Jawab:
Senyawa Raksa Klor Raksa : Klor
I 0,66 0,118 1 : 0,178
II 1,00 0,355 1 : 0,355
Perbandingan klor bila massa raksa sama:
0,178 : 0,355 1 : 2
4. Hukum Penyatuan Volume
Bila 2 liter gas hidrogen bereaksi dengan 1 liter gas oksigen menghasilkan 2 liter uap air.
Gambar 2.1 Reaksi dari gas hidrogen dan gas oksigen membentuk uap air
Berdasarkan gambar reaksi di atas, berapa perbandingan volume gas sebelum bereaksi dan volume gas hasil reaksi?
(dimana perbandingan volume gas-gas yang bereaksi sama dengan koefisien reaksinya).
Persamaan reaksinya adalah:
2H2(g) + ……. ……..
Pada suhu dan tekanan yang sama, maka perbandingan volumenya adalah:
2 volume gas Hidrogen : ………. : ………….
2 : ………. : …………
Perbandingan volume pereaksi merupakan bilangan bulat dan sederhana, mirip dengan hukum perbandingan tetap.
Dalam hukum penyatuan volume ini yang dibandingkan adalah volume gas pada Tekanan (P) dan Suhu (T) yang sama.
Berdasarkan kenyataan itu, Gay Lussac membuat pernyataan yang disebut Hukum Penyatuan Volume: “Volume gas-gas yang terlibat dalam reaksi kimia pada tekanan dan suhu yang sama berbanding sebagai bilangan bulat dan sederhana”.
5. Hukum Avogadro
Gambar 2.2. berikut menunjukkan reaksi gas metana dengan gas oksigen menghasilkan karbondioksida dan air.
Gambar 2.2 Reaksi Pembakaran Atau :
metana + Oksigen karbon dioksida + air
1 vol 2 vol 1 vol 2 vol
n molekul 2n molekul n molekul 2n molekul
CH4 + 2O2 CO2 + 2H2O
Berdasarkan reaksi tersebut Avogadro menyarankan bahwa unsur gas bukan monoatom tetapi poliatom. Avogadro sangat tertarik mempelajari sifat gas dan membuat dugaan sementara yang disebut Hipotesis Avogadro: “Pada suhu dan tekanan yang sama, semua gas yang volumenya sama mempunyai jumlah molekul yang sama”.
B. Persamaan Reaksi
Reaksi kimia merupakan suatu proses dimana zat (atau senyawa) di ubah menjadi satu atau lebih senyawa baru, atau perubahan pereaksi menjadi hasil reaksi.
Persamaan reaksi menggunakan lambang kimia untuk menunjukan apa yang terjadi saat reaksi kimia berlangsung.
1. Menuliskan Persamaan Kimia
Suatu reaksi tidak boleh melanggar hukum Kekekalan Massa, artinya jenis dan jumlah atom sebelum (pereaksi) dan sesudah reaksi (hasil reaksi) harus sama.
Contoh:
gas hidrogen (H2) terbakar di udara (yang mengandung O2) untuk membentuk air (H2O).
Hidrogen + Oksigen Air
H2 + O2 H2O
dimana tanda (+) berarti “bereaksi dengan” dan tanda ( ) berarti “menghasilkan”. Jadi, dapat dibaca gas hidrogen bereaksi dengan molekul oksigen menghasilkan air.
Jika diperhatikan jenis atom sebelum dan sesudah reaksi sama yaitu H dan O. Yang belum sama adalah jumlah atomnya. Agar memenuhi Hukum Kekekalan Massa, maka jumlah tiap-tiap atom sebelum dan sesudah reaksi harus kita tambah bilangan bulat di depan masing-masing zat, sehingga jumlah atom-atom tersebut sama, yaitu:
2H2 + O2 2H2O
Angka-angka di depan unsur dan senyawa disebut koefisien reaksi sedangkan angka 1 tidak perlu dituliskan.
Persamaan kimia yang setara ini menunjukan bahwa “dua molekul hidrogen beeaksi dengan satu molekul oksigen
menghasilkan dua molekul air” atau “dua mol molekul hidrogen bereaksi dengan satu mol molekul oksigen menghasilkan dua mol molekul air”.
H2 dan O2 pada persamaan disebut reaktan (pereaksi), sedangkan H2O disebut produk(hasil reaksi).
Dalam persamaan reaksi ada wujud fisik dari reaktan dan produk menggunakan huruf g (gas), l (cair), s (padat) dan aq (berair).
2HgO(s) 2Hg(l) + O2(g)
NaCl(s) NaCl(aq)
2. Menyetarakan Persamaan Kimia Contoh :
Setarakan reaksi berikut: C6H6 + O2 CO2 + H2O Jawab:
Misalkan koefsisien reaksi:
aC6H6 + bO2 cCO2 + dH2O
cari atom yang hanya terdapat dalam satu senyawa di kiri dan di kanan, atom tersebut merupakan atom C dan H.
Jadi: C: 6a = c H: 6a = 2d
3a = d
Persamaan reaksi menjadi:
aC6H6 + bO2 6aCO2 + 3aH2O unsur lain, yaitu atom O,
Jadi, O : 2b = 12a + 3a 2b = 15a
Persamaan reaksi: C6H6 + 152 O2 6CO2 + 3H2O supaya tidak ada pecahan maka dikalikan 2 :
2C6H6 + 15O2 12CO2 + 6H2O C. Massa Atom Relatif (Ar)
Menurut Dalton, massa atom adalah sifat utama unsur yang membedakan satu unsur dengan yang lain. Karena atom sangat ringan, maka tidak dapat digunakan satuan gram dan kg untuk massa atom dan harus dicari suatu atom sebagai massa standar.
Massa atom relatif adalah perbandingan massa satu atom dengan massa atom standar. Salah satu syarat massa standar adalah stabil dan murni. Pada tahun 1960 ditetapkan karbon- 12 atau C-12 sebagai standar, sehingga:
Ar = 𝑚𝑎𝑠𝑠𝑎 1 𝑎𝑡𝑜𝑚 𝑋 1
12 𝑥 𝑚𝑎𝑠𝑠𝑎 𝑎𝑡𝑜𝑚 𝐶−12
C-12 ditetapkan mempunyai massa 12 sma, 1 sma = 1
12 x massa 1 atom −12
Massa 1 atom C-12 = 1,993 x 10-23 gram Jadi: 1 sma = 1
12 x 1,993 x 10−23gram 1 sma = 1,66 x 10-24 gram
Massa atom relatif merupakan perbandingan massa, sehingga tidak mempunyai satuan. Massa atom relatif berguna untuk mengetahui sifat unsur dan senyawa.
Misalkan a = 1 maka:
2b = 15a 6a = c 3a = d
2b = 15 b = 15
2
6 = c 3 = d
D. Massa Molekul Relatif (Mr)
Menurut Dalton, dua unsur atau lebih dapat bergabung membentuk senyawa dengan perbandingan tertentu. Partikel terkecil senyawa disebut molekul yang mempunyai massa tertentu. Perbandingan massa molekul dengan massa standar disebut massa molekul relatif (Mr).
Mr senyawa = 𝑚𝑎𝑠𝑠𝑎 𝑠𝑎𝑡𝑢 𝑚𝑜𝑙𝑒𝑘𝑢𝑙 𝑠𝑒𝑛𝑦𝑎𝑤𝑎 1
12 𝑥 𝑚𝑎𝑠𝑠𝑎 𝑠𝑎𝑡𝑢 𝑎𝑡𝑜𝑚 𝐶−12
Cara menentukan Mr senyawa bila diketahui rumusnya, Mr senyawa yang diketahui rumusnya ditentukan langsung dari Ar unsur-unsurnya.
Contoh:
Tentukan Mr dari senyawa berikut (Ar H = 1, S = 32, N = 14, O = 16, C= 12):
a. H2SO4 b. C6H12O6
c. C8H10N4O2 Jawab :
a. Mr H2SO4 = (2 x Ar H) + (1 x Ar S) + (4 x Ar O) = (2 x 1) + (1 x 32) + (4 x 16) = 2 + 32 + 64
= 98
b. Mr C6H12O6 = (6 x Ar C) + (12 x Ar H) + (6 x Ar O) = (6 x 12) + (12 x 1) + (6 x 16) = 72 + 12 + 96
= 180
c. Mr C8H10N4O2 = (8 x Ar C) + (10 x Ar H) + (4 x Ar N) + (2 x Ar O)
= (8 x 12) + (10 x 1) + (4 x 14) + (2 x 16)
= 96 + 10 + 56 + 32
= 194