BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Selada air (Nasturtium officinale R. Br.) termasuk suku Brassicaceae. Selada air sering dikonsumsi sebagai sayur tumis dan rasanya agak mirip dengan kangkung atau bayam. Tumbuhnya menjalar seperti tanaman kangkung dan biasa ditanam di rawa-rawa. Daerah asalnya adalah wilayah timur Mediterania dan wilayah yang berbatasan dengan Asia (Permatasari, 2011).
2.1.1 Sistematika Tumbuhan
Tumbuhan selada air memiliki sistematika sebagai berikut (Lubis et al., 2013) :
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Brassicales Suku : Brassicaceae Marga : Nasturtium
Jenis : Nasturtium officinale R. Br. 2.1.2 Sinonim Tumbuhan
2.1.4 Nama Asing
Watercress (Inggris), sai yeung ts’oi (China) (Novia, 2009), Alafe-Cheshmeh (Persia) (Hoseini, 2009).
2.1.5 Morfologi
Daun tumbuhan selada air merupakan daun majemuk gasal, warna hijau sampai hijau kecoklatan; batang dan tangkai daun berwarna muda kehijauan, anak daun sebanyak 3 lembar sampai 9 lembar, anak daun di ujung umumnya berbentuk jorong melebar sampai bundar, pangkal berbentuk jantung, membundar atau tumpul; panjang helaian anak daun di ujung 1,5 cm sampai 4,5 cm dan lebar 1 cm sampai 3 cm; anak daun dibawahnya berukuran lebih kecil (Ditjen POM, 1989).
2.1.6 Kandungan Kimia
Selada air mengandung alkaloid, flavonoid, saponin, terpenoid/steroid, glikosida dan tanin (Ginting et al., 2014), juga kaya akan kandungan vitamin C, vitamin A, vitamin E, vitamin K (Costain, 2007), asam folat, iodin, besi, protein dan kalsium (Gonçalves et al., 2009).
2.1.7 Khasiat Tumbuhan
aktivitas antioksidan yang kuat sehingga dapat menghambat peroksidasi lipid pada hati, otak dan ginjal dengan dosis 500 mg/ml.
2.2 Toksikologi
Toksikologi adalah kajian tentang hakikat dan mekanisme efek toksik berbagai bahan terhadap makhluk hidup dan sistem biologik lainnya (Lu, 1994). Menurut Hodgson dan Levi (2000), toksikologi didefinisikan sebagai cabang ilmu pengetahuan yang berhubungan erat dengan senyawa racun dimana racun yang dimaksud adalah senyawa-senyawa yang menimbulkan efek merugikan tubuh bila dikonsumsi baik secara sengaja maupun tidak sengaja. Menurut Donatus (1996), toksikologi didefinisikan sebagai ilmu yang mempelajari pengaruh kuantitatif zat kimia atas sistem-sistem biologi dengan pusat perhatiannya terletak pada aksi berbahaya zat kimia tersebut.
2.3 Paparan Umum Toksikologi
Peristiwa timbulnya pengaruh berbahaya atau efek toksik racun terhadap makhluk hidup terjadi melalui beberapa proses. Menurut Donatus (1996), pertama kali makhluk hidup mengalami paparan dengan toksikan, setelah mengalami absorpsi dari tempat paparannya maka toksikan atau metabolitnya akan terdistribusi ke tempat aksi (sel sasaran atau reseptor) tertentu yang ada di dalam diri makhluk hidup. Di tempat aksi ini kemudian terjadi interaksi antara toksikan atau metabolitnya dengan komponen penyusun sel sasaran atau reseptor sehingga timbul pengaruh berbahaya atau efek toksik dengan wujud serta sifat tertentu.
secara intravaskuler meliputi intravena, intrakardial dan intraarteri dimana toksikan langsung masuk ke dalam sirkulasi darah, sedangkan masuknya toksikan secara ekstravaskuler meliputi peroral, intramuskular, intraperitonial, subkutan dan inhalasi dimana toksikan tidak langsung masuk ke dalam sirkulasi darah. Toksikan yang masuk secara ekstravaskuler selanjutnya akan masuk ke dalam sirkulasi darah setelah melalui tahap absorpsi terlebih dahulu. Toksikan yang berada dalam sirkulasi darah akan mengalami distribusi ke tempat aksi (sel sasaran atau reseptor).
Tubuh makhluk hidup memiliki sistem pertahanan terhadap zat-zat asing atau xenobiotik yang masuk ke dalam tubuhnya. Tubuh makhluk hidup akan menolak dan mengekskresikan toksikan atau metabolitnya yang masuk di dalam tubuhnya secara alami. Kapasitas toksikan yang melebihi sistem pertahanan tubuh menyebabkan toksikan yang berlebih tersebut selanjutnya akan bereaksi dengan sel sasaran atau reseptor dimana reaksi antara toksikan atau metabolitnya dengan sel sasaran atau reseptor dapat bersifat dapat balik (reversible) maupun tidak balik (irreversible). Hal tersebut berakibat timbulnya efek toksik yang tidak diinginkan (Donatus, 1996).
2.4 Toksisitas
Toksisitas adalah potensi bahan kimia untuk meracuni tubuh orang yang terpapar. Toksisitas adalah kemampuan suatu zat asing dalam menimbulkan kerusakan pada organisme baik saat digunakan atau saat berada dalam lingkungan (Priyanto, 2009).
Data yang diperoleh dapat digunakan untuk memberi informasi mengenai derajat bahaya sediaan uji tersebut bila terjadi pemaparan pada manusia sehingga dapat ditentukan dosis penggunaan dan keamanannya (OECD, 2001).
Penelitian toksisitas konvensional pada hewan coba sering mengungkapkan serangkaian efek akibat pajanan toksikan dalam berbagai dosis untuk berbagai masa pajanan. Penelitian toksikologi biasanya dibagi menjadi tiga kategori (Lu, 1994):
a. Uji toksisitas akut dilakukan dengan memberikan bahan kimia yang sedang diuji sebanyak satu kali atau beberapa kali dalam jangka waktu 24 jam.
b. Uji toksisitas jangka pendek (dikenal dengan subkronik) dilakukan dengan memberikan bahan kimia berulang-ulang, biasanya setiap hari, selama jangka waktu kurang lebih tiga bulan untuk tikus dan satu atau dua tahun untuk anjing.
c. Uji toksisitas jangka panjang dilakukan dengan memberikan bahan kimia berulang-ulang selama masa hidup hewan coba atau sekurang-kurangnya sebagian besar dari masa hidupnya, misalnya 18 bulan untuk mencit, 24 bulan untuk tikus, dan 7-10 tahun untuk anjing dan monyet.
2.4.1 Uji Toksisitas Akut
Uji toksisitas akut dengan menggunakan hewan percobaan diperlukan untuk mendeteksi efek toksik yang muncul dalam waktu singkat setelah pemberian suatu zat dalam dosis tunggal atau dosis berulang yang diberikan dalam waktu tidak lebih dari 24 jam; apabila pemberian dilakukan secara berulang, maka interval tidak kurang dari 3 jam. Penilaian toksisitas akut ditentukan dari kematian hewan uji sebagai parameter akhir. Hewan yang mati selama percobaan dan yang hidup sampai akhir percobaan diotopsi untuk dievaluasi adanya gejala-gejala toksisitas dan selanjutnya dilakukan pengamatan secara makropatologi pada setiap organ (OECD, 2001).
Takaran dosis yang dianjurkan pada toksisitas akut paling tidak terdapat empat peringkat dosis. Dari dosis terendah yang tidak atau hampir tidak mematikan seluruh hewan uji sampai dengan dosis tertinggi yang dapat mematikan seluruh atau hampir seluruh hewan uji (Donatus, 1996).
Tujuan uji toksisitas akut adalah untuk mengidentifikasi bahan kimia yang toksik dan memperoleh informasi tentang bahaya terhadap manusia bila terpajan. Uji toksisitas akut digunakan untuk menetapkan nilai LD50 suatu zat (OECD, 2001). Tujuan lain dilakukannya uji toksisitas akut yaitu untuk mengetahui hubungan antara dosis dengan timbulnya efek seperti perubahan perilaku, koma, dan kematian serta mengetahui gejala-gejala toksisitas akut sehingga bermanfaat untuk membantu diagnosis adanya kasus keracunan dan untuk memenuhi persyaratan regulasi jika zat uji akan dikembangkan menjadi obat (Priyanto, 2009).
menyebabkan kematian sampai 50% dari jumlah hewan yang diuji (Retnomurti, 2008). LD50 yaitu dosis tunggal suatu bahan yang secara statistik diharapkan akan membunuh 50% hewan coba. Pengujian ini dapat menunjukkan organ sasaran yang mungkin dirusak serta memberikan petunjuk tentang dosis yang sebaiknya digunakan dalam pengujian yang lebih lama (Lu, 1994).
LD50 adalah dosis perkiraan bahwa ketika racun itu diberikan langsung kepada hewan uji, menghasilkan kematian 50% dari populasi di bawah kondisi yang ditentukan dari tes atau LC50 merupakan konsentrasi perkiraan, dalam lingkungan hewan yang terpapar, yang akan membunuh 50% dari populasi di bawah kondisi yang ditentukan dari tes (Hodgson dan Levi, 2000).
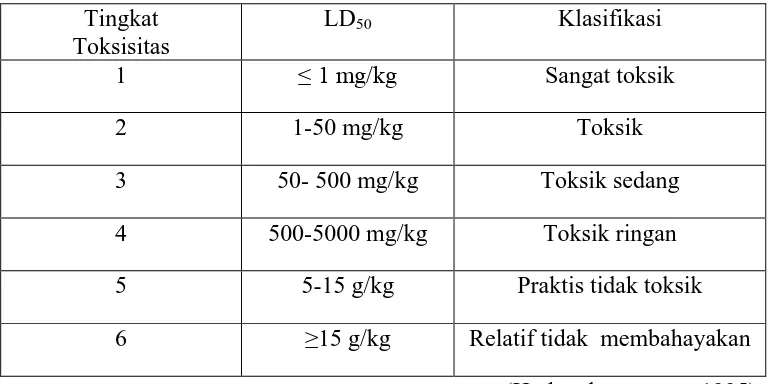
Pada umumnya, semakin kecil nilai LD50, semakin toksik senyawa tersebut. Demikian juga sebaliknya, semakin besar nilai LD50, semakin rendah toksisitasnya (Sulastry, 2009). Nilai LD50 sangat berguna untuk mengklasifikasikan zat kimia sesuai dengan toksisitas relatifnya yang dapat dilihat pada tabel berikut:
Tabel 2.1 Klasifikasi zat kimia sesuai dengan toksisitas relatifnya. Tingkat
Toksisitas
LD50 Klasifikasi
1 ≤ 1 mg/kg Sangat toksik
2 1-50 mg/kg Toksik
3 50- 500 mg/kg Toksik sedang
4 500-5000 mg/kg Toksik ringan
5 5-15 g/kg Praktis tidak toksik
Metode Penentuan LD50
Penentuan LD50 merupakan tahap awal untuk mengetahui keamanan bahan yang akan digunakan manusia dengan menentukan besarnya dosis yang menyebabkan kematian 50% pada hewan uji setelah pemberian dosis tunggal (Lu, 1994).
a. Metode Aritmatik Reed dan Muench
Metode ini menggunakan nilai-nilai kumulatif. Asumsi yang dipakai adalah bahwa seekor hewan yang mati oleh dosis tertentu akan mati juga oleh dosis yang lebih besar, sedangkan hewan bertahan hidup pada dosis tertentu juga akan tetap bertahan hidup pada dosis yang lebih rendah. Kematian kumulatif diperoleh dengan menambahkan secara suksesif kebawah dan hidup kumulatif diperoleh dengan menambahkan secara suksesif keatas persen hidup dari dosis-dosis yang berdekatan dengan LD50dihitung (Rasyid, 2012).
Penentuan LD50 didapatkan berdasarkan persamaan berikut:
�.� = ��− % ������������LD50
% �����������LD50− % ������������LD50,�=
dosisdiatasLD50 dosisdibawahLD50 Adapun: P.D (ProportionalDistance) = jarak proporsional
P = proporsionasi peningkatan dosis.
b. Perhitungan Nilai LD50 Berdasarkan Cara Thomson dan Weil
Dalam mencari harga LD50 diperlukan ketepatan atau jika dilihat dari taraf kepercayaan tertentu, harga tersebut hanya sedikit sekali bergeser dari harga sebenarnya, atau berada pada rentang atau interval yang sempit. Untuk mencapai tujuan, digunakan tabel yang dibuat oleh Thompson dan Weil. Pada penggunaan tabel, percobaan harus memenuhi beberapa syarat berikut (Priyanto, 2009):
i. jumlah hewan uji tiap kelompok peringkat dosis sama ii. interval merupakan kelipatan (d) tetap.
iii. jumlah kelompok paling tidak 4 peringkat dosis. Rumus :
Log m = log D + d (f + 1) Dimana :
m = nilai LD50
D = Dosis terkecil yang digunakan d = log dari kelipatan dosis
f = suatu nilai dalam tabel Weil, karena angka kematian tertentu (r)
c. Cara Farmakope Indonesia III (FI III)
Untuk menghitung LD50 berdasarkan FI III, uji harus memenuhi syarat-syarat seperti (Priyanto, 2009):
i. Menggunakan seri dosis atau konsentrasi yang berkelipatan tetap ii. Jumlah hewan percobaan tiap kelompok harus sama
Rumus perhitungan LD50 adalah :
m = a – b (∑ pi – 0,5) m = log LD50
a = logaritma dosis terendah yang masih menyebabkan jumlah kematian 100% tiap kelompok
b = beda log dosis yang berurutan pi = jumlah hewan yang mati
d. Metode Perhitungan Cara Grafik (Graphical Calculation) Miller dan Tainter Metode ini merupakan metoda yang paling umum dipakai dalam penghitungan efektif dosis. Namun dibutuhkan kertas khusus berkoordinat yaitu kertas probit logaritma, dengan absis dalam skala logaritma dan ordinat sebelah kiri dalam skala probit atau ordinat sebelah kanan dibuat dalam skala persen yang setara dengan skala probit (skala ini nonlinier) atau nilai persen dapat dilihat didalam table probit. Kurva sigmoid dapat ditransformasi menjadi garis lurus dengan memplotkan respon kuantal terhadap logaritma dosis. Dalam cara perhitungan ini diperlukan tabel Probit.
Menurut Retnomurti (2008), faktor-faktor yang berpengaruh pada LD50 sangat bervariasi antara jenis yang satu dengan jenis yang lain dan antara individu satu dengan individu yang lain dalam satu jenis. Beberapa faktor tersebut antara lain:
a. Spesies, Strain dan Keragaman Individu
bioaktivasi dan toksikasi suatu zat. Semakin tinggi tingkat keragaman suatu spesies dapat menyebabkan perbedaan nilai LD50. Variasi strain hewan percobaan menunjukkan perbedaan yang nyata dalam pengujian LD50.
b. Perbedaan Jenis Kelamin
Perbedaan jenis kelamin mempengaruhi toksisitas akut yang disebabkan oleh pengaruh langsung dari kelenjar endokrin. Hewan betina mempunyai sistem hormonal yang berbeda dengan hewan jantan sehingga menyebabkan perbedaan kepekaan terhadap suatu toksikan. Hewan jantan dan betina yang sama dari strain dan spesies yang sama biasanya bereaksi terhadap toksikan dengan cara yang sama, tetapi ada perbedaan kuantitatif yang menonjol dalam kerentanan terutama pada tikus.
c. Umur
Hewan-hewan yang lebih muda memiliki kepekaan yang lebih tinggi terhadap obat karena enzim untuk biotransformasi masih kurang dan fungsi ginjal belum sempurna. Perbedaan aktivitas biotransformasi akibat suatu zat menyebabkan perbedaan reaksi dalam metabolisme. Sedangkan pada hewan tua kepekaan individu meningkat karena fungsi biotransformasi dan ekskresi sudah menurun.
d. Berat Badan
e. Cara Pemberian
Lethal dosis dipengaruhi pula oleh cara pemberian. Pemberian obat melalui suatu cara yang berbeda pada spesies yang sama akan memberikan hasil yang berbeda. Pemberian obat peroral tidak langsung didistribusikan ke seluruh tubuh. Pemberian obat atau toksikan peroral didistribusikan ke seluruh tubuh setelah terjadi penyerapan di saluran cerna sehingga mempengaruhi kecepatan metabolisme suatu zat di dalam tubuh.
f. Faktor Lingkungan
Beberapa faktor lingkungan yang mempengaruhi toksisitas akut antara lain temperatur, kelembaban, iklim, perbedaan siang dan malam. Perbedaan temperatur suatu tempat akan mempengaruhi keadaan fisiologis suatu hewan. g. Kesehatan hewan
Status hewan dapat memberikan respon yang berbeda terhadap suatu toksikan. Kesehatan hewan sangat dipengaruhi oleh kondisi hewan dan lingkungan. Hewan yang tidak sehat dapat memberikan nilai LD50 yang berbeda dibandingkan dengan nilai LD50 yang didapatkan dari hewan sehat.
h. Diet
Komposisi makanan hewan percobaan dapat mempengaruhi nilai LD50. Komposisi makanan akan mempengaruhi status kesehatan hewan percobaan. Defisiensi zat makanan tertentu dapat mempengaruhi nilai LD50.
2.4.2 Uji Toksisitas Subkronik
mengungkapkan efek toksik dan jenis organ yang terkena, maupun hubungan antara dosis dan efek toksik. Selain itu, dengan uji toksisitas subkronik, memungkinkan terlihatnya wujud dan sifat efek toksik yang munculnya lambat dan tidak dapat terdeteksi pada uji toksisitas akut (Donatus, 1996).
Prinsip dari uji toksisitas subkronik oral adalah sediaan uji dalam beberapa tingkat dosis diberikan setiap hari pada beberapa kelompok hewan uji dengan satu dosis per kelompok selama 28 atau 90 hari. Selama waktu pemberian sediaan uji, hewan harus diamati setap hari untuk menentukan adanya toksisitas. Hewan yang mati selama periode pemberian sediaan uji segera diotopsi dan organ serta jaringan diamati secara makropatologi dan histopatologi. Pada akhir periode pemberian sediaan uji, semua hewan yang masih hidup diotopsi selanjutnya dilakukan pengamatan secara makropatologi dan histopatologi pada setap organ dan jaringan (OECD, 2001).
Tujuan uji toksisitas subkronik oral adalah untuk memperoleh informasi adanya efek toksik zat yang tidak terdeteksi pada uji toksisitas akut, memperoleh informasi kemungkinan adanya efek toksik setelah pemaparan sediaan uji secara berulang dalam jangka waktu tertentu, memperoleh informasi dosis yang tidak menimbulkan efek toksik dan mempelajari adanya efek kumulatif dan reversibilitas atau irreversibiltas zat uji (OECD, 2001). Uji toksisitas subkronik bertujuan untuk menentukan organ sasaran (organ yang rentan) (Priyanto, 2009). 2.4.3 Uji Toksisitas Kronik
seringkali memerlukan waktu yang relatif panjang, bahkan mungkin sepanjang masa hidup si pemakai. Uji toksisitas kronik pada prinsipnya sama dengan uji toksisitas subkronik, tetapi sediaan uji diberikan selama tidak kurang dari 12 bulan (OECD, 2001).
Tujuan dari uji toksisitas kronik oral adalah untuk mengetahui profil efek toksik setelah pemberian sediaan uji secara berulang selama waktu yang panjang, memperoleh informasi efek toksik zat uji yang tidak terdeteksi pada uji toksisitas subkronik dan untuk menetapkan tingkat dosis yang tidak menimbulkan efek toksik (OECD, 2001).
2.5 Hati
Hati merupakan organ terbesar pada tubuh, menyumbang sekitar 2 persen berat tubuh total, atau sekitar 1,5 kg pada rata-rata manusia dewasa. Unit fungsional dasar hati adalah lobulus hati, yang berbentuk silindris dengan panjang beberapa milimeter dan berdiameter 0,8 sampai 2 milimeter. Hati manusia mengandung 50.000 sampai 100.000 lobulus (Guyton dan Hall, 2007).
Hati terletak di bawah diafragma kanan, dilindungi bagian bawah tulang iga kanan. Lobus kiri hati berada di dalam epigastrium, tidak dilindungi oleh tulang iga. Hati normal kenyal dengan permukaan yang licin (Chandrasoma dan Taylor, 2005).
a. Fungsi pembentukan dan ekskresi empedu
Hal ini merupakan fungsi utama hati yaitu mengekskresikan sekitar satu liter empedu setiap hari. Garam empedu penting untuk pencernaan dan absorbsi lemak dalam usus halus.
b. Fungsi metabolik
Hati berperan penting dalam metabolisme karbohidrat, lemak, protein, vitamin dan juga memproduksi energi. Hati mengubah ammonia menjadi urea, untuk dikeluarkan melalui ginjal dan usus.
c. Fungsi pertahanan tubuh
Hati mempunyai fungsi detoksifikasi dan perlindungan yang dilakukan oleh enzim-enzim hati untuk melakukan oksidasi, reduksi, hidrolisis, atau konjugasi zat yang kemungkinan membahayakan dan mengubahnya menjadi zat yang secara fisiologis tidak aktif. Fungsi perlindungan dilakukan oleh sel kupffer yang terdapat di dinding sinusoid hati.
Pemeriksaan kerusakan hati dilakukan karena hati merupakan organ yang sangat berperan dalam proses metabolisme sehingga organ ini sering terpapar zat kimia yang akan mengalami detoksifikasi dan inaktivasi sehingga zat kimia tersebut menjadi tidak berbahaya bagi tubuh. Kerusakan hati karena obat dan zat kimia dapat terjadi akibat hilangnya kemampuan regenerasi sel hati, sehingga hati akan mengalami kerusakan permanen yang dapat menimbulkan kematian (Elya et al., 2010).
lamanya paparan zat tersebut. Kerusakan hepar dapat terjadi segera atau setelah beberapa minggu sampai beberapa bulan. Kerusakan dapat berbentuk nekrosis hepatosit, kolestasis, atau timbulnya disfungsi hepar secara perlahan-lahan. Obat-obatan yang menyebabkan kerusakan hepar pada umumnya diklasifikasikan sebagai hepatotoksik yang dapat diduga dan yang tak dapat diduga, tergantung dari mekanisme dengan cara mana mereka menyebabkan kerusakan hepar (Amalina, 2009).
Perubahan struktur hati yang terjadi pada kerusakan hepar dapat berupa (Amalina, 2009) :
1. Inflamasi (hepatitis)
Yaitu peradangan pada hati yang dapat dicetuskan oleh benda asing, organisme atau obat-obatan (akibat langsung toksin).
2. Degenerasi dan penimbunan intraseluler.
Cedera karena toksik dapat menyebabkan pembengkakan dan edema hepatosit. Pada degenerasi hidropik tampak sel-sel yang sitoplasmanya pucat, bengkak dan timbul vakuola-vakuola di dalam sitoplasma, karena penimbunan cairan. Hepatotoksik dan obat juga dapat menyebabkan penimbunan tetesan lipid (steatosis). Hati secara mikroskopis terlihat gambaran vakuola lemak kecil dalam sitoplasma di sekitar inti (mikrovesikular steatosis), yang dapat berlanjut membentuk vakuola besar yang mendesak inti ke tepi sel (makrovesikular steatosis).
kuning, pada keadaan ekstrim, hati dapat seberat tiga sampai enam kg dan berubah menjadi hati yang kuning, lunak, dan berminyak.
3. Nekrosis
Adalah kematian sel atau jaringan pada organisme hidup. Inti menjadi lebih padat (piknotik) yang dapat hancur bersegmen-segmen (karioreksis) dan kemudian sel menjadi eosinofilik. Nekrosis dapat bersifat:
a. Nekrosis fokal, adalah kematian sebuah sel atau kelompok kecil sel dalam satu lobus.
b. Nekrosis zonal, adalah kerusakan sel hepar pada satu lobus. Nekrosis zonal dapat dibedakan menjadi nekrosis sentral, midzonal, dan perifer.
c. Nekrosis masif, yaitu nekrosis yang terjadi pada daerah yang luas.
d. Nekrosis pembentukan jembatan (bridging necrosis), yaitu dengan jejas inflamasi yang lebih berat, nekrosis hepatosit dapat menjangkau lobus yang berdekatan dengan cara porta ke porta, porta ke central, atau central ke central. 4. Fibrosis
Terjadi sebagai respons terhadap radang atau akibat langsung toksin. Fibrosis yang berkepanjangan menyebabkan sirosis. Pada sirosis, morfologi hepar tampak makronoduler, mikronoduler, atau campuran. Bila berlangsung progresif, hepar menjadi berwarna coklat, tidak berlemak, mengecil, terkadang berat hepar kurang dari satu kg.
2.6 Proses Biotransformasi Obat di Hati
Reaksi metabolisme terdiri dari reaksi fase I dan reaksi fase II. Reaksi fase I terdiri dari oksidasi, reduksi, dan hidrolisis, yang mengubah obat menjadi lebih polar, dengan akibat menjadi inaktif, lebih aktif atau kurang aktif. Reaksi fase II merupakan reaksi konyugasi dengan substrat endogen seperti asam glukoronat, asam sulfat, asam asetat, atau asam amino dan akibatnya hampir selalu menjadi tidak aktif. Obat dapat mengalami reaksi fase I saja, atau reaksi fase II saja, atau reaksi fase I diikuti reaksi fase II (Amalina, 2009).
Reaksi metabolisme yang terpenting adalah oksidasi oleh enzim sitokrom P450 (CYP) dalam retikulum endoplasmik (mikrosom) hati. Ada sekitar 50 jenis isoenzim CYP yang aktif pada manusia, tetapi hanya beberapa yang penting untuk metabolisme obat, diantaranya CYP3A4/5, CYP2D6, CYP2C8/9, CYP2C19, CYP1A1/2, dan CYP2E1. CYP450 3A4/5 merupakan enzim sitokrom P450 yang paling banyak (30%) di hepar dan memetabolisme sebagian besar (50%) obat. Isoenzim ini juga terdapat di epitel usus halus dan di ginjal. CYP450 3A4/5 berperan sangat penting dalam metabolisme dan eliminasi lintas pertama berbagai obat, dengan demikian induksi dan inhibisinya membawa dampak yang besar dalam menurunkan atau meningkatkan efek dari banyak obat akibat penurunan atau peningkatan bioavailabilitas dan kadarnya dalam darah (Amalina, 2009).
2.7 Mekanisme Kerusakan Hati Akibat Obat
Kerusakan hati karena zat toksik dipengaruhi oleh beberapa faktor, seperti jenis zat kimia yang terlibat, dosis yang diberikan dan lamanya paparan zat tersebut. Kerusakan hati dapat terjadi segera atau setelah beberapa minggu sampai beberapa bulan. Kerusakan dapat berbentuk nekrosis hepatosit, kolestasis, atau timbulnya disfungsi hati secara perlahan-lahan. Obat-obatan yang menyebabkan kerusakan hati pada umumnya diklasifikasikan sebagai hepatotoksik yang dapat diduga dan yang tak dapat diduga, tergantung dari mekanisme dengan cara mana mereka menyebabkan kerusakan hati (Amalina, 2009).
Kerusakan hati oleh obat yang dapat diduga, menyebabkan reaksi hati yang berulang-ulang. Kriterianya adalah setiap individu mengalami kerusakan hati bila diberikan dalam dosis tertentu, beratnya kerusakan hati bergantung dosis, kerusakan biasanya dapat diadakan pada hewan percobaan, lesi hepatik yang terjadi biasanya jelas, mempunyai interval waktu yang singkat antara pencernaan obat dan reaksi melawan. Banyak reaksi obat yang toksik terjadi karena konversi oleh hati terhadap obat menjadi metabolit berupa kimia reaktif yang konvalen yang mengikat protein nukleofilik pada hepatosit hingga terjadi nekrosis. Reaksi oksidasi sitokrom P450 juga menghasilkan metabolit dengan rantai bebas yang dapat terikat kovalen ke protein dan ke asam lemak tak jenuh membran sel, sehingga menyebabkan peroksidasi lipid dan kerusakan membran dan akhirnya terjadi kematian hepatosit (Amalina, 2009).
metabolitnya berlaku sebagai hapten untuk membentuk antigen yang sensitif. Beberapa tandanya adalah insidens yang sangat rendah (lebih kecil dari 1%) pada individu yang menggunakan obat, kerusakan tidak tergantung dari dosis, berminggu-minggu sampai berbulan-bulan berlalu antara pencernaan obat dan reaksi melawan. Lesi ini tidak dapat dibuat pada binatang percobaan sehingga lesi ini sering tidak dapat diketahui pada penelitian toksikologi dan percobaan klinik awal (Amalina, 2009).
2.8 Hewan Percobaan
Mencit (Mus musculus) merupakan salah satu hewan percobaan yang sering digunakan dalam penelitian. Hewan ini dinilai cukup efisien dan ekonomis karena mudah dipelihara, tidak memerlukan tempat yang luas, lama hamil yang singkat dan banyak memiliki anak perkelahiran. Mencit mempunyai sifat-sifat produksi dan reproduksi yang mirip dengan mamalia besar serta memiliki siklus estrus yang pendek. Hewan pengerat merupakan jenis hewan yang paling banyak digunakan pada sebagian besar uji toksisitas (Retnomurti, 2008). Mencit dan tikus putih memiliki banyak data toksikologi, sehingga mempermudah membandingkan toksisitas zat-zat kimia (Lu, 1994).
Sistem taksonomi mencit adalah sebagai berikut (Retnomurti, 2008): Kingdom : Animalia
Jenis : Mus musculus
Mencit memiliki beberapa data biologis, diantaranya (Retnomurti 2008) : Lama hidup : 1-2 tahun
Lama produktif : 9 bulan Lama hamil : 19-21 hari Umur dewasa : 35 hari Umur dikawinkan : 8 minggu