IDENTIFIKASI SPESIES Meloidogyne PADA TANAMAN WORTEL
(Daucus carota L.) DI KAWASAN AGROPOLITAN CIANJUR,
JAWA BARAT
HALIMAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi Spesies Meloidogyne pada Tanaman Wortel (Daucus carota L.) di Kawasan Agropolitan Cianjur, Jawa Barat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Halimah
RINGKASAN
HALIMAH. Identifikasi Spesies Meloidogyne pada Tanaman Wortel (Daucus carota L.) di Kawasan Agropolitan Cianjur, Jawa Barat. Dibimbing oleh SUPRAMANA dan GEDE SUASTIKA
Nematoda puru akar (NPA), Meloidogyne spp. telah dilaporkan menjadi penyebab umbi bercabang pada wortel di beberapa sentra produksi sayuran di Jawa Tengah dan Jawa Timur. Penyakit ini menyebabkan penurunan kualitas dan kuantitas umbi sehingga menyebabkan kerugian yang tidak sedikit bagi petani. Penelitian ini bertujuan untuk mengidentifikasi spesies Meloidogyne (NPA) yang berasosiasi dengan penyakit umbi bercabang pada wortel dan untuk mengetahui tingkat kekerabatan spesies NPA yang menginfeksi pertanaman wortel di Cianjur, Jawa Barat dengan spesies Meloidogyne yang sudah dilaporkan sebelumnya menggunakan data sekuen yang ada di Genbank.
Sampel wortel dikoleksi dari pertanaman wortel Agropolitan Cianjur, Jawa Barat kemudian dilakukan pengidentifikasian di Laboratorium Nematologi Tumbuhan dan Laboratorium Virologi Tumbuhan Fakultas Pertanian, Institut Pertanian Bogor. Identifikasi NPA dilakukan berdasarkan pengamatan ciri morfologi nematoda betina dewasa dan amplifikasi DNA dengan primer spesifik.
DNA nematoda diekstraksi dari nematoda betina dan diamplifikasi melalui
polymerase chain reaction (PCR) menggunakan primer spesifik spesies (Rjav/ Fjav untuk M. javanica, Rar/ Far untuk M. arenaria dan Rinc/ Finc untuk M. incognita) dan multipleks (M. hapla, M. chitwoodi dan M. fallax). Sekuensing nukleotida dilakukan terhadap DNA hasil PCR tanpa melalui proses kloning.
Pengamatan di lapangan menunjukkan terdapat tiga tipe gejala umbi akibat infeksi NPA diantaranya umbi bercabang, umbi pendek membulat dan umbi pecah. Di samping itu, letak puru pada akar wortel juga dapat dibedakan menjadi tiga yaitu puru menempel pada permukaan umbi wortel, puru bulat membesar dan akar rambut (hairy root). Hasil identifikasi pola sidik pantat NPA (perineal pattern) ada empat spesies Meloidogyne yang ditemukan menginfeksi pertanaman wortel di lokasi pengambilan sampel yaitu M. arenaria, M. incognita, M. javanica
dan M. hapla.
Hasil analisis pohon filogenetik memperlihatkan bahwa M. javanica asal Cianjur, Jawa Barat berkerabat sangat dekat dengan M. javanica isolat asal Cina dengan tingkat homologi mencapai 91.9%. Nematoda M. hapla asal Cianjur, Jawa Barat mempunyai sekuen nukleotida yang relatif tidak berbeda dibanding dengan isolat-isolat dari negara lain.
SUMMARY
HALIMAH. Species Identification of Meloidogyne on Carrot in Cianjur, West Java. Supervised by SUPRAMANA and GEDE SUASTIKA.
Root knot nematodes (RKN), Meloidogyne spp., has been reported as the cause of carrot branched tuber on several vegetable production centers in Central and East Java. The disease caused the reduction of the quantity and quality of the tubers and lead to significant yield losses.
This research aimed to identify species of Meloidogyne that associate with carrot branched tuber diseases and determined relationship of RKN species in Cianjur, West Java with Meloidogyne species in Genbank.
Samples were collected from Agropolitan Cianjur, West Java then identified at Laboratory of Plant Nematology and Plant Virology, Faculty of Agriculture, Bogor Agriculture University. RKN identification was done by observing morphological characters of female nematode and by DNA amplification using specific primers.
DNA was extracted from female nematodes and amplified through PCR using species specific primers (Fjav/ Rjav for M. javanica, Far/ Rar for M. arenaria and Finc/ Rinc for M. incognita) and multiplex primer (M. hapla, M. chitwoodi and M. fallax). Nucleotides of PCR results were sequenced without cloning process.
Field observation showed that there were three types of tuber symptoms caused by RKN infection, that were branched tubers, short bulb and break tubers. In addition, location of galls on root of carrot also divided into three types, i.e. attached on tuber surface, enlarged bulb gall and hairy roots. Based on perineal pattern, four Meloidogyne spesies were identified namely M. arenaria, M. hapla, M. incognita, and M. javanica.
Phylogenetic analysis showed that M. javanica from Cianjur, West Java related closely to China isolate with the homology level of 91.9%. Whereas M. hapla from Cianjur, West Java had nucleotide sequence which was relatively not different from isolates of other countries.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
IDENTIFIKASI SPESIES Meloidogyne PADA TANAMAN
WORTEL (Daucus carota L.) DI KAWASAN AGROPOLITAN
CIANJUR, JAWA BARAT
HALIMAH
Tesis
sebagai salah syarat untuk dapat memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
12
Judul Tesis : Identifikasi Spesies Meloidogyne Pada Tanaman Wortel (Daucus carota L.) di Kawasan Agropolitan Cianjur, Jawa Barat
Nama : Halimah
NRP : A352100021
Disetujui oleh
Komisi Pembimbing
Dr Ir Supramana MSi Dr Ir Gede Suastika MSc
Ketua Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi Dekan Sekolah Pascasarjana
Dr Ir Sri Hendrastuti Hidayat MSc Dr Ir Dahrul Syah MScAgr
14
PRAKATA
Bismillahirrohmanirrohim,
Puji syukur kehadirat Allah SWT berkat rahmat dan hidayah-Nya sehingga
penulis dapat menyelesaikan tesis dengan judul “Identifikasi Spesies Meloidogyne pada Tanaman Wortel (Daucus carota L.) di Kawasan Agropolitan Cianjur, Jawa Barat”. Tesis disusun sebagai salah satu syarat untuk dapat memperoleh gelar Magister Sains pada Program Studi Fitopatologi Sekolah Pascasarjana IPB.
Dalam penyelesaian tesis penulis banyak mendapat bantuan dari berbagai pihak. Penulis mengucapkan terima kasih kepada:
1. Dr Ir Supramana MSi selaku ketua komisi pembimbing. 2. Dr Ir Gede Suastika MSc selaku komisi pembimbing.
3. Dr Ir Abdul Muin Adnan MSi selaku ketua Lab. Nematologi Tumbuhan. 4. Dr Ir Hendrastuti Hidayat MSc selaku ketua Lab. Virologi Tumbuhan. 5. Gatut Heru Bromo selaku laboran di Lab. Nematologi Tumbuhan. 6. Mbak Tuti selaku laboran di Lab. Virologi Tumbuhan.
7. Rekan-rekan Fitopatologi 2010.
8. Rekan-rekan di Lab. Nematologi Tumbuhan.
9. Dan rekan-rekan yang tidak disebutkan terima kasih atas persahabatan dan kerja samanya.
Terakhir, penulis menyampaikan terima kasih kepada ibunda Aisyah Harahap, ayahanda Djarkasih Siregar (alm), kakanda Rosnani Siregar, Muhammad Arsyad Nasution dan keluarga penulis atas doa, kasih sayang dan dukungannyakepada penulis untuk menjadi manusia yang berpendidikan.
Semoga hasil penelitian ini bermanfaat bagi pengembangan ilmu pengetahuan di masa yang akan datang.
Bogor, 30 September 2013
DAFTAR ISI
DAFTAR TABEL
DAFTAR GAMBAR
PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Hipotesis 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA
Wortel 3
Nematoda Puru Akar 4
Klasifikasi Nematoda Puru Akar 4
Biologi NPA 4
Gejala Penyakit 7
Identifikasi Morfologi Spesies Meloidogyne 8
Identifikasi Sekuen Nukleotida Spesies Meloidogyne 9
Amplifikasi DNA dengan PCR 9
Perunutan DNA 10
BAHAN DAN METODE
Tampat dan Waktu Penelitian 11
Metode Penelitian 11
Pengamatan Gejala Penyakit Tanaman 11
Identifikasi Meloidogyne spp. Berdasarkan Morfologi 12 Identifikasi Meloidogyne spp. Berdasarkan Sekuen Nukleotida 13 HASIL DAN PEMBAHASAN
Survei dan Gejala Penyakit Nematoda Puru Akar 16
Tipe Gejala NPA pada Umbi Wortel 17
Spesies Meloidogyne Berdasarkan Morfologi 18
Spesies Meloidogyne Berdasarkan PCR dan Sekuen Nukleotida 19 SIMPULAN
DAFTAR PUSTAKA
LAMPIRAN
16
DAFTAR TABEL
1 Primer yang digunakan untuk identifikasi spesies Meloidogyne
asal Cianjur, Jawa Barat ... 14
2 Amplifikasi fragment ITS-rDNA spesies Meloidogyne
menggunakan PCR ... 15
3 Prevalensi distribusi NPA berdasarkan ketinggian tempat Cianjur,
Jawa Barat ... 19
4 Homologi sekuen nukleotida DNA M. javanica Cianjur, Jawa
Barat dengan sekuen DNA yang ada di GenBank ... 20 5 Homologi sekuen nukleotida DNA M. hapla Cianjur, Jawa Barat
DAFTAR GAMBAR
1 Diagram siklus hidup Meloidogyne spp. ... 5
2 Sel transfer makanan Meloidogyne ... 6
3 Gejala penyakit nematoda puru akar ... 7
4 Morfologi pola sidik pantat (perineal pattern) Meloidogyne betina... 8
5 Prosedur pembuatan preparat sidik pantat Meloidogyne ... 13
6 Gejala penyakit NPA pada pertanaman wortel di Cianjur, Jawa Barat ... 16
7 Gejala umbi wortel yang terinfeksi NPA ... 17
8 Letak puru pada perakaran wortel ... 18
9 Hasil identifikasi pola sidik pantat NPA ... 19
10 Hasil amplifikasi DNA Meloidogyne isolat Cianjur, Jawa Barat menggunakan primer spesifik ... 20
11 Pohon filogenik spesies M. javanica yang menginfeksi pertanaman wortel di Cianjur, Jawa Barat ... 20
1
PENDAHULUAN
Latar Belakang
Wortel merupakan tanaman sayuran berumbi yang banyak dikembangkan di Indonesia terutama untuk memenuhi kebutuhan pangan sayur. Namun demikian, dengan berkembangnya teknologi pangan serta semakin pesatnya kemajuan bidang kesehatan, kini wortel dimanfaatkan sebagai bahan minuman, pewarna makanan dan sebagai ramuan obat tradisional. Sejalan dengan peningkatan kebutuhan wortel di Indonesia, pemerintah terus berupaya meningkatkan produksi wortel dalam negeri. Menurut catatan Badan Pusat Statistik produksi wortel di Indonesia dari tahun 2009 hingga 2011 meningkat. Pada tahun 2009 produksi wortel tercatat 358 014 ton dengan luas 24 095 ha, tahun 2010 dan 2011 meningkat menjadi 403 827 ton dengan luas 27 149 ha dan 526 917 ton dengan luas 33 228 ha (BPS 2012).
Budidaya tanaman wortel di Indonesia memiliki berbagai kendala yang berkaitan dengan produktivitas dan kualitas hasil panen. Selama periode antara 2009 dan 2011 terjadi penurunan produktivitas di beberapa sentra produksi wortel di Indonesia seperti Jawa Barat, Sumatera Utara dan Sulawesi Utara yaitu masing-masing dari 19.39 ton/ ha menjadi 17.19 ton/ ha, 21.20 ton/ ha menjadi 18.72 ton/ ha dan 12.63 ton/ ha menjadi 6.24 ton/ ha (BPS 2012).
Beberapa penyakit pada tanaman wortel yang telah dilaporkan adalah penyakit Aster yellow (fitoplasma dan spiroplasma) (Gera et al. 2011; Roger et al. 2011), penyakit hawar daun (Cercospora carotae, Alternaria dauci), busuk sklerotinia (Sclerotinia), busuk mahkota (Rhizoctonia carotae), bercak berongga pada wortel (Phytium violae) (David dan Raid 2002), Crown gall (Agrobacterium tumefaciens), Carrot virus Y (CarVY) (Latham et al. 2004) dan puru akar (Meloidogyne spp.) (McDonald et al. 2008).
Penyakit puru akar merupakan salah satu penyakit yang disebabkan oleh nematoda puru akar (NPA). NPA banyak merusak tanaman pertanian di Indonesia (Mustika 2010) dan juga negara lain terutama tanaman wortel (Anwar dan McKenry 2010). Selain itu, NPA juga dapat berinteraksi dengan patogen tanaman lainnya yang mengakibatkan kerusakan semakin meningkat (Widmer et al. 1999).
Meloidogyne spp. merupakan penyebab penyakit umbi bercabang pada wortel. Kehilangan hasil akibat infeksi NPA dilaporkan sebesar 15% hingga 95% (Kurniawan 2010). Di negara lain misalnya Amerika Serikat (Gugino et al. 2006), Eropa (Wesemael et al. 2011), Brazil (Charchar et al. 2009) dan Turki (Devran dan Sogut 2009) NPA juga merupakan patogen penting dalam budidaya wortel.
Ada empat spesies Meloidogyne (M. arenaria, M. javanica, M. incognita
dan M. hapla) penyebab umbi bercabang pada wortel dilaporkan telah menginfestasi sentra pertanaman wortel di Indonesia, diantaranya Jawa Tengah (Dieng, Wonosobo, Banjarnegara, Semarang dan Magelang) (Taher et al. 2012; Pradika 2012) dan Jawa Timur (Kota Batu) (Hikmia et al. 2012).
2
(internal transcribed spacer) ITS rRNA sebagai dasar untuk mengarakterisasi dan mengidentifikasi patogen tanaman.
ITS adalah suatu urutan RNA dari proses transkripsi utama yang berada antar prekusor ribosomal subunit. Organisme eukaryotik mempunyai dua daerah ITS; ITS 1 terletak di antara gen 18S dan gen 5.8S, dan ITS 2 terletak di antara gen 5.8S dan 28S. Daerah ITS biasanya mengalami perubahan atau mutasi sehingga dapat berbeda atau bervariasi di antara spesies (Mulyatni et al. 2011). Analisis filogenetik DNA atau sekuen nukleotida menjadi salah satu pilihan penting untuk mempelajari sejarah evolusi organisme. Analisis filogenetik juga penting untuk mengklasifikasi organisme dan mempelajari hubungan kekerabatannya pada tingkat molekuler (Nei dan Kumar 2000).
Tujuan Penelitian
1. Mengidentifikasi spesies Meloidogyne yang berasosiasi dengan penyakit umbi bercabang pada wortel.
2. Mengetahui tingkat kekerabatan spesies Meloidogyne yang menginfeksi tanaman wortel di Cianjur, Jawa Barat dengan spesies Meloidogyne dari negara lain.
Hipotesis Penelitian
1. Terdapat beberapa spesies Meloidogyne yang berasosiasi dengan penyakit umbi bercabang pada wortel.
2. Variasi sekuen nukleotida pada daerah ITS dari DNA ribosomal dapat digunakan untuk melihat tingkat kekerabatan spesies Meloidogyne.
Manfaat Penelitian
1. Informasi ini dapat digunakan sebagai dasar untuk menentukan strategi pengendalian penyakit yang lebih efektif.
2. Memberikan informasi tentang spesies NPA penyebab penyakit umbi bercabang pada wortel.
3
TINJAUAN PUSTAKA
Wortel
Pada awalnya, wortel merupakan tumbuhan liar tumbuh di Eropa dan Asia yang digunakan sebagai tanaman obat. Sebelum tahun 900, wortel dibudidayakan di Afganistan yang dianggap sebagai pusat keanekaragaman utama, kemudian tahun 1100-an wortel tersebar ke Eropa, Mediterania, dan Asia dimana Turki diakui sebagai pusat keanegaraman kedua (Grubben dan Denton 2004; Stolarczyk dan Janick 2011).
Bangsa Eropa memiliki budaya pekarangan yang dianggap mempunyai nilai magis. Hal ini terus berlangsung dengan masuknya bangsa Eropa ke Indonesia. Kedatangan dan menetapnya mereka di Indonesia sehingga dikembangkan sayuran Eropa di dataran tinggi, seperti kentang, kubis, wortel, dan lain-lain. Daerah pertama yang digunakan untuk budidaya wortel adalah Jawa Barat yaitu Lembang dan Cipanas, selanjutnya menyebar ke daerah sentra sayuran lainnya di Jawa dan luar Jawa. Berdasarkan data BPS (2012) tercatat bahwa luas pertanaman wortel di Indonesia tahun 2011 mencapai 33 228 ha yang tersebar di 24 Provinsi yaitu Jawa Tengah, Jawa Timur, Jawa Barat, Sumatera Utara, Bengkulu, Sumatera Barat, Sulawesi Selatan, Lampung, Jambi, Sumatera Selatan, Sulawesi Utara, Bali, NTB, Aceh, Sulawesi Tengah, NTT, Papua, Banten, Sulawesi Tenggara, Papua Barat dan Maluku (BPS 2012).
Wortel termasuk jenis sayuran semusim berbentuk semak (perdu). Dalam sistematika tumbuh-tumbuhan, klasifikasi tanaman wortel adalah sebagai berikut:
Divisi : Spermatophyta
Subdivisi : Angiospermae
Class : Dicotyledonae
Ordo : Umbelliferales
Famili : Umbelliferae/ Apiaceae (Simon dan Golman 2007).
Genus : Daucus
Species : Daucus carota L.
Wortel merupakan tanaman tropis dan subtropis yang tumbuh di daerah relatif dingin. Suhu optimum untuk memperoleh wortel kualitas tinggi, berkisar antara suhu 16 ºC hingga 21ºC (Hunez et al. 2008). Jika suhu di atas 21oC umbi wortel cenderung pendek dan baunya lebih kuat. Sebaliknya, di bawah suhu 16 oC umbi wortel cenderung lebih panjang dan kecil (David dan Raid 2002).
Penanaman wortel dianjurkan pada tanah yang subur, gembur dan kaya humus dengan pH antara 5.5 hingga 6.5. Namun, wortel sering dibudidayakan pada tanah berpasir (Grubben dan Denton 2004). Menurut Hunez et al. (2008) tipe tanah yang sesuai bagi pertumbuhan wortel adalah lempung berdebu.
Beberapa penyakit yang menginfeksi wortel, yaitu penyakit busuk hitam (Alternaria radicina) (Davis dan Raid 2002), busuk mahkota (Rhizoctonia solani), busuk Fusarium (Fusarium spp.), Penyakit puru akar (Meloidogyne spp.) (Brown 1950), penyakit kudis (Streptomyces scabies), Carrot virus Y, busuk Yeast (Candida sp.), penyakit hairy root (Phytoplasma) dan busuk akar Phytophthora
4
Nematoda yang menyerang tanaman wortel yaitu Meloidogyne spp. (Simon dan Golman 2007), Trichodorus spp., Heterodera carotae dan Longidorus africanus (Hunez et al. 2008).
Nematoda Puru Akar
Klasifikasi Nematoda Puru Akar (NPA)
Spesies Meloidogyne dikenal dengan “root-knot nematode atau nematoda
puru akar”. Kata Meloidogyne berasal dari bahasa Yunani yang artinya betina berbentuk apel (apple-shaped female). Meloidogyne merupakan nematoda endoparasit obligat yang bersifat menetap (sedentary). Nematoda ini adalah endoparasit akar dan patogen penting pada berbagai spesies tanaman di dunia (Dropkin 1991).
Klasifikasi Meloidogyne spp. berdasarkan Decraemer dan Hunt (2006) terdiri atas:
Meloidogyne spp. merupakan nematoda penyebab penyakit tanaman (phytonematodes) paling dikenal di seluruh dunia karena gejala pada bagian akar menonjol dan spesifik yakni menyebabkan puru pada akar tanaman. Hingga saat ini, sekitar 100 spesies Meloidogyne yang telah dideskripsikan (Mitkowski et al.
2002). Enam spesies diantaranya menjadi perhatian utama karena dapat menurunkan produksi tanaman wortel dan merugikan secara ekonomi, yaitu M. incognita, M. javanica, M. arenaria, M. hapla, M. chitwoodi, dan M. fallax
(Adam et al. 2007).
Biologi NPA
Siklus Hidup. Pada dasarnya semua spesies Meloidogyne mempunyai siklus hidup yang sama. Skema siklus hidup Meloidogyne spp. disajikan pada gambar 1.Tahap pertama siklus hidup Meloidogyne dimulai dari telur. Kulit telur terdiri atas tiga lapisan yaitu lapisan vitelin, lapisan kitin, dan lapisan glikolipid (Eisenback dan Hunt 2009). Nematoda betina menghasilkan telur sekitar 500 butir, dikumpulkan dalam massa gelatin terdiri atas glikoprotein yang dihasilkan pada kelenjar rektal. Kelompok telur berada dalam massa gelatin untuk melindungi dari lingkungan yang ekstrim, biasanya terdapat pada permukaan puru atau dalam jaringan puru (Karssen dan Moens 2006; Moens et al. 2009).
5
yang sesuai untuk penetrasi dan masuk ke dalam korteks hingga menemukan
feeding site (Moens et al. 2009). Juvenil kedua (J2) mengalami pergantian kulit menjadi J3, selanjutnya J3 berganti kulit dan berkembang menjadi J4. Pergantian kulit J4 menjadi tahap akhir dewasa yang dapat membedakan antara jantan dan betina. Jantan berbentuk seperti cacing, keluar dari akar dan hidup bebas dalam tanah sedangkan betina terus tumbuh menebal, sedikit memanjang dan berbentuk seperti buah pir (pyriform) (Agrios 2005; Eisenback dan Hunt 2009).
Mekanisme Parasitisme. Nematoda parasit tumbuhan memiliki dua struktur khusus yaitu stilet dan kelenjar sekresi esofagus yang dibutuhkan untuk proses parasitisme. Stilet digunakan untuk menusuk dinding sel tanaman.
Heteroderidae memiliki tiga kelenjar sekresi esofagus. Setiap kelenjar adalah tunggal, sel besar yang dihubungkan pada lumen esofagus nematoda melalui
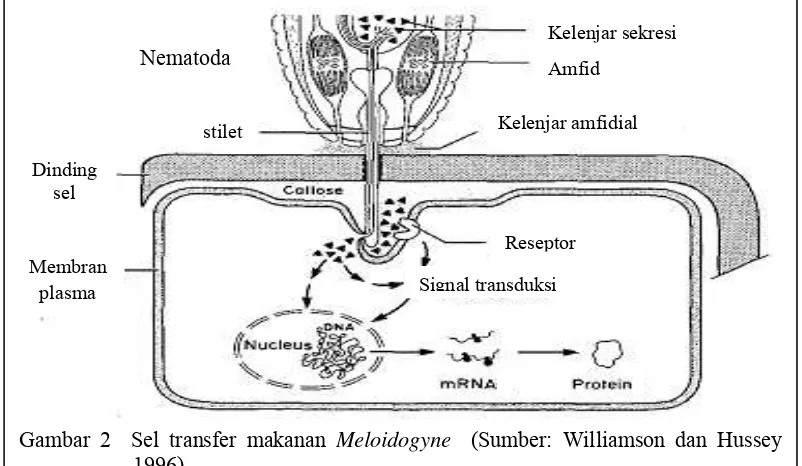
elaborate valve. Sekresi dari kelenjar esofagus dikeluarkan melalui stilet. Sekresi tersebut mengandung biokimia pemicu untuk perkembangan sel raksasa sebagai unsur penting untuk permulaan penetrasi dan berpindah. Selama makan, stilet ditusukkan menembus dinding sel tanpa merusak membran plasma, dimana menjadi invaginasi di sekitar stilet. Nematoda menyerap nutrisi dari sitosol sel terparasit melalui lubang kecil yang dibuat dalam membran plasma pada lubang stilet. Akumulasi (penumpukan) kallosa antara membran plasma dan dinding sel disekitar stilet (Gambar 2). Komposisi sekresi stilet menunjukkan adanya protein dan karbohidrat. Aktivitas enzim, termasuk selulase dan proteinase dapat dideteksi dalam eksudat dari nematoda (Williamson dan Hussey 1996).
Bagian anterior nematoda ditunjukkan dengan tonjolan stilet melalui dinding sel tanaman (Gambar 2). Kelenjar sekresi dimulai dari kelenjar esofagus
6
yang mungkin disimpan diluar membran plasma dan mempengaruhi reseptor membran atau secara langsung diinjeksikan ke dalam sitoplasma terhadap sel penerima melalui lubang kecil dalam membran plasma pada lubang stilet. Sekresi dari amphid, organ kemosensori nematoda, diambil pada permukaan dinding sel dan mungkin memiliki peran dalam interaksi (Williamson dan Hussey 1996).
Juvenil kedua (J2) menginfeksi jaringan tanaman melalui penetrasi dan menembus dinding sel akar melalui kerusakan fisik dikombinasikan dengan dorongan dari stilet dan enzim selulitik dan pektolitik. Saliva dikeluarkan untuk melunakkan isi sel dan bergerak cepat kemudian masuk ke jaringan akar dan bergerak di dalamnya atau menetap pada permukaan sel akar, dimana sel transfer makanan akan melayani nematoda. Setelah penetrasi, infeksi terjadi pada akar yang sama, ujung akar membesar dan pertumbuhan akar sering terhenti untuk periode yang singkat (Agrios 2005; Karssen dan Moens 2006).
NPA menghasilkan sekresi protease yang dapat mengubah protein dalam jaringan tanaman menjadi asam amino. Salah satu asam amino yang dihasilkan yaitu triptofan, diduga bertindak sebagai perangsang terjadinya auksin (IAA). Zat tumbuh merangsang terjadinya hipertrofi (pertambahan besar sel yang tidak normal) dan hiperplasia (pertambahan banyak sel yang tidak normal). Hal tersebut mengakibatkan terjadinya gall atau puru pada akar (Mulyadi 2009).
7
Tekstur dan struktur tanah berkaitan langsung dengan kapasitas kandungan air dan aerasi terhadap kehidupan nematoda, penetasan dan kerusakan tanaman. Tipe tanah dan pH tanah juga mempunyai pengaruh terhadap distribusi nematoda, munculnya populasi dan tingkat kerusakan tanaman. Prot dan Gundy (1981) menyatakan bahwa migrasi nematoda berkurang dengan meningkatnya kandungan lempung di dalam tanah dan migrasi terhenti apabila tanah mengandung lempung lebih dari 30%.
Gejala Penyakit
Meloidogyne spp. adalah salah satu nematoda parasit pada tanaman wortel (Agrios 2005). Nematoda ini memiliki kisaran inang yang sangat beragam, lebih dari 2000 spesies tanaman dan sebagian besar adalah tanaman budidaya (Opperman et al. 2008). Tanaman wortel yang terinfeksi menunjukkan gejala kerdil dan rumpun jarang (Taher et al. 2012). Gejala infeksi NPA pada umbi wortel antara lain malformasi bentuk umbi (Sikora dan Fernandez 2005) dan puru akar (Gambar 3). Gejala pada bagian tajuk tanaman terkonsentrasi pada titik-titik tertentu di lahan pertanaman dan mengelompok.
Di Jawa Timur gejala yang ditemukan pada umbi yang terinfeksi NPA antara lain umbi bercabang, umbi berambut, umbi bercabang berambut (Hikmia et al. 2012) dan di Jawa Tengah ditemukan umbi bercabang, umbi pendek membulat, umbi pecah, dan umbi berambut (Taher et al. 2012). Santo et al.
(1988) melaporkan bahwa M. hapla dan M. chitwoodi menyebabkan umbi pendek, hairy root dan umbi bercabang.
Tanaman terinfeksi NPA memiliki gejala khas berupa hipertropi dan hiperplasi yaitu pembengkakan jaringan akar yang disebut puru. Puru terjadi karena adanya perbesaran dan pembelahan sel yang berlebihan pada jaringan perisikel dan perubahan bentuk pada jaringan pengangkut. Timbulnya puru pada sistem perakaran merupakan gejala awal asosiasi nematoda dengan akar tersebut. Puru disebabkan oleh nematoda betina. Tanaman yang telah terinfeksi berat menyebabkan sistem perakaran mengalami disfungsi secara total, pertumbuhan
8
akar hampir tidak terjadi, fungsi perakaran terhambat dalam menyerap dan penyaluran air maupun unsur hara ke seluruh bagian tanaman (Mulyadi 2009).
Ukuran dan bentuk puru tergantung pada spesies NPA, jumlah nematoda dalam jaringan tanaman, jenis inang, dan umur tanaman. Gejala yang disebabkan
M. hapla berbeda dengan yang disebabkan oleh kebanyakan spesies NPA lainnya yaitu puru kecil, cabang akar banyak terbentuk yang berasal dari jaringan puru menyebabkan terjadinya suatu sistem akar yang disebut akar rambut (hairy root) (Netscher dan Sikora 1995).
Meloidogyne sebagai agen peluka jaringan akar tanaman, berpindah secara interseluler antar sel kortikal hingga menemukan jaringan vaskular dan membentuk daerah makan (feeding site). Luka tersebut dapat berinteraksi antara patogen dan nematoda dan sebagai fasilitas masuknya patogen ke dalam jaringan akar. Misalnya bakteri, beberapa bakteri patogen tumbuhan masuk ke dalam jaringan tanaman inang melalui lubang alami atau luka. Nematoda menembus dan memecah sel jaringan inang sehingga menyediakan jaringan nekrotik bagi perkembangan bakteri kemudian menyerang jaringan sehat. Penyakit layu oleh
Pseudomonas solanacearum pada inang yang beragam menunjukkan peningkatan pada kejadian penyakit sebagai hasil luka infeksi nematoda (Abawi dan Chen 1998). Selain itu, luka juga memberi kemudahan interaksi antara nematoda dan cendawan, terutama antara Meloidogyne dan Fusarium (Karssen dan Moens 2006).
Identifikasi Morfologi Spesies Meloidogyne
Identifikasi Meloidogyne berdasarkan ciri morfologi nematoda betina merupakan metode standar pengidentifikasian dan sering digunakan. Penciri diagnostik yang banyak digunakan untuk mengidentifikasi Meloidogyne antara lain: bentuk tubuh, daerah bibir, panjang stilet, bentuk cone stilet, basal knob dan pola sidik pantat (Hunt dan Handoo 2009).
Pengamatan pola sidik pantat (perineal pattern) merupakan salah satu teknik identifikasi nematoda yang diperkenalkan oleh Eisenback et al. (1981). Puru pada akar yang mengandung NPA betina dipilih dan direndam dalam air
Gambar 4 Morfologi pola sidik pantat (perineal pattern) Meloidogyne betina (Sumber: Eisenback et al. 1981)
Lengkung dorsal
9
hingga menjadi lunak (±48 jam) kemudian dibedah. Nematoda betina yang diperoleh dipotong dan diambil bagian posteriornya. Daerah ini terdiri atas vulva, anus, ujung ekor, fasmid, garis lateral, striae di sekitar kutikula (Hunt dan Handoo 2009). Bagian perineal (daerah di sekeliling vulva dan anus) nematoda betina menunjukkan pola ridges dan anulasi untuk tiap-tiap spesies (Gambar 4) (Eisenback et al. 1981; Mitkowski et al. 2002).
Identifikasi Sekuen Nukleotida Spesies Meloidogyne
Metode identifikasi berdasarkan karakter morfologi memerlukan banyak keterampilan dan sering tidak meyakinkan untuk penciri suatu spesies karena mempunyai variasi bentuk dan ukuran dalam suatu populasi. Identifikasi NPA melalui polymerase chain reaction (PCR) merupakan alternatif deteksi untuk spesies Meloidogyne (Zijlstra et al. 2000). Analisis DNA telah banyak digunakan dalam sistematika dan identifikasi nematoda (Qiu et al. 2006). Identifikasi melaui PCR relatif lebih cepat dibanding dengan identifikasi morfologi.
Metode identifikasi membutuhkan kesensitifan dalam mendeteksi spesies
Meloidogyne. Beberapa teknik molekuler dapat digunakan untuk mengidentifikasi NPA, seperti random amplified polymorphic DNA (RAPD)-PCR, restriction fragment length polymorphisms (RFLPs) terhadap mtDNA dari NPA, dan perbedaan sekuen DNA ribosomal (rDNA) satelit (Zijlstra 1997). PCR memiliki sensitivitas yang tinggi untuk amplifikasi dan identifikasi DNA (Power dan Harris 1993).
DNA ribosomal mengkode RNA ribosomal. Ribosom adalah makromolekul intraseluler yang menghasilkan protein atau rantai polipeptida. DNA ribosomal merupakan bagian genom paling informatif dan bagian yang sering digunakan
untuk studi filogenik. Setiap unit rDNA mengkode gen dengan urutan 5’-18S, 5.8S, 28S-3’. Daerah antara 18S dan 5.8S terdapat ratusan pasang basa yang disebut internal transcribed spacer 1 (ITS 1), diantara 5.8S dan 28S adalah ITS2 (Blok & Powers 2009).
Primer multipleks yang digunakan disusun dari intergenic spacer (IGS) M. chitwoodi, M. fallax dan M. hapla daerah 24 dan 25 ribosom. Primer spesifik didesain dari primer umum yang terletak pada gen 5S yang berlokasi di IGS 2 untuk membedakan spesies M. fallax dan M. chitwoodi. Ketiga primer multipleks dirancang di IGS 2 dari M. hapla untuk menghasilkan suatu produk komplementer yang sesuai dengan ukuran yang dihasilkan oleh M. fallax dan M. chitwoodi (Wishart et al. 2002).
Amplifikasi DNA dengan PCR
PCR merupakan suatu metode enzimatis yang melipatgandakan sekuen nukleotida secara in vitro, sehingga DNA dalam jumlah kecil dapat diamplifikasi (Higgs dan Attwood 2005). Proses PCR terdiri atas tiga tahap pengulangan, pertama yaitu pemisahan untaian DNA (denaturation) dengan inkubasi pada suhu tinggi (sekitar 95 oC). Kedua penempelan primer (annealing) pada suhu antara 50
o
10
Metode identifikasi DNA berdasarkan PCR sudah pernah dilakukan oleh Cenis (1993) melalui random amplified polymorphic DNA (RAPD) dari larva nematoda. Pada percobaan tersebut berhasil diamplifikasi pita spesies diagnostik dengan beberapa pita minor. Karajeh et al. (2010) berhasil mengidentifikasi
Meloidogyne incognita, M. javanica dan M. arenaria menggunakan sequence characterized amplified region PCR (SCAR-PCR) dan RAPD-PCR terhadap DNA yang diekstraksi dari telur dan betina nematoda. Sekora et al. (2010) juga telah berhasil mengidentifikasi spesies Meloidogyne dengan analisis fatty acid methyl ester (FAME). Kunci identifikasi molekuler spesies Meloidogyne dengan ukuran pita DNA hasil PCR telah berhasil disusun oleh Adam et al. (2007) menggunakan pasangan primer tertentu.
Teknik PCR-ITS rDNA berdasarkan sistem kerja yang dimilikinya memisahkan spesies dengan mengamplifikasi gen DNA ribosom. Pengamplifikasian bagian tertentu dari genom nematoda merupakan langkah yang efektif untuk melihat karakterisasi dan identifikasi nematoda (Powers dan Haris 1993).
Pengujian dengan teknik PCR memerlukan dua primer oligonukleotida spesifik yang akan menginisiasi pembentukan dan perbanyakan asam nukleat atau untaian DNA dengan bantuan enzim Taq polymerase dalam mesin PCR atau
thermocycler (Saiki 1990). Pemilihan primer yang tepat sangat menentukan keberhasilan identifikasi suatu patogen. Dalam bidang fitopatologi, teknik PCR banyak digunakan untuk tujuan deteksi patogen, identifikasi patogen, karakterisasi keanekaragaman patogen, maupun untuk diferensiasi patogen tumbuhan.
Publikasi tentang marker molekuler spesifik spesies Meloidogyne tersedia untuk spesies daerah dingin, seperti M. chitwoodi, M. fallax, dan M. hapla. Demikian juga untuk spesies Meloidogyne yang terdapat di daerah bersuhu hangat atau tropis seperti M. arenaria, M. incognita, dan M. javanica yang banyak menyebabkan kerusakan pertanian, sudah tersedia primer spesifik (Dong et al.
2001).
Beberapa primer yang umum digunakan untuk mengidentifikasi
Meloidogyne spp. adalah primer C2F3 untuk mengidentifikasi gen cytochrome oxidase subunit II (COII) dan 1108 untuk mengidentifikasi M. incognita (Powers dan Harris 1993), primer spesifik 5367 dan 5368 untuk mengidentifikasi M. hapla, M. chitwoodi dan M. fallax (Zijlstra 1997), primer spesifik Finc/ Rinc untuk spesies M. incognita, primer Fjav/ Rjav untuk M. javanica, Far/ Rar untuk
M. arenaria (Karajeh et al. 2010), dan Mi2F4/ Mi2R1 untuk M. incognita
(Kiewnick et al. 2011).
Perunutan DNA
Pada umumnya, analisis genom nematoda merupakan informasi bagian ITS dari rDNA. Bagian ini merupakan daerah sangat variabel sehingga dapat berfungsi sebagai penanda spesifik dalam studi taksonomi molekuler (Thiery dan Mugniery 1996).
11
sekuen yang besar mampu mengubah organisme menjadi spesies yang terpisah (Dharmayanti 2011).
Pemisahan sekuen (taksa) didefenisikan sebagai jarak filogenetik tertentu pada sebuah pohon. Pohon terdiri atas cabang pohon yang menunjukkan hubungan antartaksa. Ketika sekuen nukleotida atau protein dari dua organisme yang berbeda mempunyai kemiripan, maka diduga kedua organisme tersebut mempunyai tetua yang sama (common anchestor) (Dharmayanti 2011).
12
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Sampel berupa tanaman wortel bergejala umbi bercabang dikoleksi dari Agropolitan Cianjur, Jawa Barat. Daerah ini memiliki ketinggian 1300 m dpl, 1500 m dpl dan 1600 m dpl dan merupakan salah satu sentra produksi wortel di Jawa Barat. Identifikasi nematoda dilakukan di Laboratorium Nematologi Tumbuhan dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari bulan Mei 2012 hingga April 2013.
Metode Penelitian
Pengamatan Gejala Penyakit Tanaman Wortel
Pemilihan lahan dan pendataan. Lahan yang digunakan untuk pengambilan sampel wortel adalah sentra produksi wortel di Jawa Barat yaitu Agropolitan Cipanas mempunyai ketinggian antara 1300 m dpl dan 1600 m dpl. Pada saat pengambilan sampel dilakukan pendataan untuk mendapatkan informasi tentang lokasi kebun, luas kebun, ketinggian tempat, jenis tanah, varietas wortel yang ditanam dan teknik budidaya.
Pengambilan sampel. Sampel yang diambil berupa umbi wortel bercabang dan berpuru. Sampel umbi yang bergejala diusahakan dalam keadaan lembab dan disimpan dalam kantung plastik secara terpisah, kemudian dimasukkan ke dalam kantung plastik atau kertas yang dilapisi parafilm untuk menghindari sampel kering dan diberi label yang berisi keterangan tentang lokasi, ketinggian dan tanggal pengambilan sampel (Bezooijen 2006). Sampel diletakkan dalam box
untuk mencegah terjadinya kerusakan akibat fluktuasi suhu dan kelembapan selama perjalanan ke Laboratorium Nematologi Tumbuhan.
Pendataan. Pendataan dilakukan untuk memperoleh informasi awal mengenai lokasi kebun, ketinggian tempat, luas kebun, varietas wortel yang ditanam, produksi per hektar, tipe puru, keberadaan wortel bercabang, hairy root, teknik pengolahan tanah, kedalaman pengolahan tanah, jenis tanah, asal irigasi, serta penggunaan pupuk dan nematisida. Hasil pendataan dimaksudkan untuk dapat memberikan informasi tambahan tentang kondisi wilayah serta keberadaan gejala penyakit di lahan pengamatan.
13
Identifikasi Meloidogyne spp. Berdasarkan Morfologi
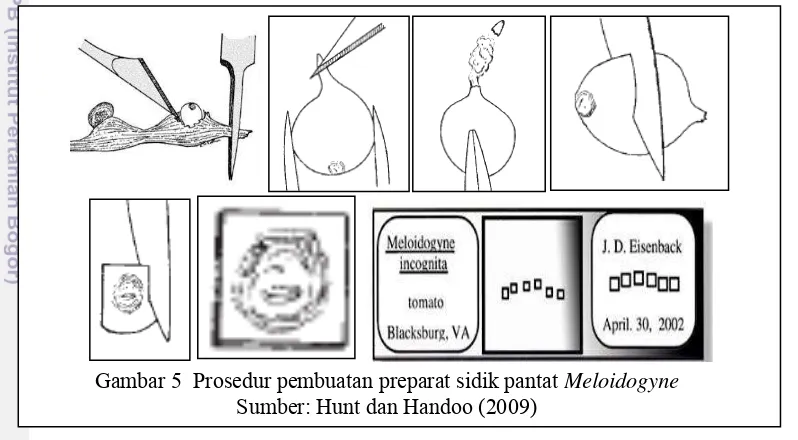
Identifikasi dilakukan dengan pengamatan pola sidik pantat (perineal pattern) nematoda betina dewasa. Pembuatan preparat nematoda betina sebanyak 150 slide menggunakan metode Eisenback et al. (1981). Prosedur pembuatan preparat sidik pantat nematoda betina dijelaskan gambar 5. Akar atau umbi yang terinfeksi Meloidogyne dicuci untuk menghilangkan partikel tanah yang menempel. Nematoda betina yang terdapat di dalam jaringan akar yang berpuru dicungkil dengan hati-hati. Bagian anterior dipotong dengan pisau khusus kemudian bagian posterior ditekan agar kandungan di dalamnya keluar. Potongan dipindahkan dalam laktafenol dingin (0.03% cotton blue). Bagian posterior
disayat dan disisihkan bagian sidik pantatnya kemudian jaringan di dalamnya dibuang secara hati-hati dengan sikat khusus. Sidik pantat kemudian dipindahkan ke gelas objek lain dengan ditetesi laktofenol 0.1% (cotton blue). Gelas objek direkatkan dengan Zut (Glycell) atau kutek kuku. Bagian perineal diamati di bawah mikroskop cahaya dengan perbesaran 400x dan diidentifikasi berdasarkan kunci identifikasi Meloidogyne (Eisenback et al. 1981).
Identifikasi Meloidogyne spp. Berdasarkan Sekuen Nukleotida
Ekstraksi DNA. Puru akar direndam selama 24 jam kemudian puru akar dibedah dengan menggunakan jarum bedah dan diekstraksi menggunakan metode Hikmia et al. (2012) yang telah dimodifikasi. Dua puluh ekor nematoda betina dimasukkan ke dalam tabung mikro. Sampel tersebut ditambah buffer ekstrak (200 mM Tris HCl pH 8.0, 25 mM EDTA pH 8.0 dan 0.5% SDS) sebanyak 150 µl dan digerus hingga halus dengan cornical grinder steril. Selanjutnya, ditambah chloroform : isoamilalkohol (24:1) sebanyak 150 µl dan disentrifugasi dengan kecepatan 11 000 rpm selama 10 menit. Supernatan diambil 100 µl kemudian dimasukkan ke dalam tabung mikro baru, ditambah larutan Sodium Asetat (CH3COONa) 3M pH 5.2 sebanyak 50 µl dibolak-balik kemudian disimpan pada
suhu -20 oC selama 10 menit. Setelah itu suspensi disentrifugasi dengan dengan kecepatan 12 000 rpm selama 20 menit. Supernatan diambil sebanyak 100 µl dan
a b c d
e f
Gambar 5 Prosedur pembuatan preparat sidik pantat Meloidogyne
14
dipindahkan ke dalam tabung mikro baru. Isopropanol ditambah 1 volume ke dalam tabung, dibolak-balik dan disimpan pada suhu ruang selama 30 menit kemudian disentrifugasi dengan kecepatan 12 000 selama 20 menit. Supernatan dibuang dan ditambah ethanol 80% sebanyak 1 volume kemudian disentrifugasi pada kecepatan 12 000 selama 15 menit dan supernatan dibuang. Endapan DNA dikeringkan, ditambah buffer TE pH 8 sebanyak 30 µl hingga 100 µl sesuai dengan ketebalan endapan DNA dan disimpan pada suhu -20 oC hingga digunakan.
Polymerase Chain Reaction. Setiap reaksi PCR yang menggunakan primer
spesifik spesies terdiri dari 12.5 µl 2x Go Taq®Green Master mix (Promega), 1 µl primer Forward 10 µM, 1 µl primer Reverse 10 µM, 1 µl DNA template dan 9.5 µl air bebas nuklease sehingga volume menjadi 25 µl.
Reaksi PCR yang menggunakan primer multipleks spesies terdiri dari 12.5 µl 2x Go Taq®Green Master mix (Promega), 1 µl primer Forward JMV1 10 µM, 1 µl primer Reverse JMV2 10 µM, 1 µl primer Reverse JMV hapla 10 µM, 1 µl DNA template dan 8.5 µl air bebas nuklease sehingga volume menjadi 25 µl. JMV1 dan JMV hapla akan menghasilkan pita berukuran 440 pasang basa (pb) menunjukkan Meloidogyne hapla sedangkan JMV1 dan JMV2 akan menghasilkan pita berukuran 540 pb (M. chitwoodi) dan 670 pb (M. fallax).
Amplifikasi DNA menggunakan teknik PCR dengan primer spesifik spesies
M. javanica, M. incognita, M. arenaria, dan multipleks primer untuk M. hapla, M. chitwoodi, M. fallax (Tabel 1) (Adam et al. 2007).
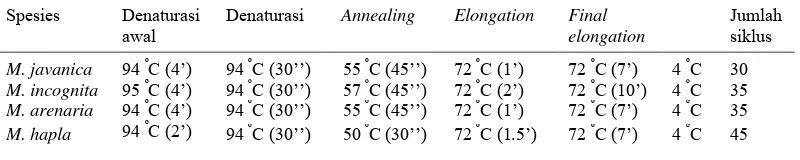
Mesin PCR (thermo cycle) diprogram sesuai dengan primer yang digunakan. Proses amplifikasi DNA nematoda dilakukan melalui lima tahap, yakni denaturasi, annealing, extension/ elongation, final elongation, dan final hold. Proses denaturasi pada suhu 94 oC selama 4 menit, extension/ elongation
pada suhu 72 oC selama 1 menit, final elongation pada suhu 72 oC selama 7 menit, dan final hold 4 oC untuk setiap DNA spesies Meloidogyne memerlukan suhu dan waktu yang sama, hanya proses annealing yang berbeda untuk setiap DNA
Fjav GGTGCGCGATTGAACTGAGC 720 pb M. javanica
Rjav CAGGCCCTTCAGTGGAACTATAC
Finc CTGGCGATAGAGGTAAATGAC 999 pb M. incognita
Rinc TCGGCGATAGACACTACAAACT
Far TCGGCGATAGAGGTAAATGAC 420 pb M. arenaria
Rar CTGGCGATAGACACTACAAAACT
JMV1 GGATGGCGTGCTTTCAAC 540 pb
670 pb 440 pb
M. chitwoodi
JMV2 TTCCCCCTTACGATGTTTACCC M. fallax
JMV hapla
15
o
C selama 45 detik dan M. hapla pada suhu 50 oC selama 30 detik (Adam et al.
2007) (Tabel 2).
DNA nematoda hasil amplifikasi dianalisis dengan elektroforesis. Larutan agarosa 1% [0.4 g agarosa dimasukkan ke dalam 40 ml buffer TBE (Tris-HCl 45 mM, asam borat 45 mM, dan EDTA 1 mM) 0.5 x selanjutnya dipanaskan dengan
microwive oven selama ± 2 menit. Dalam keadaan hangat ditambah 2 µl Ethidium bromide kemudian larutan agarosa dituang ke dalam gel box yang dipasang sisir (comb) pada ujungnya untuk membuat sumuran. Gel agarosa dibiarkan dingin selama 1 jam pada suhu ruang. Setelah gel memadat, sisir dicabut sehingga terbentuk lubang-lubang kecil/ sumuran.
Pengukuran DNA menggunakan penanda TriDyeTM-Promage 100 pb
ladder untuk M. javanica, M. arenaria, dan M. hapla dan TriDyeTM-Promage 1000 pb ladder untuk M. incognita. Masing-masing sampel diisi pada sumuran gel sebanyak 10 µl menggunakan mikropipet dan marker sebanyak 8 µl.
Setelah DNA dan marker dimasukkan ke dalam sumur gel, gel box ditutup dan dialirkan arus listrik. Kutub yang sejajar dengan lubang sampel DNA berupa kutub negatif, sedangkan kutub yang lainnya positif. Elektroforesis dilakukan pada tegangan 50 Volt selama 60 menit kemudian dilanjutkan 100 Volt selama 5 menit. Hasil elektroforesis divisualisasi dengan UV transiluminator dan gambar pita-pita DNA difoto dengan kamera digital (Hikmia et al. 2012).
Perunutan DNA. Perunutan dilakukan oleh PT Macrogen Incorporation Seoul, Korea Selatan menggunakan pasangan primer spesifik M. javanica dan primer multipleks M. hapla. Hasil sekuensing dianalisis menggunakan program
Basic Local Alignment Search Tool (BLAST) dengan program optimasi untuk mendapatkan urutan basa DNA yang terdapat dalam situs National Center for Biotechnology Information (NCBI). Sekuen identity didapatkan dengan menggunakan software Clustal W (Bioedit), sedangkan pohon filogenetik didapatkan dengan menggunakan software MEGA dan Neighbour Joining (NJ) 1000 bootstrap.
Tabel 2 Amplifikasi fragment ITS-rDNA spesies Meloidogyne menggunakan PCR
16
HASIL DAN PEMBAHASAN
Survei dan Gejala Penyakit Nematoda Puru Akar (NPA)
Agropolitan Cianjur terletak di Kabupaten Cianjur, Jawa Barat yang merupakan salah satu sentra produksi wortel Indonesia. Selain memproduksi wortel, daerah ini juga memproduksi tanaman sayuran lainnya, seperti bawang daun, lobak, brokoli, tomat, cabai rawit, cabai besar.
Gejala penyakit umbi bercabang pada wortel yang ditemukan di Agropolitan Cianjur antara lain: umbi pecah, umbi bercabang, umbi pendek membulat dan umbi berambut. Gejala ini memiliki kesamaan dengan gejala yang terdapat di pertanaman wortel Jawa Tengah (Taher et al. 2012) dan Jawa Timur (Hikmia et al. 2012). Pola penyebaran infeksi di lapang terjadi pada titik tertentu dan mengelompok.
Teknik budidaya wortel pada setiap ketinggian berbeda-beda. Ketinggian 1300 m dpl, petani menanam wortel lebih ke arah monokultur (Gambar 6d) sedangkan ketinggian 1500 m dpl dan 1600 m dpl petani melakukan rotasi tanam, salah satunya dengan tanaman brokoli. Petani wortel juga melakukan tumpang sari dengan bawang daun.
Dalam memelihara tanaman, petani menggunakan pupuk sintetik dan pupuk kandang (pukan). Pukan yang digunakan salah satunya adalah kotoran ayam.
Gambar 6 Gejala penyakit NPA pada pertanaman wortel Cianjur, Jawa Barat: a) umbi bercabang; b) ketinggian 1600 m dpl; c) ketinggian 1500 m dpl; d) ketinggian 1300 m dpl
a b
17
Petani menilai bahwa selain menyuburkan tanah, pukan ayam juga dapat meningkatkan produksi wortel. Hasil penelitian Sudirman (2011); Akhtar dan Malik (2000) menyatakan bahwa pukan ayam mengandung senyawa amonia dan asam nitrit yang dikeluarkan secara langsung bersifat nematisidal sehingga mampu mengurangi jumlah penetrasi akar oleh M. javanica, menekan perkembangan nematoda dan meningkatkan pertumbuhan tanaman.
Tekstur tanah di lokasi pengambilan sampel adalah lempung berpasir. Tekstur tanah ini sesuai untuk pertumbuhan tanaman wortel juga sesuai untuk habitat spesies Meloidogyne.
Tipe Gejala NPA pada Umbi Wortel
Petani wortel di Agropolitan Cianjur mengalami kendala dalam peningkatan produksi wortel, salah satu penyebabnya adalah penyakit umbi bercabang. Penyakit ini disebabkan oleh nematoda puru akar. Di samping menyebabkan umbi bercabang, nematoda ini juga menyebabkan gejala lain seperti umbi pecah dan umbi pendek membulat (Gambar 7). Gejala tersebut lebih mengarah ke malformasi dari bentuk normal umbi.
Umbi bercabang ditandai dengan bentuk umbi yang abnormal, dimana terdapat satu atau lebih percabangan (Gambar 7a). Gejala berikutnya adalah umbi pecah, bagian stele umbi tampak jelas (Gambar 7b). Biasanya pada bagian permukaan umbi kasar, jika dibedah terdapat NPA betina di dalamnya dan terkadang terdapat rambut akar yang berpuru. Umbi pecah diduga karena rangsangan hormon IAA untuk terjadi hipertropi dan hiperplasia sehingga permukaan kulit umbi tidak bisa mengimbangi pertumbuhan dan perkembangan umbi wortel secara keseluruhan. Hal ini diperkuat dari bagian umbi yang pecah terdapat puru yang bentuknya seperti kudis.
Tipe gejala umbi lainnya adalah umbi pendek membulat (Gambar c). Umbi wortel tumbuh abnormal dengan bentuk yang nyaris bulat dan mengerdil. Bagian umbi yang membulat terkadang dipenuhi hairy root dengan puru kecil di sepanjang rambut akar dan membentuk puru dengan ukuran yang lebih besar.
Gambar 7 Gejala umbi wortel yang terinfeksi NPA: a) umbi bercabang, b) umbi pecah, c) pendek membulat
18
Letak puru akar yang ditemukan pada umbi wortel bervariasi, seperti puru yang ditemukan pada hairy root, puru bulat berukuran besar pada akar dan puru menempel pada permukaan umbi wortel. Pertama, puru menempel pada permukaan umbi wortel (Gambar 8a). Sejumlah puru bergabung membentuk puru dengan ukuran yang lebih besar menempel pada permukaan umbi wortel. Kedua, puru bulat berukuran besar (Gambar 8b).
Identifikasi spesies Meloidogyne Berdasarkan Morfologi
Puru berwarna krem hingga coklat kehitaman. Perubahan warna puru dipengaruhi oleh lamanya infeksi hingga jaringan puru mengalami nekrosis. Terakhir adalah puru terdapat pada hairy root (Gambar 8c). Jumlah akar yang tumbuh lebih banyak dan tidak seperti pada wortel yang tumbuh normal, kemudian di sepanjang hairy root terdapat puru dengan bentuk bulat kecil dan berwarna krem. Berdasarkan Eisenback et al. (1981) M. hapla cenderung membentuk puru lebih kecil dan memiliki banyak percabangan, dimana sistem perakaran lebih tebal dan menyusut.
Spesies Meloidogyne Berdasarkan Morfologi
Berdasarkan identifikasi morfologi (perineal pattern) ada empat spesies nematoda yang menginfeksi pertanaman wortel di Agropolitan Cianjur yaitu M. incognita, M. arenaria, M. javanica dan M. hapla. Keempat spesies ini juga ditemukan pada pertanaman wortel di Jawa Tengah (Taher et al. 2012) dan Jawa Timur (Hikmia et al. 2012).
Masing-masing spesies Meloidogyne spp. diidentifikasi berdasarkan ciri khas yang dimilikinya. M. javanica hampir mirip dengan M. arenaria yang membedakan adalah garis pemisah dan penghubung antara lengkung dorsal dan lengkung ventral. M. javanica terdapat garis lateral yang memisahkan antara lengkung dorsal dan lengkung ventral (Gambar 9a). M. arenaria memiliki ciri yaitu pertemuan lengkung dorsal dan ventral seperti bahu, ujung tonjolan kutikula bercabang seperti garpu (Gambar 9b). M. incognita memiliki ciri lengkung dorsal (arch dorsal) membentuk persegi (sudut ±90o) (Gambar 9c). M. hapla terdapat
Gambar 8 Letak puru pada perakaran wortel: a) puru menempel pada umbi wortel; b) puru bulat berukuran besar; c) hairy root
19
Gambar 9 Hasil identifikasi pola sidik pantat NPA: a) M. javanica; b) M. arenaria;
c) M. incognita; d) M. hapla
tonjolan seperti duri di atas anus dan sering membentuk sayap pada bagian lateral baik pada satu ujung atau pada kedua ujungnya (Gambar 9d).
Hasil identifikasi morfologi NPA betina dewasa menunjukkan ada empat spesies NPA yang menginfeksi pertanaman wortel di Agropolitan Cianjur dengan ketinggian 1300 m dpl dan 1500 m dpl, yakni M. incognita, M. javanica, M. arenaria dan M. hapla. Nematoda yang teridentifikasi pada ketinggian 1600 m dpl yaitu M. javanica, M. arenaria dan M. hapla (Tabel 3).
Prevalensi spesies Meloidogyne spp. berdasarkan ketinggian tempat menunjukkan spesies M. hapla dan M. javanica lebih dominan pada ketiga ketinggian.
Spesies Berdasarkan PCR dan Sekuen Nukleotida
PCR menggunakan primer spesifik spesies M. javanica terhadap sampel NPA dari Jawa Barat berhasil mengamplifikasi pita DNA berukuran 720 pb (Gambar 10) pada ketinggian 1300 m dpl dan 1500 m dpl. Hasil ini mengindikasi bahwa NPA yang telah diteliti merupakan salah satu isolat M. javanica.
a b c d
Tabel 3 Prevalensi distribusi NPA berdasarkan ketinggian tempat di Agropolitan Cianjur, Jawa Barat
Spesies Meloidogyne Ketinggian tempat (m dpl)
1300 1500 1600
M. arenaria 14 14.3 24
M. javanica 36 28.5 34
M. incognita 22 14.3 0
20
Hasil amplifikasi PCR diperkuat oleh hasil analisis homologi sekuen nukleotida. Sekuen nukleotida NPA asal Cianjur, Jawa Barat memiliki tingkat kemiripan yang sangat tinggi (homologi 91.9%) dengan spesies M. javanica asal Cina, sedangkan dengan spesies lain (M. hapla, M. arenaria dan M. incognita) tingkat kemiripan hanya sebesar 35.7% hingga 40.1% (Tabel 4). Hal ini memperkuat hasil identifikasi, bahwa spesies Meloidogyne asal Cianjur, Jawa Barat adalah M. javanica.
M. javanica M. javanica M. hapla M. hapla
Tabel 4 Homologi sekuen nukleotida DNA M. javanica Cianjur, Jawa Barat dengan sekuen DNA yang ada di GenBank
Isolat No Aksesi Homologi M. javanica Cianjur (%)
M. javanica Cina JN005839.1 91.9
M. arenaria EF612714.1 35.7
M. incognita KF053036.1 35.7
M. hapla 40.1
Keterangan: Matriks identitas sekuen diperoleh dengan menggunakan software Bioedit 7.1.3
Gambar 10 Hasil amplifikasi DNA Meloidogyne isolat Cianjur, Jawa Barat menggunakan primer spesifik a) M. javanica; b) M. hapla. Sampel terdiri dari M: Marker 1 kb; K (-): Tanaman sehat; Sampel dari beberapa ketinggian tempat: 1.3, 1.5, 1.6 (km)
21
Berdasarkan analisis filogenetik M. javanica asal Cianjur, Jawa Barat menjadi satu kelompok dengan isolat M. javanica asal Cina dan terpisah dari kelompok M. javanica lainnya yang terdiri atas spesies M. javanica dari negara lain. Hal ini menunjukkan bahwa spesies M. javanica Cianjur, Jawa Barat memiliki tingkat kekerabatan lebih dekat dengan M. javanica asal Cina dibanding dengan spesies M. javanica asal negara lain (Gambar 11).
M. javanica merupakan spesies nematoda dengan sebaran yang sangat luas dari daerah tropis hingga subtropis, kisaran inang yang beragam dan menyebabkan kerusakan yang signifikan pada berbagai jenis tanaman sayuran. Secara ekologi M. javanica dapat hidup pada suhu antara 10–35 oC (Stephan 1982).
PCR yang telah dilakukan menggunakan primer multipleks yaitu JMV1, JMV2 dan JMV hapla untuk mendeteksi spesies M. fallax, M. chitwoodi dan M. hapla. Primer ini berhasil mengamplifikasi pita DNA berukuran 440 pb untuk M. hapla dan tidak berhasil mengamplifikasi pita DNA berukuran 540 pb untuk M. chitwoodi maupun 670 pb untuk M. fallax (Gambar 10). Hasil ini menunjukkan bahwa sampel DNA yang dideteksi hanya M. javanica dan M. hapla.
Keberadaan M. hapla ini juga diperkuat oleh analisis homologi sekuen nukleotida. Melalui analisis tersebut terlihat bahwa NPA asal Cianjur, Jawa Barat memiliki tingkat kemiripan yang sangat tinggi dengan spesies M. hapla asal Magelang, Jawa Tengah begitu juga dengan spesies M. hapla dari negara lain tingkat kemiripan antara 99.4% hingga 100% sedangkan dengan spesies lain (M. javanica, M. arenaria dan M. incognita) tingkat kemiripannya antara 42.3% dan 53% (Tabel 5).
Berdasarkan hasil analisis filogenetik sekuen nukleotida menunjukkan bahwa isolat M. hapla asal Cianjur, Magelang menjadi satu kelompok tersendiri dengan isolat M. hapla asal Inggris, Amerika, Cina, Australia dan Hawai dan terpisah dari kelompok M. hapla asal Swiss (Gambar 12).
Tabel 5 Homologi sekuen nukleotida DNA M. hapla Cianjur, Jawa Barat dengan sekuen DNA yang ada di GenBank
Isolat No Akses Homologi M. hapla Jawa Barat (%)
M. arenaria EF612714.1 52.7
M. incognita KF053036.1 53.0
22
M. hapla adalah salah satu spesies Meloidogyne yang dapat bertahan pada suhu dingin dan menginfeksi tanaman sayuran dan dapat bertahan hidup pada
suhu 4 oC hingga 20 oC (Das et al. 2011). M. hapla juga termasuk organisme OPTK A2 (sudah ada di Indonesia dan terbatas), daerah sebarannya adalah Jawa.Hasil laporan sebelumnya, M. hapla telah menginfeksi pertanaman wortel di Jawa Timur (Hikmia et al. 2012) dan Jawa Tengah (Taher et al. 2013). Namun menurut www.plantwise.org, wilayah Indonesia yang sudah terinfeksi M. hapla adalah Makassar, Sulawesi Selatan dan Yogyakarta, Jawa Tengah.
Berdasarkan hasil penelitian ini, M. hapla juga ditemukan di Jawa Barat, di daerah Agropolitan Cianjur. Hasil runutan DNA menunjukkan isolat M. hapla
Cianjur, Jawa Barat memiliki tingkat homologi yang sangat dekat dengan M. hapla dari negara lain. Hasil analisis filogenetik menggambarkan M. hapla asal Cianjur, Jawa Barat dan Magelang, Jawa Tengah relatif tidak berbeda dengan M. hapla asal negara lain (Cina, Inggris, Hawai, Australia,Amerika dan Swiss). Diduga M. hapla telah lama masuk ke Indonesia dan terjadi perubahan genetik dalam rangka penyesuaian diri terhadap lingkungan di Indonesia. Data BPS (2005) menyebutkan bahwa Cina, Inggris, Amerika, dan Swiss merupakan beberapa negara pemasok wortel bagi Indonesia. Diduga umbi wortel merupakan media pembawa spesies M. hapla yang menginfeksi pertanaman wortel di Jawa Barat dan Jawa Tengah.
Amplifikasi PCR menggunakan primer Far/ Rar untuk spesies M. arenaria
dan primer Finc/ Rinc untuk spesies M. incognita tidak berhasil mengamplifikasi pita DNA. Diduga ketika melakukan ekstraksi DNA dari Meloidogyne betina, spesies M. incognita dan M. arenaria tidak ada.
Tingginya tingkat kemiripan sekuen nukleotida yang dimiliki, diduga spesies M. hapla berasal dari sumber yang sama dan terjadi variasi genetik. Agrios (2005) mengemukakan bahwa ada 3 faktor yang harus dimiliki oleh patogen untuk dapat menginfeksi tanaman yaitu kemampuan penetrasi dan menginfeksi tanaman, kemampuan untuk mengatasi ketahanan tanaman, dan terakhir kemampuan patogenesis. Sinaga (2003) juga menyatakan bahwa perubahan-perubahan yang terjadi pada patogen, dapat meningkatkan sifat patogenesisnya sehingga suatu saat dapat membentuk strain baru yang virulen dan dapat menginfeksi inang yang resisten.
23
SIMPULAN DAN SARAN
Simpulan
1. Spesies Meloidogyne yang berasosiasi dengan penyakit umbi bercabang di daerah Cianjur, Jawa Barat adalah M. javanica, M. incognita, M. arenaria
dan M. hapla berdasarkan identifikasi morfologi.
2. Spesies Meloidogyne yang berasosiasi dengan penyakit umbi bercabang di daerah Cianjur, Jawa Barat adalah M. javanica dan M. hapla berdasarkan identifikasi molekuler.
3. M. javanica asal Cianjur, Jawa Barat berkerabat dekat dengan isolat asal Cina dan M. hapla asal Cianjur, Jawa Barat mempunyai sekuen nukleotida yang relatif tidak berbeda dengan M. hapla asal Inggris, Amerika, Cina, Hawai, Australia dan Swiss.
Saran
24
DAFTAR PUSTAKA
[BPS] Badan Pusat Statistik. 2005. Buletin Statistik Perdagangan Luar Negeri, Impor. Jakarta (ID): Badan Pusat Statistics Indonesia.
[BPS] Badan Pusat Statistik. 2012. Luas panen, produksi dan produktivitas wortel, 2009-2011 [internet]. Jakarta (ID): Badan Pusat Statistika Republik Indonesia; [8 Oktober 2012]. Tersedia pada: www.bps.go.id.
Abawi GS, Chen J. 1998. Concomitant pathogen and pest interactions. Di dalam: Barker KR, Pederson GA, Windham GL, editor. Plant and Nematode Interactions. Wisconsin (USA): Madison. hlm 135–158.
Adam MAM, Phillips MS, Blok CV. 2007. Molecular diagnostic key for identification of single juveniles of seven common and economically important species of root-knot nematode Meloidogyne spp. Plant Pathol. 56:190 –197. DOI:10.1111/j.1365-3059.2006.01455.x
Agrios GN. 2005. Plant Pathol. 5th ed. New York (US): Academic Press.
Akhtar M, Malik A. 2000. Roles of organic soil amendments and soil organisms in the biological control of plant-parasitic nematodes: a review. Bioresource Technology. 74:35-47.
Anwar SA, McKenry MV. 2010. Incidence and reproduction of Meloidogyne incognita on vegetable crop genotypes. Pakistan J. Zool. 42(2):135-141. Belair G. 1992. Effect of cropping sequence on population densities of
Meloidogyne hapla and carrot yield in organic soil. J Nematol. 24(3):450-456.
Bezooijen VJ . 2006. Methods and Techniques for Nematology. Wageningen. Brown JG. 1950. Disease of carrots. Experiment Station Bulletin. 227:3-19.
Charchar JM, Eisenback JD, Vieira JV, Boiteux MENF, Boiteux LS. 2009.
Meloidogyne polycephannulata n. sp. (Nematoda: Meloidogynidae), a root-knot nematode parasitizing carrot in Brazil. J Nematol. 41(3):174-186. Cenis JL. 1993. Identification of four major Meloidogyne spp. by random
amplified polymorphic DNA (RAPD-PCR). Phytopathology. 83:76-78. Das S, Wesemael WML, Perry RN. 2011. Effect of temperature and time on the
survival and energy reserves of juveniles of Meloidogyne spp. Agric. Sci. Res. J. 1:102 – 112.
David RM, Rais RN, editor. 2002. Compeddium of Umbelliferous Crop Disease. Minresota (USA); APS Press.
Decraemer W, Hunt DJ. 2006. Structure and classification. Di dalam: Perry RN, Moens M, editor. Plant Nematology. London (UK): CABI. hlm 3-32.
25
Dharmayanti NLPI. 2011. Filogenetika molekuler: metode taksonomi organisme berdasarkan sejarah evolusi. WARTAZOA. 21(1):1-10.
Dong K, Dean RA, Fortnum BA, Lewis SA. 2001. Development of for PCR primer to identify species of root-knot nematodes: Meloidogyne arenaria, M. hapla, M. incognita and M. javanica. Nematropica. 31(2):271-280. Dropkin V. 1991. Pengantar Nematologi Tumbuhan. 2nd ed. Supratoyo,
penerjemah. Yogyakarta (ID): Gadjah Mada University Press. to Terjemahan dari: Introduction to Plant Nematology.
Eisenback JD, Hirschmann H, Sasser JN, Triantaphyllou AC. 1981. A Guide to the Four Most Common Species of Root-Knot Nematodes (Meloidogyne
spp.) With A Pictorial Key. Raleigh (USA): IMP.
Eisenback JD, Hunt DJ. 2009. General morphology. Di dalam: Perry RN, Moens DJ, Starr JL, editor. Root-Knot Nematodes. London (UK): CABI. hlm 18– 55.
Evans AAF, Perry RN. 2009. Survival mechanisms. Di dalam: Perry RN, Moens M, Starr JL, editor. Root Knot Nematodes. London (UK): CABI. hlm 201– 222.
Fennimore SA, Richard SJ, Flewelling NL. 2000. Crop profile for carrots in California [internet]. Salinas (CA): Department of Vegetable Crops; [Diunduh 21 November 2012]. Tersedia pada: www.ipmcenters.org.
Gera A, Maslenin L, Weintraub PG, Muwassi M. 2011. Phytoplasma and spiroplasma diseases in open-field crops in Israel. Bulletin of Insectology. 53–54.
Harris TS, Sandall LJ, Powers TO. 1990. Identification of single Meloidogyne juveniles by polymerase chain reaction amplification of mitochondrial DNA. J Nematol. 22:518–524.
Higgs PG, Attwood TK. 2005. Bioinformatics and Molecular Evolution. Australia; Blackwell Publishing.
Hikmia Z, Supramana, Suastika G. 2012. Identifikasi spesies Meloidogyne spp. penyebab umbi bercabang pada wortel di Jawa Timur. J Fitopatol Indones. 8(3):73-78.
26
Hunt DJ, Handoo ZA. 2009. Taxonomy, identification and principal species. Di dalam: Perry RN, Moens M, Starr JL, editor, Root Knot Nematodes. London (UK): CABI. hlm 55–97.
Jamilah M, Nurhayati P. 2011. Analisis risiko produksi wortel dan bawang daun di Kawasan Agropolitan Cianjur Jawa Barat. Forum Agribisnis. 1:1-19. Karajeh MR, Abu-Gharbieh W, Masoud SA. 2010. DNA extraction and
PCR-based diagnosis of the root-knot nematodes (Meloidogyne species and races) of Jordan. Jordan J. of Agr. Sci. 6: 342-352.
Karssen G, Moens M. 2006. Root-knot nematodes. Di dalam: Perry RN, Moens M, editor. Plant Nematology. London (UK): CABI. hlm 60–90.
Kiewnick S, Wolf S, Willareth M, Frey JE. 2011. Development of a simple multiplex PCR protocol for identification of the tropical root-knot nematode species Meloidogyne incognita, M. arenaria and M. javanica. Switzerland; Agroscope Changins-Wadenswil.
Kurniawan W. 2010. Identifikasi penyakit umbi bercabang pada wortel, Daucus carota (L.) di Indonesia [tesis]. Bogor (ID): Institut Pertanian Bogor.
Latham LJ, Traicevski V, Persley DM, Wilson CR, Tesoriero L, Coles R, Jones RAC. 2004. Distribution and incidence of Carrot virus Y in Australia.
Australasian Plant Pathol. 33:83-86.
McDonald MR, Vandeer Kooi K, Saude C, Tasfaendrias M, Westerveid, Boland G. 2008. Carrot country. Spring. 16:1–16.
Mitkowski NA, Beek, J.G. Van der, Abawi GS. 2002. Characterization of root-knot nematode populations associated with vegetables in New York State.
Plant Disease. 86:840–847.
Moens M, Perry RN, Starr JL. 2009. Meloidogynespecies-a diverse group of novel and important plant parasites. Di dalam: Perry RN, Moens M, Starr JL, editor. Root Knot Nematodes. London (UK): CABI. hlm 1–17.
Mulyatni AS, Priyatmojo A, Purwantara A. 2011. Sekuen internal transcribed spacer (ITS) DNA ribosomal Oncobasidium theobromae dan jamur sekerabat pembanding. Menara Perkebunan. 79(1):1-5.
Mulyadi. 2009. Nematologi Pertanian. Yogyakarta (ID): Gadjah Mada University Press.
Mustika I. 2010. Konsep dan strategi pengendalian nematoda parasit tanaman di Indonesia. Pengembangan Inovasi Pertanian. 3(2):81-101.
Nei M, Kumar S. 2000. Molecular Evolution and Phylogenetics. New York (USA); Oxford University Press.
Netscher C, Sikora RA. 1995. Nematoda parasit pada sayuran. Di dalam: Luc M, Sikora RA, Bridge J, editor. Nematoda Parasit Tumbuhan di Pertanian Subtropik dan Tropik. Yogyakarta (ID): Gadjah Mada University Press. Opperman CH, Bird DM, Schaff JE. 2008. Genomic analysis of the root-knot
nematode genome. Plant Cell Monogr: 221-234.