TOKSISITAS TEMBAGA (Cu) TERHADAP HEMATOLOGI,
BIOAKUMULASI, SINTASAN DAN PERTUMBUHAN
JUVENIL IKAN PATIN (Pangasius sp)
DODY SIHONO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Toksisitas Tembaga (Cu) terhadap Hematologi, Bioakumulasi, Sintasan dan Pertumbuhan Juvenil Ikan Patin (Pangasius sp) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
Dody Sihono
RINGKASAN
DODY SIHONO. Toksisitas Tembaga (Cu) terhadap Hematologi, Bioakumulasi, Sintasan dan Pertumbuhan Juvenil Ikan Patin (Pangasius sp). Dibimbing oleh EDDY SUPRIYONO dan MIA SETIAWATI.
Peningkatan aktivitas antropogenik menyebabkan menurunnya kualitas lingkungan perairan. Beberapa penelitian melaporkan bahwa aktivitas antropogenik telah meningkatkan konsentrasi tembaga (Cu) dalam lingkungan perairan secara periodik. Tembaga merupakan mikro mineral yang dibutuhkan dalam tubuh organisme karena memiliki peran penting dalam sejumlah proses enzimatik seperti
cytochrome oxidase, superoxide dismutase, lysyl oxidase, dopamine hydroxylase
dan tyrosinase. Tembaga juga memiliki potensi memberikan efek negatif bila masuk ke dalam tubuh organisme dalam jumlah besar atau melebihi nilai ambang batas. Ikan dapat mengakumulasi tembaga dalam organ tubuh ketika mencapai konsentrasi yang membahayakan. Tembaga dapat mengalami bioakumulasi dan menjadi racun bagi organisme yang dibudidayakan. Kelebihan tembaga menyebabkan gangguan pada sejumlah proses fisiologis yang meliputi terganggunya regulasi pertukaran ion di insang sehingga menurunkan penyerapan oksigen, tingginya kadar Cu dalam darah yang menyebabkan anemia hemolitik dan tingginya kebutuhan energi untuk detoksifikasi. Ikan patin dibudidayakan oleh masyarakat Bangka dengan memanfaatkan lahan bekas tambang timah atau yang
biasa disebut “kolong”. Kandungan Cu pada kolong yang lebih tinggi dari baku mutu yang telah ditetapkan oleh Pemerintah berpotensi menggagalkan produksi budidaya.
Penelitian ini bertujuan untuk menganalisis toksisitas Cu pada kondisi lethal, serta menganalisis pengaruh Cu pada kondisi sublethal terhadap respons hematologi, akumulasi Cu, tingkat kelangsungan hidup dan pertumbuhan juvenil ikan patin (Pangasius sp). Bahan uji yang digunakan adalah tembaga sulfat anhidrat (CuSO4). Analisis kadar tembaga menggunakan spektrophotometer serapan atom. Rancangan penelitian menggunakan rancangan acak lengkap (RAL) dengan perlakuan konsentrasi Cu berbeda. Penelitian dilakukan dalam dua tahap meliputi uji toksisitas akut dan uji toksisitas sublethal. Uji toksisitas akut menggunakan juvenil ikan patin dengan panjang total 11±1 cm dan bobot 13±0,97 gram. Konsentrasi tembaga yang digunakan pada uji toksisitas akut yaitu K (kontrol), A (0,2), B (0,7), C (1,2) dan D (1,7) ppm. Uji toksisitas sublethal menggunakan juvenil ikan patin dengan panjang total 11±1,7 cm dan bobot 13±2,72 gram. Konsentrasi tembaga yang digunakan pada uji toksisitas sublethal yaitu K (kontrol), A (0,167), B (0,334) dan C (0,500) ppm.
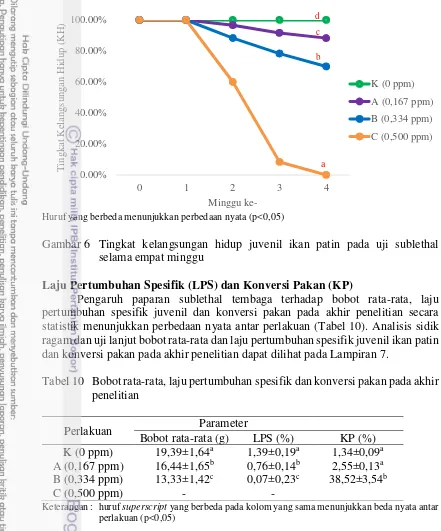
pertama paparan. Namun pada minggu kedua hingga keempat, kadar hemoglobin, hematokrit dan jumlah eritrosit mengalami penurunan, sementara kadar leukosit stabil mengalami peningkatan. Akumulasi Cu tertinggi pada seluruh organ terjadi pada perlakuan konsentrasi 0,500 ppm dan hati merupakan organ dengan akumulasi tertinggi pada akhir penelitian untuk seluruh perlakuan. Persentase kelangsungan hidup tertinggi yaitu pada perlakuan kontrol diikuti berturut-turut konsentrasi 0,167 ppm, 0,334 ppm dan 0,500 ppm dengan persentase kelangsungan hidup 100%, 88,33%, 70,00% dan 0,00%. Laju pertumbuhan spesifik tertinggi yaitu pada perlakuan kontrol diikuti konsentrasi 0,167 ppm dan 0,334 ppm dengan nilai berturut-turut 1,39%, 0,76% dan 0,07%.
Abnormalitas perilaku yang dialami oleh ikan menunjukkan bahwa tingginya konsentrasi tembaga di perairan menyebabkan gangguan pada sistem pernapasan ikan. Tembaga dapat menurunkan penyerapan Na+ dengan menghambat NA+/K+ ATPase, menurunkan penyerapan Cl- pada aktivitas karbonik anhidrase, menyebabkan gangguan pertukaran ion dan menghambat ekskresi NH3. Kontak langsung dengan Cu juga dapat merusak sistem sensorik penciuman. Pada konsentrasi sublethal, tembaga memberikan sejumlah efek negatif bagi juvenil ikan patin. Meningkatnya konsentrasi tembaga secara nyata menurunkan jumlah eritrosit, hemoglobin dan hematokrit. Penurunan jumlah eritrosit diduga merupakan dampak dari meningkatnya aktivitas superoksidase dismutase guna menetralisir radikal bebas akibat toksikan dari lingkungan. Produk yang dihasilkan berupa H2O2 menyebabkan lisisnya membran sel darah merah atau yang disebut anemia hemolitik. Anemia hemolitik menyebabkan penurunan jumlah sel darah merah dan hematokrit. Tingginya konsentrasi Cu menurunkan penyerapan besi (Fe) pada usus sehingga menyebabkan penurunan aktivitas ferrireductase dan berdampak pada penghambatan sintesis hemoglobin. Meningkatnya konsentrasi tembaga secara nyata meningkatkan bioakumulasi pada organ. Terjadi peningkatan proses detoksifikasi oleh metallothionein guna mempertahankan homeostasis tubuh yang menyebabkan penumpukan tembaga pada organ. Peningkatan energi untuk detoksifikasi dan pemeliharaan homeostasis menyebabkan laju pertumbuhan menjadi rendah dan konversi pakan menjadi tinggi.
Tembaga dikategorikan sangat toksik terhadap juvenil ikan patin dengan nilai LC50 -96 jam sebesar 0,667 ppm (0,539 - 0,805 ppm). Pada konsentrasi sublethal, tembaga berpengaruh nyata terhadap penurunan sintasan, pertumbuhan, eritrosit, hemoglobin dan hematokrit serta menyebabkan peningkatan pada akumulasi tembaga mulai pada konsentrasi 0,167 ppm.
SUMMARY
DODY SIHONO. Toxicity of Copper (Cu) on Haematological, Bioaccumulation, Survival Rate and Growth of Catfish Juvenile (Pangasius sp). Supervised by EDDY SUPRIYONO and MIA SETIAWATI.
Increased anthropogenic activities caused aquatic environmental degradation. Several studies has reported that anthropogenic activities has increased the concentration of copper (Cu) in the aquatic environment periodically. Copper is a micro-mineral needed in the body of organisms because it has an important role in a number of enzymatic processes such as cytochrome oxidase, superoxide dismutase, lysyl oxidase, dopamine hydroxylase and tyrosinase. Copper also has potential negative effect when enters the body in large quantities or exceeds the threshold value. Copper can be toxic to cultivated organisms. Copper are able to bioaccumulate and become toxic to the organisms cultured. Excess copper caused disturbances in a number of physiological processes that include disruption of the regulation of ion exchange in the gills thus lowering the absorption of oxygen, high levels of Cu in the blood caused hemolytic anemia and high energy requirements for detoxification. Catfish cultivated by the people of Bangka island by using tin mined land or commonly called "kolong". The content of Cu higher than the standard set by the government potentially failed the aquaculture production.
This study aimed to analyze the toxicity of Cu on lethal condition, and analyzes the effect of Cu on sublethal conditions to haematological response, accumulation of Cu, survival rates and growth of Pangasius sp. The test material used was anhydrous copper sulfate (CuSO4). Analysis of copper content used atomic absorption spectrophotometer. The study design used completely randomized design (CRD) with different Cu concentration treatments. The study was conducted in 2 phases include acute toxicity and sublethal toxicity test. Acute toxicity test used catfish juvenile with a total length 11 ± 1 cm and weight 13 ± 0.97 grams. The concentration of copper used in the acute toxicity test was K (control), A (0.2), B (0.7), C (1.2) and D (1.7) ppm. Sublethal toxicity test used catfish juvenile with a total length 11 ± 1.7 cm and weight 13 ± 2.72 grams. The concentration of copper used in the Sublethal toxicity test was K (control), A (0167), B (0.334) and C (0.500) ppm.
100%, 88.33%, 70.00% and 0.00%. The highest specific growth rate was control treatment followed by concentration of 0.167 ppm and 0.334 ppm with values respectively 1.39%, 0.76% and 0.07%.
Behavioral abnormalities experienced by fish indicate that the high concentration of copper in water caused disorders of the respiratory system of fish. Copper may decreased the absorption of Na+ by inhibiting NA+/K+ ATPase, decreased the absorption of Cl- on the carbonic anhydrase activity, caused disruption of ion exchange and inhibited the excretion of NH3. Direct contact with Cu can damaged the olfactory sensory system. At sublethal concentrations, copper gave a number of negative effects for catfish juvenile. Increased concentrations of copper significantly reduced erythrocytes, hemoglobin and hematocrit. Decreased erythrocytes is the impact of increased activity of superoxide dismutase to neutralized free radicals as a result of environmental toxicant. Products produced in the form of H2O2 caused lysis of red blood cell membrane or commonly called hemolytic anemia. Hemolytic anemia caused a decrease in red blood cell count and hematocrit. The high concentration of Cu decreased the absorption of iron (Fe) in the intestine, caused a decrease in the activity of ferrireductase and impact on haemoglobin synthesis inhibition. Increased concentrations of copper significantly increased the bioaccumulation in organs. There was an increase in detoxification by metallothionein in order to maintain homeostasis of the body that caused accumulation of copper in the organs. Increased energy for detoxification and maintenance of homeostasis caused the growth rate to be low and high feed conversion.
Copper categorized as highly toxic to catfish juvenile with a LC50 -96 hours value was 0.667 ppm (0.539 to 0.805 ppm). At sublethal concentrations, copper significantly effected on decreased survival rates, growth, erythrocytes, haemoglobin and hematocrit and caused an increased copper accumulation began at 0.167 ppm concentration.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
TOKSISITAS TEMBAGA (Cu) TERHADAP HEMATOLOGI,
BIOAKUMULASI, SINTASAN DAN PERTUMBUHAN
JUVENIL IKAN PATIN (Pangasius sp)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Toksisitas Tembaga (Cu) terhadap Hematologi, Bioakumulasi, Sintasan dan Pertumbuhan Juvenil Ikan Patin (Pangasius sp) Nama : Dody Sihono
NIM : C151120091
Disetujui oleh Komisi Pembimbing
Dr Ir Eddy Supriyono, MSc Ketua
Dr Ir Mia Setiawati, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2014 ini ialah toksikologi, dengan judul Toksisitas Tembaga (Cu) terhadap Hematologi, Bioakumulasi, Sintasan dan Pertumbuhan Juvenil Ikan Patin (Pangasius sp).
Terima kasih penulis ucapkan kepada Bapak Dr Ir Eddy Supriyono, MSc dan Ibu Dr Ir Mia Setiawati, MSi selaku pembimbing, serta Bapak Dr Ir Kukuh Nirmala, MSc selaku dosen penguji luar yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bupati Kabupaten Bangka Barat yang telah memberikan kesempatan kepada penulis untuk melanjutkan pendidikan di Sekolah Pascasarjana IPB, serta rekan-rekan AKU 2012 yang telah membantu selama penelitian. Ungkapan terima kasih juga disampaikan kepada orang tua, istri serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 METODE 3
Waktu dan Tempat 3
Prosedur Penelitian 3
Parameter Pengamatan 5
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 15
4 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 25
DAFTAR TABEL
1 Skoring gejala klinis toksisitas akut 4
2 Perlakuan uji sublethal tembaga pada juvenil ikan patin 5 3 Analisis parameter fisika kimia air pada uji toksisitas sublethal 7 4 Indeks toksisitas akut juvenil ikan patin pada uji toksisitas akut 8 5 Persentase mortalitas juvenil ikan patin dalam waktu 24 hingga 96 jam
akibat pengaruh konsentrasi Cu berbeda 9
6 Nilai LC50 Cu pada juvenil ikan patin 9
7 Kadar Cu pada organ juvenil ikan patin sebelum uji toksisitas sublethal 12 8 Akumulasi Cu pada organ juvenil ikan patin selama empat minggu uji
toksisitas sublethal 12
9 Faktor konsentasi Cu pada organ juvenil ikan patin selama empat minggu
uji toksisitas sublethal 13
10 Bobot rata-rata dan laju pertumbuhan juvenil ikan patin pada akhir
penelitian 11
11 Parameter kualitas air pada uji sublethal selama empat minggu 15
DAFTAR GAMBAR
1 Nilai LC50 -96 jam Cu pada juvenil ikan air tawar 9 2 Hemoglobin juvenil ikan patin pada uji toksisitas sublethal selama empat
minggu 10
3 Hematokrit juvenil ikan patin pada uji toksisitas sublethal selama empat
minggu 10
4 Eritrosit juvenil ikan patin pada uji toksisitas sublethal selama empat
minggu 11
5 Leukosit juvenil ikan patin pada uji toksisitas sublethal selama empat
minggu 11
6 Tingkat kelangsungan hidup juvenil ikan patin pada uji sublethal selama
empat minggu 14
DAFTAR LAMPIRAN
1 Prosedur analisis parameter hematologi 25
2 Prosedur destruksi sampel (Departemen Pertanian 2005) 26 3 Parameter fisika kimia air setiap minggu pada uji sublethal 27 4 Analisis sidik ragam dan uji lanjut (duncan) respons hematologi juvenil
ikan patin 27
5 Analisis sidik ragam dan uji lanjut (duncan) akumulasi Cu pada organ hati, insang, kulit dan daging juvenil ikan patin 31 6 Analisis sidik ragam dan uji lanjut (duncan) tingkat kelangsungan hidup
(kh) juvenil ikan patin 35
7 Analisis sidik ragam dan uji lanjut (duncan) laju pertumbuhan juvenil
1
PENDAHULUAN
Latar Belakang
Meningkatnya kegiatan pertambangan, industri dan pertanian mempercepat peningkatan konsentrasi tembaga (Cu) terlarut dalam badan perairan. Penelitian Andarani dan Roosmini (2009) menunjukkan bahwa rata-rata konsentrasi Cu dalam badan air sungai Cikijing sebelum menerima effluen dari industri tekstil adalah 0,0238 ppm (rentang: 0,017 ppm sampai 0,033 ppm) dan setelah menerima effluen adalah 0,3265 ppm (rentang: 0,214 ppm sampai 0,54 ppm). Terjadi peningkatan konsentrasi Cu yang sangat tajam, yaitu sebesar 1.274,74%. Penelitian Fitriyah et al. (2013) juga menunjukkan tingginya konsentrasi Cu dalam badan air sungai Surabaya yaitu antara 0,37-0,81 ppm, sedangkan pada sedimen antara 27,58-77,29 ppm. Peningkatan konsentrasi Cu juga terjadi dalam sedimen di Teluk Jakarta. Penelusuran data menunjukkan, penelitian Hutagalung dan Nontji (1995), kandungan Cu berkisar 7,2-53,9 ppm, Williams et al. (1997), kandungan Cu berkisar 5,2-71,4 ppm, dan Rochyatun dan Rozak (2007), kandungan Cu berkisar antara 0,79-193,75 ppm. Data menunjukkan konsentrasi Cu terus mengalami peningkatan dari tahun 1995 hingga 2007.
Tembaga merupakan mikro mineral yang dibutuhkan dalam tubuh organisme dalam jumlah yang sangat sedikit namun memiliki peran penting dalam sejumlah proses enzimatik. Tembaga berperan dalam aktivitas enzim seperti
cytochrome oxidase, superoxide dismutase, lysyl oxidase, dopamine hydroxylase
dan tyrosinase (Watanabe et al. 1997). Tembaga adalah bagian penting dari sitokrom oksidase, komponen penting yang terlibat dalam pembentukan hemoglobin (USPHS 2004) dan terlibat dalam reaksi redoks yang penting dalam sel (Halfdanarson et al. 2008). Selain itu, Cu dalam bentuk tembaga sulfat sering digunakan dalam akuakultur untuk mengontrol penyakit dan blooming alga (Lin et al. 2008).
2
Sejumlah penelitian yang telah dilakukan dapat memberikan informasi penting tentang dampak Cu dalam lingkungan perairan. Terdapat beberapa laporan efek jangka pendek dan kronis paparan Cu pada fisiologis ikan (Beaumont et al.
2000; Antognelli et al. 2003; Carvalho dan Fernandes 2006). Toksisitas akut Cu pada ikan terdapat pada disfungsi insang, sementara dampak kronis dari paparan sublethal Cu juga terdapat pada organ lainnya, terutama pada organ hati yang memiliki konsentrasi Cu tertinggi karena perannya pada detoksifikasi (Mela et al.
2013).
Penelitian mengenai dampak Cu terhadap juvenil biota budidaya telah dilakukan pada crustacea seperti P. monodon (Chen dan Lin 2001), M. rosenbergii
(Reddy dan Pillai 2006) dan L. vannamei (Frias-Espericueta et al. 2008). Untuk biota air tawar, penelitian dampak Cu pada juvenil ikan telah dilakukan pada
Clarias gariepinus (Olaifa et al. 2004), Channa punctatus (Singh et al. 2008),
Grass Carp (Nekoubin et al. 2012) dan O. niloticus (Monteiro et al. 2012).
Ikan patin (Pangasius sp) merupakan salah satu komoditas perikanan dalam program percepatan industrialisasi dari jenis komoditas perikanan budidaya dengan jumlah produksi pada tahun 2012 sebesar 651.000 ton (KKP 2014). Komoditas ini dibudidayakan khususnya oleh masyarakat Bangka dengan memanfaatkan lahan
bekas tambang timah atau yang biasa disebut “kolong”. Menurut Henny (2011), kandungan Cu pada perairan kolong berkisar antara 0,001-0,11 ppm. Nilai ini lebih tinggi dari kandungan maksimum tembaga pada air untuk aktivitas budidaya menurut PP No. 82 Tahun 2001 tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air sebesar 0,02 ppm. Namun penelitian mengenai toksisitas logam pada pemanfaatan kolong masih terbatas pada logam berat seperti Pb (Henny 2011; Prasetiyono 2012). Terdapat potensi kandungan Cu pada kolong yang lebih tinggi dari baku mutu akan menggagalkan produksi budidaya. Oleh karena itu, studi mengenai toksisitas Cu terhadap juvenil ikan patin perlu untuk dilakukan.
Perumusan Masalah
3
Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis toksisitas Cu pada konsentrasi akut, serta menganalisis pengaruh Cu pada konsentrasi sublethal terhadap respons hematologi, akumulasi Cu, tingkat kelangsungan hidup dan pertumbuhan juvenil ikan patin (Pangasius sp).
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang dampak toksisitas Cu dengan berbagai konsentrasi pada juvenil ikan patin (Pangasius sp).
Hipotesis
Berdasarkan perumusan masalah, tujuan dan manfaat penelitian di atas maka hipotesis yang dikemukakan adalah konsentrasi tembaga yang berbeda pada media akan memberikan respons yang berbeda terhadap respons hematologi, akumulasi Cu, tingkat kelangsungan hidup dan pertumbuhan juvenil ikan patin (Pangasius sp).
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari hingga Maret 2014 di Laboratorium Lingkungan Akuakultur Departemen Budidaya Perairan (BDP) IPB. Analisis respons hematologi dilakukan di Laboratorium Kesehatan Ikan BDP IPB. Analisis bioakumulasi tembaga dilakukan di Laboratorium Ilmu Nutrisi Ternak Perah dan Laboratorium Kimia Bersama IPB.
Prosedur Penelitian
Uji Toksisitas Akut
Uji ini menggunakan akuarium berukuran 30x40x50 cm3. Ikan uji adalah juvenil ikan patin (Pangasius sp) dengan panjang total 11±1 cm dan bobot 13±0,97 gram. Padat tebar ikan uji adalah 10 ekor per akuarium. Bahan pencemar yang digunakan adalah Tembaga(II) Sulfat Anhidrat (CuSO4).
Tujuan uji ini adalah untuk mengetahui toksisitas akut tembaga yang dinyatakan oleh nilai lethal median concentration (LC50). Nilai LC50 adalah nilai yang dapat mematikan 50% jumlah ikan uji. Nilai LC50 Cu yang lazim digunakan sebagai konsentrasi pada uji toksisitas sublethal adalah LC50 -96 jam (Singh et al.
2008; Monteiro et al. 2012; Nekoubin et al. 2012). Ikan patin merupakan keluarga
4
Olaifa et al. (2004). Uji ini terdiri atas 4 perlakuan dan 1 kontrol dengan 2 ulangan. Konsentrasi tembaga yang digunakan yaitu K (kontrol), A (0,2), B (0,7), C (1,2) dan D (1,7) ppm. Perhitungan konsentrasi larutan uji mengacu pada persamaan berikut:
V1 N1 = V2 N2 Keterangan :
N1 : Konsentrasi tembaga dalam larutan stok (mg l-1) V1 : Volume larutan stok yang akan diambil (ml)
N2 : Konsentrasi tembaga yang diinginkan dalam media air (mg l-1) V2 : Volume media air penelitian yang diinginkan (ml)
Selama uji dilakukan pergantian air 100% setiap 12 jam dengan sistem flow-through. Jumlah konsentrasi Cu sama setiap pergantian air. Selama uji tidak dilakukan pemberian pakan. Parameter yang diukur adalah mortalitas ikan yang dihitung pada jam ke- 0, 6, 12, 18, 24 dan selanjutnya dilakukan perhitungan setiap 12 jam sekali sampai jam ke- 96.
Salah satu parameter pengamatan pada uji toksisitas akut adalah gejala klinis toksisitas dengan indikator pengamatan tingkah laku ikan uji meliputi pola gerak renang dan refleksi (normal, diam di dasar, ke permukaan, tidak seimbang, atau kehilangan gerak reflek). Metode skoring adalah teknis analisis data kuantitatif yang digunakan untuk memberikan nilai pada masing-masing karakteristik parameter dari sub-sub variabel agar dapat dihitung nilainya serta dapat ditentukan peringkatnya (Powers dan Xie 2008). Metode skoring pada penilaian gejala klinis toksisitas akut pada akuakultur belum pernah dilakukan. Pada penelitian ini dilakukan skoring terhadap gejala klinis toksisitas akut melalui nilai yang disebut Indeks Toksisitas Akut (ITA).
Tabel 1 Skoring gejala klinis toksisitas akut
5 Tingkat toksisitas dari gejala klinis toksisitas akut diklasifikasikan menjadi 4 kategori, interval antar kategori diperoleh dengan menggunakan rumus interval yaitu :
� =�� �� ��∑ �
Sehingga indeks toksisitas akut (ITA) dikategorikan menjadi : Sangat Tinggi : ITA > 15
Tinggi : 10 < ITA ≤ 15 Sedang 5 < ITA ≤ 10 Rendah : ITA < 5
Untuk dapat menentukan nilai LC50 dilakukan analisis probit dengan SPSS 18.0. Analisis probit adalah suatu cara transformasi statistik dari data persentase kematian ke dalam varian yang disebut probit dan kemudian digunakan untuk menentukan fungsi regresi probit dengan log konsentrasi agar dapat mengestimasi LC50. Hasil perhitungan LC50 dilanjutkan dengan mengklasifikasikan dalam kategori tingkat toksisitas berdasarkan kriteria toksisitas yang dikeluarkan oleh Komisi Pestisida Departemen Pertanian yaitu :
Sangat tinggi : LC50 < 1 ppm
Tinggi : 1 ppm < LC50 ≤ 10 ppm Sedang : 10 ppm < LC50 ≤ 100 ppm Rendah : LC50 > 100 ppm
Uji Toksisitas Sublethal
Uji ini menggunakan akuarium berukuran 100x50x50 cm3. Ikan uji adalah juvenil ikan patin (Pangasius sp) dengan panjang total 11±1,7 cm dan bobot 13±2,72 gram. Padat penebaran ikan uji adalah 20 ekor per akuarium. Sistem pemeliharaan dilengkapi dengan aerasi. Pemberian pakan tiga kali sehari secara at satiation. Penggantian air 75% dengan konsentrasi Cu yang sama dilakukan setiap dua hari dengan sistem flow-through. Ikan dipelihara selama empat minggu. Sampling dilakukan setiap tujuh hari. Rancangan penelitian menggunakan rancangan acak lengkap (RAL) dengan perlakuan konsentrasi Cu berbeda. Setiap perlakuan memiliki tiga ulangan.
Tabel 2 Perlakuan uji sublethal tembaga pada juvenil ikan patin
Perlakuan Keterangan Nilai Konsentrasi
K Tanpa Penambahan Cu 0 ppm
A Cu dengan konsentrasi 25% dari LC50-96jam 0,167 ppm B Cu dengan konsentrasi 50% dari LC50-96jam 0,334 ppm C Cu dengan konsentrasi 75% dari LC50-96jam 0,500 ppm
Parameter Pengamatan Respons Hematologi
6
kadar Cu dalam darah dapat menyebabkan anemia hemolitik, yaitu peningkatan terjadinya lisis pada membran sel darah merah (Dethloff et al. 2001), penghambatan sintesis hemoglobin (Pamila et al. 1991) dan menurunkan hematokrit (Georgieva et al. 2010). Leukosit berperan dalam sistem kekebalan tubuh. Perubahan yang diamati dalam parameter hematologi dapat digunakan sebagai indikator stres yang diakibatkan oleh peningkatan kadar tembaga (Ciji dan Nandan 2014).
Prosedur analisis hematologi dapat dilihat pada Lampiran 1 dengan pengamatan dan pengukuran respons hematologi terdiri atas:
a. Hemoglobin: metode yang digunakan metode sahli dengan sahlinometer (Wedemeyer dan Yasutake 1977).
b. Hematokrit adalah perbandingan antara volume sel darah dengan total volume darah (Anderson dan Siwicki 1993).
� � = �� �ℎ
� �� �ℎ ×
c. Jumlah eritrosit
Σ eritrosit = Σ sel terhitung x 104 sel/mm3 (Blaxhall dan Daisley 1973)
d. Jumlah leukosit
Σ Leukosit = Σ sel terhitung x 50 sel/mm3 (Blaxhall dan Daisley 1973)
Kandungan Cu di Air dan Ikan
Kandungan Cu dianalisis dengan menggunakan spektrofotometer serapan atom (Atomic Absorption Spectrophotometer) (SNI 6989.6:2009). Prinsip analisisnya berdasarkan Hukum Lambert-Beert yaitu banyaknya sinar yang diserap berbanding lurus dengan kadar zat. Persamaan garis antara konsentrasi logam dengan absorbansi adalah persamaan linier dengan koefisien arah positif: Y = a + bX. Cara kerjanya yaitu berdasarkan atas penguapan larutan sampel yang kemudian logam terkandung didalamnya diubah menjadi atom bebas. Atom tersebut mengabsorpsi radiasi dari sumber cahaya dari lampu katoda (Hollow Cathode Lamp) yang mengandung unsur target. Banyaknya penyerapan radiasi kemudian diukur pada panjang gelombang tertentu menurut jenis logamnya. Pada ikan, kandungan Cu diuji pada hati, insang, kulit dan daging. Sebelum dianalisis dengan Atomic Absorption Spectrophotometer (AAS), tiap sampel organ mengalami proses destruksi hingga menjadi larutan sampel. Prosedur destruksi sampel dapat dilihat pada Lampiran 2.
Faktor Konsentrasi
Faktor konsentrasi (FK) merupakan rasio kadar logam dalam tubuh ikan dengan kadar logam dalam air. Kumar dan Achyuthan (2007) menyampaikan bahwa faktor konsentrasi digunakan untuk menghitung perkiraan jumlah masukan logam dari lingkungan sekitar dan dirumuskan sebagai berikut :
�K = Kadar Cu pada ikan ppmKadar Cu dalam air ppm
Hasil perhitungan FK dilanjutkan dengan mengklasifikasikan dalam kategori tingkat akumulasi berdasarkan Van Esch (1977) yaitu :
7
Tingkat Kelangsungan Hidup (KH)
Ikan yang dipelihara diamati setiap hari. Ikan yang mati dikeluarkan dari wadah uji, dicatat dan tidak dilakukan pergantian ikan. Tingkat kelangsungan hidup ikan dihitung dengan rumus berikut (Steffens 1989) :
� % =� � Keterangan =
KH = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan yang hidup pada waktu t
N0 = Jumlah ikan yang hidup pada awal penelitian Laju Pertumbuhan Spesifik (LPS)
Data laju pertumbuhan ikan uji diperoleh dengan melakukan pengambilan ikan uji pada awal dan akhir penelitian, kemudian ditimbang beratnya. Laju pertumbuhan dianalisis dengan menggunakan rumus berdasarkan Effendie (1979):
� = √� − ×
dengan =
α = laju pertumbuhan spesifik (%)
Wt = bobot rata-rata individu pada waktu t (g) Wo = bobot rata-rata individu pada waktu t0 (g) t = lama waktu pemeliharaan (hari)
Konversi Pakan (KP)
Konversi pakan dihitung dengan rumus berikut (Steffens 1989) :
�� % = �
− − ×
Keterangan =
KP = Konversi pakan (%)
F = Jumlah pakan yang diberikan (g)
Wt = Bobot total ikan pada akhir pemeliharaan (g) Wd = Bobot total ikan yang mati selama pemeliharaan (g) W0 = Bobot total ikan pada awal pemeliharaan (g)
Fisika Kimia Air
Tabel 3 Analisis parameter fisika kimia air pada uji toksisitas sublethal
Parameter Satuan Alat
Suhu 0C Termometer
DO mg l-1 DO meter
pH - pH meter
Alkalinitas mg l-1 Titrasi
Kesadahan mg l-1 Titrasi
8
Analisis Data
Data yang diperoleh ditabulasi dan dianalisis menggunakan program Microsoft Excel 2013 dan SPSS 18.0, yang meliputi Analisis Ragam (ANOVA) dengan uji F pada selang kepercayaan 95%, untuk menentukan ada atau tidaknya pengaruh perlakuan terhadap respons hematologi, kandungan Cu pada ikan, laju pertumbuhan, konversi pakan dan tingkat kelangsungan hidup. Apabila berpengaruh nyata, untuk melihat perbedaan antar perlakuan, diuji lanjut menggunakan uji Duncan. Data fisika kimia air dianalisis secara deskriptif menggunakan tabel.
3
HASIL DAN PEMBAHASAN
Hasil Toksisitas Akut
Hasil uji toksisitas akut pengaruh Cu terhadap tingkat mortalitas juvenil ikan patin (Pangasius sp) dengan 5 konsentrasi berbeda diperoleh hasil sebagai berikut: Gejala Klinis Toksisitas Akut
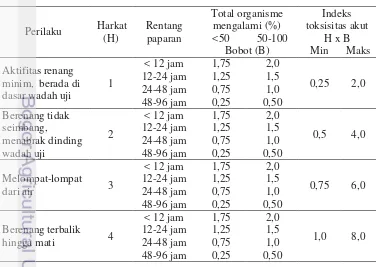
Tabel 4 Indeks toksisitas akut juvenil ikan patin pada uji toksisitas akut
Perilaku Perlakuan (ppm)
0,208 0,706 1,205 1,705 1. Aktifitas renang minim,
berada di dasar wadah uji 0,5 1,0 2,0 2,0 2. Berenang tidak seimbang,
menabrak dinding wadah uji 0,5 1,5 3,0 3,0 3. Melompat-lompat dari air 0,75 3,0 4,5 4,5 4. Berenang terbalik hingga mati 1,0 2,0 2,0 6,0
Total indeks 2,75 7,5 11,5 15,5
Kategori Rendah Sedang Tinggi Sangat
tinggi
Toksisitas Akut Tembaga
9 Tabel 5 Persentase mortalitas juvenil ikan patin dalam waktu 24 hingga 96 jam
akibat pengaruh konsentrasi Cu berbeda Konsentrasi Cu
(ppm)
Mortalitas (%)
24 Jam 48 Jam 72 Jam 96 Jam
0 0 0 0 0
0,208 0 0 10 10
0,706 0 0 30 55 ± 0,071
1,205 5 ± 0,071 35 ± 0,071 80 ± 0,141 95 ± 0,071 1,705 5 ± 0,071 95 ± 0,071 100 100
Hasil analisis probit SPSS 18.0, nilai LC50 Cu untuk juvenil ikan patin dapat dilihat pada Tabel 5 berikut.
Tabel 6 Nilai LC50 Cu pada juvenil ikan patin
LC50 Konsentrasi (ppm) 95% confidence limits
24 Jam 3,244
48 Jam 1,306 1,182 – 1,430
72 Jam 0,855 0,712 – 1,011
96 Jam 0,667 0,539 – 0,805
Salah satu faktor yang mempengaruhi tingkat toksisitas logam adalah spesies yang berbeda. Gambar 1 menunjukkan perbandingan nilai LC50 -96 jam Cu pada juvenil ikan air tawar.
Gambar 1 Nilai LC50 -96 jam Cu pada juvenil ikan air tawar (Olaifa et al. 2004; Monteiro et al. 2012; Nekoubin et al. 2012)
Uji Toksisitas Sublethal
Uji toksisitas sublethal dilakukan selama empat minggu, bertujuan untuk mengetahui pengaruh Cu terhadap respons hematologi, akumulasi Cu pada organ, tingkat kelangsungan hidup dan pertumbuhan juvenil ikan patin.
Respons Hematologi
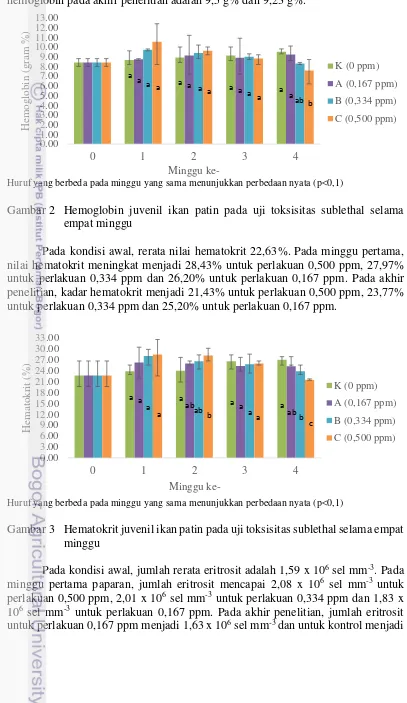
Hasil penelitian menunjukkan bahwa pada minggu pertama paparan, kadar hemoglobin pada perlakuan 0,500 ppm dan 0,334 ppm meningkat dari rerata kadar hemoglobin 8,4 g% pada kondisi awal menjadi 10,53 g% dan 9,73 g%. Pada akhir
0,667
0,670
1,207
1,717
Pangasius sp C. gariepinus
Nile Tilapia Grass Carp
Nilai LC50 -96 jam (ppm)
10
penelitian, kadar hemoglobin menjadi 7,57 g% untuk perlakuan 0,500 ppm dan 8,30 g% untuk perlakuan 0,334 ppm. Pada perlakuan kontrol dan 0,167 ppm, kadar hemoglobin pada akhir penelitian adalah 9,5 g% dan 9,23 g%.
Huruf yang berbeda pada minggu yang sama menunjukkan perbedaan nyata (p<0,1)
Gambar 2 Hemoglobin juvenil ikan patin pada uji toksisitas sublethal selama empat minggu
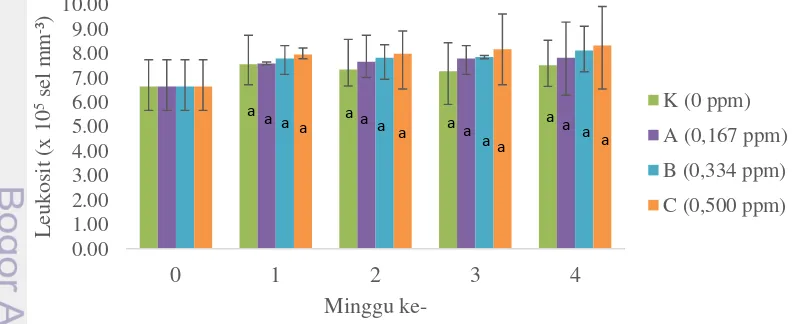
Pada kondisi awal, rerata nilai hematokrit 22,63%. Pada minggu pertama, nilai hematokrit meningkat menjadi 28,43% untuk perlakuan 0,500 ppm, 27,97% untuk perlakuan 0,334 ppm dan 26,20% untuk perlakuan 0,167 ppm. Pada akhir penelitian, kadar hematokrit menjadi 21,43% untuk perlakuan 0,500 ppm, 23,77% untuk perlakuan 0,334 ppm dan 25,20% untuk perlakuan 0,167 ppm.
Huruf yang berbeda pada minggu yang sama menunjukkan perbedaan nyata (p<0,1)
Gambar 3 Hematokrit juvenil ikan patin pada uji toksisitas sublethal selama empat minggu
Pada kondisi awal, jumlah rerata eritrosit adalah 1,59 x 106 sel mm-3. Pada minggu pertama paparan, jumlah eritrosit mencapai 2,08 x 106 sel mm-3 untuk perlakuan 0,500 ppm, 2,01 x 106 sel mm-3 untuk perlakuan 0,334 ppm dan 1,83 x 106 sel mm-3 untuk perlakuan 0,167 ppm. Pada akhir penelitian, jumlah eritrosit untuk perlakuan 0,167 ppm menjadi 1,63 x 106 sel mm-3 dan untuk kontrol menjadi
11 1,71 x 106 sel mm-3. Pada perlakuan 0,334 dan 0,500 ppm, jumlah eritrosit pada akhir penelitian menjadi 1,41 x 106 sel mm-3 untuk perlakuan 0,500 ppm dan 1,53 x 106 sel mm-3 untuk perlakuan 0,334 ppm.
Huruf yang berbeda pada minggu yang sama menunjukkan perbedaan nyata (p<0,1)
Gambar 4 Eritrosit juvenil ikan patin pada uji toksisitas sublethal selama empat minggu
Hasil penelitian menunjukkan bahwa empat minggu paparan Cu telah meningkatkan jumlah leukosit. Selama empat minggu paparan, pengaruh lanjut toksisitas tembaga pada semua perlakuan uji meningkatkan jumlah leukosit dari 6,65 x 105 sel mm-3 pada kondisi awal menjadi 8,33 x 105 sel mm-3 untuk perlakuan 0,500 ppm, 8,13 x 105 sel mm-3 untuk perlakuan 0,334 ppm dan 7,82 x 105 sel mm-3 untuk perlakuan 0,167 ppm.
Huruf yang berbeda pada minggu yang sama menunjukkan perbedaan nyata (p<0,1)
Gambar 5 Leukosit juvenil ikan patin pada uji toksisitas sublethal selama empat minggu
Hasil analisis statistik menunjukkan bahwa pengaruh lanjut toksisitas Cu pada konsentrasi yang lebih tinggi secara nyata dapat menurunkan kadar
12
hemoglobin, hematokrit dan jumlah eritrosit. Analisis sidik ragam dan uji lanjut respons hematologi dapat dilihat pada Lampiran 4.
Akumulasi Cu pada Ikan
Pengukuran Cu pada ikan dilakukan pada semua perlakuan dan kontrol meliputi hati, insang, kulit dan daging dengan menggunakan metode AAS (Atomic Absorption Spectrophotometry).
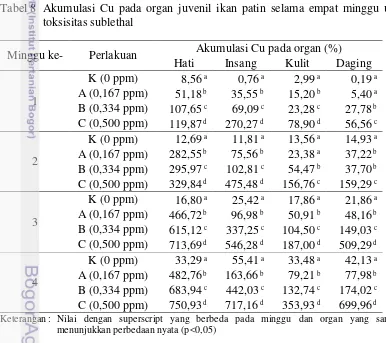
Tabel 7 Kadar Cu pada organ juvenil ikan patin sebelum uji toksisitas sublethal Organ Kadar Cu (mg kg-1 bobot basah)
Minggu ke- Perlakuan Akumulasi Cu pada organ (%) Hati Insang Kulit Daging
13 dan 0.334 ppm berturut-turut adalah 163,66% dan 442,03%. Pada perlakuan 0,500 ppm, minggu ke-1 dan ke-2, akumulasi Cu pada insang menjadi yang tertinggi dibandingkan dengan hati. Pada minggu ke-3 dan ke-4, insang menjadi organ dengan akumulasi tertinggi ke-2 setelah hati. Akumulasi Cu pada insang untuk perlakuan 0,500 ppm pada akhir penelitian adalah 717,16%.
Pada kulit, akumulasi tertinggi pada akhir penelitian juga terdapat pada perlakuan 0,500 ppm yaitu 353,93%. Pada akhir penelitian, akumulasi Cu pada kulit perlakuan 0,167 ppm dan 0,334 ppm berturut-turut adalah 79,21% dan 132,74%. Pada akhir penelitian, akumulasi Cu tertinggi pada daging terdapat pada perlakuan 0,500 ppm yaitu 746,99%. Pada akhir penelitian, akumulasi Cu pada daging ikan uji perlakuan 0,167 ppm dan 0,334 ppm berturut-turut adalah 77,98% dan 174,02%. Hasil analisis statistik menunjukkan bahwa pengaruh lanjut toksisitas Cu pada konsentrasi yang lebih tinggi secara nyata dapat meningkatkan akumulasi Cu dalam organ juvenil ikan patin. Analisis sidik ragam dan uji lanjut akumulasi Cu pada organ juvenil ikan patin dapat dilihat pada Lampiran 5.
Faktor Konsentrasi
Tabel 9 Faktor konsentasi Cu pada organ juvenil ikan patin selama empat minggu uji toksisitas sublethal
Organ Perlakuan Faktor konsentrasi minggu ke-
1 2 3 4
Hati
A (0,167 ppm) 151,0258 434,7709 529,7859 638,8470 B (0,334 ppm) 103,0719 196,0768 334,4877 365,9216 C (0,500 ppm) 68,8834 139,6626 259,2042 282,6691 Insang
A (0,167 ppm) 10,1561 14,9622 13,8034 21,6456 B (0,334 ppm) 6,2854 7,5216 15,3258 18,9500 C (0,500 ppm) 8,6877 14,0084 15,4241 25,9783 Kulit
A (0,167 ppm) 7,9842 9,7316 9,7635 13,6172 B (0,334 ppm) 4,2334 5,2895 6,6196 7,5235 C (0,500 ppm) 3,8813 5,7696 6,3291 10,4384 Daging
A (0,167 ppm) 2,8835 4,2757 3,8127 5,3677 B (0,334 ppm) 1,7420 1,8721 3,1982 3,5106 C (0,500 ppm) 1,3495 2,3140 5,3313 7,7282 Tingkat Kelangsungan Hidup (KH)
14
Huruf yang berbeda menunjukkan perbedaan nyata (p<0,05)
Gambar 6 Tingkat kelangsungan hidup juvenil ikan patin pada uji sublethal selama empat minggu
Laju Pertumbuhan Spesifik (LPS) dan Konversi Pakan (KP)
Pengaruh paparan sublethal tembaga terhadap bobot rata-rata, laju pertumbuhan spesifik juvenil dan konversi pakan pada akhir penelitian secara statistik menunjukkan perbedaan nyata antar perlakuan (Tabel 10). Analisis sidik ragam dan uji lanjut bobot rata-rata dan laju pertumbuhan spesifik juvenil ikan patin dan konversi pakan pada akhir penelitian dapat dilihat pada Lampiran 7.
Tabel 10 Bobot rata-rata, laju pertumbuhan spesifik dan konversi pakan pada akhir penelitian
Perlakuan Parameter
Bobot rata-rata (g) LPS (%) KP (%) K (0 ppm) 19,39±1,64a 1,39±0,19a 1,34±0,09a A (0,167 ppm) 16,44±1,65b 0,76±0,14b 2,55±0,13a B (0,334 ppm) 13,33±1,42c 0,07±0,23c 38,52±3,54b
C (0,500 ppm) - -
Keterangan : huruf superscript yang berbeda pada kolom yang sama menunjukkan beda nyata antar perlakuan (p<0,05)
Kualitas Air
15
Tabel 11 Parameter kualitas air pada uji sublethal selama empat minggu
Perlakuan
aMenurut Boyd (1982), bMenurut Chapman (1992), cMenurut Boyd (1988)
Pembahasan
Kontak langsung dengan Cu pada uji toksisitas akut, juvenil ikan patin menunjukkan aktivitas renang yang minim dan lebih banyak di dasar wadah uji. Menurut Hansen et al. (1999), kontak langsung dengan Cu dapat merusak sistem sensorik penciuman ikan. Tilton et al. (2008) mengungkapkan bahwa Cu menekan transkripsi gen dalam jalur transduksi sinyal penciuman. Pada rentang 24 jam paparan, ikan berenang tidak seimbang tanpa arah dan menabrak-nabrak dinding wadah uji. Baldwin et al. (2003) menjelaskan bahwa sistem sensorik lain ikan yaitu gurat sisi (lateral line), juga merupakan target dari efek neurotoksik Cu. Gurat sisi ini terdiri dari neuron mechanosensory (sel-sel rambut) yang merespon getaran permukaan air, aliran dan jenis-jenis isyarat mekanis dalam lingkungan air.
Pada rentang 48 jam paparan, abnormalitas perilaku ikan semakin terlihat dimana ikan melompat-lompat dari air hingga akhirnya berenang dalam posisi terbalik hingga mati. Pada banyak hewan air, Cu menyebabkan toksisitas dengan merusak osmoregulasi dan regulasi ion dalam insang (Blanchard dan Grosell 2005; McIntyre et al. 2008). Tingginya konsentrasi tembaga di perairan menyebabkan gangguan pada sistem pernapasan ikan. Tembaga dapat menurunkan penyerapan Na+ dengan menghambat NA+/K+ ATPase, menurunkan penyerapan Cl- pada aktivitas karbonik anhidrase, menyebabkan gangguan pertukaran ion dan menghambat ekskresi NH3 yang bersifat racun bagi tubuh (Blanchard 2009).
16
Parameter darah merupakan suatu indikator adanya perubahan kondisi kesehatan ikan, baik karena faktor infeksi (mikroorganisme) maupun karena faktor non infeksi oleh lingkungan, genetik dan nutrisi. Kemampuan darah untuk mengangkut oksigen bergantung pada kadar hemoglobin (Hb) dalam darah (Lagler
et al. 1977). Hematokrit merupakan perbandingan antara sel darah merah dan plasma darah. Kadar hematokrit bervariasi tergantung pada faktor nutrisi, umur ikan, jenis kelamin, ukuran tubuh dan masa pemijahan (Wells et al. 2005). Nilai hematokrit ikan teleost yang normal berkisar antara 20 – 30% dan untuk beberapa spesies laut berkisar 42% (Bond 1979). Nabib dan Pasaribu (1989) menyatakan bahwa nilai hematokrit dibawah 30% menunjukkan defisiensi eritrosit. Sedangkan Galaugher et al. (1995) menyatakan bahwa nilai hematokrit yang lebih kecil dari 22% menunjukkan ikan mengalami anemia. Eritrosit pada ikan merupakan sel yang terbanyak yang berfungsi sebagai transport oksigen. Pada ikan teleost, jumlah normal eritrosit adalah 1,05 x 106 – 3,0 x 106 sel mm-3 (Roberts 1978). Leukosit berjumlah lebih sedikit dibandingkan dengan eritrosit. Leukosit berperan dalam sistem kekebalan tubuh untuk mempertahankan tubuh terhadap penyakit dan material asing yang masuk dalam tubuh.
Terjadinya peningkatan sementara kadar hemoglobin dilaporkan pada trout yang terpapar 26,9 μgCu l-1 pada tiga hari dari paparan awal yang kemudian kembali normal 14 hari setelah terpapar (Dethloff et al. 2001). Georgieva et al.
(2010) melaporkan terjadinya anemia karena penurunan kadar hemoglobin dan hematokrit pada paparan tiga konsentrasi tembaga sulfat pada Crucian carp,
Carassius gibelio. Menurut Pamila et al. (1991), penurunan kadar hemoglobin pada ikan yang terpapar suatu zat beracun juga bisa disebabkan oleh efek penghambatan zat beracun tersebut pada sistem enzim yang bertanggung jawab untuk sintesis hemoglobin. Yu dan Resnick (1997) menyatakan bahwa tembaga memiliki peran dalam aktivitas ferrireductase, pengikatan besi (Fe) pada sintesis hemoglobin. Namun Ciji dan Nandan (2014) menyatakan tingginya konsentrasi Cu menekan penyerapan logam lain pada usus, termasuk Fe sehingga rendahnya Fe yang terserap mengakibatkan penurunan aktivitas ferrireductase dan berdampak pada penghambatan sintesis hemoglobin. Penurunan kadar hemoglobin menandakan bahwa kemampuan ikan untuk menyediakan oksigen yang cukup bagi jaringan tubuh mengalami keterbatasan sehingga menghasilkan penurunan aktivitas fisik (Wepener et al. 1992).
Paparan tembaga berkepanjangan pada ikan sebagai stresor memiliki kemungkinan menyebabkan ketidakseimbangan osmotik dan mengubah sistem regulasi pertukaran ion, yang akhirnya mengurangi pH darah dan volume eritrosit dan kemudian menurunkan hematokrit (Vosyliene 1999). Pada ikan mas, Cyprinus carpio (Witeska 2005) dan Prochilodus lineatus (Carvalho dan Fernandes 2006) paparan tembaga menyebabkan perubahan pada darah, ditandai dengan peningkatan kadar hemoglobin, hematokrit dan sel darah merah. Ozcelik (2002) menyatakan bahwa paparan sublethal tembaga menyebabkan haematopoietic
memanen sel darah yang masih muda sehingga meningkatkan kadar sel darah merah pada sirkulasi darah.
17 mekanisme adaptasi menghadapi stres akibat toksikan adalah meningkatnya aktivitas SOD guna menetralisir radikal bebas hidroksil oksigen. Namun produk akhir yang dihasilkan berupa H2O2 justru mampu mengoksidasi membran sel darah merah yang menyebabkan lisisnya membran sel darah merah atau anemia hemolitik (Dethloff et al. 2001). Anemia hemolitik menyebabkan penurunan jumlah sel darah merah dan hematokrit (Omoniyi et al. 2002). Khangarot dan Tripathi (1991) mengaitkan penurunan jumlah eritrosit dengan krisis hemolitik yang mengakibatkan anemia berat pada ikan terpapar Cu. Singh et al. (2008) mencatat bahwa jumlah eritrosit, kadar hemoglobin dan hematokrit secara signifikan menurun pada Channa punctatus pada paparan tembaga sulfat. Penurunan signifikan parameter hematologis karena meningkatnya jumlah sel darah merah yang hancur (Omoniyi et al. 2002; Kori-Siakpere Ovie et al. 2009) atau
haemodilution (Adeyemo 2005) atau kerusakan pada sistem haematopoietic (Gill dan Epple 1993).
Kenaikan leukosit yang tertinggi terjadi pada minggu pertama diduga merupakan respon protektif ikan untuk memerangi stres yang disebabkan oleh keracunan logam. Mekanisme pertahanan internal dari ikan telah bekerja untuk melawan infeksi / invasi asing dengan penambahan limfosit lebih banyak dalam sirkulasi (Gupta et al. 2013). Jumlah leukosit yang tinggi menunjukkan kerusakan akibat infeksi jaringan tubuh, stres fisik yang parah dan leukemia. Gambar 2 menunjukkan semakin tinggi konsentrasi Cu yang dipaparkan, jumlah leukosit juga ikut meningkat.
Selama empat minggu paparan, peningkatan yang terjadi pada minggu pertama paparan dapat diindikasikan sebagai respons stres ikan seperti yang dinyatakan oleh Wells et al. (2005), kadar tinggi menunjukkan bahwa ikan sedang berada dalam kondisi stres. Jumlah eritrosit, hemoglobin dan hematokrit pada penelitian ini masih berada pada batas jumlah parameter hematologi ikan secara umum menurut Roberts (1978) dan Bond (1979). Namun penurunan yang konsisten terjadi terhadap jumlah eritrosit, hemoglobin dan hematokrit mengindikasikan apabila paparan sublethal tembaga terjadi lebih dari empat minggu diduga dapat mengakibatkan anemia seperti yang telah dilaporkan oleh Singh et al. (2008).
Tembaga yang terdeteksi pada kondisi awal sebelum paparan sublethal memperkuat fakta bahwa Cu merupakan elemen penting untuk semua sel eukariotik karena Cu memainkan peran penting dalam proses biokimia (Urani et al. 2001) dan diperlukan untuk pertumbuhan dan metabolisme semua organisme (ICA 1995; Eisler 1998). Kebutuhan Cu pada organisme hidup termasuk pematangan sel, struktur dan fungsi, pembentukan jaringan ikat, struktur normal dan respirasi di mitokondria, dan perannya sebagai faktor dalam pembentukan kapiler baru (ICA 1995).
Hasil akhir penelitian menunjukkan akumulasi Cu tertinggi berada dalam hati. Ini memperkuat fakta bahwa hati memainkan peran utama dalam homeostasis Cu dan detoksifikasi serta penyimpanan dengan memproduksi metallothionein, sel yang berperan mengikat logam berat dan detoksifikasi pada ikan (Heath 1995; Olsson 1998). Perkins et al. (1997) mengamati pola yang sama dalam metallothionein dan akumulasi Cu di hati (koefisien korelasi 78%) pada channel catfish setelah 10 minggu paparan tembaga sulfat.
18
hasil penelitian Gbem et al. (2001) yang mengamati hubungan antara akumulasi, konsentrasi dan lama paparan Cu dalam hati dan insang Clarias gariepinus terpapar konsentrasi sublethal limbah penyamakan kulit yang mengandung Cr, Cu, Pb dan Zn. Penggunaan air sebagai media pelarut Cu menjadikan insang memiliki peranan besar dalam penyerapan Cu. Insang berfungsi sebagai area penyerapan logam terlarut dan organ pernapasan, maka organ ini adalah pintu utama masuknya zat terlarut (Olsson 1998). Insang juga memiliki membran epitel yang sangat tipis, dan area permukaan yang luas, hal yang memudahkan terserapnya bahan dari air dan tertransfer ke darah (Heath 1995).
Tembaga masuk dalam tubuh dapat melalui proses pencernaan maupun absorpsi oleh insang dan kulit (Romanenko et al. 1986). Terlepas dari fungsi ini, kulit juga berperan dalam melepaskan logam dari tubuh ikan dan oleh sebab itu dapat memberikan indikasi mengenai tingkatan atau konsentrasi logam dalam suatu lingkungan tempat hidup ikan tersebut (Bezuidenhout et al. 1990). Perbedaan tingkat akumulasi pada organ yang berbeda dari ikan dapat dikaitkan dengan perbedaan peran fisiologis masing-masing organ. Konsentrasi logam dalam hati (tidak bersentuhan langsung dengan logam dalam air) memainkan peran utama dalam detoksifikasi serta penyimpanan, karena itu akan berbeda dengan konsentrasi pada insang dan jaringan kulit (dalam kontak langsung dengan logam dalam air) yang berperan dalam penyerapan dan ekskresi logam (Kotze et al. 1999).
Bahan kimia yang terserap ke dalam tubuh biasanya terikat dengan protein dan kemudian diangkut oleh darah ke salah satu titik penyimpanan seperti lemak atau ke hati untuk transformasi dan/atau penyimpanan (Heath 1995; Nussey et al.
1999). Jika diubah oleh hati, senyawa baru dapat disimpan di hati, diekskresikan dalam empedu, atau diteruskan kembali ke dalam darah untuk diekskresikan oleh ginjal atau insang, atau disimpan dalam jaringan ekstrahepatik seperti lemak (Goyer 1996; Olsson 1998).
Faktor konsentrasi (FK) merupakan rasio kadar logam dalam tubuh ikan dengan kadar logam dalam air. Faktor konsentrasi disebut juga enrichment factor atau indeks untuk mengevaluasi toksisitas logam yang terakumulasi dalam tubuh organisme air (Yumiarti et al. 1996). Berdasarkan Tabel 9 dapat diketahui nilai FK tertinggi terdapat pada hati dengan kisaran antara 282,6691 – 638,847 di akhir penelitian. Berdasarkan kategori FK Van Esch (1977) tingkat akumulasi Cu pada hati termasuk dalam akumulasi sedang dengan nilai FK sebesar 100 < FK ≤ 1000. Sementara nilai FK pada insang, kulit dan daging termasuk dalam akumulasi rendah dengan nilai FK < 100.
Hasil penelitian menunjukkan semakin tinggi konsentrasi Cu, maka laju pertumbuhan semakin rendah dan rasio konversi pakan semakin tinggi. Menurut De Boeck et al. (1997), rendahnya pertumbuhan karena paparan Cu disebabkan oleh meningkatnya pengeluaran metabolisme untuk detoksifikasi dan pemeliharaan homeostasis. Besar kecilnya rasio konversi pakan dipengaruhi oleh beberapa faktor diantaranya adalah kualitas dan kuantitas pakan, spesies, ukuran dan kualitas air (NRC 1993). Tingginya konsentrasi Cu pada air diduga menjadi penyebab tingginya rasio konversi pakan karena berdampak pada terkurasnya energi untuk aktivitas detoksifikasi.
19 dikonsumsi adalah kulit dan daging. Melihat nilai kandungan Cu pada kulit dan daging pada penelitian ini, dapat disimpulkan ikan patin masih layak untuk dikonsumsi. Menurut Henny (2011), kandungan Cu pada perairan kolong berkisar antara 0,001-0,11 ppm. Parameter respons hematologi pada penelitian dengan konsentrasi 0,167 ppm menunjukkan terjadinya kenaikan parameter respons hematologi pada minggu pertama, yang menunjukkan gejala stres terpapar Cu. Parameter produksi yang meliputi laju pertumbuhan spesifik dan tingkat kelangsungan hidup, menunjukkan perbedaan yang signifikan dengan kontrol. Demikian pula dengan tingkat akumulasi tembaga pada organ juvenil ikan patin. Hal ini mengindikasikan bahwa, perairan kolong dengan konsentrasi Cu sebesar 0,11 ppm memiliki potensi merugikan apabila digunakan untuk aktivitas budidaya, sehingga apabila perairan ini akan digunakan untuk budidaya maka diperlukan
treatment khusus pada media budidayanya.
4
SIMPULAN DAN SARAN
Simpulan
Tembaga (Cu) dikategorikan sangat toksik terhadap juvenil ikan patin dengan nilai LC50 -96 jam sebesar 0,667 ppm (0,539-0,805 ppm). Pada konsentrasi sublethal, Cu berpengaruh nyata terhadap penurunan sintasan, pertumbuhan, eritrosit, hemoglobin dan hematokrit serta menyebabkan peningkatan pada akumulasi Cu mulai pada konsentrasi 0,167 ppm.
Saran
Perairan kolong dengan kandungan Cu 0,11 ppm memerlukan treatment khusus apabila akan digunakan untuk aktivitas budidaya.
DAFTAR PUSTAKA
Adeyemo OK. 2005. Haematological and histopathological effects of cassava mill effluent in Clarias gariepinus. Afr J Biomed Res. 8:179-183.
Andarani P, Roosmini D. 2009. Profil pencemaran logam berat (Cu, Cr, dan Zn) pada air permukaan dan sedimen di sekitar industri tekstil PT X (sungai Cikijing). Bandung (ID): Fakultas Teknik Sipil dan Lingkungan ITB.
Anderson DP, Siwicki AK. 1993. Basic Hematology and Serology for Fish Health Programs. Asian Fisheries Society. 17 p.
Antognelli C, Romani R, Baldracchini F, De Santis A, Andreani G, Talesa V. 2003. Different activity of glyoxalase system enzymes in specimens of Sparus auratus exposed to sublethal copper concentrations. Chem Biol Interact. 142:297-305.
20
Beaumont MW, Butler PJ, Taylor EW. 2000. Exposure of brown trout, Salmo trutta, to a sublethal concentration of copper in soft acidic water: effects upon muscle metabolism and membrane potential. Aquat Toxicol. 51:259-272. Bezuidenhout LM, Schoonbee HJ, De Wet LPD. 1990. Heavy metal content in
organs of the African sharptooth catfish, Clarias gariepinus (Burchell), from a Transvaal lake affected by mine and industrial effluents. Part 1. Zinc and copper. Water SA. 16(2):125-129.
Blanchard J, Grosell M. 2005. Effects of salinity on copper accumulation in the common killifish (Fundulus heteroclitus). Environ Toxicol Chem. 24(6):1403-1413.
Blanchard J. 2009. Copper toxicity and accumulation: physiology, chemistry and molecular biology [desertasi]. Miami (US): University of Miami.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. J Fish Biology. 5:577-581.
Bond CE. 1979. Biology of Fishes. Philadelphia (US): Saunders College Publishing. 514 p.
Boyd CE. 1982. Water Quality Management for Pond Fish Culture. Amsterdam (NL): Elsevier Scientific Publishing Company.
Boyd CE. 1988. Water Quality in Warmwater Fish Pond. Edisi ke-4. Alabama (US): Agricultural Experiment Station, Auburn University.
Carvalho CS, Fernandes MN. 2006. Effect of temperature on copper toxicity and haematological responses in the Neotropical fish, Prochilodus scrofa at low and high pH. Aquaculture. 251:109-117.
Chapman D. 1992. Water Quality Assessments. London (GB): Chapman and Hall Ltd.
Chen JC, Lin CH. 2001. Toxicity of copper sulfate for survival, growth, molting and feeding of juveniles of the tiger shrimp, Penaeus monodon. Aquaculture. 192(1):55-65.
Ciji PP, Nandan SB. 2014. Toxicity of copper and zinc to Puntius parrah (Day, 1865). Marine Environmental Research. 93:38-46.
De Boeck G, Vlaeminck A, Blust R. 1997. Effects of sublethal copper exposure on copper accumulation, food consumption, growth, energy stores, and nucleic acid content in common carp. Arch Environ Contam Toxicol. 33:415-422. Dethloff GM, Bailey HC, Maier KJ. 2001. Effects of dissolved copper on select
haematological, biochemical, and immunological parameters of wild rainbow trout, Oncorhynchus mykiss. Arch Environ Contam Toxicol. 40:371-380. Eisler R. 1998. Copper hazards to fish, wildlife and invertebrates: A synoptic
review. Biological Science Report 33. Washington DC (US): US Geological Survey, Biological Resources Division. 100 p.
Effendie MI. 1979. Metode Biologi Perikanan. Jakarta (ID): Gramedia Pustaka Utama.
Fitriyah AW, Utomo Y, Kusumaningrum IK. 2013. Analisis kandungan tembaga (cu) dalam air dan sedimen di sungai Surabaya. Malang (ID): Jurusan Kimia FMIPA UNM.
21 Gallaugher PH, Thorarensen H, Ferrel AP. 1995. Hematocrit in oxygen transport and swimming in raibow trout Oncorhyncus mykiss. Respiration Physiology.
102:279-292.
Gbem TT, Balogum JK, Lawal FA, Annune, PA. 2001. Trace metal accumulation in Clarias gariepinus (Teugels) exposed to sublethal levels of tannery effluent.
The Science of the Total Environment. 271:1-9.
Georgieva E, Arnaudov A, Velcheva I. 2010. Clinical, haematological and morphological studies on ex situ induced copper intoxication in crucian carp,
Carassius gibelio. J Cent Eur Agric. 11:165-172.
Gill TS, Epple A. 1993. Stress-related changes in the haematological profile of the American eel, Anguilla rostrata. Ecotoxicol Environ Saf. 25:227-235.
Goyer RA. 1996. Toxic effects of metals. 691-736 p. Di dalam: Klaassen CD, editor. Casarett and Doull’s toxicology: The basic science of poisons. Ed ke-5. New York (US): McGraw-Hill Health Progressions Division.
Gupta K, Sachar A, Raina S. 2013. Haematological response of freshwater fish
Puntius sophore (ham.) to copper exposure. Journal of Scientific and Research. 3(5):1-6.
Halfdanarson TR, Kumar N, Li CY, Phyliky RL, Hogan WJ. 2008. Haematological manifestations of copper deficiency: a retrospective review. Eur J Haematol. 80:523-531.
Handy RD. 2003. Chronic effects of copper exposure versus endocrine toxicity: two sides of the same toxicological process. Comp Biochem Physiol. 135A:25-38. Hansen JA, Rose JD, Jenkins RA, Gerow KG, Bergman HL. 1999. Chinook salmon (Oncorhynchus tshawytscha) and rainbow trout (Oncorhynchus mykiss) exposed to copper : Neurophysiological and histological effects on the olfactory system. Environ Toxicol Chem. 18:1979–1991.
Heath AG. 1995. Water Pollution and Fish Physiology. Ed ke-2. Florida (US): Lewis publishers, Boca Raton. 359 p.
Henny C. 2011. “Kolong” bekas tambang timah di pulau Bangka: permasalahan kualitas air dan alternatif solusi untuk pemanfaatan. Oseanologi dan Limnologi di Indonesia. 37(1):119-138.
Hutagalung H, Nontji A. 1995. Masalah Pesisir dan Kelautan di Teluk Jakarta dan Kaitannya dengan Rencana Reklamasi. Jakarta (ID): PPSML-UI dan BAPPEDA DKI Jakarta.
[ICA] International Copper Association. 1995. The Biological Importance of Copper: a Literature Review. ICA Project 223. 106 p.
Kennedy CJ. 2011. The effects of toxicants on olfaction in fishes. 2078-2083 p. Di dalam: Farrel AP, editor. Encyclopedia of Fish Physiology: From Genome to Environtment. Volume ke-3. London (UK): Academic Press.
Khangarot BS, Tripathi DM. 1991. Changes in humoral and cell-mediated immune responses and in skin and respiratory surfaces of catfish, Saccobranchus fossillis, following copper exposure. Ecotox Environ Safety. 22:291-308. [KKP] Kementrian Kelautan dan Perikanan. 2014. Statistik perikanan budidaya
kolam [Internet]. [diunduh 30 Juni 2014]. Tersedia pada http://sidatik.kkp.go.id.
22
Kori-Siakpere Ovie, Ogbe Gbemi M, Ikomi, Bemigho R. 2009. Haematological response of the African catfish, Clarias gariepinus (Burchell, 1822) to sublethal concentrations of potassium permanganate. Sci Res Essays. 4:457-466.
Kotze P, du Prezz HH, van Vuren JHJ. 1999. Bioaccumulation of copper and zinc in Oreochromis mossambicus and Clarias gariepinus, from the olifants river, Mpumalanga, South Africa. Water SA. 25(1):99-110.
Kumar KA, Achyuthan H. 2007. Heavy metal accumulation in certain marine animals along the east coast of Chennai, Tamil Nadu, India. J of Environ Biol. 28(3):637-643.
Lagler KF, Bardach JE, Miller RR, Passino DRM. Ichthyology. New York (US): John Wiley and Sons Inc.
Lin YH, Shie YY, Shiau SY. 2008. Dietary copper requirements of juvenile grouper
Epinephelus malabaricus. Aquaculture. 274:161-165.
Lushchak VI. 2011. Environmentally induced oxidative stress in aquatic animals.
Aquatic Toxicology. 101:13-30
Mazon AF, Monteiro EA, Pinheiro GH, Fernandes MN. 2002. Hematological and physiological changes induced by short-term exposure to copper in the freshwater fish, Prochilodus scrofa. Braz J Biol. 62:621-631.
McIntyre JK, Baldwin DH, Meador JP, Scholz NL. 2008. Chemosensory deprivation in juvenile coho salmon exposed to dissolved copper under varying water chemistry conditions. Environ Sci Technol. 42(4):1352-1358. Mela M, Guiloski IC, Doria HB, Rabitto IS, da Silva CA, Maraschi AC, Prodocimo
V, Freire CA, Randi MAF, Oliveira Ribeiro CA, Silva de Assis HC. 2013. Risks of waterborne copper exposure to a cultivated freshwater Neotropical catfish (Rhamdia quelen). Ecotoxicol Environ Saf. 88:108-116.
Monteiro SM, Oliveira E, Fontainhas-Fernandes A, Sousa M. 2012. Effects of sublethal and lethal copper concentrations on the gill epithelium ultrastructure of nile tilapia, Oreochromis niloticus. Zoological Studies. 51(7):977-987. Nabib R, Pasaribu FH. 1989. Patologi dan Penyakit Ikan. Departemen Pendidikan
dan Kebudayaan Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. Bogor (ID): UPT Produksi Media Informasi LSI-IPB.
Nekoubin H, Hatefi S, Gharedaashi E, Sudagar M, Asgharimoghadam A. 2012. Effect of sublethal doses of copper on growth performance and survival rate of grass carp (Ctenopharyngodon idella). American-Eurasian J Toxicolog Sci. 4(3):138-142.
[NRC] National Research Council. 1993. Nutrient Requirement of Fishes. Washington DC (US): National Academic of Sciences.
Nussey G, van Vuren JHJ, Du Preez HH. 1999 Bioaccumulation of aluminium, copper, iron and zinc in the tissues of the moggel from Witbank Dam, Upper Olifants River Catchment (Mpumalanga). South African Journal of Wildlife Research. 29(4):130-144.
Olaifa FE, Olaifa AK, Onwude TE. 2004. Lethal and sub-lethal effects of copper to the african catfish (Clarias gariepinus) juveniles. African Journal of Biomedical Research. 7:65-70.
23 Omoniyi I, Agbon AO, Sodunke SA. 2002. Effect of lethal and sub-lethal concentrations of tobacco (Nicotiana tobaccum) leaf dust extract on weight and haematological changes in Clarias gariepinus (Burchell). J Appl Sci Environ Manage. 6:37-41.
Ozcelik D, Toplan S, Ozdemir S, Akyolcu MC. 2002. Effects of excessive copper intake on hematological and hemorheological parameters. Biological Trace Element Research. 89:35-44.
Pamila D, Subbaiyan PA, Ramaswamy M. 1991. Toxic effect of chromium and cobalt on Sarotheredon mossambicus. Ind J Environ Health. 33:218-224. Perkins EJ, Griffin B, Hobbs M, Gollon J, Wolford L, Schlenk D. 1997. Sexual
differences in mortality and sublethal stress in channel catfish following a 10-week exposure to copper sulphate. Aquatic Toxicology. 37:327-339.
Powers DA, Xie Y. 2008. Statistical Methods for Categorical Data Analysis. Bingley (UK): Emerald Group Publishing Limited.
Prasetiyono E. 2012. Pemanfaatan kolong untuk akuakultur: penggunaan kompos untuk meminimalisasi kandungan logam berat timah hitam (Pb) pada media budidaya ikan [tesis]. Bogor (ID): Institut Pertanian Bogor.
Reddy R, Pillai BR. 2006. Bioaccumulation of copper in post-larvae and juveniles of freshwater prawn Macrobrachium rosenbergii (de Man) exposed to sublethal levels of copper sulfate. Aquaculture. 252(2):356-360.
Roberts RJ. 1978. Fish Pathology. London (GB): Balliere Tindall.
Rochyatun E, Rozak A. 2007. Pemantauan kadar logam berat dalam sedimen di perairan teluk Jakarta. Makara Sains. 11(1): 28-36.
Romanenko VD, Malyzheva TD, Yu Yevtushenko N. 1986. The role of various organs in regulating zinc metabolism in fish. Hydrobiol J. 21(3):7-12. Singh D, Nath K, Trivedi SP, Sharma YK. 2008. Impact of copper on
haematological profile of freshwater fish, Channa punctatus. J Environ Biol. 29(2):253-257.
Steffens W. 1989. Principles of Fish Nutritions. Wes Sussex (GB): Horwood Limited. 384 p.
Tilton F, Tilton SC, Bammler TK, Beyer R, Farin F, Stapleton PL, Galagher EP. 2008. Transcription biomarkers and mechanisms of copper-induced olfactory injury in zebrafish. Environ Sci Technol. 42(24):9404-9411.
[USPHS] United States Public Health Services. 2004. Toxicological profile of copper. Atlanta (US): US Department of Health and Human Services. 314 p. Urani C, Melchioretto P, Morazzoni F, Canevali C, Camatini M. 2001. Copper and zinc uptake and hsp70 expression in HepG2 cells. Toxicology in Vitro.
Vosyliene MZ. 1999. The effects of heavy metals on haematological indices of fish.
Acta Zoologica Lituanica Hydrobiologia. 9:76-82.
Watanabe T, Kiron V, Satoh S. 1997. Trace minerals in fish nutrition. Aquaculture.
24
Wedemeyer GA, Yasutake. 1977. Clinical methods for the assessment of the effect of environmental stress on fish health. Technical Paper of The US Department of the Interior Fish and the Wildlife Service. 89:1-17.
Wells RMG, Baldwin J, Seymour RS, Christian K, Britain T. 2005. Blood cell function and haematology in two tropical freshwater fishes from Australia.
Comparative Biochemistry and Physiology. Part A. 141:87-93.
Wepener W, Van Vuren JHJ, Du Preez HH. 1992. Effect of manganese and iron at neutral pH values on the haematology of the banded tilapia, Tilapia sparrmanii. Bull Environ Contam Toxicol. 49:613-619.
Williams TM, Rees J, Setiapermana D. 1997. Land-derived contaminant influent to Jakarta Bay, Indonesia. Vol 1: Geochemistry of marine water and sediment.
Overseas Geology Series. Nottingham (GB): British Geological Survey. Witeska M. 2005. Stress in fish: Haematological and immunological effects of
heavy metals. Electronic J Ichthyol. 1:35-41.
Yu J, Resnick MW. 1998. Influence of copper depletion on iron uptake mediated by sft, a stimulator of fe transport. J of Biol Chemistry. 273:6909-6915. Yumiarti, Mellawati J, Suwirma. 1996. Akumulasi, distribusi dan toksisitas cd
25
LAMPIRAN
Lampiran 1 Prosedur analisis parameter hematologi 1) Penghitungan jumlah sel darah merah (SDM)
Prosedur pengamatan dan penghitungan jumlah SDM pada penelitian ini berdasarkan Blaxhall dan Daisley (1973). Darah diambil dari ikan dengan menggunakan injeksi yang berisi cairan antikoagulan untuk mencegah terjadinya penggumpalan darah. Darah yang tersedot dimasukkan kedalam ependorf, kemudian darah dihisap menggunakan pipet pencampur sampai dengan skala 0,5 dan ditambahkan larutan Hayems yang dihisap dengan pipet yang sama hingga mencapai skala 101. Setelah itu, pipet digoyang membentuk angka delapan selama 3-5 menit. Tetesan pertama dibuang dan tetesan berikutnya diteteskan kedalam hemositometer (haemocytometer) dan ditutup dengan kaca penutup. Penghitungan dilakukan pada 5 kotak kecil yaitu pada sudut kiri atas, sudut kanan atas, sudut kiri bawah, sudut kanan bawah dan pada bagian tengah. Jumlah sel darah merah yang terhitung dikonversikan dengan rumus :
Jumlah sel darah merah = ∑ sel darah merah terhitung x 104 sel mm-3
2) Penghitungan jumlah sel darah putih (SDP)
Prosedur pengamatan dan penghitungan jumlah SDP dilakukan berdasarkan Blaxhall dan Daisley (1973). Metode pengambilan darahnya sama dengan metode pengambilan darah merah. Darah dihisap dengan pipet pencampur sampai dengan skala 11. Jumlah sel darah putih yang terhitung dikonversikan dengan rumus :
Jumlah sel darah putih = ∑ sel darah putih terhitung x 50 sel mm-3 3) Pengukuran kadar hematokrit
Prosedur pengamatan dan penghitungan kadar hematokrit dilakukan menurut Anderson dan Swicki (1993). Menggunakan Microhematocrit method, darah dimasukkan kedalam tabung mikrohematokrit sampai 4/5 bagian. Kemudian salah satu ujung tabung disumbat dengan crestaseal. Darah disentrifuge selama 5 menit. Setelah itu akan terbentuk lapisan-lapisan yang terdiri dari lapisan plasma yang jernih di bagian atas, kemudian lapisan putih abu-abu (buffy coat) yang merupakan trombosit dan leukosit dan lapisan eritrosit yang berwarna merah. Nilai hematokrit ditentukan dengan mengukur persentase volume eritrosit dari darah dengan menggunakan alat ukur panjang (mistar) dan dinyatakan dalam persentase (% Ht).
4) Kadar hemoglobin (Hb)
26
Lampiran 2 Prosedur destruksi sampel (Departemen Pertanian 2005) Sampel ditimbang di erlenmeyer ukuran 100ml atau 125 ml
Ditambah pereaksi HNO3 65% 10 ml dan Asam Perkhlorat 68% sebanyak 2 ml
Didiamkan semalam, ditutup dengan tutup cawan porselen
Keesokan harinya,mulai pemanasan diatas hotplate sampai larut, kurang lebih 4-6 jam
Lalu disaring ke labu takar ukuran 50 ml
27 Lampiran 3 Parameter fisika kimia air setiap minggu pada uji sublethal