PENETAPAN KADAR RIFAMPISIN DAN ISONIAZID
DALAM SEDIAAN TABLET SECARA MULTIKOMPONEN DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
SKRIPSI
OLEH: FAULA HASTIA
NIM 071524024
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENETAPAN KADAR RIFAMPISIN DAN ISONIAZID
DALAM SEDIAAN TABLET SECARA MULTIKOMPONEN DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk meperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: FAULA HASTIA
NIM 071524024
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN SKRIPSI
PENETAPAN KADAR RIFAMPISIN DAN ISONIAZID
DALAM SEDIAAN TABLET SECARA MULTIKOMPONEN DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
OLEH: FAULA HASTIA
NIM 071524024
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal : Desember 2010
Pembimbing I,
(Dra. Salbiah, MSi., Apt.) NIP. 194810031987012001
Pembimbing II,
(Prof. Dr. rer. nat. Effendy De Lux Putra, SU, Apt.)
NIP. 195306191983031001
Medan, Desember 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
(Prof. Dr. Sumadio Hadisahputra, Apt.) NIP. 195311281983031002
Panitia Penguji,
(Dra. Nurmadjuzita, M.Si., Apt.) NIP 194809041974122001
(Dra. Salbiah, MSi., Apt.) NIP. 194810031987012001
(Dra. Sudarmi, MSi., Apt.) NIP. 195409101983032001
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan nikmat,
rahmat, karunia dan ridhoNya, sehingga penulis dapat menyelesaikan skripsi yang
berjudul "Penetapan Kadar Rifampisin dan Isoniazid dalam Sediaan Tablet Secara
Multikomponen dengan Metode Spektrofotometri Ultraviolet". Skripsi ini
diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis hendak menyampaikan rasa hormat dan
terima kasih yang sebesar-besarnya kepada Ibu Dra. Salbiah, M.Si., Apt. dan
Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, SU, Apt. yang telah banyak
memberikan bimbingan dan bantuan selama penelitian dan penulisan skripsi ini
berlangsung. Ucapan terima kasih juga penulis sampaikan kepada Bapak Prof. Dr.
Sumadio Hadisahputra, Apt. selaku Dekan Fakultas Farmasi Universitas Sumatera
Utara dan dosen pembimbing akademik yang telah memberikan fasilitas,
bimbingan dan masukan selama masa pendidikan dan penelitian, juga kepada Ibu
Dra. Nurmadjuzita, M.Si., Apt., Ibu Dra. Sudarmi, M.Si., Apt. dan Bapak Drs.
Syafruddin, MS, Apt., selaku dosen penguji yang telah memberikan masukan
dalam penyusunan skripsi ini.
Penulis juga tidak lupa mengucapkan terima kasih dan penghargaan yang
tulus kepada kedua orang tua, Ayahanda H. M. Fauzi dan Ibunda Hj. Hasni
tercinta, adik-adikku tersayang Reza, Fanni dan Rendi atas doa, dorongan dan
pengorbanan baik moril maupun materil dalam penyelesaian skripsi ini. Juga
kepada sahabat-sahabatku Ahmad Tarmizi dan Anoy dkk yang selalu ada
memberi semangat dan pikiran selama penelitian dan penyusunan skripsi ini.
Tidak lupa penulis ingin mengucapkan terima kasih kepada teman-teman stambuk
2007 yang tidak dapat disebutkan namanya satu persatu, atas segala dorongan
motivasi dan bantuannya kepada penulis sehingga skripsi ini dapat selesai.
PENETAPAN KADAR RIFAMPISIN DAN ISONIAZID DALAM SEDIAAN TABLET SECARA MULTIKOMPONEN DENGAN METODE
SPEKTROFOTOMETRI ULTRAVIOLET Abstrak
TBC merupakan penyakit infeksi yang paling mematikan dan penyebab
kematian nomor dua setelah penyakit jantung. Jumlah penderita TBC di Indonesia
sebanyak 583.000 orang, Cina 2 juta dan India 1,5 juta. Tablet kombinasi
rifampisin dan isoniazid merupakan salah satu sediaan obat yang sering digunakan
dalam pengobatan TBC. Tujuan penelitian ini adalah menetapkan kadar
rifampisin dan isoniazid dalam sediaan tablet yang beredar di pasaran secara
spektrofotometri ultraviolet.
Penetapan kadar rifampisin dan isoniazid dalam sediaan tablet dilakukan
dengan metode spektrofotometri ultraviolet secara multikomponen menggunakan
pelarut asam klorida 0,1 N pada panjang gelombang 230 nm dan 266 nm. Diukur
validitasnya berdasarkan parameter akurasi (metode penambahan baku) dan
presisi. Rifampisin dan isoniazid baku (PT. Indofarma) sebelum digunakan
terlebih dahulu diidentifikasi menggunakan spektrofotometer FTIR. Dari hasil
penelitian menunjukkan bahwa baku yang ditentukan adalah rifampisin dan
isoniazid.
Dari hasil penelitian diperoleh kadar rifampisin yaitu campuran baku (PT.
Indofarma) 100,73% ± 0,07%, tablet generik (PT. Indofarma) 100,19% ± 0,21%,
tablet Rimactazid® (PT. Sandoz) 101,13% ± 0,23%, sedangkan kadar isoniazid yaitu campuran baku (PT. Indofarma) 99,48% ± 0,07%, tablet generik (PT.
Indofarma) 100,63% ± 0,25%, tablet Rimactazid® (PT. Sandoz) 98,96% ± 0,30%.
Hasil penelitian menunjukkan bahwa kadar rifampisin dan isoniazid dalam
sediaan tablet yang diteliti memenuhi persyaratan tablet menurut The United
States Pharmacopeia 30 yaitu tidak kurang dari 90% dan tidak lebih dari 110%
dari jumlah yang tertera pada etiket.
DETERMINATION OF RIFAMPICIN AND ISONIAZID IN THE TABLET DOSAGE FORM BY ULTRAVIOLET SPECTROPHOTOMETRY
METHOD Abstract
Tuberculosis is the most deadly infectious diseases and the number two
cause of death after heart disease. The number of tuberculosis patients in
Indonesia as many as 583,000 people, China 2 million and 1.5 million Indians.
Combination of rifampicin and isoniazid in the tablet is one of the drugs which is
usually use for TBC treatment. The aim of this study is to determination value of
rifampicin and isoniazid in the tablet which circulates in the general by ultraviolet
spectrophotometry.
The determination of rifampicin and isoniazid in the tablet has been done
by ultraviolet spectrophotometry using hydrochloric acid 0,1 N as a solvent at 230
nm and 266 nm wavelength. It is validity measured based on parameter accuracy
(standard addition method) and precision parameters. Identification of raw
material of rifampicin and isoniazid (PT. Indofarma) has been done by FTIR
spectrophotometer. The result of research that raw material are rifampicin and
isoniazid.
The result of research it has been found that amount of rifampicin has the
mix raw material (PT. Indofarma) 100,73% ± 0,07%, the generic tablet (PT.
Indofarma) 100,19% ± 0,21%, the Rimactazid® tablet(PT. Sandoz) 101,13% ± 0,23%, and that amount of isoniazid has the mix raw material (PT. Indofarma)
99,48% ± 0,07%, the generic tablet (PT. Indofarma) 100,63% ± 0,25%, the
Rimactazid® tablet (PT. Sandoz) 98,96% ± 0,30.
The result of research indicate that determining of rifampicin and isoniazid
in the tablet which researched was fulfilled requirement of The United States
Pharmacopeia 30, not less than 90,0% and not more 10,0% of the labelled
amount.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ...ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... xi
DAFTAR GAMBAR... xii
DAFTAR LAMPIRAN ...xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Alat- alat ... 5
BAB II METODOLOGI PENELITIAN ... 5
2.1 Alat- alat ... 5
2.2 Bahan-bahan ... 5
2.3 Pengambilan Sampel ... 5
2.4 Prosedur Penelitian ... 6
2.4.1 Pembuatan Pereaksi ... 6
2.4.1.1 Pembuatan Larutan Asam Klorida 0,1 N ... 6
2.4.2 Uji Identifikasi Rifampisin Baku (PT. Indofarma) ... 6
2.4.2.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah ... 6
2.4.2.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet ... 6
2.4.3 Uji Identifikasi Isoniazid Baku (PT. Indofarma) ... 7
2.4.3.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah ... 7
2.4.3.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet ... 7
2.4.4 Penetapan Kadar Sampel Secara Spektrofotometri Ultraviolet ... 8
2.4.4.1 Pembuatan Larutan Induk Baku ... 8
2.4.4.1.2 Pembuatan Larutan Induk Baku Isoniazid Baku (BPFI) ... 8
2.4.4.2 Penentuan Panjang Gelombang Maksimum... 8
2.4.4.2.1 Penentuan Panjang Gelombang Maksimum Rifampisin ... 8
2.4.4.2.2 Penentuan Panjang Gelombang Maksimum Isoniazid ... 8
2.4.4.3 Penentuan Absorptivitas ... 9
2.4.4.3.1 Penentuan Absorpivitas Rifampisin (15 mcg/ml) ... 9
2.4.4.3.2 Penentuan Absorptivitas Isoniazid (10 mcg/ml) ... 9
2.4.4.3.3 Penentuan Absorptivitas Isoniazid (15 mcg/ml) ... 9
2.4.4.4 Pembuatan Kurva Kalibrasi ... 10
2.4.4.4.1 Pembuatan Kurva Kalibrasi Rifampisin ... 10
2.4.4.4.2 Pembuatan Kurva Kalibrasi Isoniazid ... 10
2.4.4.5 Penetapan Kadar Sampel ... 10
2.4.4.5.1 Penetapan Kadar Rifampisin Baku (PT. Indofarma) ... 10
2.4.4.5.2 Penetapan Kadar Isoniazid Baku (PT. Indofarma) ... 11
2.4.4.5.3 Penetapan Kadar Campuran Rifampisin Baku dan Isonazid Baku (PT. Indofarma) ... 11
2.4.4.5.4 Penetapan Kadar Sampel Tablet Generik Rifampisin dan Isoniazid (PT. Indofarma) ... 12
2.5 Uji Validasi dengan Parameter Akurasi, Presisi, Batas Deteksi dan
Batas Kuantitasi ... 13
2.5.1 Uji Akurasi dengan Persen Perolehan Kembali (% Recovery) ... 13
2.5.2 Uji Presisi ... 14
2.5.3 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 14
2.6 Analisis Data secara Statistik ... 15
BAB III HASIL DAN PEMBAHASAN ... 16
3.1 Uji Identifikasi Rifampisin Baku (PT. Indofarma) ... 16
3.1.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah ... 16
3.1.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet ... 17
3.2 Uji Identifikasi Isoniazid Baku (PT. Indofarma) ... 19
3.2.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah ... 19
3.2.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet ... 20
3.3 Penentuan Panjang Gelombang Maksimum ... 22
3.3.1 Penentuan Panjang Gelombang Maksimum Rifampisin ... 22
3.3.2 Penentuan Panjang Gelombang Maksimum Isoniazid ... 23
3.3.3 Penggabungan Kurva Serapan Rifampisin dan Isoniazid ... 24
3.4 Penentuan Absorptivitas ... 25
3.4.2 Penentuan Absorptivitas Isoniazid (10 mcg/ml) ... 26
3.4.3 Penentuan Absorptivitas Isoniazid (15 mcg/ml) ... 27
3.5 Penentuan Kurva Kalibrasi ... 28
3.5.1 Penentuan Kurva Kalibrasi Rifampisin Baku (ARS) ... 28
3.5.2 Penentuan Kurva Kalibrasi Isoniazid Baku (BPFI)... 29
3.6 Penetapan Kadar Rifampisin Baku dan Isoniazid Baku PT. Indofarma ... 31
3.7 Penetapan Kadar Rifampisin dan Isoniazid dalam Sediaan Tablet ... 31
3.8 Uji Validasi Metode Analisis ... 32
3.8.1 Uji Validasi secara Spektrofotometri Ultraviolet ... 33
BAB IV KESIMPULAN DAN SARAN ... 35
4.1 Kesimpulan ... 35
4.2 Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman
Tabel 1. Data Panjang Gelombang Serapan Maksimum Rifampisin Baku
(ARS) ... 22
Tabel 2. Data Panjang Gelombang Serapan Maksimum Isoniazid Baku (BPFI) ... 24
Tabel 3. Nilai Absorptivitas Rifampisin ... 26 Tabel 4. Data Absorbansi Rifampisin Baku (ARS) dan Isoniazid Baku (BPFI) pada Panjang Gelombang 230 nm ... 26
Tabel 5. Nilai Absorptivitas Isoniazid ... 26 Tabel 6. Data Absorbansi Rifampisin Baku (ARS) dan Isoniazid Baku (BPFI) pada Panjang Gelombang 266 nm ... 27
Tabel 7. Nilai Absorptivitas Isoniazid ... 27 Tabel 8. Data Absorbansi Isoniazid Baku (BPFI) pada
Panjang Gelombang 230 nm ... 27
Tabel 9. Data Absorbansi Isoniazid Baku (BPFI) pada
Panjang Gelombang 266 nm ... 28
Tabel 10. Data Kurva Kalibrasi Rifampisin Baku (ARS) ... 29 Tabel 11. Data Kurva Kalibrasi Isoniazid Baku (BPFI) ... 30 Tabel 12. Hasil Penetapan Kadar Rifampisin Baku dan Isoniazid Baku (BPFI) .. 31 Tabel 13. Kadar Rata-rata Rifampisin dan Isoniazid dalam Sediaan Tablet ... 32 Tabel 14. Data Hasil Pengujian Perolehan Kembali Rifampisin dan Isoniazid
dengan Metode Penambahan Bahan Baku
DAFTAR GAMBAR
Halaman
Gambar 1. Spektrum Inframerah Rifampisin Baku (PT. Indofarma) ... 16 Gambar 2. Spektrum Inframerah Rifampisin pada Literatur Pharmaceutical Sub Stance (UV/IR) ... 17
Gambar 3. Kurva Serapan Rifampisin Baku PT. Indofarma
(konsentrasi 13 mcg/ml) dalam Pelarut HCl 0,1 N ... 18
Gambar 4. Kurva Serapan Rifampisin Baku ARS
(konsentrasi 13 mcg/ml) dalam Pelarut HCl 0,1 N ... 18
Gambar 5. Spektrum Inframerah Isoniazid Baku (PT. Indofarma)... 19 Gambar 6. Spektrum Inframerah Isoniazid pada Literatur Pharmaceutical Sub Stance (UV/IR) ... 20
Gambar 7. Kurva Serapan Isoniazid Baku PT. Indofarma
(konsentrasi 11 mcg/ml) dalam Pelarut HCl 0,1 N ... 21
Gambar 8. Kurva Serapan Isoniazid Baku BPFI
(konsentrasi 11 mcg/ml) dalam Pelarut HCl 0,1 N ... 21
Gambar 9. Kurva Serapan Rifampisin Baku ARS
(konsentrasi 13 mcg/ml) dalam Pelarut HCl 0,1 N ... 22
Gambar 10. Kurva Serapan Isoniazid Baku BPFI
(konsentrasi 11 mcg/ml) dalam Pelarut HCl 0,1 N ... 23
Gambar 11. Kurva Serapan Overlay Rifampisin Baku (ARS) dan
Isoniazid Baku (BPFI) dalam Pelarut HCl 0,1 N ... 25 Gambar 12. Kurva Kalibrasi Rifampisin Baku (ARS) dengan
Berbagai Konsentrasi pada Panjang Gelombang 230 nm ... 28 Gambar 13. Kurva Kalibrasi Isoniazid Baku (BPFI) dengan
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Spektrum Inframerah Rifampisin pada Literatur Pharmaceutical Sub Stance (UV/IR) ... 37
Lampiran 2. Spektrum Inframerah Isoniazid pada Literatur Pharmaceutical
Sub Stance (UV/IR) ... 38
Lampiran 3. Perhitungan Persamaan Regresi Rifampisin Baku (ARS) ... 39
Lampiran 4. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Rifampisin Baku (ARS) ... 40
Lampiran 5. Perhitungan Persamaan Regresi Isoniazid Baku (BPFI) ... 41
Lampiran 6. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Isoniazid Baku (BPFI) ... 42
Lampiran 7. Hasil Penetapan Kadar Rifampisin Baku (PT. Indofarma) ... 43
Lampiran 8. Contoh Perhitungan untuk Mencari Kadar Rifampisin Baku
(PT. Indofarma) ... 44
Lampiran 9. Perhitungan Statistik Kadar Rifampisin Baku (PT. Indofarma) ... 45 Lampiran 10. Hasil Penetapan Kadar Isoniazid Baku (PT. Indofarma) ... 47 Lampiran 11. Contoh Perhitungan untuk Mencari Isoniazid Baku
(PT. Indofarma) ... 48 Lampiran 12. Perhitungan Statistik Kadar Isoniazid Baku
(PT. Indofarma) ... 49 Lampiran 13. Data Kadar Rifampisin dan Isoniazid Sediaan Tablet ... 52 Lampiran 14. Perhitungan Pencampuran Rifampisin Baku dan Isoniazid Baku
(PT. Indofarma) ... 53
Lampiran 15. Perhitungan Konsentrasi Pengukur an Campuran Rifampisin Baku dan Isoniazid Baku (PT. Indofarma) ... 55
Lampiran 17. Perhitungan Statistik Kadar Isoniazid Baku (PT. Indofarma) ... 60
Lampiran 18. Perhitungan Konsentrasi Pengukuran Rifampisin dan Isoniazid Generik (PT. Indofarma) ... 63
Lampiran 19. Perhitungan Statistik Kadar Rifampisin (PT. Indofarma) ... 66
Lampiran 20. Perhitungan Statistik Kadar Isoniazid (PT. Indofarma) ... 68
Lampiran 21. Perhitungan Konsentrasi Pengukuran Rimactazid® (PT. Sandoz) ... 70
Lampiran 22. Perhitungan Statistik Kadar Rifampisin (PT. Sandoz) ... 73
Lampiran 23. Perhitungan Statistik Kadar Isoniazid (PT. Sandoz) ... 75
Lampiran 24. Data Hasil Persen Perolehan Kembali Rifampisin dan Isoniazid dalam Sediaan Tablet Rimactazid® dengan Metode Penambahan Bahan Baku (Standard Addition Method) ... 77
Lampiran 25. Contoh Perhitungan Persentase (%) Perolehan Kembali ... 78
Lampiran 26. Contoh Perhitungan % Recovery dengan Metode Penambahan Baku (Standard Addition Method) ... 81
Lampiran 27. Perhitungan Konsentrasi Pengukuran ... 82
Lampiran 28. Contoh Perhitungan Nilai Absorptivitas Rifampisin dan Isoniazid ... 83
Lampiran 29. Nilai Distribusi t ... 84
Lampiran 30. Sertifikat Analisis Rifampisin Baku (ARS)... 85
Lampiran 31. Sertifikat Analisis Isoniazid Baku (BPFI) ... 86
Lampiran 32. Sertifikat Analisis Rifampisin Baku (PT. Indofarma) ... 87
Lampiran 33. Sertifikat Analisis Isoniazid Baku (PT. Indofarma) ... 88
Lampiran 34. Sertifikat Analisis Amylum Manihot (PT. Varia Sekata) ... 89
Lampiran 35. Sertifikat Analisis Magnesium Stearat (PT. Varia Sekata) ... 90
Lampiran 36. Sertifikat Analisis Laktosa (PT. Varia Sekata) ... 91
PENETAPAN KADAR RIFAMPISIN DAN ISONIAZID DALAM SEDIAAN TABLET SECARA MULTIKOMPONEN DENGAN METODE
SPEKTROFOTOMETRI ULTRAVIOLET Abstrak
TBC merupakan penyakit infeksi yang paling mematikan dan penyebab
kematian nomor dua setelah penyakit jantung. Jumlah penderita TBC di Indonesia
sebanyak 583.000 orang, Cina 2 juta dan India 1,5 juta. Tablet kombinasi
rifampisin dan isoniazid merupakan salah satu sediaan obat yang sering digunakan
dalam pengobatan TBC. Tujuan penelitian ini adalah menetapkan kadar
rifampisin dan isoniazid dalam sediaan tablet yang beredar di pasaran secara
spektrofotometri ultraviolet.
Penetapan kadar rifampisin dan isoniazid dalam sediaan tablet dilakukan
dengan metode spektrofotometri ultraviolet secara multikomponen menggunakan
pelarut asam klorida 0,1 N pada panjang gelombang 230 nm dan 266 nm. Diukur
validitasnya berdasarkan parameter akurasi (metode penambahan baku) dan
presisi. Rifampisin dan isoniazid baku (PT. Indofarma) sebelum digunakan
terlebih dahulu diidentifikasi menggunakan spektrofotometer FTIR. Dari hasil
penelitian menunjukkan bahwa baku yang ditentukan adalah rifampisin dan
isoniazid.
Dari hasil penelitian diperoleh kadar rifampisin yaitu campuran baku (PT.
Indofarma) 100,73% ± 0,07%, tablet generik (PT. Indofarma) 100,19% ± 0,21%,
tablet Rimactazid® (PT. Sandoz) 101,13% ± 0,23%, sedangkan kadar isoniazid yaitu campuran baku (PT. Indofarma) 99,48% ± 0,07%, tablet generik (PT.
Indofarma) 100,63% ± 0,25%, tablet Rimactazid® (PT. Sandoz) 98,96% ± 0,30%.
Hasil penelitian menunjukkan bahwa kadar rifampisin dan isoniazid dalam
sediaan tablet yang diteliti memenuhi persyaratan tablet menurut The United
States Pharmacopeia 30 yaitu tidak kurang dari 90% dan tidak lebih dari 110%
dari jumlah yang tertera pada etiket.
DETERMINATION OF RIFAMPICIN AND ISONIAZID IN THE TABLET DOSAGE FORM BY ULTRAVIOLET SPECTROPHOTOMETRY
METHOD Abstract
Tuberculosis is the most deadly infectious diseases and the number two
cause of death after heart disease. The number of tuberculosis patients in
Indonesia as many as 583,000 people, China 2 million and 1.5 million Indians.
Combination of rifampicin and isoniazid in the tablet is one of the drugs which is
usually use for TBC treatment. The aim of this study is to determination value of
rifampicin and isoniazid in the tablet which circulates in the general by ultraviolet
spectrophotometry.
The determination of rifampicin and isoniazid in the tablet has been done
by ultraviolet spectrophotometry using hydrochloric acid 0,1 N as a solvent at 230
nm and 266 nm wavelength. It is validity measured based on parameter accuracy
(standard addition method) and precision parameters. Identification of raw
material of rifampicin and isoniazid (PT. Indofarma) has been done by FTIR
spectrophotometer. The result of research that raw material are rifampicin and
isoniazid.
The result of research it has been found that amount of rifampicin has the
mix raw material (PT. Indofarma) 100,73% ± 0,07%, the generic tablet (PT.
Indofarma) 100,19% ± 0,21%, the Rimactazid® tablet(PT. Sandoz) 101,13% ± 0,23%, and that amount of isoniazid has the mix raw material (PT. Indofarma)
99,48% ± 0,07%, the generic tablet (PT. Indofarma) 100,63% ± 0,25%, the
Rimactazid® tablet (PT. Sandoz) 98,96% ± 0,30.
The result of research indicate that determining of rifampicin and isoniazid
in the tablet which researched was fulfilled requirement of The United States
Pharmacopeia 30, not less than 90,0% and not more 10,0% of the labelled
amount.
BAB I PENDAHULUAN
1.1 Latar Belakang
TBC merupakan penyakit infeksi yang paling mematikan dan penyebab
kematian nomor dua setelah penyakit jantung. Menurut laporan Penanggulangan
TBC Global yang dikeluarkan oleh WHO pada tahun 2004, angka insidensi TBC
pada tahun 2002 mencapai 555.000 kasus (256 kasus/100.000 penduduk), dan
46% diantaranya diperkirakan merupakan kasus baru (Anonim, 2010). Penyakit
ini merupakan salah satu penyakit rakyat, yang tiap tahun mengambil banyak
korban. Jumlah penderita di Indonesia sebanyak 583.000 orang menduduki
peringkat ketiga terbesar setelah Cina dan India (2 dan 1,5 juta) dengan angka
kematian sebesar 140.000 per tahun dan kasus baru 262.000 per tahun (Berita
DepKes R.I. PPM & PL 23 Maret 2001). Kawasan Indonesia Timur merupakan
daerah yang banyak penderitanya. Penyakit ini ditemukan terutama diantara
rakyat jelata yang gizi makanannya belum sempurna dan hidup dalam keadaan
sosial-ekonomi dan higienis di bawah normal (Tjay dan Rahardja, 2002).
Obat yang digunakan untuk tuberkulosis digolongkan atas dua kelompok
obat primer dan obat sekunder. Kelompok obat primer, yaitu isoniazid, rifampisin,
etambutol, streptomisin dan pirazinamid, memperlihatkan efektivitas yang tinggi
dengan toksisitas yang dapat diterima. Antituberkulosis sekunder adalah
etionamid, paraaminosalisilat, sikloserin, amikasin, kapreomisin dan kanamisin
Salah satu persyaratan mutu adalah kadar yang terkandung harus
memenuhi persyaratan kadar seperti yang tercantum dalam Farmakope Indonesia
atau buku resmi lainnya. Informasi studi literatur penetapan kadar bahan baku
rifampisin menurut Farmakope Indonesia Edisi IV dan The United States
Pharmacopeia 30, ditentukan dengan Kromatografi Cair Kinerja Tinggi (KCKT)
menggunakan fase gerak campuran air:asetonitril:dapar fosfat:asam sitrat 1,0 M:
natrium perklorat 0,5 M (510:350:100:20:20), sedangkan monografi untuk sediaan
tablet tidak tercantum. Penetapan kadar bahan baku isoniazid menurut Farmakope
Indonesia Edisi IV dan The United States Pharmacopeia 30, ditentukan secara
titrimetri dan Kromatografi Cair Kinerja Tinggi (KCKT) menggunakan fase gerak
campuran natrium dokusat:metanol:air (4,4 g:600 ml:400 ml) dan monografi
untuk sediaan tablet sama seperti bahan baku. Metode KCKT ini memerlukan alat
dan biaya operasional yang relatif mahal serta waktu analisis yang relatif lama.
Dilihat dari struktur rifampisin dan isonazid yang mempunyai gugus
kromofor, maka senyawa ini dapat menyerap radiasi pada daerah ultraviolet.
Menurut Moffat, (2004) rifampisin memiliki serapan maksimum dalam larutan
asam pada panjang gelombang 231 nm (A11=320a), 263 nm, 336 nm (A11=250a),
sedangkan isoniazid memiliki serapan maksimum dalam larutan asam pada
panjang gelombang 266 nm (A11=390a) dan dalam larutan basa pada panjang
gelombang 298 nm.
Mengingat hal tersebut maka diperlukan metode alternatif yang
memerlukan alat dan biaya operasional yang lebih murah serta lebih mudah dalam
yang baik. Adapun metode yang dipilih yaitu secara spektrofotometri ultraviolet.
Metode ini memiliki keuntungan antara lain dapat digunakan untuk analisis suatu
zat dalam jumlah kecil, pengerjaannya cepat, sederhana, cukup sensitif dan selekif
serta mudah dalam interpretasi hasil yang diperoleh.
Berdasarkan hal tersebut, peneliti tertarik untuk memeriksa kadar
rifampisin dan isoniazid pada sediaan tablet secara multikomponen dengan
spektrofotometri ultraviolet. Adapun uji validasi yang digunakan yaitu uji akurasi
dengan parameter % perolehan kembali, uji presisi dengan parameter SD (Standar
Deviasi) dan RSD (Relative Standar Deviasi), limit deteksi dan limit kuantitasi.
1.2Perumusan Masalah
1. Apakah kadar rifampisin dan isoniazid dalam sediaan tablet dapat
ditentukan secara multikomponen dengan metode spektrofotometri
ultraviolet?
2. Apakah kadar rifampisin dan isoniazid dalam sediaan tablet yang beredar di
pasaran memenuhi persyaratan menurut The United States Pharmacopeia
30 tidak kurang dari 90% dan tidak lebih dari 110%?
1.3Hipotesis
1. Kadar rifampisin dan isoniazid dalam sediaan tablet dapat ditentukan
secara multikomponen dengan metode spektrofotometri ultraviolet.
2. Kadar rifampisin dan isoniazid dalam sediaan tablet yang beredar di
pasaran memenuhi persyaratan menurut The United States Pharmacopeia
1.4Tujuan
1. Menentukan kadar rifampisin dan isoniazid dalam sediaan tablet yang
beredar di pasaran secara multikomponen dengan metode spektrofotometri
ultraviolet.
2. Menentukan kadar rifampisin dan isoniazid dalam sediaan tablet yang
beredar di pasaran memenuhi persyaratan menurut The United States
Pharmacopeia 30 tidak kurang dari 90% dan tidak lebih dari 110%.
1.5 Manfaat
Manfaat penelitian ini adalah untuk mengetahui kadar rifampisin dan
isoniazid sehingga dengan kadar yang tepat obat dapat memberikan efek terapi
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Bahan
2.1.1 Rifampisin
2.1.1.1 Sifat Fisikokimia
Rumus Struktur :
Rumus molekul : C43H58N4O12
Nama kimia :
5,6,9,17,19,21-Heksahidroksi-23-metoksi-2,4,12,16,18,20,22-
heptametil-8-[N-(4-metil-1-piperazinil)formimidoil]-2,7-
(epoksipentadeka[1,11,13]trienimino]nafto[2,1-b]furan-1,11-(2H)-dion 21-asetat [13292-46-1]
Berat molekul : 822,95
Pemerian : Serbuk hablur, coklat merah.
Kelarutan : Sangat sukar larut dalam air; mudah larut dalam kloroform; larut
2.1.1.2 Farmakologi
Antibiotikum ini adalah derivat semisintetis dari rifamisin B yang dihasilkan oleh
Streptomyces mediterranei. Rifampisin bersifat bakterisid luas terhadap fase
pertumbuhan M. tuberkulosae dan M. leprae, baik yang berada di luar maupun di dalam
sel. Obat ini mematikan kuman yang dormant selama fase pembelahan yang singkat.
Maka, obat ini sangat penting untuk membasmi semua basil guna mencegah kambuhnya
TBC.
Rifampisin juga aktif terhadap kuman gram-positif dan kuman gram-negatif.
Mekanisme kerjanya berdasarkan perintangan spesifik dari suatu enzim bakteri
RNA-polymerase, sehingga sintesa RNA terganggu.
Resorpsinya di usus sangat tinggi, distribusinya ke jaringan dan cairan tubuh juga
baik. Plasma t1/2 nya berkisar antara 1,5 sampai 5 jam dan meningkat bila ada gangguan
fungsi hati. Di lain pihak, masa paruh ini akan turun pada pasien yang bersamaan waktu
menggunakan isoniazid. Dalam hati terjadi desasetilasi dengan terbentuknya
metabolit-metabolit dengan kegiatan antibakteriil. Ekskresinya melalui empedu (Tjay dan Rahardja,
2002).
2.1.1.3 Efek Samping
Menimbulkan warna oranye yang tidak berbahaya pada urin, keringat, air mata
dan lensa mata. Efek samping yang sering terjadi termasuk kulit kemerahan,
trombositopenia, nefritis dan gangguan fungs hati (Katzung, 1998).
2.1.1.4 Dosis
Oral 1 dd 450-600 mg sekaligus pagi hari sebelum makan, selalu diberikan dalam
kombinasi dengan isoniazid 300 mg dan untuk 2 bulan pertama ditambah pula dengan
2.1.2 Isoniazid
2.1.2.1 Sifat Fisikokimia
Rumus Struktur :
Rumus molekul : C6H7N3O
Nama kimia : Asam isonikotinat hidrazida [54-85-3]
Berat molekul : 137,14
Pemerian : Hablur putih atau tidak berwarna atau serbuk hablur putih; tidak
berbau, perlahan-lahan dipengaruhi oleh udara dan cahaya.
Kelarutan : Mudah larut dalam air; agak sukar larut dalam etanol; sukar larut
dalam kloroform dan dalam eter (Ditjen POM, 1995).
2.1.2.2 Farmakologi
Derivat asam isonikotinat ini berkhasiat tuberkulostatis paling kuat terhadap M.
tuberkulosae dan bersifat bakterisid terhadap basil yang sedang tumbuh pesat. Aktif
terhadap kuman yang berada intraseluler dalam makrofag maupun di luar sel
(ekstraseluler).
Mekanisme kerjanya berdasarkan terganggunya sintesa mycolic acid, yang
kemoterapi terpenting terhadap berbagai tipe tuberkulosa dan selalu dalam bentuk
multiple terapi dengan rifampisin dan pirazinamid.
Resorpsinya dari usus sangat cepat, difusinya ke dalam jaringan dan cairan tubuh
baik sekali, bahkan menembus jaringan yang sudah mengeras. Penetrasi yang cepat ini
sangat penting dalam pengobatan tuberculous meningitis. Di dalam hati, isoniazid
diasetilasi oleh enzim asetiltransferase menjadi metabolit inaktif. Plasma t1/2 nya antara 1
dan 4 jam tergantung pada kecepatan asetilasi. Ekskresinya melalui ginjal (Tjay dan
Rahardja, 2002).
2.1.2.3 Efek Samping
Gatal-gatal, ikterus, polineuritis, perasaan tidak sehat, letih dan lemah, anoreksia,
kadang-kadang terjadi kerusakan hati dengan hepatitis dan ikterus yang fatal (Tjay dan
Rahardja, 2002).
2.1.2.4 Dosis
Oral/i.m. dewasa dan anak-anak 1 dd 4-8 mg/kg/hari sehari atau 1 dd 300-400
mg, atau sebagai single dose bersama rifampisin, pagi hari a.c. atau sesudah makan bila
terjadi gangguan lambung (Tjay dan Rahardja, 2002).
2.2 Spektrofotometri Ultraviolet
2.2.1 Teori Spektrofotometri Ultraviolet
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara radiasi
elektromagnetik dan molekul atau atom dari suatu zat kimia. Teknik yang sering
digunakan dalam analisis farmasi meliputi spektrofotometri ultraviolet, cahaya tampak,
inframerah dan serapan atom. Jangkauan panjang gelombang untuk daerah ultraviolet
adalah 190-380 nm, daerah cahaya tampak 380-780 nm, daerah inframerah dekat
Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk
terjadinya transisi elektronik. Transisi-transisi elektronik akan meningkatkan energi
molekuler dari keadaan dasar ke satu atau lebih tingkat energi tereksitasi. Jika suatu
molekul sederhana dikenakan radiasi elektromagnetik maka molekul tersebut akan
menyerap radiasi elektromagnetik yang energinya sesuai. Interaksi antara molekul
dengan radiasi elektromagnetik ini akan meningkatkan energi potensial elektron dari
tingkat dasar ke tingkat tereksitasi. Apabila pada molekul yang sederhana tadi hanya
terjadi transisi elektronik pada satu macam gugus yang terdapat pada molekul, maka
hanya akan terjadi satu absorpsi yang merupakan pita spektrum. Terjadinya dua atau
lebih pita spektrum diberikan oleh molekul dengan struktur yang lebih kompleks karena
terjadi beberapa transisi sehingga mempunyai lebih dari satu panjang gelombang
(Gandjar dan Rohman, 2007).
Gugus fungsi yang menyerap radiasi di daerah ultraviolet dekat dan daerah
tampak disebut gugus kromofor dan hampir semua gugus ini mempunyai ikatan tak
jenuh. Pada kromofor jenis ini transisi terjadi dari π → π*, yang menyerap pada panjang
gelombang maksimum kecil dari 200 nm (tidak terkonyugasi), misalnya pada >C=C<
dan –C ≡ C–. Kromofor ini merupakan tipe transisi dari sistem yang mengandung
elektron π pada orbital molekulnya. Untuk senyawa yang mempunyai sistem konyugasi,
perbedaan energi antara keadaan dasar dan keadaan tereksitasi menjadi lebih kecil
sehingga penyerapan terjadi pada panjang gelombang yang lebih besar (Dachriyanus,
2004).
Gugus fungsi seperti –OH, -O, -NH2, dan –OCH3 yang memberikan transisi n →
π* disebut gugus auksokrom. Gugus ini adalah gugus yang tidak dapat menyerap radiasi
ultraviolet-sinar tampak, tetapi apabila gugus ini terikat pada gugus kromofor
mengakibatkan pergeseran panjang gelombang ke arah yang lebih besar (pergeseran
Hal-hal yang harus diperhatikan dalam analisis spektrofotometri ultraviolet:
a. Pemilihan panjang gelombang maksimum
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang
gelombang dimana terjadi serapan maksimum. Untuk memperoleh panjang gelombang
maksimum, dilakukan dengan membuat kurva hubungan antara absorbansi dengan
panjang gelombang dari suatu larutan baku pada konsentrasi tertentu.
b. Pembuatan kurva kalibrasi
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai
konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi diukur,
kemudian dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi.
Bila hukum Lambert-Beer terpenuhi maka kurva kalibrasi merupakan garis lurus.
c. Pembacaan absorbansi sampel atau cuplikan
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2-0,6. Anjuran ini
berdasarkan anggapan bahwa pada kisaran nilai absorbansi tersebut, kesalahan fotometrik
yang terjadi adalah paling minimal (Gandjar dan Rohman, 2007).
2.2.2 Hukum Lambert-Beer
Menurut Hukum Lambert, serapan berbanding lurus terhadap ketebalan sel yang
disinari. Sedangkan menurut Beer, serapan berbanding lurus dengan konsentrasi, ini
berlaku untuk radiasi monokromatis dalam larutan yang sangat encer. Kedua pernyataan
ini dapat dijadikan satu dalam Hukum Lambert-Beer, sehingga diperoleh bahwa serapan
berbanding lurus terhadap konsentrasi dan ketebalan sel, yang dapat ditulis dengan
persamaan :
A= a.b.c (g/liter) atau A= ε. b. c (mol/liter)
a = absorptivitas
b = ketebalan sel
c = konsentrasi
ε = absorptivitas molar
Hukum Lambert-Beer menjadi dasar aspek kuantitatif spektrofotometri dimana
konsentrasi dapat dihitung berdasarkan rumus di atas. Absorptivitas merupakan suatu
tetapan dan spesifik untuk setiap molekul pada panjang gelombang dan pelarut tertentu.
Menurut Roth dan Blaschke (1981), absorptivitas spesifik juga sering digunakan
untuk menggantikan absorptivitas. Harga ini, memberikan serapan larutan 1 % (b/v)
dengan ketebalan sel 1 cm, sehingga dapat diperoleh persamaan:
A = A11. b. c
Dimana : A11= absorptivitas spesifik
b = ketebalan sel
c = konsentrasi senyawa terlarut (g/100ml larutan)
2.2.3 Penggunaan Spektofotometri Ultraviolet
Analisis kualitatif
Secara eksperimental, sangat mudah untuk mengukur banyaknya radiasi yang
diserap oleh suatu molekul sebagai fungsi frekuensi radiasi. Suatu grafik yang
menghubungkan antara banyaknya sinar yang diserap dengan frekuensi (atau panjang
gelombang) sinar merupakan spektrum absorpsi. Transisi yang dibolehkan untuk suatu
molekul dengan struktur kimia yang berbeda adalah tidak sama sehingga spektrum
absorpsinya juga berbeda. Dengan demikian, spektrum dapat digunakan sebagai bahan
Analisis kuantitatif
Penggunaan utama spektrofotometri ultraviolet adalah dalam analisis kuantitatif.
Apabila dalam alur spektrofotometer terdapat senyawa yang mengabsorpsi radiasi, akan
terjadi pengurangan kekuatan radiasi yang mencapai detektor. Parameter kekuatan energi
radiasi yang diabsorpsi oleh molekul adalah absorban (A) yang dalam batas konsentrasi
tertentu nilainya sebanding dengan banyaknya molekul yang mengabsorpsi radiasi.
Senyawa yang tidak mengabsorpsi radiasi ultraviolet-sinar tampak dapat juga ditentukan
dengan spektrofotometri ultraviolet-sinar tampak, apabila ada reaksi kimia yang dapat
mengubahnya menjadi kromofor atau dapat disambungkan dengan suatu pereaksi
kromofor (Satiadarma, 2004).
Analisis kuantitatif secara spektrofotometri ultraviolet dapat dilakukan dengan
metode regresi dan pendekatan.
1. Metode Regresi
Analisis kuantitatif dengan metode regresi yaitu dengan menggunakan persamaan
regresi yang didasarkan pada harga serapan dan konsentrasi standar yang dibuat dalam
beberapa konsentrasi, paling sedikit menggunakan 5 rentang konsentrasi yang meningkat
yang dapat memberikan serapan yang linier, kemudian diplot menghasilkan suatu kurva
yang disebut dengan kurva kalibrasi. Konsentrasi suatu sampel dapat dihitung
berdasarkan kurva tersebut.
2. Metode Pendekatan
Analisis kuantitatif dengan cara ini dilakukan dengan membandingkan serapan
standar yang konsentrasinya diketahui dengan serapan sampel. Konsentrasi sampel dapat
dihitung melalui rumus perbandingan C = As. Cb / Ab dimana As = serapan sampel, Ab
= serapan standar, Cb = konsentrasi standar, dan C = konsentrasi sampel (Holme dan
2.2.4 Peralatan Untuk Spektrofotometri
Spektrofotometer adalah alat untuk mengukur transmitans atau serapan suatu
sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan penggabungan
dari dua fungsi alat yang terdiri dari spektrometer yang menghasilkan sinar dari spektrum
dengan panjang gelombang tertentu dan fotometer sebagai alat pengukur intensitas
cahaya yang ditransmisikan atau yang diabsorpsi (Day dan Underwood, 1981).
Unsur -unsur terpenting suatu spektrofotometer adalah sebagai berikut:
1. Sumber-sumber lampu: lampu deuterium digunakan untuk daerah UV pada panjang
gelombang dari 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten
digunakan untuk daerah visibel pada panjang gelombang antara 350- 900 nm.
2. Monokromotor: digunakan untuk memperoleh sumber sinar yang monokromatis.
Alatnya dapat berupa prisma maupun grating. Untuk mengarahkan sinar
monokromatis yang diinginkan dari hasil penguraian.
3. Kuvet (sel): digunakan sebagai wadah sampel untuk menaruh cairan ke dalam berkas
cahaya spektrofotometer. Kuvet itu haruslah meneruskan energi radiasi dalam daerah
spektrum yang diinginkan. Pada pengukuran di daerah tampak, kuvet kaca atau kuvet
kaca corex dapat digunakan, tetapi untuk pengukuran pada daerah ultraviolet kita
harus menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini.
Kuvet tampak dan ultraviolet yang khas mempunyai ketebalan 1 cm, namun tersedia
kuvet dengan ketebalan yang sangat beraneka, mulai dari ketebalan kurang dari 1
milimeter sampai 10 cm bahkan lebih.
4. Detektor: Peranan detektor penerima adalah memberikan respon terhadap cahaya
pada berbagai panjang gelombang.
5. Suatu amplifier (penguat) dan rangkaian yang berkaitan yang membuat isyarat listrik
6. Sistem pembacaan yang memperlihatkan besarnya isyarat listrik (Day and Underwood,
1981).
2.3 Validasi
Validasi adalah suatu tindakan terhadap parameter tertentu pada prosedur
penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi
persyaratan untuk penggunaannya (WHO, 1992).
Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi,
kespesifikan, limit deteksi, limit kuantitasi, linieritas dan rentang.
Akurasi (kecermatan) adalah ukuran yang menunjukkan derajat kedekatan hasil
analisis dengan kadar analit sebenarnya. Akurasi dinyatakan sebagai persen perolehan
kembali (% recovery) analit yang ditambahkan dan dapat ditentukan melalui dua cara
yaitu metode simulasi (spiked placebo recovery) dan metode penambahan bahan baku
(standard addition method). Dalam kedua metode tersebut, persen perolehan kembali
dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya.
% Perolehan Kembali = x100% C
B A−
Keterangan :
A = konsentrasi sampel yang diperoleh setelah penambahan baku
B = konsentrasi sampel sebelum penambahan baku
C = konsentrasi baku yang ditambahkan
Presisi merupakan ukuran keterulangan metode analisis dan biasanya
diekspresikan sebagai relatif standar deviasi (RSD) dari sejumlah sampel yang berbeda
Batas deteksi (limit of detection) didefinisikan sebagai konsentrasi analit terendah
dalam sampel yang masih dapat terdeteksi. Batas deteksi dapat dihitung dengan rumus
sebagai berikut:
Batas deteksi =
Slope xSB
3
Batas kuantitasi (limit of quantitation) didefinisikan sebagai konsentrasi analit
terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat
diterima pada kondisi operasional metode yang digunakan.
Batas Kuantitasi =
Slope xSB
10
Kelinieran suatu metode analisis adalah kemampuan untuk menunjukkan bahwa
nilai hasil uji langsung atau setelah diolah secara matematika, proporsional dengan
konsentrasi analit dalam sampel dalam batas rentang konsentrasi tertentu.
Rentang suatu metode analisis adalah interval antara batas konsentrasi tertinggi
dan konsentrasi terendah analit yang dapat ditentukan dengan presisi, akurasi dan
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Penelitian
ini dilaksanakan di Laboratorium Kimia Farmasi Kuantitatif dan Laboratorium
Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometer
inframerah (Shimadzu), spektrofotometer ultraviolet (UV mini 1240 Shimadzu),
oven, neraca analitik (Vibra AJ), dan alat-alat gelas yang lazim digunakan di
laboratorium.
3.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah rifampisin baku
(ARS), isoniazid baku (BPFI), rifampisin baku (PT. Indofarma), isoniazid baku
(PT. Indofarma), amilum manihot (PT. Varia Sekata), talkum (PT. Varia Sekata),
magnesium stearat (PT. Varia Sekata), laktosa (PT. Varia Sekata), KBr
(Shimadzu), asam klorida (E.Merck) dan akuades (Laboratorium Kimia Farmasi
Kuantitatif Fakultas Farmasi USU). Sampel yang digunakan adalah tablet generik
rifampisin dan isoniazid (PT. Indofarma) dan tablet Rimactazid® (PT. Sandoz).
3.3 Pengambilan Sampel
Metode pengambilan sampel yang dilakukan adalah sampling purposif
Pengambilan sampel secara purposif, tanpa membandingkan sampel antara satu
tempat dengan tempat yang lain, karena pengambilan sampel dianggap homogen.
Sampel yang digunakan adalah tablet generik rifampisin dan isoniazid (PT.
Indofarma) dan tablet Rimactazid® (PT. Sandoz).
3.4 Prosedur Penelitian 3.4.1 Pembuatan Pereaksi
3.4.1.1 Pembuatan Larutan Asam Klorida 0,1 N (Ditjen POM, 1979)
Dimasukkan kira-kira 250 ml akuades ke dalam wadah, lalu ditambahkan
8,3 ml asam klorida pekat melalui dinding wadah biarkan dingin, kemudian
dicukupkan sampai 1000 ml.
3.4.2 Uji Identifikasi Rifampisin Baku (PT. Indofarma)
3.4.2.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah
Dicampur 10 mg rifampisin baku (PT. Indofarma) dengan 90 mg serbuk
KBr dalam lumpang digerus hingga halus dan homogen, campuran tersebut
diletakkan pada sampel pan, kemudian dipasangkan pada DRS 8000 dan dianalisa
pada bilangan gelombang 4000-500 cm-1. Spektrum inframerah yang diperoleh
dibandingkan dengan literatur (hasil dapat dilihat pada gambar 1 halaman 16).
3.4.2.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet
Sejumlah lebih kurang 50 mg rifampisin baku (PT. Indofarma) ditimbang
seksama, dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan HCl 0,1
N lalu dicukupkan sampai garis tanda dengan HCl 0,1 N dan dikocok homogen,
dipipet sebanyak 1,3 ml, dimasukkan ke dalam labu tentukur 50 ml dan
diencerkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen
sehingga diperoleh larutan dengan konsentrasi 13 mcg/ml, diukur serapannya
pada panjang gelombang 200-400 nm dan dibandingkan dengan kurva serapan
rifampisin baku (ARS) (hasil dapat dilihat pada gambar 3 halaman 18).
3.4.3 Uji Identifikasi Isoniazid Baku (PT. Indofarma)
3.4.3.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah
Dicampur 10 mg isoniazid baku (PT. Indofarma) dengan 90 mg serbuk
KBr dalam lumpang digerus hingga halus dan homogen, campuran tersebut
diletakkan pada sampel pan, kemudian dipasangkan pada DRS 8000 dan dianalisa
pada bilangan gelombang 4000-500 cm-1. Spektrum inframerah yang diperoleh
dibandingkan dengan literatur (hasil dapat dilihat pada gambar 5 halaman 19).
3.4.3.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet
Sejumlah lebih kurang 50 mg isoniazid baku (PT. Indofarma) ditimbang
seksama, dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan HCl 0,1
N lalu dicukupkan sampai garis tanda dengan HCl 0,1 N dan dikocok homogen,
sehingga diperoleh larutan dengan konsentrasi 500 mcg/ml. Dari larutan ini,
dipipet sebanyak 1,1 ml, dimasukkan ke dalam labu tentukur 50 ml dan
diencerkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen
sehingga diperoleh larutan dengan konsentrasi 11 mcg/ml, diukur serapannya
pada panjang gelombang 200-400 nm dan dibandingkan dengan kurva serapan
3.4.4 Penetapan Kadar Sampel Secara Spektrofotometri Ultraviolet 3.4.4.1 Pembuatan Larutan Induk Baku
3.4.4.1.1 Pembuatan Larutan Induk Baku Rifampisin Baku (ARS)
Sejumlah lebih kurang 50 mg rifampisin baku (ARS) ditimbang seksama,
dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan HCl 0,1 N lalu
dicukupkan sampai garis tanda dengan HCl 0,1 N dan dikocok homogen,
sehingga diperoleh larutan dengan konsentrasi 500 mcg/ml larutan induk baku.
3.4.4.1.2 Pembuatan Larutan Induk Baku Isoniazid Baku (BPFI)
Sejumlah lebih kurang 50 mg isoniazid baku (BPFI) ditimbang seksama,
dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan HCl 0,1 N lalu
dicukupkan sampai garis tanda dengan HCl 0,1 N dan dikocok homogen,
sehingga diperoleh larutan dengan konsentrasi 500 mcg/ml larutan induk baku.
3.4.4.2 Penentuan Panjang Gelombang Maksimum
3.4.4.2.1 Penentuan Panjang Gelombang Maksimum Rifampisin
Dipipet sebanyak 1,3 ml larutan induk baku rifampisin, dimasukkan ke
dalam labu tentukur 50 ml dan diencerkan dengan HCl 0,1 N sampai garis tanda,
dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 13 mcg/ml,
diukur serapannya pada panjang gelombang 200-400 nm (hasil dapat dilihat pada
3.4.4.2.2 Penentuan Panjang Gelombang Maksimum Isoniazid
Dipipet sebanyak 1,1 ml larutan induk baku isoniazid, dimasukkan ke
dalam labu tentukur 50 ml dan diencerkan dengan HCl 0,1 N sampai garis tanda,
dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 11 mcg/ml,
diukur serapannya pada panjang gelombang 200-400 nm (hasil dapat dilihat pada
gambar 10 halaman 23 dan tabel 2 halaman 24).
3.4.4.3 Penentuan Absorptivitas
3.4.4.3.1 Penentuan Absorptivitas Rifampisin (15 mcg/ml)
Dipipet sebanyak 1,5 ml larutan induk baku rifampisin, dimasukkan ke
dalam labu tentukur 50 ml dan diencerkan dengan HCl 0,1 N sampai garis tanda,
dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 15 mcg/ml,
diukur serapannya pada panjang gelombang maksimum rifampisin dan panjang
gelombang maksimum isoniazid (hasil dapat dilihat pada tabel 3 halaman 26).
3.4.4.3.2 Penentuan Absorptivitas Isoniazid (10 mcg/ml)
Dipipet sebanyak 1 ml larutan induk baku isoniazid, dimasukkan ke dalam
labu tentukur 50 ml dan diencerkan dengan HCl 0,1 N sampai garis tanda,
dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 10 mcg/ml,
diukur serapannya pada panjang gelombang maksimum rifampisin dan panjang
gelombang maksimum isoniazid (hasil dapat dilihat pada tabel 5 halaman 26).
3.4.4.3.3 Penentuan Absorptivitas Isoniazid (15 mcg/ml)
Dipipet sebanyak 1,5 ml larutan induk baku isoniazid, dimasukkan ke
dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 15 mcg/ml,
diukur serapannya pada panjang gelombang maksimum rifampisin dan panjang
gelombang maksimum isoniazid (hasil dapat dilihat tabel 7 halaman 27).
3.4.4.4 Pembuatan Kurva Kalibrasi
3.4.4.4.1 Pembuatan Kurva Kalibrasi Rifampisin
Dari larutan induk baku rifampisin (500 mcg/ml) dipipet masing-masing
sebanyak 0,6; 0,9; 1,2; 1,5 dan 1,8 ml dimasukkan ke dalam labu tentukur 50 ml
dan diencerkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen
hingga diperoleh larutan dengan konsentrasi 6; 9; 12; 15 dan 18 mcg/ml, diukur
serapannya pada panjang gelombang maksimum rifampisin (hasil dapat dilihat
pada gambar 12 halaman 28 dan tabel 10 halaman 29).
3.4.4.4.2 Pembuatan Kurva Kalibrasi Isoniazid
Dari larutan induk baku isoniazid (500 mcg/ml) dipipet masing-masing
sebanyak 0,6; 0,8; 1; 1,2 dan 1,4 ml dimasukkan ke dalam labu tentukur 50 ml
dan diencerkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen
hingga diperoleh larutan dengan konsentrasi 6; 8; 10; 12 dan 14 mcg/ml, diukur
serapannya pada panjang gelombang maksimum isoniazid (hasil dapat dilihat
pada gambar 13 dan tabel 11 halaman 30).
3.4.4.5Penetapan Kadar Sampel
3.4.4.5.1 Penetapan Kadar Rifampisin Baku (PT. Indofarma)
Timbang seksama lebih kurang 100 mg rifampisin baku (PT. Indofarma),
100 ml dan dilarutkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai
homogen hingga diperoleh larutan dengan konsentrasi 1000 mcg/ml. Dari larutan
tersebut, dipipet 5 ml dimasukkan ke dalam labu tentukur 50 ml dan diencerkan
dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen hingga diperoleh
larutan dengan konsentrasi 100 mcg/ml. Dari larutan tersebut, dipipet 3,4 ml
dimasukkan ke dalam labu tentukur 25 ml dan diencerkan dengan HCl 0,1 N
sampai garis tanda, dikocok sampai homogen hingga diperoleh larutan dengan
konsentrasi 13,6 mcg/ml. Ukur serapan pada panjang gelombang maksimum
rifampisin (hasil dapat dilihat pada tabel 12 halaman 31).
3.4.4.5.2 Penetapan Kadar Isoniazid Baku (PT. Indofarma)
Timbang seksama lebih kurang 100 mg isoniazid baku (PT. Indofarma),
dilakukan sebanyak 6 kali. Masing-masing dimasukkan ke dalam labu tentukur
100 ml dan dilarutkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai
homogen hingga diperoleh larutan dengan konsentrasi 1000 mcg/ml. Dari larutan
tersebut, dipipet 5 ml dimasukkan ke dalam labu tentukur 50 ml dan diencerkan
dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen hingga diperoleh
larutan dengan konsentrasi 100 mcg/ml. Dari larutan tersebut, dipipet 2,8 ml
dimasukkan ke dalam labu tentukur 25 ml dan diencerkan dengan HCl 0,1 N
sampai garis tanda, dikocok sampai homogen hingga diperoleh larutan dengan
konsentrasi 11,2 mcg/ml. Ukur serapan pada panjang gelombang maksimum
3.4.4.5.3 Penetapan Kadar Campuran Rifampisin Baku dan Isoniazid Baku (PT. Indofarma)
Homogenkan rifampisin baku dan isoniazid baku (PT. Indofarma),
tambahkan laktosa, amilum manihot, talkum dan magnesium stearat. Sejumlah
serbuk timbang seksama setara 231 mg rifampisin dan 154 mg isoniazid, lakukan
sebanyak 6 kali. Masing-masing masukkan ke dalam labu tentukur 100 ml dan
dilarutkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen.
Saring dengan kertas saring, 10 ml filtrat pertama dibuang. Dari larutan tersebut,
dipipet 10 ml dimasukkan ke dalam labu tentukur 100 ml dan diencerkan dengan
HCl 0,1 N sampai garis tanda, dikocok sampai homogen. Dari larutan tersebut,
dipipet 3,3 ml dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan
HCl 0,1 N sampai garis tanda, dikocok sampai homogen. Ukur serapan pada
panjang gelombang maksimum rifampisin dan pada panjang gelombang
maksimum isoniazid (hasil dapat dilihat pada tabel 13 halaman 32).
3.4.4.5.4 Penetapan Kadar Sampel Tablet Generik Rifampisin dan Isoniazid (PT. Indofarma)
Sejumlah 20 tablet ditimbang dan diserbukkan homogen. Sejumlah serbuk
timbang seksama setara 150 mg rifampisin dan 150 mg isoniazid, lakukan
sebanyak 6 kali. Masing-masing masukkan ke dalam labu tentukur 100 ml dan
dilarutkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen.
Saring dengan kertas saring, 10 ml filtrat pertama dibuang. Dari larutan tersebut,
dipipet 10 ml dimasukkan ke dalam labu tentukur 100 ml dan diencerkan dengan
HCl 0,1 N sampai garis tanda, dikocok sampai homogen. Dari larutan tersebut,
dipipet 5,1 ml dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan
panjang gelombang maksimum rifampisin dan pada panjang gelombang
maksimum isoniazid (hasil dapat dilihat pada tabel 13 halaman 32).
3.4.4.5.5 Penetapan Kadar Sampel Tablet Rimactazid® (PT. Sandoz)
Sejumlah 20 tablet ditimbang dan diserbukkan homogen. Sejumlah serbuk
timbang seksama setara 231 mg rifampisin dan 154 mg isoniazid, lakukan
sebanyak 6 kali. Masing-masing masukkan ke dalam labu tentukur 100 ml dan
diencerkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen.
Saring dengan kertas saring, 10 ml filtrat pertama dibuang. Dari larutan tersebut,
dipipet 10 ml dimasukkan ke dalam labu tentukur 100 ml dan diencerkan dengan
HCl 0,1 N sampai garis tanda, dikocok sampai homogen. Dari larutan tersebut,
dipipet 3,3 ml dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan
HCl 0,1 N sampai garis tanda, dikocok sampai homogen. Ukur serapan pada
panjang gelombang maksimum rifampisin dan pada panjang gelombang
maksimum isoniazid (hasil dapat dilihat pada tabel 13 halaman 32).
3.5 Uji Validasi dengan Parameter Akurasi, Presisi, Batas Deteksi dan Batas Kuantitasi
3.5.1 Uji Akurasi dengan Persen Perolehan Kembali (% Recovery)
Uji akurasi dilakukan dengan metode penambahan baku (Standard
Addition Method) yaitu dengan membuat konsentrasi 3 analit dengan rentang
spesifik 80%, 100% dan 120%, dimana masing-masing dilakukan sebanyak 3 kali
replikasi. Setiap rentang spesifik mengandung 70% analit dan 30% baku,
kemudian dianalisa dengan perlakuan yang sama seperti pada penetapan kadar
Persen perolehan kembali (% recovery) dapat dihitung dengan rumus
sebagai berikut:
% Recovery = x C
B
A−
100%
Keterangan :
A = Konsentrasi sampel yang diperoleh setelah penambahan baku.
B = Konsentrasi sampel sebelum penambahan baku.
C = Konsentrasi baku yang ditambahkan.
3.5.2 Uji Presisi
Uji presisi (keseksamaan) ditentukan dengan parameter RSD (Relative
Standard Deviasi) dengan rumus :
RSD = x100% X
SD
Keterangan:
RSD = Relatif Standar Deviasi
SD = Standar Deviasi
X = Kadar rata-rata sampel
3.5.3 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Untuk menentukan batas deteksi (LOD) dan batas kuantitasi (LOQ) dapat
digunakan rumus:
LOD=
SB = Simpangan Baku
LOD = Batas Deteksi
LOQ = Batas Kuantitasi
3.6 Analisis Data Secara Statistik
Untuk menghitung Standar Deviasi (SD) digunakan rumus:
Untuk mengetahui apakah data diterima atau ditolak digunakan rumus
t =
n SD
X X −
Dasar penolakan data jika thitung ≥ ttabel dan bila thitung mempunyai nilai
negatif, data ditolak jika t hitung ≤ -ttabel.
Untuk mencari kadar sebenarnya dengan taraf kepercayaan 99%, dengan
derajat kebebasan dk = n -1, digunakan rumus:
μ =
X
± t(
1−1/2α)
dk x SD / nKeterangan:
μ = interval kepercayaan
X = kadar rata-rata sampel
X = kadar sampel
t = harga t tabel sesuai dengan dk = n -1
α = tingkat kepercayaan
dk = derajat kebebasan
SD = standar deviasi
BAB IV
HASIL DAN PEMBAHASAN
4.1 Uji Identifikasi Rifampisin Baku (PT. Indofarma)
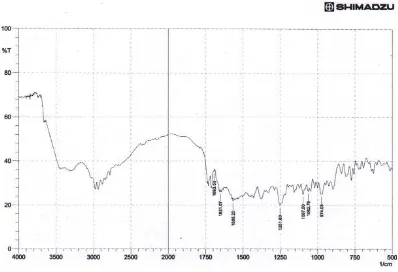
4.1.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah
Rifampisin baku yang diperoleh dari PT. Indofarma sebelum digunakan
sebagai pembanding terlebih dahulu diidentifikasi menggunakan spektrofotometer
FTIR pada rentang bilangan gelombang 4000–500 cm-1 dengan metode pellet
KBr.
Spektrum inframerah rifampisin baku (PT. Indofarma) dapat dilihat pada
gambar di bawah ini:
Peak (cm-1)
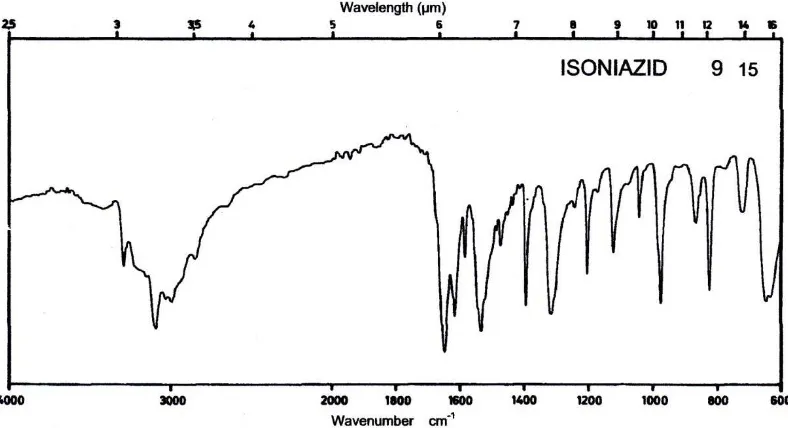
Gambar 1. Spektrum Inframerah Rifampisin Baku (PT. Indofarma)
Gambar 2. Spektrum Inframerah Rifampisin pada Literatur Pharmaceutical Sub Stance (UV/IR)
Dari hasil spektrum rifampisin diperoleh bentuk spektrum yang hampir
sama dengan spektrum pembanding yang terdapat pada library (dapat dilihat pada
gambar 2). Bilangan gelombang pada daerah sidik jari juga hampir sama dengan
bilangan gelombang yang terdapat pada literatur yaitu pada bilangan gelombang
1250, 1567, 976, 1098, 1064, 1650 cm-1.
Dari data spektrum yang diperoleh, dapat diambil kesimpulan bahwa baku
yang diidentifikasi adalah rifampisin.
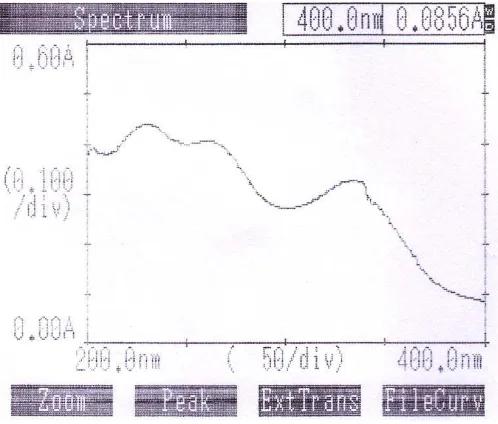
4.1.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet
Pada penelitian ini, dianalisis spektrum rifampisin baku (PT. Indofarma)
dan dibandingkan dengan panjang gelombang serapan maksimum rifampisin baku
Gambar 3. Kurva Serapan Rifampisin Baku PT. Indofarma (konsentrasi 13 mcg/ml) dalam Pelarut HCl 0,1 N
Gambar 4. Kurva Serapan Rifampisin Baku ARS (konsentrasi 13 mcg/ml) dalam Pelarut HCl 0,1 N
Dari hasil pengukuran diperoleh puncak yang sama dengan puncak
rifampisin baku (ARS). Panjang gelombang serapan maksimum rifampisin baku
Indofarma) yaitu 231 nm, hal ini berarti baku dari PT. Indofarma adalah
rifampisin. Menurut Farmakope Indonesia Ed IV, suatu penetapan kadar atau
pengujian mengenai panjang gelombang serapan maksimum tersebut tepat pada
atau dalam batas 2 nm dari panjang gelombang yang ditentukan.
4.2 Uji Identifikasi Isoniazid Baku (PT. Indofarma)
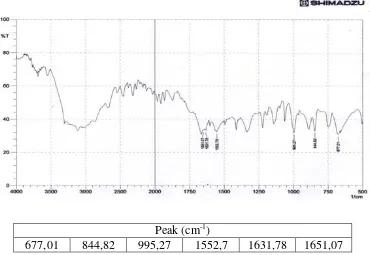
4.2.1 Uji Identifikasi Berdasarkan Data Spektrum Inframerah
Isoniazid baku yang diperoleh dari PT. Indofarma sebelum digunakan
sebagai pembanding terlebih dahulu diidentifikasi menggunakan spektrofotometer
FTIR pada rentang bilangan gelombang 4000–500 cm-1 dengan metode pellet
KBr.
Spektrum inframerah isoniazid baku (PT. Indofarma) dapat dilihat pada
gambar di bawah ini:
Peak (cm-1)
677,01 844,82 995,27 1552,7 1631,78 1651,07
Gambar 6. Spektrum Inframerah Isoniazid pada Literatur Pharmaceutical Sub Stance (UV/IR)
Dari hasil spektrum isoniazid diperoleh bentuk spektrum yang hampir
sama dengan spektrum pembanding yang terdapat pada library (dapat dilihat pada
gambar 6). Bilangan gelombang pada daerah sidik jari juga hampir sama dengan
bilangan gelombang yang terdapat pada literatur yaitu pada bilangan gelombang
1653, 1541, 1621, 676, 992, 845 cm-1.
Dari data spektrum yang diperoleh, dapat diambil kesimpulan bahwa baku
yang diidentifikasi adalah isoniazid.
4.2.2 Uji Identifikasi Berdasarkan Data Spektrum Ultraviolet
Pada penelitian ini dianalisis spektrum isoniazid baku (PT. Indofarma) dan
dibandingkan dengan panjang gelombang serapan maksimum isoniazid baku
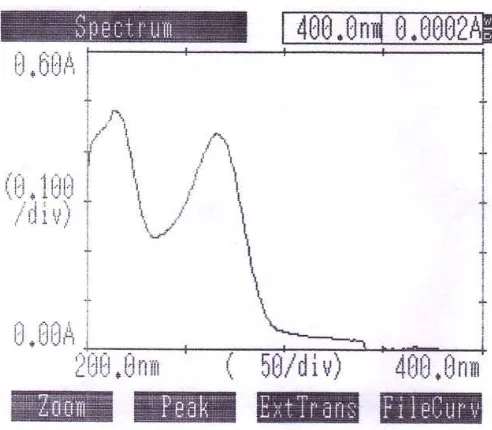
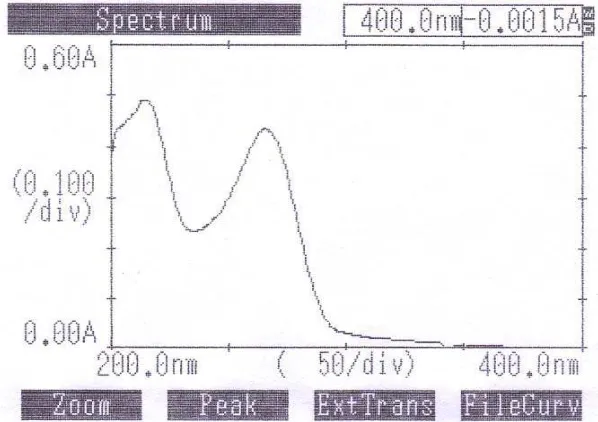
Gambar 7. Kurva Serapan Isoniazid Baku PT. Indofarma (konsentrasi 11 mcg/ml) dalam Pelarut HCl 0,1 N
Gambar 8. Kurva Serapan Isoniazid Baku BPFI (konsentrasi 11 mcg/ml)
dalam Pelarut HCl 0,1 N
Dari hasil pengukuran diperoleh puncak yang sama dengan puncak
(BPFI) dan isoniazid baku (PT. Indofarma) sama yaitu 266 nm, hal ini berarti
baku dari PT. Indofarma adalah isoniazid.
4.3 Penentuan Panjang Gelombang Maksimum
4.3.1 Penentuan Panjang Gelombang Maksimum Rifampisin
Pada penelitian ini digunakan baku rifampisin dari Asean Reference
Substance (ARS). Hasil dapat dilihat pada gambar 9.
Gambar 9. Kurva Serapan Rifampisin Baku ARS (konsentrasi 13 mcg/ml) dalam Pelarut HCl 0,1 N
Dari hasil pengukuran secara spektrofotometri ultraviolet diperoleh tiga
puncak, yaitu pada panjang gelombang 230 nm, 263 nm dan 334 nm. Menurut
Moffat, (2004) rifampisin memiliki serapan maksimum dalam larutan asam 231
nm. Serapan maksimum pada panjang gelombang 230 nm masih dapat ditoleransi.
Menurut Farmakope Indonesia Ed IV, suatu penetapan kadar atau pengujian
mengenai panjang gelombang serapan maksimum tersebut tepat pada atau dalam
batas 2 nm dari panjang gelombang yang ditentukan. Berdasarkan hal tersebut,
peneliti memilih panjang gelombang serapan maksimum 230 nm dengan serapan
0,4081.
4.3.2 Penentuan Panjang Gelombang Maksimum Isoniazid
Pada penelitian ini digunakan isoniazid baku dari Badan Pengawasan Obat
dan Makanan Republik Indonesia (BPOM RI). Hasil dapat dilihat pada gambar
10.
Tabel 2. Data Panjang Gelombang Serapan Maksimum Isoniazid Baku (BPFI)
Dari hasil pengukuran secara spektrofotometri ultraviolet diperoleh dua
puncak, yaitu pada panjang gelombang 215 nm dan 266 nm. Menurut Moffat,
(2004) isoniazid memiliki serapan maksimum dalam larutan asam 266 nm.
Menurut Farmakope Indonesia Ed IV, suatu penetapan kadar atau pengujian
mengenai panjang gelombang serapan maksimum tersebut tepat pada atau dalam
batas 2 nm dari panjang gelombang yang ditentukan. Berdasarkan hal tersebut
peneliti memilih panjang gelombang serapan maksimum 266 nm dengan serapan
0,4353.
4.3.3 Penggabungan Kurva Serapan Rifampisin dan Isoniazid
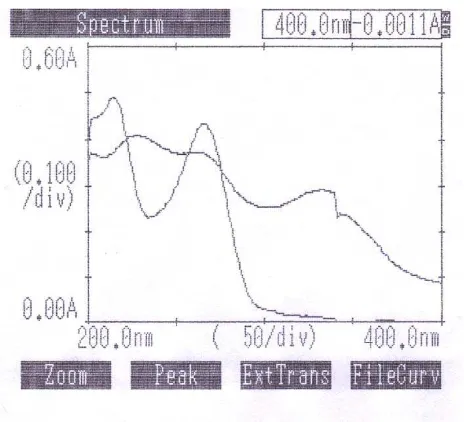
Kurva overlay antara rifampisin baku (ARS) dan isoniazid baku (BPFI)
Gambar 11. Kurva Serapan Overlay Rifampisin Baku (ARS) dan Isoniazid Baku (BPFI) dalam Pelarut HCl 0,1 N
Dari hasil pengukuran secara spktrofotometri ultraviolet diperoleh bahwa
pada pengukuran rifampisin terjadi gangguan yang disebabkan dari pengukuran
isoniazid dan sebaliknya pada pengukuran isoniazid terjadi gangguan yang
disebabkan dari pengukuran rifampisin, sehingga kurva serapan overlay
rifampisin baku (ARS) dan isoniazid baku (BPFI) merupakan spektrum absorpsi
saling tindih dua-jalan. Saling tindih dua-jalan artinya tidak ada panjang
gelombang yang masing-masing senyawa dapat di ukur tanpa mengalami
gangguan oleh yang lainnya. (Jr, R. A. Day dan Linderwood, A. L., 1990)
4.4 Penentuan Absorptivitas
4.4.1 Penentuan Absorptivitas Rifampisin (15 mcg/ml)
Pada penelitian ini digunakan rifampisin baku (ARS) yang diukur pada
panjang gelombang rifampisin (230 nm) dan isoniazid (266 nm). Hasil dapat
Tabel 3. Nilai Absorptivitas Rifampisin
NO Sampel Panjang
Gelombang
Absorbansi (A)
Absorptivitas (a)
1 Rifampisin (15 mcg/ml)
230 0,4733 0,0315
2 266 0,4276 0,0285
(perhitungan nilai absorptivitas dapat dilihat pada lampiran 28 halaman 81)
Tabel 4. Data Absorbansi Rifampisin Baku (ARS) dan Isoniazid Baku (BPFI) pada Panjang Gelombang 230 nm
4.4.2 Penentuan Absorptivitas Isoniazid (10 mcg/ml)
Pada penelitian ini digunakan isoniazid baku (BPFI) yang diukur pada
panjang gelombang rifampisin (230 nm) dan isoniazid (266 nm). Hasil dapat
dilihat pada tabel 5.
Tabel 5. Nilai Absorptivitas Isoniazid
NO Sampel Panjang
Gelombang
Absorbansi (A)
Absorptivitas (a)
1 Isoniazid (10 mcg/ml)
230 0,2336 0,0234
2 266 0,3887 0,0389
Tabel 6. Data Absorbansi Rifampisin Baku (ARS) dan Isoniazid Baku (BPFI) pada Panjang Gelombang 266 nm
4.4.3 Penentuan Absorptivitas Isoniazid (15 mcg/ml)
Pada penelitian ini digunakan rifampisin baku (ARS) yang diukur pada
panjang gelombang rifampisin (230 nm) dan isoniazid (266 nm). Hasil dapat
dilihat pada tabel 7.
Tabel 7. Nilai Absorptivitas Isoniazid
NO Sampel Panjang
Gelombang
Absorbansi (A)
Absorptivitas (a)
1 Isoniazid (15 mcg/ml)
230 0,2800 0,0187
2 266 0,5493 0,0366
Tabel 8. Data Absorptivitas Isoniazid Baku (BPFI) pada Panjang Gelombang
230 nm
Tabel 9. Data Absorptivitas Isoniazid Baku (BPFI) pada Panjang Gelombang
4.5 Penentuan Kurva Kalibrasi
4.5.1 Penentuan Kurva Kalibrasi Rifampisin Baku (ARS)
Pembuatan kurva kalibrasi rifampisin baku (ARS) dilakukan dengan
membuat berbagai konsentrasi pengukuran yaitu 6 mcg/ml, 9 mcg/ml, 12 mcg/ml,
15 mcg/ ml dan 18 mcg/ml, kemudian diukur serapannya pada panjang
gelombang 230 nm. Linearitas kurva kalibrasi dapat dilihat pada gambar 12 (data
pengamatan dan perhitungan pada lampiran 3 halaman 37).
Gambar 12. Kurva Kalibrasi Rifampisin Baku (ARS) dengan Berbagai Konsentrasi pada Panjang Gelombang 230 nm
Dari hasil pembuatan kurva kalibrasi rifampisin baku (ARS) diperoleh
hubungan yang linier antara konsentrasi dan serapan dengan koefisien korelasi
(r)=0,9998 dan persamaan regresi Y= 0,032714 X – 0,00214. Koefisien korelasi
yang diperoleh memenuhi kriteria penerimaan untuk korelasi adalah r ≥ 0,995
(Shargel, 1995).
4.5.2 Penentuan Kurva Kalibrasi Isoniazid Baku (BPFI)
Pembuatan kurva kalibrasi isoniazid baku (BPFI) dilakukan dengan
membuat berbagai konsentrasi pengukuran yaitu 6 mcg/ml, 8 mcg/ml, 10 mcg/ml,
12 mcg/ml dan 14 mcg/ml, kemudian diukur serapannya pada panjang gelombang
266 nm. Linearitas kurva kalibrasi dapat dilihat pada gambar 13 (data pengamatan
dan perhitungan pada lampiran 5 halaman 39).
Tabel 11. Data Kurva Kalibrasi Isoniazid Baku (BPFI)
Dari hasil pembuatan kurva kalibrasi isoniazid baku (BPFI) diperoleh
hubungan yang linier antara konsentrasi dan serapan dengan koefisien korelasi
(r)=0,9998 dan persamaan regresi Y= 0,039681 X + 0,004326. Koefisien korelasi
yang diperoleh memenuhi kriteria penerimaan untuk korelasi adalah r ≥ 0,995
(Shargel, 1995).
4.6 Penetapan Kadar Rifampisin dan Isoniazid Baku (PT. Indofarma)
Dilakukan penetapan kadar rifampisin baku dan isoniazid baku secara
spektrofotometri ultraviolet, menggunakan pelarut HCl 0,1 N. Hasil dapat dilihat