Lampiran 1. Daftar Spesifikasi Sampel 1. Tablet Tarivid (Kalbe)
Komposisi : Tiap tablet mengandung ofloksasin 400 mg No Batch : 525084
No Registrasi : DKL9311608317C1 Exp Date : 05 2017
2. Tablet Akilen (Sanbe Farma)
Komposisi : Tiap tablet mengandung ofloksasin 400 mg No Batch : XX2423
No Registrasi : DKL9522213017B1 Exp Date : 05 2016
3. Tablet Danoflox (Dankos)
Komposisi : Tiap tablet mengandung ofloksasin 400 mg No Batch : 432082
No Registrasi : DKL9304407317B1 Exp Date : 12 2016
4. Tablet Tariflox (Lapi)
Komposisi : Tiap tablet mengandung ofloksasin 400 mg No Batch : 80013
No Registrasi : DKL9813308917B1 Exp Date : 03 2017
5. Tablet Ofloksasin (Indofarma)
37 Lampiran 1. (Lanjutan)
No Registrasi : GKL9720921417B1 Exp Date : 11 2017
6. Tablet Ofloksasin (Novell)
Komposisi : Tiap tablet mengandung ofloksasin 400 mg No Batch : E7K039
No Registrasi : GKL0433510217B1 Exp Date : 11 2018
Lampiran 2. Perhitungan Konsentrasi Pengukuran Diketahui: Nilai absorptivitas (ɛ) = 36140 L mol-1 cm-1
BM ofloksasin = 361.388 Tebal sel (b) = 1 cm A = ɛ× b × c
c = � ɛ ×�
c = .
× mol/liter
c = 1.20172 × 10-5 mol/liter
c = 1.20172 × 10-5 mol/liter × 361.38 g/mol c = 4.34276 × 10-3 × 103 µg/ml
39
Lampiran 3. Data Kalibrasi dan Perhitungan Persamaan Regresi Ofloksasin
No Konsentrasi (µg/ml)
Lampiran 3. (Lanjutan)
Perhitungan Koefisien Korelasi (r):
r= ∑ − ∑ ∑ /
√[ ∑ 2 − ∑ 2/ ][ ∑ 2 − ∑ 2/ ]
r= , – , /
√[ − 2/ ][ , − , 2/ ]
r = , ,
41
Lampiran 4. Perhitungan Batas Deteksi dan Batas Kuantitasi Persamaan garis regresinya adalah = , − ,
No. X Y Yi Y-Yi (Y-Yi)2 (10-5)
1 0 0 0 0 0
2 2 0,197 0,1897 0,0073 5,329
3 3 0,295 0,2848 0,0102 10,404
4 4 0,380 0,3799 0,0001 0,001
5 5 0,468 0,4751 -0,0071 5,041
6 6 0,559 0,5702 -0,0112 12,544
Σ (Y-Yi)2 33,319× 10-5
� / = √∑ − �− 2 = √ , − × −5 = 912,67×10-5
��� = ×� /� � = × , , × −5 =0,28785 μg/mL
��� = � ×� /� = × , , × −5= 0,95950 μg/mL
Lampiran 5. Contoh Perhitungan Penetapan Kadar Ofloksasin dalam Sampel (Tablet Tariflox®)
Berat 20 tablet = 12217,5 mg
Kandungan ofloksasin pada etiket = 400 mg Bobot rata-rata 1 tablet = 610,875 mg
Ditimbang seksama serbuk setara dengan 50,0 mg ofloksasin, maka berat sampel yang ditimbang adalah:
Berat penimbangan sampel = �
× �× , �
= 76,3594 mg
Absorbansi ofloksasin yang diperoleh adalah 0,3868 Konsentrasi perolehan:
Y = 0.095119X – 0.0005316 0.3868 = 0.095119X – 0.0005316
X = . + . .
X = 4.07207 µg/ml
Konsentrasi ofloksasin dalam larutan yang diencerkan 250× = 4,07207 µg/ml × 250
= 1018,0175 µg/ml
Kadar ofloksasin dalam labu awal (50 ml): = 1018,0175 µg/ml × ml = 50900,875 µg
43 Lampiran 5. (Lanjutan)
Kadar perolehan ofloksasin tablet:
= , �
, � × 610,875 mg = 406,990 mg
% kadar ofloksasin = , �
Lampiran 7. Perhitungan Statistik Kadar Ofloksasin pada Tablet Tariflox®
Data diterima jika t hitung < t tabel.
47 Lampiran 7. (Lanjutan)
t hitung 4 = | −
�� √⁄ | = | − .
, ⁄√ | = − .
t hitung 5 = | −
�� √⁄ | = | − .
, ⁄√ | = − .
t hitung 6 = | −
�� √⁄ | = | − .
, ⁄√ | = − .
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar ofloksasin dalam sampel Tariflox (Lapi): μ = ± (tα/2, dk) x SD/√n)
Lampiran 8. Perhitungan Statistik Kadar Ofloksasin pada Tablet Ofloksasin
Data diterima jika t hitung < t tabel.
49 Lampiran 8. (Lanjutan)
t hitung 4 = | −
�� √⁄ | = | ,
, ⁄√ | = .
t hitung 5 = | −
�� √⁄ | = | − ,
, ⁄√ | = −0.3525
t hitung 6 = | −
�� √⁄ | = | − ,
, ⁄√ | = − .
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar ofloksasin dalam sampel Ofloksasin (Novell): μ = ± (tα/2, dk) x SD/√n)
Lampiran 9. Perhitungan Statistik Kadar Ofloksasin pada Tablet Ofloksasin
Data diterima jika t hitung < t tabel.
51
Karena data ke-1 ditolak maka dilakukan perhitungan tanpa menyertakan data ke-1.
Lampiran 9. (Lanjutan)
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar ofloksasin dalam sampel Ofloksasin (Indofarma): μ = ± (tα/2, dk) x SD/√n)
53
Lampiran 10. Perhitungan Statistik Kadar Ofloksasin pada Tablet Danoflox® (Dankos)
Data diterima jika t hitung < t tabel.
Lampiran 10. (Lanjutan)
t hitung 4 = | −
�� √⁄ | = | − ,
, ⁄√ | = − .
t hitung 5 = | −
�� √⁄ | = | ,
, ⁄√ | = .
t hitung 6 = | −
�� √⁄ | = | − ,
, ⁄√ | = − .
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar ofloksasin dalam sampel Danoflox (Dankos): μ = ± (tα/2, dk) x SD/√n)
55
Lampiran 11. Perhitungan Statistik Kadar Ofloksasin pada Tablet Tarivid® (Kalbe)
Data diterima jika t hitung < t tabel.
Lampiran 11. (Lanjutan)
t hitung 4 = | −
�� √⁄ | = | − ,
, ⁄√ | = − .
t hitung 5 = | −
�� √⁄ | = | ,
, ⁄√ | = .
t hitung 6 = | −
�� √⁄ | = | − ,
, ⁄√ | = − .
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar ofloksasin dalam sampel Tarivid (Kalbe): μ = ± (tα/2, dk) x SD/√n)
57
Lampiran 12. Perhitungan Statistik Kadar Ofloksasin pada Tablet Akilen®(Sanbe)
Data diterima jika t hitung < t tabel.
Lampiran 12. (Lanjutan)
t hitung 4 = | −
�� √⁄ | = | ,
, ⁄√ | = .
t hitung 5 = | −
�� √⁄ | = | − ,
, ⁄√ | = − .
t hitung 6 = | −
�� √⁄ | = | ,
, ⁄√ | = .
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar ofloksasin dalam sampel Akilen (Sanbe): μ = ± (tα/2, dk) x SD/√n)
59
Lampiran 14. Perhitungan Rata-rata, Standar Deviasi dan Relatif Standar Deviasi Perolehan Kembali Ofloksasin pada Tablet Tariflox®
SD = √∑ Xi− X̅ 2 −
= √ ,
= 0,7076
RSD = S
X̅x 100%
= ,
, x 100% = 0,7035%
No Kadar Perolehan Kembali
[X](%) Xi-X (Xi–X)
2
1. 100,97 0,38 0,1444
2. 101,29 0,70 0,4900
3. 100,97 0,38 0,1444
4. 101,19 0,60 0,3600
5. 101,01 0,42 0,1764
6. 100,75 0,16 0,0256
7. 100,17 -0,42 0,1764
8. 99,44 -1,15 1,3225
9. 99,51 -1,08 1,1664
61
Lampiran 15. Contoh Perhitungan Persentase Perolehan Kembali (% Recovery) Sampel yang digunakan adalah tablet Tariflox® (Lapi).
Berat 20 tablet Tariflox® (Lapi) = 12217,5 mg
Berat kesetaraan penimbangan sampel pada penetapan kadar = 50 mg Perolehan 80%
Absorbansi sebelum penambahan baku adalah 0,2138 Konsentrasi ofloksasin: Kadar ofloksasin dalam labu awal:
= konsentrasi ofloksasin × FP × volume (ml) = 2,2533 µg/ml × 250 × 50 ml
= 28166,25 µg = 28,1662 mg
Absorbansi setelah penambahan baku adalah 0,3060 Konsentrasi ofloksasin:
Lampiran 15. (Lanjutan)
X = , + . .
X = 3,2226 µg/ml Kadar ofloksasin dalam labu awal:
= konsentrasi ofloksasin × FP × volume (ml) = 3,2226 µg/ml × 250 × 50 ml
= 40282,5 µg = 40,2825 mg Maka, persen perolehan kembali ofloksasin:
= , g – , g g x 100 %= , %
Perolehan 100%
Ofloksasin 100% = x 50 mg = 50 mg
Analit 70% = 8x 50 mg = 35 mg
Sampel yang ditimbang=
x gx 12217,5 mg = 53,4515 mg
Baku 30% = x 50 mg = 15 mg
Absorbansi sebelum penambahan baku adalah 0,2667 Konsentrasi ofloksasin:
Y = 0,095119x – 0,0005316 0,2667 = 0,095119x – 0,0005316
X = , + . .
X = 2,8094µg/ml Kadar ofloksasin dalam labu awal:
63 Lampiran 15. (Lanjutan)
= 2,8094 µg/ml × 250 × 50 ml = 35117,5 µg = 35,1175 mg
Absorbansi setelah penambahan baku adalah 0,3822 Konsentrasi ofloksasin: Kadar ofloksasin dalam labu awal:
= konsentrasi ofloksasin × FP × volume (ml) = 4,0237 µg/ml × 250 × 50 ml
= 50296,25 µg = 50,29625 mg Maka, persen perolehan kembali ofloksasin:
= , g – , g g x100 %= , %
Absorbansi sebelum penambahan baku adalah 0,3238 Konsentrasi ofloksasin:
Lampiran 15. (Lanjutan)
0,3238 = 0,095119x – 0,0005316
X = , + . .
X = 3,4097 µg/ml Kadar ofloksasin dalam labu awal:
= konsentrasi ofloksasin × FP × volume (ml) = 3,4097 µg/ml × 250 × 50 ml
= 42621,25 µg = 42,62125 mg Absorbansi setelah penambahan baku adalah 0,4610 Konsentrasi ofloksasin:
Y = 0,095119x – 0,0005316 0,4610 = 0,095119x – 0,0005316
X = , + . .
X = 4,8521 µg/ml Kadar ofloksasin dalam labu awal:
= konsentrasi ofloksasin × FP × volume (ml) = 4,8521 µg/ml × 250 × 50 ml
= 60651,25 µg = 60,65125 mg Maka, persen perolehan kembali ofloksasin:
65
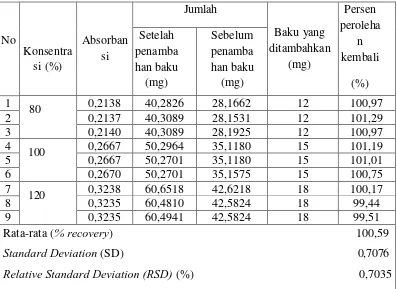
Lampiran 16. Data Uji Perolehan Kembali (% Recovery) 1. Rentang 80 %
Sebelum penambahan baku:
Lampiran 16. (Lanjutan) 2. Rentang 100 %
Sebelum penambahan baku:
67 Lampiran 16. (Lanjutan)
3. Rentang 120 %
Sebelum penambahan baku:
33
DAFTAR PUSTAKA
Agoes, G. (2008). Pengembangan Sediaan Farmasi. Edisi revisi dan perluasan. Bandung: Penerbit ITB. Halaman 197.
Al-Omar, M. A. (2009). Ofloxacin dalam Profiles of Drug Substances, Excipients, and Related Methodology. Editor: Brittain, H. G. Volume 34. Burlington: Academic Press. Halaman 265-298.
Anief, M. (2003). Ilmu Meracik Obat; Teori dan Praktik. Cetakan ke-10. Yogyakarta: Gadjah Mada University Press. Halaman 214-216.
Banker, G.S., dan Anderson, N.R. (1986). Tablet dalam The Theory and Practice of Industrial Pharmacy II, 3rd Edition. Editor: Lachman, L., Lieberman, H.A., dan Kanig, J.L. Penerjemah: Suyatmi, S. (1994). Tablet dalam Teori dan Praktek Farmasi Industri II. Edisi ke-3. Jakarta: Penerbit Universitas Indonesia (UI Press). Halaman 645-646.
Bhusari, K.P., dan Chaple, D.R. (2009). Simultaneous Spectrophotometric Estimation of Ofloxacin and Ornidazole in Tablet Dosage Form. Asian J. Research Chem. 2 (1): Jan-March, 2009; 60-62.
Cairns, D. (2004). Essentials of Pharmaceutical Chemistry, 2nd Edition. Penerjemah: Puspita, R.M. (2008). Intisari Kimia Farmasi. Edisi ke-2. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 177.
Day, R. A., dan Underwood, A. L. (1998). Quantitative Analysis, 6th Edition. Penerjemah: Sopyan, I. (2002). Analisa Kimia Kuantitatif. Edisi ke-6. Jakarta: Penerbit Erlangga. Halaman 413.
Denney, R. C., dan Sinclair, R. (1991). Visible and Ultraviolet Spectroscopy; Analytical Chemistry by Open Learning. Singapore: John Wiley and Sons. Halaman 84-85.
Ditjen POM. (1995). Farmakope Indonesia Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 1061.
Ermer, J., dan McB. Miller, J.H. (2005). Method Validation in Pharmaceutical Analysis. A Guide to Best Practice. Weinhem: Wiley-VCH Verlag GmbH & Co. KGaA. Halaman 80-89.
Gandjar, I.G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 464.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian. I (3): 117-135.
Holme, D.J., dan Peck, H. (1983). Analytical Biochemistry. New York: Longman Inc. Halaman 42-43.
Khopkar, S.M. (1985). Basic Concepts of Analytical Chemistry. Penerjemah: Saptorahardjo, A. (1990). Konsep Dasar Kimia Analitik. Jakarta: Penerbit Universitas Indonesia (UI Press). Halaman 225.
Moffat, A.C., Osselton, M.D., dan Widdop, B. (2005). Clarke’s Analysis Of Drug And Poisons. Edisi ke-3. London: Pharmaceutical Press. Electronic Version.
Munson, J. W. (1984). Pharmaceutical Analysis – Part B; Modern Methods. Penerjemah: Harjana dan Soemadi. (1991). Analisis Farmasi Metode Modern; Parwa B. Surabaya: Airlangga University Press. Halaman 334.
Okeri, H.A., dan Arhewoh, I.M. (2008). Analytical Profile of the Fluoroquinolone Antibacterials; I. Ofloxacin. African Journal of Biotechnology. Vol. 7 (6), pp. 670-680.
Puspitasari, I. (2006). Cerdas Mengenali Penyakit dan Obat. Yogyakarta: Bentang Pustaka. Halaman 4-5.
Patel, S.A., dan Patel,S.A. (2011). Simultaneous Spectrophotometric Determination of Cefpodoxime Proxetil and Ofloxacin in Tablets. Journal of Apllied Pharmaceutical Science. 01 (07); 2011: 141-144.
Satiadarma, K., Mulja, M., Tjahjono, D.H., Kartasasmita, R.E. (2004). Asas Pengembangan Prosedur Analisis. Edisi ke-1. Surabaya: Airlangga University Press. Halaman 91.
35
Purwantyastuti. Jakarta: Penerbit Bagian Farmakologi FKUI. Halaman 683.
Sudjana. (2005). Metode Statistika. Bandung: Penerbit Tarsito. Halaman 168-227.
Sukandar, E.Y., Andrajati, R., Sigit, J.I., Adnyana, I.K., Setiadi, A.P., dan Kusnandar. (2009). ISO Farmakoterapi. Cetakan Kedua. Jakarta: Penerbit PT. ISFI Penerbitan. Halaman 801-803.
Syamsuni, H.A. (2006). Ilmu Resep. Editor: Elviana, E., dan Syarief, W.R. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 166-171.
Tan, H.T., dan Rahardja, K. (2007). Obat-obat Penting; Khasiat, Penggunaan, dan Efek-efek Sampingnya. Edisi ke-6. Jakarta: PT Elex Media Komputindo. Halaman 149.
BAB II
TINJAUAN PUSTAKA
2.1 Ofloksasin
Menurut Farmakope Indonesia edisi V (2014), tablet ofloksasin mengandung ofloksasin, C18H20FN3O4, tidak kurang dari 90,0% dan tidak lebih
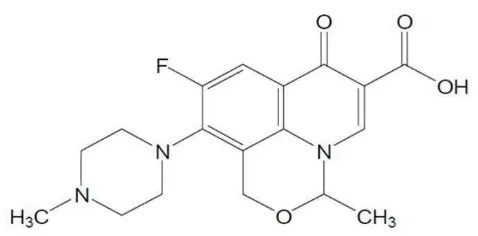
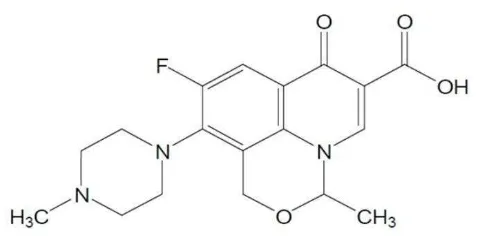
dari 110,0% dari jumlah yang tertera pada etiket. Ofloksasin memiliki rumus struktur seperti berikut ini:
Gambar 2.1 Struktur ofloksasin (Ditjen BKAK, 2014)
Beberapa karakterisitik ofloksasin yang disebutkan dalam Farmakope Indonesia edisi V (2014) antara lain:
Rumus molekul : C18H20FN3O4
Berat molekul : 361,38
Nama kimia : 9-fluoro-2,3-dihidro-3-metil-10-(4-metil-1-piperazinil)-7-okso-7H-pirido [1,2,3-de]-1,4-benzoksasin-6-karboksilat. Pemerian : Hablur atau serbuk hablur; putih kekuningan pucat sampai
putih kekuningan terang.
6
Analisa elemen : C, 59.83%; H, 5.5%; F, 5.26%; N, 11.63%; O, 17.71% (Al-Omar, 2009).
pH : 3.8-5.5 (Al-Omar, 2009). 2.1.1 Mekanisme Kerja
Ofloksasin merupakan antibiotik golongan kuinolon, berkhasiat bakterisid pada fase pertumbuhan kuman berdasarkan inhibisi dua enzim bakteri yaitu DNA-gyrase dan topo-isomerase IV sehingga sintesis DNA-nya terganggu. DNA-gyrase adalah enzim yang mengkompres DNA bakteri sehingga dapat diinkorporasi dalam sel bakteri, sedangkan topo-isomerase diperlukan bagi struktur ruang DNA. Enzim tersebut hanya terdapat pada pada kuman dan tidak pada sel dari organisme lebih tinggi, sehingga sintesa DNA manusia tidak dihambat (Tan dan Rahardja, 2007).
2.1.2 Farmakologi
Ofloksasin digunakan untuk infeksi saluran kemih, saluran nafas bawah, gonore uretritis dan servisitis (Sukandar, dkk., 2009). Ofloksasin ini merupakan antibakteri yang memiliki spektrum kerja luas (broad spectrum), dapat digunakan untuk pengobatan infeksi yang disebabkan oleh bakteri gram positif dan bakteri gram negatif (Okeri dan Arhewoh, 2008).
2.1.3 Efek Samping
Efek samping obat ini yang terpenting ialah pada saluran cerna dan susunan saraf pusat. Manifestasi pada saluran cerna, terutama berupa mual dan hilang nafsu makan, merupakan efek samping yang paling sering dijumpai. Efeksamping pada susunan saraf pusat umumnya bersifat ringan berupa sakit kepala, vertigo, dan insomnia (Setiabudy, 1995).
2.1.4 Dosis
Sukandar dkk., (2009) menyebutkan pembagian dosis ofloksasin sebagai berikut:
1. Oral
Infeksi saluran kemih: 200-400 mg/hari, sebaiknya pagi hari. Pada infeksi saluran kemih atas dapat dinaikkan sampai 2× 400 mg/hari. Infeksi saluran kemih bawah: 400 mg/hari, bila perlu dinaikkan menjadi 2× 400 mg/hari. Gonore tanpa komplikasi: 400 mg dosis tunggal. Uretritis atau servisitis non gonokokus: 400 mg/hari dalam dosis terbagi atau tunggal.
2. Infus intravena: (200 mg/30 menit)
Infeksi saluran kemih dengan komplikasi: 200 mg/hari. Infeksi saluran kemih bawah: 200 mg dua kali sehari. Infeksi kulit dan jaringan lunak: 400 mg dua kali sehari. Infeksi berat atau dengan komplikasi: 400 mg dua kali sehari.
2.2 Tablet
8
Berdasarkan metode pembuatan, dapat digolongkan sebagai tablet cetak dan tablet kempa. Sebagian besar tablet dibuat dengan cara pengempaan dan merupakan bentuk sediaan yang paling banyak digunakan.
2.2.1 Keuntungan dan Kerugian Tablet
Banker dan Anderson (1986), menyebutkan beberapa hal berikut sebagai keunggulan utama sediaan tablet:
1. Tablet merupakan bentuk sediaan yang utuh dan menawarkan kemampuan terbaik dari semua bentuk sediaan oral untuk ketepatan ukuran serta variabilitas kandungan yang paling rendah.
2. Tablet merupakan bentuk sediaan yang ongkos pembuatannya paling rendah.
3. Tablet merupakan bentuk sediaan oral yang paling ringan dan paling kompak.
4. Tablet merupakan bentuk sediaan oral yang paling mudah dan murah untuk dikemas serta dikirim.
5. Pemberian tanda pengenal produk pada tablet paling mudah dan murah; tidak memerlukan langkah pekerjaan tambahan bila menggunakan permukaan pencetak yang bermonogram atau berhiasan timbul.
6. Tablet paling mudah ditelan serta paling kecil kemungkinan tertinggal di tenggorokan, terutama bila bersalut yang memungkinkan pecah/hancurnya tablet tidak segera terjadi.
8. Tablet merupakan bentuk sediaan oral yang paling mudah untuk diproduksi secara besar-besaran.
9. Tablet merupakan bentuk sediaan oral yang memiliki sifat pencampuran kimia, mekanik dan stabilitas mikrobiologi yang paling baik.
Disebutkan juga beberapa kerugian tablet, diantaranya:
1. Beberapa obat tidak dapat dikempa menjadi padat dan kompak, tergantung pada keadaan amorfnya, flokulasi, atau rendahnya berat jenis. 2. Obat yang sukar dibasahkan, lambat melarut, dosisnya cukupan atau
tinggi, absorbsi optimumnya tinggi melalui saluran cerna atau setiap kombinasi dari sifat di atas, akan sukar atau tidak mungkin diformulasi dan dipabrikasi dalam bentuk tablet yang masih menghasilkan bioavailabilitas obat cukup.
3. Obat yang rasanya pahit, obat dengan bau yang tidak dapat dihilangkan, atau obat yang peka terhadap oksigen atau kelembapan udara perlu pengapsulan atau penyelubungan dulu sebelum dikempa (bila mungkin) atau memerlukan penyalutan dulu. Pada keadaan ini kapsul dapat merupakan jalan keluar yang terbaik serta lebih murah.
2.2.2 Eksipien Formulasi Tablet
Agoes (2008), mengutarakan bahwa komposisi tablet umumnya terdiri atas bahan aktif dan eksipien. Eksipien ditambahkan dengan berbagai fungsi dan tujuan spesifik sebagai berikut:
1. Pengisi/pengencer 2. Pengikat
10 4. Pelincir (lubricants)
5. Anti lengket (anti adhesive) 6. Pelicin (glidants)
7. Pembasah (wetting/surface active agents) 8. Zat warna (colours/pigments)
9. Peningkat rasa (flavors) 10.Pemanis
11.Penutup rasa.
2.2.3 Penggolongan Tablet
Syamsuni (2006), menggolongkan tablet ke dalam beberapa jenis, antara lain:
a. Berdasarkan metode pembuatannya;
1. Tablet cetak. Dibuat dari bahan obat dan bahan pengisi, dengan memberikan tekanan yang rendah ke dalam lubang cetakan.
2. Tablet kempa. Dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan cetakan baja. Umumnya mengandung zat aktif, bahan pengisi, bahan pengikat, desintegran, dan lubrikan, tetapi dapat juga mengandung bahan pewarna, bahan pengaroma, dan bahan pemanis. b. Berdasarkan distribusi obat dalam tubuh;
1. Bekerja lokal; misalnya tablet hisap untuk pengobatan pada rongga mulut.
2. Bekerja sistemik; per oral. c. Berdasarkan jenis bahan penyalut;
2. Tablet salut selaput (film-coated tablet) 3. Tablet salut kempa
4. Tablet salut enterik (enteric-coated tablet) 5. Tablet lepas lambat (sustained-release tablet). d. Berdasarkan cara pemakaian;
1. Tablet biasa/tablet telan
2. Tablet kunyah (chewable tablet)
3. Tablet isap (lozenges, trochisi, pastiles) 4. Tablet larut (effervescent tablet)
5. Tablet implan (pelet)
6. Tablet hipodermik (hypodermic tablet) 7. Tablet bukal (buccal tablet)
8. Tablet sublingual 9. Tablet vagina (ovula). 2.2.4 Syarat-syarat Tablet
Adapun syarat-syarat formulasi tablet menurut Anief (2003), antara lain: 1. Memenuhi keseragaman ukuran
2. Memenuhi keseragaman bobot dan keseragaman kandungan 3. Memenuhi waktu hancur
4. Memenuhi kekerasan tablet 5. Memenuhi keregasan tablet.
2.3 Spektrofotometri Ultraviolet-Visibel (UV-Vis)
12
sering digunakan dalam analisis farmasi meliputi spektrofotometri ultraviolet, cahaya tampak, infra merah dan serapan atom. Jangkauan panjang gelombang untuk daerah ultraviolet adalah 190-380 nm, daerah cahaya tampak 380-780 nm, daerah infra merah dekat 780-3000 nm, dan daerah infra merah jauh 2,5-40 µm atau 4000-250 cm-1 (Ditjen POM, 1995).
Spektrofotometer adalah alat untuk mengukur transmitan atau serapan suatu sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan penggabungan dari dua fungsi alat yang terdiri dari spektrometer yang menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer sebagai alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi (Gandjar dan Rohman, 2007).
Pada spektrofotometer, panjang gelombang yang benar-benar terseleksi dapat diperoleh dengan bantuan alat pengurai cahaya seperti prisma. Suatu spektrofotometer tersusun dari spektrum tampak yang kontinu, monokromator, sel pengabsorpsi untuk larutan sampel atau blangko dan suatu alat untuk mengukur perbedaan absorpsi antara sampel dan blangko ataupun pembanding (Khopkar, 1990).
Menurut Day dan Underwood (1998), unsur-unsur terpenting suatu spektrofotometer adalah sebagai berikut:
2. Monokromator: digunakan untuk memperoleh sumber sinar yang monokromatis. Alatnya berupa prisma untuk mengarahkan sinar monokromatis yang diinginkan dari hasil penguraian.
3. Kuvet (sel): digunakan sebagai wadah sampel untuk menaruh cairan ke dalam berkas cahaya spektrofotometer. Kuvet itu haruslah meneruskan energi radiasi dalam daerah spektrum yang diinginkan. Pada pengukuran di daerah sinar tampak, kuvet dapat digunakan, tetapi untuk pengukuran pada daerah ultraviolet kita harus menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini. Kuvet tampak dan ultraviolet yang khas mempunyai ketebalan 1 cm, namun tersedia kuvet dengan ketebalan yang sangat beraneka, mulai dari ketebalan kurang dari 1 mm sampai 10 cm bahkan lebih.
4. Detektor: Peranan detektor penerima adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang.
2.3.1 Penyerapan Radiasi
14
dengan banyaknya molekul yang menyerap radiasi, sehingga spektra absorpsi dapat digunakan untuk analisis kuantitatif (Gandjar dan Rohman, 2007).
Sistem ikatan rangkap terkonjugasi merupakan kromofor yang dapat menyerap radiasi ultraviolet. Salah satu kromofor yang paling sederhana adalah benzen (Watson, 2005). Gugus fungsi seperti –OH, -O, -NH2, dan –OCH3 yang
memberikan transisi n → π* disebut gugus auksokrom. Gugus ini adalah gugus
yang tidak dapat menyerap radiasi ultraviolet-sinar tampak, tetapi apabila gugus ini terikat pada gugus kromofor mengakibatkan pergeseran panjang gelombang ke arah yang lebih besar (efek batokromik atau pergeseran merah) dan disertai peningkatan intensitas (efek hiperkromik) (Gandjar dan Rohman, 2007).
2.3.2 Hukum Lambert-Beer
Menurut Hukum Lambert, serapan berbanding lurus terhadap ketebalan sel yang disinari. Sedangkan menurut Beer, serapan berbanding lurus dengan konsentrasi. Kedua pernyataan ini dapat dijadikan satu dalam Hukum Lambert-Beer, sehingga diperoleh bahwa serapan berbanding lurus terhadap konsentrasi dan ketebalan sel, yang dapat ditulis dengan persamaan:
Jadi dengan hukum Lambert-Beer konsentrasi dapat dihitung dari ketebalan sel dan serapan. Absorptivitas merupakan suatu tetapan dan spesifik untuk setiap molekul pada panjang gelombang dan pelarut tertentu. Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,6. Anjuran ini berdasarkan anggapan bahwa pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi adalah paling minimal (Gandjar dan Rohman, 2007).
Menurut Denney dan Sinclair (1991) hukum Lambert-Beer terdapat beberapa pembatasan yaitu:
1. Larutan yang menyerap cahaya adalah campuran yang homogen. 2. Menggunakan sinar monokromatis.
3. Rendahnya konsentrasi dari senyawa yang menyerap cahaya.
Parameter kekuatan energi radiasi yang diabsorpsi oleh molekul adalah absorbansi (A) yang dalam batas konsentrasi tertentu nilainya sebanding dengan banyaknya molekul yang mengabsorpsi radiasi. Senyawa yang tidak mengabsorpsi radiasi ultraviolet-sinar tampak dapat juga ditentukan dengan spektrofotometri ultraviolet-sinar tampak, apabila ada reaksi kimia yang dapat mengubahnya menjadi kromofor atau dapat disambungkan dengan suatu pereaksi kromofor (Gandjar dan Rohman, 2007).
2.3.3 Kegunaan Spektrofotometri Ultraviolet - Visibel (UV-Vis)
16
Menurut Holme dan Peck (1983), analisis kuantitatif secara spektrofotometri dapat dilakukan antara lain dengan metode regresi dan pendekatan.
1. Metode Regresi
Analisis kuantitatif dengan metode regresi yaitu dengan menggunakan persamaan garis regresi yang didasarkan pada harga serapan dan konsentrasi standar yang dibuat dalam beberapa konsentrasi, paling sedikit menggunakan 5 rentang konsentrasi yang meningkat yang dapat memberikan serapan yang linier, kemudian diplot menghasilkan suatu kurva yang disebut dengan kurva kalibrasi. Konsentrasi suatu sampel dapat dihitung berdasarkan kurva tersebut.
2. Metode Pendekatan
Analisis kuantitatif dengan cara ini dilakukan dengan membandingkan serapan standar yang konsentrasinya diketahui dengan serapan sampel. Konsentrasi sampel dapat dihitung melalui rumus perbandingan:
Cs = As.Cb/Ab
Dimana:
As = serapan sampel
Ab = serapan standar
Cb = konsentrasi standar
Cs = konsentrasi sampel
2.4 Validasi
Validasi metode adalah suatu proses yang menunjukkan bahwa prosedur analitik telah sesuai dengan penggunaan yang dikehendaki. Validasi merupakan persyaratan mendasar yang diperlukan untuk menjamin kualitas dan hasil dari semua aplikasi analitik (Ermer dan McB. Miller, 2005).
Beberapa parameter validasi metode menurut USP antara lain presisi, akurasi, batas deteksi, batas kuantitasi, spesifisitas, linieritas dan rentang, kekasaran (ruggedness), dan ketahanan (robutness) (Gandjar dan Rohman, 2007).
2.4.1 Akurasi (Kecermatan)
Akurasi atau kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan, dan dapat ditentukan dengan dua cara yaitu metode simulasi (spiked-placebo recovery) atau metode penambahan baku (standard addition method). Dalam metode simulasi, sejumlah analit bahan murni (senyawa
pembanding kimia) ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan. Bila tidak memungkinkan membuat sampel sampel plasebo maka dapat dipakai metode penambahan baku, yaitu dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa (Harmita, 2004).
18
% perolehan kembali = F− A
∗A x 100 %
Keterangan:
CF = konsentrasi sampel yang diperoleh setelah penambahan baku
CA = konsentrasi sampel sebelum penambahan baku
C*A = konsentrasi baku yang ditambahkan
2.4.2 Presisi (Keseksamaan)
Presisi adalah derajat kesesuaian di antara masing-masing hasil uji, jika prosedur analisis ditetapkan berulang kali pada sejumlah cuplikan yang diambil dari satu sampel homogen. Presisi dinyatakan sebagai deviasi standar atau deviasi standar relatif (Satiadarma, dkk., 2004).
Parameter-parameter seperti simpangan baku (SD), simpangan baku relatif (Relative Standard Deviation) dan derajat kepercayaan haruslah dikalkulasi untuk mendapatkan tingkat presisi tertentu. Nilai simpangan baku relatif dinyatakan memenuhi persyaratan jika < 2% (Ermer dan McB. Miller, 2005).
Simpangan baku relatif =
2.4.3 Batas Deteksi dan Batas Kuantitasi
2.4.4 Linearitas dan Rentang
Linearitas menunjukkan kemampuan suatu metode analisis untuk memperoleh hasil pengujian yang sesuai dengan kisaran konsentrasi analit tertentu. Hal ini dapat dilakukan dengan cara membuat kurva kalibrasi dari beberapa set larutan baku yang telah diketahui konsentrasinya. Persamaan garis yang digunakan pada kurva kalibrasi diperoleh dari persamaan y = ax + b. Persamaan ini akan menghasilkan koefisien korelasi (r). Koefisien korelasi inilah yang digunakan untuk mengetahui linearitas suatu metode analisis. Kelinieran suatu metode analisis adalah kemampuan untuk menunjukkan bahwa nilai hasil uji langsung atau setelah diolah secara matematika, proporsional dengan konsentrasi analit dalam sampel dalam batas rentang konsentrasi tertentu (Satiadarma, dkk., 2004).
20 BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Biofarmasi dan Farmakokinetika Fakultas Farmasi Universitas Sumatera Utara pada bulan Juli tahun 2015.
3.2 Alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit alat spektrofotometer UV-Vis (UV mini-1240 Shimadzu), neraca analitik (Mettler Toledo), kuvet, lumpang dan alu, alat-alat gelas serta alat-alat lainnya yang diperlukan dalam penyiapan sampel dan larutan. Gambar alat spektrofotometer UV-Vis dapat dilihat pada Lampiran 20.
3.3 Bahan
Bahan-bahan yang digunakan adalah Methanol (E.Merck®), ofloksasin BP (Sigma-Aldrich), tablet Ofloksasin 400 mg (Novell), tablet Ofloksasin 400 mg (Indofarma), tablet Tariflox® 400 mg (Lapi), tablet Tarivid® 400 mg (Kalbe), tablet Akilen® 400 mg (Sanbe Farma), tablet Danoflox® 400 mg (Dankos).
3.4 Pengambilan Sampel
merk dagang dan dua jenis tablet generik. Data spesifikasi sampel dapat dilihat pada Lampiran 1.
3.5 Prosedur Penelitian
3.5.1 Pembuatan Larutan Induk Baku Ofloksasin
Ditimbang 50 mg ofloksasin, dimasukkan ke dalam labu tentukur 50 ml, ditambahkan metanol dan dikocok hingga larut, lalu dicukupkan sampai garis tanda dengan metanol sehingga diperoleh larutan dengan konsentrasi 1000 µg/ml, larutan ini disebut larutan induk baku I (LIB I). Dari larutan ini dipipet 5 ml, dimasukkan ke dalam labu tentukur 50 ml, diencerkan dengan metanol sampai garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 100 µg/ml (LIB II).
3.5.2 Penentuan Panjang Gelombang Serapan Maksimum
Dipipet 2 ml dari larutan induk baku II (100 µg/ml), dimasukkan ke dalam labu tentukur 50 ml, diencerkan dengan metanol hingga garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 4,0 µg/ml. Kemudian diukur serapan pada panjang gelombang 200-400 nm. Kurva serapan maksimum ofloksasin dapat dilihat pada Gambar 3.1.
3.5.3 Pembuatan Kurva Kalibrasi
22
3.5.4 Penentuan Kadar Ofloksasin dalam Sediaan Tablet
Dua puluh tablet yang mengandung ofloksasin 400 mg ditimbang, lalu digerus dalam lumpang sampai halus dan homogen. Kemudian ditimbang seksama sejumlah serbuk setara dengan 50 mg ofloksasin (penimbangan serbuk sebanyak 6 kali pengulangan), dimasukkan ke dalam labu tentukur 50 ml, ditambahkan metanol, dikocok dan diencerkan dengan metanol sampai garis tanda. Larutan tersebut kemudian disaring, lebih kurang 10 ml filtrat pertama dibuang. Filtrat selanjutnya ditampung. Dipipet 0,2 ml filtrat, dimasukkan ke dalam labu tentukur 50 ml, diencerkan dengan metanol sampai garis tanda, dikocok dan diukur serapannya pada panjang gelombang maksimum yang diperoleh. Kadar ofloksasin dalam sediaan tablet dapat dilihat pada Lampiran 4.
Konsentrasi ditentukan dengan menggunakan persamaan regresi yaitu: Y = aX + b
3.6 Uji Validasi 3.6.1 Uji Akurasi
Menurut Harmita (2004) uji akurasi dilakukan dengan metode penambahan baku (Standard Addition Method), yaitu dengan membuat 3 konsentrasi analit sampel dengan rentang spesifik 80 %, 100 %, 120 %, dimana masing-masing dilakukan sebanyak 3 kali replikasi. Setiap rentang spesifik mengandung 70 % analit dan 30 % baku pembanding, kemudian dianalisa dengan perlakuan yang sama seperti pada penetapan kadar sampel.
% perolehan kembali = F− A
∗A x 100 %
Keterangan:
CF = konsentrasi sampel yang diperoleh setelah penambahan baku
CA = konsentrasi sampel sebelum penambahan baku
C*A = konsentrasi baku yang ditambahkan
3.6.2 Uji Presisi
Menurut Sudjana (2005) untuk uji presisi (keseksamaan) ditentukan dengan parameter RSD (Relative Standard Deviasi) dengan rumus :
RSD =
Mencari standar deviasi (SD) digunakan rumus:
Keterangan:
RSD = standar deviasi relatif SD = standar deviasi
X = kadar rata-rata sampel
3.6.3 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
24
Batas kuantitasi ataulimit of quantitation (LOQ) adalah kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004). Batas kuantitasi dapat dihitung dengan rumus sebagai berikut:
Batas kuantitasi = � /
� �
3.6.4 Analisis Data Secara Statistik
Menurut Sudjana (2005) analisis data secara statistik menggunakan uji t. Untuk mengetahui apakah data diterima atau ditolak digunakan rumus seperti di bawah ini:
Untuk mencari kadar sebenarnya dengan taraf kepercayaan 99% dengan derajat kebebasan dk= n-1, digunakan rumus:
µ = X̅ ± t (α/2, dk) x SD/√n ) α = tingkat kepercayaaan
BAB IV
HASIL DAN PEMBAHASAN
Moffat dkk., (2005) menyebutkan bahwa ofloksasin memiliki serapan maksimum dalam larutan asam pada panjang gelombang 225, 226, 256, dan 326 nm; dan dalam larutan basa pada panjang gelombang 288 dan 332 nm. Spektrum ofloksasin dalam etanol memiliki serapan maksimum pada panjang gelombang 225,6 nm (A11 = 477), 299,4 nm (A11 = 996), 328,8 nm (A11 = 385) (Al-Omar,
2009). Berdasarkan keterangan tersebut maka ofloksasin dalam sediaan tablet dapat ditetapkan kadarnya secara spektrofotometri ultraviolet.
4.1 Penentuan Panjang Gelombang Serapan Maksimum Ofloksasin
Sebelum melakukan penetapan kadar dengan menggunakan metode spektrofotometri ultraviolet terlebih dahulu dilakukan penentuan panjang gelombang maksimum meskipun panjang gelombangnya telah tercantum dalam literatur. Hal ini dikarenakan oleh berbedanya panjang gelombang suatu senyawa jika ditentukan pada kondisi dan alat yang berbeda.
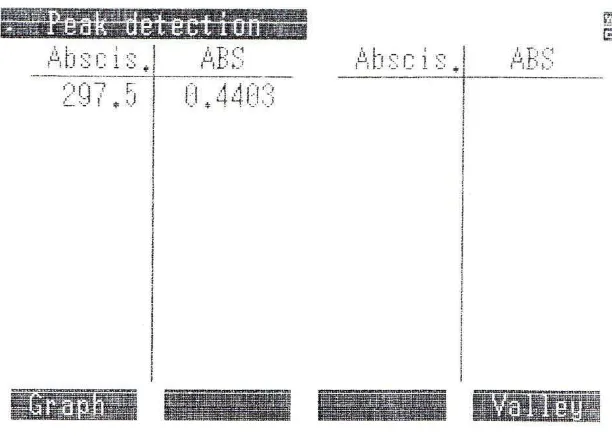
Penentuan panjang gelombang ini dilakukan pada panjang gelombang 200-400 nm dan pada konsentrasi yang memberikan serapan dengan kesalahan fotometrik terkecil (±0,4343). Untuk mendapatkan konsentrasi tersebut dapat dihitung dengan menggunakan nilai absorptivitas molar (ε) yang tertera pada
literatur, yaitu 36140L mol-1 cm-1 (Patel dan Patel, 2011).
26
nm dengan nilai serapan sebesar 0,4403. Kurva serapan ofloksasin dan data absorbansinya dapat dilihat pada Gambar 4.1 dan Tabel 4.1.
Gambar 4.1 Kurva serapan ofloksasin pada konsentrasi 4,0 µg/ml
Tabel 4.1 Data absorbansi dari kurva serapan maksimum
tablet yang beredar di pasaran. Menurut Satiadarma dkk., (2004), penentuan kadar dilakukan dengan mengukur serapan pada panjang gelombang maksimum, agar dapat memberikan serapan tertinggi untuk setiap konsentrasi.
4.2 Pembuatan Kurva Kalibrasi
Penentuan linearitas kurva kalibrasi ofloksasin dengan konsentrasi 2,0; 3,0; 4,0; 5,0; dan 6,0 µg/ml pada panjang gelombang 297,5 nm menunjukkan hubungan yang linier antara absorbansi dengan konsentrasi. Kurva kalibrasi ofloksasin pada panjang gelombang 297,5 nm dapat dilihat pada Gambar 4.2 dibawah ini.
Gambar 4.2 Kurva kalibrasi ofloksasin pada panjang gelombang 297,5 nm Gambar 4.2 menunjukkan hubungan yang linier antara konsentrasi dan absorbansi. Persamaan garis regresi yang diperoleh yaitu Y = 0,095119X - 0,0005316 dengan nilai koefisien korelasi (r) sebesar 0,9995. Nilai r ≥ 0,995
28
4.3 Penentuan Kadar Ofloksasin dalam Sediaan Tablet
Hasil penentuan kadar ofloksasin dalam sediaan tablet dapat dilihat pada Tabel 4.2 dibawah ini.
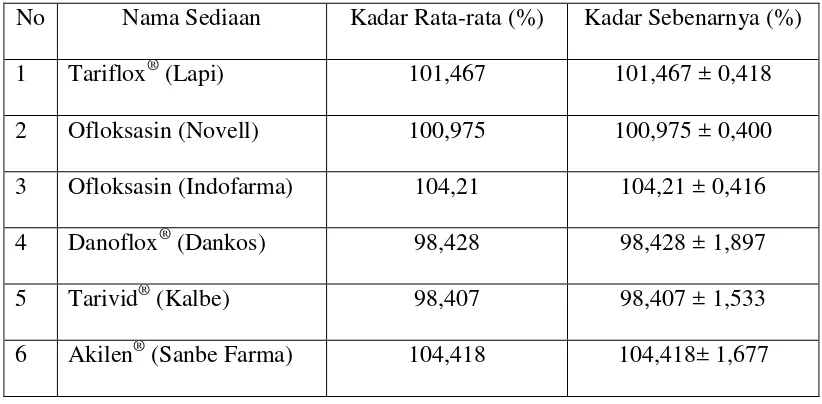
Tabel 4.2 Kadar rata-rata ofloksasin pada sediaan tablet
No Nama Sediaan Kadar Rata-rata (%) Kadar Sebenarnya (%) 1 Tariflox® (Lapi) 101,467 101,467 ± 0,418 2 Ofloksasin (Novell) 100,975 100,975 ± 0,400 3 Ofloksasin (Indofarma) 104,21 104,21 ± 0,416 4 Danoflox® (Dankos) 98,428 98,428 ± 1,897
5 Tarivid® (Kalbe) 98,407 98,407 ± 1,533 6 Akilen® (Sanbe Farma) 104,418 104,418± 1,677
Data pada tabel di atas menunjukkan bahwa kadar ofloksasin dalam sediaan tablet generik maupun merk dagang memenuhi persyaratan kadar yang tertera pada FI V, yaitu tidak kurang 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Tablet ofloksasin generik memiliki mutu yang setara dengan tablet ofloksasin merk dagang dalam hal terpenuhinya syarat kadar menurut FI V.
4.4 Uji Validasi
Pada penelitian ini dilakukan uji validasi dengan metode penambahan bahan baku (standard addition method) terhadap sampel tablet Tariflox (Lapi), yang meliputi uji akurasi dengan parameter persen perolehan kembali (% recovery), uji presisi dengan parameter RSD (relative standard deviation), batas
Uji akurasi dengan parameter persen perolehan kembali dilakukan dengan membuat 3 konsentrasi analit dengan rentang spesifik 80%, 100%, dan 120% dihitung dari kesetaraan penimbangan pada penetapan kadar sampel, masing-masing dengan 3 replikasi dan setiap rentang spesifik mengandung 70% analit dan 30% baku pembanding. Contoh perhitungan persen perolehan kembali dapat dilihat pada Lampiran 15.
Data hasil pengujian perolehan kembali ofloksasin pada tablet Tariflox® (Lapi) dengan metode penambahan bahan baku (standard addition method) dapat dilihat pada Tabel 4.3 berikut.
Tabel 4.3 Data hasil pengujian perolehan kembali ofloksasin pada tablet Tariflox® (Lapi) dengan metode penambahan baku (Standard Addition Method)
30
kembali tersebut telah memenuhi syarat akurasi dan presisi untuk validasi prosedur analitik dimana rentang rata-rata hasil persen perolehan kembali adalah 98-102% (Harmita, 2004). Hasil uji presisi dengan parameter standar deviasi relatif (RSD) adalah sebesar 0,7035%. Nilai RSD yang diizinkan adalah ≤ 2%. Dengan demikian dapat dinyatakan hasil yang diperoleh telah memenuhi syarat presisi untuk validasi metode analisis karena lebih kecil dari 2%. Perhitungan standar deviasi relatif dapat dilihat pada Lampiran 14.
Batas deteksi dan batas kuantitasi dihitung dari persamaan regresi yang diperoleh dari kurva kalibrasi. Batas deteksi (LOD) dan batas kuantitasi (LOQ) ofloksasin yang diperoleh pada penelitian ini adalah 0,2878 μg/ml dan 0,9595
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang dilakukan, maka dapat disimpulkan bahwa: a. Metode spektrofotometri ultraviolet dapat digunakan untuk menetapkan
kadar ofloksasin dalam sediaan tablet dengan batas deteksi (LOD) dan batas kuantitasi (LOQ) sebesar 0,2878 µg/ml dan 0,9595 µg/ml, dan memenuhi syarat uji validasi dengan persen perolehan kembali yaitu 100,59% (berada pada rentang 98-102%) serta nilai standar deviasi relatif sebesar 0,7035% (syaratnya adalah ≤ 2%).
32 5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Ofloksasin
Menurut Farmakope Indonesia edisi V (2014), tablet ofloksasin mengandung ofloksasin, C18H20FN3O4, tidak kurang dari 90,0% dan tidak lebih
dari 110,0% dari jumlah yang tertera pada etiket. Ofloksasin memiliki rumus struktur seperti berikut ini:
Gambar 2.1 Struktur ofloksasin (Ditjen BKAK, 2014)
Beberapa karakterisitik ofloksasin yang disebutkan dalam Farmakope Indonesia edisi V (2014) antara lain:
Rumus molekul : C18H20FN3O4
Berat molekul : 361,38
Nama kimia : 9-fluoro-2,3-dihidro-3-metil-10-(4-metil-1-piperazinil)-7-okso-7H-pirido [1,2,3-de]-1,4-benzoksasin-6-karboksilat. Pemerian : Hablur atau serbuk hablur; putih kekuningan pucat sampai
putih kekuningan terang.
6
Analisa elemen : C, 59.83%; H, 5.5%; F, 5.26%; N, 11.63%; O, 17.71% (Al-Omar, 2009).
pH : 3.8-5.5 (Al-Omar, 2009). 2.1.1 Mekanisme Kerja
Ofloksasin merupakan antibiotik golongan kuinolon, berkhasiat bakterisid pada fase pertumbuhan kuman berdasarkan inhibisi dua enzim bakteri yaitu DNA-gyrase dan topo-isomerase IV sehingga sintesis DNA-nya terganggu. DNA-gyrase adalah enzim yang mengkompres DNA bakteri sehingga dapat diinkorporasi dalam sel bakteri, sedangkan topo-isomerase diperlukan bagi struktur ruang DNA. Enzim tersebut hanya terdapat pada pada kuman dan tidak pada sel dari organisme lebih tinggi, sehingga sintesa DNA manusia tidak dihambat (Tan dan Rahardja, 2007).
2.1.2 Farmakologi
Ofloksasin digunakan untuk infeksi saluran kemih, saluran nafas bawah, gonore uretritis dan servisitis (Sukandar, dkk., 2009). Ofloksasin ini merupakan antibakteri yang memiliki spektrum kerja luas (broad spectrum), dapat digunakan untuk pengobatan infeksi yang disebabkan oleh bakteri gram positif dan bakteri gram negatif (Okeri dan Arhewoh, 2008).
2.1.3 Efek Samping
Efek samping obat ini yang terpenting ialah pada saluran cerna dan susunan saraf pusat. Manifestasi pada saluran cerna, terutama berupa mual dan hilang nafsu makan, merupakan efek samping yang paling sering dijumpai. Efeksamping pada susunan saraf pusat umumnya bersifat ringan berupa sakit kepala, vertigo, dan insomnia (Setiabudy, 1995).
2.1.4 Dosis
Sukandar dkk., (2009) menyebutkan pembagian dosis ofloksasin sebagai berikut:
1. Oral
Infeksi saluran kemih: 200-400 mg/hari, sebaiknya pagi hari. Pada infeksi saluran kemih atas dapat dinaikkan sampai 2× 400 mg/hari. Infeksi saluran kemih bawah: 400 mg/hari, bila perlu dinaikkan menjadi 2× 400 mg/hari. Gonore tanpa komplikasi: 400 mg dosis tunggal. Uretritis atau servisitis non gonokokus: 400 mg/hari dalam dosis terbagi atau tunggal.
2. Infus intravena: (200 mg/30 menit)
Infeksi saluran kemih dengan komplikasi: 200 mg/hari. Infeksi saluran kemih bawah: 200 mg dua kali sehari. Infeksi kulit dan jaringan lunak: 400 mg dua kali sehari. Infeksi berat atau dengan komplikasi: 400 mg dua kali sehari.
2.2 Tablet
8
Berdasarkan metode pembuatan, dapat digolongkan sebagai tablet cetak dan tablet kempa. Sebagian besar tablet dibuat dengan cara pengempaan dan merupakan bentuk sediaan yang paling banyak digunakan.
2.2.1 Keuntungan dan Kerugian Tablet
Banker dan Anderson (1986), menyebutkan beberapa hal berikut sebagai keunggulan utama sediaan tablet:
1. Tablet merupakan bentuk sediaan yang utuh dan menawarkan kemampuan terbaik dari semua bentuk sediaan oral untuk ketepatan ukuran serta variabilitas kandungan yang paling rendah.
2. Tablet merupakan bentuk sediaan yang ongkos pembuatannya paling rendah.
3. Tablet merupakan bentuk sediaan oral yang paling ringan dan paling kompak.
4. Tablet merupakan bentuk sediaan oral yang paling mudah dan murah untuk dikemas serta dikirim.
5. Pemberian tanda pengenal produk pada tablet paling mudah dan murah; tidak memerlukan langkah pekerjaan tambahan bila menggunakan permukaan pencetak yang bermonogram atau berhiasan timbul.
6. Tablet paling mudah ditelan serta paling kecil kemungkinan tertinggal di tenggorokan, terutama bila bersalut yang memungkinkan pecah/hancurnya tablet tidak segera terjadi.
8. Tablet merupakan bentuk sediaan oral yang paling mudah untuk diproduksi secara besar-besaran.
9. Tablet merupakan bentuk sediaan oral yang memiliki sifat pencampuran kimia, mekanik dan stabilitas mikrobiologi yang paling baik.
Disebutkan juga beberapa kerugian tablet, diantaranya:
1. Beberapa obat tidak dapat dikempa menjadi padat dan kompak, tergantung pada keadaan amorfnya, flokulasi, atau rendahnya berat jenis. 2. Obat yang sukar dibasahkan, lambat melarut, dosisnya cukupan atau
tinggi, absorbsi optimumnya tinggi melalui saluran cerna atau setiap kombinasi dari sifat di atas, akan sukar atau tidak mungkin diformulasi dan dipabrikasi dalam bentuk tablet yang masih menghasilkan bioavailabilitas obat cukup.
3. Obat yang rasanya pahit, obat dengan bau yang tidak dapat dihilangkan, atau obat yang peka terhadap oksigen atau kelembapan udara perlu pengapsulan atau penyelubungan dulu sebelum dikempa (bila mungkin) atau memerlukan penyalutan dulu. Pada keadaan ini kapsul dapat merupakan jalan keluar yang terbaik serta lebih murah.
2.2.2 Eksipien Formulasi Tablet
Agoes (2008), mengutarakan bahwa komposisi tablet umumnya terdiri atas bahan aktif dan eksipien. Eksipien ditambahkan dengan berbagai fungsi dan tujuan spesifik sebagai berikut:
1. Pengisi/pengencer 2. Pengikat
10 4. Pelincir (lubricants)
5. Anti lengket (anti adhesive) 6. Pelicin (glidants)
7. Pembasah (wetting/surface active agents) 8. Zat warna (colours/pigments)
9. Peningkat rasa (flavors) 10.Pemanis
11.Penutup rasa.
2.2.3 Penggolongan Tablet
Syamsuni (2006), menggolongkan tablet ke dalam beberapa jenis, antara lain:
a. Berdasarkan metode pembuatannya;
1. Tablet cetak. Dibuat dari bahan obat dan bahan pengisi, dengan memberikan tekanan yang rendah ke dalam lubang cetakan.
2. Tablet kempa. Dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan cetakan baja. Umumnya mengandung zat aktif, bahan pengisi, bahan pengikat, desintegran, dan lubrikan, tetapi dapat juga mengandung bahan pewarna, bahan pengaroma, dan bahan pemanis. b. Berdasarkan distribusi obat dalam tubuh;
1. Bekerja lokal; misalnya tablet hisap untuk pengobatan pada rongga mulut.
2. Bekerja sistemik; per oral. c. Berdasarkan jenis bahan penyalut;
2. Tablet salut selaput (film-coated tablet) 3. Tablet salut kempa
4. Tablet salut enterik (enteric-coated tablet) 5. Tablet lepas lambat (sustained-release tablet). d. Berdasarkan cara pemakaian;
1. Tablet biasa/tablet telan
2. Tablet kunyah (chewable tablet)
3. Tablet isap (lozenges, trochisi, pastiles) 4. Tablet larut (effervescent tablet)
5. Tablet implan (pelet)
6. Tablet hipodermik (hypodermic tablet) 7. Tablet bukal (buccal tablet)
8. Tablet sublingual 9. Tablet vagina (ovula). 2.2.4 Syarat-syarat Tablet
Adapun syarat-syarat formulasi tablet menurut Anief (2003), antara lain: 1. Memenuhi keseragaman ukuran
2. Memenuhi keseragaman bobot dan keseragaman kandungan 3. Memenuhi waktu hancur
4. Memenuhi kekerasan tablet 5. Memenuhi keregasan tablet.
2.3 Spektrofotometri Ultraviolet-Visibel (UV-Vis)
12
sering digunakan dalam analisis farmasi meliputi spektrofotometri ultraviolet, cahaya tampak, infra merah dan serapan atom. Jangkauan panjang gelombang untuk daerah ultraviolet adalah 190-380 nm, daerah cahaya tampak 380-780 nm, daerah infra merah dekat 780-3000 nm, dan daerah infra merah jauh 2,5-40 µm atau 4000-250 cm-1 (Ditjen POM, 1995).
Spektrofotometer adalah alat untuk mengukur transmitan atau serapan suatu sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan penggabungan dari dua fungsi alat yang terdiri dari spektrometer yang menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer sebagai alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi (Gandjar dan Rohman, 2007).
Pada spektrofotometer, panjang gelombang yang benar-benar terseleksi dapat diperoleh dengan bantuan alat pengurai cahaya seperti prisma. Suatu spektrofotometer tersusun dari spektrum tampak yang kontinu, monokromator, sel pengabsorpsi untuk larutan sampel atau blangko dan suatu alat untuk mengukur perbedaan absorpsi antara sampel dan blangko ataupun pembanding (Khopkar, 1990).
Menurut Day dan Underwood (1998), unsur-unsur terpenting suatu spektrofotometer adalah sebagai berikut:
2. Monokromator: digunakan untuk memperoleh sumber sinar yang monokromatis. Alatnya berupa prisma untuk mengarahkan sinar monokromatis yang diinginkan dari hasil penguraian.
3. Kuvet (sel): digunakan sebagai wadah sampel untuk menaruh cairan ke dalam berkas cahaya spektrofotometer. Kuvet itu haruslah meneruskan energi radiasi dalam daerah spektrum yang diinginkan. Pada pengukuran di daerah sinar tampak, kuvet dapat digunakan, tetapi untuk pengukuran pada daerah ultraviolet kita harus menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini. Kuvet tampak dan ultraviolet yang khas mempunyai ketebalan 1 cm, namun tersedia kuvet dengan ketebalan yang sangat beraneka, mulai dari ketebalan kurang dari 1 mm sampai 10 cm bahkan lebih.
4. Detektor: Peranan detektor penerima adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang.
2.3.1 Penyerapan Radiasi
14
dengan banyaknya molekul yang menyerap radiasi, sehingga spektra absorpsi dapat digunakan untuk analisis kuantitatif (Gandjar dan Rohman, 2007).
Sistem ikatan rangkap terkonjugasi merupakan kromofor yang dapat menyerap radiasi ultraviolet. Salah satu kromofor yang paling sederhana adalah benzen (Watson, 2005). Gugus fungsi seperti –OH, -O, -NH2, dan –OCH3 yang
memberikan transisi n → π* disebut gugus auksokrom. Gugus ini adalah gugus
yang tidak dapat menyerap radiasi ultraviolet-sinar tampak, tetapi apabila gugus ini terikat pada gugus kromofor mengakibatkan pergeseran panjang gelombang ke arah yang lebih besar (efek batokromik atau pergeseran merah) dan disertai peningkatan intensitas (efek hiperkromik) (Gandjar dan Rohman, 2007).
2.3.2 Hukum Lambert-Beer
Menurut Hukum Lambert, serapan berbanding lurus terhadap ketebalan sel yang disinari. Sedangkan menurut Beer, serapan berbanding lurus dengan konsentrasi. Kedua pernyataan ini dapat dijadikan satu dalam Hukum Lambert-Beer, sehingga diperoleh bahwa serapan berbanding lurus terhadap konsentrasi dan ketebalan sel, yang dapat ditulis dengan persamaan:
Jadi dengan hukum Lambert-Beer konsentrasi dapat dihitung dari ketebalan sel dan serapan. Absorptivitas merupakan suatu tetapan dan spesifik untuk setiap molekul pada panjang gelombang dan pelarut tertentu. Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,6. Anjuran ini berdasarkan anggapan bahwa pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi adalah paling minimal (Gandjar dan Rohman, 2007).
Menurut Denney dan Sinclair (1991) hukum Lambert-Beer terdapat beberapa pembatasan yaitu:
1. Larutan yang menyerap cahaya adalah campuran yang homogen. 2. Menggunakan sinar monokromatis.
3. Rendahnya konsentrasi dari senyawa yang menyerap cahaya.
Parameter kekuatan energi radiasi yang diabsorpsi oleh molekul adalah absorbansi (A) yang dalam batas konsentrasi tertentu nilainya sebanding dengan banyaknya molekul yang mengabsorpsi radiasi. Senyawa yang tidak mengabsorpsi radiasi ultraviolet-sinar tampak dapat juga ditentukan dengan spektrofotometri ultraviolet-sinar tampak, apabila ada reaksi kimia yang dapat mengubahnya menjadi kromofor atau dapat disambungkan dengan suatu pereaksi kromofor (Gandjar dan Rohman, 2007).
2.3.3 Kegunaan Spektrofotometri Ultraviolet - Visibel (UV-Vis)
16
Menurut Holme dan Peck (1983), analisis kuantitatif secara spektrofotometri dapat dilakukan antara lain dengan metode regresi dan pendekatan.
1. Metode Regresi
Analisis kuantitatif dengan metode regresi yaitu dengan menggunakan persamaan garis regresi yang didasarkan pada harga serapan dan konsentrasi standar yang dibuat dalam beberapa konsentrasi, paling sedikit menggunakan 5 rentang konsentrasi yang meningkat yang dapat memberikan serapan yang linier, kemudian diplot menghasilkan suatu kurva yang disebut dengan kurva kalibrasi. Konsentrasi suatu sampel dapat dihitung berdasarkan kurva tersebut.
2. Metode Pendekatan
Analisis kuantitatif dengan cara ini dilakukan dengan membandingkan serapan standar yang konsentrasinya diketahui dengan serapan sampel. Konsentrasi sampel dapat dihitung melalui rumus perbandingan:
Cs = As.Cb/Ab
Dimana:
As = serapan sampel
Ab = serapan standar
Cb = konsentrasi standar
Cs = konsentrasi sampel
2.4 Validasi
Validasi metode adalah suatu proses yang menunjukkan bahwa prosedur analitik telah sesuai dengan penggunaan yang dikehendaki. Validasi merupakan persyaratan mendasar yang diperlukan untuk menjamin kualitas dan hasil dari semua aplikasi analitik (Ermer dan McB. Miller, 2005).
Beberapa parameter validasi metode menurut USP antara lain presisi, akurasi, batas deteksi, batas kuantitasi, spesifisitas, linieritas dan rentang, kekasaran (ruggedness), dan ketahanan (robutness) (Gandjar dan Rohman, 2007).
2.4.1 Akurasi (Kecermatan)
Akurasi atau kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan, dan dapat ditentukan dengan dua cara yaitu metode simulasi (spiked-placebo recovery) atau metode penambahan baku (standard addition method). Dalam metode simulasi, sejumlah analit bahan murni (senyawa
pembanding kimia) ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan. Bila tidak memungkinkan membuat sampel sampel plasebo maka dapat dipakai metode penambahan baku, yaitu dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa (Harmita, 2004).
18
% perolehan kembali = F− A
∗A x 100 % Keterangan:
CF = konsentrasi sampel yang diperoleh setelah penambahan baku
CA = konsentrasi sampel sebelum penambahan baku
C*A = konsentrasi baku yang ditambahkan
2.4.2 Presisi (Keseksamaan)
Presisi adalah derajat kesesuaian di antara masing-masing hasil uji, jika prosedur analisis ditetapkan berulang kali pada sejumlah cuplikan yang diambil dari satu sampel homogen. Presisi dinyatakan sebagai deviasi standar atau deviasi standar relatif (Satiadarma, dkk., 2004).
Parameter-parameter seperti simpangan baku (SD), simpangan baku relatif (Relative Standard Deviation) dan derajat kepercayaan haruslah dikalkulasi untuk mendapatkan tingkat presisi tertentu. Nilai simpangan baku relatif dinyatakan memenuhi persyaratan jika < 2% (Ermer dan McB. Miller, 2005).
Simpangan baku relatif =
2.4.3 Batas Deteksi dan Batas Kuantitasi
2.4.4 Linearitas dan Rentang
Linearitas menunjukkan kemampuan suatu metode analisis untuk memperoleh hasil pengujian yang sesuai dengan kisaran konsentrasi analit tertentu. Hal ini dapat dilakukan dengan cara membuat kurva kalibrasi dari beberapa set larutan baku yang telah diketahui konsentrasinya. Persamaan garis yang digunakan pada kurva kalibrasi diperoleh dari persamaan y = ax + b. Persamaan ini akan menghasilkan koefisien korelasi (r). Koefisien korelasi inilah yang digunakan untuk mengetahui linearitas suatu metode analisis. Kelinieran suatu metode analisis adalah kemampuan untuk menunjukkan bahwa nilai hasil uji langsung atau setelah diolah secara matematika, proporsional dengan konsentrasi analit dalam sampel dalam batas rentang konsentrasi tertentu (Satiadarma, dkk., 2004).
1
BAB I PENDAHULUAN
1.1Latar Belakang
Ofloksasin termasuk antibakteri golongan fluorokuinolon yang aktif melawan bakteri gram positif dan bakteri gram negatif, digunakan pada infeksi saluran kemih, prostatitis, infeksi pernapasan, gonore dan infeksi mata, juga sebagai obat TBC sekunder (Tan dan Rahardja, 2007). Obat ini juga direkomendasikan pada pengobatan gonore, uretritis, dan cervicitis (Al-Omar, 2009).
Dalam bidang farmasi, pemeriksaan mutu obat diperlukan agar obat dapat sampai pada reseptor target dan memberikan efek terapi yang dikehendaki dengan kadar yang tepat. Salah satu parameter dari uji mutu tersebut adalah kadar zat berkhasiat dari suatu sediaan obat harus memenuhi persyaratan kadar seperti yang tercantum dalam Farmakope Indonesia atau buku resmi lainnya. Persyaratan kadar untuk sediaan ofloksasin menurut Farmakope Indonesia edisi ke-V 2014, yaitu mengandung ofloksasin tidak kurang dari 90,0% dan tidak lebih dari 110,0% (Ditjen BKAK, 2014).
Obat dengan nama generik merupakan obat yang harganya murah dibandingkan obat merek dagang. Masyarakat menganggap obat generik yang harganya murah tidak memiliki mutu sebaik obat merek dagang yang harganya jauh lebih mahal (Puspitasari, 2006).
ultraviolet. Gugus kromofor bertanggung jawab terhadap penyerapan cahaya, dan semakin panjang ikatan rangkap terkonjugasi di dalam molekul, molekul tersebut akan lebih mudah menyerap cahaya (Cairns, 2008). Gugus ausokrom tidak dapat menyerap radiasi ultraviolet-sinar tampak, tetapi apabila gugus ini terikat pada gugus kromofor akan mengakibatkan pergeseran panjang gelombang ke arah yang lebih besar dan disertai peningkatan intensitas serapan (Gandjar dan Rohman, 2007).
Moffat dkk., (2005) menyebutkan bahwa ofloksasin memiliki serapan maksimum dalam larutan asam pada panjang gelombang 225, 226, 256, dan 326 nm; dan dalam larutan basa pada panjang gelombang 288 dan 332 nm. Spektrum ofloksasin dalam etanol memiliki serapan maksimum pada panjang gelombang 225.6 nm (A11 = 477, ε = 1.72 x 104 L mol-1 cm-1), 299.4 nm (A11= 996, ε = 3.59
x 104 L mol-1 cm-1), 328.8 nm (A11= 385, ε = 1.39 x 104 L mol-1 cm-1) (Al-Omar,
2009).
Bhusari dan Chaple (2009) telah mengembangkan metode spektrofotometri untuk menentukan kadar campuran ofloksasin dan ornidazol dalam sediaan tablet dengan menggunakan asam asetat sebagai pelarut pada panjang gelombang 294 nm, nilai A11 yang diperoleh sebesar 996.92. Sedangkan
Patel dan Patel (2011) menentukan kadar campuran ofloksasin dan cefpodoksim proksetil dalam sediaan tablet secara spektrofotometri pada panjang gelombang 297 nm dengan pelarut metanol (ε = 36140 L mol-1 cm-1).
3
validasi metode dilakukan dengan beberapa parameter yaitu uji akurasi (kecermatan) yang dinyatakan dalam persen perolehan kembali dengan menggunakan metode penambahan baku, presisi (keseksamaan) yang dilakukan dengan menggunakan parameter simpangan baku relatif (Relative Standard Deviation), dan batas deteksi dan batas kuantitasi ditentukan dengan
menggunakan rumus Limit of Detection (LOD) dan Limit of Quantitation (LOQ) (Harmita, 2004).
Berdasarkan uraian di atas, penulis mencoba menetapkan kadar ofloksasin dalam sediaan tablet yang beredar di pasaran dengan metode spektrofotometri ultraviolet. Metode spektrofotometri ini memiliki beberapa keuntungan antara lain dapat digunakan untuk analisis suatu zat dalam jumlah kecil, kepekaan yang cukup tinggi, ketelitian yang baik, sederhana, biayanya relatif murah dan mudah pengerjaannya (Munson, 1991).
1.2 Perumusan Masalah
Berdasarkan latar belakang diatas, maka perumusan masalah pada penelitian ini adalah:
a. Apakah metode spektrofotometri ultraviolet dapat digunakan untuk menetapkan kadar ofloksasin dalam sediaan tablet dan memenuhi syarat uji validasi metode?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas, maka dibuat hipotesis sebagai berikut:
a. Metode spektrofotometri ultraviolet dapat digunakan untuk menetapkan kadar ofloksasin dalam sediaan tablet dan memenuhi syarat uji validasi metode.
b. Kadar ofloksasin dalam sediaan tablet memenuhi persyaratan kadar yang tertera pada FI V.
1.4 Tujuan Penelitian
Adapun tujuan dilakukannya penelitian ini adalah:
a. Untuk mengetahui metode spektrofotometri ultraviolet dapat digunakan untuk menetapkan kadar ofloksasin dalam sediaan tablet dan memenuhi syarat uji validasi metode.
b. Untuk mengetahui kadar ofloksasin dalam sediaan tablet memenuhi persyaratan kadar yang tertera pada FI V.
1.5 Manfaat Penelitian
vi
PENETAPAN KADAR OFLOKSASIN DALAM SEDIAAN
TABLET DENGAN METODE SPEKTROFOTOMETRI
ULTRAVIOLET
Abstrak
Ofloksasin merupakan antibiotik golongan florokuinolon generasi kedua yang digunakan pada pengobatan infeksi saluran kemih, prostatitis, infeksi saluran pernapasan dan infeksi kulit. Obat ini juga direkomendasikan pada pengobatan gonore, uretritis, dan cervicitis. Bentuk sediaan obat ini yang beredar di pasaran salah satunya adalah dalam bentuk tablet; generik dan merk dagang. Pemeriksaan mutu obat diperlukan agar obat sampai pada titik tangkapnya dan memberi efek terapi. Tujuan penelitian ini adalah untuk menetapkan kadar ofloksasin dalam sediaan tablet yang beredar di pasarandengan menggunakan metode spektrofotometri ultraviolet apakah memenuhi persyaratan mutu obat.
Penetapan kadar ofloksasin dalam sediaan tablet dilakukan dengan metode spektrofotometri ultraviolet menggunakan pelarut metanol pada panjang gelombang 297,5 nm dan diuji validitasnya berdasarkan parameter akurasi dengan metode penambahan baku (standard addition method), presisi, batas deteksi (limit of detection), dan batas kuantitasi (limit of quantitation).
Diperoleh kadar ofloksasin pada tablet Tariflox® (Lapi) sebesar (101.467 ± 0.418)%; tablet Ofloksasin (Novell) sebesar (100.975 ± 0.400)%; tablet Ofloksasin (Indofarma) sebesar (104.21 ± 0.416)%; tablet Danoflox® (Dankos) sebesar (98.428 ± 1.897)%; tablet Tarivid® (Kalbe) sebesar (98.407 ± 1.533)%; dan tablet Akilen® (Sanbe) sebesar (104.418 ± 1.677)%. Hasil uji validasi yang didapat menunjukkan bahwa metode spektrofotometri ultraviolet dapat digunakan untuk penetapan kadar ofloksasin dalam sediaan tablet, karena memberikan nilai akurasi dan presisi yang baik dengan batas deteksi (LOD) dan batas kuantitasi (LOQ) sebesar 0.2878 µg/ml dan 0.9595 µg/ml.
Hasil penelitian menunjukkan bahwa kadar ofloksasin dalam sediaan tablet generik dan tablet merk dagang memenuhi persyaratan tablet menurut Farmakope Indonesia V (2014), yaitu tidak kurang dari 90.0% dan tidak lebih dari 110.0% dari jumlah yang tertera pada etiket.