PENGARUH EKSTRAK RIMPANG KENCUR (Kaempferia
galanga L) PADA PROFIL FARMAKOKINETIKA
NATRIUM DIKLOFENAK TERHADAP HEWAN UJI TIKUS
SKRIPSI
OLEH:
IRAWINATA SITUMORANG NIM 111524048
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
PENGARUH EKSTRAK RIMPANG KENCUR (Kaempferia
galanga L) PADA PROFIL FARMAKOKINETIKA
NATRIUM DIKLOFENAK TERHADAP HEWAN UJI TIKUS
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
IRAWINATA SITUMORANG NIM 111524048
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN
SKRIPSI
PENGARUH EKSTRAK RIMPANG KENCUR (Kaempferia
galanga L) PADA PROFIL FARMAKOKINETIKA
NATRIUM DIKLOFENAK TERHADAP HEWAN UJI TIKUS
OLEH:
IRAWINATA SITUMORANG NIM 111524048
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: Juli 2014
Pembimbing I, Panitia Penguji,
Dr. Edy Suwarso, S.U., Apt. Prof. Dr. Karsono, Apt.
NIP 130935857 NIP 195409091982011001
Dr. Edy Suwarso, S.U., Apt. Pembimbing II, NIP 130935857
Prof. Dr. M.T. Simanjuntak, M.Sc., Apt. Poppy A.Z.H, S.Si., M.Si., Apt.
NIP 195212041980021001 NIP 197506102005012003
Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001
Medan, Juli 2014 Fakultas Farmasi
Universitas Sumatera Utara\ Dekan,
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Esa yang telah melimpahkan
rahmat dan anugerah-Nya sehingga penulis dapat menyelesaikan penelitian dan
penyusunan skripsi ini yang berjudul “Pengaruh Ekstrak Rimpang Kencur
(Kaempferia Galanga L) Pada Profil Farmakokinetika Natrium Diklofenak Terhadap Hewan Uji Tikus”. Skripsi ini diajukan sebagai salah satu syarat untuk
memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera
Utara.
Penulis menyampaikan terimakasih kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU yang telah memberikan
bantuan dan fasilitas selama masa pendidikan. Bapak Dr. Edy Suwarso, S.U.,
Apt., dan Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt., yang telah
membimbing penulis dengan penuh kesabaran, tulus dan ikhlas selama penelitian
hingga selesainya penulisan skripsi ini. Ibu Dra. Erly Sitompul, M.Si., Apt.,
selaku dosen wali yang telah membimbing penulis selama masa pendidikan.
Bapak Prof. Dr. Karsono, Apt., Ibu Poppy Anjelisa Z. Hasibuan, S.Si., M.Si.,
Apt., dan Ibu Dra. Suwarti Aris, M.Si., Apt., sebagai dosen penguji yang telah
memberikan saran dan kritikan kepada penulis hingga selesainya penulisan skripsi
ini. Ibu Marianne, S.Si., M.Si., Apt., selaku kepala Laboratorium Farmakologi dan
Toksikologi, Ibu Dra. Suwarti Aris, M.Si., Apt., selaku Kepala Laboratorium
Koordinator Laboratorium Biofarmasetika dan Farmakokinetika yang telah
memberikan fasilitas dan bantuan selama penelitian.
Ucapan terimakasih dan penghargaan yang tulus tiada terhingga kepada Ayahanda
J. Situmorang dan Ibunda D. Silalahi tercinta serta Abang Ebenezer Situmorang,
Abang Daniel Purba, Kakak Imeldawati Situmorang, Adik Ivalentina Situmorang
dan Adik Isaulina Situmorang atas doa, dorongan dan semangat baik moril
maupun materil kepada penulis selama perkuliahan hingga selesainya penyusunan
skripsi ini. Kepada seluruh Staf Pengajar, Pegawai Tata Usaha dan
sahabat-sahabat (Franky Sitorus, Bettika manik, Tri Ika Florida, Novalya Frisley, Juni
Bancin, Maria Susanti Manalu, Yolin Hartika Barus, Agnes Margaretta, Mutia
Mustika, Fusfita Arika Ningsih, dan Gustiani Syahfitri) yang telah membantu
selama penelitian hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih memiliki
banyak kekurangan, oleh karena itu sangat diharapkan kritikan dan saran yang
dapat menyempurnakan skripsi ini.
Medan, Juli 2014
Penulis,
PENGARUH EKSTRAK RIMPANG KENCUR (Kaempferia galanga L) TERHADAP PROFIL FARMAKOKINETIKA NATRIUM DIKLOFENAK
TERHADAP HEWAN UJI TIKUS ABSTRAK
Natrium diklofenak termasuk Non-Steroid Anti-Inflamatory Drugs (NSAID) yang mempunyai aktivitas antirematik, antiradang dan analgetik-antipiretik. Ekstrak rimpang kencur berkhasiat sebagai antiradang dimana semakin tinggi dosis ekstrak rimpang kencur yang diberikan maka semakin kecil persentase radang yang terjadi. Melihat efek sinergisme antara rimpang kencur dengan natrium diklofenak maka tujuan penelitian ini adalah pada pemberian EERK selama 7 hari berturut-turut dapat mempengaruhi proses metabolisme natrium diklofenak. Ekstraksi dilakukan dengan pelarut etanol 96%, kemudian dibuat dosis 20 mg/kg bb, 40 mg/kg bb dan 80 mg/kg bb. Penelitian dilakukan dengan memberikan larutan berturut-turut selama 7 hari dan pada hari ke-7 setelah 4 jam kemudian diberikan larutan natrium diklofenak secara oral. Selanjutnya darah masing-masing tikus jantan diambil dengan berbagai interval waktu dan diukur dengan spektrofotometri UV panjang gelombang 276 nm.
Hasil penelitian menunjukkan perbedaan antara perlakuan pada hewan tikus. Di mana nilai Cmaks meningkat dari EERK dosis 20 mg/kg bb (8,1203 ± 0,6907
mcg/ml), 40 mg/kg bb (10,5922 ± 0,8404 mcg/ml), 80 mg/kg bb (12,7621 ± 0,4303 mcg/ml), kontrol (7,4420 ± 0,2335 mcg/ml). Nilai AUC meningkat dari dosis 20 mg/kg bb (9669,2869 ± 978,3981 mcg/ml.menit), 40 mg/kg bb (14571,0840 ± 1376,9879 mcg/ml.menit), 80 mg/kg bb (21772,6671 ± 2073,7437 mcg/ml.menit), kontrol (8350,0142 ± 100,2482 mcg/ml.menit). Pemberian EERK menurunkan nilai CL, dosis 20 mg/kg bb (0,0491 ± 0,0066 ml/menit); 40 mg/kg bb (0,0321 ± 0,0047 ml/menit); 80 mg/kg bb (0,0209 ± 0,0045 ml/menit); kontrol (0,0573 ± 0,0075 ml/menit). Nilai Vd menurun dengan perlakuan EERK, dosis 20 mg/kg bb (49,4431 ± 7,0101 ml), 40 mg/kg bb (37,8919 ± 3,6637 ml), 80 mg/kg bb (31,6582 ± 6,4912 ml) dibandingkan kontrol (53,3887 ± 7,6580 ml). Nilai MRT meningkat pada EERK, kontrol (967,6589 ± 28,0171 menit); 20 mg/kg bb (1040,1964 ± 44,7328 menit); 40 mg/kg bb (1210,8529 ± 72,8713 menit); 80 mg/kg bb (1559,0302 ± 111,4972 menit).
Berdasarkan hasil di atas, disimpulkan bahwa EERK mempengaruhi profil farmakokinetika natrium diklofenak yang menunjukkan kemampuan EERK terhadap penghambatan metabolisme sebagai enzim inhibisi.
THE EFFECT OF EXTRACT Kaempferiae galangae L ON THE PHARMACOKINETIC PROFIL OF SODIUM DIKLOFENAC AT THE
EXPERIMENTAL WITH WHITE RATS ABSTRACT
Diclofenac sodium has antirheumatic activity, anti-inflammatory and analgesic – antipyretic. Rhizome extract as a potent anti-inflammatory
Kaempferiae galangae L where the higher dose given Kaempferiae galangae L extract the smaller the percentage of inflammation that occurs, Seeing the effect of synergism between Kaempferiae galangae L with diclofenac sodium, the purpose of this research is on EERK administration for 7 days in a row can affect the metabolism of diclofenac.
Extraction is done with 96 % ethanol, then made a dose of 20 mg / kg bw, 40 mg / kg bw and 80 mg / kg bw. Research done by providing a solution for 7 consecutive days and on day 7 after 4 hours and then given oral diclofenac sodium. Further blood each male rat was taken with various time intervals and measured by UV spectrophotometry wavelength 276 nm.
The results showed differences between treatments in mice. Where Cmax values increased in EERK administration of a of 20 mg/kg bw (8.1203 ± 0.6907 mcg/ml), 40 mg/kg bw (10.5922 ± 0.8404 mcg/ml), 80 mg/kg bw (12.7621 ± 0.4303 mcg/ml), controls (7.4420 ± 0.2335 mcg/ml). AUC values greater than EERK 20 mg/kg bw (9669.2869 ± 978.3981 mcg/ml.minute), 40 mg/kg bw (14571.0840 ± 1376.9879 mcg/ml.minute), 80 mg/kg bw (21772.6671 ± 2073.7437 mcg/ml.minute), control (8350.0142 ± 100.2482 mcg/ml. minute), EERK could decrease the value of CL, 20 mg/kg bw (0.0491 ± 0.0066 ml/minute), 40 mg/kg bw (0.0321 ± 0.0047 ml/minute), 80 mg/kg bw (0.0209 ± 0.0045 ml/minute), control (0.0573 ± 0.0075 ml/minute). Vd values decreased, EERK 20 mg/kg bw (49.4431 ± 7.0101 ml), 40 mg/kg bw (37.8919 ± 3.6637 ml), 80 mg/kg bw (31.6582 ± 6.4912 ml), controls (53.3887 ± 7.6580 ml). MRT values increased, control (967.6589 ± 28.0171 menit), 20 mg/kg bw (1040.1964 ± 44.7328 minute), 40 mg/kg bw (1210.8529 ± 72.8713 minute), 80 mg/kg bw (1559.0302 ± 111.4972 minute).
Based on the above results, it was concluded that EERK affect the pharmacokinetics of diclofenac sodium profile, the ability EERK on the inhibition of metabolism as enzyme inhibitor.
DAFTAR ISI
Halaman
JUDUL ……… i
LEMBAR PENGESAHAN ……… iii
KATA PENGANTAR ……….... iv
ABSTRAK ……… vi
ABSTRACT ………... vii
DAFTAR ISI ……….. viii
DAFTAR TABEL ………... xii
DAFTAR GAMBAR ………. xiii
DAFTAR LAMPIRAN ……….. xiv
BAB I PENDAHULUAN ……….. 1
1.1 Latar Belakang ……… 1
1.2 Perumusan Masalah ……… 4
1.3 Hipotesis ………. 4
1.4 Tujuan Penelitian ……… 4
1.5 Manfaat Penelitian ……….. 4
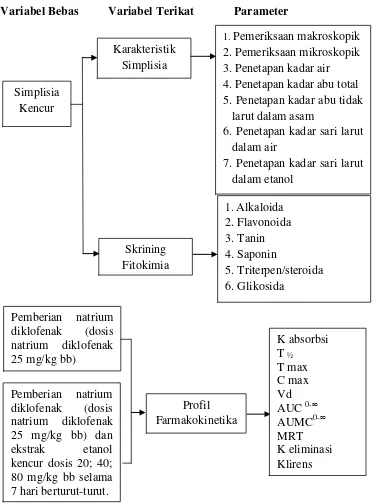
1.6 Kerangka Pikir Penelitian ……… 4
BAB II TINJAUAN PUSTAKA ……… 5
2.1 Natrium Diklofenak ……… 6
2.2 Uraian Tumbuhan ……… 6
2.2.1 Sistematika tumbuhan ……….…….………. 7
2.3.3 Kandungan kimia ……….. 8
2.3 Ekstrak .……….………... 8
2.3.1 Cara dingin ……….…….……….………….. 8
2.3.2 Cara panas ……….…………. 9
2.4 Farmakokinetik ……….………... 10
2.4.1 Absorbsi ……….…….……….….………….. 10
2.4.2 Distribusi ……….….……….. 11
2.3.3 Metabolisme ………... 12
2.4.1 Ekskresi ……….…….……….….…………... 13
2.5 Parameter Farmakokinetik ……… 13
BAB III METODE PENELITIAN ……….. 15
3.1 Alat ………... 15
3.2 Bahan ……… 15
3.3 Penyiapan Tumbuhan ……….………. 15
3.3.1 Pengambilan tumbuhan ……….…….……… 15
3.3.2 Identifikasi tumbuhan ………. 16
3.3.3 Pengolahan tumbuhan ………. 16
3.4 Pemeriksaan Karakteristik Simplisia ………... 16
3.4.1 Pemeriksaan makroskopik dan organoleptik ……….. 16
3.4.2 Pemeriksaan mikroskopik ..………. 16
3.4.3 Penetapan kadar air simplisia ……….. 17
3.4.4 Penetapan kadar sari larut dalam air …..……….…… 17
3.4.6 Penetapan kadar abu total ……… 18
3.4.7 Penetapan kadar abu tidak larut asam ………. 18
3.5 Pemeriksaan Skrining Fitokimia Simplisia ..……… 19
3.5.1 Pemeriksaan flavonoid ……… 19
3.5.2 Pemeriksaan alkaloida ……… 19
3.5.3 Pemeriksaan saponin …….………. 20
3.5.4 Pemeriksaan tanin ……….………. 20
3.5.5 Pemeriksaan glikosida ...………. 20
3.5.6 Pemeriksaan steroida/triterpenoida ……… 21
3.6 Pembuatan Ekstrak Etanol Rimpang Kencur (EERK) ……. 21
3.7 Pembuatan DiklofenakBaku ……….…… 22
3.7.1 Pembuatan larutan induk baku I natrium diklofenak ……….……...…… 22
3.7.2 Pembuatan larutan induk baku II natrium diklofenak .……….……...…… 22
3.7.3 Pengukuran panjang gelombang absorpsi maksimum di dalam larutan NaOH 0,1 N ……… 22
3.7.4 Pembuatan kurva baku natrium diklofenak pada panjang gelombang maksimum ……….. 22
3.8 Pembuatan Suspensi .………. 23
3.8.1 Pembuatan suspensi CMC 1% ……… 23
3.8.2 Pembuatan suspensi natrium diklofenak 0,05% ……. 23
3.8.3 Pembuatan suspensi ekstrak etanol rimpang kencur (EERK) ………... 23
3.9 Perlakuan Terhadap Hewan Percobaan ………. 23
3.9.2 Pemberian natrium diklofenak dengan pemberian EERK pada hewan tikus selama 7 hari
berturut-turut ……….…. 25
3.10 Analisis Data ……….. 25
BAB IV HASIL DAN PEMBAHASAN ……….. 26
4.1 Karakterisasi Simplisia dan Ekstrak ……….. 26
4.2 Skrining Simplisia dan Ekstrak ………. 20
4.3 Nilai Kadar Rata-rata Natrium diklofenak dalam Plasma …. 31 BAB V KESIMPULAN DAN SARAN ………... 39
5.1 Kesimpulan ……… 39
5.2 Saran ……… 39
DAFTAR PUSTAKA………... 40
DAFTAR TABEL
Tabel Halaman
4.1 Hasil karakteristik simplisia rimpang kencur ……… 29
4.2 Hasil skrining simplisia rimpang kencur ………... 30
4.3 Nilai kadar rata-rata natrium diklofenak dalam plasma ……… 32
4.4 Data rata-rata parameter farmakokinetika natrium diklofenak
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema kerangka pikir penelitian ……….………. 4
4.1 Gambar Hasil Mikroskopik Serbuk Rimpang Kencur …………. 28
4.2 Nilaikadar rata-rata (Log C) vs Waktu (t) natrium diklofenak
dalam plasma ……….……….….….….….….…………. 32
4.3 Grafik peningkatan nilai Cmaks terhadap rata-rata tiap
perlakuan .……….……….….….….….….….….……… 34
4.4 Grafik peningkatan nilai AUC 0-∞ terhadap rata-rata tiap
perlakuan ……….……….….….….….….….……….. 35
4.5 Grafik peningkatan nilai MRT terhadap rata-rata tiap
perlakuan .……….……….….….….….….….………. 36
4.6 Grafik peningkatan nilai CL terhadap rata-rata tiap
perlakuan ……….….….….….….….………... 37
4.7 Grafik peningkatan nilai Vd terhadap rata-rata tiap
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Hasil identifikasi tanaman ……… 42
Lampiran 2 Sertifikat analisis natrium diklofenak (PT. Dexa Medika) 43
Lampiran 3 Kerangka pikir penelitian ………..……… 44
Lampiran 4 Gambar hasil makroskopik ……… 45
Lampiran 5 Hasil karakterisasi serbuk simplisia rimpang kencur …… 47
Lampiran 6 Tabel maksimum larutan sediaan uji untuk hewan ……… 54
Lampiran 7 Tabel konversi dosis hewan dengan manusia ………. 55
Lampiran 8 Flowsheet ………..……….……… 56
Lampiran 9 Contoh perhitungan dosis ………..……… 60
Lampiran 10 Kurva dan data serapan natrium diklofenak baku Pembanding (PT. Dexa Medica) konsentrasi 12 μg/ml
dalam pelarut NaOH 0,1 N …...……….. 62
Lampiran 11 Hasil penentuan persamaan regresi dari kurva kalibrasi natrium diklofenak (PT. Dexa Medica) pada panjang
gelombang 276 nm dalam pelarut NaOH 0,1 N …... 63
Lampiran 12 Hasil Perhitungan Persamaan Regresi dari Kurva Kalibrasi Natrium Diklofenak (PT. Dexa Medica) pada Panjang gelombang 276 nm dalam pelarut NaOH 0,1 N ... 64
Lampiran 13 Contoh perhitungan parameter farmakokinetik
secara manual …...……… 65
Lampiran 14 Kadar natrium diklofenak dalam plasma tiap
waktu pengambilan sampel …...……….. 68
Lampiran 15 Data parameter farmakokinetika natrium diklofenak
dalam plasma …...………... 76
Lampiran 17 Hewan percobaan dan alat …...………... 80
PENGARUH EKSTRAK RIMPANG KENCUR (Kaempferia galanga L) TERHADAP PROFIL FARMAKOKINETIKA NATRIUM DIKLOFENAK
TERHADAP HEWAN UJI TIKUS ABSTRAK
Natrium diklofenak termasuk Non-Steroid Anti-Inflamatory Drugs (NSAID) yang mempunyai aktivitas antirematik, antiradang dan analgetik-antipiretik. Ekstrak rimpang kencur berkhasiat sebagai antiradang dimana semakin tinggi dosis ekstrak rimpang kencur yang diberikan maka semakin kecil persentase radang yang terjadi. Melihat efek sinergisme antara rimpang kencur dengan natrium diklofenak maka tujuan penelitian ini adalah pada pemberian EERK selama 7 hari berturut-turut dapat mempengaruhi proses metabolisme natrium diklofenak. Ekstraksi dilakukan dengan pelarut etanol 96%, kemudian dibuat dosis 20 mg/kg bb, 40 mg/kg bb dan 80 mg/kg bb. Penelitian dilakukan dengan memberikan larutan berturut-turut selama 7 hari dan pada hari ke-7 setelah 4 jam kemudian diberikan larutan natrium diklofenak secara oral. Selanjutnya darah masing-masing tikus jantan diambil dengan berbagai interval waktu dan diukur dengan spektrofotometri UV panjang gelombang 276 nm.
Hasil penelitian menunjukkan perbedaan antara perlakuan pada hewan tikus. Di mana nilai Cmaks meningkat dari EERK dosis 20 mg/kg bb (8,1203 ± 0,6907
mcg/ml), 40 mg/kg bb (10,5922 ± 0,8404 mcg/ml), 80 mg/kg bb (12,7621 ± 0,4303 mcg/ml), kontrol (7,4420 ± 0,2335 mcg/ml). Nilai AUC meningkat dari dosis 20 mg/kg bb (9669,2869 ± 978,3981 mcg/ml.menit), 40 mg/kg bb (14571,0840 ± 1376,9879 mcg/ml.menit), 80 mg/kg bb (21772,6671 ± 2073,7437 mcg/ml.menit), kontrol (8350,0142 ± 100,2482 mcg/ml.menit). Pemberian EERK menurunkan nilai CL, dosis 20 mg/kg bb (0,0491 ± 0,0066 ml/menit); 40 mg/kg bb (0,0321 ± 0,0047 ml/menit); 80 mg/kg bb (0,0209 ± 0,0045 ml/menit); kontrol (0,0573 ± 0,0075 ml/menit). Nilai Vd menurun dengan perlakuan EERK, dosis 20 mg/kg bb (49,4431 ± 7,0101 ml), 40 mg/kg bb (37,8919 ± 3,6637 ml), 80 mg/kg bb (31,6582 ± 6,4912 ml) dibandingkan kontrol (53,3887 ± 7,6580 ml). Nilai MRT meningkat pada EERK, kontrol (967,6589 ± 28,0171 menit); 20 mg/kg bb (1040,1964 ± 44,7328 menit); 40 mg/kg bb (1210,8529 ± 72,8713 menit); 80 mg/kg bb (1559,0302 ± 111,4972 menit).
Berdasarkan hasil di atas, disimpulkan bahwa EERK mempengaruhi profil farmakokinetika natrium diklofenak yang menunjukkan kemampuan EERK terhadap penghambatan metabolisme sebagai enzim inhibisi.
THE EFFECT OF EXTRACT Kaempferiae galangae L ON THE PHARMACOKINETIC PROFIL OF SODIUM DIKLOFENAC AT THE
EXPERIMENTAL WITH WHITE RATS ABSTRACT
Diclofenac sodium has antirheumatic activity, anti-inflammatory and analgesic – antipyretic. Rhizome extract as a potent anti-inflammatory
Kaempferiae galangae L where the higher dose given Kaempferiae galangae L extract the smaller the percentage of inflammation that occurs, Seeing the effect of synergism between Kaempferiae galangae L with diclofenac sodium, the purpose of this research is on EERK administration for 7 days in a row can affect the metabolism of diclofenac.
Extraction is done with 96 % ethanol, then made a dose of 20 mg / kg bw, 40 mg / kg bw and 80 mg / kg bw. Research done by providing a solution for 7 consecutive days and on day 7 after 4 hours and then given oral diclofenac sodium. Further blood each male rat was taken with various time intervals and measured by UV spectrophotometry wavelength 276 nm.
The results showed differences between treatments in mice. Where Cmax values increased in EERK administration of a of 20 mg/kg bw (8.1203 ± 0.6907 mcg/ml), 40 mg/kg bw (10.5922 ± 0.8404 mcg/ml), 80 mg/kg bw (12.7621 ± 0.4303 mcg/ml), controls (7.4420 ± 0.2335 mcg/ml). AUC values greater than EERK 20 mg/kg bw (9669.2869 ± 978.3981 mcg/ml.minute), 40 mg/kg bw (14571.0840 ± 1376.9879 mcg/ml.minute), 80 mg/kg bw (21772.6671 ± 2073.7437 mcg/ml.minute), control (8350.0142 ± 100.2482 mcg/ml. minute), EERK could decrease the value of CL, 20 mg/kg bw (0.0491 ± 0.0066 ml/minute), 40 mg/kg bw (0.0321 ± 0.0047 ml/minute), 80 mg/kg bw (0.0209 ± 0.0045 ml/minute), control (0.0573 ± 0.0075 ml/minute). Vd values decreased, EERK 20 mg/kg bw (49.4431 ± 7.0101 ml), 40 mg/kg bw (37.8919 ± 3.6637 ml), 80 mg/kg bw (31.6582 ± 6.4912 ml), controls (53.3887 ± 7.6580 ml). MRT values increased, control (967.6589 ± 28.0171 menit), 20 mg/kg bw (1040.1964 ± 44.7328 minute), 40 mg/kg bw (1210.8529 ± 72.8713 minute), 80 mg/kg bw (1559.0302 ± 111.4972 minute).
Based on the above results, it was concluded that EERK affect the pharmacokinetics of diclofenac sodium profile, the ability EERK on the inhibition of metabolism as enzyme inhibitor.
BAB I
PENDAHULUAN
1.1Latar Belakang
Fase farmakokinetika berkaitan dengan masuknya zat aktif ke dalam
tubuh dan merupakan salah satu unsur penting yang menentukan profil
keberadaan zat aktif pada tingkat biofase dan selanjutnya menentukan aktivitas
terapeutik obat (Aiache, 1993).
Dalam praktek terapeutik, suatu obat harus mencapai tempat kerja yang
diinginkan setelah masuk ke dalam tubuh dengan jalur tertentu. Obat harus
diabsorpsi ke dalam darah dari tempat pemberiannya dan didistribusikan
ketempat kerjanya, sesudah memberikan efek harus dikeluarkan dengan
kecepatan tertentu melalui inaktivasi metabolik, melalui ekskresi dari tubuh
atau gabungan kedua proses ini yang dikenal dengan nama eliminasi (Katzung,
1998).
Tanaman merupakan sumber kekayaan alam yang potensial di
Indonesia. Pendayagunaan obat asal tanaman akan memberikan keuntungan
yang besar bagi masyarakat dibandingkan dengan obat-obat sintetis, karena
biaya pengobatan akan lebih murah (Gholib, 2009).
Kencur (Kaempferia galanga L.) merupakan tumbuhan yang dikembangkan sebagai tanaman obat asli Indonesia. Rimpang kencur
bisul. Tanaman ini termasuk kelas Monocotyledoneae, bangsa Zingiberales,
suku Zingiberaceae, dan marga Kaempferia(Winarto, 2007).
Sulaiman, dkk., (2007), menyatakan bahwa rimpang kencur dapat
digunakan untuk hipertensi, rematik, dan asma. Menurut Hasanah, dkk.,
(2011), bahwa ekstrak rimpang kencur berkhasiat sebagai antiradang dimana
semakin tinggi dosis ekstrak rimpang kencur yang diberikan maka semakin
kecil persentase radang yang terjadi dan semakin tinggi pula persentase inhibisi
radangnya atau semakin tinggi dosis ekstrak maka semakin baik efeknya
sebagai antiinflamasi.
Natrium diklofenak mempunyai aktivitas antirematik, antiradang dan
analgetik-antipiretik. Digunakan terutama untuk mengurangi rasa nyeri akibat
peradangan pada berbagai rematik dan kelainan degeneratif pada sistem otot
rangka. Diklofenak diserap secara cepat dan sempurna di dalam lambung,
kadar plasma tertinggi dicapai 2 jam setelah pemberian oral, dengan waktu
paruh antara 1 - 3 jam (Anonim, 2007).
Natrium diklofenak merupakan derivat sederhana fenil asetat yang
termasuk Non-Steroid Anti-Inflamatory Drugs (NSAID) yang terkuat antiradangnya, tetapi mempunyai efek samping pada pemakaian sediaan obat
konvensional dalam jangka waktu lama dapat menyebabkan pendarahan pada
saluran cerna (Insel, 1996).
Berdasarkan uraian di atas, melihat efek dari ekstrak rimpang kencur
sebagai antiradang, diharapkan efek sinergisme dengan natrium diklofenak
dapat diketahui berapa dosis ekstrak rimpang kencur yang diberikan sebagai
dosis natrium diklofenak tunggal dan mengurangi efek samping dari natrium
diklofenak tersebut.
1.2 Perumusan Masalah
a. apakah ada pengaruh pemberian ekstrak rimpang kencur terhadap
perubahan parameter farmakokinetik natrium diklofenak?
b. apakah pemberian ekstrak rimpang kencur dapat mempengaruhi proses
metabolisme natrium diklofenak?
c. apakah ekstrak rimpang kencur dapat mengurangi efek samping
natrium diklofenak?
1.3 Hipotesis
a. ekstrak rimpang kencur mempengaruhi parameter farmakokinetik
natrium diklofenak pada hewan tikus.
b. ekstrak rimpang kencur mempengaruhi proses metabolisme natrium
diklofenak pada hewan tikus.
c. ekstrak rimpang kencur dapat mengurangi efek samping dari natrium
diklofenak?
1.4 Tujuan Penelitian
a. melihat pengaruh pemberian ekstrak rimpang kencur selama 7 hari
berturut-turut terhadap profil farmakokinetik natrium diklofenak pada
b. mengetahui apakah pemberian ekstrak rimpang kencur dapat
mempengaruhi proses metabolisme natrium diklofenak pada hewan
tikus.
c. mengetahui apakah pemberian ekstrak rimpang kencur dapat
mengurangi efek samping natrium diklofenak
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat digunakan sebagai informasi
terhadap penggunaan ekstrak rimpang kencur selama 7 hari berturut-turut akan
mempengaruhi aktivitas enzim pemetabolisme di dalam tubuh sehingga efek
1.6 Kerangka Pikir Penelitian
Adapun kerangka pikir penelitian ini adalah sebagai berikut:
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka pikir penelitian Simplisia
1. Pemeriksaan makroskopik 2. Pemeriksaan mikroskopik 3. Penetapan kadar air 4. Penetapan kadar abu total 5. Penetapan kadar abu tidak
larut dalam asam
6. Penetapan kadar sari larut dalam air
7. Penetapan kadar sari larut dalam etanol
BAB II
TINJAUAN PUSTAKA
2.1Natrium diklofenak
Menurut USP XXX (2007), sifat fisikokimia dari Natrium diklofenak adalah:
Gambar 2.1 Rumus struktur Natrium diklofenak Rumus molekul : C14H10Cl2NO2Na
Nama Kimia : (2- (2,6-diklorophenyl) amino benzeneacetic acid)
Berat Molekul : 318,13
Pemerian : Serbuk hablur, berwarna putih, tidak berasa
Diklofenak merupakan derivat fenil asetat dan termasuk NSAID yang
terkuat daya anti-radangnya dengan efek samping yang lebih kecil
dibandingkan dengan obat lainnya. Obat ini sering digunakan untuk segala
macam nyeri, juga pada migrain dan encok. Lagi pula secara parenteral sangat
efektif untuk menanggulangi rasa nyeri hebat (Tjay dan Rahardja, 2002).
NSAID berkhasiat analgetis, antipiretik serta anti radang, dan sering
sekali digunakan untuk menghalau gejala penyakit rematik, seperti artrosis dan
spondylosis. Obat ini efektif untuk peradangan lain akibat trauma (pukulan,
benturan, kecelakaan), juga misalnya setelah pembedahan atau pada memar
minum sedini mungkin dalam dosis yang cikup tinggi (Tjay dan Rahardja,
2002).
Cara kerja NSAID untuk sebagian besar berdasarkan hambatan sintetis
prostaglandin, dimana kedua jenis cyclo-oxygenase (COX) di blokir. NSAID
ideal hendaknya hanya menghambat COX-2 (peradangan) dan tidak COX-1
(perlindungan mukosa lambung), lagipula menghambat lipo-oxygenase
(pembentukan leukotrien) (Tjay dan Rahardja, 2002). Diklofenak adalah
inhibitor COX yang memiliki afinitas lebih besar untuk COX-2 dibanding
COX-1. Diklofenak menghambat sintesa prostaglandin, dan juga mengurangi
pembentukan leukotrien, yang dapat memberikan kontribusi kepada aktivitas
anti-inflamasi. Obat ini waktu paruhnya pendek pada sebagian besar spesies,
termasuk manusia, tetapi terakumulasi di situs peradangan, dimana mencapai
konsentrasi yang lebih tinggi di non-peradangan jaringan, dan sama dengan
yang dicapai dalam plasma (Veterinaria, 2006).
Efek samping yang lazim ialah mual, gastritis, eritema kulit dan sakit
kepala sama seperti semua obat NSAID. Pemakaian obat ini harus berhati-hati
pada penderita tukak lambung. Peningkatan enzim transaminase dapat terjadi
pada 15% pasien dan umumnya kembali ke normal. Pemakaian selama
kehamilan tidak dianjurkan (Wilmana, 2005).
2.2Uraian Tumbuhan
Kencur merupakan terna kecil yang tumbuh subur di daerah dataran
rendah atau pegunungan yang tanahnya gembur (Armando, 2009). Kencur
digolongkan sebagai salah satu jenis temu – temuan yang mempunyai daging
buah paling lunak dan tidak berserat.
2.2.1 Sistematika Tumbuhan
Sistematika tumbuhan kencur menurut Depkes (2001) adalah sebagai
berikut:
Kerajaan : Plantae
Divisi : Spermatophyta
Kelas : Monocotyledoneae
Bangsa : Zingiberales
Suku : Zingiberaceae
Marga : Kaempferia
Jenis : Kaempferia galanga L. 2.2.2 Morfologi Tumbuhan
Terna yang hampir menutupi tanah, tidak berbatang, rimpang
bercabang-cabang, berdesak-desakan, akar-akar berbentuk gelendong,
kadang-kadang berumbi, panjang 1 cm sampai 1,5 cm. Setiap tanaman berdaun
sebanyak 1 sampai 3 (umumnya 2 ) helai, lebar merata, dan hampir menutupi
tanah, daun berbentuk jorong lebar sampai hampir bundar, pangkal hampir
berbentuk jantung, ujung mendadak lancip, bagian atas tidak berambut, bagian
bawah berambut halus, pinggir bergelombang berwarna merah kecoklatan,
bagian tengah berwarna hijau, pelepah terbenam dalam tanah, warna putih.
Memiliki bunga dengan panjang 4 cm dan mengandung 4 sampai 12 bunga
2.2.3 Kandungan Kimia
Rimpang tumbuhan kencur (Kaempferia galanga L.) mengandung saponin, flavonoida, polifenol, dan minyak atsiri (Depkes, 2001).
Kandungan minyak atsiri dari rimpang tumbuhan kencur terdiri dari borneol,
metil p-coumaric acid, cinnamid ethyl ester, pentadecane, cinnamal dehyde,
dan camphene (Muhlisah, 1999).
2.3 Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan cara mengekstraksi
zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang
telah ditetapkan (Ditjen POM, 1995).
Metode ekstraksi menurut Ditjen POM (2000) dan Syamsuni (2006)
ada beberapa cara, yaitu: cara dingin dan cara panas.
2.3.1 Cara dingin a. Maserasi
Maserasi merupakan suatu proses pengekstrakan simplisia dengan
menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada
temperatur ruangan (kamar).
Perkolasi merupakan suatu cara penyarian simplisia dengan menggunakan
perkolator di mana simplisianya terendam dalam pelarut yang selalu baru dan
umumnya dilakukan pada temperatur kamar. Prosesnya terdiri dari tahapan
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan dan penampungan ekstrak) terus-menerus sampai diperoleh ekstrak
(perkolat).
2.3.2 Cara panas a. Refluks
Refluks merupakan suatu cara ekstraksi dengan pelarut pada temperatur
titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif
konstan dengan adanya pendingin balik.
b. Sokletasi
Sokletasi merupakan suatu cara ekstraksi kontinu dengan menggunakan
alat soklet, di mana pelarut akan terkondensasi dari labu menuju pendingin,
kemudian jatuh membasahi sampel dan mengisi bagian tengah alat soklet.
Tabung sifon juga terisi dengan larutan ekstraksi dan ketika mencapai bagian
atas tabung sifon, larutan tersebut akan kembali ke dalam labu.
c. Digesti
Digesti merupakan maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar, umumnya dilakukan pada
suhu 40-50oC.
Infus merupakan suatu cara ekstraksi dengan menggunakan pelarut air pada
temperatur 90oC selama 15 menit.
e. Dekok
Dekok merupakan suatu cara ekstraksi pada suhu 90oC dengan
menggunakan pelarut air selama 30 menit.
2.4 Farmakokinetik
Profil keberadaan bahan obat dalam darah sebagai fungsi dari waktu
menggambarkan interaksi antara fase ketersediaan zat aktif dan fase
disposisinya. Selain itu, profil tersebut juga mengungkapkan nasib obat di
dalam tubuh. Oleh karena fenomena penyerapan zat aktif dari darah menuju
jaringan dapat terjadi secara bolak-balik (reversible), maka selalu terjadi
hubungan dinamik antara konsentrasi zat aktif dalam jaringan dan konsentrasi
zat aktif dalam darah (Aiache, 1993).
2.4.1 Absorbsi
Obat-obat yang diberikan peroral akan di absorpsi bila molekul obat
berada dalam bentuk terlarut. Molekul obat mula-mula berikatan dengan
mukosa lambung atau usus, kemudian obat mencapai lapisan yang lebih dalam
dari membran sel tapi belum sampai ke pembuluh darah. Penyerapan obat
dapat terjadi di lambung atau usus halus. Penyerapan obat di lambung
tergantung pada keadaan lambung yang penuh dan kosong. Saat saluran
di usus halus. Selanjutnya obat akan menembus dinding pembuluh darah dan
masuk ke dalam sirkulasi darah (Aiache, 1993).
Natrium diklofenak di absorpsi melalui saluran cerna yang berlangsung
cepat dan lengkap. Obat ini terikat 99% pada protein plasma dan mengalami
efek metabolisme lintas pertama (first pass effect = FPE). Walaupun waktu paruhnya singkat yakni sekitar 1-3 jam, Natrium diklofenak diakumulasi di
cairan synovial yang menjelaskan efek terapi di sendi jauh lebih panjang dari
waktu paruh obat tersebut (Altaher, 2005).
2.4.2 Distribusi
Apabila obat mencapai pembuluh darah, obat akan ditransfer lebih
lanjut bersama aliran darah dalam sistem sirkulasi. Akibat perubahan
konsentrasi darah terhadap jaringan, bahan obat meninggalkan pembuluh darah
dan terdistribusi ke dalam jaringan (Mutscler, 1985).
Obat setelah masuk ke dalam peredaran darah akan disebarkan ke
seluruh bagian tubuh melalui aliran darah. Pada tahap ini sebagian obat dapat
berikatan dengan protein darah dan membentuk kompleks obat protein yang
reversible dan umumnya melibatkan albumin. Obat yang terikat dengan protein
merupakan suatu kompleks besar yang tidak dapat melewati membran sel
dengan mudah sehingga tidak aktif secara farmakologik. Sebaliknya obat
bentuk bebas atau tidak terikat dapat melewati membran sel dan didistribusikan
ke semua jaringan, dimana obat dapat berinteraksi dengan reseptor uuntuk
2.4.3 Metabolisme
Dalam hati, seluruh atau sebagian obat mengalami perubahan kimiawi
secara enzimatis dan hasil perubahannya (metabolit) menjadi tidak atau kurang
aktif (Tjay dan Rahardja, 2002). Faktor yang mempengaruhi metabolisme obat
yaitu induksi enzim yang dapat meningkatkan kecepatan biotransformasi.
Selain itu inhibisi enzim yang merupakan kebalikan dari induksi enzim,
biotranformasi obat diperlambat, menyebabkan bioavailabilitasnya meningkat,
menimbulkan efek menjadi lebih besar dan lebih lama. Kompetisi (interaksi
obat) juga berpengaruh terhadap metabolisme dimana terjadi oleh obat yang
dimetabolisir oleh sistem enzim yang sama (Hinz, 2005).
Obat yang digunakan secara oral akan melalui lever (hepar) sebelum
masuk ke dalam darah menuju ke daerah lain dari tubuh (misalnya otak,
jantung, paru-paru dan jaringan lainnya). Di dalam lever terdapat enzim khusus
yaitu sitokrom P-450 yang akan mengubah obat menjadi bentuk metabolitnya.
Metabolit umumnya menjadi lebih larut dalam air (polar) dan akan dengan
cepat diekskresi ke luar tubuh melalui urin, feses, keringat dan lain-lain. Hal ini
akan secara dramatik mempengaruhi kadar obat dalam plasma dimana obat
yang mengalami first pass metabolism akan kurang bioavailabilitasnya sehingga efek yang di hasilkan juga berkurang (Hinz, 2005).
Metabolit umumnya merupakan suatu bentuk yang lebih larut dalam air
dibandingkan molekul awal. Perubahan sifat fisiko kimia ini paling sering
dikaitkan dengan penyebaran kuantitatif metabolit yang dapat sangat berbeda
mediator farmakologik, maka akan terjadi perubahan, baik berupa peningkatan
maupun penurunan efeknya (Aiache, 1993).
2.4.4 Ekskresi
Pengeluaran obat atau metabolitnya dari tubuh terutama dilakukan oleh
ginjal melalui air seni disebut ekskresi. Lazimnya tiap obat diekskresi berupa
metabolitnya dan hanya sebagian kecil dalam keadaan asli yang utuh. Tapi
adapula beberapa cara lain yaitu melalui kulit bersama keringat, paru-paru
melalui pernafasan dan melalui hati dengan empedu (Tjay dan Rahardja, 2002).
2.5Parameter Farmakokinetika
a. T maksimum (tmaks) yaitu waktu konsentrasi plasma mencapai puncak
dapat disamakan dengan waktu yang diperlukan untuk mencapai konsentrasi
obat maksimum setelah pemberian obat. Pada tmaks absorpsi obat adalah
terbesar, dan laju absorpsi obat sama dengan laju eliminasi obat. Absorpsi
masih berjalan setelah tmaks tercapai, tetapi pada laju yang lebih lambat.
Harga tmaks menjadi lebih kecil (berarti sedikit waktu yang diperlukan untuk
mencapai konsentrasi plasma puncak) bila laju absorpsi obat menjadi lebih
cepat (Shargel, 2005).
b. Konsentrasi plasma puncak (Cmaks) menunjukkan konsentrasi obat
maksimum dalam plasma setelah pemberian secara oral. Untuk beberapa
obat diperoleh suatu hubungan antara efek farmakologi suatu obat dan
konsentrasi obat dalam plasma. Konsentrasi plasma puncak memberi suatu
petunjuk bahwa obat cukup diabsorpsi secara sistemik untuk memberi suatu
c. Menurut Holford (1998), Volume Distribusi (Vd) adalah volume yang
didapatkan pada saat obat didistribusikan. Volume distribusi yang diperoleh
mencerminkan suatu keseimbangan antara ikatan pada protein plasma yang
meningkatkan konsentrasi plasma dan membuat volume distribusi menjadi
lebih kecil.
d. AUC (Area Under Curve) adalah permukaan di bawah kurva (grafik) yang
menggambarkan naik turunnya kadar plasma sebagai fungsi dari waktu.
e. MRT merupakan waktu keberadaan obat dalam tubuh
f. Tetapan Laju Eliminasi dan Waktu Paruh dalam Plasma
Waktu paruh dalam plasma adalah waktu dimana konsentrasi obat dalam
darah (plasma) menurun hingga separuh dari nilai seharusnya.
g. Klirens
Klirens suatu obat adalah faktor yang memprediksi laju eliminasi obat dari
BAB III
METODE PENELITIAN
Penelitian ini dilakukan terhadap rimpang kencur (Kaempferia galangal L)berdasarkan metode eksperimental dengan tahapan penelitian yaitu penyiapan tumbuhan, pemeriksaan karakteristik simplisia, pemeriksaan
skrining fitokimia simplisia, pembuatan ekstrak, pemberian obat kepada
hewan, pengambilan darah, pengukuran dengan spektrofotometer ultraviolet.
3.1 Alat
Alat-alat yang digunakan adalah alat-alat gelas laboratorium, blender
(National), lemari pengering, perkolator, oven, cawan penguap, Rotary evaporator (Heidolph VV-300), oral sonde, timbangan hewan (GW-1500), pisau cukur, neraca analitik (Mettler Toledo), tabung sentrifug, rak tabung, alat vortex, alat sentrifuge (Velocity 18R), spuit, labu tentukur, pipet tetes, spektrofotometer UV (Shimadzu UV 1800), stamfer dan mortir, stopwatch. 3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah aquades,
natrium diklofenak (PT. Dexa Medica), ekstrak kencur, natrium klorida
(E-merck), etanol 96%, trikloroacid, heparin, karboksi metil selulosa (CMC).
3.3 Penyiapan Tumbuhan 3.3.1 Pengambilan tumbuhan
Pengambilan tumbuhan yang digunakan dalam penelitian ini adalah
rimpang kencur yang masih segar yang diperoleh dari pasar pagi Tanjung Sari,
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense
Laboratorium Penelitian Biologi Fakultas MIPA Universitas Sumatera Utara,
Medan.
3.3.3 Pengolahan tumbuhan
Rimpang kencur yang masih segar dibersihkan dari kotoran atau bahan
asing lainnya kemudian dicuci dengan air bersih lalu ditiriskan dan ditimbang
sebagai berat basah. Lalu dirajang ± 1-4 mm dan dikeringkan dalam lemari
pengering hingga kering ditandai dengan rimpang mudah dipatahkan dan
ditimbang sebagai berat kering. Irisan rimpang kencur kering diblender hingga
menjadi serbuk dan ditimbang sebagai berat serbuk simplisia. Lalu disimpan
dalam wadah plastik, diberi etiket dan disimpan ditempat kering.
3.4 Pemeriksaan karakteristik simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air,
penetapan kadar sari larut dalam etanol, penetapan kadar abu total, dan
penetapan kadar abu tidak larut dalam asam (Ditjen POM, 1995).
3.4.1 Pemeriksaan makroskopik dan organoleptik
Pemeriksaan makroskopik dan organoleptik dilakukan dengan
mengamati bentuk, rasa, bau, dan warna dari simplisia rimpang kencur.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia rimpang
telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup,
selanjutnya diamati di bawah mikroskop.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari alas bulat 500 ml, alat penampung, pendingin, tabung
penyambung dan tabung penerima 10 ml.
Caranya: Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam
labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi
selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit,
kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml
(WHO, 1992). Kemudian sebanyak 5 g serbuk simplisia dimasukkan ke dalam
labu lalu dipanaskan selama 15 menit. Setelah toluen mendidih, kecepatan
tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi,
kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah
semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin pada
suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca
dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan
kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung
dalam persen (Ditjen POM, 1995).
3.4.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 ml air
bersumbat sambil sesekali dikocok selama 6 jam pertama kemudian dibiarkan
selama 18 jam dan disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai
kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan
dalam oven pada suhu 105ºC sampai diperoleh bobot konstan. Kadar sari yang
larut di dalam air dihitung terhadap bahan yang telah dikeringkan (Ditjen
POM, 1995).
3.4.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam
pertama dan kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml
filtrat pertama diuapkan sampai kering dalam cawan dangkal berdasar rata
yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105ºC sampai
diperoleh bobot konstan. Kadar sari yang larut di dalam air dihitung terhadap
bahan yang telah dikeringkan (Ditjen POM, 1995).
3.4.6 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia dimasukkan dalam kurs porselen yang
telah dipijar dan ditara, kemudian diratakan. Kurs dipijarkan hingga arang
habis, kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap.
Kadar abu total dihitung terhadap bahan yang telah dikeringkan (Ditjen POM,
1995).
3.4.7 Penetapan kadar abu tidak larut dalam asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan
asam dikumpulkan, disaring melalui kertas saring, dipijarkan hingga bobot
tetap kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam
asam dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.5 Skrining Fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa
golongan flavonoid, alkaloid, saponin, tanin, glikosida dan steroid/triterpenoid.
3.5.1 Pemeriksaan flavanoid
Sebanyak 10 g simplisia ditambahkan 10 ml air panas, dididihkan
selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat
ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml
amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika warna
merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.5.2 Pemeriksaan alkaloid
Simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji
alkaloida: diambil 3 tabung reaksi, lalu kedalamannya dimasukkan 0,5 ml
filtrat.
Pada masing-masing tabung reaksi:
1. Ditambahkan 2 tetes pereaksi Mayer
2. Ditambahkan 2 tetes pereaksi Bouchardat
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua
dari tiga percobaan diatas (Ditjen POM, 1995).
3.5.3 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam
tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan, kemudian
dikocok kuat-kuat selama 10 menit. Jika terbentuk busa setinggi 1-10 cm yang
stabil tidak kurang dari 10 menit dan buih tidak hilang dengan penambahan 1
tetes asam klorida 2 N menunjukkan adanya saponin (Ditjen POM, 1995).
3.5.4 Pemeriksaan tanin
Serbuk simplisia ditimbang sebanyak 1 g, dididihkan selama 30 menit
dalam 100 ml air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan
1 - 2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau
hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.5.5 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml
campuran etanol 96%-air (7:3) dan 10 ml asam klorida 2 N, direfluks selama
30 menit, didinginkan dan disaring. Diambil 20 ml filtrat, ditambahkan 25 ml
air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan selama 5
menit, lalu disaring. Filtrat disari dengan 20 ml campuran
kloroform-isopropanol (3:2) sebanyak 3 kali. Kumpulan sari air diuapkan pada
temperatur tidak lebih dari 500C, sisanya dilarutkan dengan 2 ml metanol.
Larutan sisa digunakan untuk percobaan berikut, yaitu 0,1 ml larutan
Sisa ditambahkan 2 ml air dan 5 tetes Molish, kemudian ditambahkan perlahan
2 ml asam sulfat, terbentuk cincin berwarna ungu pada batas cairan,
menunjukkan adanya ikatan gula (Ditjen POM, 1995).
3.5.6 Pemeriksaan steroid/triterpenoid
Serbuk simplisia ditimbang sebanyak 1 g, dimaserasi dengan 20 ml
nheksan selama 2 jam, disaring. Filtrat diuapkan dalam cawan penguap dan
pada sisanya ditambahkan pereaksi Liebermann-Burchard melalui dinding
cawan. Apabila terbentuk warna ungu atau merah yang berubah menjadi biru
ungu atau biru hijau menunjukkan adanya triterpenoid/steroid (Harborne,
1987).
3.6 Pembuatan Ekstrak Etanol Rimpang Kencur (EERK)
Pembuatan ekstrak etanol rimpang kencur dilakukan dengan metode
perkolasi. Caranya 350 g serbuk simplisia dimaserasi dengan etanol 96%
selama 3 jam. Selanjutnya dipindahkan massa tersebut sedikit demi sedikit ke
dalam perkolator, tambahkan etanol 96% secukupnya hingga simplisia
terendam dan terdapat cairan penyari di atasnya, perkolator ditutup dengan
aluminium foil dan dibiarkan selama 24 jam. Kemudian kran perkolator dibuka
dan dibiarkan cairan ekstrak menetes dengan kecepatan 20 tetes per menit dan
ditambahkan etanol 96% berulang-ulang secukupnya sehingga selalu terdapat
selapis cairan penyari di atas simplisia. Perkolasi dihentikan jika 500 mg
perkolat yang keluar terakhir diuapkan, tidak meninggalkan sisa. Perkolat
dari 50oC menggunakan rotary evaporator sehingga diperoleh ekstrak kental
sebanyak 56,87 g (Ditjen POM, 1995).
3.7. Pembuatan Diklofenak Baku
3.7.1 Pembuatan larutan induk baku I natrium diklofenak
Timbang seksama sejumlah 50 mg Natrium diklofenak baku,
dimasukan kedalam labu tentukur 100 ml, dicukupkan dengan NaOH 0,1 N
hingga garis tanda. Dikocok sampai homogen sehingga diperoleh larutan
dengan konsentrasi 500 mcg/ml.
3.7.2 Pembuatan larutan induk baku II natrium diklofenak
Pipet dari LIB I sebanyak 10 ml, dimasukan kedalam labu tentukur 50
ml, dicukupkan dengan NaOH 0,1 N hingga garis tanda. Dikocok sampai
homogen sehingga diperoleh larutan dengan konsentrasi 100 mcg/ml.
3.7.3 Pengukuran panjang gelombang absorpsi maksimum di dalam larutan NaOH 0,1 N
Larutan natrium diklofenak dibuat dengan konsentrasi 13 mcg/mL
dengan memipet 6,5 ml dari LIB II dimasukan kedalam labu tentukur 50 ml,
lalu di tambahkan larutan NaOH 0,1 N. Serapan larutan tersebut diukur pada
panjang gelombang 200 - 400 nm dengan alat spektrofotometer ultraviolet.
3.7.4 Pembuatan kurva baku natrium diklofenak pada panjang gelombang maksimum
Pembuatan kurva baku natrium diklofenak pada panjang gelombang
maksimum dilakukan dengan cara:
Dipipet larutan dari LIB II berturut-turut 2,0; 2,5; 3; 3,5; dan 4 ml larutan
14; dan 16 mcg/ml. Larutan diukur serapan nya pada panjang gelombang yang
sesuai dengan hasil pengukuran panjang gelombang maksimum.
3.8 Pembuatan Suspensi
3.8.1 Pembuatan suspensi Na-CMC 1%
Ditimbang sebanyak 1 gram Na-CMC lalu ditaburkan dalam lumpang
yang berisi 20 ml akuades panas. Didiamkan selama 15 menit hingga diperoleh
massa yang transparan, lalu digerus sampai homogen, diencerkan dengan
aquadest dan dimasukkan ke dalam labu tentukur 100 ml, kemudian
dicukupkan volumenya dengan akuades hingga 100 ml.
3.8.2 Pembuatan suspensi natrium diklofenak 0,05%
Ditimbang sebanyak 50 mg Natrium diklofenak baku, masukan dalam
lumpang kemudian ditambahkan suspensi Na-CMC 1 % digerus sampai
homogen. Dituang kedalam labu tentukur 100 ml, ditambah Na-CMC 1 %
sampai batas tanda, kocok hingga homogen.
3.8.3 Penyiapan suspensi ekstrak etanol rimpang kencur (EERK) 1% Ditimbang sebanyak 250 mg ekstrak etanol rimpang kencur,
dimasukkan ke dalam lumpang, ditambahkan sedikit suspensi Na-CMC 1%
digerus kemudian dihomogenkan. Dituang ke dalam labu tentukur 25 ml,
ditambah suspensi Na-CMC 1% sampai batas tanda.
3.9 Perlakuan Terhadap Hewan Tikus
Tikus jantan sebanyak 20 ekor dengan berat badan 150-300 g
dikelompokkan secara acak menjadi 4 kelompok, yang masing-masing
Kelompok I : Diberikan suspensi natrium diklofenak dosis 2,25 mg/kg bb
Kelompok II : Diberikan suspensi EERK dosis 20 mg/kg bb dan natrium
diklofenak dosis 2,25 mg/kg bb
Kelompok III : Diberikan suspensi EERK dosis 40 mg/kg bb dan natrium
diklofenak dosis 2,25 mg/kg bb
Kelompok IV : Diberikan suspensi EERK dosis 80 mg/kg bb dan natrium
diklofenak dosis 2,25 mg/kg bb
3.9.1 Pemberian natrium diklofenak tanpa EERK pada hewan tikus 1. Sebelum digunakan tikus dipuasakan selama 14 jam.
2. Hewan uji diberikan larutan natrium diklofenak secara peroral
dengan menggunakan oral sonde dengan dosis 2,25 mg/kg bb.
3. Rambut pada ekor tikus dicukur terlebih dahulu.
4. Masing-masing hewan uji diambil darahnya sebanyak 0,5 ml dari
vena bagian ekor tikus secara venaseksi dengan spuit yang terisi
heparin dengan interval waktu 15 menit; 30 menit; 45 menit; 75
menit; 105 menit; 135 menit; 195 menit; 255 menit; 315 menit; 435
menit; 555 menit; 675 menit. Kemudian divorteks dan disentrifug.
Hasil sentrifug ditambahkan TCA 20% sebanyak 1 ml lalu divorteks
dan disentrifug pada 3000 rpm selama 10 menit untuk memisahkan
plasmanya dan diambil supernatan kemudian ukur absorbansi
3.9.2 Pemberian natrium diklofenak dan EERK pada hewan tikus selama 7 hari berturut-turut
1. Pada kelompok perlakuan masing-masing hewan diberi ekstrak
kencur dengan dosis 20 mg/kg bb, 40 mg/kg bb, 80 mg/kg bb selama
7 hari berturut-turut secara peroral dengan menggunakan oral sonde.
2. Sebelum digunakan tikus dipuasakan selama 14 jam
3. Kemudian pada hari ke-7 setelah 4 jam pemberian ekstrak kencur
diberi larutan obat natrium diklofenak dosis 2,25 mg/kg bb secara
oral.
4. Selanjutnya dilakukan sama seperti sub point 2.9.1 nomor 3 dan 4.
3.10 Analisis Data
Data hasil penelitian ini dianalisis secara statistik menggunakan metode
ANAVA (analisis variansi) dengan tingkat kepercayaan 95%, dilanjutkan
dengan uji Duncan untuk mengetahui kelompok mana yang mempunyai
BAB IV
HASIL DAN PEMBAHASAN
4.1 Karakterisasi Simplisia dan Ekstrak
Berdasarkan identifikasi yang dilakukan di Herbarium Medanense
Laboratorium Penelitian Biologi Fakultas MIPA Universitas Sumatera Utara,
Medan identitas sampel tumbuhan yang diteliti adalah Kaempferia galanga L suku Zingiberaceae yang dikenal masyarakat dengan nama Kencur. (Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1).
Hasil pemeriksaan makroskopik dan organoleptik simplisia rimpang
kencur yaitu, bentuk pipih, memiliki bau khas aromatik, rasa pedas dan hangat,
bagian luar berwarna coklat kemerahan, bagian dalam berwarna putih
kekuningan sampai kecoklatan, bagian tepi berombak dan berkeriput (Hasil
dapat dilihat pada lampiran 4).
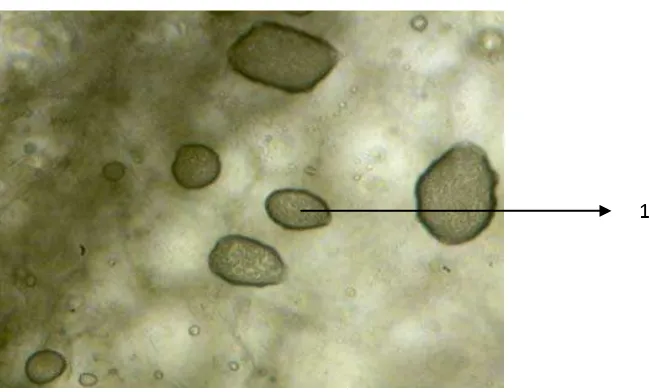
Hasil pemeriksaan mikroskopik terhadap serbuk simplisia tumbuhan
rimpang kencur mempunyai warna putih kecoklatan sampai coklat dan terdapat
parenkim, parenkim yang berisi sel minyak, pembuluh kayu dengan penebalan
spiral, terdapat periderm, periderm dengan parenkim, serta pembuluh kayu
dengan penebalan spiral, dan butir pati yang mempunyai bentuk bulat seperti
Keterangan: 1. Periderm
2. Pembuluh kayu dengan penebalan spiral 3. Sel minyak
4. Parenkim dengan sel minyak 5. Periderm dengan parenkim
Keterangan: 1. Butir pati
Gambar 4.1 Hasil Mikroskopik Serbuk Rimpang Kencur
1
1 2
3
4
Hasil pemeriksaan karakteristik simplisia rimpang kencur dapat dilihat
pada Tabel 4.1 berikut ini.
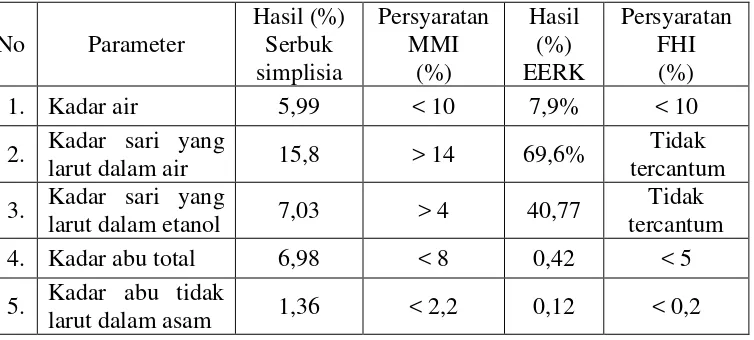
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia rimpang kencur
No Parameter
Hasil karakterisasi rimpang kencur dan ekstrak rimpang kencur
memenuhi persyaratan yang tercantum pada Materia Medika Indonesia dan
Farmakope Herbal Indonesia. Persyaratan kadar air pada simplisia rimpang
kencur yaitu < 10 dan kadar air pada simplisia rimpang kencur sebesar 5,99%
dan kadar air pada ekstrak rimpang kencur sebesar 7,9%. Penetapan kadar air
ini bertujuan untuk melindungi simplisia dari cemaran mikroorganisme.
Penetapan kadar sari larut larut dalam air pada simplisia rimpang
kencur juga memenuhi persyaratan Materia Medika Indonesia yaitu > 14
dimana kadar sari larut air sebesar 15,8% dan kadar dari ekstrak rimpang
kencur sebesar 69,6%. Kadar sari larut dalam etanol pada simplisia rimpang
kencur sebesar 7,03% dan syarat pada Meteria Medika Indonesia yaitu > 4.
Sementara pada ekstrak rimpang kencur sebesar 40,77%. Syarat kadar sari larut
diharapkan untuk hasil karakterisasi ini dapat digunakan sebagai pembanding
dalam pembuatan ekstrak.
Kadar abu total pada simplisia rimpang kencur sebesar 6,98% dan
ekstrak rimpang kencur sebesar 0,42% . Tujuan dari penetapan kadar abu total
untuk mengetahui kadar mineral, kalium dan magnesium yang tidak larut
(Diharmi, dkk., 2011). Kadar abu larut asam pada simplisia rimpang kencur
sebesar 1,36%, pada ekstrak rimpang kencur sebesar 0,12%. Sementara kadar
abu tidak larut asam adalah garam-garam klorida yang tidak larut asam yang
sebagian adalah garam-garam logam berat dan silika (Diharmi, dkk., 2011).
4.2 Skrining Fitokimia
Tujuan dilakukannya skrining fitokimia adalah untuk mengetahui
senyawa metabolit sekunder yang terdapat dalam simplisia (Harborne, 1996).
Hasil skrining fitokimia dapat dilihat pada Tabel 4.2.
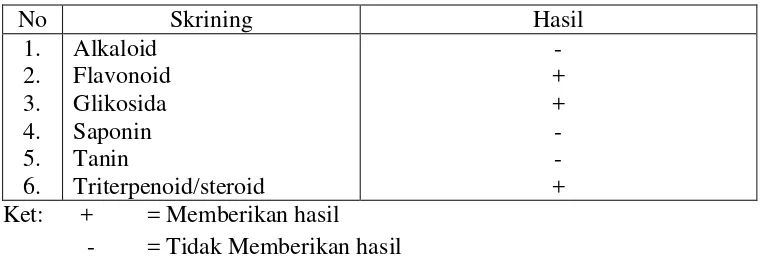
Tabel 4.2 Hasil Skrining Fitokimia Simplisia Rimpang Kencur
Ket: + = Memberikan hasil - = Tidak Memberikan hasil
Berdasarkan hasil skrining fitokomia serbuk simplisia rimpang kencur
Menurut Kurniawati, (1995) flavonoid bekerja menghambat fase
penting dalam biosintesis prostaglandin, yaitu pada lintasan siklooksigenase.
Flavonoid juga menghambat fosfodiesterase, aldoreduktase, monoamine
oksidase, protein kinase, DNA polymerase dan lipooksigenase. Mekanisme
flavonoid dalam menghambat proses terjadinya inflamasi melalui dua cara,
yaitu dengan menghambat permeabilitas kapiler dan menghambat metabolisme
asam arakidonat dan sekresi enzim lisosom dari sel neutrofil dan sel
endothelial (Kurniawati, 2005).
Rimpang kencur yang digunakan pada penelitian ini sebanyak 8 kg,
yang selanjutnya dikeringkan dalam lemari pengering dengan temperatur ±
40oC sampai kering dan diperoleh berat simplisia sebesar 750 g.
Hasil penyarian 350 g serbuk simplisia rimpang dengan pelarut etanol
96% diperoleh ekstrak kental yang kemudian diuapkan dengan menggunakan
rotary evaporator dan kemudian dikeringkan dengan menggunakan freeze dryer diperoleh 56,87 g ekstrak (rendemen 16,24%).
4.3 Nilai Kadar Rata-rata Natrium Diklofenak dalam plasma
Penentuan kadar natrium diklofenak dilakukan dengan menggunakan
darah tikus. Dari hasil pengukuran kadar rata-rata untuk perlakuan natrium
diklofenak dalam plasma tanpa EERK dan perlakuan natrium diklofenak
dengan pemberian EERK dosis 20 mg/kg bb, 40 mg/kg bb, 80 mg/kg bb
selama 7 hari berturut-turut yang menggunakan spektrofotometri ultraviolet
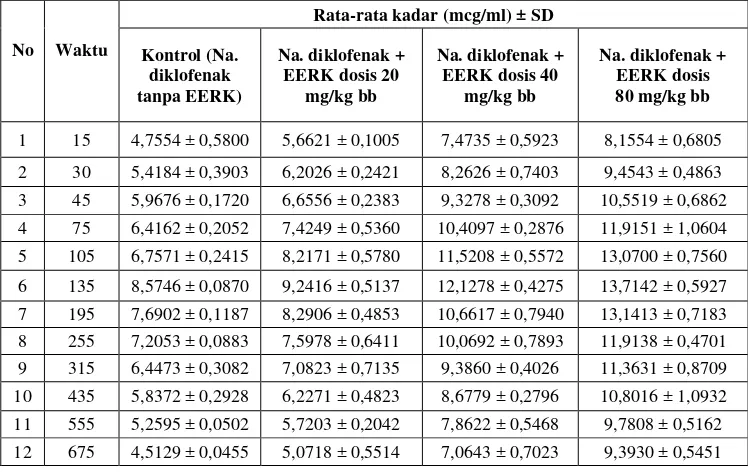
Tabel 4.3 Nilai kadar rata-rata ±sd terhadap waktu natrium diklofenak dalam plasma tikus putih jantan
Tabel 4.3 dapat digambarkan kadar rata-rata (Log C) vs Waktu (t)
natrium diklofenak dalam plasma tanpa eerk dan perlakuan natrium diklofenak
dengan pemberian EERK dosis 20 mg/kg bb, 40 mg/kg bb, 80 mg/kg bb
selama 7 hari berturut-turut seperti yang terlihat pada Gambar 4.2 di bawah ini.
Gambar 4.2 Nilai kadar rata-rata (Log C) vs waktu (t) natrium diklofenak dalam plasma tikus putih jantan
1
EERK dosis 20 mg/kg bb
EERK dosis 40 mg/kg bb
EERK dosis 80 mg/kg bb No Waktu
Rata-rata kadar (mcg/ml) ± SD Kontrol (Na.
diklofenak tanpa EERK)
Na. diklofenak + EERK dosis 20
mg/kg bb
Na. diklofenak + EERK dosis 40
mg/kg bb
Hasil dari rata-rata kadar natrium diklofenak kemudian digunakan
untuk menghitung nilai parameter farmakokinetika natriun diklofenak dalam
plasma tanpa EERK dan perlakuan natrium diklofenak dengan pemberian
EERK dosis 20 mg/kg bb, 40 mg/kg bb, 80 mg/kg bb selama 7 hari
berturut-turut dapat dilihat pada Tabel 4.4 berikut.
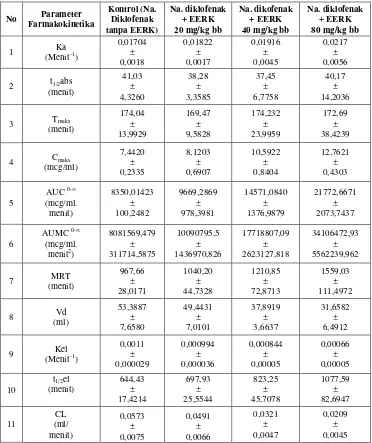
Tabel 4.4 Data rata-rata parameter farmakokinetika natrium diklofenak dalam plasma tikus putih jantan untuk setiap perlakuan
No Parameter Farmakokinetika
Kontrol (Na. Diklofenak tanpa EERK)
Dari Tabel 4.4 dapat dilihat adanya perbedaan dari masing-masing
perlakuan. Konsentrasi obat maksimum dalam plasma (Cmaks) merupakan
petunjuk bahwa obat diabsorpsi secara sistemik untuk memberikan suatu
respon terapeutik dan menunjukan kemungkinan adanya kadar toksik obat
dalam tubuh. Nilai Cmaks tergantung oleh dosis (D0), volume distribusi (Vd),
tetapan laju eliminasi obat (Kel), dan tmaks. Nilai Cmaks dari natrium diklofenak
dalam plasma mengalami peningkatan secara bermakna (p<0,05) pada
perlakuan dengan ekstrak rimpang kencur. Peningkatan nilai Cmaks dapat dilihat
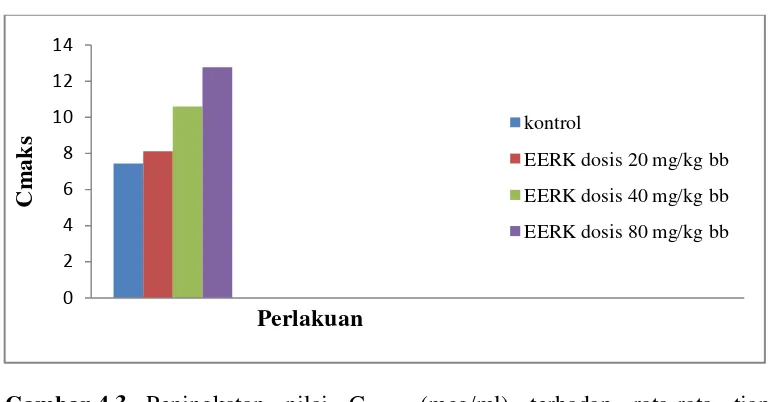
pada Gambar 4.3.
Gambar 4.3 Peningkatan nilai Cmaks (mcg/ml) terhadap rata-rata tiap
perlakuan pada tikus putih jantan
Nilai Cmaks pada kontrol adalah 7,4420 ± 0,2335 mcg/ml, perlakuan
dengan pemberian ekstrak kencur dosis 20 mg/kg bb sebesar 8,1203 ± 0,6907
mcg/ml, dosis 40 mg/kg bb meningkat menjadi 10,5922 ± 0,8404 mcg/ml, dan
dosis 80 mg/kg bb mengalami peningkatan menjadi 12,7621 ± 0,4303 mcg/ml.
Hasil penelitian menunjukan jumlah Cmaks meningkat diakibatkan jumlah
absorpsi yang meningkat. 0
2 4 6 8 10 12 14
C
mak
s
Perlakuan
kontrol
EERK dosis 20 mg/kg bb
EERK dosis 40 mg/kg bb
Luas area di bawah kurva (AUC) merupakan salah satu parameter
bioavaibilitas obat, dimana AUC 0-∞ menunjukan jumlah obat aktif yang berada
pada sirkulasi sistemik. Nilai AUC 0-∞ dipengaruhi oleh jumlah total obat yang
tersedia dan klirens (CL). Bila nilai AUC 0-∞ meningkat maka nilai CL
menurun (Shargel dan Yu, 1998).
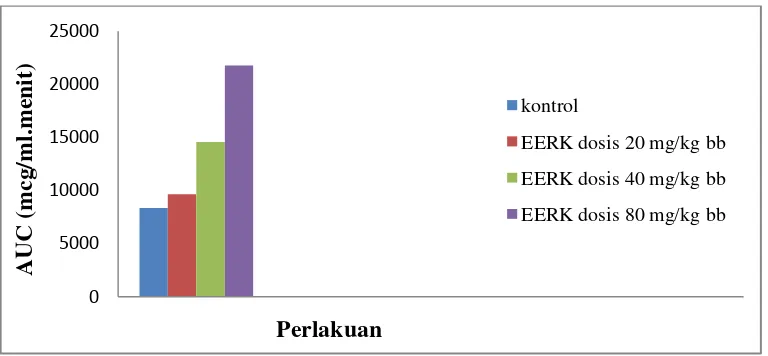
Pada hasil penelitian menunjukan nilai AUC 0-∞ pada pemberian ekstrak
kencur dari dosis 20 mg/kg bb, 40 mg/kg bb, dan 80 mg/kg bb menyebabkan
peningkatan nilai AUC 0-∞ secara bermakna (P < 0,05)dari natrium diklofenak
dalam plasma. Nilai AUC 0-∞ kontrol sebesar 8350,0142 ± 100,2482
mcg/ml.menit, pada perlakuan EERK dosis 20 mg/kg bb sebesar 9669,2869 ±
978,3981 mcg/ml.menit, perlakuan EERK dosis 40 mg/kg bb sebesar
14571,0840 ± 1376,9879 mcg/ml.menit dan nilai AUC 0-∞ pada perlakuan
EERK dosis 80 mg/kg bb lebih meningkat dari perlakuan dosis 40 mg/kg bb
dan 20 mg/kg bb yaitu 21772,6671 ± 2073,7437 mcg/ml.menit. Peningkatan
nilai AUCdapat dilihat pada Gambar 4.4.
Gambar 4.4 Peningkatan nilai AUC (mcg/ml.menit) terhadap rata-rata tiap 0
EERK dosis 20 mg/kg bb
EERK dosis 40 mg/kg bb
Nilai MRT juga mengalami perbedaan bermakna (p<0,05) antara
kontrol dengan perlakuan pemberian EERK. Nilai MRT pada kontrol adalah
967,6589 ± 28,0171 menit, sedangkan perlakuan dengan pemberian EERK
dosis 20 mg/kg bb meningkat 1040,1964 ± 44,7328 menit, EERK dosis 40
mg/kg bb 1210,8529 ± 72,8713 menit, dan perlakuan EERK dosis 80 mg/kg bb
1559,0302 ± 111,4972 menit.
Nilai MRT menggambarkan waktu rata-rata obat berada dalam tubuh.
Nilai MRT yang meningkat terhadap perlakuan ekstrak kencur menyebabkan
obat tidak berubah dan lebih lama berada di dalam tubuh sehingga nilai AUC
0-∞ dan C
maks meningkat sedangkan laju eliminasi dan klirens menurun (Shargel
dan yu, 1988). Hal ini dapat dilihat dari penurunan nilai Kel dari 0,0011 ±
0,000028 menit-1 untuk kontrol sampai 0,0217 ± 0,0056 menit-1 pada perlakuan
eerk dosis 80 mg/kg bb. Peningkatan nilai MRTdapat dilihat pada Gambar 4.5.
Gambar 4.5 Peningkatan nilai MRT (Mean Recidence Time) (menit) terhadap rata-rata tiap perlakuan pada tikus putih jantan
Pada kontrol menunjukan nilai kel yang besar yaitu 0,0011 ± 0,000029
menit-1 sedangkan pada perlakuan EERK dosis 20 mg/kg bb (0,00099 ± 0
EERK dosis 20 mg/kg bb
EERK dosis 40 mg/kg bb
0,000036 menit-1)dosis 40 mg/kg bb (0,00084 ± 0,00005 menit-1) dan dosis 80
mg/kg bb terlihat nilai kel yang semakin kecil yaitu (0,00066 ± 0,000047 menit
-1
), sehingga obat tersebut akan lebih lama untuk di eliminasi oleh tubuh.
Penurunan nilai kel ini diperjelas dengan penurunan nilai CL secara bermakna
(P < 0,05) antara kontrol dengan ekstrak rimpang kencur.
Klirens adalah ukuran kemampuan tubuh untuk mengeliminasi obat
yang dipengaruhi oleh laju eliminasi dan kadar obat didalam plasma. Nilai CL
dapat dilihat pada Gambar 4.6.
Gambar 4.6 Penurunan nilai CL (Klirens) (ml/menit) terhadap rata-rata tiap perlakuan pada tikus putih jantan
Perlakuan ekstrak kencur dosis 20 mg/kg bb (0,0491 ± 0,0066
ml/menit), 40 mg/kg bb (0,0321 ± 0,0047 ml/menit) dan EERK dosis dosis 80
mg/kg bb (0,0209 ± 0,0045 ml/menit) berpengaruh secara bermakna terhadap
penurunan CL terhadap kontrol (0,0573 ± 0,0075 ml/menit). Eliminasi obat
meliputi proses metabolisme dan ekskresi, penurunan nilai klirens
menggambarkan penurunan laju eliminasi obat. Penurunan kedua parameter ini
menyebabkan proses metabolisme dan eksresi obat menjadi terhambat 0
sehingga obat bebas akan berada lebih lama didalam tubuh dan dalam jumlah
yang tinggi (Shargel dan Yu, 1998).
Volume distribusi adalah volume yang dibutuhkan untuk memuat
jumlah obat secara homogen pada konsentrasi yang ditemukan dalam darah
atau plasma. Vd dipengaruhi oleh tetapan laju eliminasi (Kel) dan klirens (CL).
Semakin kecil nilai Kel dan CL maka nilai Vd juga semakin kecil. Nilai Vd
dapat dilihat pada Gambar 4.7.
Gambar 4.7 Peningkatan nilai Vd (Volume distribusi) (ml) terhadap rata-rata tiap perlakuan pada tikus putih jantan
Nilai Vd menurun secara bermakna (p < 0,05) antara kontrol dan EERK
dosis 20 mg/kg bb, 40 mg/kg bb, dan 80 mg/kg bb. Hal ini menyebabkan
terjadi penurunan distribusi obat bebas ke jaringan karena obat terikat oleh
protein dalam jumlah yang besar atau tinggal dalam jaringan perifer sehingga
nilai Cmaks menjadi lebih tinggi (Shargel dan Yu, 1998). 0
10 20 30 40 50 60
V
d
(
ml
) kontrol
EERK dosis 20 mg/kg bb
EERK dosis 40 mg/kg bb
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. pemberian ekstrak rimpang kencur mempengaruhi profil
farmakokinetika natrium diklofenak yang ditandai dengan peningkatan
nilai Cmaks, AUC0-∞, MRT dan penurunan nilai Vd dan CL.
b. peningkatan nilai Cmaks pada perlakuan EERK menunjukkan
kemampuan ekstrak rimpang kencur terhadap pengaruh penghambatan
metabolisme sebagai enzim inhibisi.
c. dengan adanya kemampuan ekstrak rimpang kencur terhadap pengaruh
penghambatan metabolisme sebagai enzim inhibisi sehingga pemberian
ekstrak rimpang kencur dapat mengurangi efek samping dari narium
diklofenak.
5.2 Saran
disarankan kepada peneliti selanjutnya untuk menguji profil
farmakokinetik ekstrak rimpang kencur terhadap farmakokinetika obat
DAFTAR PUSTAKA
Aiache, J.M. (1993). Farmasetika 2-Biofarmasi. Edisi Kedua. Surabaya: Penerbit Airlangga University Press. Hal. 7-11, 39.
Altaher, A.Y. (2005). Pharmacokinetics Of Diclofenac In Sheep Following Intra Venous and Intramuscular Administration. Saudi Pharmaceutical Journal. 13(2-3): 107-108.
Anonim. (2007). Diklofenak. Maret
Armando, R. (2009). Memproduksi Minyak Atsiri Berkualitas. Jakarta: Penebar Swadaya. Hal. 51.
Depkes, RI. (2001). Inventaris Tanaman Obat Indonesia. Jilid II. Jakarta: Departemen Kesehatan dan Kesejahteraan Sosial RI.
Diharmi, A., Fardiaz, D., Andarwulan, N., dan Heruwati., S.E. (2011). Karakterisasi Karagenan Hasil Isolasi Euchema spinosum (Alga merah) dari Perairan Sumenep Madura. Jurnal perikanan dan kelautan, 16(1): 120.
Ditjen POM. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 300-304, 306.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departmen Kesehatan Republik Indonesia. Hal. 512.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Halaman 1-5, 10-11.
Farnsworth, N.R. (1966). Biological and Phytochemical Screenning of Plants.
Journal of Pharmaceutical Science. 55(3): 257.
Gholib, D. (2009). Daya Hambat Ekstrak Kencur (Kaempferia galanga L.)
terhadap Trichophyton mentagrophytes dan Cryptococcus neoformans
Jamur Penyebab Penyakit Kurap pada Kulit dan Penyakit Paru. Bul. Littro. 20(1): 59 – 67.
Harbone, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terjemahan Kosasih Padmawinata. Edisi II. Bandung: ITB Press. Hal. 147.