INDUKSI EMBRIOGENESIS SOMATIK
DAN SELEKSI
IN VITRO
EMPAT GENOTIPE KEDELAI
UNTUK TOLERANSI TERHADAP CEKAMAN ALUMINIUM
VINA NOVITA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Induksi Embriogenesis Somatik dan Seleksi In vitro Empat Genotipe Kedelai untuk Toleransi terhadap Cekaman Aluminium adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk karya apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
SUMMARY
VINA NOVITA. Induction of Somatic Embryogenesis and In Vitro Selection of Four Soybean Genotypes for Aluminum Tolerance. Supervised by NURUL KHUMAIDA and SINTHO WAHYUNING ARDIE.
Soybean (Glycine max (L.) Merr.) is an important source of protein for many Indonesian and the demand of soybean for food is increasing year by year. The increasing demand of soybean is not met by national production mainly due to decreasing harvest area. Therefore, expansion of soybean harvested area should be the main priority in the effort to increase soybean production. However, the targeted area should not be in competition with the other more profitable crops such as corn and rice. Dry acid soil, the main marginal lands in Indonesia, can be developed as an expansion of soybean planting areas because of the area reach 102.8 million hectares. Efficient crop improvement programs should be targeted to generate high yielding soybean varieties grown in acid soil. Currently, more than sixty varieties of soybean have been released by the Ministry of Agriculture, however, few are tolerant to acid soil. The constraint in developing soybean varieties for adaptation to adverse environmental condition is low genetic variability. Genetic variability can induced by conventional and non conventional plant breeding. In vitro selection is one strategy from non conventional plant breeding to produce plants that can be use as a source of variation in a breeding program. The use of somatic embryo for in vitro selection program is very valuable since the selected traits will be inherited in the progenies. Embryogenesis somatic was reported to be genotype specific for soybean. The general objective of this research was to obtain soybean promising lines tolerant to Al toxicity. Specifically, this study was aimed to obtain the optimum medium for induction and proliferation of somatic embryo, and to regenerate embryogenic callus of four soybean genotypes; and to obtain tolerant Al somaclones (putative). This study consisted of two experiments, which was induction of somaclonal variation of four soybean genotypes via somatic embryogenesis and in vitro selection of four soybean genotypes using AlCl3 to generate a putative somaclone acid soil tolerant.
differences, color and diameter in each type of media being used and the type of genotypes. The morphology of the formed callus can be classified into six groups. Callus can be induced at 6 weeks after treatment (WAT) on MS medium with the addition of 10 mg/l 2,4-D and 10 mg/l NAA in all soybean genotypes. Callus induced on medium with 5 mg/l NAA had callus morphology that tends to be green and then rooted. Callus induced on MS medium with the addition of 40 mg/l 2,4-D tends to had compact callus. In MS medium containing 40 mg/l 2,4-D, 54.5% of the Tanggamus genotype callus was embryogenic. Tanggamus genotypes was the only genotype that successfully formed somatic embryo (globular, torpedo and cotyledonary stages) after cultured for 4 weeks in medium containing 40 ppm 2,4-D and subcultured for another 4 weeks in the same media. The other genotype (Willis) formed only preembryonic mass (PEM) and failed to form somatic embryo after cultured in four different induction mediums. In order to increase the number of somatic embryo formed, several proliferation methods were tested for Tanggamus genotype. MS liquid medium supplemented with 10 mg/l 2,4-D resulted in the highest rate of proliferation (approximately 52 globular-stage embryos at 4 WAT). In the in vitro selection experiment, the fresh weight of callus on all genotypes without AlCl3 increased at 8 WAT. Fresh weight of callus
on medium containing AlCl3 (100-500 mg/l) increased up to 8 WAT, but began to
decline at 12 WAT. The total number of somaclone Al-tolerant candidates (putative) was 9 candidates, that were Wilis (3 candidates), Tanggamus (2 candidates), SP-10-4 (1 candidates), and CG-22-10 (3 candidates).
Keywords : Glycine max (L.) Merr., 2,4-D, AlCl3, somatic embryos, globular,
RINGKASAN
VINA NOVITA. Induksi Embriogenesis Somatik dan Seleksi In vitro Empat Genotipe Kedelai untuk Toleransi terhadap Cekaman Aluminium. Dibimbing oleh NURUL KHUMAIDA dan SINTHO WAHYUNING ARDIE.
Produksi kedelai pada tahun 2011 sebesar 851 ribu ton mengalami penurunan sebesar 56 ribu ton dibandingkan produksi tahun 2010. Kebutuhan kedelai di Indonesia setiap tahun mengalami peningkatan yaitu kebutuhan tahun 2011 sebesar 2.16 juta ton dan meningkat sebesar 2.2 juta ton pada tahun 2012. Produksi kedelai lokal hanya sebesar 851 ribu ton atau 29% dari total kebutuhan, sehingga Indonesia harus mengimpor kedelai sebanyak 2.09 juta ton untuk memenuhi 71% kebutuhan kedelai dalam negeri (BPS 2012). Rendahnya produksi kedelai nasional diperkirakan terjadi akibat dari penurunan luas panen. Program peningkatan produksi kedelai dapat dilakukan melalui program intensifikasi, yaitu perbaikan teknik budidaya dan perbaikan varietas. Keragaman plasma nutfah yang tinggi merupakan syarat utama dalam perbaikan varietas tanaman. Salah satu teknik untuk meningkatkan keragaman adalah melalui induksi variasi somaklonal, misalnya melalui embriogenesis somatik. Somaklon yang diperoleh dari embriogenesis somatik kemudian dapat diseleksi menggunakan agen seleksi melalui seleksi in vitro sehingga diperoleh somaklon dengan sifat yang diinginkan. Keberhasilan seleksi in vitro untuk mendapatkan tanaman kedelai dengan sifat yang diinginkan memerlukan, yaitu tersedianya keragaman di tingkat sel atau jaringan, metode seleksi in vitro untuk mengidentifikasi sel atau jaringan sesuai dengan sifat yang diinginkan, dan metode regenerasi sel jaringan menjadi tanaman secara in vitro yang efektif. Tujuan umum penelitian ini adalah untuk mendapatkan kandidat varietas yang toleran tanah masam. Secara khusus, penelitian ini bertujuan mendapatkan media induksi, proliferasi, dan serta meregenerasikan kalus embriogenik pada empat genotipe kedelai, dan mendapatkan somaklon kedelai yang putatif toleran cekaman Al. Pada penelitian ini dilakukan 2 percobaan, yaitu induksi variasi somaklonal empat genotipe kedelai melalui embriogenesis somatik dan seleksi in vitro empat genotipe kedelai menggunakan AlCl3 untuk menghasilkan somaklon yang putatif toleran cekaman
kalus embriogenik adalah kalus berhasil diinduksi hampir pada seluruh genotipe. Kalus yang terinduksi memiliki perbedaan morfologi, warna, dan diameter kalus pada masing-masing jenis media dan jenis genotipe yang digunakan. Berdasarkan pengamatan pada 6 minggu setelah tanam (MST), morfologi kalus dikelompokkan dalam enam kategori. Kalus dapat diinduksi pada media MS dengan penambahan 2,4-D 10 mg/l dan NAA 10 mg/l pada semua genotipe kedelai. Kalus yang terinduksi pada media dengan NAA 5 mg/l memiliki morfologi kalus yang cenderung berwarna hijau dan kemudian berakar. Kalus yang terinduksi pada media MS dengan penambahan 2,4-D 40 mg/l cenderung menginduksi kalus yang paling sedikit. Pada percobaan optimasi media induksi embrio somatik hanya berhasil menginduksi kalus embriogenik pada genotipe Tanggamus pada media MS dengan penambahan 2,4-D 40 mg/l sebesar 54.5%. Kalus embriogenik tidak berhasil diperoleh pada genotipe Wilis yang diinduksi pada media MS dengan penambahan 2,4-D 40 mg/l. Kalus embriogenik juga tidak berhasil diperoleh pada genotipe Wilis dan Tanggamus pada media MS dengan penambahan 2,4-D 10 mg/l dan NAA 10 mg/l. Pada media MS dengan penambahan pikloram 40 mg/l dan media MS dengan penambahan pikloram 20 mg/l juga tidak berhasil menginduksi kalus embriogenik baik pada genotipe Tanggamus maupun Wilis. Pada percobaan optimasi media proliferasi embrio somatik diperoleh media yang paling sesuai yaitu media MS cair ataupun padat dengan penambahan 2,4-D 10 mg/l pada genotipe Tanggamus. Media yang optimum untuk regenerasi embrio somatik kedelai belum diperoleh pada penelitian ini. Pada percobaan seleksi in vitro empat genotipe kedelai dengan AlCl3 untuk menghasilkan somaklon yang
putatif toleran cekaman tanah masam, diperoleh informasi bahwa bobot klum kalus embriogenik dengan pemberian AlCl3 100-500 mg/l hampir seluruhnya
mengalami peningkatan sampai dengan 8 MSP, akan tetapi mulai terjadi penurunan pada 12 MSP pada media seleksi in vitro. Jumlah total kandidat somaklon toleran cekaman Al (putatif) yang berhasil didapatkan adalah 9 kandidat yaitu Wilis (3), Tanggamus (2), SP-10-4 (1), dan CG-22-10 (3).
Kata kunci: Glycine max (L.) Merr., 2,4-D, AlCl3, embrio somatik, globular, tanah
©Hak Cipta Milik IPB, tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan sebagian besar pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
INDUKSI EMBRIOGENESIS SOMATIK
DAN SELEKSI
IN VITRO
EMPAT GENOTIPE KEDELAI
UNTUK TOLERANSI TERHADAP CEKAMAN ALUMINIUM
VINA NOVITA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Disetujui Komisi Pembimbing
Dr. Ir. Nurul Khumaida, M.Si Dr. Sintho Wahyuning Ardie, SP., M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr
Tanggal Ujian : 30 November 2012 Tanggal Lulus:
Judul Tesis : Induksi Embriogenesis Somatik dan Seleksi In vitro Empat Genotipe Kedelai untuk Toleransi terhadap Cekaman Aluminium
Nama : Vina Novita NRP : A 253090041
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis yang berjudul “Induksi Embriogenesis Somatik dan Seleksi In vitro Empat Genotipe Kedelai untuk Toleransi terhadap Cekaman Aluminium” dapat diselesaikan dengan baik. Ucapan terima kasih yang tak terhingga penulis sampaikan kepada Dr. Ir. Nurul Khumaida, M.Si dan Dr. Sintho Wahyuning Ardie, SP., M.Si selaku komisi pembimbing atas bimbingan dan arahannya selama perencanaan, pelaksanaan, dan penulisan tesis. Kemudian kepada Dr. Ir. Trikoesoemaningtyas, M.Sc. selaku ketua Program Studi Pemuliaan dan Bioteknologi Tanaman IPB. Ucapan terima kasih juga penulis sampaikan kepada Dr. Ir. Agus Purwito, M.Sc.Agr. selaku peguji luar komisi pada saat Ujian Tesis yang telah memberikan banyak saran. Seluruh staf pengajar dan semua teknisi yang telah memberikan bantuan selama penulis belajar di IPB. Tak lupa penulis sampaikan terima kasih kepada Dr. Ika Roostika dan Dr. Atra Romeida yang telah memberikan inspirasi dan motivasi. Ibu Siti Kholifah dan Ibu Juju Juariah di Laboratorium Kultur Jaringan I dan III, Bapak Yudiansyah, Bapak Joko Mulyono, dan Bapak Iwan di IPB atas bantuannya selama penelitian. Aminullah, STP. atas bantuan dan dukungan semangat selama penulis melaksanakan penelitian dan penulisan tesis. Kemudian kepada teman-teman S2 dan S3 PBT angkatan 2008, 2009, dan 2010 atas kebersamaannya. Dan terima kasih kepada I-MHERE B.2c IPB untuk dana penelitian. Kemudian yang tercinta kedua orang tua, dr. H. Achmad Rusli dan ibu Hj. Erna Tuti. Kakak dan adik tercinta, Yunita Syafitri, SE.Ak, dr. Ismail Bastomi, SpOT., dr. Rika Marlina, dr. Tedy Gazali, drg. Lukita Praninditya, dan keponakan tersayang Arib Fauzan Azli atas doa, restu, dan motivasi selama penulis menempuh pendidikan pasca sarjana di IPB. Semoga segala bentuk bantuan dari segala pihak mendapatkan berkah dan nilai ibadah sehingga tesis ini dapat berguna. Amin Ya Robbal alamin.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Palembang tanggal 28 November 1983 dari ayah dr. H. Achmad Rusli dan ibu Hj. Erna Tuti. Penulis merupakan anak ketiga dari empat bersaudara.
Jenjang pendidikan penulis berturut-turut adalah lulusan SMA Negeri 1 Palembang tahun 2002. Tahun 2006 penulis mendapat gelar sarjana (S1) di Program Studi Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Tahun 2009 penulis melanjutkan studi pada Sekolah Pascasarjana IPB untuk mengambil program magister dengan Program Studi Pemuliaan dan Bioteknologi Tanaman, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis menjadi asisten pratikum mata kuliah Kultur Jaringan Lanjut pada tahun ajaran 2011/2012. Biaya penelitian diperoleh dari program I-MHERE B.2c. Makalah presentasi poster yang berjudul “In Vitro Selection of Four Soybean Genotypes for Acid Soil Tolerance : Optimation of Somatic Embryo-Induction Medium” disampaikan pada Seminar
Internasional The 2nd SUIJI 3-4 Juli 2012 di IPB ICC Botani Square Bogor. Makalah presentasi oral yang berjudul “Induction of Somatic Embryogenesis and In Vitro Selection of Four Soybean Genotypes for Aluminum Tolerance”
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesis ... 3
Manfaat Penelitian ... 3
Ruang Lingkup Penelitian ... 5
TINJAUAN PUSTAKA ... 7
Produksi dan Kebutuhan Kedelai ... 7
Taksonomi, Morfologi dan Budidaya Kedelai ... 7
Pengaruh Cekaman Al dan Mekanisme Toleransi Al pada Tanaman 9 Pemanfaatan Variasi Somaklonal untuk Seleksi In Vitro ... 10
Embriogenesis Somatik Kedelai ... 12
Zat Pengatur Tumbuh ... 16
INDUKSI VARIASI SOMAKLONAL EMPAT GENOTIPE KEDELAI MELALUI EMBRIOGENESIS SOMATIK ... 17
Abstrak ... 17
Pendahuluan ... 18
Bahan dan Metode ... 19
Hasil dan Pembahasan ... 25
Simpulan ... 41
SELEKSI IN VITRO EMPAT GENOTIPE KEDELAI DENGAN AGEN SELEKSI AlCl3 UNTUK MENGHASILKAN SOMAKLON YANG PUTATIF TOLERAN CEKAMAN TANAH MASAM………... 43
Pendahuluan ... 44
Bahan dan Metode... 45
Hasil dan Pembahasan... 46
Simpulan ... 52
PEMBAHASAN UMUM ... 53
SIMPULAN DAN SARAN... 57
DAFTAR PUSTAKA ... 59
DAFTAR TABEL
Halaman
1. Data produksi, luas panen dan produktivitas kedelai nasional tahun
2001-2011 ... 7 2. Status penelitian embriogenesis somatik kedelai di mancanegara dan
di Indonesia ... 14 4. Komposisi media induksi kalus embriogenik ... 21 5. Pengaruh media terhadap morfologi kalus empat genotipe
kedelai... 26 6. Pengaruh media terhadap warna kalus empat genotipe kedelai…… 27 7. Pengaruh genotipe terhadap diameter kalus pada 6 MST………….. 28 8. Pengaruh media terhadap diameter kalus pada 6 MST……….. 29 9. Jumlah embrio somatik genotipe Tanggamus setelah di subkultur ke
media N4 (N4 (MS + sukrosa 30 g/l+ 2,4-D 10 mg/l + NAA 10 mg/l + glisin 2 mg/l + arginin 100 mg/l + glutamin 100 mg/l + vit B5)
pada 12 minggu setelah subkultur (MSS)... 31 10. Pengaruh komposisi media proliferasi terhadap pertambahan bobot
kalus pada 6 MSP... 34 11. Pengaruh genotipe terhadap pertambahan bobot kalus pada 6 MSP 34 12. Jumlah embrio somatik genotipe Tanggamus setelah di subkultur ke
yang sama dengan media asal pada 4 MSS... 38 13. Pertambahan jumlah embrio somatik genotipe Tanggamus pada 4
minggu setelah proliferasi (MSPr)... 39 14. Rataan persentase jumlah kalus yang mati akibat keracunan Al pada
15. Rataan persentase kalus yang mati akibat keracunan Al dan jumlah
DAFTAR GAMBAR
Halaman
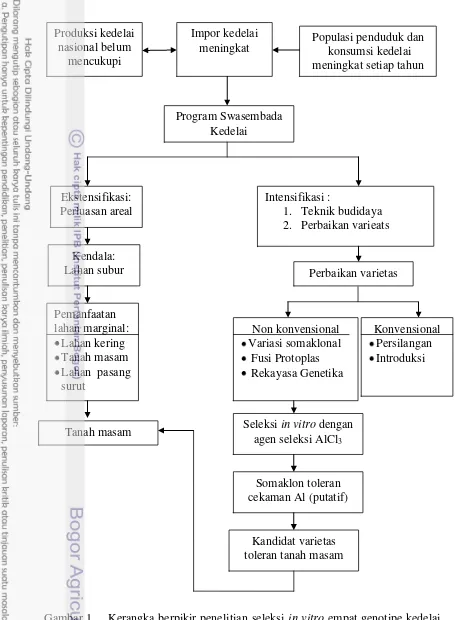
1. Kerangka berpikir penelitian seleksi in vitro empat genotipe kedelai dengan agen seleksi AlCl3 untuk menghasilkan somaklon yang
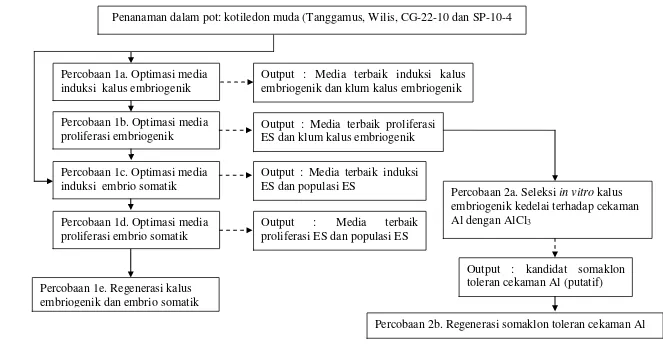
putatif toleran cekaman tanah masam. ... 4 2. Diagram alir kegiatan ... 6
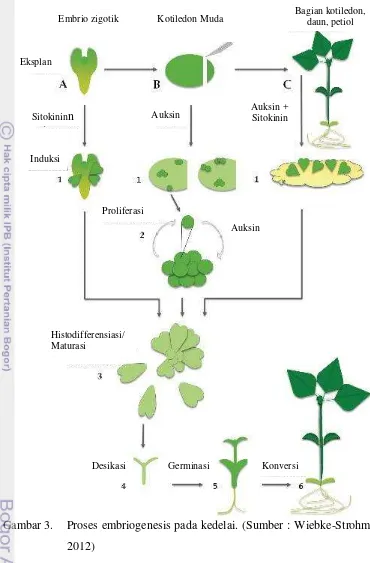
3. Proses embriogenesis pada kedelai ... 13 4. Sumber eksplan ... 20
5. Posisi eksplan pada media... 21 6. Berbagai keragaan respon eksplan kotiledon kedelai pada berbagai
media induksi kalus embriogenik ... 22 7. Skor warna kalus ... 23 8. Struktur PEM dari kalus kedelai dengan struktur struktur kompak,
berwarna putih kekuningan dan diameter yang besar ... 30 9. Pembentukan embrio somatik secara langsung pada genotipe
Tanggamus ... 32 10. Regenerasi kalus embriogenik kedelai ... 33 11. Keragaan kalus pada media proliferasi ... 34 12. Ciri-ciri kalus embriogenik dan tidak embriogenik genotipe
16. Proliferasi embrio somatik genotipe Tanggamus ... 39 17. Proliferasi embrio somatik genotipe Tanggamus ... 39 18. Kondisi embrio globular setelah di pindahkan ke berbagai media
regenerasi cair dan padat ... 41 19. Persentase kematian kalus ... 46 20. Kalus yang mati pada media seleksi AlCl3... 47
21. Bobot kalus selama 12 MSP ... 49 22. Kondisi embrio globular setelah dipindahkan ke media media seleksi
DAFTAR LAMPIRAN
Halaman
1. Keragaan tanaman kedelai varietas Wilis dalam pot ... 67 2. Komposisi Media Murashige and Skoog dan media Gamborg ... 68 3. Deskripsi kedelai varietas Tanggamus ... 69 4. Deskripsi kedelai varietas Wilis ... 70 5. Deskripsi kedelai genotipe CG-22-10 dan SP-10-4 ... 71
6.
Prosedur penyiapan preparat parafin untuk analisis histologi kalus1
PENDAHULUAN
Latar BelakangKedelai merupakan salah satu bahan pangan utama sumber protein bagi masyarakat Indonesia. Produksi nasional kedelai saat ini baru mampu memenuhi sekitar 40% dari kebutuhan dalam negeri. Produksi kedelai pada tahun 2011 sebesar 851 ribu ton mengalami penurunan sebesar 56 ribu ton dibandingkan produksi tahun 2010 (BPS 2012). Penurunan produksi diperkirakan terjadi akibat dari penurunan luas panen. Luas lahan produksi kedelai yang dibutuhkan untuk meningkatkan produksi mencapai 1.3 juta ha (Deptan 2012). Setiap tahun, pemerintah harus mengimpor kedelai untuk menutupi kekurangan produksi. Oleh karena itu, upaya peningkatan produksi kedelai perlu dipercepat. Upaya tersebut tersusun dalam program pemerintah melalui program swasembada kedelai.
Program peningkatan produksi kedelai dapat dilakukan melalui metode intensifikasi, yaitu perbaikan teknik budidaya dan perbaikan varietas, serta melalui program ekstensifikasi yaitu perluasan areal tanam termasuk ke daerah berlahan marginal. Lahan marginal di Indonesia sebagian besar berupa lahan kering masam dan memiliki potensi untuk dikembangkan sebagai perluasan areal tanam karena luasnya mencapai 102.8 juta ha di Indonesia (Mulyani et al. 2004). Namun demikian, masih ditemukan kendala pada tanah masam yaitu kemasaman tanah yang rendah, keracunan aluminium (Al) dan kekahatan hara seperti N, P, K, Ca, Mg dan Mo serta kurang aktifnya mikroba tanah. Kendala pada tanah masam tersebut dapat diatasi dengan perbaikan teknik budidaya dan penggunaan varietas kedelai yang toleran terhadap pH rendah dan keracunan Al.
Perbaikan teknik budidaya yang umum dilakukan adalah penambahan kapur pertanian misalnya kapur dolomit [CaMg(CO3)2]. Hasil penelitian
Kamprath (1970) menunjukkan bahwa untuk setiap 1.0 me Al-dd diperlukan 1.65 ton/ha CaCO3 ton/ha. Di samping itu, aplikasi pupuk pertanian pada tanah masam
2
pemupukan P, aplikasi kapur pertanian dan penambahan pemupukan P pada tanah masam tanpa penggunaan varietas toleran dianggap kurang efisien. Perbaikan varietas tanaman agar toleran terhadap cekaman tanah masam memerlukan keragaman plasma nutfah yang tinggi. Varietas kedelai nasional toleran tanah masam yang sudah dilepas oleh pemerintah adalah Tanggamus, Sibayak, Nanti, Ratai dan Seluah. Tim pemulia kedelai IPB memiliki beberapa galur harapan toleran naungan dengan produktivitas tinggi (F7) yaitu CG-22-10 dan SP-10-4 namun sampai saat ini belum diketahui tingkat toleransinya terhadap cekaman Al. Teknik perakitan varietas unggul dapat dilakukan secara konvensional yaitu melalui persilangan dari berbagai tetua yang memiliki sifat unggul yang diinginkan, dan secara non konvensional yang salah satunya melalui melalui induksi variasi somaklonal dan seleksi in vitro. Variasi somaklonal adalah keragaman yang muncul di antara tanaman hasil perbanyakaan secara kultur in vitro (Larkin & Scowcroft 1981). Embriogenesis somatik merupakan salah satu
teknik kultur in vitro yang memberikan peluang tinggi untuk mendapatkan keragaman di tingkat sel atau jaringan. Media induksi embriogenesis somatik pada kedelai dilaporkan memiliki sifat genotype specific. Variasi somaklonal yang diperoleh melalui embriogenesis somatik dapat digunakan sebagai materi seleksi in vitro dengan menggunakan media seleksi yang sesuai sehingga diperoleh
somaklon dengan sifat yang diinginkan. Peran seleksi in vitro dalam program pemuliaan tanaman adalah mempercepat waktu seleksi (Jain 2001). Menurut Wenzel dan Fouroughi-Wehr (1993), seleksi in vitro memiliki beberapa keuntungan yaitu tidak dipengaruhi lingkungan, dapat dilakukan seleksi pada tingkat sel, dan dapat dilakukan seleksi untuk satu faktor tunggal. Sehingga tanaman yang dihasilkan dari seleksi in vitro tetap mempertahankan sifat-sifat unggul sebelumnya dan menambah sifat unggul baru yang diinginkan seperti ketahanan terhadap cekaman tanah masam.
3
(Widoretno et al. 2003). Pengujian kalus embriogenik pada media seleksi Al pertama kali dilakukan oleh Meredith (1978) menggunakan AlCl3 dengan
konsentrasi 200 dan 400 mg/l. Pada konsentrasi tersebut diketahui pertumbuhan kalus terhambat sehingga dapat dilakukan untuk mendapatkan tanaman putatif toleran cekaman Al melalui seleksi in vitro. Seleksi in vitro terhadap toleransi cekaman Al telah dilakukan pada dua kultivar tomat (Sutjahjo et al. 2004) dan pada jagung (Sutjahjo 2006), dengan menggunakan agen seleksi AlCl3 pada
konsentrasi 0, 100, 200 dan 800 mg/l. Penelitian Mariska et al. (2004) menghasilkan beberapa galur harapan kedelai yang memiliki ketahanan yang lebih baik terhadap Al dan pH rendah dibandingkan varietas yang toleran dengan menggunakan agen seleksi AlCl3 pada konsentrasi 100 dan 500 mg/l dengan
menggunakan eksplan embrio somatik. Kerangka berpikir penelitian ini disajikan pada Gambar 1.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mendapatkan kandidat varietas yang toleran tanah masam. Secara khusus, penelitian ini bertujuan untuk :
1. Mendapatkan media induksi dan proliferasi kalus embriogenik, serta meregenerasikan kalus embriogenik pada empat genotipe kedelai
2. Mendapatkan somaklon kedelai yang putatif toleran cekaman Al
Hipotesis Penelitian
1. Terdapat media induksi, proliferasi dan regenerasi kalus embriogenik yang optimal pada masing-masing genotipe
2. Terdapat somaklon kedelai yang putatif toleran cekaman Al Manfaat Penelitian
1. Diperoleh informasi media induksi embriogenesis terbaik dalam menginduksi embrio somatik pada genotipe Tanggamus
2. Diperoleh informasi media proliferasi terbaik dalam memperbanyak embrio globular pada genotipe Tanggamus
4
Gambar 1. Kerangka berpikir penelitian seleksi in vitro empat genotipe kedelai dengan agen seleksi AlCl3 untuk menghasilkan somaklon toleran
cekaman Al.
Tanah masam Seleksi in vitro dengan agen seleksi AlCl3
Somaklon toleran cekaman Al (putatif)
5
Ruang Lingkup Penelitian
Program peningkatan produksi kedelai dapat dilakukan melalui program intensifikasi, yaitu perbaikan teknik budidaya dan perbaikan varietas. Keragaman plasma nutfah yang tinggi merupakan syarat utama dalam perbaikan varietas tanaman. Salah satu teknik untuk meningkatkan keragaman adalah melalui induksi variasi somaklonal, misalnya melalui embriogenesis somatik. Somaklon yang diperoleh dari embriogenesis somatik kemudian dapat diseleksi menggunakan agen seleksi tertentu melalui seleksi in vitro sehingga diperoleh somaklon dengan sifat yang diinginkan. Keberhasilan seleksi in vitro untuk mendapatkan tanaman kedelai dengan sifat yang diinginkan memerlukan tersedianya keragaman di tingkat sel atau jaringan, metode seleksi in vitro untuk mengidentifikasi sel atau jaringan sesuai dengan sifat yang diinginkan, dan metode regenerasi sel jaringan menjadi tanaman secara in vitro yang efektif.
Penelitian ini terdiri dari dua percobaan yaitu peningkatan variasi somaklonal empat genotipe kedelai melalui embriogenesis somatik dan seleksi in vitro empat genotipe kedelai menggunakan AlCl3 untuk menghasilkan somaklon
yang putatif toleran cekaman Al. Percobaan pertama dilakukan untuk mendapatkan media induksi, proliferasi kalus embriogenik dan embrio somatik, serta meregenerasikan kalus embriogenik dan embrio somatik pada empat genotipe kedelai. Hasil penelitian pada percobaan pertama dijadikan sebagai sumber bahan eksplan yaitu berupa klum kalus embriogenik yang kemudian diseleksi pada percobaan kedua. Pada percobaan kedua yaitu seleksi in vitro empat genotipe kedelai menggunakan AlCl3 untuk menghasilkan somaklon yang
6
Gambar 2. Diagram alir kegiatan penelitian induksi embriogenesis somatik dan seleksi in vitro empat genotipe kedelai untuk toleransi terhadap cekaman Aluminium
Penanaman dalam pot: kotiledon muda (Tanggamus, Wilis, CG-22-10 dan SP-10-4
Percobaan 1a. Optimasi media induksi kalus embriogenik
Output : Media terbaik induksi kalus embriogenik dan klum kalus embriogenik
Percobaan 1b. Optimasi media proliferasi embriogenik
Percobaan 1c. Optimasi media induksi embrio somatik
Percobaan 1d. Optimasi media proliferasi embrio somatik
Percobaan 1e. Regenerasi kalus embriogenik dan embrio somatik
Output : Media terbaik proliferasi ES dan klum kalus embriogenik
Output : Media terbaik induksi ES dan populasi ES
Output : Media terbaik proliferasi ES dan populasi ES
Percobaan 2a. Seleksi in vitro kalus embriogenik kedelai terhadap cekaman Al dengan AlCl3
Output : kandidat somaklon toleran cekaman Al (putatif)
Percobaan 2b. Regenerasi somaklon toleran cekaman Al
TINJAUAN PUSTAKA
Produksi dan Kebutuhan Kedelai
Produksi kedelai nasional pada tahun 2011 sebesar 851 ribu ton mengalami penurunan sebesar 56 ribu ton dibandingkan produksi tahun 2010 (BPS 2012). Penurunan produksi diperkirakan terjadi akibat dari penurunan luas panen (Tabel 1). Sebaliknya, kebutuhan kedelai di Indonesia setiap tahun mengalami peningkatan, misalnya kebutuhan pada tahun 2011 adalah sebesar 2.16 juta ton, kemudian kebutuhan pada tahun 2012 meningkat menjadi sebesar 2.2 juta ton kedelai. Produksi kedelai nasional hanya sebesar 851 ribu ton atau 29% dari total kebutuhan, sehingga Indonesia harus mengimpor kedelai sebanyak 2.09 juta ton untuk memenuhi 71% kebutuhan kedelai dalam negeri (BPS 2012). Tabel 1. Produksi, luas panen dan rataan produktivitas kedelai nasional tahun
8
Kedelai merupakan tanaman menyerbuk sendiri, yakni pada kepala putik diserbuki oleh tepung sari dari bunga yang sama. Bunga kedelai biasanya membuka pada pagi hari pada kondisi suhu relatif rendah dengan kelembaban yang cukup. Biasanya bunga kedelai telah terserbuki sebelum bunga membuka. Kemungkinan untuk terjadi penyerbukan silang sangat kecil yaitu kurang dari 1%. Keadaan ini mengakibatkan kedelai menjadi homozigot dan kemurnian varietas dapat dipertahankan selama beberapa generasi, sehingga biji-biji dalam satu polong adalah identik (Poelhman 1996).
Pertumbuhan batang kedelai dibedakan menjadi dua tipe, yaitu tipe determinate dan indeterminate. Perbedaan sistem pertumbuhan batang ini didasarkan atas keberadaan bunga pada pucuk batang. Pertumbuhan batang tipe determinate ditunjukkan dengan batang yang tidak tumbuh lagi pada saat tanaman mulai berbunga. Sementara pertumbuhan batang tipe indeterminate dicirikan bila pucuk batang tanaman masih bisa tumbuh daun, walaupun tanaman sudah mulai berbunga. Kedelai diklasifikasikan sebagai tanaman hari pendek dikarenakan hari yang pendek akan menginisisasi pembungaan, karena lama periode gelap merupakan faktor yang menentukan dalam pembungaan. Penelitian menunjukkan bahwa dalam satu menit periode gelap dapat menghambat perkembangan bunga. Suhu hangat dapat mempercepat pembungaan dan pemasakan kedelai dan sebaliknya, suhu dingin akan menghambat dua proses tersebut (Adie & Krisnawati 2007).
9 Pengaruh Cekaman Al dan Mekanisme Toleransi Al pada Tanaman
Lahan marginal di Indonesia sebagian besar berupa tanah kering masam dan memiliki potensi untuk dikembangkan sebagai perluasan areal tanam karena luasnya mencapai 102.8 juta ha di Indonesia dan tersebar di wilayah Sumatra, Kalimantan, dan Papua. Luas tanah kering masam yang sesuai untuk usaha pertanian sekitar 55.8 juta ha (Mulyani et al. 2004). Tanah masam memiliki pH tanah ≤ 5.5 (Kochian et al. 2005). Saat pH tanah berada dibawah 5 maka aluminium (Al) dalam bentuk Al3+ akan meracuni perakaran tanaman. Sementara itu Sanchez (1992) menyatakan bahwa pertumbuhan tanaman yang buruk pada tanah masam berkaitan dengan kejenuhan Al yang tinggi. Tanah masam dapat mengubah populasi dan aktivitas jasad mikro yang berperan pada transformasi N, S dan P dalam tanah, sehingga secara tidak langsung akan mempengaruhi ketersediaan unsur-unsur tersebut bagi tanaman.Tanah masam akan meningkatkan ketersediaan unsur-unsur Mn dan Al (Kennedy 1992). Unsur-unsur ini merupakan racun bagi tanaman. Keberadaan Mn dan Al ada pada saat pH tanah rendah.
Gejala keracunan Al sangat cepat (dimulai pada hitungan menit) akan menyebabkan kerusakan pada akar dan penyerapan air dan nutrisi akan terhambat. Respon yang sangat cepat mengindikasikan bahwa Al pertama kali akan menghambat perkembangan dan sel pada akar serta perpanjangan akar. Daerah keracunan Al terlokalisasi pada ujung akar (Ryan et al. 1997). Karena Al sangat reaktif maka banyak daerah yang menjadi target keracunan yaitu dinding sel, permukaan plasma membran, sitoskleton dan nukleus. Aluminium tidak hanya mempengaruhi dinding sel tetapi juga mengakibatkan kerusakan struktur membran plasma akar. Interaksi Al dengan senyawa lipid dan protein membran dapat memicu peroksidasi lipid sehingga sel kehilangan integritas membran plasma (Yamamoto et al. 2003). Dampak dari Al yaitu akan menginduksi reactive oxygen species (ROS) dan juga rusaknya membran oleh peroxidative (Horst et al.
1992).
10
eksternal merupakan mekanisme eksklusi Al (mencegah Al agar tidak melintasi membran plasma masuk ke simplas), yaitu selektivitas membran plasma terhadap pengambilan Al, meningkatkan pH dalam rizosfir atau apoplas akar, eksudasi senyawa organik pengkelat Al, dan immobilisasi Al pada dinding sel. Mekanisme internal merupakan mekanisme yang menyebabkan tanaman memiliki daya toleransi untuk mengakumulasi Al dalam sel (tanaman membiarkan Al masuk ke dalam simplas dan tidak memperlihatkan gejala keracunan). Mekanisme internal yaitu kompartementasi (pengurungan) Al di vakuola, sintesis protein pengikat Al yang akan menurunkan serapan Al, dan kelatisasi oleh asam organik (asam malat, oksalat, fenolat, fulfat dan tartat) di sitosol (Kochian et al. 2005). Mekanisme internal umumnya dimiliki oleh spesies tanaman pengakumulasi Al seperti tanaman teh (Camelia sinensis L.) dan melastoma (Melastoma sp).
Kedelai tumbuh baik pada tanah yang sedikit masam sampai mendekati netral, pada pH 5.5-7.0 dan pH optimal 6.0-6.5. Pada kisaran pH tersebut hara makro dan mikro tersedia bagi tanaman kedelai. Pada tanah yang bereaksi masam (pH < 5.5), hara fosfor (P), kalsium (Ca), magnesium (Mg), kalium (K), dan sulfur (S) tidak mudah tersedia bagi tanaman kedelai (Khan et al. 2001). Pada tanah masam, unsur Mn, Al, dan Fe tersedia secara berlebihan, sehingga dapat bersifat racun bagi tanaman. Pada tanah masam yang mengandung Al tinggi yaitu lebih dari 20% akan menyebabkan terjadinya keracunan pada akar kedelai, sehingga akar tidak berkembang (pendek dan tebal), tanaman tumbuh kerdil, daun berwarna kuning kecoklatan, dan tidak mampu membentuk polong (Sumarno & Manshuri 2007).
Pemanfaatan Variasi Somaklonal untuk Seleksi In Vitro
Variasi somaklonal adalah keragaman genetik yang berasal dari kultur in vitro (Larkin & Scowcroft 1981). Keragaman genetik merupakan faktor yang
11 perubahan struktur kromosom (pindah silang), perubahan gen dan sitoplasma (Bairu et al. 2011). Menurut Evans dan Sharp (1986) perubahan genetik yang terjadi dalam kultur in vitro meliputi mutasi gen pada genom nukleus dan sitoplasma, translokasi, delesi, inversi, transposabel elemen dan amplifikasi gen.
Beberapa faktor yang mempengaruhi munculnya variasi somaklonal yaitu sumber eksplan yang digunakan, lamanya sel atau jaringan tanaman yang dikulturkan secara in vitro, tipe regenerasi yang digunakan, genotipe tanaman donor, konsentrasi dan tipe zat pengatur tumbuh yang digunakan. Pada tanaman kedelai telah dilaporkan terjadi variasi somaklonal yang diregenerasikan melalui proses embriogenesis dan organogenesis. Penggunaan auksin 2,4-D dengan konsentrasi yang tinggi juga telah dilaporkan dapat menginduksi variasi somaklonal. Berbagai karakter dapat berubah akibat variasi somaklonal, akan tetapi karakteristik yang lain dilaporkan tetap menyerupai tanaman induknya (Gesteira et al. 2002).
Seleksi in vitro adalah teknik yang sangat berguna untuk menghasilkan somaklon yang mempunyai karakteristik tertentu. Dengan teknik ini, variasi somaklonal akan dapat diinduksi dan hasilnya dapat diseleksi dalam media selektif yang sesuai. Dengan menggunakan seleksi in vitro, intensitas seleksi yang lebih besar dan lebih homogen dapat diberikan ke populasi sel dan jaringan tanaman sehingga dapat meningkatkan efisiensi didapatkannya varian tanaman yang diinginkan (Widholm 1996). Husni et al. (2006) menunjukkan bahwa metode seleksi in vitro dapat meningkatkan toleransi kedelai terhadap kekeringan yang ditunjukkan oleh kandungan prolin dari somaklon lebih tinggi daripada tanaman asalnya. Masalah yang sering dihadapi dalam seleksi in vitro adalah sulitnya induksi kalus dan teknik regenerasi dari sel yang tahan terhadap komponen seleksi menjadi planlet. Dengan demikian, induksi kalus serta teknik regenerasi perlu dikuasai terlebih dahulu.
12
et al. 2004). Seleksi in vitro lebih efisien karena melalui seleksi in vitro jutaan sel
dapat diseleksi dengan hanya menggunakan beberapa botol kultur, sedangkan seleksi di lapang harus menggunakan beratus-ratus tanaman yang diuji pada areal yang lebih luas, selain itu seleksi in vitro tidak terlalu dipengaruhi oleh lingkungan serta memungkinkan melakukan seleksi pada tingkat sel (Biswas et al. 2002).
Embriogenesis Somatik Kedelai
13
Gambar 3. Proses embriogenesis pada kedelai. (Sumber : Wiebke-Strohm et al. 2012)
Eksplan yang digunakan dapat berasal dari embrio zigotik, kotiledon muda, dan bagian dari jaringan tanaman yaitu kotiledon, buku batang, daun (Lazzeri 1985). Embriogenesis somatik pada kedelai dilaporkan pertama kali oleh Christianson et al. (1983). Beberapa penelitian menunjukkan bahwa embrio somatik dapat diperoleh secara langsung atau tidak langsung (melalui kalus)
Eksplan
Auksin Eksplan Sitokininn
Eksplan
Auksin Ekspl Proliferasi
Induksi
Auksin + Sitokinin
Histodifferensiasi/ Maturasi
Desikasi Germinasi Konversi
14
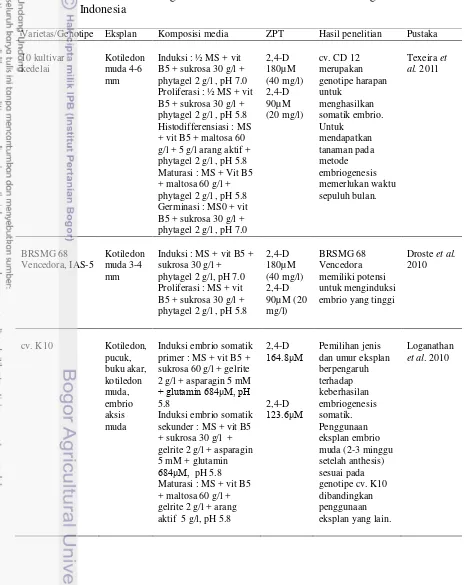
(Ranch et al. 1985; Barwale et al. 1986). Keberhasilan dalam somatik embriogenesis sangat dipengaruhi oleh berbagai macam faktor yaitu genotipe, jenis dan umur eksplan dan konsentrasi ZPT (Jimènez 2005). Penelitian mengenai embriogenesis somatik kedelai telah dilakukan oleh para peneliti baik di Indonesia dan di manca negara yang ditunjukkan pada Tabel 2.
Tabel 2. Penelitian embriogenesis somatik kedelai di manca negara dan di Indonesia
Varietas/Genotipe Eksplan Komposisi media ZPT Hasil penelitian Pustaka
15 Varietas/
Genotipe
Eksplan Komposisi media ZPT Hasil penelitian Pustaka
16
Zat Pengatur Tumbuh
Beberapa faktor penting yang mempengaruhi induksi kalus dan regenerasi tanaman yaitu pemilihan jenis eksplan, genotipe dan suplemen media yang digunakan mencakup tipe dan kuantitas zat pengatur tumbuh. Zat pengatur tumbuh adalah senyawa organik bukan hara yang dalam jumlah sedikit dapat mempengaruhi proses-proses fisiologi dari pertumbuhan dan perkembangan tanaman. Dalam perbanyakan in vitro, auksin berperan dalam merangsang pembentukan kalus, pemanjangan sel, pembesaran jaringan dan pembentukan akar. Pengaruh sitokinin dalam perbanyakan in vitro adalah merangsang pembelahan sel dan multiplikasi tunas (George & Sherrington, 1984). Dari berbagai hasil penelitian menunjukkan bahwa 2.4-D merupakan auksin yang efektif untuk induksi kalus embriogenik pada kedelai (Texeira et al. 2011, Droste et al. 2010, Loganathan et al. 2010). Tahap proliferasi pada embrio somatik yang
berasal dari eksplan kotiledon muda membutuhkan ZPT jenis auksin.
Perbandingan konsentrasi auksin dan sitokinin perlu diperhatikan karena adanya sifat antagonis dari sitokinin terhadap auksin dalam inisiasi dan perbanyakan akar. Tunas akan terbentuk apabila media mengandung sitokinin yang tinggi dan auksin yang rendah, sedangkan akar terbentuk apabila perbandingan zat-zat tersebut didalam media adalah sebaliknya. Morfogenesis eksplan tergantung kepada keseimbangan auksin dan sitokinin di dalam media dan interaksi antara zat pengatur tumbuh endogen pada tanaman serta zat pengatur tumbuh eksogen yang diserap dari media tumbuh (Wattimena 1992).
17
INDUKSI VARIASI SOMAKLONAL
EMPAT GENOTIPE KEDELAI MELALUI
EMBRIOGENESIS SOMATIK
Abstrak
Keragaman genetik yang tinggi pada kedelai (Glycine max (L.) Merr.) sangat penting untuk program pemuliaan tanaman. Seleksi in vitro merupakan salah satu strategi untuk meningkatkan variasi somaklonal. Penggunaan embrio somatik dalam program seleksi in vitro sangat penting karena somaklon yang dihasilkan diharapkan dapat diregenerasikan. Embriogenesis somatik pada kedelai dilaporkan sangat dipengaruhi oleh genotipe (genotype specific). Penelitian ini bertujuan untuk mendapatkan media induksi dan proliferasi kalus embriogenik pada empat genotipe kedelai, serta meregenerasikan kalus embriogenik. Pada percobaan awal, kalus embriogenik terinduksi pada media MS dengan penambahan 2,4-D 10 mg/l dan NAA 10 mg/l. Pengamatan histologi menunjukkan bahwa struktur PEM ditemukan pada kalus dengan ciri-ciri warna kekuningan dan struktur kompak. Struktur kalus tersebut ditemukan dari kalus yang diinduksi pada media MS dengan penambahan 2,4-D 10 mg/l dan NAA 10 mg/l. Kalus kemudian diproliferasi pada media MS dengan penambahan 2,4-D 5 mg/l dan NAA 5 mg/l. Induksi embrio somatik dilakukan pada genotipe Wilis dan Tanggamus. Embrio somatik genotipe Tanggamus diinduksi setelah 4 minggu dalam medium induksi (media MS dengan penambahan 40 mg/l 2,4-D) dan kemudian sub-kultur selama 4 minggu di media yang sama. Beberapa metode proliferasi diuji untuk meningkatkan jumlah embrio somatik. Media proliferasi cair MS dengan penambahan 2,4-D 10 mg/l menghasilkan pertambahan jumlah embrio somatik paling banyak yaitu sekitar 52 embrio tahap globular pada 4 minggu setelah kultur.
Kata kunci : Glycine max (L.) Merr., 2,4-D, AlCl3, globular, embrio somatik
Abstract
18
Tanggamus genotypes. Somatic embryo of Tanggamus genotype was induced after 4 weeks in the induction medium (MS medium supplemented with 40 mg/l 2,4-D) and then subcultured for another 4 weeks in the same media. In order to increase the number of somatic embryo formed, several proliferation methods were tested. MS liquid medium supplemented with 10 mg/l 2,4-D resulted in the highest rate of proliferation (approximately 52 globular-stage embryos at 4 weeks after culture).
Keywords : Glycine max (L.) Merr., 2,4-D, AlCl3, globular, somatic embryo
Pendahuluan
Variasi somaklonal adalah variasi yang muncul dalam populasi tanaman hasil regenerasi in vitro (Larkin & Scowcroft 1981). Variasi somaklonal pada tanaman yang dihasilkan dari kultur in vitro dapat digunakan untuk mendapatkan sumber keragaman genetik baru dalam upaya perbaikan sifat tanaman yang diinginkan serta untuk menghasilkan kultivar baru (Jain 2001). Embriogenesis somatik merupakan salah satu teknik kultur in vitro yang memberikan peluang tinggi untuk mendapatkan variasi di tingkat sel atau jaringan. Penelitian embriogenesis kedelai sebelumnya melaporkan bahwa penggunaan ZPT 2,4-D pada konsentrasi yang tinggi dapat menyebabkan variasi somaklonal (Gesteira et al. 2002). Variasi somaklonal yang diperoleh melalui embriogenesis somatik
19 Bahan dan Metode
Waktu dan Tempat
Penelitian dilaksanakan mulai bulan Januari 2011 sampai dengan Agustus 2012. Kegiatan penelitian dilaksanakan di Laboratorium Kultur Jaringan dan Laboratorium Mikroteknik, Departemen Agronomi dan Hortikultura, Fakultas Pertanian. Analisis histologi jaringan dilakukan di Laboratorium Histologi, Fakultas Kedokteran Hewan, IPB.
Bahan dan Alat
Bahan tanaman yang digunakan pada penelitian ini adalah empat genotipe kedelai yaitu dua varietas nasional (Tanggamus dan Willis), serta dua nomor hasil silangan (F7) yaitu CG-22-10, dan SP-10-4 yang didapatkan dari koleksi Laboratorium Penelitian Pemuliaan Tanaman IPB (Lampiran 1). Bahan kimia yang diperlukan adalah formula media MS Murashige dan Skoog (1962) (Lampiran 2), dan media seleksi yang mengandung AlCl3. Zat pengatur tumbuh
yang digunakan adalah NAA, 2,4-D, pikloram dan BAP. Asam amino yang di gunakan adalah asparagin dan gl utamin. Sukrosa digunakan sebagai sumber karbon dan gelrite digunakan sebagai bahan pemadat. Bahan sterilisasi yang digunakan adalah alkohol 70% dan air steril. Alat yang akan digunakan sebagian besar berupa alat gelas standar seperti botol kultur, erlenmeyer, petridis, pipet, labu ukur, corong, saringan, timbangan analiti k, autoklaf, pH met er, oven, alat diseksi (pisau, pinset dan gunting), laminar air flow cabinet (LAFC), lampu spritus dan rak kultur. Mikroskop digunakan untuk analisis sel dan jaringan.
Metode Percobaan
20
1 mm 5 mm
1.a. Optimasi media induksi kalus embriogenik
Tujuan dari percobaan ini adalah untuk mendapatkan komposisi media induksi kalus embriogenik terbaik pada masing-masing genotipe kedelai. Keragaan tanaman kedelai di lapang dan benih kedelai dapat dilihat pada Gambar Lampiran 1. Sumber eksplan berasal dari polong muda (immature pod) yang berumur 14 hari setelah bunga mekar (Gambar 4A). Eksplan berupa polong muda (Gambar 4B) dengan kotiledon berukuran 4-7 mm disterilisasi dengan alkohol 70% selama 3 menit lalu dibilas sebanyak 3 kali menggunakan akuades steril. Kotiledon muda tanpa aksis embrio ditanam dengan posisi abaksial yaitu bagian kotiledon yang cembung menyentuh media tanam (Gambar 5).
Gambar 4. Sumber eksplan. A) Bunga mekar, B) Polong muda, C) kotiledon muda berukuran 4-7 mm, D) Kotiledon muda pada media.
Percobaan disusun berdasarkan rancangan acak lengkap (RAL) dengan dua faktor. Faktor pertama adalah genotipe kedelai (Tanggamus, Wilis, CG-22-10 dan SP-10-4 yang didapatkan dari koleksi Laboratorium Penelitian Pemuliaan Tanaman, IPB). Faktor kedua adalah komposisi media induksi kalus embriogenik yang terdiri atas 8 taraf media dasar MS + gelrite 2 g/l + vit B5 (Tabel 4).
A a
B a
C a
21
Gambar 5. Posisi eksplan pada media. Sumber: Thibaud-Nissen et al. (2003) Tabel 4. Komposisi media induksi kalus embriogenik
Kode
Media Komposisi Media
N1 Suk 60 g/l + 2,4-D 40 mg/l + Gly 2 mg/l + Arg 100 mg/l + Glu 100 mg/l + vit B5
N2 Suk 30 g/l + 2,4-D 40 mg/l + Gly 2 mg/l + Arg 100 mg/l + Glu 100 mg/l + vit B5
N3 Suk 30 g/l + 2,4-D 10 mg/l + NAA 10 mg/l + vit B5
N4 Suk 30 g/l + 2,4-D 10 mg/l + NAA 10 mg/l + Gly 2 mg/l + Arg 100 mg/l + Glu
100 mg/l + vit B5
N5 Suk 30 g/l + 2,4-D 40 mg/l + vit B5
N6 Suk 30 g/l + NAA 5 mg/l + vit B5 + CaP 2 mg/l
N7 Suk 30 g/l + NAA 5 mg/l + vit B5
N8 Suk 30 g/l + NAA 5 mg/l + Gly 2 mg/l + Arg 100 mg/l + Glu 100 mg/l + vit B5
Keterangan: Suk=sukrosa, Gly=glisin, Arg=arginin, Glu=glutamin
Media N1 adalah komposisi media dengan gula 60 g/l (Ito et al. 1999) yang berhasil menginduksi embrio somatik pada kedelai genotipe Bromo (Mariska et al. 2004). Media N2 adalah komposisi media modifikasi dari media N1 dengan mengurangi penggunaan sukrosa menjadi 30 g/l. Media N3 adalah komposisi media yang berhasil menginduksi ES pada beberapa genotipe yaitu B3731, MLG2999, MLG3072, Tambora, dan Kipas Putih (Widoretno et al. 2003). Media N4 adalah komposisi media modifikasi dari media N3 dengan menambahkan beberapa asam amino yaitu arginin 100 mg/l + glutamin 100 mg/l + glisin 2 mg/l. Media N5 adalah komposisi media yang dapat menginduksi embrio somatik pada genotipe Jack (Yang et al. 2009; Schimdt et al. 2005; Ko et al. 2003; Moon & Hildebrand 2003; Tomlin et al. 2002) dan Wilis (Mariska et al.
2004). Media N6 adalah komposisi media modifikasi dari media N5 dengan menambahkan CaP. Media N7 adalah komposisi media yang berhasil menginduksi embrio somatik pada genotipe CG-70-10 (Riyadi 2009). Media N8
Kotiledon muda
Media
Adaksial
22
adalah media modifikasi dari media N7 dengan menambahkan beberapa asam amino yaitu + glisin 2 mg/l + arginin 100 mg/l + glutamin 100 mg/l.
Tanggamus dan Wilis adalah varietas nasional yang memiliki sifat toleran terhadap tanah masam (Lampiran 3 & Lampiran 4). Genotipe CG-22-10 adalah generasi F7 hasil persilangan Ceneng dan Godek, dan genotipe SP-10-4 adalah generasi F7 hasil persilangan Sibayak dan Pangrango (Lampiran 5). Genotipe CG-22-10 dan SP-10-4 memiliki sifat toleran terhadap naungan dan diduga memiliki sifat high yielding sehingga berpotensi untuk dikembangkan ke arah ketahanan terhadap tanah masam (Lampiran 5). Percobaan ini terdiri atas 10 ulangan dengan satu botol kultur berisi dua kotiledon sebagai satuan percobaan.
Skoring morfologi kalus dilakukan berdasarkan respon eksplan terhadap media induksi kalus embriogenik (Gambar 6).
Gambar 6. Berbagai keragaan respon eksplan kotiledon kedelai pada berbagai media induksi kalus embriogenik. Terdiri atas skor morfologi : (1= kalus yang terbentuk sedikit; 2=eksplan langsung berakar; 3=eksplan membentuk kalus kemudian kalus tersebut membentuk akar; 4=eksplan berkalus; 5=eksplan langsung berakar dan bertunas; 6=eksplan bertunas). (Bar = 0.5 mm)
Aba 2
a
3
a 1
a
4
a
5
a
6
23 Pengamatan terhadap morfologi, warna dan diameter kalus serta pengamatan histologi dilakukan pada 6 MST. Skoring warna kalus dibagi menjadi 6 yaitu; skor 0 (warna tidak diamati karena kalus yang terbentuk sedikit atau tidak ada), skor 1 (hijau), skor 2 (hijau muda), skor 3 (kekuningan), skor 4 (putih), skor 5 (coklat) (Gambar 7).
Gambar 7. Skor warna kalus. Skor 0 = warna tidak diamati karena kalus yang terbentuk sedikit atau tidak ada, skor 1 = hijau, skor 2 = hijau muda, skor 3 = kekuningan, skor 4 = putih, skor 5 = coklat. (Sumber : Riyadi 2009).
1.b. Optimasi media proliferasi kalus embriogenik
Tujuan dari percobaan ini adalah untuk mendapatkan komposisi media proliferasi kalus embriogenik terbaik pada masing-masing genotipe kedelai. Eksplan yang digunakan adalah kalus embriogenik kedelai hasil percobaan 1a. Percobaan disusun berdasarkan rancangan acak lengkap (RAL) dengan dua faktor. Faktor pertama adalah genotipe kedelai (Tanggamus, Wilis, CG-22-10 dan SP-10-4). Faktor kedua adalah komposisi media proliferasi kalus embriogenik yang terdiri atas 3 taraf (P1 = 2,4-D 5 mg/l + NAA 5 mg/l; P2 = 2,4-D 10 mg/l + NAA 10 mg/l; P3 = 2,4-D 20 mg/l) dengan media dasar MS + gelrite 2 g/l + sukrosa 30 g/l + glisin 2 mg/l + arginin 100 mg/l + glutamin 100 mg/l + vit B5. Setiap satuan percobaan diulang 10 kali dengan 2 klum kalus per botol kultur. Kultur dipelihara di ruang kultur dengan suhu 24 ± 3ºC, tingkat penyinaran 1500 lux dan fotoperiode 24 jam. Pengamatan dilakukan pada 6 Minggu Setelah Perlakuan (MSP), yaitu menghitung pertambahan bobot basah kalus.
1.c. Optimasi media induksi embrio somatik
24
disusun berdasarkan rancangan acak lengkap (RAL) dengan dua faktor. Faktor pertama adalah genotipe kedelai (Tanggamus dan Wilis). Faktor kedua adalah komposisi media induksi embrio somatik yang terdiri atas atas 4 taraf yaitu (N3 = 2,4-D 10 mg/l + NAA 10 mg/l; N5 = 2,4-D 40 mg/l; N9 = pikloram 40 mg/l; N10 = pikloram 20 mg/l) dengan media dasar MS + gelrite 2 g/l + sukrosa 30 g/l + vit B5. Percobaan ini terdiri atas 15 ulangan dengan satu botol kultur berisi dua kotiledon sebagai satuan percobaan.
Pengamatan dilakukan terhadap :
1. Jumlah kalus embriogenik pada 4 minggu setelah tanam (MST) 2. Jumlah embrio somatik pada 4 minggu setelah subkultur (MSS)
3. Pengamatan histologi dengan menggunakan metode paraffin (Lampiran 6) dilakukan pada embrio somatik fase globular, jantung dan torpedo.
1.d. Optimasi media proliferasi embrio somatik
Tujuan dari percobaan ini adalah untuk mendapatkan komposisi media proliferasi embrio somatik terbaik pada genotipe Tanggamus. Eksplan yang digunakan adalah embrio somatik kedelai hasil Percobaan 1c. Percobaan ini disusun berdasarkan RAL yaitu faktor komposisi media proliferasi embrio somatik yang terdiri atas 4 taraf yaitu (MP5 = gelrite 2 g/l + 2,4-D 20 mg/l; MP6 = gelrite 2 g/l + 2,4-D 10 mg/l; MC5 = 2,4-D 20 mg/l; MC6 = 2,4-D 10 mg/l) dengan media dasar MS + sukrosa 30 g/l + vit B5. Percobaan ini terdiri atas 3 ulangan dengan satu botol kultur berisi satu klum kalus yang terdapat satu embrio fase globular sebagai satuan percobaan. Pengamatan dilakukan terhadap pertambahan jumlah embrio somatik pada 4 MSP.
1.e. Regenerasi embrio somatik
25 dasar MS + sukrosa 30 g/l + vit B5. Percobaan ini terdiri atas 3 ulangan dengan satu botol kultur berisi satu klum kalus yang terdapat satu embrio fase globular sebagai satuan percobaan. Pengamatan dilakukan terhadap perkembangan embrio globular.
Analisis data
Data yang diperoleh di analisis ragam menggunakan uji F pada taraf nyata 5%, dan uji lanjut menggunakan DMRT (Duncan Multiple Range Test) pada taraf 5 %. Untuk data skor morfologi dan warna kalus dianalisis dengan menggunakan uji Kruskal-Wallis.
Hasil dan Pembahasan
Optimasi media induksi kalus embriogenik
Media yang digunakan pada penelitian ini adalah media untuk menginduksi kalus embriogenik pada beberapa genotipe kedelai. Induksi kalus embriogenik pada kedelai sangat dipengaruhi oleh genotipe tanaman (genotype specific) (Texeira et al. 2011; Loganathan et al. 2010; Yang et al. 2009). Pada
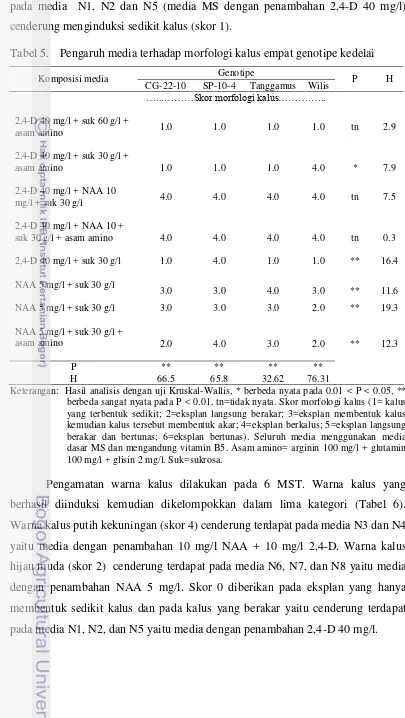
media yang sama, morfologi, warna dan diameter kalus dapat berbeda antar genotipe. Penilaian morfologi kalus dilakukan pada 6 MST. Morfologi kalus yang terbentuk dikelompokkan dalam enam kategori (Tabel 5 & Gambar 6).
26
pada media N1, N2 dan N5 (media MS dengan penambahan 2,4-D 40 mg/l) cenderung menginduksi sedikit kalus (skor 1).
Tabel 5. Pengaruh media terhadap morfologi kalus empat genotipe kedelai
Komposisi media Genotipe P H
CG-22-10 SP-10-4 Tanggamus Wilis …...………Skor morfologi kalus……….…..
Keterangan: Hasil analisis dengan uji Kruskal-Wallis, * berbeda nyata pada 0.01 < P < 0.05, ** berbeda sangat nyata pada P < 0.01, tn=tidak nyata. Skor morfologi kalus (1= kalus yang terbentuk sedikit; 2=eksplan langsung berakar; 3=eksplan membentuk kalus kemudian kalus tersebut membentuk akar; 4=eksplan berkalus; 5=eksplan langsung berakar dan bertunas; 6=eksplan bertunas). Seluruh media menggunakan media dasar MS dan mengandung vitamin B5. Asam amino= arginin 100 mg/l + glutamin 100 mg/l + glisin 2 mg/l. Suk=sukrosa.
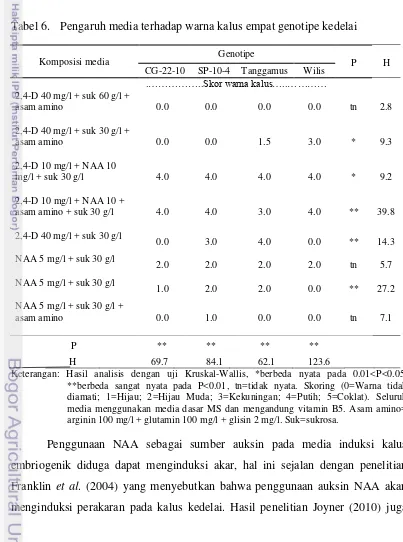
27 Induksi kalus embriogenik pada kedelai pada berbagai media induksi dengan komposisi yang berbeda-beda akan menghasilkan morfologi kalus yang berbeda pula. Untuk menginduksi kalus embriogenik, penambahan hormon auksin sangat berperan penting. Hartweck et al. 1988 menunjukkan bahwa induksi embriogenesis somatik bergantung pada kadar auksin pada media induksi serta jaringan eksplan. Kalus yang berhasil diinduksi pada media dengan penambahan NAA 5 mg/l cenderung berwarna hijau dan akan membentuk akar.
Tabel 6. Pengaruh media terhadap warna kalus empat genotipe kedelai
Komposisi media Genotipe P H
CG-22-10 SP-10-4 Tanggamus Wilis .………..Skor warna kalus…..…………
Keterangan: Hasil analisis dengan uji Kruskal-Wallis, *berbeda nyata pada 0.01<P<0.05, **berbeda sangat nyata pada P<0.01, tn=tidak nyata. Skoring (0=Warna tidak diamati; 1=Hijau; 2=Hijau Muda; 3=Kekuningan; 4=Putih; 5=Coklat). Seluruh media menggunakan media dasar MS dan mengandung vitamin B5. Asam amino= arginin 100 mg/l + glutamin 100 mg/l + glisin 2 mg/l. Suk=sukrosa.
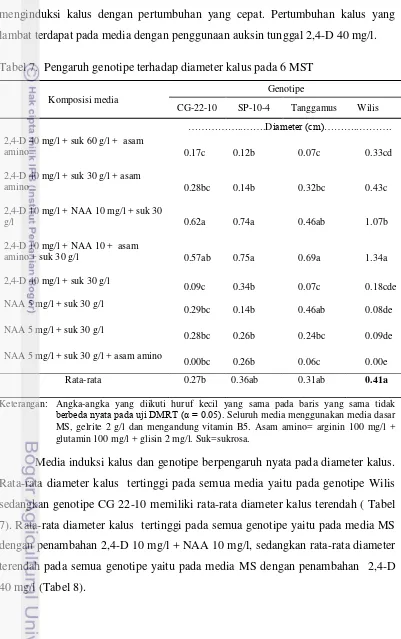
28
menunjukkan hal yang sama yaitu penggunaan NAA sebagai sumber auksin tunggal akan menginduksi akar pada eksplan yang dikulturkan. Pada media dengan penggunaan kombinasi NAA 10 mg/l + 2,4-D 10 mg/l berhasil menginduksi kalus dengan pertumbuhan yang cepat. Pertumbuhan kalus yang lambat terdapat pada media dengan penggunaan auksin tunggal 2,4-D 40 mg/l. Tabel 7. Pengaruh genotipe terhadap diameter kalus pada 6 MST
Komposisi media
Genotipe
CG-22-10 SP-10-4 Tanggamus Wilis
………..…….Diameter (cm)………..……….
berbeda nyata pada uji DMRT (α = 0.05). Seluruh media menggunakan media dasar
MS, gelrite 2 g/l dan mengandung vitamin B5. Asam amino= arginin 100 mg/l + glutamin 100 mg/l + glisin 2 mg/l. Suk=sukrosa.
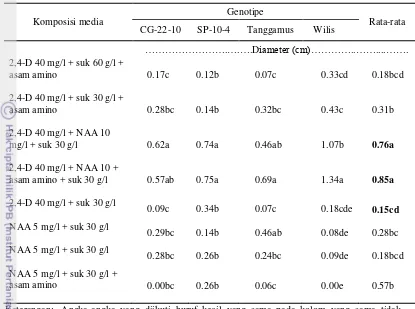
29 Tabel 8. Pengaruh media terhadap diameter kalus pada 6 MST
Komposisi media
Genotipe
Rata-rata CG-22-10 SP-10-4 Tanggamus Wilis
……….….….Diameter (cm)…………..……....…….
berbeda nyata pada uji DMRT (α = 0.05). Seluruh media menggunakan media dasar
MS, gelrite 2 g/l dan mengandung vitamin B5. Asam amino= arginin 100 mg/l + glutamin 100 mg/l + glisin 2 mg/l. Suk=sukrosa.
Kalus yang terbentuk pada media MS yang mengandung 2,4-D 10 mg/l + NAA 10 mg/l diduga merupakan kalus embriogenik karena memiliki struktur kompak, berwarna putih kekuningan, dan memiliki diameter besar (Gambar 8A). Warna kalus yang putih kekuningan dengan struktur yang kompak memperlihatkan adanya kapasitas embriogenik dari massa kalus tersebut (Tang et al. 2000; Fulzele & Satdive 2003, Kumari et al. 2006). Diameter kalus yang
tinggi menunjukkan adanya pertambahan massa kalus. Menurut Khumaida dan Handayani (2010), pertumbuhan kalus yang cepat diduga akan mampu menginisiasi embrio somatik lebih banyak. Oleh karena itu, analisis histologi dilakukan pada kalus-kalus yang terbentuk pada kedua media tersebut.
30
besar dan sitoplasmanya pekat (Gambar 8D), dimana ciri-ciri sel yang demikian dimiliki oleh sel-sel embriogenik (Taylor & Vasil 1996). Hal tersebut menunjukkan bahwa kalus yang terbentuk pada media MS yang mengandung 2,4-D 10 mg/l + NAA 10 mg/l adalah kalus embriogenik.
Gambar 8. Struktur PEM dari kalus kedelai dengan struktur struktur kompak, berwarna putih kekuningan dan diameter yang besar. A) Kalus kedelai yang diduga embriogenik pada genotipe wilis yang pada media MS yang mengandung 2,4-D 10 mg/l dan NAA 10 mg/l dengan struktur kompak, berwarna putih kekuningan dan diameter yang besar, B) struktur PEM perbesaran 10x, C) Perbesaran 40x, D) sel-sel embriogenik.
Penelitian Widoretno et al. (2003) pada kedelai menunjukkan bahwa subkultur dari media yang mengandung 2,4-D 40 mg/l ke media dengan konsentrasi 2,4-D 10 mg/l + NAA 10 mg/l mampu menginduksi embrio somatik sekunder. Oleh karena itu seluruh kalus yang terbentuk disubkultur ke media yang
A a
B a
C a
31 mengandung 2,4-D 10 mg/l + NAA 10 mg/l. Pengamatan terhadap induksi embrio somatik sekunder dilakukan pada 12 minggu setelah perlakuan (MSP). Embrio somatik hanya berhasil diinduksi pada genotipe Tanggamus pada media yang mengandung 2,4-D 10 mg/l + NAA 10 mg/l, sedangkan genotipe Wilis, CG-22-10 dan SP-10-4 hanya menghasilkan kalus dan tidak berhasil membentuk embrio somatik. Parrott et al. (1989) menunjukkan bahwa genotipe sangat berpengaruh dalam keberhasilan embriogenesis somatik. Beberapa genotipe lebih responsif terhadap media kultur dibandingkan genotipe lainnya (Yang et al. 2009). Oleh karena itu penggunaan media yang optimum harus disesuaikan untuk masing-masing genotipe. Berdasarkan jumlah embrio somatik pada fase globular, jantung, torpedo dan kotiledon yang terbentuk, maka media induksi kalus embriogenik terbaik untuk genotipe Tanggamus adalah MS + sukrosa 30 g/l + 2,4-D 40 mg/l + vit B5 dan kemudian disubkultur ke media MS + sukrosa 30 g/l+ 2,4-D 10 mg/l + NAA 10 mg/l + asam amino + vit B5 (Tabel 9 dan Gambar 9).
Tabel 9. Jumlah embrio somatik genotipe Tanggamus setelah di subkultur ke media N4 (N4 (MS + sukrosa 30 g/l+ 2,4-D 10 mg/l + NAA 10 mg/l + glisin 2 mg/l + arginin 100 mg/l + glutamin 100 mg/l + vit B5) pada 12 minggu setelah subkultur (MSS)
Media asal Jumlah embrio somatik
Globular Jantung Torpedo Kotiledon 2,4-D 40 mg/l + suk 60 g/l +
32
yang memiliki aktivitas fisiologi sangat kuat, persistensi yang lama, dan mudah ditranslokasikan (Wattimena 1992). Adanya transport polar NAA diduga menyebabkan proses diferensiasi sel lebih lanjut membentuk embrio somatik.
Gambar 9. Pembentukan embrio somatik secara langsung pada genotipe Tanggamus. A) media awal 2,4-D 40 mg/l + sukrosa 60 g/l +asam amino kemudian setelah satu bulan disubkultur ke media 2,4-D 40 mg/l + NAA 10 + asam amino + suk 30 g/l, B) media awal 2,4-D 40 mg/l + sukrosa 30 g/l + asam amino kemudian setelah satu bulan disubkultur ke media 2,4-D 40 mg/l + NAA 10 + asam amino + sukrosa 30 g/l, C) media awal 2,4-D 40 mg/l + sukrosa 30 g/l kemudian di subkultur ke media 2,4-D 40 mg/l + NAA 10 + asam amino + sukrosa 30 g/l. (Bar = 0.5 mm).
Urutan proses regenerasi kalus embriogenik menjadi planlet didahului dengan terbentuknya embrio pada fase globular, hati, torpedo, dan kemudian kotiledon (Gambar 10). Pembentukan planlet diawali dengan pembentukan struktur yang bipolar (2 kutub), yaitu calon tajuk (Gambar 10A) dan calon akar (Gambar 10B).
A a
B a
33
Gambar 10. Regenerasi kalus embriogenik kedelai. A) globular, B) torpedo, C) kotiledon, D) calon tajuk (plumula) E) calon akar (radikula). Bar = 1 mm.
Proliferasi Kalus
Hasil uji F pada taraf α 5% menunjukkan bahwa faktor media proliferasi kalus serta faktor genotipe berpengaruh nyata terhadap pertambahan bobot kalus (Tabel 10 & Tabel 11). Bobot awal kalus yang digunakan bervariasi yaitu antara 0.3 g sampai 0.5 g klum kalus per botol, oleh karena itu untuk mengetahui laju proliferasi kalus maka yang diamati adalah pertambahan bobot kalus. Media MS dengan penambahan 2,4-D 5 mg/l + NAA 5 mg/l dan media MS dengan penambahan 2,4-D 10 mg/l + NAA 10 mg/l memberikan rataan pertambahan bobot kalus tertinggi, sedangkan media MS dengan penambahan 2,4-D 20 mg/l memberikan respon pertambahan bobot paling rendah. Pengaruh genotipe tidak berpengaruh nyata terhadap pertambahan bobot kalus (Tabel 11).
Kalus yang berada di media proliferasi mengalami pertambahan bobot kalus sebesar 0.562 g pada media MS dengan penambahan 2,4-D 5 mg/l + NAA 5 mg/l pada semua genotipe dan 0.515 g pada media MS dengan penambahan 2,4-D 10 mg/l + NAA 10 mg/l pada semua genotipe. Keragaan kalus pada beberapa media proliferasi ditunjukkan pada Gambar 11.
A B C
D
34
Tabel 10. Pengaruh komposisi media proliferasi terhadap pertambahan bobot kalus pada 6 MSP
Komposisi media Genotipe
Rata-rata CG-22-10 SP-10-4 Tanggamus Wilis
…………Pertambahan bobot kalus (g)……….…
berbeda nyata pada uji DMRT (α = 0.05). Seluruh media asal menggunakan media dasar MS, gelrite 2 g/l dan mengandung sukrosa 30 g/l, vitamin B5 serta arginin 100 mg/l + glutamin 100 mg/l + glisin 2 mg/l.
Tabel 11. Pengaruh genotipe terhadap pertambahan bobot kalus pada 6 MSP
Komposisi media Genotipe
CG-22-10 SP-10-4 Tanggamus Wilis ………..Pertambahan bobot kalus (g)….….…
berbeda nyata pada uji DMRT (α = 0.05). Seluruh media asal menggunakan media dasar MS, gelrite 2 g/l dan mengandung sukrosa 30 g/l, vitamin B5 serta arginin 100 mg/l + glutamin 100 mg/l + glisin 2 mg/l.
Gambar 11. Keragaan kalus pada media proliferasi . A) kalus pada media MS dengan penambahan 2,4-D 5 mg/l + NAA 5 mg/l, B) kalus pada media MS dengan penambahan 2,4-D 10 mg/l + NAA 10 mg/l, C) kalus pada media MS dengan penambahan 2,4-D 20 mg/l.
35 Optimasi Media Induksi Embrio Somatik
Percobaan 1b dilaksanakan untuk menginduksi embrio somatik dari eksplan kotiledon muda pada genotipe Tanggamus dan Wilis. Dari percobaan 1a media MS dengan penambahan 2,4-D 40 mg/l adalah media yang dapat menginduksi embrio somatik tertinggi pada genotipe Tanggamus. Namun, jumlah embrio somatik yang dihasilkan masih sangat sedikit (satu globular, satu jantung, tiga torpedo dan tiga kotiledon) sehingga perlu dilakukan optimasi media induksi embrio somatik kedelai.
Pada percobaan media ini, media induksi embrio somatik diharapkan dapat menginduksi kalus embriogenik. Pengamatan terhadap persentase kalus embriogenik dilakukan dengan menggunakan mikroskop pada 4 MST. Pengamatan dengan mikroskop diperlukan agar ciri-ciri kalus embriogenik dapat terlihat dengan jelas. Ciri-ciri kalus embriogenik yaitu adanya struktur embrio somatik pada kalus yang dihasilkan, hal ini ditunjukkan pada tanda lingkaran (Gambar 12A). Sedangkan pada kalus yang tidak embriogenik maka tidak terbentuk struktur embrio pada kalus yang terinduksi (Gambar 12B).
Gambar 12. Ciri-ciri kalus embriogenik dan tidak embriogenik genotipe Tanggamus pada media dengan 2,4-D 40 mg/l pada saat 4 MST. A) kalus embriogenik akan muncul embrio somatik secara langsung (tanda lingkaran pada gambar) dan B) kalus non embriogenik. (Bar = 1 mm).
A a
36
Persentase kalus embriogenik hanya terjadi pada genotipe Tanggamus dan pada media MS dengan penambahan 2,4-D 40 mg/l yaitu sebesar 54.5%. Ketidakberhasilan genotipe Wilis menghasilkan kalus embriogenik pada media MS dengan penambahan 2,4-D 40 mg/l diduga disebabkan oleh faktor genotipe. Hasil penelitian Texeira et al. (2011) pada kedelai menunjukkan bahwa efisiensi embriogenesis somatik dan organogenesis dipengaruhi oleh genotipe tanaman. Pada media MS dengan penambahan 2,4-D 10 mg/l + NAA 10 mg/l juga tidak berhasil menginduksi kalus embriogenik (Gambar 13 A). Kalus yang berasal dari media MS dengan penambahan 2,4-D 10 mg/l + NAA 10 mg/l memiliki warna putih kekuningan dan menutupi seluruh eksplan Pada media MS dengan penambahan pikloram 40 mg/l dan 20 mg/l tidak berhasil menginduksi kalus embriogenik (Gambar 13B & 13C). Kalus yang berasal dari media dengan pikloram 20 mg/l dan media dengan pikloram 40 mg/l memiliki warna putih kekuningan dan menutupi eksplan yang terluka.
Auksin jenis 2,4-D lebih responsif dalam pembentukkan kalus embriogenik pada kedelai daripada auksin jenis pikloram. Hal ini sesuai dengan beberapa penelitian sebelumnya pada beberapa genotipe kedelai (Barwale et al. 1986; Widoretno et al. 2003; Ko & Korban 2004; Yang et al. 2009) yang menunjukkan bahwa penggunaan 2,4-D lebih sesuai daripada jenis auksin yang lainnya untuk digunakan sebagai sumber auksin dalam induksi embriogenesis somatik.
Gambar 13. Keragaan kalus pada media induksi embrio somatik. A) kalus pada media MS dengan penambahan 2,4-D 10 mg/l + NAA 10 mg/l, B) kalus pada MS dengan penambahan pikloram 40 mg/l, C) kalus pada media MS dengan penambahan pikloram 20 mg/l.
A a
C a B