ANALISIS KANDUNGAN MINERAL KALSIUM, KALIUM
DAN MAGNESIUM PADA KULIT BUAH MANGGIS
(Garcinia mangostana L.) SEGAR DAN KERING
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
OLEH:
NENY MANDASARI
NIM 121524034
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KANDUNGAN MINERAL KALSIUM, KALIUM
DAN MAGNESIUM PADA KULIT BUAH MANGGIS
(Garcinia mangostana L.) SEGAR DAN KERING
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Mencapai Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NENY MANDASARI
NIM 121524034
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ANALISIS KANDUNGAN MINERAL KALSIUM, KALIUM
DAN MAGNESIUM PADA KULIT BUAH MANGGIS
(Garcinia mangostana L.) SEGAR DAN KERING
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
OLEH:
NENY MANDASARI NIM 121524034
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatra Utara
Pada tanggal : 11 Februari 2015 Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Prof. Dr. UripHarahap, Apt Prof. SumadioHadisahputra, Apt.
NIP 195301011983031004
Medan, Maret 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
Prof. Dr. Julia Reveny, M.Si., Apt. NIP 195807101986012001
Pembimbing I,
Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195201041980031002
Panitia Penguji,
Prof. Dr. Jansen Silalahi, M.App.Sc., Apt. NIP 195006071979031001
Pembimbing II,
Prof. Dr. rer. nat. E.D.L Putra, S.U., Apt. NIP 195306191983031001
Drs. Maralaut Batubara, M.Phill., Apt. NIP 195101311976031003
Dra. Masria Lasma Tambunan, M.Si., Apt. NIP 195005081977022001
KATA PENGANTAR
Bismillahirrahmanirrahiim,
Puji syukur penulis ucapkan kehadirat Allah SWT atas segala limpahan
rahmat dan karunianya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini, serta shalawat beriring salam untuk Rasulullah
Muhammad SAW sebagai suri tauladan dalam kehidupan.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul
Analisis Kadungan Mineral Kalsium, Kalium dan Magnesium pada Kulit Buah
Manggis (Garcinia mangostana L.) Segar dan Kering secara Spektrofotometri
Serapan Atom.
Pada kesempatan kali ini dengan segala kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Drs. Fathur
Rahman Harun, M.Si., Apt., dan Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U., Apt. yang telah membimbing dan memberikan petunjuk serta saran-saran
selama penelitian hingga selesainya skripsi ini. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Medan, Ibu Prof. Dr. Julia Reveny, M.Si. Apt., selaku Wakil Dekan I Fakultas Farmasi USU Medan,
yang telah memberikan pengarahan dan bimbingan dalam menyelesaikan skripsi ini. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., Bapak Drs. Maralaut
Lux Putra, S.U., Apt., selaku Kepala Laboratorium Penelitian USU yang telah
memberikan izin dan fasilitas untuk penulis sehingga dapat mengerjakan dan menyelesaikan penelitian ini. Yang terkasih, Ayahanda Sulaiman, SE dan Ibunda Yunidar yang telah memberikan cinta dan kasih sayang yang tidak ternilai dengan
apapun, motivasi beserta doa yang tulus dan tak pernah henti. Saudaraku Dedy Achmanda, SE, Nevy Yulaida S.Farm, dr. Agmeldia Yugistika, Yuni Lestari
Multra, SE dan seluruh keluarga besar yang selalu setia memberikan doa dan dukungan penuh kepada penulis.
Sahabat-sahabat terbaikku Hikmah, Widia, Aida, dan seluruh teman-teman
84AC serta teman-teman Farmasi Ekstensi 2012, terima kasih atas perhatian, semangat, doa, dan kebersamaannya selama ini. Serta seluruh pihak yang telah
ikut mebantu penulis namun tidak tercantum namanya.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis
menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 11 Februari 2015 Penulis,
ANALISIS KANDUNGAN MINERAL KALSIUM, KALIUM DAN MAGNESIUM PADA KULIT BUAH MANGGIS
(Garcinia mangostana L.) SEGAR DAN KERING SECARA SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Mineral mempunyai peranan penting dalam pemeliharaan fungsi tubuh dan banyak ditemukan dalam berbagai jenis buah dan sayuran. Buah manggis
disebut juga queen of fruits atau ratunya buah karena kaya akan vitamin dan
mineral diantaranya kalsium, kalium, dan magnesium. Penelitian ini bertujuan untuk menentukan kandungan mineral dan perbedaan kandungan mineral kalsium, kalium, dan magnesium pada kulit buah manggis segar dan kulit buah manggis kering.
Pengujian kuantitatif dilakukan terhadap kulit buah manggis segar dan kulit buah manggis kering dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 422,7 nm untuk kalsium, 766,5 nm untuk kalium, dan 285,2 nm untuk magnesium, dengan menggunakan nyala udara-asetilen. Metode ini dipilih karena pelaksanaannya mudah, cepat, teliti dan tidak memerlukan pemisahan pendahuluan.
Hasil penelitian menunjukkan kadar kalsium pada kulit buah manggis segar sebesar (37,5151 ± 2,3852) mg/100 g dan pada kulit buah manggis kering sebesar (110,2301 ± 2,2960) mg/100 g. Kalium pada kulit buah manggis segar sebesar (403,7570 ± 0,9088) mg/100 g dan pada kulit buah manggis kering sebesar (1358,1438 ± 10,1438) mg/100 g. Magnesium pada kulit buah manggis segar sebesar (20,9644 ± 0,5375) mg/100g dan pada kulit buah manggis kering sebesar (51,3023 ± 0,0874) mg/100 g. Dapat disimpulkan bahwa kulit buah manggis kering mengandung mineral kalsium, kalium dan magnesium lebih tinggi dari pada kulit buah manggis segar.
ANALYSIS OF MINERAL CONTENT; CALCIUM, POTASSIUM, AND MAGNESIUM IN FRESH AND DRY MANGOSTEEN
(Garcia Mangostana L.) RIND
BY ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Mineral has an important role in care of body functions and were found in
a variety of fruits and vegetables. Mangosteen is also called queen of fruits
because it is rich in vitamins and mineral such as calcium, potassium and magnesium. This study aims to determine the level of mineral and the differences in the level of minerals calcium, potassium and magnesium in fresh and dry mangosteen rind.
The quantitative analysis conducted on fresh and dry mangosteen rind using atomic absorption spectrophotometer. Calcium at a wavelength of 422.7 nm, potassium at a wavelength of 766.5 nm and 285.2 nm for magnesium with air-acetilen. This method was chosen because its implementation more easy, quick, thorough and not required the preliminary experiments.
The results showed that the level of calcium in fresh mangosteen rind was (37.5151 ± 2.3852) mg/100 g and the dry mangosteen rind was (110.2301 ± 2.2960) mg/100 g. Potassium in fresh mangosteen rind size (403.7570 ± 0.9088) mg/100 g and the dry mangosteen rind was (1358.1438 ± 10.1438) mg/100 g. Magnesium in fresh mangosteen rind size (20.9644 ± 0.5375) mg/100 g and the dry mangosteen rind was (51.3023 ± 0.0874) mg/100 g. The results can be concluded that level of calcium, potassium, magnesium in dry mangosteen rind higher than in fresh mangosteen rind.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Perumusan Masalah ... 3
1.3Hipotesis ... 3
1.4Tujuan Penelitian ... 3
1.5Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1Manggis ... 5
2.1.1Sistematika tanaman manggis ... 5
2.1.2Spesifikasi tumbuhan ... 5
2.1.3Khasiat ... 6
2.1.4Kandungan kimia ... 6
2.2.1 Kalsium ... 7
2.2.2 Kalium ... 8
2.2.3 Magnesium ... 9
2.3Spektrofotometri Serapan Atom ... 10
2.4Validasi Metode Analisis ... 15
2.4.1Kecermatan (Accuracy) ... 15
2.4.2Keseksamaan ... 16
2.4.3Batas deteksi dan Batas kuantifikasi ... 17
BAB III METODE PENELITIAN ... 18
3.1Tempat dan Waktu Penelitian ... 18
3.2Bahan-bahan ... 18
3.2.1Sampel ... 18
3.2.2Pereaksi ... 18
3.3Alat-Alat ... 18
3.4Pembuatan Pereaksi ... 19
3.5Prosedur Penelitian ... 19
3.5.1Pengambilan sampel ... 19
3.5.2Penyiapan sampel ... 19
3.5.3Proses destruksi ... 20
3.5.4Pembuatan larutan sampel ... 20
3.5.5Analisis kuantitatif ... 20
3.5.5.1Pembuatan kurva kalibrasi kalsium ... 20
3.5.5.2Pembuatan kurva kalibrasi kalium ... 21
3.5.5.4Pengujian kadar kalsium ... 22
3.5.5.5Pengujian kadar kalium ... 22
3.5.5.6Pengujian kadar magnesium ... 23
3.5.5.7Perhitungan kadar kalsium, kalium, dan magnesium dalam sampel ... 23
3.5.6Analisis data secara statistik ... 23
3.5.7Validasi metoda ... 24
3.5.7.1Uji perolehan kembali ... 24
3.5.7.2Penentuan batas deteksi (LOD) dan batas kuantitasi (LOQ) ... 25
3.5.7.3Uji keseksamaan ... 26
BAB IV HASIL DAN PEMBAHASAN ... 27
4.1Identifikasi Tumbuhan ... 27
4.2Analisis Kuantitatif ... 27
4.2.1 Kurva kalibrasi kalsium, kalium, dan magnesium 28
4.2.2 Kadar kalsium, kalium, dan magnesium pada sampel ... 29
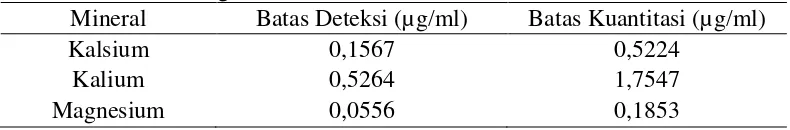
4.2.3 Batas deteksi dan batas kuantitasi ... 30
4.2.4 Uji perolehan kembali ... 30
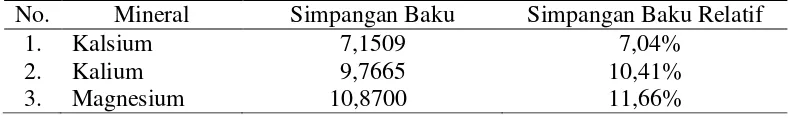
4.2.5 Simpangan baku relatif ... 31
BAB V KESIMPULAN DAN SARAN ... 33
5.1 Kesimpulan ... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Halaman Tabel 4.1 Hasil Analisis Kuantitatif Kalsium, Kalium, dan Magnesium
pada KMS dan KMK ... 29 Tabel 4.2 Batas Deteksi dan Batas Kuantitasi Kalsium, Kalium, dan
Magnesium ... 30
Tabel 4.3 Persen Uji Perolehan Kembali (recovery) Kalsium, Kalium,
dan Magnesium dalam Sampel ... 31 Tabel 4.4 Nilai Simpangan Baku dan Simpangan Baku Relatif
DAFTAR GAMBAR
Halaman Gambar 4. 1. Kurva kalibrasi kalsium ... 28 Gambar 4.2. Kurva kalibrasi kalium ... 28
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Tumbuhan ... 36
Lampiran 2. Gambar Sampel kulit buah manggis ... 37
Lampiran 3. Gambar Alat-Alat yang Digunakan ... 38
Lampiran 4. Bagan Alir Proses Dekstruksi Kering ... 40
Lampiran 5. Bagan Alir Pembuatan Larutan Sampel ... 42
Lampiran 6. Data Hasil Pengukuran Absorbansi Larutan Standar Kalsium, Kalium, dan Magnesium ... 43
Lampiran 7. Perhitungan Persamaan Garis Regresi ... 44
Lampiran 8. Hasil Analisis Kalsium, Kalium, dan Magnesium dalam Sampel ... 48
Lampiran 9. Contoh Perhitungan Kadar Kalsium, Kalium, dan Magnesium dalam Sampel ... 50
Lampiran 10. Perhitungan Statistik Kadar Kalsium dalam Sampel .... 54
Lampiran 11. Perhitungan Statistik Kadar Kalium dalam Sampel ... 58
Lampiran 12. Perhitungan Statistik Kadar Magnesium dalam Sampel ... 62
Lampiran 13. Rekapitulasi Data Kadar Kalsium, Kalium dan Magnesium pada Kulit Buah Manggis (Garcinia mangostana L.) Sebelum Uji-t . ... 66
Lampiran 14. Rekapitulasi Data Kadar Kalsium, Kalium dan Magnesium pada Kulit Buah Manggis (Garcinia mangostana L.) Setelah Uji-t . ... 68
Lampiran 15. Perhitungan Batas Deteksi dan Batas Kuantitasi Kalsium, Kalium, dan Magnesium ... 70
Lampiran 17. Perhitungan Uji Perolehan Kembali Kalsium, Kalium,
dan Magnesium dalam Sampel ... 76
Lampiran 18. Perhitungan Simpangan Baku Relatif (RSD) Kalsium,
Kalium, dan Magnesium dalam Sampel ... 79
BAB I PENDAHULUAN
1.1 Latar Belakang
Manggis dengan nama latin Garcinia Mangostana L merupakan tanaman
yang banyak tumbuh secara alami pada hutan tropis di kawasan Asia Tenggara seperti Indonesia, Malaysia dan Thailan. Di Indonesia tanaman manggis mudah
dijumpai dari Sabang sampai Marauke (Mardiana, 2013). Buah dan kulit mangis mengandung mineral seperti kalium dan magnesium. Kandungan kalium pada kulit dan buah manggis berfungsi untuk mengontrol detak jantung dan tekanan
darah, ini berarti kulit dan buah manggis dapat menjadi senjata ampuh mencegah stroke dan jantung koroner (Anonim, 2014). Kulit manggis juga mengandung
kalsium yang sangat dibutuhkan oleh tubuh untuk memperkuat tulang. (Anonim, 2013). Kulit buah manggis segar dapat dikonsumsi dengan dalam bentuk jus (Anonim, 2014). Selain itu kulit buah manggis baik segar maupun kering dapat
dikonsumsi dalam bentuk air rebusannya.
Mineral merupakan kebutuhan tubuh manusia yang mempunyai peranan
penting dalam pemeliharaan fungsi tubuh, seperti untuk pengaturan kerja enzim-enzim, pemeliharaan keseimbangan asam-basa, membantu pembentukan ikatan yang memerlukan mineral seperti pembentukan hemoglobin (Almatsier, 2004).
Kalsium merupakan suatu mineral yang membantu aktivitas saraf dan otot normal. Kalsium merangsang kontraksi otot jantung (miokardium) dan membantu
kalsium juga dibutuhkan untuk pembentukan tulang dan gigi (Kee dan Hayes
1993).
Kalium, suatu elektrolit selular yang penting untuk transmisi dan konduksi impuls-impuls saraf, kontraksi otot-otot rangka, otot jantung dan otot polos. (Kee
dan Hayes 1993).
Kadar magnesium yang normal dapat mempertahankan kontraksi otot
polos, dan berimplikasi terhadap kontrol tekanan darah. Magnesium juga dapat melindungi otot jantung dari kerusakan selama iskemia (Barasi, 2007).
Kadar kalsium, kalium dan magnesium harus dipertahankan dalam batas
yang ketat agar aktivitas listrik di jantung dapat berjalan normal. Kadar abnormal ketiga mineral ini dapat mengakibatkan aritmia (Barasi, 2007).
Keseimbangan mineral-mineral tersebut dalam tubuh sangatlah penting. Oleh karena itu peneliti tertarik melakukan penelitian untuk mengetahui kandungan kalsium, kalium, dan magnesium yang terdapat pada kulit buah
manggis yang berperan dalam menambah asupan mineral dalam tubuh. Sampel yang diuji dalam penelitian ini adalah kulit buah manggis segar (KMS) dan kulit
buah manggis kering (KMK).
Berbagai metode dapat diterapkan dalam pemeriksaan kandungan kalsium, kalium dan magnesium. Kalsium dan magnesium dapat ditentukan dengan metode
kompleksometri, gravimetri dan spektrofotometri serapan atom. Sedangkan untuk kalium dapat memakai metode gravimetri, dan spektrofotometri serapan atom
ketelitiannya sampai tingkat runut serta tidak memerlukan pemisahan
pendahuluan (Khopkar, 1984) sehingga dipilih untuk pemeriksaan kalsium, kalium, dan magnesium pada KMS dan KMK.
1.2Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian ini dapat
dirumuskan sebagai berikut:
1. Berapakah kadar kalsium, kalium dan magnesium pada kulit buah manggis
(Garcinia Mangostana L.) segar dan kering?
2. Apakah ada pebedaan antara kadar kalsium, kalium, dan magnesium pada
kulit buah manggis (Garcinia Mangostana L.) segar dan kering?
2.3Hipotesis
1. Kulit buah manggis (Garcinia Mangostana L.) segar dan kering
mengandung kalsium, kalium, dan magnesium dalam jumlah tertentu.
2. Kulit buah manggis (Garcinia Mangostana L.) kering mengandung
kalsium, kalium dan magnesium lebih tinggi dari pada kulit buah manggis segar.
2.4Tujuan Penelitian
1. Untuk mengetahui kadar mineral kalsium, kalium, dan magnesium pada
2. Untuk mengetahui perbedaan kandungan mineral kalsium, kalium, dan
magnesium pada kulit buah manggis (Garcinia Mangostana L.) yang
segar dan kering.
2.5Manfaat Penelitian
Memberikan informasi kepada masyarakat tentang kandungan mineral
BAB II
TINJAUAN PUSTAKA
2.1Manggis
Menurut Nikolai Ivanovich Vavilov, ahli botani dari Soviet, sentrum utama
asal tanaman manggis adalah Indo-Malaya, yang meliputi Indo-Cina, Malaysia, indonesia, dan Filipina. Namun beberapa literatur menyebutkan bahwa tanaman
manggis berasal dari Asia Tenggara yang memiliki tipe iklim basah, termasuk Indonesia (Rukmana, 2007).
2.1.1 Sistematika tanaman manggis
Menurut Tjitrosupomo (2000), Rukmana (2007) dan Herbarium Bogoriense (2014) sistematika tanaman manggis adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Sub-divisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Guttifernales
Famili : Guttiferae atau Clusiaceae
Genus : Garcinia
Spesies : Garcinia mangostana L.
2.1.2 Spesifikasi tumbuhan
Tanaman manggis termasuk famili Guttiferae, merupakan pohon setinggi
Ujung daun runcing, pangkal tumpul, tetapi rata, dan agak tebal. Panjang daun
20-22 cm, lebar 6-9 cm, bertangkai silindris. Bunga tunggal, berkelamin dua, dan terletak di ketiak daun. Benang sari kuning, putiknya putih kekuningan. Tangkai bunga silindris, panjang 1-2 cm. Buahnya bulat, berdiameter 6-8 cm, warna coklat
keunguan. Biji bulat warna kuning, berdiameter 2 cm. Satu buah manggis berisi 5-7 biji. Akar tunggang berwarna putih kecoklatan (Adi, 2008).
2.1.3 Khasiat
Mengkonsumsi manggis dipercaya memiliki banyak manfaat bagi kesehatan, terutama kesehatan kardiovaskular, seperti mengatasi penyakit jantung,
aterosklerosis, hipertensi, dan trombosis. Selain itu kulit manggis juga dapat mengobati diare, radang amandel, meluruhkan dahak, sakit gigi, sariawan,
mengatasi haid yang tidak teratur, keputihan dan wasir. Kadar antioksidan manggis yang cukup tinggi dapat menangkal radikal bebas penyebab penyakit kanker (Mangan, 2009).
2.1.4 Kandungan kimia
2.1.4.1Buah
Setiap 100 g buah manggis mengandung 63,0 kalori; 0,6 g protein; 0,6 g lemak; 15,6 g Karbohidrat; 8,0 mg kalsium; 12,0 mg fosfor; 0,8 mg zat besi; 0,03 mg vitamin B1; 2,0 mg vitamin C; 83,0 g air; dan 29,0% bagian yang dapat
dimakan (Rukmana, 2012).
2.1.4.2Kulit Buah Manggis
2.1.4.3Kulit Batang dan Akar
Kulit batang dan akar manggis mengandung flavonoid, polifenol, tanin, dan saponin (Adi, 2008).
2.2Mineral
Mineral merupakan komponen cairan tubuh yang bekerja sama dengan
enzim, hormon dan vitamin (Devi, 2010). Mineral yang terdapat dalam tubuh dan makanan terutama terdapat dalam bentuk ion-ion. Keseimbangan ion-ion mineral dalam tubuh mengatur proses metabolisme, mengatur keseimbangan asam basa,
tekanan osmotik, membantu transport senyawa-senyawa penting pembentuk membran, beberapa diantaranya sebagai konstituen pembentuk jaringan tubuh.
Mineral dalam tubuh berkaitan antara yang satu dengan yang lainnya, dan kekurangan atau kelebihan salah satu mineral akan berpengaruh terhadap kerja mineral lainnya (Poedjiadi, 2006).
Mineral dibagi ke dalam dua kelompok yaitu mineral makro dan mineral mikro. Mineral makro merupakan mineral yang dibutuhkan oleh tubuh dalam
jumlah lebih dari 100 mg per hari sedangkan mineral mikro merupakan mineral yang dibutuhkan tubuh dalam jumlah kecil 100 mg per hari. Unsur-unsur yang termasuk ke dalam mineral makro adalah kalsium, fosfor, magnesium, natrium,
kalium, dan klor, sedangkan yang termasuk ke dalam mineral mikro adalah besi, seng, iodium, mangan, selenium, dan kromium (Devi, 2010).
2.2.1Kalsium
memegang peranan penting pada berbagai proses fisiologik dan biokimia di dalam
tubuh, seperti pada pembekuan darah, eksitabilitas syaraf otot, kerekatan seluler, transmisi impul-impul syaraf, memelihara dan meningkatkan fungsi membran sel, mengaktifkan reaksi enzim dan sekresi hormon (Suhardjo dan Kusharto, 2000).
Tubuh memerlukan kalsium selama hidup terutama pada masa kanak-kanak, masa mengandung dan laktasi. Kalsium seringkali kurang memadai dalam
diri seseorang. Kekurangan kalsium dapat menghambat pembentukan tulang dan gigi, riketsia pada anak-anak, dan dapat mengakibatkan osteoporosis pada orang dewasa (Poedjiadi, 2006).
Pada tahun 1920, hasil penelitian Sherman menyatakan bahwa bagi orang laki-laki dewasa kebutuhan minimal akan kalsium cukup 0,45 gram sehari.
Setelah itu penelitian dilakukan oleh para ahli seperti Chu, Vuthonse, Steggerda dan Mitchel yang berkesimpulan bahwa kebutuhan kalsium 7-7,5 mg per kg berat badan atau kurang lebih sekitar 0,5-0,7 gram sehari bagi orang dewasa (Suhardjo
dan Kusharto, 2000). Sumber kalsium adalah susu, ikan, udang kering, bayam, keju, es krim, melinjo dan sawi. Kalsium juga dapat diperoleh dalam jumlah yang
cukup dari air mineral yang dapat mengandung sampai 50mg/L (Budiyanto 2004).
2.2.2Kalium
Kalium merupakan kation penting dalam cairan intraselular yang berperan
dalam keseimbangan pH dan osmolaritas. Tubuh manusia mengandung 2,6 mg kalium per kg berat badan bebas lemak, sel-sel syaraf dan otot mengandung
Menurut Budiyanto (2004), kebutuhan kalium sehari adalah sekitar 2-6 g.
Kekurangan kalium umumnya disebabkan oleh karena ekskresi yang berlebihan melalui ginjal, muntah-muntah yang berlebihan dan diare yang berat. Pengaruh kekurangan kalium terutama pada otot yaitu dapat mengakibatkan kelumpuhan
(Suhardjo dan Kusharto, 2000). Sumber kalium dari makanan antara lain terdapat pada jeruk, semangka, tomat, sayuran berdaun hijau, pisang, kentang, kacang
polong, susu dan daging (Tim Redaksi Vitahealt, 2006).
2.2.3Magnesium
Magnesium di alam merupakan bagian dari klorofil daun. Peranan
magnesium dalam tumbuh-tumbuhan sama dengan peranan zat besi dalam ikatan hemoglobin di dalam darah manusia, yaitu untuk pernapasan. Selain itu,
magnesium juga terlibat dalam berbagai proses metabolisme (Almatsier, 2004). Magnesium bertindak di dalam semua sel jaringan lunak sebagai katalisator dalam reaksi-reaksi biologi termasuk reaksi-reaksi yang berkaitan
dengan metabolisme energi, karbohidrat, lipid, protein, dan asam nukleat. Di dalam cairan ekstraselular, magnesium berperan dalam transmisi saraf, kontraksi
otot, dan pembekuan darah. Dalam hal ini, peranan magnesium berlawanan dengan kalsium dimana kalsium merangsang kontraksi otot sedangkan magnesium mengendorkan otot. Kalsium merangsang penggumpalan darah,
sedangkan magnesium mencegah penggumpalan darah. Kalsium menyebabkan ketegangan saraf sedangkan magnesium melemaskan saraf. Selain itu, magnesium
Orang dewasa pria membutuhkan magnesium sebanyak 350 mg/hari dan
untuk wanita membutuhkan magnesium sebanyak 300 mg/hari. Jika tetjadi defisiensi maka dapat menimbulkan gangguan metabolisme (Budiyanto 2004). Sumber terbaik magnesium adalah sayuran hijau. Sumber lain adalah
kacang-kacangan, biji-bijian, gandum, oatmeal, yoghurt, kedelai, alpukat dan pisang
(Devi, 2010). Daging, susu dan hasil olahannya serta cokelat juga merupakan
sumber magnesium yang baik (Almatsier, 2004).
2.3Spektrofotometri Serapan Atom
Spektrofotometri serapan atom digunakan untuk analisis kuantitatif
unsur-unsur logam dalam jumlah sekelumit (trace) dan sangat kelumit (ultratrace). Cara
analisis ini memberikan kadar total unsur logam dalam suatu sampel dan tidak tergantung pada bentuk molekul dari logam dalam sampel tersebut. Cara ini cocok untuk analisis kelumit logam karena mempunyai kepekaan yang tinggi (batas
deteksi kurang dari 1 ppm), pelaksanaannya relatif sederhana, dan interferensinya sedikit (Gandjar dan Rohman, 2011).
Metode spektrofotometri serapan atom (SSA) mendasarkan pada prinsip absorpsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Sebagai contoh, magnesium
menyerap pada 285,2 nm, kalsium 422,7 nm, sementara kalium menyerap pada panjang gelombang 766,5 nm. Cahaya pada panjang gelombang ini mempunyai
Keberhasilan analisis dengan SSA ini tergantung pada proses eksitasi dan cara
memperoleh garis resonansi yang tepat. Temperatur nyala harus sangat tinggi. Di dalam nyala, atom akan mampu menyerap sinar dengan panjang gelombang yang sesuai dengan transisi dari tingkat azas ke salah satu tingkat energi elektron
tereksitasi yang lebih tinggi. Maka secara eksperimental dapat diperoleh puncak-puncak serapan sinar oleh atom-atom zat yang dianalisis. Garis-garis spektrum
serapan atom yang timbul karena serapan sinar yang menyebabkan eksitasi dari azas ke salah satu tingkat energi yang lebih tinggi disebut garis-garis resonansi (Resonanceline) (Gandjar dan Rohman, 2011).
Adapun bagian instrumen spektrofotometer serapan atom adalah sebagai berikut:
a. Sumber Radiasi
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow
cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung
suatu katoda dan anoda. Katoda berbentuk silinder berongga yang terbuat dari logam atau dilapisi dengan logam tertentu. Tabung logam ini diisi dengan gas
mulia (neon atau argon) dengan tekanan rendah (10-15 torr). Dalam hal ini neon lebih disukai karena dapat memberikan intensitas pancaran lampu yang lebih rendah (Gandjar dan Rohman, 2011).
b. Tempat Sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan
1. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Suhu yang dapat dicapai oleh nyala tergantung pada gas-gas
yang digunakan. Gas yang digunakan antara lain sebagai berikut;
1. Udara-Propana
Gas udara-propana dipilih untuk logam alkali karena suhu nyala yang lebih rendah yaitu 1950 °C yang akan mengurangi banyak ionisasi. Namun gas ini tidak cocok digunakan untuk
senyawa-senyawa yang bersifat refraktorik yang membutuhkan suhu tinggi untuk proses atomisasinya.
2. Udara-asetilen
Campuran asetilen sebagai bahan pembakar dan udara sebagai pengoksidasi merupakan sumber nyala yang paling sering digunakan
pada analisis menggunakan spektrofotometri serapan atom. Sumber nyala ini dapat mengatomisasi hampir semua elemen. Sumber nyala ini
mempunyai suhu 2200°C.
3. Dinitrogen (N2O)-asetilen
Campuran gas dinitrogen oksida-asetilen ini mempunyai suhu
3000°C sehingga tidak cocok untuk logam-logam alkali. Senyawa yang bersifat refraktorik dapat terdisosiasi sempurna dengan sumber
nyala ini.
nyala ini yaitu secara langsung dan tidak langsung. Cara langsung atau
pembakar konsumsi total dilakukan dengan diaspirasikan sampel secara langsung ke dalam nyala, dan semua sampel akan dikonsumsi oleh pembakar. Sedang secara tidak langsung, sampel terlebih dahulu dicampur
dengan bahan pembakar dan bahan pengoksidasi dalam suatu ruang pencampur sebelum dibakar (Gandjar dan Rohman, 2011).
2. Tanpa nyala
Atomisasi tanpa nyala muncul karena teknik atomisasi dengan menggunakan nyala dinilai kurang peka yang berakibat atomisasi kurang
sempurna. Pengatoman tanpa nyala dilakukan dalam tungku dari grafit. Sistem pemanasan tanpa nyala ini dapat melalui tiga tahap yaitu:
pengeringan (drying) yang membutuhkan suhu yang relatif rendah;
pengabuan (ashing) yang membutuhkan suhu yang lebih tinggi karena
untuk menghilangkan matriks kimia dengan mekanisme volatilasi atau
pirolisis; dan pengatoman (atomising) (Gandjar dan Rohman, 2011).
c. Monokromator
Monokromator berfungsi untuk memisahkan dan memilih panjang gelombang yang digunakan dalam analisis. Di samping sistem optik, dalam monokromator juga terdapat suatu alat yang digunakan untuk memisahkan radiasi
resonansi dan kontinyu yang disebut dengan chopper (Gandjar dan Rohman,
2011).
d. Detektor
(photomultiplier tube). Ada dua cara yang dapat digunakan dalam sistem deteksi
yaitu: (a) yang memberikan respon terhadap radiasi resonansi dan radiasi kontinyu; (b) yang hanya memberikan respon terhadap radiasi resonansi (Gandjar dan Rohman, 2011).
e. Readout
Readout merupakan suatu alat petunjuk atau dapat juga diartikan sebagai
sistem pencatatan hasil. Pencatatan hasil dilakukan dengan suatu alat telah terkalibrasi untuk pembacaan suatu transmisi atau absorbsi. Hasil pembacaan dapat berupa angka atau berupa kurva dari suatu rekorder yang menggambarkan
absorbansi atau intensitas emisi (Gandjar dan Rohman, 2011).
Peristiwa-peristiwa yang menyebabkan pembacaan absorbansi unsur yang
dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel merupakan suatu gangguan pada SSA. Gangguan-gangguan tersebut dapat diuraikan sebagai berikut:
1. Gangguan yang mempengaruhi banyaknya sampel yang mencapai nyala
Matriks dapat berpengaruh terhadap laju aliran bahan bakar atau gas
pengoksidasi. Sifat-sifat tersebut antara lain viskositas, tegangan permukaan, berat jenis, dan tekanan uap. Selain itu pengendapan unsur yang dianalisis dapat mengakibatkan jumlah atom yang mencapai nyala lebih sedikit dari konsentrasi
yang seharusnya terdapat dalam sampel (Gandjar dan Rohman, 2011).
2. Gangguan kimia yang mempengaruhi jumlah atom yang terjadi dalam nyala.
dan (b) ionisasi atom-atom di dalam nyala akibat suhu untuk atomisasi terlalu
tinggi (Gandjar dan Rohman, 2011).
3. Gangguan oleh absorbansi
Gangguan ini terjadi akibat absorbansi bukan disebabkan oleh absorbansi
atom yang dianalisis, melainkan absorbansi oleh molekul-molekul yang tidak terdisosiasi di dalam nyala. (Gandjar dan Rohman, 2011).
4. Gangguan oleh penyerapan non-atomik
Gangguan ini terjadi akibat penyerapan cahaya dari sumber sinar yang bukan berasal dari atom-atom yang akan dianalisis, melainkan penyerapan oleh
partikel-partikel padat yang berada di dalam nyala.
Cara mengatasi gangguan ini adalah dengan bekerja pada panjang
gelombang yang lebih besar atau pada suhu yang lebih tinggi. Jika kedua cara ini masih belum bisa membantu menghilangkan gangguan ini, maka satu-satunya cara adalah dengan mengukur besarnya penyerapan non-atomik menggunakan
sumber sinar yang memberikan spektrum kontinyu (Gandjar dan Rohman, 2011).
2.4Validasi Metoda Analisis
Validasi metoda analisis adalah suatu penilaian yang terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa
parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
2.4.1Kecermatan (Accuracy)
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai
kembali dapat ditentukan dengan cara membuat sampel plasebo (eksepien obat,
cairan biologis) kemudian ditambah analit dengan konsentrasi tertentu (biasanya 80% sampai 120% dari kadar analit yang diperkirakan), kemudian dianalisis dengan metode yang akan divalidasi. Tetapi bila tidak memungkinkan membuat
sampel plasebo karena matriksnya tidak diketahui seperti obat-obatan paten, atau karena analitnya berupa suatu senyawa endogen misalnya metabolit sekunder
pada kultur kalus, maka dapat dipakai metode adisi. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode tersebut. Persen perolehan kembali
ditentukan dengan menentukan berapa analit yang ditambahkan tadi dapat ditemukan (Harmita, 2004).
2.4.2Keseksamaan
Keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui pernyebaran hasil individual dari rata-rata jika
prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2004). Presisi harus dilakukan pada tiga
tingkatan yang berbeda yaitu : keterulangan (repeatibility), presisi antara
(intermediate precision) dan ketertiruan (reproducibility) (Gandjar dan Rohman, 2011).
Pengujian presisi pada saat awal validasi metode seringkali hanya menggunakan dua parameter yang pertama, yaitu: keterulangan dan presisi antara.
��� =��
�̅ �100%
Keterangan: �̅ : Kadar rata-rata sampel
SD : Standar Deviasi
RSD : Relative Standard Deviation
2.4.3Batas deteksi dan batas kuantifikasi
Batas Deteksi (limit of detection, LOD) didefinisikan sebagai konsentrasi
analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu
dapat dikuantifikasi. Batas Kuantifikasi (limit of quantification, LOQ)
BAB III
METODE PENELITIAN
3.1.Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Penelitian Fakultas Farmasi USU
pada bulan September – November 2014.
3.2. Bahan-bahan
3.2.1 Sampel
Sampel yang digunakan terdiri dari dua jenis yaitu kulit buah manggis
segar (KMS) dan kulit buah manggis kering (KMK)yang diambil secara purposif
di pusat perbelanjaan Carrefour jalan Gatot Subroto Medan, Sumatera utara.
3.2.2 Pereaksi
Semua bahan yang digunakan dalam penelitian ini berkualitas pro analisis
keluaran E. Merck yaitu larutan standar kalsium nitrat (konsentrasi 1000µg/mL),
kalium nitrat (konsentrasi 1000µg/mL) dan magnesium nitrat (konsentrasi
1000µg/mL) dan asam nitrat 65% b/v, kecuali aqua demineralisata (Laboratorium
Penelitian Fakultas Farmasi USU).
3.3 Alat-alat
Spektrofotmeter Serapan Atom (Hitachi Z-2000) dengan nyala
udara-asetilen lengkap dengan lampu katoda Ca, K, dan Mg; neraca analitik
(ANDGF-200); tanur (Stuart); hot plate; kertas saring Whatman no. 42; krus porselen;
3.4 Pembuatan Pereaksi HNO3 1:1
Larutan HNO3 65% b/v sebanyak 50 ml diencerkan dengan 50 ml air suling (Isaac, 1990).
3.5 Prosedur Penelitian
3.5.1Pengambilan sampel
Sampel KMS dan KMK yang terdiri dari kulit buah manggis yang diambil
di Pasar Swalayan Carrefour dengan metoda pengambilan sampel secara purposif.
Metode pengambilan secara purposif ini ditentukan atas dasar pertimbangan
bahwa sampel yang terambil mempunyai karakteristik yang sama dengan sampel yang ada dan dianggap sebagai sampel representatif (Sudjana, 2002).
3.5.2Penyiapan sampel
Penyiapan sampel dilakukan dilakukan dengan cara sebagai berikut:
1. Kulit buah manggis segar
Sebanyak 1 kg kulit buah manggis yang segar dibersihkan dari pengotoran, dicuci bersih, ditiriskan. Selanjutnya dikeringkan dengan cara
diangin-anginkan di udara terbuka terhindar dari sinar matahari langsung.
2. Kulit buah manggis kering
Sebanyak 1 kg kulit buah manggis yang segar dibersihkan dari
pengotoran, dicuci bersih, ditiriskan. Selanjutnya dikeringkan dengan cara diangin-anginkan di udara terbuka terhindar dari sinar matahari langsung.
3.5.3 Proses dekstruksi
Sampel yang telah disiapkan masing-masing ditimbang sebanyak 10 g,
dimasukkan ke dalam krus porselen, lalu diarangkan di atas hot plate selama 10
jam, kemudian diabukan dengan tanur pada temperatur awal 100°C dan dinaikkan
perlahan-lahan hingga 500°C dengan interval 25°C setiap 5 menit. Pengabuan dilakukan selama 60 jam dan dibiarkan hingga dingin dalam desikator. Abu
ditambahkan 5 mL larutan HNO3 (1:1), kemudian diuapkan pada hote plate
sampai kering. Krus porselen dimasukkan kembali ke tanur dengan temperatur awal 100°C dan dinaikkan perlahan-lahan hingga suhu 500°C dengan interval
25°C setiap 5 menit. Pengabuan dilakukan selama 1 jam dan dibiarkan hingga dingin dalam desikator (Isaac, 1990).
3.5.4Pembuatan larutan sampel
Sampel hasil destruksi dilarutkan dalam 5 mL HNO3 (1:1), lalu dimasukkan ke dalam labu tentukur 50 ml, krus porselen dibilas hingga tiga kali,
kemudian larutan dicukupkan dengan aqua demineralisata hingga garis tanda. Kemudian disaring dengan kertas Whatman No.42 dan 5 mL filtrat pertama
dibuang untuk menjenuhkan kertas saring kemudian filtrat selanjutnya ditampung dalam botol.
3.5.5 Analisis kuantitatif
3.5.5.1Pembuatan kurva kalibrasi kalsium
Larutan baku kalsium (1000 µg/ml) dipipet sebanyak 5 mL, dimasukkan
0,5; 1; 1,5; 2; dan 2,5 mL, dilarutkan dalam labu 25 mL dan dicukupkan sampai
garis tanda dengan aqua demineralisata sehingga didapatkan konsentrasi berturut-turut (1,0; 2,0; 3,0; 4,0; 5,0) µg/mL dan diukur pada panjang gelombang 422,7 nm dengan tipe nyala udara-asetilen.
3.5.5.2Pembuatan kurva kalibrasi kalium
Larutan baku kalium (1000 µg/mL) dipipet sebanyak 5 mL, dimasukkan
ke dalam labu tentukur 100 mL dan dicukupkan hingga garis tanda dengan aqua demineralisata (larutan induk baku II, konsentrasi 50 µg/mL). Larutan untuk kurva kalibrasi kalium dibuat dengan memipet larutan induk baku II sebanyak 1;
2; 3; 4; dan 5 mL, dilarutkan dalam labu 25 mL dan dicukupkan sampai garis tanda dengan aqua demineralisata sehingga didapatkan konsentrasi berturut-turut
(2,0; 4,0; 6,0; 8,0; 10,0) µg/mL dan diukur pada panjang gelombang 766,5 nm dengan tipe nyala udara-asetilen.
3.5.5.3Pembuatan kurva kalibrasi magnesium
Larutan baku magnesium (1000 µg/mL) dipipet sebanyak 1 mL, dimasukkan ke dalam labu tentukur 100 mL dan dicukupkan hingga garis tanda
dengan aqua demineralisata (larutan induk baku II, konsentrasi 10 µg/mL). Larutan untuk kurva kalibrasi magnesium dibuat dengan memipet larutan induk baku II sebanyak 1,5; 3; 4,5; 6; dan 7,5 mL, dilarutkan dalam labu 50 mL dan
dicukupkan sampai garis tanda dengan aqua demineralisata sehingga didapatkan konsentrasi berturut-turut (0,3; 0,6; 0,9; 1,2; 1,5) µg/mL dan diukur pada panjang
3.5.5.4Pengujian kandungan kalsium
Larutan sampel KMS (kulit buah manggis segar) dan KMK (kulit buah manggis kering) dipipet masing-masing sebanyak 2,5 mL dan 0,5 mL dimasukkan ke dalam labu tentukur 50 mL (faktor pengenceran masing-masing 20 kali dan
100 kali) dan dicukupkan dengan aqua demineralisata hingga garis tanda. Lalu diukur absorbansinya dengan menggunakan spektrofotometer serapan atom yang
telah dikondisikan dan diatur metodenya di mana pengujian kandungan kalsium dilakukan pada panjang gelombang 422,7 nm. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium. Konsentrasi
kalsium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.5.5Pengujian kandungan kalium
Larutan sampel KMS (kulit buah manggis segar) dan KMK (kulit buah manggis kering) dipipet masing-masing sebanyak 0,2 mL dan 0,1 mL dimasukkan
ke dalam labu tentukur 50 mL dan dicukupkan dengan aqua demineralisata hingga garis tanda (faktor pengenceran masing-masing 250 kali dan 500 kali). Lalu
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan di atur metodenya di mana pengujian kandungan kalium dilakukan pada panjang gelombang 766,5 nm. Nilai absorbansi yang diperoleh
harus berada dalam rentang kurva kalibrasi larutan baku kalium. Konsentrasi kalium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva
3.5.5.6Pengujian kandungan magnesium
Larutan sampel KMS (kulit buah manggis segar) dan KMK (kulit buah manggis kering) dipipet masing-masing sebanyak 0,5 mL dimasukkan ke dalam labu tentukur 50 mL dan dicukupkan dengan aqua demineralisata hingga garis
tanda (faktor pengenceran 100 kali). Lalu diukur absorbansinya dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan diatur
metodenya di mana pengujian kandungan magnesium dilakukan pada panjang gelombang 285,2 nm. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku magnesium. Konsentrasi magnesium dalam sampel
ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.5.7Perhitungan kadar kalsium, kalium, dan magnesium pada sampel Kadar kalsium, kalium, dan magnesium dalam sampel dapat dihitung dengan cara sebagai berikut:
Kadar (µg/g) =C × V × Fp W
Keterangan: C = Konsentrasi logam dalam larutan sampel (µg /mL)
V = Volume larutan sampel (mL)
Fp = Faktor pengenceran
W = Berat sampel (g)
3.5.6 Analisis data secara statistik
Menurut Gandjar dan Rohman (2011), kadar yang diperoleh dari hasil
pengukuran masing-masing larutan sampel dianalisis secara statistik dengan cara menghitung standar deviasi menggunakan rumus sebagai berikut:
��= �∑(Xin−1−X�)2
Keterangan: Xi = Kadar sampel
�� = Kadar rata-rata sampel
Kadar yang diperoleh dari hasil pengukuran masing-masing ke enam
larutan sampel, diuji secara statistik dengan uji T.
Untuk mengetahui data ditolak atau diterima dilakukan dengan uji T yang dapat dihitung dengan rumus:
thitung =
�
(Xi ��− X )√�
�
�
Hasil pengujian atau nilai thitung yang diperoleh ditinjau terhadap tabel distribusi t,
apabila thitung > ttabel maka data tersebut ditolak.
Menurut Sudjana (2002), untuk menentukan kadar suatu zat di dalam
sampel dengan tingkat kepercayaan 99%, α = 0,01, dk = n-1, dapat digunakan
rumus:
µ=�� ± �(½α,dk ) SD⁄√n
Keterangan: µ = kadar suatu zat
�� = kadar rata-rata sampel
t = harga t tabel sesuai dengan dk = n-1
α = tingkat kepercayaan
SD = standar deviasi
n = jumlah perlakuan
3.5.7Validasi metoda
3.5.7.1Uji perolehan kembali (Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode adisi
(penambahan baku). Dalam metode adisi dengan menambahkan sejumlah larutan
standar dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis. Persen perolehan kembali ditentukan dengan menentukan berapa persen analit
(konsentrasi 1000 µg/mL), dan 0,2 mL larutan baku magnesium (konsentrasi 1000
µg/mL).
Menurut Harmita (2004), Sampel yang telah dihaluskan ditimbang secara seksama sebanyak 10 g di dalam krus porselen, lalu ditambahkan 0,4 mL larutan
baku kalsium (konsentrasi 1000 µg/mL), 4 mL larutan baku kalium (konsentrasi 1000 µg/mL), dan 0,2 mL larutan baku magnesium (konsentrasi 1000 µg/mL),
kemudian dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya. Persen perolehan kembali dapat dihitung dengan rumus di bawah ini:
% Perolehan Kembali =CF−CA C∗A
× 100%
Keterangan: CA = Kadar logam dalam sampel sebelum penambahan baku
CF = Kadar logam dalam sampel setelah penambahan baku
C∗A = Kadar larutan baku yang ditambahkan
3.5.7.2Penentuan batas deteksi (Limit of Detection) dan batas kuantitasi (Limit of Quantitation)
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Sebaliknya, batas kuantitasi
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama.
Menurut Harmita (2004); Gandjar dan Rohman (2011), Batas deteksi dan
batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Simpangan Baku =�∑(Y−Yi )2
n−2
Batas Deteksi (LOD) =3��
Batas Kuantitasi ((LOQ) =10��
�����
3.5.7.3Uji keseksamaan (Presisi)
Uji keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode
dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode
yang dilakukan.
Menurut Harmita (2004) rumus untuk menghitung simpangan baku relatif adalah:
��� = ��
�� × 100%
Keterangan : �� = Kadar rata-rata sampel
SD = Standar Deviasi
BAB IV
HASIL DAN PEMBAHASAN
4.1Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh bagian Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi LIPI Bogor. Hasil identifikasi
menunjukkan bahwa tumbuhan yang digunakan adalah Manggis dengan jenis Garcinia Mangostana L. dari suku Clusiaceae. Data hasil identifikasi dapat dilihat pada Lampiran 1, halaman 36.
4.2Analisis Kuantitatif
4.2.1 Kurva kalibrasi kalsium, kalium, dan magnesium
Kurva kalibrasi kalsium, kalium, dan magnesium diperoleh dengan cara
mengukur absorbansi dari larutan baku kalsium, kalium, dan magnesium pada
panjang gelombang masing-masing. Hasil pengukuran kurva kalibrasi untuk kalsium, kalium, dan magnesium diperoleh persamaan garis regresi yaitu Y =
0,027831428 X + 0,000071429 untuk kalsium, Y = 0,04501 X – 0,011133334
untuk kalium, dan Y = 0,451685714 X + 0,005819047 untuk magnesium.
Y = 0,027831428 X + 0,000071429 r = 0,9997
Gambar 4.1. Kurva kalibrasi kalsium
[image:42.595.138.494.292.478.2]Y = 0,04501 X - 0,011133334 r = 0,9991
Gambar 4.2. Kurva kalibrasi kalium
Y = 0,451685714 X + 0,0058190047 r = 0,9996
[image:42.595.137.493.527.712.2]Berdasarkan kurva di atas diperoleh hubungan yang linear antara
konsentrasi dengan absorbansi, dengan kofisien korelasi (r) untuk kalsium sebesar
0,9997, kalium sebesar 0,9991, dan magnesium sebesar 0,9996. Nilai r ≥ 0,997
menunjukkan adanya korelasi linear antara X dan Y (Ermer dan McB. Miller,
2005).
4.2.2 Kadar kalsium, kalium, dan magnesium pada sampel
Konsentrasi kalsium, kalium, dan magnesium dalam sampel ditentukan berdasarkan persamaan garis regresi kurva kalibrasi. Data dapat dilihat pada Lampiran 6, halaman 43 dan contoh perhitungan dapat dilihat pada Lampiran 7,
halaman 44.
Pengujian dilanjutkan dengan perhitungan statistik (perhitungan dapat
[image:43.595.117.512.496.631.2]dilihat pada Lampiran 10, halaman 54; Lampiran 11, halaman 58; dan Lampiran 12, halaman 62). Hasil analisis kuantitatif kalsium, kalium, dan magnesium pada sampel dapat dilihat pada Tabel 4.1.
Tabel 4.1 Kadar Kalsium, Kalium, dan Magnesium pada Sampel KMS dan KMK
Mineral Kadar Sampel KMS
(mg/100 g)
Kadar Sampel KMK (mg/100 g)
Kalsium 37,5151 ± 2,3852 110,2301 ± 2,2960
Kalium 403,7570 ± 0,9088 1358,1438 ± 10,4440
Magnesium 20,9644 ± 0,5375 51,3023 ± 0,0874
Keterangan:
KMS = Kulit buah manggis segar KMK = Kulit buah manggis kering
Dari hasil analisis kuantitatif kalsium, kalium, dan magnesium, sesuai
kemungkinan terjadi karena mineral kalsium, kalium dan magnesium tidak ikut
menguap pada proses pengabuan.
Kalsium yang membutuhkan suhu yang tinggi dalam proses atomisasi hanya dapat teratomisasi sempurna menggunakan udara-asetilen dengan
menambah unsur penyangga seperti Sr dan La (Ganjar dan Rohman, 2011). Namun kekurangan unsur-unsur penyangga tersebut adalah bernilai mahal.
Sedangkan kalium pada dasarnya merupakan logam alkali yang dapat teratomisasi
sempurna dengan udara-propana ataupun dapat menggunakan grafit furnance
akan tetapi dalam hal ini keterbatasan alat dan bahan sangat diperhitungkan.
4.2.3 Batas deteksi dan batas kuantitasi
Berdasarkan data kurva kalibrasi kalsium, kalium, dan magnesium
[image:44.595.115.510.470.535.2]diperoleh batas deteksi dan batas kuantitasi untuk mineral tersebut. Batas deteksi dan batas kuantitasi kalsium, kalium, dan magnesium dapat dilihat pada Tabel 4.2.
Tabel 4.2 Batas Deteksi dan Batas Kuantitasi Kalsium, Kalium, dan Magnesium
Mineral Batas Deteksi (µg/ml) Batas Kuantitasi (µg/ml)
Kalsium 0,1567 0,5224
Kalium 0,5264 1,7547
Magnesium 0,0556 0,1853
Dari hasil perhitungan dapat dilihat bahwa semua hasil yang diperoleh pada pengukuran sampel berada diatas batas deteksi dan batas kuantitasi. Perhitungan
batas deteksi dan batas kuantitasi dapat dilihat pada Lampiran 15, halaman 70.
4.2.4 Uji perolehan kembali (Recovery)
Hasil uji perolehan kembali (Recovery) kalsium, kalium, dan magnesium
setelah penambahan larutan baku dalam sampel dapat dilihat pada Lampiran 16,
sampel dapat dilihat pada Lampiran 17, halaman 76. Persen recovery kalsium,
kalium, dan magnesium pada sampel dapat dilihat pada Tabel 4.3.
Tabel 4.3 Persen Uji Perolehan Kembali (recovery) Kalsium, Kalium, dan Magnesium pada Sampel
No Mineral yang
dianalisis
Recovery (%) Syarat rentang persen Recovery (%)
1. Kalsium 101,61 80-120
2. Kalium 93,82 80-120
3. Magnesium 93,24 80-120
Berdasarkan Tabel 4.3 di atas, dapat dilihat bahwa rata-rata hasil uji
perolehan kembali (recovery) untuk kalsium 101,61%, kalium 93,82%, dan
magnesium 93,24%. Persen perolehan kembali tersebut menunjukkan kecermatan kerja yang memuaskan pada pengujian kandungan kalsium, kalium, dan
magnesium pada sampel. Hasil yang diperoleh dari uji perolehan kembali (recovery) ini memenuhi syarat akurasi yang telah ditetapkan, jika rata-rata hasil
perolehan kembali berada pada rentang 80-120% (Ermer dan McB. Miller, 2005). 4.2.5 Simpangan baku relatif
Nilai simpangan baku dan simpangan baku relatif untuk kalsium, kalium,
[image:45.595.114.510.587.646.2]dan magnesium dapat dilihat pada Tabel 4.4, sedangkan perhitungannya dapat dilihat pada Lampiran 18, halaman 77.
Tabel 4.4 Nilai Simpangan Baku dan Simpangan Baku Relatif Kalsium, Kalium, dan Magnesium
No. Mineral Simpangan Baku Simpangan Baku Relatif
1. Kalsium 7,1509 7,04%
2. Kalium 9,7665 10,41%
3. Magnesium 10,8700 11,66%
Berdasarkan Tabel 4.4 di atas, dapat dilihat nilai simpangan baku (SD) untuk kalsium adalah sebesar 7,1509, kalium adalah sebesar 9,7665, dan
sebesar 7,04% untuk kalsium dan 10,41% untuk kalium, dan 11,66% untuk
magnesium. Menurut Harmita (2004), nilai simpangan baku relatif (RSD) untuk
analit dengan kadar part per million (ppm) adalah tidak lebih dari 16% dan untuk
analit dengan kadar part per billion (ppb) RSD nya adalah tidak lebih dari 32%.
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Pengujian secara kuantitatif dengan menggunakan spektrofotometer serapan atom menunjukkan kadar kalsium pada kulit buah manggis segar sebesar
(37,5151 ± 2,3852) mg/100 g dan pada kulit buah manggis kering sebesar (110,2301 ± 2,2960) mg/100 g. Kalium pada kulit buah manggis segar sebesar (403,7570 ± 0,9088) mg/100 g dan pada kulit buah manggis kering sebesar
(1358,1438 ± 10,1438) mg/100 g. Magnesium pada kulit buah manggis segar sebesar (20,9644 ± 0,5375) mg/100g dan pada kulit buah manggis kering sebesar
(51,3023 ± 0,0874) mg/100 g. Data tersebut menunjukkan bahwa kandungan kalsium, kalium, dan magnesium pada kulit buah manggis kering lebih tinggi dari pada kulit buah manggis segar.
5.2Saran
1. Disarankan kepada peneliti selanjutnya untuk menguji kandungan mineral
kalsium, kalium dan magnesium pada air rebusan kulit buah manggis segar dan kulit buah manggis kering.
2. Disarankan kepada peneliti selanjutnya untuk menguji kandungan mineral lain
DAFTAR PUSTAKA
Adi, L. T. (2008). Tanaman Obat dan Jus. Cetakan I. Jakarta: Agromedia
Pustaka. Hal. 123.
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia Pustaka
Utama. Hal. 228.
Anonim. (2013). Manfaat Kulit Buah manggis Untuk Asam Urat.
file:///E:/Manfaat%20Kulit%20Manggis%20Untuk%20Mengatasi%20Asa m%20Urat.htm diakses pada tanggal 08 Juli 2014.
Anonim. (2014). Manfaat Kulit Manggis Untuk Pengobatan.
file:///E:/Manfaat%20Kulit%20Buah%20Manggis%20untuk%20Pengobat an%20%20%20Alami%20Ilmiah.htm diakses pada tanggal 08 Juli 2014.
Barasi, M. E. (2007). Nutrition at a Glance. Penerjemah: Halim, H. (2009). At a
Glance Ilmu Gizi. Jakarta: Penerbit Airlangga. Hal. 53.
Budiyanto, M. A. K. (2004) Dasar-dasar Ilmu Gizi. Cetakan III. Malang: UMM
Pres. Hal. 60, 65, 66.
Devi, N. (2010). Nutrition And Food Gizi Untuk Keluarga. Jakarta: Buku
Kompas. Hal. 94.
Ermer, J., dan McB. Miller, J. H. (2005). Method Validation in Pharmaceutical
Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co.KGaA. Hal. 250, 253.
Gandjar, I. G., dan Rohman, A. (2011). Kimia Farmasi Analisis. Cetakan VIII.
Yogyakarta: Pustaka Pelajar. Hal. 298-322.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara
Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. 1(3): 117,
118, 120, 123, 132.
Herbarium Bogoriense. (2014). Identifikasi Tumbuhan. Bogor: Lembaga Ilmu
Pengetahuan Indonesia.
Isaac, R. A. (1990). Metal in Plants. Dalam: Helrich, K. (1990). Official Methods
Kee, J. L., dan Hayes, E. R. (1993). Pharmacology: A Nursing Process Approach.
Penerjemah: Anugerah, P. (1996). Farmakologi. Pendekatan Proses
Keperawatan. Cetakan I. Jakarta: EGC. Hal. 179.
Khopkar, S. M. (1984). Basic Concepts of Anayitical Chemistry. Penerjemah:
Saptoraharjo, A., dan Nurhadi, A. (2008). Konsep Dasar Kimia Analitik.
Jakarta: UI-Press. Hal. 296.
Mangan, Y. (2009). Solusi Sehat Mencegah dan Mengatasi kanker. Cetakan I.
Agromedia Pustaka. Hal. 54.
Mardiana, L. (2013). Ramuan dan Khasiat Kulit Manggis. Cetakan V. Jakarta:
Penebar Swadaya. Hal:14.
Poedjiadi, A. dan Supriyanti. T. (2006). Dasar-Dasar Biokimia. Jakarta:
UI-Press. Hal. 420.
Rukmana, H. R. (2012). Bertanam Buah Buahan di Pekarangan. Cetakan V.
Yogyakarta: Penerbit Kanisius. Hal. 49.
Rukmana, H.R. (2007). Bibit Manggis. Cetakan V. Yogyakarta: Penerbit
Kanisius.Hal. 16,17.
Sudjana. (2002). Metode Statistika. Cetakan II. Edisi VI. Bandung: Tarsito. Hal.
168, 227, 249.
Suhardjo., dan Kusharto, C. M. (2000). Prinsip-Prinsip Ilmu Gizi. Cetakan VII.
Yogyakarta: Kanisius. Hal. 73.
Tim Redaksi Vitahealt (2006). Seluk Beluk Food Supplement. Jakarta: PT.
Gramedia Pustaka Utama. Hal.102.
Tjitrosupomo, G. (2000). Taksonomi Tumbuhan (Spermatophyta). Jakarta: Gajah
Lampiran 2. Gambar Sampel Kulit Buah Manggis
Kulit Buah Manggis Segar (KMS)
[image:51.595.213.412.358.523.2]Lampiran 3. Gambar Alat-Alat yang Digunakan
Spektrofotometer Serapan Atom Hitachi Z-2000
[image:52.595.189.436.380.718.2]Lanjutan Lampiran 3
Lampiran 4. Bagan Alir Proses Dekstruksi Kering
1. Bagan alir proses dekstruksi sampel I
Dibersihkan dari pengotoran
Dicuci dengan air mengalir, dan dibilas dengan
aqua demineralisata
Ditiriskan dan dikeringkan dengan cara diangin-
anginkan dan dipotong-potong kira-kira ± 2 cm
Abu
Ditimbang sebanyak 10 g di atas krus porselen
Diarangkan di atas hot plate selama 10 jam
Diabukan di tanur dengan temperatur awal 100oC
dan perlahan-lahan temperatur dinaikkan menjadi
500oC dengan interval 25oC setiap 5 menit
Dilakukan selama 60 jam dan dibiarkan dingin
pada desikator Sampel yang telah di potong-potong
Kulit Buah manggis
Ditambahkan 5 ml HNO3 (1:1)
Diuapkan diatas hot plate sampai kering
Ditanur kembali dengan temperatur awal 100oC
dan perlahan-lahan temperatur dinaikkan menjadi
500oC dengan interval 25oC setiap 5 menit
Dilakukan selama 1 jam dan dibiarkan dingin
Lanjutan Lampiran 4
2. Bagan alir proses dekstruksi sampel II
Dibersihkan dari pengotoran
Dicuci dengan air mengalir, dan dibilas dengan
aqua demineralisata
Ditiriskan dan dikeringkan dengan cara diangin-
anginkan dan dipotong-potong kira-kira ± 2 cm
Dikeringkan dalam lemari pengering selama 3 hari
Abu
Ditimbang sebanyak 10 g di atas krus porselen
Diarangkan diatas hot plate selama 8 jam
Diabukan di tanur dengan temperatur awal 100oC
dan perlahan-lahan temperatur dinaikkan menjadi
500oC dengan interval 25oC setiap 5 menit
Dilakukan selama 60 jam dan dibiarkan dingin
pada desikator Kulit Buah Manggis Kering
Kulit Buah Manggis Segar
Ditambahkan 5 ml HNO3 (1:1)
Diuapkan diatas hot plate sampai kering
Ditanur kembali dengan temperatur awal 100oC
dan perlahan-lahan temperatur dinaikkan menjadi
500oC dengan interval 25oC setiap 5 menit
Dilakukan selama 1 jam dan dibiarkan dingin
Lampiran 5. Bagan Alir Pembuatan Larutan Sampel
Hasi destruksi kering
Dilarutkan dalam 5 ml HNO3 (1:1)
Dimasukkan ke dalam labu tentukur 50 ml
Dibilas Krus porselen dengan akuabides sebanyak
3 kali
Dicukupkan volumenya dengan akua-
demineralisata sampai garis tanda
Disaring dengan kertas Whatman No.42 dengan
membuang 5 ml untuk menjenuhkan kertas saring Larutan Sampel
Dilakukan analisa kuantitatif dengan
spektrofotometer serapan atom pada λ 422,7 nm
untuk kalsium, λ 766,50 nm untuk kalium dan
pada λ 285,2 nm untuk magnesium
Lampiran 6. Data Hasil Pengukuran Absorbansi Larutan Standar Kalsium, Kalium, dan Magnesium
1. Data Hasil Pengukuran Absorbansi Larutan Standar Kalsium
No Konsentrasi (µg/ml)
(X)
Absorbansi (Y)
1 0,0000 0,0002
2 1,0000 0,0284
3 2,0000 0,0559
4 3,0000 0,0812
5 4,0000 0,1130
6 5,0000 0,1392
2. Data Hasil Pengukuran Absorbansi Larutan Standar Kalium
No Konsentrasi (µg/ml)
(X)
Absorbansi (Y)
1 0,0000 -0,0009
2 2,0000 0,0685
3 4,0000 0,1670
4 6,0000 0,2551
5 8,0000 0,3527
6 10,0000 0,4411
3. Data Hasil Pengukuran Absorbansi Larutan Standar Magnesium
No Konsentrasi (µg/ml)
(X)
Absorbansi (Y)
1 0,0000 -0,0003
2 0,3000 0,1376
3 0,6000 0,2864
4 0,9000 0,4203
5 1,2000 0,5487
Lampiran 7. Perhitungan Persamaan Garis Regresi
1. Perhitungan Persamaan Garis Regresi Kalsium
No X Y X2 Y2 XY
1. 0,0000 0,0002 0,0000 0,0000 0,0000
2. 1,0000 0,0284 1,0000 0,0008 0,0284
3. 2,0000 0,0559 4,0000 0,0031 0,1118
4. 3,0000 0,0812 9,0000 0,0065 0,2436
5. 4,0000 0,1130 16,0000 0,0127 0,5420
6. 5,0000 0,1392 25,0000 0,0194 0,6960
∑ 15,0000
2,5000
=
X
0,41790,0697
=
Y
55,0000 0,0427 1,5318
027831428 , 0 6 ) 15 ( 55 6 ) 4179 , 0 )( 15 ( 5318 , 1 ) ( 2 2 2 = − − = ∑ − ∑ ∑ ∑ − ∑ = n X X n Y X XY a 000071429 , 0 ) 5 , 2 )( 027831428 , 0 ( 0697 , 0 = − = − = + = X a Y b X a Y
Lanjutan Lampiran 7
{
}{
}
{
}{
}
9997 , 0 9232 , 2 9223 , 2 ) 4179 , 0 ( ) 0427 , 0 ( 6 ) 15 ( ) 55 ( 6 ) 4179 , 0 )( 15 ( ) 5318 , 1 ( 6 ) ( ) ( 2 2 2 2 2 2 = = − − − = − − ∑ ∑ − ∑ =∑
∑
∑
X∑
X n Y Y n Y X XY n r2. Perhitungan Persamaan Garis Regresi Kalium
No X Y X2 Y2 XY
1. 0,0000 -0,0009 0,0000 0,0000 0,0000
2. 2,0000 0,0685 4,0000 0,0047 0,1370
3. 4,0000 0,1670 16,0000 0,0279 0,6680
4. 6,0000 0,2551 36,0000 0,0651 1,5306
5. 8,0000 0,3527 64,0000 0,1244 2,8216
6. 10,0000 0,4411 100,0000 0,1946 4,4110
∑ 30,0000
5,0000
=
X
1,28350,2139
=
Y
220,0000 0,4166 9,5682
Lanjutan Lampiran 7 01113 , 0 ) 5 )( 0450 , 0 ( 2139 , 0 − = − = − = + = X a Y b X a Y
Maka persamaan garis regresinya adalah : Y=0,04501 X – 0,01113
{
}{
}
{
}{
}
9991 , 0 9192 , 18 9042 , 18 ) 2835 , 1 ( ) 4166 , 0 ( 6 ) 30 ( ) 220 ( 6 ) 2835 , 1 )( 30 ( ) 5682 , 9 ( 6 ) ( ) ( 2 2 2 2 2 2 = = − − − = − − ∑ ∑ − ∑ =∑
∑
∑
X∑
X n Y Y n Y X XY n r3. Perhitungan Persamaan Garis Regresi Magnesium
No X Y X2 Y2 XY
1. 0,0000 -0,0003 0,0000 0,0000 0,0000
2. 0,3000 0,1376 0,0900 0,0189 0,0413
3. 0,6000 0,2864 0.3600 0,0820 0,1718
4. 0,9000 0,4203 0,8100 0,1766 0,3783
5. 1,2000 0,5487 1,4400 0,3011 0,6584
6. 1,5000 0,6748 2,2500 0,4554 1,0122
Lanjutan Lampiran 7 451685714 , 0 6 ) 5 , 4 ( 95 , 4 6 ) 0675 , 2 )( 5 , 4 ( 2620 , 2 ) ( 2 2 2 = − − = ∑ − ∑ ∑ ∑ − ∑ = n X X n Y X XY a 005819047 , 0 ) 75 , 0 )( 451685714 , 0 ( 3446 , 0 = − = − = + = X a Y b X a Y
Maka persamaan garis regresinya adalah : Y=0,451685714 X +0,005819047
Lampiran 8. Hasil Analisis Kalsium, Kalium, dan Magnesium dalam Sampel
A. Sampel Kulit Buah Manggis Segar
1. Hasil Analisis Kalsium
No. Sampel
Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100 g)
1. 10,0086 0,1050 3,7702 37,6696
2. 10,0140 0,1041 3,7360 37,3078
3. 10,0090 0,1042 3,7396 37,3624
4. 10,0152 0,1048 3,7630 37,5729
5. 10,0111 0,1089 3,7648 37,6063
6. 10,0107 0,1048 3,7612 37,5718
2. Hasil Analisis Kalium
No. Sampel
Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100 g)
1. 10,0086 0,1341 3,2267 402,9909
2. 10,0140 0,1346 3,2367 404,0219
3. 10,0090 0,1345 3,2345 403,9489
4. 10,0152 0,1347 3,2401 404,3978
5. 10,0111 0,1342 3,2289 403,1650
6. 10,0107 0,1345 3,2356 404,0177
3. Hasil Analisis Magnesium
No. Sampel
Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100 g)
1. 10,0086 0,1999 0,4297 21,4665
2. 10,0140 0,1976 0,4246 21,2003
3. 10,0090 0,1942 0,4171 20,8362
4. 10,0152 0,1956 0,4202 20,9781
5. 10,0111 0,1934 0,4152 20,7370
Lanjutan Lampiran 8
B. Sampel Kulit Buah Manggis Kering
1. Hasil Analisis Kalsium
No. Sampel
Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100 g)
1. 10,0552 0,0620 2,2233 110,5877
2. 10,0436 0,0610 2,1892 108,9848
3. 10,0480 0,0605 2,1713 108,0464
4. 10,0509 0,0622 2,2305 110,9602
5. 10,0482 0,0624 2,2377 111,3483
6. 10,0468 0,0624 2,2395 111,4534
2. Hasil Analisis Kalium
No. Sampel
Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100 g)
1. 10,0552 0,2334 5,4318 1350,8983
2. 10,0436 0,2356 5,4806 1364,2021
3. 10,0480 0,2357 5,4840 1364,4506
4. 10,0509 0,2332 5,4273 1349,9537
5. 10,0482 0,2348 5,4629 1359,1738
6. 10,0468 0,2349 5,4662 1360,1843
3. Hasil Analisis Magnesium
No. Sampel
Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/mL)
Kadar (mg/100 g)
1. 10,0552 0,4724 1,0330 51,3818
2. 10,0436 0,4716 1,0312 51,3363
3. 10,0480 0,4715 1,0309 51,2988
4. 10,0509 0,4713 1,0306 51,2690
5. 10,0482 0,4708 1,0295 51,2281
Lampiran 9. Contoh Perhitungan Kadar Kalsium, Kalium, dan Magnesium Dalam Sampel
A. Contoh Perhitungan Kadar Kalsium, Kalium, dan Magnesium pada Kulit
Buah Manggis Segar
1. Contoh Perhitungan Kadar Kalsium
Berat sampel yang ditimbang = 10,0086 g
Absorbansi (Y) = 0,1050
Persamaan regresi : Y=0,027831428 X + 0,000071429
mL g
X 3,7702
µ
027831428 , 0 000071429 , 0 1050 ,
0 − =
=
Konsentrasi Kalsium = 3,7702
µ
gmL2. Contoh Perhitungan Kadar Kalium
Berat sampel yang ditimbang = 10,0086 g
Absorbansi (Y) = 0,1341
Persamaan regresi : Y=0,04501 X – 0,011133334
mL g
X 3,2267
µ
04501 , 0 011133334 , 0 1341 ,
0 + =
Konsentrasi Kalsium = 3,2267 µg/mL
Lanjutan Lampiran 9
3. Contoh Perhitungan Kadar Magnesium
Berat sampel yang ditimbang = 10,0086 g
Absorbansi (Y) = 0,1999
Persamaan regresi : Y=0,451685714 X + 0,005819047
mL g
X 0,4297
µ
451685714 , 0 005819047 , 0 1999 ,
0 − =
=
Konsentrasi Kalsium = 0,4297
Lanjutan Lampiran 9
B. Contoh Perhitungan Kadar Kalsium, Kalium, dan Magnesium pada Kulit
Buah Manggis Kering
1. Contoh Perhitungan Kadar Kalsium
Berat sampel yang ditimbang = 10,0436 g
Absorbansi (Y) = 0,0610
Persamaan regresi : Y=0,027831428 X + 0,000071429
mL g
X 2,1892
µ
027831428 , 0 000071429 , 0 0610 , 0 = − =
Konsentrasi Kalsium = 2,1892
mL g
µ
2. Contoh Perhitungan Kadar Kalium
Berat sampel yang ditimbang = 10,0480 g
Absorbansi (Y) = 0,2357
Persamaan regresi : Y=0,04501 X – 0,011133334
mL g
X 5,4840
µ
04501 , 0 011133334 , 0 2357 , 0 = + =
Konsentrasi Kalsium = 5,4840
Lanjutan Lampiran 9
3. Contoh Perhitungan Kadar Magnesium
Berat sampel yang ditimbang = 10,0552 g
Absorbansi (Y) = 0,4724
Persamaan regresi : Y=0,451685714 X + 0,005819047
mL g
X 1,03330
µ
451685714 , 0 005819047 , 0 4724 ,
0 − =
=
Konsentrasi Kalsium = 1,0330
Lampiran 10. Perhitungan Statistik Kadar Kalsium dalam Sampel
1. Perhitungan Statistik Kadar Kalsium pada Kulit Buah Manggis Segar
No. Xi
Kadar (mg/100 g) Xi−X
2
)
(
Xi
−
X
1 37,6696 0,1545 0,0239
2 37,3078 -0,2073 0,0430
3 37,3624 -0,1527 0,0233
4 37,5729 0,0578 0,0033
5 37,6063 0,0911 0,0083
6 37,5718 0,0567 0,0032
∑ 225,0907
5151
,
37
=
X
0,1050 g mg/100 4490 , 1 1 6 1050 , 0 1 ) ( 2 = − = − − =∑
n X Xi SDPada interval kepercayaan 99% dengan nilai α = 0,01 dk = 5 diperoleh nilai ttabel =
α/2, dk = 4,0321
Data diterima jika thitung < ttabel
Thitung = n SD X