KENDALI STABILITAS BETA KAROTEN SELAMA PROSES
PRODUKSI TEPUNG UBI JALAR (Ipomoea batatas L.)
CHRISTINA MUMPUNI ERAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
CHRISTINA MUMPUNI ERAWATI. Kendali stabilitas beta karoten selama proses produksi tepung ubi jalar (Ipomoea batatas L.). Dibimbing oleh TIEN R. MUCHTADI dan PURWIYATNO HARIYADI.
Ubi jalar (Ipomoea batatas L.) terutama yang berdaging umbi warna oranye atau kuning memiliki potensi unggulan pada kandungan beta karoten (provitamin A) yang tinggi dan memiliki banyak manfaat bagi tubuh, karena selain mampu memenuhi kebutuhan vitamin A juga berfungsi sebagai antioksidan untuk melawan radikal bebas dalam tubuh. Pengolahan ubi jalar menjadi tepung adalah salah satu usaha untuk mendapatkan produk setengah jadi dari komoditas ini sehingga mampu memperbanyak aplikasi dan daya simpan komoditas ini pada masa-masa berikutnya. Namun demikian, adanya ikatan rangkap pada struktur kimia beta karoten menyebabkan bahan ini menjadi sangat sensitif terhadap reaksi oksidasi ketika terkena udara (O2), cahaya, metal, peroksida, dan panas selama proses produksi maupun aplikasinya. Kandungan beta karoten yang sudah menyusut selama proses pengolahan tepung ini akan semakin menyusut pada proses aplikasinya (misalnya untuk pembuatan roti atau mie kering). Kondisi ini terjadi jika proses pengolahan dilakukan tanpa pengendalian dan perlindungan, sehingga pada akhirnya kandungan beta karoten yang seharusnya bermanfaat tinggi menjadi hilang percuma selama itu.
Penelitian ini menggunakan bahan baku berupa ubi jalar berdaging umbi warna oranye dan kuning. Penelitian dilakukan untuk mengendalikan stabilitas beta karoten selama proses produksi tepung ubi jalar hingga diperoleh retensi beta karoten tertinggi. Nilai korelasi tertinggi antara pengukuran warna menggunakan kromameter dalam sistem tristimulus Hunter dengan pengukuran kadar beta karoten tepung ubi jalar menggunakan HPLC dicapai pada nilai C dan b, masing-masing sebesar 0,86 dan 0,85. Selain itu, dengan adanya faktor-faktor perusak struktur trans beta karoten berupa oksigen dan panas maka telah ditetapkan titik-titik kendali selama proses produksi tepung ubi jalar yaitu pada tahap blanching, pengeringan dan penepungan.
Tepung ubi jalar yang dihasilkan memiliki kadar trans beta karoten pada kisaran 103,94 - 207,39 μg/g. Faktor yang paling berpengaruh terhadap stabilitas beta karoten selama penyimpanan adalah adanya oksigen pada headspace
KENDALI STABILITAS BETA KAROTEN SELAMA
PROSES PRODUKSI TEPUNG UBI JALAR (Ipomoea batatas L.)
CHRISTINA MUMPUNI ERAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kendali Stabilitas Beta Karoten selama Proses Produksi Tepung Ubi Jalar (Ipomoea batatas L.)
Nama : Christina Mumpuni Erawati NRP : F251034061
Disetujui, Komisi Pembimbing
Prof. Dr. Ir. Tien R. Muchtadi, MS Dr. Ir. Purwiyatno Hariyadi, MSc. Ketua Anggota
Mengetahui,
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Dr. Ir. Khairil Anwar Notodiputro, MS
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kendali Stabilitas Beta Karoten selama Proses Produksi Tepung Ubi Jalar (Ipomoea batatas L.) adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 26 Desember 1975 dari ayah Sukarjono (alm) dan ibu Ennatha Surtinah. Penulis merupakan anak keenam dari enam bersaudara. Pendidikan sarjana ditempuh di Jurusan Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Universitas Gadjah Mada, lulus pada tahun 1999. Sejak tahun 2000 hingga 2001 bekerja di PT Riau Sakti United Plantation Industry pada Quality Assurance Department yang kemudian ditempatkan di Production Planning and Inventory Control (PPIC Department) untuk divisi Nanas Kaleng. Pada tahun 2001 hingga 2004 bekerja di PT Freyabadi Indotama pada Manufacturing Department untuk Production Planning and Inventory Control coklat olahan, yang bertanggungjawab membuat dan mengkoordinasikan rencana produksi dan rencana pengiriman.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan YME atas segala berkat dan anugerahNya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilakukan pada bulan Maret 2005 hingga Maret 2006 ini berjudul Kendali Stabilitas Beta Karoten selama Proses Produksi Tepung Ubi Jalar (Ipomoea batatas L.).
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Prof. Dr. Ir. Tien R. Muchtadi, MS sebagai dosen pembimbing pertama yang telah memberikan bimbingan, pengarahan, nasehat dan dorongan semangat kepada penulis. Serta kepada Dr. Ir. Purwiyatno Hariyadi, MSc sebagai dosen pembimbing kedua yang telah memberikan komitmen, bimbingan dan semangat selama penelitian hingga penulisan tesis ini.
Ucapan terima kasih sebesar-besarnya penulis sampaikan pula kepada Ir Budianto Wijaya, MAppSc. sebagai penguji luar komisi atas kesediaan, bimbingan dan wacananya untuk penulisan tesis ini, panitia Bogasari Nugraha 2004 yang telah memberikan bantuan dana penelitian ini, Central International Potato, Muara – Bogor dan Dr. Jusuf di Balai Penelitian Kacang-kacangan dan Umbi-umbian, Malang atas penyediaan bahan baku penelitian ini.
Kepada teman-teman Ilmu Pangan 2002, 2003, 2004 dan 2005, pihak-pihak di Laboratorium Seafast, ITP, Pasca panen, dan PT Mbrio Biotekindo yang tidak dapat penulis sebutkan satu per satu (mohon dimaafkan) serta mBak Mar dan Pak Ade, terima kasih atas segala bantuannya selama penelitian.
Akhirnya, terima kasih kepada keluarga, suami tercinta C. Perwira Jati Wicaksana, SE atas segala doa dan kesabarannya mendukung dan membantu penulis hingga dapat menyelesaikan studi ini. Kepada ayahanda (alm) dan ibunda atas segala doa dan dukungannya. Juga kepada papah (alm), mamah mertua, kakak-kakak dan adik-adik semua atas segala doa dan dorongannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2006
DAFTAR ISI
Halaman
DAFTAR TABEL ……….….……… vii
DAFTAR GAMBAR………..……… viii
DAFTAR LAMPIRAN ……….. ix
PENDAHULUAN.. ………..………….... 1
Latar Belakang ……… 1
Tujuan Penelitian ………. 2
Kerangka Pemikiran ………. 3
Hipotesa ……… 4
Manfaat Penelitian ……… 4
TINJAUAN PUSTAKA ……… 5
Ubi jalar ……… 5
Tepung ubi jalar ……… 9
Karotenoid dan Beta Karoten ……… 11
Stabilitas Beta Karoten ………. 15
Hubungan Absorbansi Warna dengan Konsentrasi Pigmen ……. 19
METODOLOGI PENELITIAN ……… 21
Tempat dan Waktu Penelitian ……… 21
Bahan dan Alat ……… 21
Metode Penelitian ……… 21
Prosedur Analisis ……… 25
HASIL DAN PEMBAHASAN ……… 30
Karakterisasi Bahan …...……… 30
Penelitian Pendahuluan ………. 30
Pemilihan pelarut untuk ekstraksi karotenoid ubijalar ……… 30
Pemilihan fase gerak untuk analisis HPLC ……… 35
Penelitian Inti ……… 38
Analisa Efek O2, Cahaya dan Panas Selama Proses Produksi .... 40
Penetapan Alat Ukur in line Produksi ……… 46
Perlakuan-perlakuan untuk pengendalian stabilitas beta karoten selama proses produksi tepung ubi jalar………. 48
Stabilitas Beta Karoten selama Proses Produksi ... 50
DAFTAR TABEL
Halaman
Tabel 1. Produksi dan distribusi panen ubi jalar per tahun ………. 5
Tabel 2. Komponen nutrisi utama ubi jalar ………. …. ……….. 8
Tabel 3. Polaritas relatif berbagai pelarut (Adnan 1997) ...32
Tabel 4. Hasil perhitungan luas permukaan tepung dan beta karoten...34
Tabel 5. Tabel kendali proses ………..………… 41
Tabel 6. Hasil perhitungan kadar beta karoten pada tahap blanching…... 42
Tabel 7. Data pengukuran warna dari 2 alat pengering yang berbeda … 43 Tabel 8. Hasil pengamatan warna menggunakan kromameter selama proses produksi tepung ubi jalar oranye tanpa perlakuan perendaman bahan pelindung ………..……... 45
Tabel 9. Kadar beta karoten dan pengukuran warna tepung perlakuan… 47 Tabel 10. Perkiraan % degradasi beta karoten selama produksi ... 50
Tabel 11. Perkiraan % degradasi beta karoten selama produksi ...…... 51
Tabel 12. Kadar beta karoten selama penyimpanan … ………... 52
Tabel 13. % penurunan kadar trans beta karoten selama penyimpanan .... 53
KENDALI STABILITAS BETA KAROTEN SELAMA PROSES
PRODUKSI TEPUNG UBI JALAR (Ipomoea batatas L.)
CHRISTINA MUMPUNI ERAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
CHRISTINA MUMPUNI ERAWATI. Kendali stabilitas beta karoten selama proses produksi tepung ubi jalar (Ipomoea batatas L.). Dibimbing oleh TIEN R. MUCHTADI dan PURWIYATNO HARIYADI.
Ubi jalar (Ipomoea batatas L.) terutama yang berdaging umbi warna oranye atau kuning memiliki potensi unggulan pada kandungan beta karoten (provitamin A) yang tinggi dan memiliki banyak manfaat bagi tubuh, karena selain mampu memenuhi kebutuhan vitamin A juga berfungsi sebagai antioksidan untuk melawan radikal bebas dalam tubuh. Pengolahan ubi jalar menjadi tepung adalah salah satu usaha untuk mendapatkan produk setengah jadi dari komoditas ini sehingga mampu memperbanyak aplikasi dan daya simpan komoditas ini pada masa-masa berikutnya. Namun demikian, adanya ikatan rangkap pada struktur kimia beta karoten menyebabkan bahan ini menjadi sangat sensitif terhadap reaksi oksidasi ketika terkena udara (O2), cahaya, metal, peroksida, dan panas selama proses produksi maupun aplikasinya. Kandungan beta karoten yang sudah menyusut selama proses pengolahan tepung ini akan semakin menyusut pada proses aplikasinya (misalnya untuk pembuatan roti atau mie kering). Kondisi ini terjadi jika proses pengolahan dilakukan tanpa pengendalian dan perlindungan, sehingga pada akhirnya kandungan beta karoten yang seharusnya bermanfaat tinggi menjadi hilang percuma selama itu.
Penelitian ini menggunakan bahan baku berupa ubi jalar berdaging umbi warna oranye dan kuning. Penelitian dilakukan untuk mengendalikan stabilitas beta karoten selama proses produksi tepung ubi jalar hingga diperoleh retensi beta karoten tertinggi. Nilai korelasi tertinggi antara pengukuran warna menggunakan kromameter dalam sistem tristimulus Hunter dengan pengukuran kadar beta karoten tepung ubi jalar menggunakan HPLC dicapai pada nilai C dan b, masing-masing sebesar 0,86 dan 0,85. Selain itu, dengan adanya faktor-faktor perusak struktur trans beta karoten berupa oksigen dan panas maka telah ditetapkan titik-titik kendali selama proses produksi tepung ubi jalar yaitu pada tahap blanching, pengeringan dan penepungan.
Tepung ubi jalar yang dihasilkan memiliki kadar trans beta karoten pada kisaran 103,94 - 207,39 μg/g. Faktor yang paling berpengaruh terhadap stabilitas beta karoten selama penyimpanan adalah adanya oksigen pada headspace
KENDALI STABILITAS BETA KAROTEN SELAMA
PROSES PRODUKSI TEPUNG UBI JALAR (Ipomoea batatas L.)
CHRISTINA MUMPUNI ERAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kendali Stabilitas Beta Karoten selama Proses Produksi Tepung Ubi Jalar (Ipomoea batatas L.)
Nama : Christina Mumpuni Erawati NRP : F251034061
Disetujui, Komisi Pembimbing
Prof. Dr. Ir. Tien R. Muchtadi, MS Dr. Ir. Purwiyatno Hariyadi, MSc. Ketua Anggota
Mengetahui,
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Dr. Ir. Khairil Anwar Notodiputro, MS
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kendali Stabilitas Beta Karoten selama Proses Produksi Tepung Ubi Jalar (Ipomoea batatas L.) adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 26 Desember 1975 dari ayah Sukarjono (alm) dan ibu Ennatha Surtinah. Penulis merupakan anak keenam dari enam bersaudara. Pendidikan sarjana ditempuh di Jurusan Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Universitas Gadjah Mada, lulus pada tahun 1999. Sejak tahun 2000 hingga 2001 bekerja di PT Riau Sakti United Plantation Industry pada Quality Assurance Department yang kemudian ditempatkan di Production Planning and Inventory Control (PPIC Department) untuk divisi Nanas Kaleng. Pada tahun 2001 hingga 2004 bekerja di PT Freyabadi Indotama pada Manufacturing Department untuk Production Planning and Inventory Control coklat olahan, yang bertanggungjawab membuat dan mengkoordinasikan rencana produksi dan rencana pengiriman.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan YME atas segala berkat dan anugerahNya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilakukan pada bulan Maret 2005 hingga Maret 2006 ini berjudul Kendali Stabilitas Beta Karoten selama Proses Produksi Tepung Ubi Jalar (Ipomoea batatas L.).
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Prof. Dr. Ir. Tien R. Muchtadi, MS sebagai dosen pembimbing pertama yang telah memberikan bimbingan, pengarahan, nasehat dan dorongan semangat kepada penulis. Serta kepada Dr. Ir. Purwiyatno Hariyadi, MSc sebagai dosen pembimbing kedua yang telah memberikan komitmen, bimbingan dan semangat selama penelitian hingga penulisan tesis ini.
Ucapan terima kasih sebesar-besarnya penulis sampaikan pula kepada Ir Budianto Wijaya, MAppSc. sebagai penguji luar komisi atas kesediaan, bimbingan dan wacananya untuk penulisan tesis ini, panitia Bogasari Nugraha 2004 yang telah memberikan bantuan dana penelitian ini, Central International Potato, Muara – Bogor dan Dr. Jusuf di Balai Penelitian Kacang-kacangan dan Umbi-umbian, Malang atas penyediaan bahan baku penelitian ini.
Kepada teman-teman Ilmu Pangan 2002, 2003, 2004 dan 2005, pihak-pihak di Laboratorium Seafast, ITP, Pasca panen, dan PT Mbrio Biotekindo yang tidak dapat penulis sebutkan satu per satu (mohon dimaafkan) serta mBak Mar dan Pak Ade, terima kasih atas segala bantuannya selama penelitian.
Akhirnya, terima kasih kepada keluarga, suami tercinta C. Perwira Jati Wicaksana, SE atas segala doa dan kesabarannya mendukung dan membantu penulis hingga dapat menyelesaikan studi ini. Kepada ayahanda (alm) dan ibunda atas segala doa dan dukungannya. Juga kepada papah (alm), mamah mertua, kakak-kakak dan adik-adik semua atas segala doa dan dorongannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2006
DAFTAR ISI
Halaman
DAFTAR TABEL ……….….……… vii
DAFTAR GAMBAR………..……… viii
DAFTAR LAMPIRAN ……….. ix
PENDAHULUAN.. ………..………….... 1
Latar Belakang ……… 1
Tujuan Penelitian ………. 2
Kerangka Pemikiran ………. 3
Hipotesa ……… 4
Manfaat Penelitian ……… 4
TINJAUAN PUSTAKA ……… 5
Ubi jalar ……… 5
Tepung ubi jalar ……… 9
Karotenoid dan Beta Karoten ……… 11
Stabilitas Beta Karoten ………. 15
Hubungan Absorbansi Warna dengan Konsentrasi Pigmen ……. 19
METODOLOGI PENELITIAN ……… 21
Tempat dan Waktu Penelitian ……… 21
Bahan dan Alat ……… 21
Metode Penelitian ……… 21
Prosedur Analisis ……… 25
HASIL DAN PEMBAHASAN ……… 30
Karakterisasi Bahan …...……… 30
Penelitian Pendahuluan ………. 30
Pemilihan pelarut untuk ekstraksi karotenoid ubijalar ……… 30
Pemilihan fase gerak untuk analisis HPLC ……… 35
Penelitian Inti ……… 38
Analisa Efek O2, Cahaya dan Panas Selama Proses Produksi .... 40
Penetapan Alat Ukur in line Produksi ……… 46
Perlakuan-perlakuan untuk pengendalian stabilitas beta karoten selama proses produksi tepung ubi jalar………. 48
Stabilitas Beta Karoten selama Proses Produksi ... 50
DAFTAR TABEL
Halaman
Tabel 1. Produksi dan distribusi panen ubi jalar per tahun ………. 5
Tabel 2. Komponen nutrisi utama ubi jalar ………. …. ……….. 8
Tabel 3. Polaritas relatif berbagai pelarut (Adnan 1997) ...32
Tabel 4. Hasil perhitungan luas permukaan tepung dan beta karoten...34
Tabel 5. Tabel kendali proses ………..………… 41
Tabel 6. Hasil perhitungan kadar beta karoten pada tahap blanching…... 42
Tabel 7. Data pengukuran warna dari 2 alat pengering yang berbeda … 43 Tabel 8. Hasil pengamatan warna menggunakan kromameter selama proses produksi tepung ubi jalar oranye tanpa perlakuan perendaman bahan pelindung ………..……... 45
Tabel 9. Kadar beta karoten dan pengukuran warna tepung perlakuan… 47 Tabel 10. Perkiraan % degradasi beta karoten selama produksi ... 50
Tabel 11. Perkiraan % degradasi beta karoten selama produksi ...…... 51
Tabel 12. Kadar beta karoten selama penyimpanan … ………... 52
Tabel 13. % penurunan kadar trans beta karoten selama penyimpanan .... 53
DAFTAR GAMBAR
Halaman
Gambar 1. Bagian-bagian kulit dan daging umbi ubi jalar ..……… 7
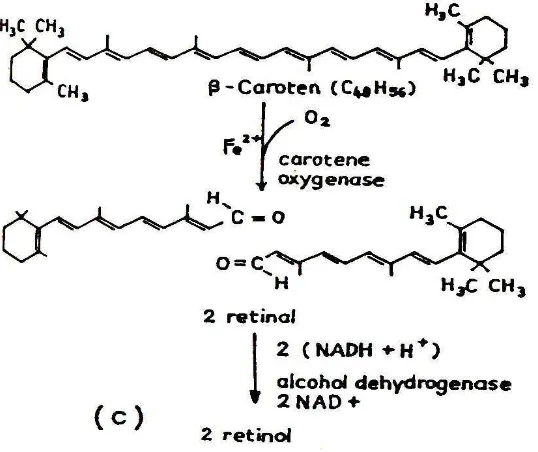
Gambar 2. Pengubahan beta karoten menjadi 2 retinol….…..…… 13
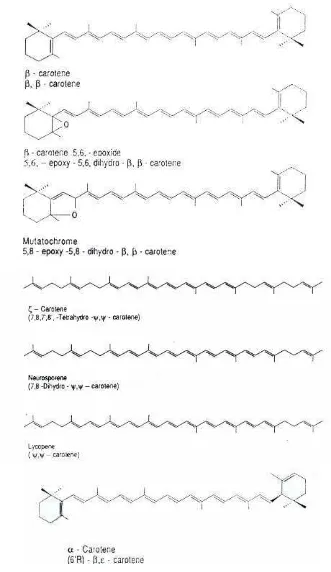
Gambar 3. Struktur beta karoten diantara jenis karotenoid lainnya … 14 Gambar 4. Spektrum absorbsi 3 macam stereoisomer beta karoten .. 17
Gambar 5. Perubahan struktur trans menjadi cis beta karoten ……… 18
Gambar 6. Proses produksi tepung ubijalar……… 23
Gambar 7. Tahap-tahap penelitian ……… 24
Gambar 8. Uji sensitivitas 3 kombinasi fase gerak ……… 38
Gambar 9. Kerusakan trans beta karoten ……… 40
DAFTAR LAMPIRAN
Halaman Lampiran 1. Gambar pengamatan tepung berdasarkan warna
dan teksturnya ...… 65 Lampiran 2. Rumus perhitungan beta karoten standar ……… 66
Lampiran 3. Rumus perhitungan beta karoten sampel………. 67 Lampiran 4. Data pemilihan pelarut untuk proses ekstraksi ………. 68 Lampiran 5. Perhitungan ANOVA dengan SAS 6.12 ……….. 69 Lampiran 6. Analisis statistik korelasi antara 2 peubah…………... 70 Lampiran 7. Gambar pengamatan dengan mikroskop polarisasi…… 72 Lampiran 8. Penentuan nilai energi aktivasi ……… 73 Lampiran 9. Perhitungan luas muka partikel tepung ubi jalar
PENDAHULUAN
Latar BelakangUbi jalar (Ipomoea batatas L.) terutama yang berdaging umbi warna oranye atau kuning memiliki potensi unggulan pada kandungan beta karoten (provitamin A) yang tinggi. Beta karoten atau provitamin A dalam ubi jalar diketahui memiliki banyak manfaat bagi tubuh, karena selain mampu memenuhi kebutuhan vitamin A juga berfungsi sebagai antioksidan untuk melawan radikal bebas dalam tubuh.
Pengolahan ubi jalar menjadi tepung adalah salah satu usaha untuk mendapatkan produk setengah jadi dari komoditas ini sehingga mampu memperbanyak aplikasi dan daya simpan komoditas ini pada masa-masa berikutnya.
Namun demikian, potensi ini akan menyusut selama pengolahan ubi jalar menjadi tepung karena sifat beta karoten yang sensitif terutama terhadap oksigen dan cahaya. Adanya ikatan rangkap pada struktur kimia beta karoten, menyebabkan bahan ini menjadi sangat sensitif terhadap reaksi oksidasi ketika terkena udara (O2), cahaya, metal, peroksida, dan panas selama proses produksi maupun aplikasinya. Kandungan beta karoten yang sudah menyusut selama proses pengolahan tepung ini akan semakin menyusut pada proses aplikasinya (misalnya untuk pembuatan roti atau mie kering). Kondisi ini terjadi jika proses pengolahan dilakukan tanpa pengendalian dan perlindungan, sehingga pada akhirnya kandungan beta karoten yang seharusnya bermanfaat tinggi menjadi hilang percuma selama itu.
Oleh karena itu, dua pemikiran mendasar yang menjadi pertimbangan adalah apakah kandungan beta karoten ini perlu diekstraksi terlebih dahulu sebelum diolah menjadi tepung atau apakah ada rekayasa proses pengolahan tepung ubi jalar yang dapat meminimalkan kerusakan beta karoten, sehingga produk jadinya memiliki daya guna yang tinggi (terutama dalam pemenuhan vitamin A di masyarakat). Proses ekstraksi beta karoten dari ubi jalar yang pernah dilakukan adalah supercritical CO2 dengan hasil sebesar 98% beta karoten (Spanos et al. 1993). Meskipun demikian, secara komersial tidak banyak pihak yang berminat pada proses ini.
Ubi jalar secara alami mengandung beta karoten bentuk trans dominan (Bauernfeind 1981; Gross 1991), isomerisasi cis-trans yang terjadi pada suhu tinggi akan menyebabkan perubahan posisi dari bentuk trans ke bentuk cis. Sedangkan beta karoten bentuk cis biasanya memiliki aktivitas vitamin A yang lebih rendah daripada bentuk trans (IVACG 1999).
Penelitian ini berupaya untuk mempelajari dan mengendalikan stabilitas beta karoten selama proses pengolahan tepung ubi jalar sehingga dapat diperoleh tepung ubi jalar yang kaya beta karoten dan pada tahap selanjutnya dapat diperoleh rekomendasi untuk perbaikan produksi tepung ubi jalar kaya beta karoten.
Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut :
1. Menghasilkan tepung ubi jalar kaya beta karoten dengan menguraikan terlebih dahulu faktor-faktor yang mempengaruhi stabilitas beta karoten selama proses produksi tepung ubi jalar, salah satunya dengan mempelajari isomerisasi struktur beta karoten yang terjadi, sehingga diperoleh titik-titik kontrol proses.
2. Menguji pengendalian stabilitas beta karoten selama proses produksi tepung ubi jalar terhadap penyimpanan produk selama penyimpanan 3 bulan.
Kerangka Pemikiran
Beberapa sifat beta karoten, salah satu komponen unggulan ubi jalar, telah diketahui melalui beberapa penelitian. Namun demikian, telaah stabilitas beta karoten selama proses produksi tepung ubi jalar belum banyak dilakukan. Hal ini penting dilakukan karena akan menjadi dasar pertimbangan pengembangan pengolahan selanjutnya, sehingga beta karoten akan mampu berdaya guna pada tahap pengembangan maupun aplikasinya. Adanya panas, oksigen dan cahaya selama proses produksi ubi jalar menjadi tepung belum mampu dihilangkan sepenuhnya sehingga terjadi proses isomerisasi atau rusaknya struktur beta karoten yang menyebabkan sebagian nutrisi yang berupa provitamin A (beta karoten) mengalami penurunan aktivitas.
Isomerisasi struktur beta karoten selama proses pengolahan tepung ubi jalar diharapkan mampu dikontrol secara in line pada proses pengolahan tepung ubi jalar berdasarkan telaah berbagai metode konversi warna dan absorbansi. Pengendalian secara in line disini dapat diartikan sebagai pengendalian yang dilakukan secara cepat, mengikuti alir produk secara industrial, mudah dan memiliki ketelitian pengukuran cukup akurat.
Metode ini menjadi pilihan jika dibandingkan dengan analisa konvensional yang memerlukan analisa laboratorium yang sulit, lama dan mahal. Dengan demikian, beberapa titik kontrol selama proses pengolahan tepung ubijalar yang memiliki potensi dapat mempengaruhi stabilitas beta karoten dapat dikendalikan. Melalui rekayasa proses akan diperhitungkan kondisi fisik bahan selama pengeringan maupun upaya-upaya perlindungan struktur beta karoten dengan penyalutan beberapa bahan, yaitu natrium bisulfit, asam askorbat dan dekstrin-gum.
Hipotesa
Hipotesis yang dikemukakan dalam penelitian ini menekankan pada perbaikan proses produksi, berupa tahap perendaman dengan salah satu bahan pelindung/antioksidan sebelum tahap pengeringan, akan mampu meminimalkan penurunan kadar beta karoten tepung ubi jalar secara signifikan dari kadar awal bahan bakunya.
Manfaat Penelitian
TINJAUAN PUSTAKA
Ubi jalar (Ipomoea batatas L.)Ubi jalar (Ipomoea batatas L.) termasuk tanaman palawija penting di Indonesia setelah jagung dan ubikayu (Suismono 1995). Tabel 1 memperlihatkan bahwa terjadi kenaikan dan penurunan produksi setiap tahunnya akibat kenaikan maupun penurunan luas panen. Namun demikian hasil per hektar lahan tanam menunjukkan peningkatan setiap tahunnya (periode 2000-2004), artinya terjadi optimalisasi lahan yang mampu meningkatkan hasil per hektar luas tanam.
Tabel 1. Produksi dan distribusi panen ubi jalar per tahun
Peningkatan hasil ini mendorong pemanfaatan komoditi ubi jalar menjadi bahan baku berbagai produk pangan. Berbagai produk ubi jalar yang dapat dikembangkan antara lain adalah produk-produk hasil pengembangan ubi jalar segar (seperti ubi yang dipanggang dalam oven), produk ubi jalar siap santap, produk ubi jalar siap masak, dan produk ubi jalar setengah jadi untuk bahan baku makanan (Juanda & Cahyono 2000).
Sebelum ubi jalar diolah menjadi beberapa produk turunannya tersebut perlu diketahui terlebih dahulu sifat-sifat morfologi, histologi maupun kandungan nutrisinya (Suismono 1995). Umbi tanaman ubi jalar memiliki ukuran, bentuk, warna kulit, dan warna daging bermacam-macam, tergantung varietasnya. Daging umbi tanaman ubi jalar ada yang berwarna putih, kuning, jingga dan ungu muda.
Bentuk umbi tanaman ubi jalar ada yang bulat, oval, dan bulat panjang. Selanjutnya jika bentuk umbi diketahui maka lama pengupasan dan perancangan
Periode tahun Produksi (ton) Luas panen (ha) Hasil/Ha (ku)
2000 1.827.687 194.262 94
2001 1.749.070 181.026 97
2002 1.771.642 177.276 99,94
2003 1.991.478 197.455 101
2004 1.901.802 184.546 103
alat pencucian dapat diperkirakan (Suismono 1995). Kulit umbi ada yang berwarna putih, kuning, ungu, jingga dan merah (Juanda & Cahyono 2000). Untuk kulit yang warnanya putih sampai kuning dapat diolah langsung sebab tanpa pengupasan tidak mempengaruhi produk, tetapi kulit umbi yang warnanya merah harus dilakukan pengupasan (Suismono 1995). Struktur kulit umbi tanaman ubi jalar juga bervariasi antara tipis sampai tebal dan bergetah antara bergetah sedikit sampai bergetah banyak (Juanda & Cahyono 2000).
Kulit ubi jalar dapat dibagi menjadi 4 bagian pokok yaitu kulit ari, lapisan getah, lapisan gabus, dan daging umbi (Gambar 1). Enzim polifenol oksidase, yang menyebabkan terjadinya pencoklatan atau browning bila ada luka pada umbi, terletak dalam phellogen (cork cambium), phelloderm dan getah ubi jalar.
A B
(Bauwkamp 1985) (reproduksi dari dokumentasi Hartana 1994) Keterangan gambar : ep = epidermis (kulit ari)
co = cortex (lapisan kulit getah) lac = lacuna
ca = cambium (lapisan gabus/kambium) par = parenkim
en = endodermis
xy, ph = xylem, phloem
Gambar 1. Bagian-bagian kulit dan daging umbi ubi jalar
Sedangkan daging umbi terdiri dari parenchyme dan serat (Suismono 1995). Dengan mengetahui susunan kulit dan daging umbi akan dapat diketahui teknik pengupasan yang benar agar tidak terjadi pencoklatan (browning) dan
berpengaruh pada rendemen tepung (Suismono 1995). Dari komposisi gizinya, ubi jalar merupakan sumber karbohidrat dan
mengandung karbohidrat sebesar 27,9 gram dan menghasilkan kalori sekitar 123 kalori tiap 100 gram bahan (lihat Tabel 2). Vitamin yang terkandung dalam ubi jalar adalah vitamin A, vitamin C, vitamin B1 (thiamin), vitamin B2 (riboflavin), sedangkan mineral yang terkandung dalam ubi jalar adalah zat besi (Fe), fosfor (P), kalsium (Ca), dan natrium (Na). Kandungan gizi lain yang terdapat dalam ubi jalar adalah protein, lemak, serat kasar, kalori dan abu (Juanda & Cahyono 2000). Namun demikian, nilai gizi ubi jalar secara kualitatif maupun kuantitatif dipengaruhi oleh varietas, lokasi dan musim tanam (Suismono 1995).
Produksi vitamin yang tinggi pada ubi jalar belum banyak dikembangkan. Tabel 2 menunjukkan bahwa ubi jalar memiliki potensi vitamin A cukup tinggi (ubi jalar merah memiliki kadar vitamin A 7700 SI, setara dengan 2312 RE, dan ubi jalar kuning memiliki kadar vitamin A 900 SI setara dengan 270 RE, sedangkan Angka Kecukupan Gizi pria dewasa sebesar 700 RE/hari, Widyakarya Nasional Pangan dan Gizi VI). Namun demikian, ubi jalar memiliki kadar protein rendah yaitu sekitar 1,8 gram sehingga perlu penambahan sumber protein nabati lain dalam pembuatan produk makanan dari bahan ubi jalar.
Tabel 2. Komponen utama ubi jalar
Sumber : Direktorat Gizi Depkes R.I., 1981
Kadar /100 g bahan No Unsur gizi
Selain kandungan gizi yang cukup lengkap, ubi jalar juga mengandung zat antigizi yaitu antitripsin, antikimotripsin dan rafinosa. Antitripsin dan antikimotripsin mampu menghambat aktivitas proteolitik enzim tripsin dan kimotripsin (Djuanda 2003). Namun kerja zat antigizi ini tidak akan aktif setelah bahan menjadi matang akibat pengolahan/pemanasan. Selain itu, ubi jalar juga mengandung senyawa-senyawa seperti ipomaemarone, furanoterpen, koumarin, dan polifenol yang menyebabkan rasa pahit. Senyawa-senyawa tersebut terbentuk dalam jaringan karena adanya luka serangan hama (Juanda & Cahyono 2000).
Tepung Ubi jalar
Salah satu pemanfaatan ubi jalar sebagai komoditas pangan adalah dalam bentuk tepung. Ubi jalar diubah menjadi tepung atau pati, sehingga dapat digunakan sebagai bahan baku industri alkohol, sirup, maltosa, glukosa, fruktosa, bahan perekat, biskuit, dan industri lainnya (Kadarisman 1985). Teknik pembuatan tepung ubi jalar merupakan salah satu jenis pengolahan yang penting, hal ini disebabkan tepung ubi jalar dapat disimpan lebih lama dan lebih luas penggunaannya dalam pembuatan berbagai jenis makanan (Santosa dkk. 1994).
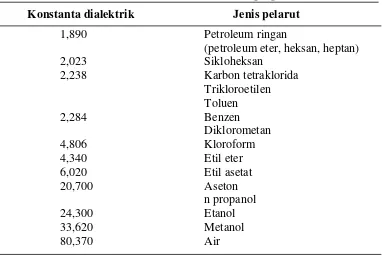
Tepung ubi jalar merupakan bentuk produk olahan setengah jadi dari umbi ubi jalar. Pembuatan tepung ubi jalar di tingkat petani dapat dilakukan dengan membuat chip ubi jalar kering. Pengertian chip kering dan tepung ubi jalar adalah produk ubi jalar yang berbentuk irisan umbi yang dikeringkan lalu ditepungkan. Secara umum, tahap pembuatan tepung ubi jalar adalah tahap pencucian, pengupasan, perlakuan blanching, pengirisan, perendaman, pengeringan dan penepungan (Suismono 1995). Perlakuan tambahan yang dapat dipertimbangkan adalah pengepresan untuk mengurangi kadar air sehingga dapat mempercepat pengeringan.
Pengupasan dilakukan untuk mendapatkan kualitas bahan baku yang benar-benar bagus, karena sebenar-benarnya tanpa pengupasan pun masih dapat diterima oleh panelis pada uji organoleptik baik warna maupun aromanya. Namun demikian, kadar mikroba, kapang/khamir lebih banyak ditemukan pada produk yang tidak dikupas daripada yang dikupas (Suismono 1995). Jika dilakukan pengupasan akan terlihat jelas adanya penyimpangan mutu (biasanya berupa lubang atau warna daging yang berbeda) sehingga dapat diupayakan untuk di-trimming ataupun dibuang.
Perlakuan blanching (70-1050C) adalah pemanasan cepat untuk menginaktivasi enzim dan menstabilkan bahan pangan melawan perusakan selama penyimpanan jangka panjang. Blanching dapat dilakukan dalam air, uap, atau menggunakan energi mikrowave (Kidmose 2002).
Pengirisan adalah proses pengecilan ukuran yang bertujuan untuk mempercepat pengeringan dan mempermudah proses pengepresan serta penepungan. Pengirisan dapat dilakukan secara manual maupun menggunakan alat seperti slicer, pencacah sawut dan lain-lain.
Tahap berikutnya adalah persiapan pengeringan. Ada beberapa metode pengolahan ubi jalar yang melakukan tahap perendaman pada larutan sulfit sebelum pengeringan. Senyawa sulfit yang biasa digunakan adalah SO2, SO32-, HSO3-, atau S2O52-. Reaksi bisulfit dengan kelompok karbonil dari gula pereduksi serta komponen lain yang berperan dalam pencoklatan berlangsung secara dapat balik (reversible). Dengan demikian proses pencoklatan dapat dihambat. Tetapi hasil reaksi ini juga diduga mampu menghilangkan kromofor karbonil dalam struktur melanoidin sehingga menyebabkan efek bleaching pada pigmen. Proses pengikatan bisulfit dengan kelompok hidroksil juga dapat berlangsung secara tidak dapat balik (irreversible) membentuk sulfonat. Selain itu penggunaan sulfit atau metabisulfit dengan disemprot atau direndam memberi kontrol efektif terhadap enzim pencoklatan dalam hal ini enzim yang mengkatalis proses oksidasi senyawa fenolik (misal enzim fenolase atau polifenol oksidase) (Lindsay 1996).
operasi rumit yang melibatkan perpindahan massa dan panas sehingga menyebabkan perubahan mutu produk (Devahastin 2000). Dibandingkan pengering alami (dengan sinar matahari), pengering buatan memiliki lebih banyak keuntungan, misalnya bahan yang dikeringkan akan lebih seragam mutunya, cepat prosesnya serta terhindar dari bahan asing yang tidak diinginkan, karena dapat dikontrol kondisi lingkungannya.
Tepung ubi jalar merupakan hasil penepungan chip atau irisan ubi jalar kering. Penepungan yang dilakukan harus memperhatikan jenis dan teknologi mesin penepung berdasarkan tingkat kehalusan dan kapasitas produksi (Suismono 1995).
Standar mutu tepung ubi jalar belum ada. Namun bila ditinjau dari komponen mutu tepung umbi-umbian seperti pada tepung ubi kayu (SII tepung kasava N.2462-1991) meliputi : keadaan (bau, rasa, warna), benda asing, derajat putih, pati, cemaran logam (Pb, Cu, Zn, Hg dan As) serta cemaran mikroba (E.coli
dan kapang), maka komponen mutu tepung di atas secara garis besar terdiri dari sifat fisik, kimia, dan mikrobiologis (Suismono 1995). Sementara kluster ubi jalar di Bogor Barat memiliki spesifikasi produk yaitu kadar air maksimal 6% dan total mikroba sebanyak 103 koloni/ml (Syah 2005).
Karotenoid dan Beta Karoten
Ubi jalar terutama yang berdaging umbi warna merah hingga kuning diketahui mengandung banyak karotenoid terutama beta karoten (Bauernfeind & Klaul 1981; Gross 1991). Purcell (1962) melakukan analisis karotenoid secara detail pada ubi jalar kuning jenis Goldrush dan ada 7 pigmen yang teridentifikasi yaitu phytoene (2,6%), phytofluene (0,8%), β-karoten (89,9%), ζ-karoten (1,2%),
ubi jalar memiliki dasar genetis yang sangat luas dengan variabilitas yang luar biasa sehingga belum ada bukti atau cara yang akurat untuk menunjukkan varietas ubi jalar mana yang kaya beta karoten.
Karrer dan Jucker (1950) dalam Muchtadi (1992) mendefinisikan karotenoid atas persetujuan Unit Internationale de Chimie, sebagai suatu zat warna kuning sampai merah yang mempunyai struktur alifatik atau alisiklik yang pada umumnya disusun oleh delapan unit isoprena, dimana kedua gugus metil yang dekat pada molekul pusat terletak pada posisi C-1 dan C-6, sedangkan gugus metil lainnya terletak pada posisi C-1 dan C-5, serta diantaranya terdapat ikatan ganda terkonjugasi.
Menurut Association of Vitamin Chemistry, London dalam Method of Vitamin Assay, secara umum karotenoid mempunyai sifat fisik dan kimia sebagai berikut :
• Larut dalam lemak
• Larut dalam kloroform, pewarna, karbon disulfida, petroleum eter
• Sukar larut dalam alkohol
• Sensitif terhadap oksidasi
• Auto oksidasi
• Stabil terhadap panas di dalam udara bebas oksigen kecuali untuk beberapa perubahan stereo isometrik
• Punya spektrum serapan yang spesifik
Meyer (1973) menjelaskan bahwa karotenoid dapat dikelompokkan menjadi 4 golongan, yaitu :
1. Karoten merupakan karotenoid hidrokarbon C40H56, yaitu alfa, beta dan gamma karoten serta likopen
2. Xantofil dan derivat karoten yang mengandung oksigen dan hidroksil. Contoh : kriptoxantin dan lutein
4. Asam karotenoid, yaitu derivat karoten yang mengandung gugus karboksil
Sedangkan Bielsen (1994) hanya menggolongkan pigmen karotenoid ini menjadi 2 kelompok besar saja yaitu hydrocarbon carotenes dan oxygenated
xanthophylls. Dari suatu survey dasar diketahui bahwa vitamin A hanya ditemukan di
makanan hewani berupa daging, hati, hingga telur. Vitamin A tidak ditemukan di makanan nabati, namun demikian tumbuhan mampu membentuk atau mensintesa senyawa karotenoid, yang merupakan prekursor vitamin A. Prekursor vitamin A ini merupakan pigmen warna kuning hingga merah yang dapat ditemukan pada daun atau buah dan sayuran. Karotenoid tersebut biasanya berupa beta karoten, alpha karoten, cryptoxanthin, lutein, zeaxanthin, dan likopen. Diantara jenis karotenoid yang ada, beta karoten memiliki aktivitas vitamin A (retinol) yang lebih besar ( Low et al. 1997). Hal ini akan tampak lebih jelas pada Gambar 2 yang menunjukkan bahwa beta karoten mampu membentuk 2 retinol di dalam mukosa usus, sedangkan jenis karotenoid yang lain (Gambar 3) hanya mampu membentuk paling tidak 1 retinol atau tidak sama sekali.
[image:34.595.185.454.481.707.2]
[image:35.595.149.480.102.674.2]
Karakterisasi beta karoten menurut Bauernfeind & Klaul (1981) terutama adalah sifatnya yang tidak larut dalam air, ethanol, methanol namun larut dalam minyak sayur dan memiliki titik leleh dalam kisaran 178 –184 oC.
Stabilitas Beta Karoten
Beta karoten sebagaimana karotenoid lain di alam, sebagian besar berupa hidrokarbon yang larut dalam air dan lemak, serta berikatan dengan senyawa yang strukturnya menyerupai lemak. Adanya struktur ikatan rangkap pada molekul beta karoten (11 ikatan rangkap pada 1 molekul beta karoten) menyebabkan bahan ini mudah teroksidasi ketika terkena udara. Menurut Walfford (1980) oksidasi karotenoid akan lebih cepat dengan adanya sinar dan katalis logam, khususnya tembaga, besi dan mangaan. Oksidasi dapat terjadi secara acak pada rantai karbon yang mengandung ikatan ganda. Pengaruh suhu terhadap oksidasi pada karotenoid dikemukakan oleh Worker (1957) dalam Muchtadi (1992) yaitu bahwa karotenoid belum mengalami kerusakan karena pemanasan pada suhu 600 C, sedangkan Mc Weeny (1968) berpendapat bahwa reaksi oksidasi karotenoid berjalan lebih cepat pada suhu yang relatif tinggi terutama jika terdapat prooksidan.
Marty dan Berset (1990) melakukan penelitian dengan beta karoten all trans
sintetis dan menyatakan bahwa ketahanan molekul tersebut pada suhu tinggi dipengaruhi oleh kondisi medium. Pemanasan yang lama pada suhu 1800 C (pada kondisi tanpa oksigen) hanya menyebabkan sedikit kerusakan pada molekul ini, namun pada bahan pangan (dengan adanya komponen penyusun berupa pati, lemak, air dan lain-lain) serta dikombinasikan dengan pencampuran secara mekanis akan memberi kesempatan masuknya oksigen dan menyebabkan kerusakan molekul beta karoten all trans ini lebih besar hingga jauh lebih besar lagi.
Beberapa macam kerusakan karotenoid yang mungkin terjadi : 1. Kerusakan pada suhu tinggi
Eskin (1979) menyebutkan bahwa karotenoid akan mengalami kerusakan pada suhu tinggi yaitu melalui degradasi thermal sehingga terjadi dekomposisi karotenoid yang mengakibatkan turunnya intensitas warna karoten atau terjadi pemucatan warna. Hal ini terjadi dalam kondisi oksidatif.
2. Oksidasi
Eskin (1979) menyebutkan pula bahwa oksidasi dapat dikelompokkan menjadi 2 yaitu oksidasi enzimatis dan oksidasi non enzimatis. Oksidasi enzimatis dikatalis oleh enzim lipoksigenase. Hasil proses oksidasi ini berupa hidroksi beta karoten, semi karoten, beta karotenon, aldehid, dan hidroksi beta neokaroten yang menyebabkan penyimpangan citarasa. 3. Isomerisasi
Bentuk all trans memberikan warna kuat. Makin banyak ikatan cis, warna makin terang. Rantai poliene pada karoten bertanggung jawab akan ketidakstabilan karoten seperti kepekaannya terhadap oksidasi oleh oksigen dan peroksida, penambahan elektrofil (H+ dan asam Lewis), isomerisasi E/Z oleh panas, cahaya dan bahan kimia (Britton, Jensen, & Pfander 1995)
Khusus pada kerusakan beta karoten selama pengolahan dapat dinyatakan, salah satunya dengan persentase aktivitas provitamin A. Senyawa beta karoten dalam bentuk isomer trans mempunyai aktivitas provitamin A sebesar 100 persen. Kehilangan aktivitas provitamin A dapat terjadi selama sterilisasi anaerob dan bervariasi dari 5 sampai 50 persen tergantung pada suhu, waktu dan bentuk karotenoid (Andarwulan & Kuswara 1987).
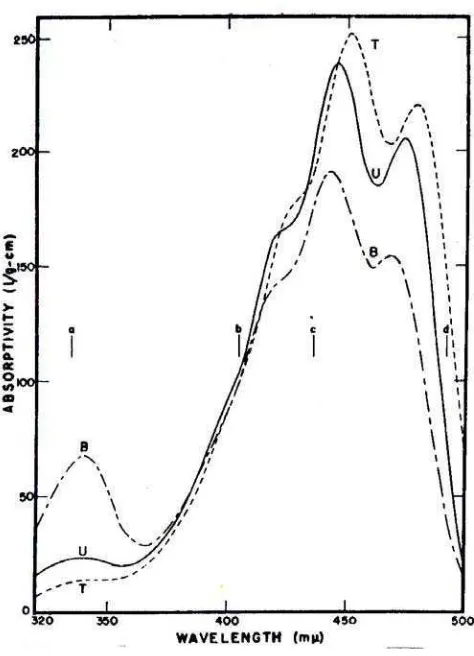
Gambar 4. Spektrum absorbsi 3 macam stereoisomer beta karoten, trans beta karoten T, neo beta karoten U, neo beta karoten B. (Bauernfeind & Klaul 1981)
posisi terendah dibandingkan neo beta karoten B atau 13 mono cis beta karoten (pemasakan 400 menit) dan neo beta karoten U atau 9 mono cis beta karoten, kemudian dikenai cahaya yang makin besar panjang gelombangnya , menunjukkan perubahannya ke posisi puncak teratas (Gambar 4).
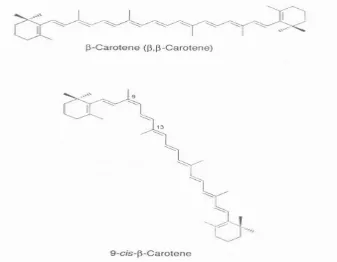
Sementara itu, perubahan struktur kimia beta karoten dari bentuk trans ke bentuk cis dapat dilihat pada Gambar 5. Perubahan ini menyebabkan penurunan aktivitas vitamin A dari 100% ke 30% saja (Andarwulan & Koeswara 1990).
Gambar 5. Perubahan struktur trans ke cis beta karoten (Mac Dougall 2002)
menunjukkan penurunan kadar beta karoten sebesar 20% dengan waktu terlama yaitu dengan antioksidan turunan phenylenediamine dan diphenylamine. Secara umum, Bauernfeind & Klaul (1981) mencatat bahwa stabilitas karotenoid dapat ditingkatkan dengan antioksidan pada formulasi yang cocok dan melibatkan asam askorbat dan ester asam bebasnya, tokoferol, lecithin, butylated hydroxyanisole
(BHA) dan butylated hydroxytoluene (BHT).
Selain itu, menurut Chang dan Zhao (1995) penambahan pati jagung dan sulfit mampu memperlambat penurunan maupun rusaknya alpha, beta karoten dan total karoten pada wortel kering selama penyimpanan. Hingga penyimpanan bulan ke- 12 kadar beta karoten pada wortel kering yang dikenai perlakuan 2,5% pati jagung adalah sebesar 66% lebih baik dibanding kontrol sebesar 30,8%.
Hubungan Absorbansi Warna dengan Konsentrasi Pigmen
Klaul 1981). Intensitas warna beta karoten pada ubi jalar telah diperkirakan sebagai indikator nilai provitamin A bahan pangan tersebut (Takahata et al. 1993). Semakin rendah kadar beta karoten akan menurunkan warna dominan merah.
Mac Dougall (2002) menyebutkan bahwa warna kuning, oranye, merah karotenoid adalah terkait dengan sistem konjugasi ikatan rangkap karbon-karbon. Semua struktur trans dapat diubah menjadi isomer cis. Isomerisasi cis-trans menghasilkan perubahan warna produk yang ditunjukkan oleh sifat spektral karotenoid cis yang berbeda dengan karotenoid trans.
Hubungan antara absorbansi warna dengan konsentrasi dari pigmen warna yang diserap tersebut dinyatakan dalam hukum Beer (Nielsen 1998) yaitu :
A = abc
A = absorbansi b = tebal kuvet
a = absortivitas bahan c = konsentrasi pigmen
Makna yang dapat diambil dari hukum diatas adalah absorbansi berbanding lurus dengan konsentrasi pigmen.
Penelitian akhir-akhir ini telah banyak menelaah berbagai pengukuran konsentrasi pigmen secara cepat dengan mengkonversikan pengukuran warna dengan konsentrasi pigmen karena selain cepat, metode tersebut juga dapat dilakukan tanpa merusak bahan uji, seperti wortel, tomat, cabai, jeruk, ubi jalar dan bahan berwarna lainnya (Schoels 2002). Fratianni, et al (2005) mendapatkan konfirmasi komponen utama pembentuk warna pada tepung durum yaitu lutein dan beta karoten dengan membandingkan pengukuran colorimeter, WSB ( Water-Saturated Butanol) dan HPLC. Penelitian lain dalam review Schoels (2002) menunjukkan beberapa persamaan matematik untuk memperkirakan modifikasi pigmen yang terjadi selama proses produksi pangan. Beberapa peneliti menggunakan warna hue angle untuk mengkarakterisasi perubahan warna (Schoels 2002).
Color Difference Meter (CDM) pada varietas ubi jalar Centinnial, varietas Jasper dan varietas George Jet mempunyai kadar beta karoten masing-masing sebesar 18,5 mg/100 g , 15,5 mg/100 g dan 8,5 mg/100g dihasilkan nilai warna (L value) masing-masing 53,3 dan 50,4 serta 48,5. Penelitian berikutnya adalah penelitian Takahata et al. (1993) dan Camire et al. (1994) yang menggunakan pengukuran warna untuk perkiraan cepat (rapid estimation) kadar total karoten ubi jalar.
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, IPB, Laboratorium Mutu dan Keamanan Pangan –
Seafast Centre, IPB dan Agricultural Products Processing Pilot Plant (AP4), IPB. Dimulai dari bulan Maret 2005 sampai dengan Maret 2006.
Bahan dan Alat
Bahan yang digunakan meliputi bahan baku utama, bahan tambahan dan bahan kimia untuk keperluan analisis. Bahan baku utama adalah ubi jalar berdaging umbi oranye dan kuning. Bahan baku tambahan adalah natrium metabisulfit, asam askorbat, dan maltodekstrin-gum arab. Bahan – bahan kimia yang digunakan untuk analisa adalah kalium hidroksida, butilhidroksitoluen (BHT), natrium sulfat, heksan, asetonitril, kloroform, metanol, tetrahidrofuran, dietil eter, dan petroleum eter dengan grade pro analisis, serta larutan asam asetat 5%.
Peralatan yang digunakan dalam penelitian ini adalah HPLC dengan detektor ultraviolet-visible merek Shimatzu dan kolom Vydac reverse-phase C18 CAT #201 TP 54 (USA), kromameter CR300 merek Minolta, spektrofotometer
ultraviolet-visible merek Shimatzu, oven menggunakan pemanas gas dan listrik,
slicer, vorteks, kompor, loyang pengering, dan gelas-gelas analisa.
Metode Penelitian
Penelitian ini dilakukan dalam dua tahap, yaitu tahap penelitian pendahuluan dan penelitian inti, sebagai berikut :
1. Penelitian pendahuluan
pengendapan dan absorbansi yang dihasilkan jika konsentrat hasil ekstraksi 2,5 gram sampel tepung dilarutkan dalam 5 ml heksan pada panjang gelombang 450 nm. Pemilihan pelarut untuk fase gerak HPLC dilakukan dengan uji sensitivitas antara konsentrasi beta karoten yang divariasikan (sebagai sumbu x) dan hasil luas area pada kromatogram (sebagai sumbu y).
Penelitian inti
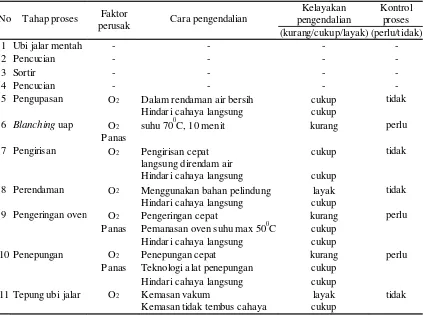
Kajian stabilitas beta karoten selama proses produksi dilakukan dengan pengamatan warna menggunakan kromameter dan kadar beta karoten menggunakan HPLC sehingga diperoleh tahapan proses yang menjadi titik-titik kendali proses pada penelitian inti.
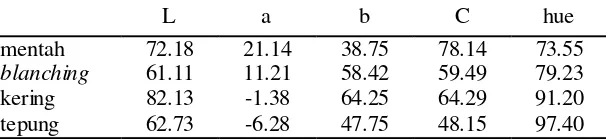
Dengan adanya titik-titik kendali proses maka dilakukan beberapa perlakuan untuk melihat besarnya kadar beta karoten tanpa dan dengan tahapan proses tersebut. Pada tahap blanching dilakukan perlakuan proses dengan dan tanpa blanching. Pada tahap pengeringan dilakukan beberapa perlakuan sebelum pengeringan yaitu perendaman irisan ubi jalar dalam air, larutan sulfit 0,3% selama 30 menit tanpa air panas (modifikasi Santosa dkk 1994), larutan sulfit 0,3% dengan air panas 60 0C (modifikasi Zhao & Chang 1995), asam askorbat 0,3%, dan perendaman menggunakan malto-dekstrin:gum arab = 1:1 (8%). Pada tahap ini, stabilitas beta karoten diamati dengan alat kromameter.
Masing-masing perlakuan pada penelitian pendahuluan dan penelitian inti dilakukan dalam 2 kali ulangan. Produk yang dihasilkan dari penelitian inti bersama-sama dengan kontrol dan tepung ubi jalar komersial dilakukan analisa beta karoten dengan HPLC untuk mendapatkan hasil tepung terbaik yang akan digunakan pada tahap penelitian berikutnya.
Proses produksi tepung ubi jalar dapat dilihat pada Gambar 6 berikut ini :
Persiapan bahan baku
Pencucian awal
Pemeriksaan fisik
Pencucian ulang
Pengupasan di dalam rendaman air
Blanching uap 700 C, 10 menit
Pengirisan di dalam rendaman air
Perendaman 25 – 600C, 10 – 30 menit
Pengeringan 500 C
Penepungan
Pengemasan kemasan vakum dan non vakum
[image:44.595.185.472.125.611.2]Penyimpanan
Gambar 6. Proses produksi tepung ubi jalar (Modifikasi Suismono 1995) Sedangkan alur penelitian yang dilakukan mengikuti Gambar 7 berikut ini :
Penelitian pendahuluan
Penelitian inti
Pemilihan tahapan proses sebagai titik-titik kendali proses.
Perlakuan-perlakuan yang dilakukan pada tahap blanching adalah sebagai berikut :
Perlakuan 1 : Produksi tepung dari ubi jalar Varietas Sewu dengan blanching
Perlakuan 2 : Produksi tepung dari ubi jalar Varietas Sewu tanpa blanching
Perlakuan 3 : Produksi tepung dari ubi jalar klon BB 105.010 dengan
blanching Perlakuan 4 : Produksi tepung dari ubi jalar klon BB 105.010 tanpa blanching
Tepung ubi jalar dengan kadar beta karoten tertinggi
Perlakuan-perlakuan sebelum tahap pengeringan adalah sebagai berikut :
Perlakuan 1 : Perendaman pada sulfit 0,3% air biasa (S30) Perlakuan 2 : Perendaman pada sulfit 0,3%, 600C (S10)
Perlakuan 3 : Perendaman pada asam askorbat 0,3% air biasa (A30) Perlakuan 4 : Perendaman pada asam askorbat 0,3%, 600C (A10) Perlakuan 5 : Perendaman pada maltodekstrin:gum arab (1:1),8% (Gum)
Tepung ubi jalar dengan kadar beta karoten tertinggi Perlakuan-perlakuan pada tahap pengeringan adalah sebagai berikut :
Perlakuan 1 : lama pengeringan 4 jam (kadar air maksimal (12%) Perlakuan 2 : lama pengeringan 24 jam (kadar air maksimal 12%)
Tepung ubi jalar dengan kadar beta karoten tertinggi
Penyimpanan bulan ke-0,1,2,3
Perlakuan 1 : Dikemas dalam alufo secara vakum Perlakuan 2 : Dikemas dalam alufo secara non vakum
Prosedur Analisis
Analisis beta karoten dengan HPLC, Modifikasi Parker (Sulaswatty 1998)
Sampel diekstraksi lebih dahulu menggunakan pelarut atau kombinasi pelarut yang akan ditentukan dalam penelitian pendahuluan hingga 7-8 kali ekstraksi. Koleksi lapisan atas hasil ekstraksi lalu diuapkan dengan gas N2. Ekstrak dicampur KOH 5% dalam metanol sebanyak 3-5 ml dan dipanaskan pada suhu 50 0C selama 30 menit. Ditambah air destilasi sebanyak 3-5 ml kemudian diekstrak kembali dengan heksan, koleksi lapisan atasnya lalu dicuci berturut-turut dengan asam asetat 5% sebanyak 3-5 ml dan air destilasi lalu diuapkan lagi menggunakan N2 hingga diperoleh ekstrak beta karoten. Kondisi HPLC diset menggunakan kolom C18, fase gerak, flow rate 1 ml/menit, suhu 250C, dan detektor UV-Visible pada panjang gelombang 450 nm. HPLC di-conditioning terlebih dahulu menggunakan fase diam, dilanjutkan dengan fase gerak masing-masing selama sekitar 1 jam hingga didapatkan baseline yang lurus pada kromatogram. Sampel dilarutkan dalam 5 ml larutan fase gerak lalu sebanyak 25
μl diinjeksikan hingga 2 kali ulangan. Hasil analisis dibaca melalui kromatogram. Analisis kuantitatif dilakukan dengan rumus seperti yang tercantum pada Lampiran 3.
Pembuatan larutan standar untuk pengukuran konsentrasi beta karoten
menggunakan spektrofotometer, Metode Parker (Sulaswatty 1998)
Larutan standar disiapkan dari kristal standar beta karoten all trans type 1 dari Sigma sebanyak 1 mg yang dilarutkan dalam 2 ml kloroform, dan 6 ml metanol (larutan ini disebut standar kualitatif). Konsentrasi beta karoten standar diperoleh dengan mengencerkannya pada pelarut metanol:asetonitril (1:1, v:v) dan dibaca absorbansinya pada panjang gelombang 450 nm (Parker 1992). Konsentrasi beta karoten dapat dihitung berdasarkan nilai E1%(1 cm), yaitu absorbansi dari 1 % larutan beta karoten atau sebesar 10 mg/ml pada panjang gelombang 450 nm menggunakan kuvet 1 cm, sebagai berikut :
Nilai 2600 adalah nilai E1% (1 cm) untuk 1% larutan beta karoten pada panjang gelombang 450 nm.
Sebelum disuntikkan ke HPLC larutan standar disiapkan pada beberapa konsentrasi pada fase gerak untuk pembuatan kurva standar antara konsentrasi dan luas area. Pada kromatogram yang diperoleh dapat dilihat persen kemurnian dari beta karoten pada panjang gelombang 450 nm. Dari persen kemurnian tersebut dapat diperoleh konsentrasi beta karoten yang sebenarnya dengan cara mengalikan persen kemurnian dengan konsentrasi beta karoten semu tersebut.
Perhitungan konsentrasi standar beta karoten adalah sebagai berikut :
[beta karoten] mg/ml =
2600 puncak kemurnian % x FP x mg/ml 10 A x
Keterangan : A = Nilai absorbansi standar FP = Faktor Pengenceran
2600 = nilai E1%1 cm beta karoten
Pengukuran warna menggunakan kromameter Minolta CR300
Sampel berupa tepung kira-kira sebanyak 3 gram dipadatkan pada suatu wadah dengan diameter tertentu beralaskan kaca dari bahan tertentu (khusus untuk pengukuran sampel berupa tepung pada pengukuran kromameter). Nilai-nilai pengukuran kromameter dikalibrasi terlebih dahulu menggunakan plate kalibrasi berwarna putih setiap kali akan digunakan.
Penentuan Kadar Air, Metode Oven (AOAC 1984)
Cawan kosong dikeringkan dalam oven dan didinginkan dalam desikator, kemudian ditimbang. Sejumlah sampel ditimbang dalam cawan. Cawan dan sampel dimasukkan ke dalam oven pada suhu 1050C, dikeringkan sampai diperoleh berat tetap. Kadar air dihitung dengan rumus sebagai berikut :
Kadar air (%) =
(g) sampel Berat (g) berat Kehilangan
Penentuan luas permukaan partikel (Mc Cabe et al. 1999)
Mc Cabe et al (1999) menyatakan bahwa dalam contoh yang ukurannya seragam dengan diameter Dp, volume total partikel ialah m/ρp, dimana m dan ρp masing-masing adalah massa contoh dan densitas partikel. Oleh karena volume satu partikel adalah Vp maka banyaknya partikel dalam contoh N ialah :
N = p V m
p
ρ
Luas permukaan total partikel ialah :
A = Nsp =
p p
s D
m 6
ρ
Φ
Densitas kamba (Khalil 1999)
Densitas kamba diukur dengan menimbang berat sampel pada volume tertentu. Densitas kamba merupakan salah satu sifat fisik bahan pangan yang berupa tepung atau biji-bijian yang dinyatakan dalam g/ml. Pada penelitian ini akan dibandingkan densitas kamba tepung dari masing-masing perlakuan pengeringan. serta tepung komersial yang sudah beredar umum di masyarakat. Nilai densitas kamba menunjukkan porositas dari bahan, yaitu jumlah rongga yang terdapat antara partikel-partikel bahan.
Densitas padat (Khalil 1999)
Sudut Curah (Khalil 1999)
Sudut curah digunakan untuk merencanakan suatu desain wadah serta fasilitas penyimpanannya. Tujuan pengukuran sudut curah adalah untuk mengetahui kemudahan jatuh dari tepung.
Tepung dijatuhkan dari ketinggian sekitar 15 cm hingga ketinggian gunungan tepung mencapai ketinggian tertentu pada suatu bidang datar, maka besar sudut curah dapat ditentukan dengan menghitung besar tangent sudut yang terjadi.
Penentuan Energi Aktivasi untuk Penurunan Kadar Beta Karoten selama
Penyimpanan Tepung Ubi Jalar (Chen & Huang 1988).
Dari data kadar beta karoten yang diperoleh menggunakan HPLC akan di plot dalam grafik antara ln [beta karoten] vs t (waktu) pada masing-masing suhu penyimpanan yaitu 20C, 250C, dan 350C. Dari masing-masing grafik suhu penyimpanan tersebut akan diperoleh besaran slope (ki). Hal ini dilakukan berdasarkan rumus reaksi orde 1 yaitu :
ln C = -kix + c
Besar slope dari masing-masing grafik suhu penyimpanan tersebut di plot dalam grafik antara ln ki (sumbu y) vs 1/T (suhu mutlak, pada sumbu x) hingga diperoleh slope k yang akan dimasukkan dalam rumus Arrhenius :
ln(k) = - (Ea/R) (1/T) + ln (A)
Dengan demikian slope (k) adalah Ea/R. Jika R diketahui sebesar 8,3148 J/Kmol atau 1,986 kalori/Kmol maka energi aktivasi (Ea) dapat diperoleh.
Rancangan percobaan untuk uji stabilitas beta karoten selama penyimpanan
akibat perendaman sulfit, asam askorbat, dan gum-dekstrin.
percobaan dalam tahap ini adalah Rancangan Acak Lengkap (RAL) 1 faktorial, masing-masing perlakuan dengan 2 ulangan. Model matematikanya adalah :
Yijk = μ + αi + εik
Yijk = respon (kadar beta karoten) dengan lama penyimpanan ke-i, pada ulangan ke-k
μ = rataan umum
αi = pengaruh lama penyimpanan bulan ke-i (i = 0, 1, 2, 3)
εik = pengaruh galat dari lama simpan ke-i pada ulangan ke-k Data yang diperoleh akan dianalisa dengan analisa sidik ragam (ANOVA) menggunakan program SAS 6.12, bila terdapat perbedaan yang nyata, akan dilakukan uji Duncan Multiple Range Test (Steel & Torrie 1991).
Faktor α : Lamanya penyimpanan
α1 : Bulan ke-0
α2 : Bulan ke-1 α3 : Bulan ke-2
HASIL DAN PEMBAHASAN
Karakterisasi Bahan
Bahan baku ubi jalar diperoleh dari balai penelitian CIP Muara, Bogor dan Balai Penelitian Kacang-kacangan dan Umbi-umbian, Malang.
Ubi jalar yang diperoleh dari CIP Muara, Bogor adalah ubi jalar berdaging umbi warna oranye, masih tergolong klon hasil pemuliaan, yaitu klon BB 00105.10 yang ditanam pada ketinggian sekitar 750 m diatas permukaan laut, dengan perkiraan produksi/panen sebesar 19,4 ton/hektar, sedangkan ubi jalar dari Malang berdaging umbi warna putih dan memiliki semburat-semburat warna oranye atau kuning, merupakan varietas ubi jalar yang sudah ada di masyarakat dengan nama varietas sewu. Menurut Litbang Balikabi Malang, ubi jalar varietas sewu ini memiliki kadar beta karoten sebesar 14 mikrogram/gram. Keduanya dipanen 3-4 bulan setelah masa tanam.
Penelitian Pendahuluan
Penelitian pendahuluan meliputi pemilihan pelarut yang akan digunakan selama ekstraksi untuk persiapan analisa HPLC, dan pemilihan pelarut sebagai fase gerak untuk analisa HPLC.
Pemilihan Pelarut untuk Ekstraksi Karotenoid Ubi jalar
karena itu, penelitian ini menggunakan standar beta karoten all trans type 1 dari Sigma.
Karotenoid termasuk senyawa lipida yang tidak tersabunkan, larut dengan baik dalam pelarut-pelarut organik, seperti karbon disulfida, benzena, kloroform, aseton, metanol, etanol, eter dan petroleum eter, tetapi tidak larut dalam air (Goodwin 1976; Hasan 1987 dalam Muchtadi 1992). Sifat ini penting dipelajari lebih dahulu terutama pada tahap ekstraksi karotenoid dari bahan uji yang lain. Delgado-Vargas dan Paredes-Lopez (2003) menyatakan bahwa ekstraksi dengan pelarut kimia adalah salah satu metode pemisahan yang memiliki beberapa keunggulan dibanding metode yang lain seperti Super Critical Fluida Extraction
(SFE), yaitu biaya yang lebih rendah. Namun demikian, pada metode ini perlu diperhatikan jenis pelarut yang digunakan yaitu memiliki titik didih rendah, tidak mudah terbakar, dan tidak beracun.
Tahap ekstraksi ini disiapkan dengan mengacu pada jenis analisa yang akan dilakukan yaitu pengukuran kadar trans-beta karoten menggunakan HPLC. Hal ini perlu mendapat perhatian lebih sebagai persiapan analisis karena sejauh ini belum ada prosedur standar untuk ekstraksi beta karoten maupun karotenoid disebabkan oleh banyaknya jenis produk makanan yang mengandung senyawa ini, dan luasnya kisaran kandungan karotenoid yang dapat ditemukan pada sampel (Oliver & Palou 2000). Di samping itu, belum ada solven tunggal yang optimal untuk mengekstrak semua karotenoid dalam sampel bahan pangan. Karbon disulfida adalah yang terbaik tapi sifatnya yang volatil, mudah terbakar, toksik, dan mudah rusak telah membatasi penggunaannya (Oliver & Palou 2000). Proses ekstraksi melibatkan pemisahan karotenoid yang hidrofob dari medium yang hidrofili. Oleh karena itu, pelarut yang digunakan untuk proses ekstraksi satu komoditi berbeda untuk komoditi yang lain, bahkan untuk komoditi yang sama karena komoditi tersebut memiliki bemacam-macam varietas dan karakteristik maupun komposisi hidrofilik-hidrofobiknya masing-masing.
memperhatikan tingkat polaritas masing-masing pelarut dan efektivitasnya menarik atau mengekstrak karotenoid dari tepung ubi jalar, maka telah dilakukan percobaan menggunakan beberapa pelarut dan kombinasi berbagai pelarut (Lampiran 5).
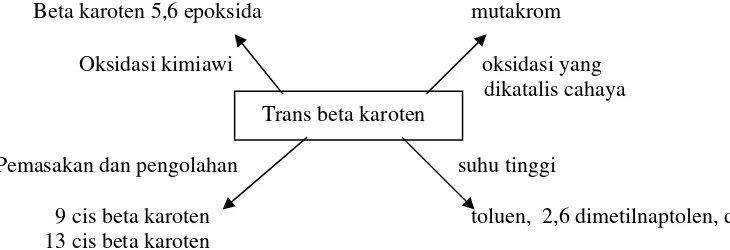
[image:53.595.125.507.296.552.2]Pemilihan pelarut yang akan digunakan tersebut dievaluasi efektivitasnya pada kecepatan pemisahan fase polar dan non polar serta absorbansi hasil ekstraksi yang dihasilkannya. Besarnya polaritas dari zat pelarut proporsional dengan besarnya konstanta dialektriknya (Adnan 1997), seperti terlihat pada Tabel 3 berikut ini :
Tabel 3. Polaritas relatif berbagai pelarut*
Konstanta dialektrik Jenis pelarut
1,890 Petroleum ringan
(petroleum eter, heksan, heptan)
2,023 Sikloheksan
2,238 Karbon tetraklorida
Trikloroetilen Toluen
2,284 Benzen
Diklorometan
4,806 Kloroform
4,340 Etil eter
6,020 Etil asetat
20,700 Aseton
n propanol
24,300 Etanol
33,620 Metanol
80,370 Air
* Adnan 1997
heksan:aseton (10:1). Ekstrak yang diperoleh dari ekstraksi awal masih merupakan campuran antara karotenoid non polar dan sedikit karotenoid polar serta beberapa senyawa lipofilik lain sehingga disebut ekstrak kasar.
Ekstrak kasar selanjutnya akan disaponifikasi dengan larutan kalium hidroksida 5% dalam metanol untuk membebaskan karotenoid yang ada dalam bentuk ester dengan asam lemak, selain menyabunkan lemak yang belum tersabunkan. Setelah proses penyabunan, sabun yang terbentuk dipisahkan menggunakan pelarut yang bersifat non polar yaitu heksan karena dari hasil percobaan menunjukkan absorbansi tertinggi pada hasil ekstraksinya walaupun waktu yang digunakan lebih lama. Penambahan pelarut ini mengakibatkan karotenoid non polar saja yang terlarut, sedangkan sabun terbawa ke dalam pelarut yang lebih polar, yaitu air yang ditambahkan.
Proses saponifikasi tetap dilakukan dengan mempertimbangkan bahwa kadar lemak tepung ubi jalar adalah sekitar 2,97% (hasil analisa proksimat tepung ubi jalar). Hal ini bertentangan dengan beberapa metode analisa karotenoid yang akhir-akhir ini berkembang yaitu tidak dilakukannya tahap saponifikasi untuk bahan-bahan yang mengandung kadar lemak dibawah 45% dengan alasan proses tersebut dapat merusak vitamin yang terkandung (Oliver & Palou 2000). Namun demikian, persiapan analisa beta karoten yang dilakukan pada penelitian ini tetap menggunakan tahap saponifikasi untuk meminimalkan pengotor yang akan menghasilkan pengganggu-pengganggu pada hasil kromatogram HPLC. Tahap ini dilakukan dengan modifikasi waktu, suhu pemanasan, penghembusan gas N2 sebelum pemanasan, tabung digoyang 10 menit sekali serta pendinginan tabung segera setelah proses pemanasan. Waktu saponifikasi adalah 30 menit, berbeda dari waktu yang biasa dilakukan yaitu 60 menit dan suhu yang digunakan adalah 500C (Eder 1996). Penghembusan N2 dilakukan untuk mengantisipasi terjadinya oksidasi selama pemanasan, jika pemanasan dilakukan dengan penghembusan N2 lebih dahulu maka enzim polifenol yang mungkin masih ada tidak sempat bereaksi dengan oksigen tapi dengan N2, sehingga mencegah proses pencoklatan yang mengindikasikan terjadinya proses oksidasi.
karoten selama persiapan analisa. Semua proses persiapan sampel dilakukan dalam ruang gelap untuk meminimalkan terjadinya fotooksidasi. Proses persiapan ini juga harus dilakukan secara ringkas (dalam 1 hari dan jika perlu penyimpanan maka harus dilakukan dalam kondisi kering atau tidak terlarut dalam pelarut non polar) untuk mencegah terjadinya oksidasi meskipun antisipasi terjadinya oksidasi telah dilakukan yaitu dengan penambahan antioksidan berupa BHT (0,01%) dalam setiap pelarut (Bauernfeind & Klaul 1981) dan penghembusan N2, sehingga selain mencegah terjadinya oksidasi, data yang dihasilkan juga lebih akurat dan konsisten. Hasil yang diperoleh adalah ekstrak kering yang diperkirakan didominasi oleh trans-beta karoten yang pada analisa berikutnya akan dibandingkan dengan standar all trans beta karoten untuk mendapatkan data kuantitatif kadar beta karoten sampel.
[image:55.595.119.516.462.506.2]Data yang konsisten juga diperoleh dari keseragaman ukuran partikel bahan pangan yang diekstrak, karena ukuran partikel berpengaruh pada efektivitas penetrasi pelarut menarik senyawa yang diinginkan dari bahan asalnya. Makin halus ukuran, makin luas permukaannya, makin efektif proses ekstraksi (Tabel 4).
Tabel 4. Hasil perhitungan luas permukaan tepung dan kadar beta karoten Bahan Luas muka (m2) [beta karoten] (ppm) Var Sewu - blanching 3.17 9.79 Var Sewu – non blanching 16.50 11.52
• Data ukuran partikel berdasarkan pengamatan mikroskop polarisasi (Lampiran 7) • Hitungan lengkap mengenai luas permukaan tepung ini ada di Lampiran 9
Tepung ubi jalar varietas sewu yang memiliki luas permukaan lebih besar ternyata memiliki kadar beta karoten yang lebih besar pula. Hal ini pernah pula dilakukan Suismono (1995) dalam membuat tepung ubi jalar dengan berbagai ukuran, total karoten tepung dengan mesh 100 lebih besar daripada tepung dengan mesh 80 dan 60 (Suismono 1995). Meskipun demikian, perlakuan proses tanpa
Pemilihan Pelarut untuk Fase Gerak pada Analisa Trans Beta Karoten
Menggunakan HPLC
HPLC atau High Performance Liquid Chromatography digunakan sebagai salah satu alat untuk mengidentifikasi dan mengkuantifikasi komponen-komponen pembentuk karotenoid hasil ekstraksi, termasuk kadar trans beta karoten.
Suatu penelitian tentang penggunaan spektrofotometer sebagai alat untuk mengukur kadar karotenoid telah dilakukan Zukhrawardi (1994) dan menyatakan bahwa pengukuran kadar beta karoten menggunakan spektrofotometer berbeda nyata dengan pengukuran kadar beta karoten yang menggunakan HPLC (p<0,05) pada pemisahan beta karoten dari limbah pemucatan minyak sawit. Hal ini menunjukkan bahwa spektrofotometer memiliki kemampuan yang lebih rendah untuk mendeteksi kadar beta karoten dari limbah pemucatan minyak sawit apabila dibandingkan dengan HPLC. HPLC lebih efektif apabila dibandingkan dengan spektrofotometer karena memiliki sensitivitas dan akurasi yang tinggi serta analisis dapat langsung dimonitor komputer dan rekorder (Zukhrawardi 1994). Alat lain yang dapat digunakan untuk mengidentifikasi karotenoid selain
HPLC adalah teknik kromatografi lapis tipis (TLC). Identifikasi dengan kromatografi lapis tipis didasarkan atas nilai Rf dan jumlah noda (spot), sedangkan HPLC berdasarkan waktu retensinya dalam suatu pelarut. Waktu retensi yang sama seperti ditunjukkan oleh standar menyatakan zat yang sama pada sampel, karenanya pengujian HPLC memerlukan suatu standar (contoh hasil kromatogram HPLC dapat dilihat pada Lampiran 10).
Dalam hal penggunaan kolom, baik kolom normal-phase maupun reverse-phase dapat dengan baik memisahkan komponen senyawa karotenoid, meskipun sistem reverse-phase lebih sering digunakan (Cserhati & Forgacs 2001). Reverse-phase HPLC seperti kolom C8 dan C18 cukup baik dalam memisahkan senyawa-senyawa karotenoid (Su et al. 2002).
isokratik tujuan pemisahan sudah tercapai, maka tidak perlu dilanjutkan dengan gradien untuk mencapai yang lebih baik (Cserhati & Forgacs 2001).
Ada beberapa macam detektor untuk HPLC seperti UV-Visible, Electrochemical array detection (ED), Thermal lens spectrometry (TLS), Mass Spekroscopy (MS) dan sebagainya. Detektor UV-Visible dengan panjang gelombang tunggal telah digunakan sebagai komponen dari sistem HPLC untuk kuantitasi karotenoid. Pendeteksian dengan detektor ini memungkinkan sensitivitas yang cukup untuk beberapa tujuan rutin ( Su et al. 2002).
Sebelum memulai analisis sampel dengan HPLC dilakukan tahap pengkondisian sistem HPLC. Tahap ini sangat perlu dilakukan untuk mendapatkan pemisahan dan kuantitasi analat sampel yang akurat, tidak terganggu oleh faktor-faktor pengganggu (yang menimbulkan noise) yang berasal dari adanya pengotor atau bubble pada sistem pelarut. Pengkondisian ini juga untuk penyesuaian kolom dengan sistem pelarut yang akan digunakan. Pengkondisian sistem HPLC yang baik ditunjukkan oleh base line yang lurus pada kromatogram dan stabilitas tekanan pompa dapat dilihat pada monitor di HPLC.
Untuk menghindari adanya gelembung udara yang terlarut dalam pelarut maka sebelum digunakan perlu dilakukan degassing (penghilangan gelembung). Penghilangan gelembung udara ini dapat dilakukan dalam wadah pelarut yang berupa botol gelas dengan menggunakan Helium yang dialirkan ke wadah pelarut.
Degassing juga dapat dilakukan dengan vakum, panas atau ultrasonifikasi. Perlunya dilakukan penghilangan udara/gas terlarut dalam pelarut untuk mencegah terbentuknya gelembung-gelembung udara pada keseluruhan sistem alat HPLC yang akan mempengaruhi kerja pompa dan kesalahan deteksi akibat adanya udara yang terperang