LAPORAN RESMI PRAKTIKUM KINETIKA KIMIA
Teks penuh
Gambar
Garis besar
Dokumen terkait
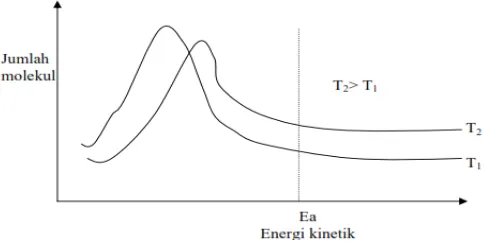
(B) Tumbukan yang berlangsung pada suhu tinggi akan menghasilkan reaksi. (C) Tekanan tidak mempengaruhi laju reaksi (D) Hanya tumbukan antara
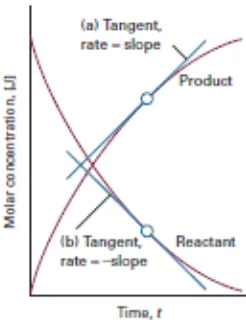
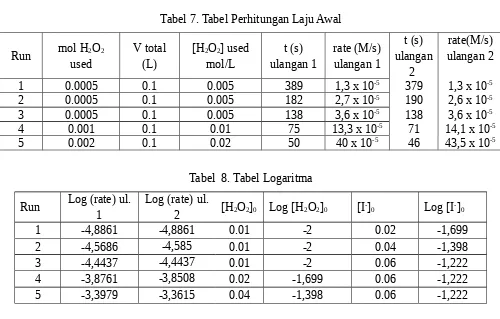
Berdasarkan praktikum kali ini tentang “laju reaksi”, seperti yang telah dijelaskan dalam teori bahwa Laju reaksi didefinisikan sebagai laju pengurangan konsentrasi molar salah
Hubungan molaritas dengan laju reaksi adalah bahwa semakin besar molaritas suatu zat, maka semakin cepat suatu reaksi berlangsunga. Dengan demikian, pada molaritas
Pada konsentrasi tinggi, memungkinkan tumbukan yang terjadi akan lebih banyak, sehingga membuka peluang semakin banyak tumbukan efektif yang menyebabkan
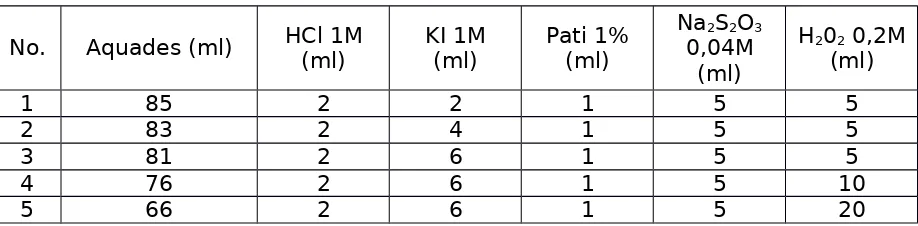
Dalam suasana asam sebagai hasil reaksi diperoleh juga H + sehingga dalam larutan yang tidak di buffer kecepatan awal reaksi (pada saat kurang dari 10% pereaksi telah bereaksi)
Teori yang menyatakan jika konsentrasi zat semakin besar makan laju reaksinya semakin besar pula, dan sebaliknya jika sentrasi suatu zat semakin kecil maka
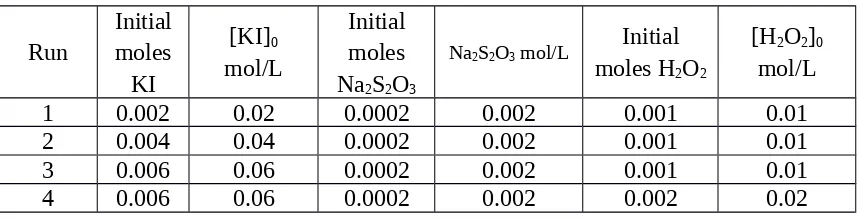
– Laju dari reaksi unimolekuler adalah orde 1 pada konsentrasi molekul reaktan.. Hukum Laju
b) Tetapan laju adalah tetapan perbandingan antara laju reaksi dan hasi kali konsentrasi spesi yang mempengaruhi laju reaksi. Tetapan laju juga merupakan
![Grafik 2. Grafik Log (rate) terhadap Log [H2O2]0](https://thumb-ap.123doks.com/thumbv2/123dok/1419040.1521278/11.595.126.477.322.525/grafik-grafik-log-rate-terhadap-log-h-o.webp)
![Grafik 3. Grafik Log (rate) terhadap Log [I-]0](https://thumb-ap.123doks.com/thumbv2/123dok/1419040.1521278/12.595.127.475.77.285/grafik-grafik-log-rate-terhadap-log-i.webp)
