Buletin
Volume 24 Nomor 1, 2019
Pengarah
Kepala Badan Penelitian dan Pengembangan Pertanian
Penanggung Jawab
Sekretaris Badan Penelitian dan Pengembangan Pertanian
Dewan Redaksi
Nuning Argo Subekti (Ketua)
Ketut Gede Mudiarta (Wakil Ketua)
Budi Winarto
A. M. Adnan
Dwi Priyanto
Ai Dariah
Suparlan
Hernani
Waryat
Redaksi Pelaksana
Endang Setyorini
Slamet Sutriswanto
Arif Surahman
Candra Komala
Akmaludin
Moh. Maulana
Wasiyah Utami
Penerbit
Sekretariat Badan Penelitian dan Pengembangan Pertanian
Jalan Ragunan No. 29, Pasarminggu, Jakarta Selatan 12540
Alamat Redaksi
Sekretariat Badan Penelitian dan Pengembangan Pertanian
Jalan Ragunan No. 29, Pasarminggu, Jakarta Selatan 12540
Telepon: (021) 7806202 , Faksimile: (021) 7800644
E-mail: [email protected], [email protected]
Homepage: http://www.litbang.pertanian.go.id
Pengantar
Puji Syukur dipanjatkan ke hadirat Tuhan Yang Maha Esa atas diterbitkannya Buletin Teknik Pertanian (Bultektan) Volume 24 Nomor 1, 2019. Bultektan merupakan media bagi teknisi litkayasa untuk menginformasikan hasil kegiatannya kepada para pengguna/pembaca yang diterbitkan dua kali per tahun oleh Badan Penelitian dan Pengembangan Pertanian. Sebagai mitra kerja peneliti, teknisi litkayasa mempunyai peran yang sangat penting dalam mendukung kegiatan penelitian, sehingga teknisi litkayasa dituntut untuk selalu meningkatkan kinerja dan profesionalismenya. Menghadapi perkembangan jaman yang telah memasuki era pertanian 4.0 juga menuntut teknisi litkayasa selalu meningkatkan kompetensinya, salah satunya adalah kemampuan menuangkan ide, gagasan, dan kegiatan ke dalam karya tulis ilmiah.
Pada terbitan kali ini BTP menyajikan 14 artikel yang merupakan hasil dari pendampingan penyiapan karya tulis ilmiah bagi teknisi litkayasa yang dilaksanakan beberapa waktu yang lalu. Tiga artikel mengupas tentang budi daya tanaman. Pemuliaan tanaman, pemupukan, dan hama penyakit masing masing dibahas pada dua artikel. Tiga artikel lainnya membahas pascapanen, ekonomi pertanian, dan kandungan logam pada tanaman.
Ucapan terima kasih dan penghargaan kepada pimpinan unit kerja Badan Litbang pertanian, yang telah memberikan perhatian pembinaan kepada teknisi litkayasa, melalui pendampingan penulisan karya tulis limiah maupun pertemuan ilmiah. Redaksi juga mengucapkan kepada para teknisi litkayasa yang telah membuat karya tulis ilmiah dan diterbitkan di Bultektan.
Akhirnya redaksi Bultektan berharap agar karya tulis yang disajikan bermanfaat bagi pembaca/ pengguna dan kami mohon masukan untuk meningkatkan mutu dan Bultektan.
Salam Redaksi
Buletin Teknik Pertanian memuat karya tulis tentang kegiatan teknisi litkayasa serta analisis kegiatan lapangan yang disajikan secara praktis. Buletin ini diterbitkan sejak tahun 1996 dengan frekuensi dua kali dalam setahun.
Buletin
Volume 24 Nomor 1, 2019 ISSN 0853-8379
Daftar Isi
Uji Tingkat Kematangan Tandan dan Viabilitas Serbuk Sari Tiga Varietas Kelapa Dalam
Toni Surya Hidayat 1–4
Uji Kualitas dan Kuantitas DNA Plasma Nutfah Sorgum (Sorghum Bicolor)
Fristy Damanik 5–8
Pembuatan Sabun Mandi Padat Berbasis Virgin Coconut Oil dengan Penambahan Ampas Kelapa Sebagai Scrub
Nugroho Utomo dan Putri Wulan Adiningrum 9–14
Estimasi Ketidakpastian Penetapan Kadar Karbon Organik dalam Tanah Metode Spektrofotometri UV-VIS
Putri Wulan Adiningrum 15–20
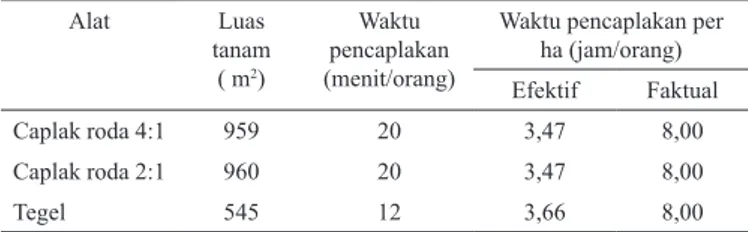
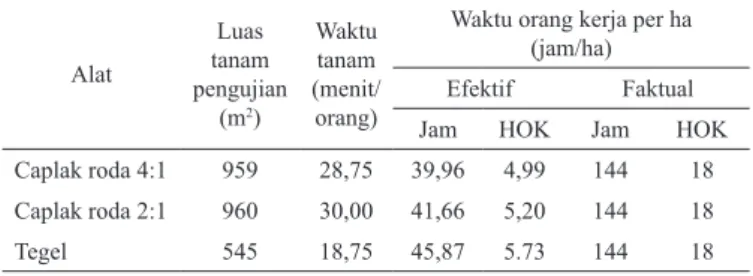
Pengukuran Waktu Kerja Efektif dan Faktual Penanaman Padi Sawah dengan Caplak Roda
Hendri Suyanto 21–24
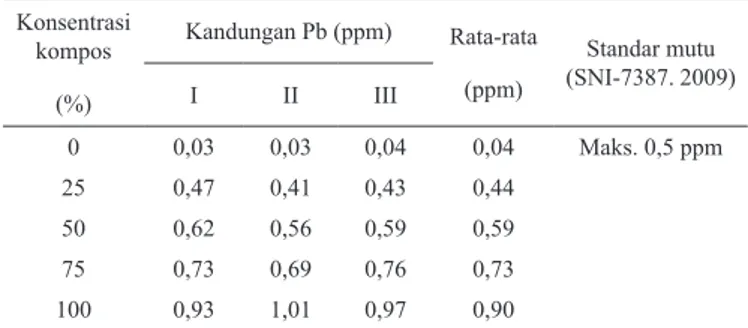
Analisis Kandungan Timbal dan Kadmium pada Bayam yang Ditanam dalam Media Kompos Sampah Kota
Khairiyanti 25-28
Total Nitrogen dan Karbon dalam Tanah Sebagai Dampak Penambahan Berbagai Bahan Organik
Sri Wahyuni, Suharsih, dan Titi Sopiawati 29–32
Pengaruh Pemberian Pupuk Hayati Terhadap Pertumbuhan Tanaman Padi di Tanah Sulfat Masam
Isri Hayati 33–36
Pengaruh Kombinasi Media Tanam dan Penyungkupan Terhadap Perkecambahan Biji Bawang Merah Varietas Trisula
Eko Binti Lestari dan Ressa Rindiani 37–40
Deteksi Banana Bunchy Top Virus pada Tanaman Pisang Menggunakan Metode Polymerase Chain Reaction dengan Primer Coat Protein dan Nuclear Shuttle Protein
Dwi Wahyuni Ardiana 41–46
Teknik Pengendalian Hama Tikus dengan Trap Barrier System pada Tanaman Padi Sawah di Lahan Pasang Surut Jambi
Rustanhadi 47–52
Teknik Pengkajian Varietas Unggul Baru Padi Gogo di Lahan Marginal
Noeriwan Budi Soerjandono 53–56
Perbandingan Penggunaan Kertas Saring dan Glasswool Terhadap Presisi Hasil Analisis Serat Kasar pada Pakan Ternak
Rina Ariyanti 57–60
Penampilan Hasil Varietas Unggul Padi Sawah pada Ketinggian Lahan Menengah di Kuningan, Jawa Barat
UJI TINGKAT KEMATANGAN TANDAN DAN VIABILITAS SERBUK SARI TIGA
VARIETAS KELAPA DALAM
Toni Surya Hidayat
Teknisi Litkayasa pada Balai Penelitian Tanaman Palma
Jl. Raya Mapanget, Kotak Pos 1004 Manado 95001 - Sulawesi Utara - Indonesia Telp. (0431) 812430, Faks. (0431) 812017
E-mail: [email protected]
ABSTRAK
Kelapa merupakan komoditas yang dibutuhkan hampir seluruh bagian dunia. Oleh karena itu untuk mencukupi kebutuhan masyarakat dan industri perlu dilakukan peningkatan kualitas dan populasi tanaman kelapa yang unggul dengan cara perakitan kelapa hibrida. Kualitas polen merupakan salah satu aspek yang memegang peran penting dalam perakitan kelapa hibrida dan untuk itu perlu diketahui tingkat kematangan tandan. Penelitian ini bertujuan untuk mengetahui kondisi tandan bunga kelapa yang layak untuk diproses serbuk sarinya (polen) sebagai bahan tetua jantan pada perakitan kelapa hibrida. Percobaan dilaksanakan di Laboratorium Bioteknologi Balai Penelitian Tanaman Palma pada bulan Februari-Maret 2019. Materi yang digunakan adalah tandan bunga dari tiga varietas kelapa dalam yaitu, kelapa dalam Mapanget (DMT), kelapa dalam Palu (DPU), dan kelapa dalam Bali (DBI). Penelitian didesain mengikuti Rancangan Acak Lengkap (RAL) faktorial 3x3 dengan tiga ulangan. Faktor A terdiri dari tiga varietas kelapa (DMT, DPU dan DBI) dan faktor B terdiri atas tiga kondisi tandan yaitu: sudah terbuka (Tbk), mulai terbuka (Mtb) dan masih tertutup (Tt). Peubah yang diamati meliputi jumlah polen berkecambah normal, polen berkecambah tidak normal, dan polen tidak berkecambah. Hasil penelitian memperlihatkan bahwa ketiga varietas kelapa dengan kriteria tandan masih tertutup memiliki rendemen polen yang terendah dibandingkan kriteria mulai terbuka dan sudah terbuka. Pengambilan polen varietas kelapa DPU dan DBI menunjukkan hasil terbaik pada tandan yang sudah terbuka, sedangkan varietas kelapa DMT memberikan hasil polen terbaik pada pengambilan dari tandan mulai terbuka. Kata kunci: cocos nucifera, serbuk sari, kelapa hibrida
PENDAHULUAN
Kelapa (Cocos nucifera) merupakan salah satu komoditas strategis yang memiliki banyak manfaat pada berbagai aspek seperti sosial, ekonomi, budaya, arsitektur dan gaya hidup. Seluruh bagian dari tanaman mulai dari daun sampai akar dapat digunakan dalam kehidupan masyarakat, sehingga ada yang menyebut kelapa sebagai the tree of lifeI (Bessie 2017). Seiring perkembangan jaman dan berkembangnya industri kelapa membuat kebutuhan hidup yang bersumber dari kelapa juga semakin meningkat. Oleh karena itu untuk mencukupi kebutuhan masyarakat dan industri perlu dilakukan peningkatan kualitas dan populasi tanaman kelapa yang unggul.
Sifat genetik suatu tanaman dapat ditingkatkan melalui pemuliaan tanaman dengan cara merakit sifat-sifat unggul yang dimiliki oleh tanaman. Salah satu metode pemuliaan yang sederhana adalah melalui persilangan, yaitu menggabungkan
dua atau lebih sifat unggul yang dimiliki tetua dengan tujuan untuk memperoleh benih hibrida yang unggul. Kelapa hibrida yang memiliki karakteristik batang pendek, produksi tinggi, tahan hama-penyakit dan cepat berbuah adalah idaman para petani dan konsumen kelapa pada umumnya (Tenda 2004). Untuk mendapatkan tanaman kelapa dengan keunggulan karakter cepat berbuah, produksi buah tinggi dan pertambahan tinggi batang lambat dapat dilakukan melalui persilangan buatan antara varietas kelapa genjah unggul yang secara alami bersifat homozygot dengan kelapa dalam yang lebih homozigot, dari tetua yang pertumbuhan tinggi batangnya lambat (Mahayu
et al 2015). Untuk itu serbuk sari (polen) diambil dari kelapa dalam sebagai tetua jantan dalam persilangan.
Menurut Bots dan Mariani (2005) polen memegang peran penting dalam reproduksi tanaman. Polen yang memiliki daya kecambah tinggi akan meningkatkan potensi buah jadi dan selanjutnya akan meningkatkan hasil produksi. Bunga kelapa adalah monoecious dimana bunga jantan dan betina berada dalam satu tandan (spadix). Setiap bunga keluar secara individu dari setiap ketiak dan tandan. Perkembangan tandan dilindungi dua seludang (sheath). Ketika tandan telah berkembang penuh panjangnya bisa mencapai 1-1,5 meter dengan diameter kurang lebih 15 cm pada bagian terlebar. Selanjutnya menurut Thomas (2013) bunga jantan mulai matang bersamaan dengan terbukanya tandan yang biasanya terjadi pada pagi hari. Penelitian ini bertujuan untuk mengetahui kondisi tandan bunga kelapa yang layak untuk diproses polen-nya sebagai bahan tetua jantan pada perakitan kelapa hibrida.
BAHAN DAN METODE Tempat dan Waktu Percobaan
Percobaan dilaksanakan di Laboratorium Bioteknologi, Balai Penelitian Tanaman Palma, Manado, Sulawesi Utara pada Februari-Maret 2019.
Bahan dan Alat Percobaan
Bahan-bahan percobaan meliputi bunga kelapa (DMT, DPU dan DBI) dengan 3 (tiga) kriteria tandan (Gambar 1), kertas
Uji Tingkat Kematangan Tandan dan Viabilitas Serbuk Sari Tiga Varietas Kelapa Dalam (Toni Surya Hidayat)
cover, masker, plastik pembungkus, kertas label, agar-agar, gula, boric acid, dan aquades. Sedangkan alat yang digunakan adalah parang, sarung tangan, timbangan, alat penggilas, almari pengering, ayakan 65 Mesh, ayakan 212 Mesh, kuas 3”, sendok, neraca analitik, hot plate, cawan petri, gelas ukur, mikroskop, pensil dan buku catatan.
Gambar 2. Tandan bunga kelapa sesuai 3 kriteria yang akan diamati : a.Tandan yang masih tertutup, b. Tandan yang mulai terbuka, c.Tandan yang sudah terbuka penuh
Persiapan Percobaan
Tahap persiapan percobaan yang dilakukan adalah prosesing
polen mengikuti langkah-langkah sebagaimana diilustrasikan pada Gambar 2.
1. Pengambilan tandan bunga kelapa sesuai 3 kriteria yang akan diamati.
2. Pemisahan tangkai bunga jantan (spikelet) dari tandan bunga (untuk bunga yang masih tertutup perlu dilakukan pembukaan selaput seludang sesuai alur garis)
3. Pemipilan bulir bunga jantan dari tangkainya (Gambar 2a).
4. Setelah semua bunga jantan dipipil kemudian ditimbang berat basahnya dan dicatat.
5. Penggilasan bunga jantan yang belum pecah alami menggunakan alat penggilas dari kayu yang dibentuk silinder untuk membantu keluarnya polen (Gambar 2b). 6. Bunga jantan dihamparkan secara merata pada wadah
yang telah dilapisi kertas cover.
7. Pengeringan bunga jantan menggunakan almari pengering (dehumidifier) (Gambar 2c) dengan suhu 35oC-40oC,
kelembapan 45%-50% selama 28-30 jam (Novarianto & Karel 1999)
8. Bunga jantan yang telah kering selanjutnya diayak dua tahap. Pengayakan yang pertama menggunakan ayakan berpori 65 Mesh untuk memisahkan kulit bunga jantan yang membungkus polen (Gambar 2d). Selanjutnya pada pengayakan tahap yang ke dua menggunakan ukuran 125 Mesh untuk mendapatkan polen yang paling murni (Gambar 2e).
9. Setelah didapatkan polen yang paling murni, kemudian polen tersebut ditimbang dan dicatat sesuai kode perlakuan yang diamati. Berat bersih polen ini kemudian
10. Polen dikemas dalam plastik dan ditempelkan label yang bertuliskan jenis tandan yang diamati, tanggal prosesing, berat basah, berat bersih polen, rendemen polen dan viabilitas polen (Gambar 2f). Rendemen polen dihitung menggunakan rumus:
Rendemen Polen=(berat bersih polen)/(berat bulir bunga jantan) x 100
Gambar 2. Prosesing polen (a. Pemipilan bulir bunga jantan, b. Penggilasan, c. Pengeringan, d. Pengayakan 65 Mesh, e. Pengayakan 125 Mesh, f. Pengemasan sebelum uji viabilitas)
Perlakuan Percobaan
Perlakuan percobaan dalam penelitian ini adalah uji viabilitas
polen yang dilakukan pada media in vitro, dengan mengikuti langkah-langkah sebagai berikut:
1. Penimbangan 7,5 gr gula dan 0,6 gr agar. 2. Penyiapan 50 ml aquades.
3. Pencampuran bahan-bahan (langkah 1 dan 2) ke dalam tabung reaksi/gelas ukur.
4. Pemasakan bahan menggunakan hot plate dengan suhu 100oC.
5. Penambahan 4 butir boric acid pada larutan langkah 4 tersebut dan pemasakan hingga larutan mendidih.
6. Penyiapan cawan petri yang sudah ditandai dengan 5 garis petak blok menggunakan spidol pada permukaan luar dasar cawan.
7. Setelah mendidih larutan media (hasil langkah 5) dituangkan setebal 2 ml secara merata pada cawan petri, ditutup, dan didiamkan selama 10 menit.
8. Media ditunggu hingga dingin dan siap untuk ditaburi
polen di permukaannya secara merata pada setiap blok (Gambar 3a).
9. Cawan petri ditutup dan didiamkan selama 2 jam (Novarianto & Karel 1999) untuk menunggu polen
10. Setelah 2 jam viabilitas polen siap diamati menggunakan mikroskop dengan perbesaran 100 kali dan dihitung jumlah
polen yang berkecambah, berkecambah tidak normal, serta
polen yang mati/tidak berkecambah (Gambar 3c dan 3d). 11. Cara penghitungan kecambahnya adalah dengan
mengamati lima petak blok. Untuk mendapatkan akurasi viabilitas yang tepat, pengamatan dilakukan 5 kali pada setiap petak blok sehingga jumlah pengamatan pada setiap cawan petri adalah 25 kali.
12. Pengamatan difokuskan pada setiap blok, kemudian hasil pengamatan tersebut dijumlahkan untuk menentukan persentase viabilitas polen dengan rumus:
Keterangan :
V = Viabilitas polen (%)
a = jumlah polen yang berkecambah
b = jumlah polen yang berkecambah tidak normal c = jumlah polen yang mati/tidak kecambah
13. Persentase hasil uji viabilitas ditulis pada kolom label yang telah disediakan.
14. Polen siap dibungkus dan disimpan dalam freezer dengan suhu 0oC. Polen dapat bertahan sampai dengan satu tahun.
Jika polen akan disimpan dalam jangka 2-3 tahun maka harus menggunakan botol yang divacum terlebih dahulu (Novarianto & Karel 1999).
Gambar 3. Uji viabilitas polen (a. Penaburan polen, b. Pendiaman selama 2 jam, c. Pengamatan kecambah polen di bawah mikroskop, d. Kecambah polen)
Analisis Data
Data semua peubah percobaan (jumlah spikelet, berat bulir bunga jantan, berat bersih polen, jumlah polen berkecambah normal, jumlah polen berkecambah tidak normal, jumlah polen tidak berkecambah, serta viabilitas polen) dianalisis secara deskriptif dan disajikan dalam bentuk tabel.
HASIL DAN PEMBAHASAN
Potensi Bunga Jantan Pada Varietas DMT, DPU dan DBI Hasil pengamatan terhadap bunga jantan dari ketiga varietas kelapa dalam memperlihatkan adanya keragaman jumlah
spikelet, berat bulir bunga jantan, berat bersih polen dan rendemen polen. Jumlah spikelet terbanyak dijumpai pada kelapa DPU-Mtb sebanyak 47 spikelet, sedangkan spikelet
paling sedikit diperoleh pada kelapa DMT-Mtb dan DMT-Tt sebanyak 40 spikelet. Berat basah bulir bunga jantan tertinggi ditemui pada kelapa DBI-Tt (1.660 g) dan terendah pada kelapa DBI-Mtb (1.080 g). Berat bersih polen yang dihasilkan terbanyak diperoleh dari kelapa DMT-Mtb sebanyak 33,04 g dan yang paling sedikit diperoleh dari kelapa DPU-Tt (18,23 g). Dari pemrosesan bulir bunga jantan sampai didapatkan berat bersih polen, rendemen polen tertinggi dihasilkan oleh kelapa DPU-Mtb (2,25%) dan rendemen terendah pada kelapa DBI-Tt (1,39%) (Tabel 1).
Hasil analisis dan pengamatan terhadap ketiga varietas kelapa menunjukkan bahwa tandan tertutup (Tt) memiliki rendemen polen yang lebih rendah dibandingkan dengan dua kriteria tandan lainnya. Hal ini dimungkinan karena tingkat kematangan bunga jantan belum optimal untuk memproduksi polen pada tandan yang masih tertutup. Tidak hanya itu, kondisi tandan yang masih tertutup juga tidak memungkinkan terjadinya kontaminasi/tercampurnya polen. Hal ini berbeda dengan tandan yang sudah terbuka, dimana resiko kontaminasi polen dari serangga yang telah hinggap pada bunga jantan lain lebih besar sehingga polen tersebut sudah tidak terjamin
Tabel 1. Rerata jumlah spikelet, berat basah bunga jantan, berat bersih polen dan rendemen polen
Kombinasi
Perlakuan spikeletJumlah
Berat bulir bunga jantan (g)
Berat bersih
polen (g) Rendemen polen (%)
DMT Tbk 44 1.120 20,07 1,79 DMT Mtb 40 1.480 33,04 2,23 DMT Tt 40 1.510 23,24 1,54 DPU Tbk 44 1.600 31,65 1,98 DPU Mtb 47 1.240 27,95 2,25 DPU Tt 41 1.360 18,23 1,34 DBI Tbk 45 1.100 23,39 2,13 DBI Mtb 43 1.080 21,73 2,01 DBI Tt 44 1.660 23,02 1,39 Keterangan :
DMT = Dalam Mapanget Tbk = Tandan Terbuka DPU = Dalam Palu Mtb = Tandan Mulai Terbuka DBI = Dalam Bali Tt = Tandan Tertutup
kemurniannya. Selain itu jumlah polen pada tandan yang sudah terbuka akan berkurang karena tertiup angin dan terbawa oleh serangga-serangga yang hinggap.
Kualitas Polen
Rahmi et al (2015) menegaskan bahwa tingkat kematangan bunga jantan dan betina merupakan salah satu faktor yang
Uji Tingkat Kematangan Tandan dan Viabilitas Serbuk Sari Tiga Varietas Kelapa Dalam (Toni Surya Hidayat)
mempengaruhi kualitas benih. Kematangan bunga betina sangat mudah diketahui karena secara visual dapat dilihat apakah bunga sudah mekar dan mengeluarkan lendir/nectar. Bunga betina yang telah mekar dan menghasilkan nectar telah reseptif/siap untuk proses penyerbukan. Hal ini tidak dapat dilihat dengan mudah pada bunga jantan. Untuk mengetahui tingkat kematangan bunga jantan perlu uji daya kecambah/ viabilitas polen.
Kualitas polen yang ditunjukkan dengan daya kecambah atau tingkat viabilitas yang tinggi merupakan salah satu faktor pendukung utama keberhasilan perakitan kelapa hibrida. Bunga jantan dan polen yang berjumlah banyak belum menjamin kualitas polen yang bagus untuk suatu tetua jantan dalam persilangan. Oleh karena itu penting dilakukan pengamatan viabilitas polen untuk mengetahui tingkat kematangan polen yang akan digunakan pada persilangan. Syarat minimal viabilitas polen pada perakitan kelapa hibrida adalah 40%. (Novarianto 2010).
Pengamatan terhadap rerata perkecambahan polen dari tiga varietas kelapa pada tiga kriteria tandan menunjukan tingkat viabilitas tertinggi dan terendah didapatkan berturut-turut dari kelapa DMT-Mtb sebesar 56,76% dan DBI-Mtb sebesar 24,29% (Tabel 2). Dari semua kombinasi perlakuan varietas dan kriteria tandan didapatkan kombinasi-kombinasi perlakuan yang memperlihatkan viabilitas polen yang memenuhi syarat minimum (> 40%) untuk digunakan dalam perakitan kelapa hibrida, kecuali 3 perlakuan yaitu kelapa-kelapa DPU-Tt, DBI-Mtb, dan DBI-Tt.
Secara umum terlihat bahwa kelapa dalam Mapanget
memiliki kualifikasi tinggi sebagai tetua jantan karena
viabilitas polen yang dimilikinya relatif tinggi untuk semua kriteria tandan (tertutup, mulai terbuka, terbuka). Adapun kelapa dalam Bali dan Palu masih menunjukkan kelemahan dari aspek viabilitas polen dan apabila memang diperlukan untuk menggunakan polen dari kedua varietas tersebut maka disarankan untuk menggunakan polen dari tandan terbuka dan mulai terbuka untuk kelapa dalam Palu dan dari tandan terbuka dari kelapa dalam Bali.
KESIMPULAN
Berdasarkan hasil pengamatan terhadap kriteria tandan dan viabilitas serbuk sari dari ketiga varietas kelapa dalam yang diuji pada penelitian ini, disimpulkan bahwa kelapa dalam Mapanget sangat cocok untuk dijadikan tetua jantan pada perakitan varietas kelapa hibrida. Varietas ini memiliki rendemen polen tidak berbeda jauh dari kelapa dalam Palu dan Bali, namun viabilitas polen-nya lebih tinggi dibanding kedua varietas tersebut.
Tabel 2. Rerata perkecambahan dan viabilitas polen Kombinasi Perlakuan Polen berkecambah normal Polen mati Polen berkecambah tidak normal Viabilitas (%) DMT Tbk 19.00 16.00 3.00 50.00 DMT Mtb 21.00 13.33 2.67 56.76 DMT Tt 15.67 12.67 4.00 48.45 DPU Tbk 23.00 15.67 2.67 55.65 DPU Mtb 21.33 16.67 2.33 52.89 DPU Tt 7.00 11.67 1.00 35.59 DBI Tbk 20.00 14.00 1.67 56.07 DBI Mtb 5.67 12.00 5.67 24.29 DBI Tt 8.33 12.33 3.00 35.21 Keterangan :
DMT = Dalam Mapanget Tbk = Tandan Terbuka DPU = Dalam Palu Mtb = Tandan Mulai Terbuka DBI = Dalam Bali Tt = Tandan Tertutup
UCAPAN TERIMAKASIH
Ucapan terimakasih penulis sampaikan kepada para peneliti senior Balai Penelitian Tanaman Palma yang telah membimbing selama proses penyusunan karya tulis ini; Dr. Ismail Maskromo, Ir. Elsje Tenda, MS, Ir. Miftahorrachman, Muhammad Roiyan Romadhon, SP, M.Si, dan Lidya Deetje Samau serta kepada Dr. Nuning Argo Subekti yang telah mendampingi selama proses perbaikan dan finalisasi naskah.
DAFTAR PUSTAKA
Bessie, YMDP. 2017. Optimalisasi Bahan Baku Kelapa.
Warta Ekspor 2017. Kementerian Perdagangan Republik Indonesia. Jakarta. 20 hal
Bots, M., and C. Mariani. 2005. Pollen Viability in the Field. Nijmegen: Radboud University.
Mahayu, W.M. dan H. Novarianto. 2015. Penampilan Bibit Kelapa F1 Hasil Silangan Genjah x Dalam Mapanget S4.
Buletin Palma 16(2):141-146
Novarianto, H. dan G. Karel. 1999. Teknik Prosesing dan Keragaman Hasil Polen dari Beberapa Kultivar Kelapa Dalam. Buletin Plasma Nutfah 5(1):11-15
Novarianto, H. 2010. Karakteristik Bunga dan Buah Hasil Persilangan Kelapa Hibrida Genjah x Genjah. Buletin Palma. 39:100-110
Rahmi, Y.M., S.L. Purnamaningsih., dan S. Ashari. 2015. Tingkat Viabilitas Benih Mentimun (Cucumis sativus l.) Hasil Persilangan. Jurnal Produksi Tanaman 3(1):50 – 55 Tenda, E.T. 2004. Perakitan Kelapa Hibirida Intervarietas dan
Pengembangannya di Indonesia. Perspekti 3(2):35-45 Thomas,.R.J. and A. Joseph Rajkumar. 2013. Flowering and
pollination biology in coconut. Journal of Plantation Crops 42(2):109-117
UJI KUALITAS DAN KUANTITAS DNA PLASMA NUTFAH SORGUM (
Sorghum Bicolor
)
Fristy Damanik
Teknisi Litkayasa Terampil pada Balai Penelitian Tanaman Serealia Jl. Dr. Ratulangi No. 274, Maros 90514
Telp. (0411) 371529-371016, Faxs. (0411) 371961 E-mail: [email protected]
ABSTRAK
Pemanfaatan marka molekuler sangat mendukung dalam identifikasi genetik plasma nutfah tanaman, tidak terkecuali sorgum. Teknologi marka molekuler terkait erat dengan kualitas dan kuantitas DNA. Percobaan ini bertujuan untuk mengetahui kualitas dan kuantitas DNA sorgum yang diuji pada gel elektroforesis dan spektrofotometer. Materi penelitian yang digunakan adalah sampel daun muda plasma nutfah sorgum sebanyak 20 aksesi. Pengujian kualitas DNA sorgum dilakukan di Lab Biologi Molekuler Balitsereal pada Juni-Juli 2018. Hasil pengujian pada gel elektroforesis menunjukkan konsentrasi DNA yang dihasilkan cukup besar sekitar 300 ng/ µl namun masih ada smear pada elektrogramnya. Sedangkan hasil pengujian menggunakan spektrofotometer memperlihatkan konsentrasi DNA yang dihasilkan juga cukup besar yaitu antara 175 – 235 ng/ µl tetapi sampel BC-7-1-1, Keler, 1115C dan 4-183ABEOTO masih terkontaminasi protein sehingga perlu dilakukan pemurnian DNA dengan penambahan campuran phenol:kloroform:isoamylalkohol (P:C:I). Konsentrasi DNA yang tinggi pada penelitian ini sangat penting untuk memenuhi kebutuhan pengenceran DNA pada proses PCR selanjutnya.
Kata kunci: sorgum, DNA, kualitas, konsentrasi
PENDAHULUAN
Sorgum (Sorghum bicolor) merupakan salah satu tanaman pangan yang potensial dan menghasilkan pada wilayah kering (Tabri dan Zubachtirodin, 2013). Pengembangan sorgum di Indonesia dalam skala luas terdapat di NTT, NTB dan Jawa Timur pada lahan kering beriklim kering. Sorgum mengandung nutrisi sebanding dengan padi dan jagung bahkan kandungan protein lebih tinggi namun kandungan lemaknya lebih rendah (Dicko et al, 2006). Selain biji sorgum sebagai bahan pangan, batang sorgum juga berguna sebagai bahan baku industri pembuatan bioethanol dan juga pembuatan gula cair serta hijauannya digunakan sebagai pakan ternak (Yulita dan Risda, 2006).
Untuk mendukung penelitian pengembangan sorgum secara konvensional teknologi marka molekuler sangat membantu dalam memberikan informasi penting tentang genetik sorgum secara lebih akurat. Teknologi marka molekuler terkait erat dengan pemanfaatan DNA (deoxyribonucleid acid) tanaman. Keberhasilan penelitian berbasis DNA sangat tergantung pada kualitas dan kuantitas DNA.
DNA merupakan pembawa informasi genetik yang akan diturunkan kepada generasi penerusnya. Di dalam sel, DNA terletak didalam inti sel. Peran DNA di dalam sebuah sel adalah sebagai materi genetik, artinya DNA menyimpan cetak biru
bagi segala aktifitas sel dan ini berlaku umum untuk semua
organisme (Anonim, 2010).
Keberadaan DNA dalam suatu organisme dapat diketahui dengan cara uji kualitatif dan kuantitatif. Uji kualitatif DNA diawali dengan isolasi DNA. Isolasi DNA merupakan proses untuk mendapatkan DNA murni yang bebas dari RNA (ribonucleic acid) maupun protein lainnya. Isolasi DNA ini bertujuan mengeluarkan DNA yang berada di dalam inti sel dari organisme (Harahap, 2017). Kemudian dilakukan uji kualitatif DNA dengan metode elektroforesis gel Agarosa dan uji kuantitatif dengan metode spektrofotometer (Fatchiyah, 2011). Uji kualitatif dan kuantitatif DNA adalah analisis untuk menentukan kandungan dan konsentrasi DNA suatu larutan contoh.
Percobaan ini bertujuan untuk mengetahui kualitas dan kuantitas DNA sorgum yang diuji melalui dua alat bantu, gel elektroforesis dan spektrofotometer.
BAHAN DAN METODE Tempat dan Waktu Percobaan
Percobaan dilaksanakan di Laboratorium Biologi Molekuler Balai Penelitian Tanaman Serealia pada bulan Juni sampai Juli 2018.
Bahan dan Alat Percobaan
Materi genetik yang digunakan adalah sampel daun muda plasma nutfah sorgum sebanyak 20 aksesi. Bahan lainnya adalah paket bahan kimia yang digunakan dalam kegiatan isolasi DNA pada umumnya seperti buffer cetyl trimetylammonium bromide
(CTAB), ß-mercaptoethanol, chloroform isoamyl alcohol
Uji Kualitas dan Kuantitas DNA Plasma Nutfah Sorgum (Fristy Damanik)
es batu, agarose, buffer tris borate EDTA (TBE) 0.5X, loading dye, serta etidium bromida (EtBr). Alat yang digunakan adalah
autoclave, termos es, timbangan analitis, gunting, mortar, pestel, spatula, tabung mikrosentrifus 1,5 ml, pipet mikro, tip
mikro, waterbath, vortex mixer, sentrifus, tabung erlenmeyer, gelas ukur, magnetic stirrer, hot plate, freezer, perangkat
elektroforesis, nampan, UV transilluminator, kamera, dan
spektrofotometer.
Persiapan Percobaan Persiapan Sampel
Sampel daun muda sorgum berusia sekitar 14 hari setelah tanam diambil dari Kebun Percobaan Maros kemudian dibersihkan dari kotoran dan disimpan dalam kondisi dingin pada suhu 4º C.
Isolasi DNA
Pada tahapan ini isolasi DNA menggunakan metode ekstraksi
modifikasi prosedur George et al (2008) dengan menggunakan penambahan buffer CTAB (cetyl trimetylammonium bromide). Sampel daun ditimbang masing-masing sebanyak 0,4 gram dan dimasukkan ke dalam mortar. Setelah itu digerus menggunakan pestel dengan menambahkan CTAB hingga halus, sedemikian rupa diusahakan agar tidak sampai berbusa.
Sampel yang telah halus dimasukkan ke dalam dua tabung mikro dengan volume yang sama kemudian ditambahkan ß-mercaptoethanol sebanyak 10 µl setiap tabung mikro. Selanjutnya tabung mikro diinkubasi dalam
waterbath pada suhu 60ºC selama 60 menit dengan teknik setiap 15 menit tabung dibolak-balik. Setelah 60 menit tabung dikeluarkan dari waterbath, didinginkan lalu ditambahkan
chloroform isoamylalkohol (chisam) kemudian dihomogenkan menggunakan vortex mixer selama 10 menit, dan selanjutnya disentrifugasi dengan kecepatan 11600 rpm selama 10 menit.
Hasil sentrifugasi terbentuk tiga lapisan yaitu supernatan, pelet dan chisam. Supernatan (cairan bening yang paling atas) dipindahkan ke tube dengan hati-hati dan ditambahkan isopropanol dingin kemudian disimpan di dalam freezer semalaman. Tabung dikeluarkan dari freezer, setelah supernatan mencair kemudian tabung diputar-putar hingga terbentuk untaian DNA berupa benang-benang halus. Tabung disentrifugasi selama 10 menit untuk mengendapkan DNA di dasar tabung. Endapan dan cairan dipisah dengan cara membuang cairan supernatan dengan hati-hati sehingga yang tersisa hanya endapan DNA.
Endapan DNA dicuci dengan menambahkan etanol 70% dingin dan didiamkan selama 10 menit. Etanol 70% dingin kemudian dibuang dengan hati-hati agar DNA tidak ikut
terbuang. Selanjutnya ditambahkan lagi etanol 70% dingin untuk pencucian kedua kalinya dan didiamkan kembali selama 10 menit lalu etanol 70% dingin dibuang.
Tahap berikutnya adalah mengeringkan pellet DNA dengan cara membalik tabung di atas nampan yang telah dilapisi tissue. Setelah cukup kering, ke dalam tabung yang berisi pellet
DNA ditambahkan buffer Tris-EDTA dan kemudian diinkubasi
menggunakan waterbath selama 60 menit. Setelah DNA larut
dalam buffer Tris-EDTA, larutan dihomogenkan dengan cara
disentifugasi menggunakan vortex. Pembuatan Gel Agarosa 1%
Pengujian kualitas dan kuantitas DNA memerlukan gel agarosa sebagai media untuk proses elektroforesis. Gel dibuat dengan melarutkan 1 gram agarosa dengan 100 ml TBE ke dalam labu erlenmeyer dan dihomogenkan menggunakan magnetic stirrer diatas hotplate. Setelah larutan terlihat bening, dinginkan dan tuang diatas cetakan yang telah dipasangi sisir untuk membuat sumur gel. Setelah gel mengeras, angkat sisir dari cetakan.
Perlakuan Percobaan
Uji Kualitas DNA Sorgum Secara Gel Elektroforesis
Pengujian kualitas DNA secara gel elektroforesis diawali dengan mencampurkan 4 µl larutan DNA dengan loading dye di atas parafilm. Agar konsentrasi DNA dapat diestimasi,
terlebih dulu disiapkan standar DNA dengan mencampurkan lambda 50 ng/µl, 100 ng/µl, 200 ng/µl dan 300 ng/µl dengan
dye. Kemudian campuran DNA dan loading dye dimasukkan ke dalam sumur gel diikuti standar DNA lambda pada 4 sumur pertama dan dilanjutkan dengan setiap sampel pada sumur berikutnya untuk kedua puluh aksesi DNA sorgum yang diuji. Setelah itu gel agarose di-running di alat elektroforesis
pada tegangan listrik 110 volt selama 1-2 jam. Ketika proses
elektroforesis selesai dilakukan, gel agarose diberi pewarna (di-staining) dengan cara merendam ke dalam larutan ethidium bromida selama 30 menit dan kemudian di-destaining dengan merendam gel ke dalam ultrapure selama 30 menit. Selanjutnya gel agarose divisualisasi pada alat transilluminator dengan kamera. Hasil visualisasi akan memperlihatkan kualitas dan konsentrasi DNA sorgum yang dibandingkan terhadap DNA standar lambda.
Uji Kuantitas DNA Sorgum pada Spektrofotometer
Uji kuantitas DNA sorgum pada spektrofotometer dilakukan dengan cara memipet 3 µl larutan DNA sorgum ke alat
spektrofotometer pada panjang gelombang 260 nm dan 280 nm sehingga diperoleh nilai kemurnian dan konsentrasi
DNA sorgum yang secara otomatis dapat dibaca oleh alat. Konsentrasi DNA diukur pada panjang gelombang 260 nm sedangkan protein diukur pada panjang gelombang 280 nm. Kemurnian DNA dihitung melalui perbandingan A260 nm dengan A280 nm. Batas kemurnian yang biasa dipakai dalam analisis molekuler adalah 1,8 – 2,0 (Sambrook dan Russel, 1989).
Peubah Percobaan
Peubah yang diamati pada percobaan ini adalah konsentrasi dan kemurnian DNA setiap aksesi sorgum.
Penyajian Data Percobaan
Data yang berhasil dihimpun melalui pengamatan dan pengukuran peubah percobaan dihitung nilai rata-ratanya dan disajikan dalam bentuk tabel.
HASIL DAN PEMBAHASAN Uji Kualitas DNA Sorgum Secara elektroforesis Gel Kualitas DNA yang baik yang diperoleh dari hasil ekstraksi merupakan syarat dasar yang harus dipenuhi dalam studi molekuler, terutama dalam penandaan sidik jari (Syafaruddin dan Randriani, 2011). Untuk menghasilkan kualitas dan kuantitas DNA yang murni yang bebas dari RNA atau protein dan kontaminasi kotoran, teknik isolasi DNA merupakan faktor penentu dalam ekstraksi DNA. Tingkat kuantitas hasil ekstraksi DNA ditunjukkan oleh tebal tipisnya DNA yang berpendar dibandingkan dengan pendaran pengenceran lambda DNA. Pada gambar 1 ditampilkan hasil uji kualitas DNA pada gel
elektroforesis yang menunjukkan isolasi DNA berhasil dengan kualitas DNA yang cukup baik. Hal ini terlihat dari rata-rata nilai konsentrasi DNA yang dihasilkan setiap aksesi sorgum jika dibanding dengan standar lambda DNA sekitar 300 ng/µl. Hasil ini relatif bagus karena DNA yang dihasilkan memiliki konsentrasi tinggi sehingga nantinya dapat diencerkan menjadi konsentrasi yang lebih rendah sesuai dengan kebutuhan proses PCR. Namun dari hasil gel elektroforesis masih terlihat adanya kotoran berupa RNA atau protein yang menunjukkan gambaran smear pada elektrogramnya. Pita DNA yang
smear dapat disebabkan oleh terdegradasinya sampel DNA (Noer dan Gustiananda, 1997). Pita DNA yang smear perlu dimurnikan dengan penambahan phenol : kloroform : isoamil
alkohol (P:C:I) yang berfungsi untuk mrnghilangkan senyawa-senyawa kontaminan DNA dan mendenaturasi protein tanpa mengikutserakan DNA (Eknath et al, 1991; Syafaruddin dan Santoso, 2011).
Uji kuantitas DNA Secara Spektrofotometer
Prinsip dasar uji kualitas DNA pada spektrofotometer adalah sampel DNA harus jernih dan larut sempurna. DNA yang mengandung basa-basa purin dan pirimidin dapat menyerap cahaya UV. Konsentrasi DNA dapat menyerap cahaya UV pada 260 nm sedangkan kontaminan protein dapat menyerap cahaya pada 280 nm. Dengan adanya perbedaan penyerapan cahaya UV ini, kemurnian DNA dapat diukur dengan menghitung nilai absorbansi 260 nm dibagi dengan nilai absorbansi 280 nm. Batas kemurnian yang biasa dipakai dalam analisis molekuler adalah 1.8 – 2,0 (Sambrook dan Russel, 1989). Nilai kemurnian DNA yang berada di bawah dan di atas batas kemurnian menunjukkan bahwa DNA tersebut terkontaminasi dengan protein dan kotoran senyawa lainnya.
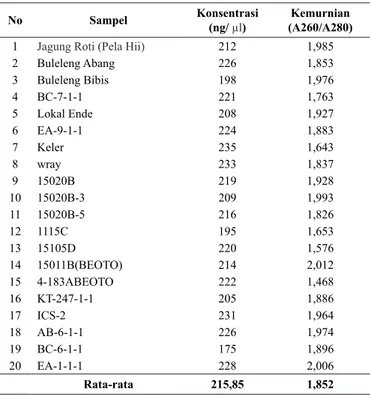
Berdasarkan hasil pengujian kualitas dan kuantitas DNA sorgum secara spektrofotometer menunjukkan kuantitas DNA yang dihasilkan cukup baik dengan nilai konsentrasi antara 175 – 235 ng/µl. Nilai konsentrasi terendah terdapat pada sampel BC-6-1-1, tertinggi terdapat pada sampel Keler, dan rerata konsentrasi DNA semua sampel 215,85 ng/µl (Tabel 1).
Gambar 1. Hasil uji kualitas DNA sorgum pada gel agarose 1%
Tabel 1. Hasil pengujian konsentrasi dan kemurnian DNA sorgum secara spektrofotometer
No Sampel Konsentrasi (ng/ µl) (A260/A280)Kemurnian 1 Jagung Roti (Pela Hii) 212 1,985
2 Buleleng Abang 226 1,853 3 Buleleng Bibis 198 1,976 4 BC-7-1-1 221 1,763 5 Lokal Ende 208 1,927 6 EA-9-1-1 224 1,883 7 Keler 235 1,643 8 wray 233 1,837 9 15020B 219 1,928 10 15020B-3 209 1,993 11 15020B-5 216 1,826 12 1115C 195 1,653 13 15105D 220 1,576 14 15011B(BEOTO) 214 2,012 15 4-183ABEOTO 222 1,468 16 KT-247-1-1 205 1,886 17 ICS-2 231 1,964 18 AB-6-1-1 226 1,974 19 BC-6-1-1 175 1,896 20 EA-1-1-1 228 2,006 Rata-rata 215,85 1,852
Uji Kualitas dan Kuantitas DNA Plasma Nutfah Sorgum (Fristy Damanik)
Konsentrasi DNA yang dihasilkan cukup banyak untuk standar pengenceran pada proses PCR setara 10 ng/ µl. Sedangkan kemurnian DNA berada pada kisaran 1,643 – 2,012 dengan rerata 1,852. Hal ini masih sesuai dengan standart kemurnian DNA dalam kisaran 1,8-2,0 (Sambrook dan Russel, 1989). Sampel dengan nilai kemurnian dibawah 1,8 menunjukkan DNA terkontaminasi dengan protein dan senyawa lainnya sebagaimana terlihat pada sampel BC-7-1-1, Keler, 1115C, 15105D, dan 4-183ABEOTO. DNA yang terkontaminasi protein dan kotoran senyawa lainnya dapat dimurnikan dengan penambahan campuran phenol-kloroform-isoamyl alkohol yang menyebabkan protein kehilangan kelarutannya dan mengalami presipitasi. Presipitasi tersebut dapat memisahkan dari DNA melalui proses sentrifugasi yang membentuk 2 fase yang terpisah, yakni fase organik pada lapisan bawah dan fase aquoes pada lapisan atas. DNA berada pada lapisan aqueous sedangkan protein yang terdenaturasi berada pada lapisan organik.
KESIMPULAN
Kualitas dan kuantitas DNA yang diuji pada gel elektroforesis dan pada spektrofotometer menunjukkan konsentrasi DNA yang dihasilkan cukup besar dan masih sesuai dengan standar kebutuhan pengenceran proses PCR selanjutnya yaitu setara 10 ng/ul namun ada beberapa DNA masih terkontaminasi RNA atau protein sehingga perlu dilakukan pemurnian DNA dengan penambahan campuran senyawa phenol : kloroform : isoamyl
alkohol (P:C:I).
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih kepada Haryati, SP yang telah membantu penulis dalam persiapan, pelaksanaan dan pengambilan data percobaan, kepada Dr. Marcia Bunga Pabendon yang telah memberikan bimbingan dan arahan dalam penulisan naskah, serta kepada Dr. Nuning Argo Subekti yang telah mereview dan memberikan saran-saran perbaikan sehingga naskah ini layak dipublikasikan.
DAFTAR PUSTAKA
Anonim, 2010. Uji Hasil Isolasi DNA. http://uji-hasil-isolasi dna.html. Diakses pada tanggal 12 Februari 2019.
Dicko, M.H., H. Gruppen, A.S Traore, W.J.H van Berkel, and A.G.J Voragen. 2006. Sorghum grain as human food in Afrika: relevance of content of starch and amylase activities. African Journal of Biotechnology 5(5):384-395 Eknath, A.E., J.M Macaranas, R.R. Valesco, M.C.A. Ablan,
M.J.R. Panted and Pullin. 1991. Biochemichal and Morphometric Aproaches to Characterize Farmed Tilapia. NAGA.
Fatchiyah., 2011. Modul Pelatihan Analisis Fingerprinting DNA Tanaman dengan Metode RAPD. Laboratorium Sentral Ilmu Hayati Universitas Brawijaya, Malang. George, I.A. Khan, F.S. Awan, A. Ahmad and A.A. Khan.
2008. A modified mini-prep method for economical
and rapid extraction of genomic DNA in plants. Plant Molecular Biology Reporter. 22: 89a-89e.
Harahap, A.S. 2017. Uji Kualitas dan Kuantitas DNA Beberapa Populasi Pohon Kapur Sumatera. Journal of Animal Science and Agronomy Panca Budi, Medan 2: 2 Noer, A S. and M. Gustiananda. 1997. PCR Tanpa Isolasi
DNA Dari Sel Epitel Rongga Mulut. JMS Journal. Vol. 2. No.1. ITB Press, Bandung
Sambrook J. and D.W. Russel. 1989. Molecular Cloning: A Laboratory Manual. New York: Cold-Spring Harbor Pr. Syafaruddin dan E. Randriani, 2011. Efektivitas dan Efesiensi
Teknik Isolasi dan Purifikasi DNA pada Jambu Mete. Balai
Penelitian Tanaman Rempah dan Aneka Tanaman Industri. Syafaruddin dan T.J. Santoso. 2011. Optimalisasi Teknik
Isolasi dan Purifikasi DNA yang Efesien dan Efektif pada
Kemiri Sunan (Reutalis Trisperma). Jurnal Littri 17(1): 11-17
Tabri, F dan Zubachtirodin. 2013. Budidaya Tanaman Sorgum. Balai Penelitian Tanaman Serealia. hal 175-186
Yulita, R dan Risda. 2006. Pengembangan sorgum di Indonesia. Direktorat Budi daya Serealia. Ditjen Tanaman Pangan, Jakarta.
PEMBUATAN SABUN MANDI PADAT BERBASIS
VIRGIN COCONUT OIL
DENGAN
PENAMBAHAN AMPAS KELAPA SEBAGAI
SCRUB
Nugroho Utomo
1dan Putri Wulan Adiningrum
2Teknisi Litkayasa Pelaksana Pemula1 dan Teknisi Laboratorium2 pada Balai Penelitian Tanaman Palma
Jl. Raya Mapanget, Kotak Pos 1004 Manado 95001 - Sulawesi Utara - Indonesia Telp. (0431) 812430, Faks. (0431) 812017
E-mail: [email protected]
ABSTRAK
Sabun adalah sediaan pembersih kulit yang dibuat melalui proses saponifikasi atau netralisasi lemak, minyak, wax, rosin atau asam dengan basa tanpa menimbulkan iritasi. Salah satu minyak yang digunakan dalam pembuatan sabun adalah virgin coconut oil (VCO). VCO mengandung asam lemak rantai medium yang berfungsi sebagai antimikroba, antivirus, dan antijamur. Tujuan percobaan adalah untuk mengetahui pengaruh komposisi formula sabun padat dengan penambahan ampas kelapa sebagai scrub terhadap karakteristik sensoris dan fisikokimia sabun. Metode yang digunakan adalah dengan tahapan formulasi sabun dengan perbandingan antara VCO dan minyak sawit. Terdapat tiga formula sabun yang dibuat, yaitu menggunakan VCO dan minyak sawit dengan perbandingan 25% : 25% (formula 1), 12,5% : 37,5% (formula 2), dan 37,5% : 12,5% (formula 3). Proses pembuatannya adalah dengan mencampurkan NaOH dan minyak (VCO dan minyak sawit) kemudian ditambahkan ampas kelapa dan fragrance oil. Selanjutnya dilakukan pencetakan, aging selama 24 jam, dan curing sampai 4 minggu. Selama masa curing dilakukan pengujian organoleptik dan analisis kimia, yang meliputi nilai pH, kadar air dan alkali bebas/asam lemak bebas. Hasil percobaan menunjukkan bahwa formula 3 dengan perbandingan VCO dan minyak sawit 37,5% : 12,5% merupakan formula terbaik dan paling disukai oleh panelis dengan rata-rata nilai tingkat kesukaan 3–4 (netral–suka). Untuk kadar air, pH, dan alkali bebas/asam lemak bebas, formula 3 memenuhi standar mutu yang dipersyaratkan SNI sabun mandi padat.
Kata kunci: sabun mandi padat, VCO, minyak sawit, ampas kelapa
PENDAHULUAN
Sabun adalah sediaan pembersih kulit yang dibuat melalui
proses saponifikasi atau netralisasi lemak, minyak, wax,
rosin atau asam dengan basa organik atau anorganik tanpa menimbulkan iritasi pada kulit (Badan Standarisasi Nasional 2016). Hingga saat ini, sabun mandi mengalami perkembangan pesat yang ditandai semakin bervariasinya jenis sabun mandi dengan berbagai bahan tambahan yang diklaim bermanfaat bagi kesehatan kulit. Sabun konvensional yang diproduksi pabrik merupakan campuran kompleks dari bahan detergen seperti sodium lauril sulfat dan sodium laurat sulfat serta bahan lain
yang limbahnya dapat mencemari air (Taufik 2006). Produk
sabun lain yang banyak beredar di masyarakat adalah sabun alami, yang terbuat dari minyak nabati yang dicampur dengan bahan lain dan tidak mengandung detergen. Sabun jenis ini
digemari masyarakat seiring dengan meningkatnya kesadaran akan pola hidup sehat dan pencemaran lingkungan. Salah satu jenis minyak nabati yang digunakan dalam pembuatan sabun adalah minyak kelapa murni atau virgin coconut oil (VCO).
VCO adalah minyak kelapa yang diproses dari kelapa segar dengan atau tanpa pemanasan dan tidak melalui pemurnian dengan bahan kimia. Bila dibandingkan dengan minyak kelapa yang diolah secara tradisional, VCO memiliki keunggulan, antara lain kadar air dan asam lemak bebas rendah, tidak berwarna (bening), beraroma harum, dan daya simpannya lebih lama. Selain itu, VCO memiliki keunikan tersendiri dibandingkan dengan minyak nabati lain, yaitu sebagian besar asam lemak yang terkandung di dalamnya merupakan asam lemak rantai medium (ALRM). ALRM dalam VCO terdiri atas asam laurat, asam miristat, asam kaprilat, dan asam kaprat yang berfungsi sebagai antimikroba, antivirus, dan antijamur (Karouw et al. 2014). VCO dikategorikan sebagai minyak sehat dan pangan fungsional sehingga banyak dimanfaatkan sebagai bahan baku farmasi, kosmetik, dan pangan (Rindengan 2003). Pada pembuatan sabun mandi, penggunaan VCO akan memberikan tekstur yang lembut dan halus pada kulit karena VCO memiliki struktur molekul minyak yang kecil sehingga mudah diserap kulit. Kandungan asam laurat dalam VCO mampu memberikan sifat pembusaan yang sangat baik dan lembut pada produk sabun. Selain itu, asam laurat juga bersifat antivirus, antibakteri, dan anti jamur.
Untuk meningkatkan manfaat sabun VCO dapat ditambahkan ampas kelapa sebagai scrub. Ampas kelapa merupakan produk ikutan dari pengolahan VCO dan masih mempunyai nilai ekonomis sebagai bahan pangan fungsional maupun pakan ternak (Rindengan 1997). Selain itu, ampas kelapa mengandung protein, karbohidrat, rendah lemak, dan kaya akan serat kasar. Dengan berbagai kandungan tersebut, ampas kelapa dapat dijadikan sebagai scrub yang memiliki butir-butir kasar yang berfungsi mengangkat sel kulit mati (Putri 2010). Oleh karena itu, dalam pembuatan sabun, ampas kelapa dapat dimanfaatkan sebagai pembersih, pelembap ringan, dan menghaluskan kulit. Tujuan percobaan adalah untuk mengetahui pengaruh formula sabun padat berbasis VCO dengan penambahan ampas kelapa sebagai scrub terhadap
Pembuatan Sabun Mandi Padat Berbasis Virgin Coconut Oildengan Penambahan Ampas Kelapa Sebagai Scrub (Nugroho Utomo, Putri Wulan Adiningrum)
BAHAN DAN METODE Tempat dan Waktu Percobaan
Percobaan dilaksanakan di Laboratorium Pascapanen dan
Ekofisiologi Balai Penelitian Tanaman Palma, Manado, pada
bulan Januari - Maret 2019.
Bahan dan Alat Percobaan
Bahan yang digunakan dalam pembuatan sabun adalah minyak sawit, VCO, minyak zaitun, natrium hidroksida (NaOH),
fragrance oil, akuades, dan bahan kimia lain yang digunakan untuk analisis. Alat yang digunakan yaitu timbangan, pengaduk, termometer, wadah stainless, wadah plastik, gelas ukur, cetakan, pisau, baki, dan alat untuk analisis.
Tahapan Percobaan Pembuatan Sabun
Pembuatan sabun mengacu pada penelitian yang dilakukan
Sukawaty (2016) dengan modifikasi penambahan ampas
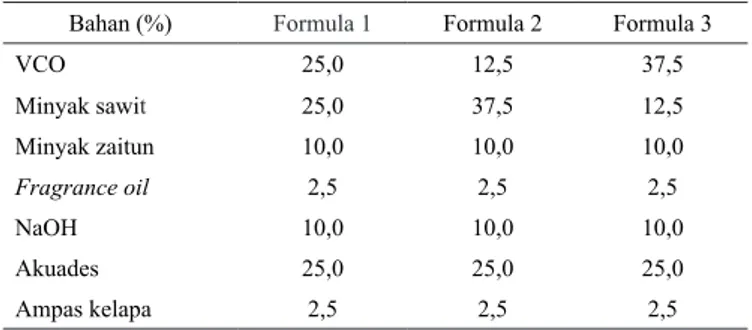
kelapa. Perlakuan percobaan yaitu rasio VCO dan minyak sawit dengan komposisi formula disajikan pada Tabel 1.
Proses pembuatan sabun terdiri atas tiga tahap, yaitu pencampuran bahan, aging, dan curing. VCO, minyak zaitun, dan minyak sawit dimasukkan ke dalam gelas piala, kemudian ditambahkan larutan NaOH sedikit demi sedikit sambil diaduk sampai terjadi trace atau sabun telah mengental. Selanjutnya, ditambahkan ampas kelapa dan fragrance oil dan diaduk kembali sampai homogen.
Campuran lalu dimasukkan ke dalam cetakan dan didiamkan (aging) selama 24 jam, kemudian dilakukan curing
(pemeraman) selama 4 minggu. Selama masa curing dilakukan analisis mutu pada hari ke-2, 8, 15, 22, dan 29.
Tabel 1. Formulasi sabun mandi berbasis VCO
Bahan (%) Formula 1 Formula 2 Formula 3
VCO 25,0 12,5 37,5 Minyak sawit 25,0 37,5 12,5 Minyak zaitun 10,0 10,0 10,0 Fragrance oil 2,5 2,5 2,5 NaOH 10,0 10,0 10,0 Akuades 25,0 25,0 25,0 Ampas kelapa 2,5 2,5 2,5 Peubah Percobaan
Peubah yang diamati dan dihitung adalah sifat fisikokimia
produk sabun yang dihasilkan dan uji organoleptik. Analisis
fisikokimia meliputi analisis kadar air (SNI 3532:2016), pH
(SNI 3532:2016), dan alkali bebas/asam lemak bebas (SNI 3532 : 2016).
Uji organoleptik dilakukan untuk mengetahui penerimaan konsumen terhadap sabun padat yang dihasilkan. Pengujian yang dilakukan adalah uji kesukaan (hedonik) dengan parameter yang diamati antara lain warna, aroma, kekerasan, efek rasa, dan banyak busa. Panelis berjumlah 20 orang yang tidak terlatih. Penilaiannya bedasarkan pada tingkat kesukaan dengan skala 1 (sangat tidak suka), 2 (tidak suka), 3 (netral), 4 (suka), dan 5 (sangat suka). Untuk menentukan produk yang paling disukai dilakukan dengan cara menjumlahkan nilai persentase panelis yang menyatakan suka (4) dan sangat suka (5). Kedua nilai tertinggi tersebut dinyatakan sebagai persentase kesukaan panelis pada produk sabun padat dengan penambahan ampas kelapa.
HASIL DAN PEMBAHASAN Kadar Air
Hasil pengujian kadar air dari tiga komposisi formula sabun mandi disajikan pada Tabel 2.
Tabel 2. Hasil analisis kadar air tiga formula sabun mandi VCO
Formula
Kadar air (%) Hari
ke-2 Hari ke-8 ke-15Hari ke-22Hari ke-29Hari SNI maks (%) 1 27,70 20,48 7,54 13,53 12,28 15 2 26,75 19,26 8,47 12,92 10,95 15 3 26,74 18,05 9,79 13,34 11,78 15
Data pada Tabel 2 menunjukkan terjadinya penurunan kadar air pada setiap minggu. Kadar air sabun pada hari ke-2 dan ke-8 untuk formula 1 masing-masing adalah 27,70% dan 20,48%, formula 2 sebesar 26,75% dan 19,26%, dan formula 3 masing-masing 26,74% dan 18,05%. Penurunan kadar air rata- rata pada ketiga formula tersebut sekitar 7,8%. Kadar air pada masa curing tersebut belum memenuhi syarat mutu SNI, yaitu maksimal 15%. Hal ini disebabkan oleh masa curing
yang belum optimal. Kadar air sabun pada hari ke-22 dan ke-29 berkisar antara 13,53%-10,95% dan telah memenuhi syarat mutu SNI. Untuk kadar air pada hari ke-15 terdapat penyimpangan, yaitu 7,54%-9,79%. Hal ini dikarenakan adanya kesalahan dalam pengambilan sampel. Sampel yang digunakan untuk pengujian seharusnya merupakan sabun utuh yang baru dihaluskan, bukan sisa analisis pada minggu sebelumnya.
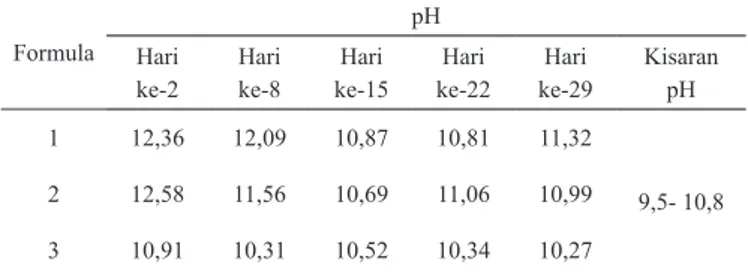
Tabel 3. Hasil analisis pH tiga formula sabun mandi VCO
Formula
pH Hari
ke-2 Hari ke-8 ke-15Hari ke-22Hari ke-29Hari Kisaran pH 1 12,36 12,09 10,87 10,81 11,32
9,5- 10,8 2 12,58 11,56 10,69 11,06 10,99
3 10,91 10,31 10,52 10,34 10,27
Tabel 4. Hasil analisis alkali bebas dan asam lemak bebas tiga formula sabun mandi VCO Formula Alkali bebas (%) SNI maks (%) Hari
ke- 8 ke-15Hari ke-22Hari ke-29Hari
1 0,04 0,03 0,03 0,03 0,1 2 0,06 0,03 0,08 0,02 0,1 3 0,01 - - - 2,5 Formula Asam lemak (%) SNI Maks (%) Hari ke-8 ke-15Hari ke-22Hari ke-29Hari
3 0,08 0,13 0,16 0,12 2,5
Formula 3 terbaca sebagai asam lemak sehingga tidak terdapat kadar alkali bebas pada hari ke-15, 22, dan 29.
Tabel 5. Data rata-rata penerimaan panelis terhadap tiga formula sabun mandi VCO
Formula Warna Aroma Tekstur Efek rasa Busa
1 3,38 3,41 3,59 3,35 3,61
2 3,23 3,36 3,29 3,53 3,59
3 3,05 3,83 3,15 3,56 3,81
Derajat Keasaman (pH)
Hasil pengujian pH sabun mandi disajikan pada Tabel 3. Data pada tabel tersebut menunjukkan bahwa Formula 1 dan 2 tidak memenuhi kisaran pH yang dipersyaratkan.
Nilai pH tertinggi diperlihatkan oleh Formula 1, yaitu 11,32, sedangkan pH terendah terdapat pada sabun Formula 3 (10,27). Jellinek (1970) menjelaskan bahwa pH sabun umumnya berkisar antara 9,5–10,8. Formula 3 dengan penambahan VCO terbanyak (37,5%) dan masa curing 8, 15, 22 dan 29 hari merupakan sabun dengan kisaran pH yang paling sesuai. Hal ini dikarenakan masa curing sabun belum optimal untuk menurunkan pH. Sabun Formula 3 dengan masa
curing 3-4 minggu aman untuk digunakan dengan kisaran pH sesuai yang dipersyaratkan yaitu 10,27 – 10,34.
Derajat keasaman (pH) merupakan parameter kimiawi untuk mengetahui sabun yang dihasilkan bersifat asam atau basa. pH merupakan parameter penting dalam produk kosmetik karena nilai pH dapat memengaruhi daya absorbsi kulit yang dapat berakibat pada iritasi kulit seperti gatal, luka atau mengelupas.
Alkali Bebas dan Asam Lemak Bebas
Alkali bebas adalah alkali dalam sabun yang tidak terikat dengan asam lemak membentuk garam asam lemak (sabun). Mengacu pada SNI, nilai alkali dalam sabun mandi tidak boleh melebihi 0,1% untuk natrium, sedangkan bila terbaca sebagai asam lemak bebas maksimal 2,5%. Alkali memiliki sifat yang keras dan dapat mengakibatkan iritasi pada kulit. Bila kadar alkali bebas terlalu tinggi maka kulit akan menjadi kering (Langingi 2012). Analisis yang dilakukan pada minggu ke-1, ke-2, ke-3, dan ke-4 bertujuan untuk mengetahui kadar alkali bebas dan asam lemak bebas sehingga dapat diketahui pada minggu ke berapa sabun aman untuk digunakan.
Berdasarkan hasil analisis kadar alkali bebas dan asam lemak bebas, tingkat penambahan VCO pada pembuatan sabun padat memberikan pengaruh yang berbeda dengan kadar alkali bebas antara 0,01–0,08% dan kadar asam lemak bebas 0,08–
Berdasarkan Tabel 4 diketahui bahwa kadar alkali bebas tertinggi terdapat pada sabun Formula 2 (penambahan VCO 12,5%) dengan nilai 0,02–0,08%. Sabun Formula 3 (penambahan VCO 37,5%) pada minggu pertama kadar alkalinya 0,01% dan asam lemak bebas 0,08%. Pada minggu ke-2, 3, dan 4 tidak terdapat alkali bebas tetapi terbaca sebagai asam lemak bebas antara 0,08–0,16%. Jumlah alkali bebas dan asam lemak bebas pada sabun dipengaruhi oleh jumlah alkali (NaOH) dan penambahan VCO. Semakin banyak VCO yang digunakan, asam lemak yang bereaksi dengan air (proses hidrolisis) semakin banyak sehingga menghasilkan asam lemak bebas yang tinggi. Kadar alkali bebas dan asam lemak bebas pada sabun yang dihasilkan (Tabel 4) sesuai dengan SNI. Dengan demikian dapat disimpulkan bahwa sabun mandi padat berbasis VCO dengan penambahan ampas kelapa aman untuk digunakan.
Uji Organoleptik
Data rata-rata penerimaan panelis terhadap sabun mandi yang dihasilkan disajikan pada Tabel 5. Berdasarkan data tesebut, rata-rata nilai parameter warna, aroma, tekstur, efek rasa, dan busa berada pada kisaran 3–4 atau pada tingkat kesukaan netral sampai suka. Data tiap parameter uji disajikan pada Gambar 1–4.
0,12%. Hasil pengujian kadar alkali bebas dan asam lemak bebas sabun mandi disajikan pada Tabel 4.
Pembuatan Sabun Mandi Padat Berbasis Virgin Coconut Oildengan Penambahan Ampas Kelapa Sebagai Scrub (Nugroho Utomo, Putri Wulan Adiningrum)
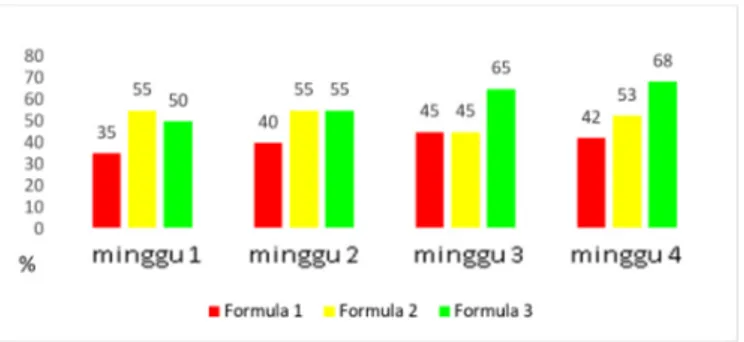
Warna
Berdasarkan Gambar 1 dapat dilihat bahwa persentase panelis yang menyukai sabun Formula 1 dan 2 cenderung mengalami penurunan. Formula 1 pada minggu pertama disukai oleh 65% panelis dan terus menurun sampai minggu ke-4 yang hanya disukai oleh 32% panelis. Sabun Formula 2 disukai oleh 40% panelis pada minggu pertama dan menurun sampai 16% pada minggu ke-4. Untuk Formula 3, meskipun ada penurunan pada minggu ketiga, tingkat kesukaan panelis cenderung meningkat dari 20% pada minggu pertama menjadi 53% pada minggu keempat. Hal ini terjadi karena adanya perubahan warna yang
siginifikan pada Formula 1 dan 2 yang cenderung memudar.
Sementara sabun Formula 3 dengan kandungan VCO terbanyak (37,5%) warnanya lebih stabil.
Gambar 1. Hasil uji organoleptik tiga formula sabun mandi VCO pada parameter warna
Aroma
Hasil pengujian organoleptik sabun mandi VCO dengan penambahan ampas kelapa menunjukkan adanya keragaman data (Gambar 2). Untuk Formula 1 dan 2, persentase kesukaan panelis cenderung menurun pada setiap minggunya. Pada Formula 1, persentase kesukaan tertinggi 60% pada minggu pertama terus mengalami penurunan hingga minggu ke-4 menjadi 32%. Formula 2 dengan persentase tertinggi 65% pada minggu ke-2 mengalami penurunan menjadi 26% pada minggu ke-4. Hal ini berbanding terbalik dengan sabun Formula 3. Nilai terendah adalah 55% pada minggu ke-2 dan tertinggi pada minggu ke-3, yaitu sebanyak 85% panelis menyukai aromanya. Pada minggu ke-4 terjadi penurunan menjadi 68% yang merupakan angka yang lebih tinggi dibandingkan dengan formula lain. Ini menunjukkan bahwa aroma sabun Formula 3 dengan VCO 37,5% lebih disukai dan lebih stabil selama masa curing, dengan persentase kesukaan tertinggi 85% pada minggu ketiga.
Tekstur
Pengujian yang dilaksanakan empat kali selama masa curing
memperoleh hasil yang beragam. Nilai terendah 20% dan tertinggi 70% terhadap tiga formula sabun membuktikan adanya keragaman tekstur. Panelis paling menyukai sabun Formula 1 dengan tingkat kesukaan 47–70%. Menurut panelis, sabun Formula 1 lebih keras dibandingkan dengan Formula 3 yang cenderung lunak. Berdasarkan hal tersebut dapat disimpulkan bahwa panelis lebih menyukai sabun padat dengan tekstur yang keras.
Gambar 2. Hasil uji organoleptik tiga formula sabun mandi VCO pada parameter aroma
Gambar 3. Hasil uji organoleptik tiga formula sabun mandi pada parameter tekstur
Efek Rasa
Beberapa catatan dari panelis mengenai efek rasa setelah penggunaan sabun adalah adanya rasa gatal dan panas (iritasi). Hal ini ditemukan pada Formula 1 pada minggu pertama sebanyak 10% panelis dan 5% pada Formula 3. Pada minggu ke-2, ke-3, dan ke-4, sebanyak 5% panelis menyatakan agak gatal saat menggunakan Formula 1. Formula 1 disukai oleh 35%-45% panelis dan Formula 2 disukai 45%-55% panelis. Formula 3 paling disukai panelis dengan persentase 50% pada minggu pertama dan terus meningkat sampai 68% pada minggu keempat. Beberapa panelis memberikan catatan bahwa Formula 3 memberikan efek lembap pada kulit setelah pemakaian sabun.
Gambar 4. Hasil uji organoleptik tiga formula sabun mandi pada parameter efek rasa
Busa
Busa merupakan bagian penting dalam penggunaan sabun. Sebagian panelis lebih menyukai sabun dengan busa banyak dan sebagian lagi menyukai sabun yang berbusa sedikit. Beberapa panelis menyatakan bahwa sabun Formula 3 mempunyai busa yang banyak dan terasa lembut pada saat pemakaian. Hasil uji organoleptik kesukaan panelis terhadap busa berkisar antara 35–84%. Rata-rata selama empat kali pengujian, Formula 2 memperoleh nilai terendah yaitu 61%, sementara 74% panelis menyukai busa sabun Formula 3. Ini berarti bahwa sabun dengan kandungan VCO terbanyak (37,5%) paling disukai oleh panelis dari sisi keluaran busa pada saat pemakaian. Data hasil pengujian organoleptik parameter busa disajikan pada Tabel 6.
Tabel 6. Hasil uji organoleptik tiga formula sabun mandi pada param-eter kesukaan terhadap busa
Minggu
Tingkat kesukaan panelis terhadap formula (%) 1 2 3 1 70 80 70 2 65 75 70 3 70 35 70 4 53 53 84 Rata-rata (%) 64 61 74
Scrub Ampas Kelapa
Ampas kelapa merupakan hasil samping dari proses pengolahan VCO. Kandungan protein, karbohidrat, dan lemak yang rendah pada ampas kelapa dapat melembapkan kulit. Sementara kandungan serat kasar yang tinggi berfungsi sebagai scrub
yang dapat mengikis lapisan kulit luar yang kasar dan kering, termasuk sel kulit mati. Oleh karena itu, penggunaan ampas
kelapa pada sabun mandi dapat menjadikan kulit terasa lebih bersih dan lembap.
KESIMPULAN
Formula sabun mandi terbaik adalah Formula 3 dengan kandungan VCO 37,5%. Mutu produk sabun Formula 3 juga telah memenuhi standar yang disyaratkan dalam SNI sabun mandi padat. Sabun mandi Formula 3 paling disukai panelis untuk parameter warna, aroma, efek rasa, dan busa. Sabun mandi padat berbasis VCO dengan penambahan ampas kelapa dapat digunakan dengan aman pada minggu ketiga masa curing
dan bermanfaat sebagai scrub.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Ismail Maskromo, M.Si; Ibu Ir. Rindengan Barlina, M.Si, dan Ibu
Linda Trivana S.Si beserta staf Laboratorium Ekofisiologi
Balai Penelitian Tanaman Palma atas dukungan dan bimbingan dalam pelaksanaan percobaan dan pembuatan karya tulis ini.
DAFTAR PUSTAKA
Badan Standarisasi Nasional. 2016. Standar Nasional Indonesia (SNI) Sabun Mandi Padat No.3532: 2016. Jakarta.
Karouw, S., L. Trivana., B. Rindengan dan B. Santosa. 2016. Hidrolisis enzimatis minyak kelapa dengan lipase dari
Rhyzomucor miehei. Buletin Palma 17(1): 35–40.
Jellinek, S. 1970. Formulation and Function of Cosmetics. Wiley Interscience, New York. 586p.
Langingi, R., L.I. Momuat., M.G. Kumaunang. 2012. Pembuatan sabun mandi padat dari VCO yang mengandung karotenoid wortel. Jurnal MIPA UNSRAT. 1 (1): 20–23. Putri, M. F. 2010. Tepung ampas kelapa pada umur panen
11-12 bulan sebagai bahan pangan sumber kesehatan. Jurnal Kompetensi Teknik 1(2): 98–105.
Rindengan, B. 2003. Pengembangan minyak kelapa murni (virgin coconut oil) untuk industri farmasi dan kosmetika. Makalah disampaikan pada Aplikasi Teknologi Pascapanen Komoditas Perkebunan di Makassar pada 2–7 September 2003.
Rindengan, B. 1997. Pemanfaatan ampas kelapa untuk bahan makanan rendah kalori. Jurnal Penelitian Tanaman Industri. 3(2): 56–63.
Pembuatan Sabun Mandi Padat Berbasis Virgin Coconut Oildengan Penambahan Ampas Kelapa Sebagai Scrub (Nugroho Utomo, Putri Wulan Adiningrum)
Sukawaty,Y., H. Warnida., A.V. Artha. 2016. Formulasi sediaan sabun mandi padat ekstrak etanol umbi Bawang Tiwai (Eleutherine bulbosa (Mill.) Urb.). Med. Farm. 13 (1) : 14-22.
Taufik, I. 2006. Pencemaran deterjen dalam perairan dan
dampaknya terhadap organisme air. Media Aquakultur 1 (1) : 25–32.
ESTIMASI KETIDAKPASTIAN PENETAPAN KADAR KARBON ORGANIK DALAM TANAH
METODE SPEKTROFOTOMETRI UV-VIS
Putri Wulan Adiningrum
Calon Teknisi Litkayasa Pelaksana pada Balai Penelitian Tanaman Palma Jl. Raya Mapanget, Kotak Pos 1004 Manado 95001 - Sulawesi Utara - Indonesia
Telp. (0431) 812430, Faks. (0431) 812017 E-mail: [email protected]
ABSTRAK
Kualitas hasil pengujian yang akurat dan teliti secara kuantitatif memerlukan penanganan prosedur yang benar dan melalui beberapa langkah pengukuran dengan suatu besaran yang disebut ketidakpastian (uncertainty). Tujuan percobaan adalah untuk menentukan estimasi ketidakpastian penetapan kadar karbon organik dalam tanah dengan metode spektrofotometri UV-Vis. Percobaan dilaksanakan di Laboratorium Pengujian Balai Penelitian Tanaman Palma, Manado pada bulan Mei sampai Juni 2018. Tahapan estimasi ketidakpastian penetapan kadar karbon organik yaitu (1) menyusun model langkah pengujian; (2) melakukan inventarisasi semua faktor yang dapat memberikan kontribusi kesalahan terhadap hasil akhir dalam bentuk cause and effect diagram dan mengelompokkannya ke dalam kategori komponen ketidakpastian; dan (3) melakukan estimasi masing-masing komponen ketidakpastian sehingga ekuivalen dengan simpangan baku untuk menghasilkan nilai ketidakpastian baku gabungan serta nilai ketidakpastian diperluas untuk memberikan suatu interval di mana nilai kuantitas yang diukur diperkirakan berada pada tingkat kepercayaan tertentu. Hasil percobaan menunjukkan kadar karbon organik dalam tanah berdasarkan nilai rata-rata 10 kali ulangan sebesar 1,44%. Nilai estimasi ketidakpastian penetapan kadar karbon organik dalam tanah dengan metode spektrofotometri UV-Vis sebesar 0,14%. Sementara rentang nilai benar kadar karbon organik tanah berkisar antara 1,30–1,58%.
Kata kunci: karbon organik, tanah, ketidakpastian, spektrofotometer UV-visible
PENDAHULUAN
Salah satu kebijakan Komite Akreditasi Nasional (KAN) tentang persyaratan umum kompetensi laboratorium pengujian yang terakreditasi adalah pengawasan mutu terhadap kualitas hasil pengujian yang tercakup pada butir 7.6 standar SNI ISO/ IEC 17025: 2017 (Komite Akreditasi Nasional 2018). Kualitas hasil pengujian yang akurat dan teliti secara kuantitatif memerlukan penanganan prosedur yang benar dan melalui beberapa langkah pengukuran dengan suatu besaran yang disebut ketidakpastian (uncertainty). Dalam
hal ini, laboratorium harus mengidentifikasi semua sumber
ketidakpastian dan membuat estimasi yang wajar serta memastikan bentuk pelaporan hasil yang benar terhadap suatu metode pengujian.
Ketidakpastian adalah suatu parameter yang menetapkan rentang nilai yang di dalamnya terdapat nilai benar (true value) dan memadukan semua kesalahan yang diketahui menjadi satu rentang tunggal. Menurut Kusumaningtyas et al. (2016), estimasi ketidakpastian merupakan indikator yang dapat digunakan untuk menentukan keandalan atau kapabilitas suatu laboratorium pengujian.
Laboratorium pengujian Balai Penelitian Tanaman Palma merupakan laboratorium terakreditasi KAN sesuai pedoman SNI ISO/ IEC 17025: 2017 dengan nomor akreditasi LP-998-IDN. Salah satu parameter pengujian yang masuk lingkup akreditasi adalah penetapan kadar karbon (C) organik metode spektrofotometri UV-Vis. Tahapan penetapannya dimulai dari persiapan standar dan contoh, pengukuran standar dan contoh, pengolahan data, dan pelaporan hasil. Dalam proses pengujian, sejak tahap awal sampai tahap akhir pasti terdapat sumber-sumber ketidakpastian yang akan memengaruhi hasil analisis sehingga perlu dilakukan estimasi ketidakpastian pengukuran. Sumber-sumber ketidakpastian tersebut antara lain adalah pengambilan contoh (sampling), penyiapan contoh, kalibrasi peralatan, instrumen, kesalahan random, kesalahan sistematik, dan personel. Komponen ketidakpastian dikelompokkan dalam dua tipe, yaitu tipe A (data primer) berdasarkan pekerjaan eksperimen dan tipe B (data sekunder) berdasarkan informasi
yang dapat dipercaya, seperti sertifikat kalibrasi (Kantasubrata
2008).
Tahapan estimasi ketidakpastian penetapan kadar karbon organik metode spektrofotometri UV-Vis yaitu menyusun model langkah pengujian, melakukan inventarisasi semua faktor yang dapat memberikan kontribusi kesalahan, dan melakukan estimasi masing- masing komponen ketidakpastian. Nilai estimasi harus ekuivalen dengan simpangan baku untuk menghasilkan nilai ketidakpastian baku gabungan serta nilai ketidakpastian diperluas, dan memberikan suatu interval di mana nilai kuantitas yang diukur diperkirakan berada pada tingkat kepercayaan tertentu (Kusumaningtyas et.al.
2016). Tujuan percobaan adalah untuk menentukan estimasi ketidakpastian penetapan kadar karbon organik dalam tanah dengan metode spektrofotometri UV-Vis.
Estimasi Ketidakpastian Penetapan Kadar Karbon Organik dalam Tanah Metode Spektrofotometri UV-VIS (Putri Wulan Adiningrum)
BAHAN DAN METODE Tempat dan Waktu Percobaan
Percobaan dilaksanakan di Laboratorium Pengujian Balai Penelitian Tanaman Palma, Manado pada bulan Mei sampai Juni 2018.
Bahan dan Alat Percobaan
Alat yang digunakan dalam penetapan kadar karbon organik adalah Spektrofotometer UV-Visible merek Hitachi tipe UH-5300, neraca analitik, labu ukur 100 mL, pipet volumetrik 5 mL, bulb, dispenser 10 mL, gelas piala 1 L, gelas ukur, labu ukur 1 L, dan peralatan gelas lainnya. Bahan-bahan yang digunakan yaitu contoh tanah ukuran < 0,5 mm, asam sulfat pekat, kalium dikromat 1 N, larutan standar C 5.000 ppm, dan air bebas ion.
Persiapan Percobaan Desain Estimasi Ketidakpastian
1. Tahapan Pengujian
Dasar penetapan karbon organik tanah yaitu karbon sebagai senyawa organik akan mereduksi Cr6+ yang berwarna jingga menjadi Cr3+ yang berwarna hijau dalam suasana asam. Intensitas warna hijau yang terbentuk setara dengan kadar karbon dan diukur dengan spektrofotometer UV-Vis
pada panjang gelombang 561 nm (Eviati et al. 2009). a. Pembuatan Pereaksi
• Kalium dikromat 1 N
Kalium dikromat 98,1 g dilarutkan dengan 600 mL air bebas ion dalam labu ukur 1 L, kemudian ditambahkan asam sulfat pekat 100 mL. Setelah dingin diencerkan dengan air bebas ion sampai tanda tera.
• Larutan standar C (5.000 ppm)
Glukosa p.a. 12,510 g dilarutkan dengan air bebas ion dalam labu ukur 1 L dan diimpitkan.
b. Pengerjaan Contoh
Ditimbang 0,500 g contoh tanah ukuran partikel < 0,5 mm kemudian dimasukkan ke dalam labu ukur 100 mL, ditambahkan 5 mL larutan K2Cr2O7 1 N, lalu dikocok. Selanjutnya ditambahkan 7,5 mL H2SO4 pekat, dikocok lalu didiamkan selama 30 menit. Selanjutnya, diencerkan dengan air bebas ion, dibiarkan sampai dingin, dan diimpitkan. Keesokan harinya diukur absorbansi larutan jernih dengan spektrofotometer pada panjang gelombang 561 nm. Sebagai pembanding, dibuat standar 0 dan 250 ppm dengan memipet 0 dan 5 mL larutan standar C 5.000 ppm ke dalam labu ukur 100 mL dengan perlakuan yang sama dengan pengerjaan contoh.
c. Perhitungan
Kadar karbon organik dihitung dengan menggunakan rumus:
C-organik (%) = ppm kurva x mL ekstrak/1000 mL x 100/mg contoh x Fk (1) di mana ppm kurva adalah kadar contoh yang didapat dari kurva hubungan antara kadar deret standar dengan pembacaannya setelah dikoreksi blanko; 100 adalah konversi ke persen (%); dan Fk adalah faktor koreksi kadar air.
2. Identifikasi Sumber Ketidakpastian dengan Cause and
EffectDiagram atau Fish Bone
Identifikasi sumber ketidakpastian dilakukan dengan
menggunakan cara cause and effect diagram (Gambar 1), yaitu dengan membuat skema berupa gambar tulang punggung ikan. Parameter uji diletakkan sebagai kepala
ikan, selanjutnya dilakukan identifikasi tulang utama dan
tulang kecil yang menjadi penyebab pada tulang utama.
Gambar 1. Identifikasi penyumbang ketidakpastian pada penetapan kadar karbon organik dalam tanah
Perlakuan Percobaan 1. Penentuan Tipe Ketidakpastian
Kategori tipe ketidakpastian pada penetapan kadar karbon organik dalam tanah dengan metode spektrofotometri disajikan pada Tabel 1.
Tabel 1. Kategori tipe ketidakpastian pada penetapan kadar karbon organik dalam tanah dengan metode spektrofotometri
No. Sumber ketidakpastian Tipe Sumber data 1 Ketidakpastian baku kadar air, dipengaruhi oleh:
Ketidakpastian baku massa teruapkan B Sertifikat kalibrasi neraca Ketidakpastian baku massa
basah B Sertifikat kalibrasi neraca Ketidakpastian baku efek
suhu oven A Pengukuran kadar air tanah 10 kali ulangan
B Sertifikat kalibrasi oven