WRAP UP SKENARIO 3
“DIARE”
Disusun oleh: KELOMPOK A-1
KETUA : ANISA NURJANAH (1102013033)
SEKRETARIS: ANGGIE ELKA PRATIWI (1102013029)
ANGGOTA : ABDUL RAHMAN (1102013001)
ABI RAFDI ZHAFARI (1102013002) ABIYYA FARAH PUTRI (1102013003) ADELIA PUTRI SABRINA (1102013005) ADELINA ANNISA PERMATA (1102013006) ANDINI ZULMAETA (1102013027) ANDREW ROZAAN F (1102013028) AURYN ZHAFIRI (1102013049) FAKULTAS KEDOKTERAN UNIVERSITAS YARSI 2013/2014
Skenario :
“DIARE”
Seorang mahasiswa, 35 tahun, dibawa ke Puskesmas karena mengalami mencret lebih dari 12 kali dalam sehari sejak 2 hari yang lalu. Keluhan ini timbul setelah makan di warung nasi dekat kampusnya. Pemeriksaan fisik : kesadaran komposmentis lemah, urine sedikit. Di Puskesmas penderita dipasang infuse dan diberikan pertolongan pertama lalu dirujuk ke RS terdekat. Dokter meminta untuk diperiksa Analisa Gas Darah.
Kesannya : terdapat gangguan keseimbangan asam basa berupa asidosis metabolic, dengan anion gap yang normal.
A. Brainstroming / Activation Prior Knowledge :
1. Mengapa dokter meminta untuk melakukan analisis gas darah?
2. Kenapa pada penderita diare denyut nadi naik, pernapasan naik dan tekanan darah menurun?
3. Apa hubungan asidosis metabolic dengan diare? 4. Berapakah kadar normal anion gap?
5. Mengapa anion gap menjadi indicator dalam pemeriksaan? 6. Apa saja gangguan keseimbangan asam basa?
7. Kenapa urine yang keluar sedikit? 8. Bagaimana terjadinya diare?
A. Jawaban:
1. untuk mengukur keasaman pH, kadar oksigen dan CO2 dalam darah dan untuk mengetahui keseimbangan asam basa dalam tubuh.
2. tekanan darah = karena volume cairan tubuh berkurang sehingga tekanan darah menurun akibat pengeluaran cairan berlebihan
Nadi = karena kekurangan cairan tubuh jantung dan paru memompa lebih cepat untuk menyeimbangkan tubuh sehingga nadi dan pernapasan meningkat.
3. karena bikarbonat keluar lebih banyak sehingga H+ tidak bias berikatan dengan HCO3 menyebabkan pH darah menurun dan H+ meningkat
4. 12-16 mmol/l
5. karena untuk mengetahui perbedaan antara jumlah muatan ion positif pada Na+ dan jumlah muatan ion negative pada Cl- dan
HCO3-6. - asidosis metabolik - alkalosis metabolik - asidosis respiratorik - alkalosis respiratorik
7. karena sekresi ADH meningkat sehingga urine yang keluar sedikit untuk menyeimbangkan kesetimbangan cairan
8. karena makanan yang mengandung bakteri sehingga usus tidak melakukan absorbsi air melainkan sekresi air untuk mengencerkan kadar toksin yang ada dalam usus besar
A. Hipotesa
Makanan yang mengandung bakteri, virus dll dapat menyebabkan absorbsi air di usus sehingga terjadi diare karena pengeluaran HCO3 yang berlebihan menyebabkan gangguan keseimbangan asam basa yaitu asidosis metabolik.
B. Learning Objective / Sasaran belajar :
1. Memahami dan Menjelaskan Keseimbangan Asam Basa 1.1 Definisi 1.2 Klasifikasi 1.3 Fungsi 1.4 Mekanisme 1.5 Indikator 1.6 Fisiologis
2. Memahami dan Menjelaskan ukuran keasaman pH 2.1 Definisi
2.2 Cara Menentukan pH 2.3 Penyebab Perubahan pH
3. Memahami dan Menjelaskan Asidosis Metabolik 3.1 Definisi
3.2 Etiologi 3.3 Mekanisme 3.4 Gejala
3.5 Pemeriksaan Analisa Gas Darah 3.6 Diagnosis
3.7 Penatalaksanaan 3.8 Kompensasi
4. Memahami dan menjelaskan Alkalosis Metabolik 4.1 Definisi
4.2 Etiologi 4.3 Manifestasi 4.4 Kompensasi
LI 1. Memahami dan Menjelaskan tentang Keseimbangan Asam Basa LO 1.1 Definisi
- Asam adalah zat yang terdisosiasi dalam air membentuk H+ - Basa adalah zat yang tedisosisasi dalam air membentuk OH - Menurut Bronsted dan lowry
- Asam adalah zat yang dapat memberikan ion H ke zat lain (disebut sebagai donor proton).
- Basa adalah zat yang dapat menerima ion H dari zat yang lain (disebut sebagai akseptor proton).
Menurut konsep dari G.N Lewis
- Asam adalah suatu zat yang menerima sebuah pasangan elektron. - Basa adalah suatu zat yang memberikan sepasang electron.
LO 1.2 Klasifikasi
Berdasarkan kemampuan melepas H+
1. Asam lemah
Adalah asam yang hanya terdisosiasi sebagian dalam air (berdisodiasi tidak sempurna). 2. Asam kuat
Adalah asam yang berdisosiasi sempurna dalam air. 3. Basa lemah
Adalah basa yang hanya terdisosiasi sebagian dalam air/suatu persenyawaan yang bergabung tidak sempurna dengan ion hidrogen dalam larutan air.
4. Basa kuat
Adalah persenyawaan yang berdisosiasi secara sempurna dalam larutan air.
Berdasarkan bentuk ion
1. Asam anion
Asam yang mempunyai muatan negatif. Misalnya : H2SO4 dan SO3
2. Asam kation
Asam yang mempunyai muatan positif. Misalnya : NH4 dan H3O
3. Basa anion
Basa yang mempunyai muatan negative. Misalnya : CL dan CN
4. Basa kation
Basa yang mempunyai muatan positif.
LO 1.3 Fungsi
Mempengaruhi aktifitas reaksi enzimatik Mempengaruhi permeabilitas sel
Memepengaruhi sifat-sifat dan fungsi dari sistem biologis
LO 1.4 Mekanisme
Mekanisme untuk mengendalikan keseimbangan asam basa darah :
1.Kelebihan asam dibuang oleh ginjal, sebagian besar dalam bentuk ammonia. Ginjal memiliki kemampuan untuk merubah jumlah asam atau basa yang dibuang, yang biasanya berlangsung beberapa hari.
2.Tubuh menggunakan penyangga pH (buffer) dalam darah sebagai pelindung
terhadap perubahan yang terjadi secara tiba-tiba dalam pH darah. Penyangga pH yang paling penting dalam darah menggunakan bikarbonat. Bikarbonat ( suatu komponen basa ) berada dalam kesetimbangan dengan karbondioksida ( suatu komponen asam ). Jika lebih banyak asam yang masuk ke dalam aliran darah, maka akan dihasilkan lebih
banyak bikarbonat dan lebih sedikit karbondioksida. Jika lebih banyak basa yang masuk kedalam aliran darah, maka akan dihasilkan lebih banyak karbondioksida dan lebih sedikit bikarbonat.
3.Pembuangan karbondioksidaJika pernafasan meningkat, kadar karbondioksida darah menurun dan darah menjadi lebih basa. Jika pernafasan menurun, kadar karbondioksida darah menigkat dan darah menjadi lebih asam.
LO 1.5 Indikator
larutan indikator adalah zat-zat yang mempunyai warna berbeda dalam larutan yang bersifat asam, basa, dan netral, sehingga dapat digunakan untuik membedakan larutan yang bersifat asam, basa, dan netral. Larutan indikator akan berubah warna jika PH (derajat keasaman) berubah. Pada suhu 25 derajat celcius maka pH + pOH = 14, untuk larutan netral pH = pOH = 7, sedangkan untuk larutan asam pH lebih kecil 7 dan larutan basa lebih besar 7. Jadi, pH
merupakan ukuran konsentrasi ion hidrogen atau ukuran keasaman larutan. Ada dua macam indikator, yaitu:
Indikator penunjuk asam adalah indikator yang akan berubah warnanya, jika
konsentrasi asam berubah sedikit saja. Daerah perubahan warna untuk indikator ini kurang dari 7.
Indikator penunjuk basa adalah indikator yang akan berubah warnanya, jika
konsentrasi basa (OH) berubah sedikit saja. Daerah perubahan warnanya lebih dari 7.
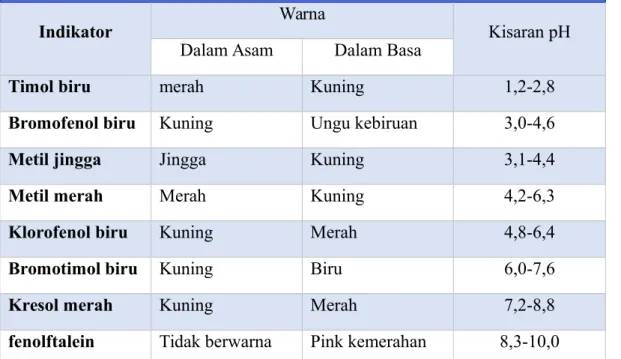
Di laboratorium, indikator yang sering digunakan adalah larutan fenolftalein (PP), metil merah, dan metil orange.
Table beberapa indicator Asam-Basa yang lazim
Indikator Warna Kisaran pH
Dalam Asam Dalam Basa
Timol biru merah Kuning 1,2-2,8
Bromofenol biru Kuning Ungu kebiruan 3,0-4,6
Metil jingga Jingga Kuning 3,1-4,4
Metil merah Merah Kuning 4,2-6,3
Klorofenol biru Kuning Merah 4,8-6,4
Bromotimol biru Kuning Biru 6,0-7,6
Kresol merah Kuning Merah 7,2-8,8
fenolftalein Tidak berwarna Pink kemerahan 8,3-10,0
*kisaran pH didefinisikan sebagai kisaran di mana indicator berubah dari warna asam ke warna basa
LO 1.6 Fisiologis
Keseimbangan asam basa adalah keseimbangan ion hidrogen, keseimbangan antara ion [ ] bebas dan [HC ] dalam cairan tubuh sehingga keseimbangan tubuh yang harus dijaga kadar ion [ ] bebas dalam batas normal maupun pembentukan asam maupun basa terus berlangsung dalam kehidupan.
pH darah normal adalah 7.3-7.5 asam adalah pH dibawah 7.3 dan basa adalah pH di atas 7.5.pH 7.3-7.5 harus tetap dipertahankan,walaupun banyak senyawa-senyawa metabolit atau nutrien yang bersifat mengganggu nilai tersebut.Gangguan ke arah keasaman (asidosis) pH kurang dari 7.3 atau ke arah kebasaan (alkalosis) pH diatas 7.5.Gangguan dapat dipulihkan ke keadaan semula oleh alat kompensasi tubuh.
Karena ion [H+] berpengaruh besar dalam keseimbangan asam-basa, maka faktor yang mempengaruhi [H+] juga mempengaruhi keseimbangan asam basa, yaitu :
A. Lebihnya kadar [H+] yang ada dalam cairan tubuh, berasal dari
Katabolisme zat organik
Disosiasi asam organik pada metabolisme intermedik, contoh pada metabolik lemak terbentuk asam lemak dan laktat yaitu melepaskan [H+]
B. Keseimbangan intake dan output ion [H+] tubuh Bervariasi tergantung dari:
Diet ( makanan ), H+ naik, jika kebanyakan makan asam (asidosis), sedangkan dengan mengkonsumsi sayur dan buah bersifat basa banyak menghasilkan . Aktivitas yaitu lari cepat membuat tubuh kita asam karena menghasilkan banyak
CO2 sehingga pH turun.
Proses anaerob yaitu lebih banyak penumpukan asam laktat seperti olahraga berat sehingga menimbulkan reaksi asam dan membuat pH turun.
LI 2. Memahami dan menjelaskan ukuran keasaman pH LO 2.1 Definisi
Simbol yang berhubungan dengan konsentrasi hidrogen ] atau aktivitas larutan dibandingkan larutan standar yang diberikan. Secara numeric, pH kira-kira sama dengan logaritma negative konsentrasi yang dinyatakan dalma molaritas, pH 7 merupakan keadaan netral; di atas 7 terjadi peningkatan alkalinitas sedangkan dibawah 7 dan peningkatan keasaman (asiditas).
LO 2.2 Cara menentukan pH
PH adalah konsentrasi ion hidrogen (hydronium) yang dapat dinyatakan dengan pH = log 1 = -log[H+]
[H+] = -log [HCO 3-]
Selain itu menurut persamaan Henderson-Hasselbach PH dihitung dengan rumus : pH = pKa + log [garam]/[asam]
atau
pH = pK + log [HCO3-]/[H2CO3] dimana :
Pk = konstanta disosiasi asam karbonat =6,1 [HCO3] = kadar bikarbonat plasma
[H2CO3] = kadar asam karbonat plasma PH = pK + log [HCO3]/S X PCO2
S = konstan kelarutan CO2 dengan nilai sebesar 0.03
LO 2.3 Penyebab perubahan pH
Beban makanan dan beban metabolic
Ion hydrogen di tambahkan atau di kurangi sebagai akibat makan-makanan tertentu atau akibat perubahan metabolic
Beban respirasi
Peningkatan laju pernafasan yang tidak di sertai peningkatan aliran CO2 ke paru-paru akan mengurangi tekanan Co2 dalam alveoli . begitu juga pada darah yang kembali menuju ke jaringan perifer sehingga terjadi akibat respiratorik à H+ menurun PH meningkat
LI 3. Memahami dan Menjelaskan Asidosis Metabolik LO 3.1 Definisi Asidosis Metabolik
Asidosis Metabolik adalah penurunan kadar ion HCO3- diikuti dengan penurunan tekanan parsial CO2 didalam arteri (Gangguan Keseimbangan Asam basa, FKUI)
Asidosis Metabolik adalah gangguan sistemik yang ditandai dengan penurunan primer kadar bikarbonat plasma sehingga menyebabkan terjadinya penurunan pH yaitu peningkatan [H+] (Price. Wilson.2006.Patofisiologi)
Asidosis Metabolik yang disebut juga Asidosis Non-Respiratori adalah keadaan asidosis yang status asam basa tubuhnya bergeser ke sisi asam akibat kehilangan basa atau retensi asam selain asam karbonat. (Kamus Dorland)
LO 3.2 Etiologi asidosis metabolik
Penyebab asidosis metabolik dapat dibagi dalam tiga kelompok yaitu :
1. Pembentukan asam yang berlebhan di dalam tubuh. Ion hidrogen dibebaskan oleh sistem buffer asam karbonat-bikarbonat, sehingga terjadi penurunan pH. Dalam klinik ditemukan keadaan ini seperti pada:
- Asidosis laktat. Timbul karena hipoksia jaringan berkepanjangan, mengakibatkan jaringan mengalami proses metabolisme anaerob.
- Ketoasidosis. Timbul karena produksi badan keton dalam jumlah sangat tinggi pada metabolisme fase pasca absortif. Ketoasidosis merupakan akibat dari starvasi dan
komplikasi diabetes mellitus yang tidak terkendali, jaringan tidak dapat memanfaatkan glukosa dari sirkulasi, sehingga mengandalkan metabolisme lipid dan keton
- Intoksikasi salisat - Intoksikasi etanol
2. Berkurangnya kadar ion-HCO3 didalam tubuh
Sistem buffer asam karbonat-bikarbonat yang mengatur keseimbangan ion hidrogen dan mempengaruhi keseimbangan pH. Penurunan konsentrasi HCO3 di cairan ekstraseluler menyebabkan penurunan efektifitas sistem buffer dan asidosis timbul. Penyebab penurunan konsentrasi HCO3 anatara lain adalah diare, renal tubular acidosis (RTA ) , pemakaian obat inhibitor enzime anhidrase karbonat atau pada penyakit ginjal kronik stadium III-IV
3. Adanya rentesi ion-H dalam tubuh
Jaringan tidak mampu ekskresi ion hidrogen melalui ginjal. Ini terjadi pada penyakit ginjal kronik stadium IV-V, RTA-1 atau RTA-4
LO 3.3 Mekanisme Asidosis Metabolik
Asidosis Metabolik (juga dikenal sebagai asidosis non respiratorik ) mencakup semua jenis asidosis selain yang disebabkan oleh kelebihan dicairan tubuh. Pada keadaan tak terkompensasi (gambar 15-12), asidosis metabolik selalu ditandai oleh penurunan plasma (dalam contoh kita menjadi separuhnya), sementara [ ] normal sehingga terbentuk rasio asidotik 10/1. Masalah dapt timbul karena pengeluaran cairan kaya yang berlebihan dari tubuh/karena akumulasi asam nonkarbonat. Pada kasus yang terakhir, plasma.
Asidosis Metabolik adalah keasaman darah yang berlebihan, yang ditandai dengan rendahnya kadar bikarbonat dalam darah. Asidosis dapat terjadi jika diare. Bila peningkatan keasaman melampaui system penyangga pH, darah akan menjadi asam. Seiring dengan menurunnya pH darah, eprnapasan menjadi lebih salam dan lebih cepat sebagai usaha tubuh untuj menurunkan kelebihan asam dalam darah dengan cara menurunkan jumlah CO2.
Jika kita makan, saluran pencernaan seperti lambung, usus dsb akan menghasilkan HCO3. Nanti HCO3 akan diserap oleh plasma yang akan dieksresi bersama urin. Tetapi jika terjadi diare, HCO3 akan banyak keluar bersama feses. Karena diare tidak terjadi absorbsi pada usus. Diare dapat disebabkan oleh infeksi, alergi, virus serta bakteri. Sehingga HCO dalam plasma akan
terjadi penurunan besar-besaran karena keluar bersama feses. Sedangkan jika HCO3 berkurang, H+ tidak dapat diikat. Karena HCO
3 berperan sebagi buffer bagi H+ agar tidak kelebihan asam dalam tubuh. Karena penurunan HCO3 akan menyebabkan kenaikan H+ dalam tubuh lalu pH akan turun, HCO3 turun, tetapi H+ naik sehingga tubuh menjadi asam. Maka terjadilah Asidosis Metabolik.
LO 3.4 Gejala Asidosis Metabolik
Mual Muntah Kelelahan
Pernapasan menjadi lebih dalam atau sedikit lebih cepat (pernafasan kussmaul’s); Rasa mengantuk
Mengalami kebingungan
Tekanan darah menurun, menyebabkan syok, koma dan kematian
LO 3.5 Pemeriksaan (AGD) Pemeriksaan Diagnostik
1. Nilai-nilai AGD: menentukan pH (biasanya , 7,35) dan derajat kompensasi respiratori
seperti dilihatkan oleh PaC , yang biasanya adalah < 35 mmHg.
2. Bikarbonat serum: menentukan adanya asidosis metabolik ( < 22 mEq/L).
3. Elektrolit serum: mungkin terjadi peningkatan kalium Karena pertukaran kalium
intrasellular dari ion-ion hydrogen dalam usaha tubuh untuk menormalkan lingkungan asam-basa.
Anion Gap: dalam usaha untuk mengidentifikasi penyebab asidosis metabolik,
penganalisaan elektrolit serum untuk mendeteksi anion gap mungkin sangat
membantu. Anion gap mencerminkan adanya anion yang tak terukur dalam plasma dan dihitung dengan mengurangi penjumlahan klorida dan natrium bikarbonat dengan jumlah konsentrasi natrium plasma.
Anion Gap = minus ( +
4. EKG: mendeteksi distrima yang disebabkan oleh hyperkalemia. Perubahan yang tampak
pada hyperkalemia termasuk memuncaknya gelombang T, penurunan segmen ST, penurunan ukuran gelombang R, menurun atau tidak terdapatnya gelombang P, dan pelebaran kompleks QRS, asidosis dapat menyebabkan perubahan ECG yang tidak spesifik.
LO 3.6 Diagnosis
Asidosis metabolic akut dapat menyebabkan :
2. penurunan tekanan darah,
3. penurunan aliran ke sirkulasi hepatic dan renal 4. menyebabkan aritmia dan fibrillasi ventricular 5. metabolism otak menurun secara progresif
6. pada pH yang lebih dari 7,1 akan menyebabkan fatigue (rasa lelah), sesak napas, nyeri perut, nyeri tulang, dan mual/muntah
7. pada pH kurang atau sama dengan 7,1 akan menyebabkan inotropic negative, aritmia, konstriksi vena perifer, dilatasi arteri perifer, penurunan tekanan darah, penurunan aliran darah ke hati, kontriksi pembuluh darah paru (pertukaran oksigen terganggu) Diagnosis asidosis metabolic ditegakkan berdasarkan gambaran klinis dan dipastikan oleh hasil pemeriksaan laboratorium yaitu pH, PaCO2, dan HCO3 dengan menggunakan pendekatan sistematik.
Hasil pemeriksaan menunjukkan : pH : <7,35
HCO3 : <22 mEq/L PaCO2 : <40 mmHg
LO 3.7 Penatalaksanaan
Tujuan penanganan asidosis metabolic adalah untuk meningkatkan pH sistemik sampai ke batas aman, dan mengobati penyebab asidosis yang mendasari.
Langkah koreksi asidosis metabolic :
1. Langkah pertama, tetapkan berat ringannya gangguan asidosis. Gangguan disebut letal bila pH darah kurang dari 7 atau kadar ion H lebih dari 100 nmol/L. gangguan yang perlu mendapat perhatian bila pH darah 7,1-7,3 atau kadar ion H antara 50-80 nmol/L.
2. Langkah kedua, tetapkan anion gap atau bila perlu anion gap urin untuk mengetahui dugaan etiologi asidosis metabolic. Dengan bantuan gejala klinis lain dapat dengan mudah ditetapkan etiologinya.
3. Langkah ketiga, bila dicurigai kemungkinan asidosis laktat, hitung rasio delta anion gap dengan delta HCO3 (delta anion gap : anion gap pada saat pasien diperiksa dikurangi dengan median anion gap normal, delta HCO3: kadar HCO3 normal dikurangi dengan kadar HCO3 pada saat pasien diperiksa). Bila rasio lebih dari 1, asidosis disebabkan oleh asidosis laktat. Langkah ini menetapkan sampai sejauh mana koreksi dapat dilakukan.
Kecuali pada asidosis uremik, asidosis metabolic dikompensasi oleh mekanisme pernapasan dan ginjal serta dapar kimiawi.
Penyangga menyerap kelebihan H+
Paru mengeluarkan lebih banyak CO2 penghasil H+
Ginjal mengeksresikan H+ lebih banyak dan menahan HCO
3- lebih banyak.
Dalam mengompensasi asidosis metabolik, paru secara sengaja menggeser CO2 dari normal dalam upaya memulihkan H+ kearah normal. Sementara pada gangguan asam basa yang disebabkan oleh faktor pernapasan kelainan CO2 adalah penyebab ketidakseimbangan H+ , pada gangguan asam basa metabolic CO2 secara sengaja digeser dari normal sebagai kompensasi penting untuk ketidakseimbangan H+ .
LI 4. Memahami dan menjelaskan Alkalosis Metabolik LO 4.1 Definisi
Alkalosis metabolik (kelebihan HCO3-) adalah suatu gangguan sistemik yang dicirikan dengan adanya peningkatan primer kadar HCO3- plasma, sehingga menyebabkan peningkatan pH (penurunan [H+]. [HCO
3-] ECF lebih besar dari 26 mEq/L dan pH lebih besar dari 7.45. Alkalosis metabolik sering disertai dengan berkurangnya volume ECF dan hipokalemia.
LO 4.2 Etiologi
- Kekurangan H+ dari ECF(Muntah,penyedotan nasogastrik, diare dengan kehilangan klorida, diuretik, hipokalemia)
- Retensi HCO3- (Pemberian natrium bikarbonat berlebihan, sindrom susu alkali)
LO 4.3 Manifestasi
Tidak terdapat gejala dan tanda alkalosis metabolik yang spesifik. Adanya gangguan ini harus dicurigai pada pasien yang memiliki riwayat muntah, penyedotan, nasogastrik, pengobatan diuretik atau pasien yang baru sembuh dari gagal nafas (Hiperkapnia)
LO 4.4 Kompensasi Alkalosis Metabolik
Kompensasi utamanya adalah penurunan ventilasi, yang meningkatkan PaCO2 dan peningkatan ekskresi HCO3 oleh ginjal, yang membantu mengkompensasi peningkatan awal konsentrasi HCO3 cairan ekstrasel.
DAFTAR PUSTAKA
(zenius.net)
(Horne, Mima M. 2000. Keseimbangan Cairan, Elektrolit, dan Asam-basa. Jakarta:EGC)
(Kee, Joyce LeFever. Pemeriksaan Laboratorium & Diagnostik. Jakarta: EGC) (Danis, Difa. Kamus Istilah Kedokteran.Gitamedia press)
(Guyton, 1996) (Price. Wilson.2006.Patofisiologi) (Chang, Raymond. Kimia Dasar. Erlangga) (Fay, McMurry. 2004. Chemistry. New Jersey)
(Sherwood, Lauralee. Fisiologi Manusia Dari sel ke Sistem. EGC) ( Corwin, Elizabeth J. 2009. Buku Saku Patofisiologi. Jakarta:EGC)