Bab ini merupakan bagian penting dari Kimia. Rumus kimia sebagai salah satu sifat kimia yang telah disinggung pada bab terdahulu akan dibahas lebih jauh. Sementara “lambang atom”
yang telah dibahas di Bab 3 akan menjadi dasar penulisan rumus kimia suatu zat. Pemahaman terhadap rumus kimia akan memudahkan pemahaman pada bab-bab selanjutnya; rumus kimia memiliki aplikasi penting terutama dalam penulisan persamaan reaksi dan dalam penyelesaian masalah yang berhubungan dengan perhitungan kimia.
Oleh karena itu siapkan waktu dan perhatian khusus; pemahaman baru akan digapai hanya jika disertai dengan latihan menyelesaikan soal-soal di akhir bab.
A. RUMUS KIMIA ZAT
Zat meliputi unsur dan senyawa. Rumus kimia zat bergantung pada jenis partikel yang membangun zat itu dan harus menggambarkan sifat zat yang bersangkutan. Rumus kimia merupakan salah satu sifat kimia yang berperan penting dalam ilmu kimia. Oleh karenanya beberapa aturan dalam menyatakan rumus kimia zat yang telah disepakati harus dipatuhi.
1. Rumus Kimia Unsur
Rumus kimia unsur umumnya sama dengan lambang atomnya.
Contoh:
Nama Unsur: Lambang Atom: Rumus Kimia Unsur:
karbon C C
besi Fe Fe
tembaga Cu Cu
seng Zn Zn
dst.
Catatan:
Jika hafal nama unsur dan lambang atomnya, maka dengan sendirinya akan diketahui pula rumus kimia unsur itu. Rumus kimia unsur ini sangat berguna pada pembahasan persamaan reaksi.
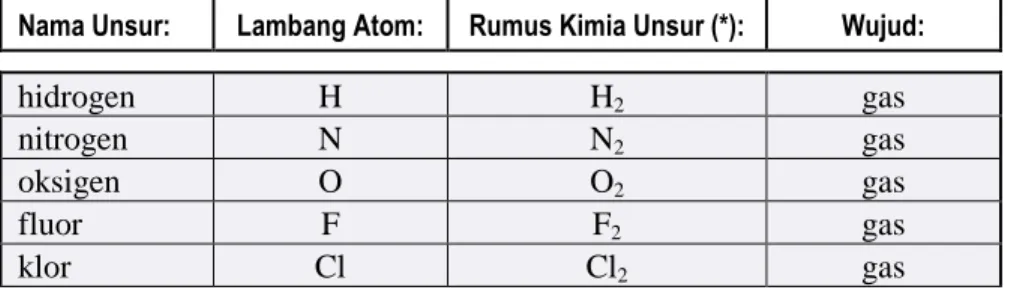
Hanya ada beberapa unsur yang tidak selalu demikian. Unsur-unsur seperti ini di antaranya ditunjukkan pada Tabel 4.1.
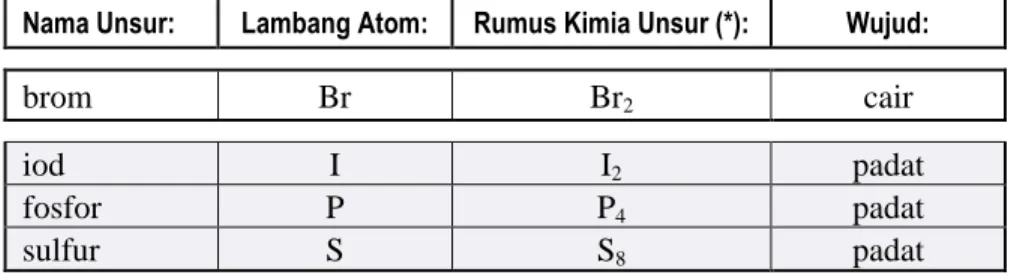
Tabel 4.1 Beberapa Unsur dan Pengecualian Rumus Kimianya Nama Unsur: Lambang Atom: Rumus Kimia Unsur (*): Wujud:
hidrogen H H2 gas
nitrogen N N2 gas
oksigen O O2 gas
fluor F F2 gas
klor Cl Cl2 gas
Nama Unsur: Lambang Atom: Rumus Kimia Unsur (*): Wujud:
brom Br Br2 cair
iod I I2 padat
fosfor P P4 padat
sulfur S S8 padat
(*) Rumus kimia unsur untuk kelompok unsur ini sering disebut sebagai rumus molekul unsur.
Tabel 4.1 erat hubungannya dengan bagan yang diperlihatkan pada Gbr. 3.13 (halaman 45) karena saling memperjelas satu sama lain.
CATATAN:
Tabel 3.2 dan 4.1 merupakan kunci penting untuk memperkirakan rumus kimia unsur. Semua unsur, rumus kimianya sama dengan lambang atomnya; kecuali unsur-unsur yang tertera pada tabel 4.1.
2. Rumus Kimia Senyawa
Pada bab 3, Dalton telah menyatakan bahwa molekul terbentuk sebagai hasil penggabungan kimia dari atom-atom. Juga telah dikemukakan bahwa senyawa dibangun dari partikel- partikel kecil yang disebut molekul senyawa. Hanya molekul-molekul senyawa ini terbentuk dari hasil penggabungan kimia dari atom-atom yang berbeda jenisnya.
Karena senyawa merupakan gabungan dari beberapa unsur tak-sejenis, maka lambang molekulnya pun merupakan kumpulan lambang/tanda atom unsurnya. Lambang molekul senyawa dengan sendirinya menjadi rumus kimia senyawa atau umumnya disebut sebagai rumus molekul senyawa. Tabel 4.2 dapat memperjelas hal ini.
Tabel 4.2
Nama, Jenis Molekul, Lambang Molekul, Rumus Kimia, dan Rumus Molekul dari Beberapa Senyawa.
Senyawa Molekul Senyawa Lambang
Molekul Rumus Kimia Senyawa (Rumus Molekul Senyawa) Karbon monoksida Terbentuk dari 1 atom C,
dan 1 atom O CO CO
karbon dioksida Terbentuk dari 1 atom C,
dan 2 atom O CO2 CO2
air Terbentuk dari 2 atom H,
dan 1 atom O. H2O H2O
amoniak Terbentuk dari 1 atom N,
dan 3 atom H. NH3 NH3
alkohol Terbentuk dari 2 atom C,
6 atom H, dan 1 atom O. C2H6O C2H6O glukosa Terbentuk dari 6 atom C,
12 atom H, dan 6 atom O. C6H12O6 C6H12O6
Rumus molekul suatu senyawa ditetapkan berdasarkan pengujian komposisi unsur-unsur yang menyusunnya, dan dari hasil ini selanjutnya ditetapkan “rumus perbandingan jumlah atom”-nya yang disebut rumus empirik.
Di alam sering ditemukan ada 2 senyawa dengan rumus molekul berbeda tetapi keduanya memiliki rumus empirik yang sama. Contoh berikut yang memperlihatkan hubungan rumus empirik dan rumus molekul adalah:
Perbandingan jumlah atom Rumus Empirik Rumus Molekul
H : O = 2 : 1 H2O H2O
N : O = 1 : 2 NO2 NO2 ; N2O4
C : H = 1 : 2 CH2 C2H4; C3H6; C4H8; C5H10; dst.
Tampak bahwa, ada beberapa senyawa mempunyai rumus empirik yang sama. Terhadap rumus empirik seperti ini harus dilakukan pengujian lebih lanjut untuk memastikan rumus molekul senyawa mana yang dimaksud. Hal ini akan dijelaskan pada bagian lain.
Yang penting dari hubungan di atas adalah bahwa dari 2 jenis unsur dapat dibentuk lebih dari 1 jenis senyawa. Sederetan senyawa yang terbentuk dari dua jenis unsur selalu mempunyai rumus empirik yang sama.
Di samping itu, sebagai contoh, C dan O dapat membentuk lebih dari 2 jenis senyawa dengan rumus, yaitu CO dan CO2; hanya kedua senyawa ini masing-masing memiliki rumus empirik yang sekaligus merupakan rumus molekulnya.
Telah disebutkan pada bab lalu bahwa di alam terdapat lebih dari 110 unsur, maka dapat dibayangkan betapa banyaknya senyawa di alam ini.
Banyak senyawa telah tersedia di alam; jadi alamlah yang membentuk senyawa itu (disebut senyawa alami). Di samping senyawa alami, dikenal pula senyawa buatan (senyawa sintetis). Senyawa pemberi rasa, bau, warna yang berasal dari alam, kini telah dapat dibuat secara sintesis. Karet, serat, plastik, batu permata, dsb. juga dapat dibuat secara sintetis.
B. PERSAMAAN REAKSI
Mengapa kita harus belajar hal-hal yang sulit seperti harus menguasai rumus kimia unsur dan senyawa? Uraian berikut memperlihatkan salah satu kegunaan penting dari rumus kimia. Perhatikanlah 2 pernyataan di bawah ini.
1. Definisi Persamaan Reaksi
Pernyataan 1 dan pernyataan 2 mengandung pengertian yang sama. Namun harus diakui bahwa pernyataan 2 lebih singkat dan praktis, bahkan memperlihatkan suatu hubungan (suatu persamaan) antara zat asal (kiri panah) dan zat baru (kanan panah). Jadi rumus kimia dapat digunakan untuk menyatakan suatu peristiwa kimia yang terjadi di sekitar kita.
Pernyataan 1
(dengan menggunakan lambang kata)
“arang (karbon)
dibakar (bereaksi dengan oksigen) menghasilkan gas karbon dioksida”
Pernyataan 2
(dengan menggunakan lambang kimia)
C + O2 CO2
Pernyataan singkat tentang sebuah perubahan kimia dengan menggunakan rumus kimia atau simbol kimia dinamakan persamaan reaksi kimia, atau persamaan reaksi.
Sebuah persamaaan reaksi terdiri dari 2 suku, yaitu:
suku kiri; sebagai zat-zat yang bereaksi (disebut pereaksi), dan
suku kanan; sebagai zat baru hasil reaksi (disebut hasil reaksi).
2. Syarat persamaan reaksi
Sebuah persamaan reaksi telah dinyatakan secara benar dan mencirikan peristiwanya, antara lain bila:
(1) kedua suku memperlihatkan kesamaan jenis atom, dan (2) kedua suku memperlihatkan kesamaan jumlah atom sejenis.
3. Penyetaraan Persamaan Reaksi
Perhatikan sebuah contoh persamaan reaksi di bawah ini.
Persamaan reaksi merupakan
pernyataan singkat tentang suatu perubahan kimia dengan menggunakan rumus kimia atau simbol kimia.
C + O2 CO2 suku kiri suku kanan
(1) Kedua suku memiliki kesamaan jenis atom, yaitu C & O (2) Kedua suku memiliki kesamaan jumlah atom sejenis:
suku kiri : ada 1 atom C; dan 2 atom O suku kanan : ada 1 atom C; dan 2 atom O
Dengan demikian persamaan reaksi di atas telah memenuhi persyaratan sebuah persamaan reaksi yang benar (setara).
Fe + O2 Fe2O3
Persamaan reaksi ini kedua sukunya baru memenuhi:
kesamaan jenis atom, tetapi jumlah atom sejenisnya belum sama.
CARA MENYETARAKANNYA :
Tetapkan dulu rumus kimia yang paling kompleks sebagai acuan.
Untuk ini kita pilih Fe2O3 Fe + O2 Fe2O3
Atom Fe: [1] x 2 [2]
Diperoleh: 2 Fe + O2 Fe2O3
Atom O: [2] x 1½ [3]
Diperoleh: 2 Fe + 1½ O2 Fe2O3
Diperoleh: 4 Fe + 3 O2 2 Fe2O3
(Persamaan reaksi ini telah setara.)
x 2 (untuk pembulatan)
4. Koefisien Reaksi
Bilangan yang terlibat dalam penyetaraan sebuah persamaan reaksi disebut koefisien persamaan reaksi atau koefisien reaksi.
Untuk reaksi:
4 Fe + 3 O2 2 Fe2O3,
koefisien reaksinya berturut-turut adalah 4, 3, dan 2.
Latihan 4.1.
Periksalah apakah persamaan reaksi berikut setara, dan kemudian tetapkan koefisien reaksinya.
a. S8 + 10 O2 4 SO2 + 4 SO b. Al2O3 + 3 H2O 2 Al(OH)3
5. Arti Persamaan Reaksi
Setelah memenuhi persyaratan “setara”, barulah sebuah persamaan reaksi memberikan arti secara kuantitatif, yaitu persamaan reaksi dapat menunjukkan hubungan perubahan kuantitatif antar zat-zat yang terlibat dalam persamaan. Jadi koefisien reaksi memiliki fungsi penting pada sebuah persamaan reaksi. Penjelasan lebih jauh tentang hal ini akan dibahas pada bab selanjutnya.
Di samping beberapa ketentuan di atas, pada persamaan reaksi biasanya disertai beberapa tambahan keterangan untuk memperjelas reaksi yang bersangkutan. Keterangan tambahan ini bergantung pada sifat kejelasan reaksi yang dituntut dari pokok pembahasan yang dibicarakan. Jadi tidak harus selalu disertakan dalam penulisan persamaan reaksi.
Penulisan persamaan reaksi yang dilengkapi dengan beberapa keterangan tambahan dicontohkan seperti di bawah ini.
a. Wujud Zat
Zat-zat yang terlibat reaksi biasanya dilengkapi dengan keterangan wujud atau fasanya.
Simbol wujud yang diterapkan adalah:
(s) ‘solid’; menyatakan bahwa zat itu berwujud padat atau kristal; kadang-kadang untuk kristal dapat digunakan simbol: (c).
(l) ‘liquid’; menyatakan bahwa zat itu berwujud cair.
(g) ‘gas’; menyatakan bahwa zat itu berwujud gas
(aq) ‘aqueous’; menyatakan bahwa zat itu dalam keadaan terlarut dalam pelarut air; jika terlarut dalam pelarut amoniak diberi simbol (am); dalam pelarut CCl4 ditulis (CCl4).
Contoh penerapan:
C(s) + O2(g) CO2(g)
S8(s) + 10 O2(g) 4 SO2(g) + 4 SO3(g) Al2O3(s) + 3 H2O(l) 2 Al(OH)3(aq)
Ca(OH)2(aq) + H2SO4(aq) CaSO4(s) + 2 H2O(l)
b. Kalor reaksi
Perubahan energi selalu menyertai reaksi kimia. Reaksi kimia ada yang melepaskan dan ada pula yang menyerap energi panas (kalor). Selain itu ada beberapa reaksi kimia berlangsung karena adanya energi cahaya (berupa sinar UV atau sinar lainnya), atau oleh adanya energi listrik.
c. Zat pemercepat
Reaksi ada yang berlangsung cepat dan berlangsung amat lambat. Reaksi yang terakhir ini dapat dipercepat dengan menambahkan zat pemecepat yang disebut katalis. Katalis ini tidak mengalami perubahan dan dapat diperoleh kembali di akhir reaksi.
6. Penyetaraan secara Aljabar
Di samping cara yang dikemukakan di atas, penyetaraan persamaan reaksi dapat juga dilakukan dengan cara lain, yakni cara aljabar. Cara ini tidak begitu penting; disajikan hanya untuk menunjukkan sebagai salah satu cara penyetaraan.
Sebelum melakukan penyetaraan selalu terlebih dahulu diperiksa apakah jenis atom yang terlibat di kedua suku sudah sama. Berikut adalah contoh penyetaraan cara aljabar (menggunakan persamaan matematis).
Diketahui sebuah persamaan reaksi belum setara: NaOH + Cl2 NaCl + NaClO3 + H2O Setarakanlah persamaan reaksi tersebut.
Penyelesaian:
“Menyetarakan persamaan reaksi” berarti menetapkan koefisien reaksi.
Misalkan koefisien reaksi itu seperti berikut:
NaOH + a Cl2 b NaCl + c NaClO3 + d H2O
Karena melibatkan 4 jenis atom (Na, O, H, Cl) berarti akan melibatkan 4 persamaan matematis.
Persamaan matematis ini diperoleh melalui penyamaan suku kiri dan suku kanan untuk setiap jenis atom.
Diperoleh:
Na: 1 = b + c O: 1 = 3c + d
(pers. 1) (pers. 2)
H: 1 = 2d Cl: 2a = b + c
(pers. 3) (pers. 4) Contoh penerapan:
2 H2O2(l) 2 H2O(l) + O2(g) N2(g) + 3 H2(g) 2 NH3(g)
CO(g) + 3 H2(g) CH4(g) + H2O(g)
MnO2
Fe Ni
Contoh penerapan:
C(s) + O2(g) CO2(g) + kalor CaCO3(s) + kalor CaO(s) + CO2(g)*
CH4(g) + Cl2(g) + sinar uv CH3Cl(g) + HCl(g) H2O(l) 2 H2(g) + O2(g)
* Dapat ditulis sebagai: CaCO3(s) CaO(s) + CO2(g)
En. listrik
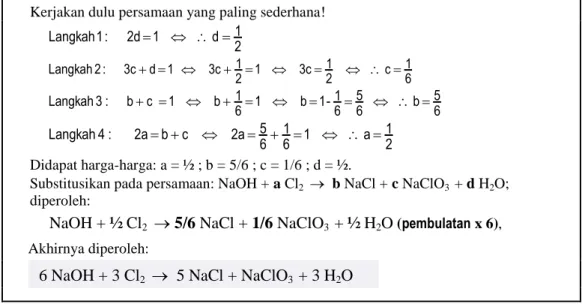
Kerjakan dulu persamaan yang paling sederhana!
21 d 1 2d : 1
Langkah
61 c 2 3c 1 21 1 3c 1 d 3c : 2
Langkah
65 b 6 61 5 - 1 b 6 1 b 1 1 c b : 3
Langkah
21 a 6 1 6 1 2a 5 c b 2a : 4
Langkah
Didapat harga-harga: a = ½ ; b = 5/6 ; c = 1/6 ; d = ½.
Substitusikan pada persamaan: NaOH + a Cl2 b NaCl + c NaClO3 + d H2O;
diperoleh:
NaOH + ½ Cl2 5/6 NaCl + 1/6 NaClO3 + ½ H2O (pembulatan x 6), Akhirnya diperoleh:
6 NaOH + 3 Cl2 5 NaCl + NaClO3 + 3 H2O
Latihan 4.2.
Setarakan persamaan reaksi berikut:
a. Al + H2SO4 Al2(SO4)3 + H2. (Jawab: Koefisien reaksinya 2; 3; 1; 3.)
b. Cu + HNO3 Cu(NO3)2 + NO + H2O. (Jawab: Koefisien reaksinya 3; 8; 3; 2; 4.)
C. BEBERAPA JENIS SENYAWA
Senyawa dapat dibagi menjadi senyawa anorganik dan senyawa organik.
Yang termasuk senyawa organik pada umumnya adalah senyawa yang dihasilkan atau berasal dari makhluk hidup. Contoh senyawa ini adalah pati (amilum), gula, asam cuka, alkohol, bensin, minyak tanah, dst. Jadi senyawa organik pada dasarnya dapat diproduksi ulang melalui pembudi-dayaan.
Sementara senyawa anorganik pada umumnya terbentuk dari unsur-unsur yang terdapat di bumi (alam) yang tak dapat diproduksi ulang; jadi jumlahnya terbatas. Kelompok unsur yang membentuk senyawa anorganik, misalnya semua logam, dan beberapa unsur bukan-logam (hidrogen, oksigen, nitrogen, belerang, fosfor, fluor, klor, brom, dan iod). Contoh senyawa anorganik adalah asam klorida (HCl), air (H2O), amoniak (NH3), garam dapur (NaCl), dan sebagainya.
Berikut ini akan dibahas beberapa jenis senyawa anorganik biner dan tata namanya.
Senyawa biner merupakan senyawa yang terbentuk dari 2 jenis atom yang berbeda. (Senyawa organik dan tata namanya akan dibahas pada bab tersendiri.)
1. Bilangan Oksidasi Unsur dan Penerapannya
Rumus molekul suatu senyawa bergantung pada bilangan oksidasi (BO) dari masing- masing unsur pembentuk senyawa itu. Mengetahui (hafal) BO suatu unsur akan menudahkan penetapan rumus molekul senyawanya.
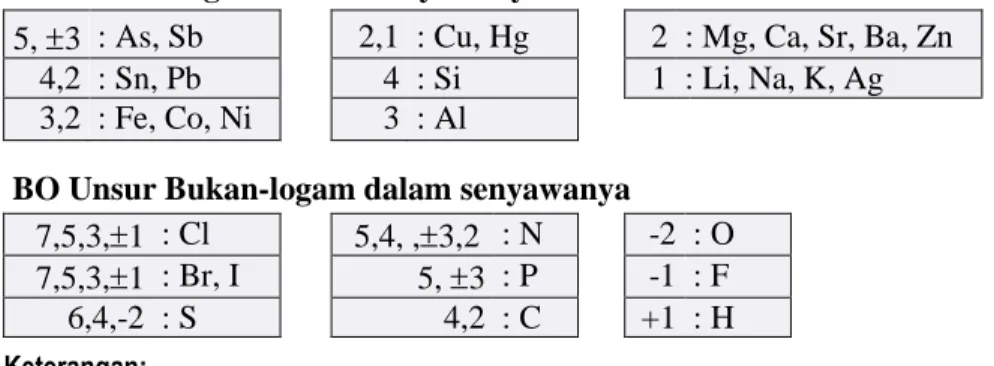
Tabel 4.3 menyajikan BO beberapa unsur penting.
Tabel 4.3 Bilangan Oksidasi (BO) Beberapa Unsur Penting dalam Senyawanya BO Unsur Logam dalam Senyawanya
5, 3 : As, Sb 2,1 : Cu, Hg 2 : Mg, Ca, Sr, Ba, Zn 4,2 : Sn, Pb 4 : Si 1 : Li, Na, K, Ag 3,2 : Fe, Co, Ni 3 : Al
BO Unsur Bukan-logam dalam senyawanya
7,5,3,1 : Cl 5,4, ,3,2 : N -2 : O 7,5,3,1 : Br, I 5, 3 : P -1 : F
6,4,-2 : S 4,2 : C +1 : H
Keterangan:
(1) BO yang ditulis 4,2, dst. seharusnya dibaca +4,+2.
(2) BO unsur adalah 0 (misalnya BO dari H2; O2; Cl2; P4; S8; dst. berharga 0).
(3) BO senyawa adalah 0 (BO H2O = 0; BO NH3 = 0; BO CO2 = 0; BO H2SO4 = 0).
Berdasarkan nilai BO unsur dalam senyawanya, kita dapat menuliskan rumus molekul senyawa biner antara 2 unsur berbeda. Perhatikan beberapa contoh berikut.
Contoh: BO Rumus
Molekul Contoh: BO Rumus
Molekul
positip negatip positip negatip
(1) +2 C O -2 CO (5) Fe +2 O -2 FeO
(2) +4 C O -2 CO2 (6) Fe +3 O -2 Fe2O3
(3) +1 -2 H2O (7) +1 -1 NaCl
H O Na Cl
(4) +1 -2 H2S (8) +1 -2 Na2S
H S Na S
Pada setiap contoh, rumus molekul dapat dibentuk dari 2 unsur yang BO-nya berlawanan tanda.
Pada contoh (1) dan (2), unsur C memiliki BO +2 dan BO +4 sedangkan unsur O memiliki BO –2. Dengan demikian unsur C dan unsur O dapat membentuk 2 jenis senyawa masing-masing dengan rumus molekul CO dan CO2.
Sementara pada contoh (5) dan (6), unsur besi dapat membentuk dua senyawa dengan rumus molekul FeO dan Fe2O3.
Jadi dalam hal ini, rumus molekul senyawa biner diambil dari rumus perbandingan jumlah atom yang paling sederhana.
CATATAN:
“Bilangan oksidasi” akan dibahas lebih lengkap pada bab khusus.
BO unsur dalam senyawanya pada Tabel 4.3 akan diterapkan pada pembahasan berikut ini.
Maka rumus perbandingan atom: C2O2. Rumus molekulnya: CO.
+2 –2
C O
+4 –2
C O
Maka rumus perbandingan atom: C2O4. Rumus molekulnya: CO2.
Latihan 4.3.
Tuliskan rumus molekul yang terbentuk antara:
a. kalium dan iodium d. fosfor dan hidrogen b. antimon dan oksigen e. nitrogen dan oksigen c. aluminium dan belerang
2. Oksida Dan Tata Namanya
Oksida adalah senyawa yang terbentuk antara suatu unsur dan oksigen. Rumus molekul oksida dapat diperkirakan dari BO unsur yang bersangkutan (lihat Tabel 4.3).
Contoh oksida:
H2O; N2O5, CO2, P2O3, Cl2O7, SO3, Na2O, CaO, Fe2O3, PbO2, dst.
Karena unsur dapat dibedakan sebagai unsur logam dan unsur bukan-logam, maka oksida pun dapat dibedakan menjadi oksida logam dan oksida bukan-logam. Berdasarkan Tabel 4.3, maka contoh untuk kedua oksida ini adalah:
Contoh oksida logam: Contoh oksida bukan-logam:
Na2O, CaO, Fe2O3, PbO2, dst. H2O; N2O5, CO2, P2O3, Cl2O7, SO3, dst.
a. Tata Nama Oksida Bukan-logam
Aturan penamaan oksida bukan-logam adalah:
(awalan+nama unsur bukan-logam) (awalan+oksida) Awalan yang digunakan dapat dilihat pada Tabel 4.4 berikut.
Tabel 4.4 Awalan dalam Kimia
1 = mono 6 = heksa 11 = undeka 20 = ikosa 2 = di 7 = hepta 12 = dodeka 21 = henikosa 3 = tri 8 = okta 13 = trideka 22 = dokosa 4 = tetra 9 = nona 14 = tetradeka 23 = trikosa 5 = penta 10 = deka 15 = pentadeka 24 = tetrakosa Contoh:
Rumus Nama Rumus Nama
CO (mono)karbon monoksida Cl2O diklor (mono)oksida CO2 (di)karbon dioksida Cl2O3 diklor trioksida H2O dihidrogen (mono)oksida Cl2O5 diklor pentoksida
Cl2O7 diklor heptoksida Keterangan:
(1) Awalan di antara dua tanda kurung dapat dihilangkan.
(2) H2O pada keadaan kamar berwujud cair dan sering disebut air.
Dengan demikian, berdasarkan pada harga BO (Tabel 4.3), kita dapat memperkirakan atau menuliskan rumus kimia oksida bukan-logam yang mungkin.
Latihan 4.4.
Tuliskan rumus molekul dan nama dari oksida-oksida belerang, dan oksida-oksida nitrogen.
b. Tata Nama Oksida Logam
Aturan penamaan oksida logam adalah:
nama unsur logam+(BO*)+oksida atau: (nama Latin unsur logam+o/i*)+(oksida) Keterangan:
Tambahan (harga BO*) atau kata o/i*, bila unsur logam memiliki lebih dari sebuah harga BO.
Contoh:
Rumus Nama: Nama Lain:
Na2O natrium oksida - MgO magnesium oksida - Al2O3 aluminium oksida -
Hg2O raksa(I)oksida merkuro oksida HgO raksa(II)oksida merkuri oksida
Dst.
Catatan:
(1) Pada “raksa(I)oksida”, bilangan romawi I menunjukkan harga BO Hg=+1 dalam Hg2O.
(2) Oksida logam dari unsur logam ber-BO tunggal hanya memiliki sebuah nama oksida.
Latihan 4.5.
1. Tuliskan rumus kimia dari kalium oksida dan ferro oksida.
2. Apa nama dari BaO dan Sb2O3.
3. Asam, Basa, Dan Tata Namanya
Asam adalah senyawa yang mengandung gugus H dan dapat dilepaskan sebagai ion H+. Basa adalah senyawa yang mengandung gugus OH dan dapat dilepaskan sebagai ion OH-. Menurut batasan ini, setiap senyawa asam selalu mengadung gugus H sedangkan senyawa basa selalu mengandung gugus OH. Dengan demikian rumus kimia kedua kelompok senyawa ini pun bersifat khas termasuk aturan penamaannya.
a. Tata Nama Asam
Asam-asam memiliki tatanama khusus. Untuk memperjelas hal ini amatilah berbagai asam yang diberikan menurut Tabel 4.5 dan 4.6 berikut.
Tabel 4.5 Beberapa Asam Non-oksi
Rumus Nama Rumus Nama
HF asam fluorida HCN asam sianida HCl asam klorida HCNS asam tiosianida HBr asam bromida H2S asam sulfida
HI asam iodida
Tabel 4.6 Beberapa Asam Oksi.
Rumus Nama Rumus Nama
CH3COOH asam asetat HClO asam hipoklorit HNO2 asam nitrit HClO2 asam klorit HNO3 asam nitrat HClO3 asam klorat H2CO3 asam karbonat HClO4 asam perklorat H2C2O4 asam oksalat HBrO asam hipobromit H2SO3 asam sulfit HBrO3 asam bromat H2SO4 asam sulfat HIO asam hipoiodit H3PO3 asam fosfit HIO3 asam iodat H3PO4 asam fosfat HIO4 asam periodat Keterangan:
Asam nonoksi merupakan asam yang tidak mengandung unsur oksigen; sebaliknya asam oksi sebagai asam yang mengandung unsur oksigen. (Lihat juga Tabel 4.8.)
b. Tata Nama Basa
Basa-basa memiliki tatanama yang tidak begitu berbeda dengan nama oksidanya, yaitu hanya dengan mengganti kata “oksida” dengan kata “hidroksida”. Beberapa basa ditunjukkan pada Tabel 4.7.
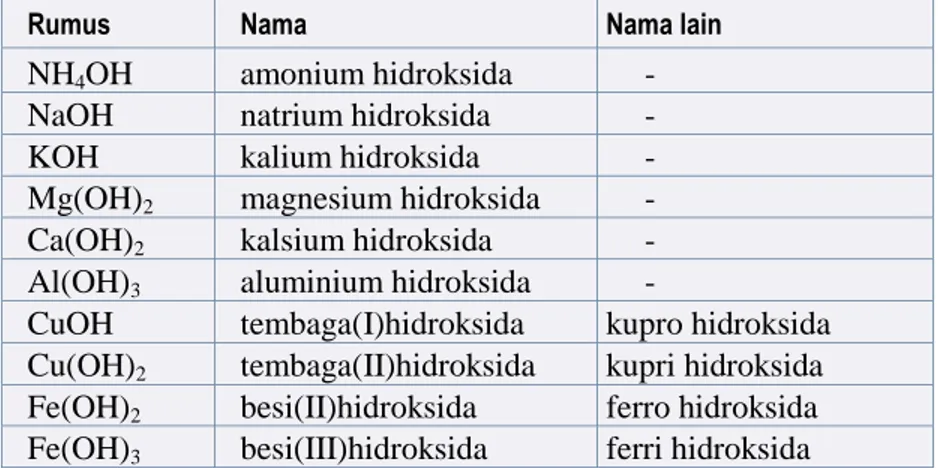
Tabel 4.7 Rumus Kimia Dan Nama Beberapa Basa
Rumus Nama Nama lain
NH4OH amonium hidroksida -
NaOH natrium hidroksida -
KOH kalium hidroksida -
Mg(OH)2 magnesium hidroksida - Ca(OH)2 kalsium hidroksida - Al(OH)3 aluminium hidroksida -
CuOH tembaga(I)hidroksida kupro hidroksida Cu(OH)2 tembaga(II)hidroksida kupri hidroksida Fe(OH)2 besi(II)hidroksida ferro hidroksida Fe(OH)3 besi(III)hidroksida ferri hidroksida
Dst.
Catatan:
BO unsur logam berperan penting dalam memperkirakan rumus kimia dan nama dari basanya.
4. Oksida Basa, Oksida Amfoter, Dan Oksida Asam
a. Oksida BasaDi muka telah dibahas oksida logam dan oksida bukan-logam. Semua oksida logam merupakan oksida basa, yakni oksida yang dapat membentuk basa dengan pelarut air. Jadi semua basa mempunyai oksida basanya, kecuali amonium hidroksida, NH4OH.
Reaksi pembentukan NH4OH adalah NH3 + H2O NH4OH.
Semua oksida basa berwujud padat dan dapat bereaksi dengan air membentuk basa. Hampir sebagian besar basa sukar larut di dalam air, oleh karena itu larutan menjadi keruh oleh terbentuknya endapan. Hanya beberapa yang mudah larut di dalam air seperti NH4OH, LiOH, NaOH, KOH, Sr(OH)2, dan Ba(OH)2. Sedangkan Ca(OH)2 sedikit larut dalam air.
Reaksi di atas secara lengkap dapat ditulis sebagai berikut:
b. Oksida Amfoter
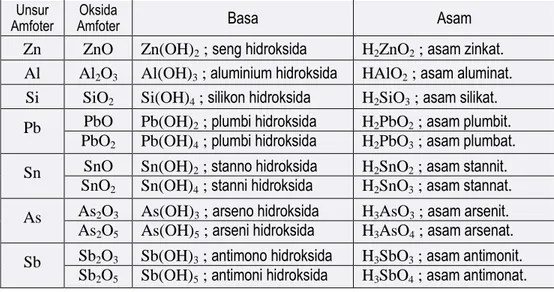
Beberapa oksida-logam ada yang dapat membentuk basa maupun asam. Oksida seperti ini disebut oksida amfoter. Oksida amfoter meliputi ZnO, Al2O3, SiO2, PbO, PbO2, SnO, SnO2, As2O3, As2O5, Sb2O3, dan Sb2O5. Oksida amfoter beserta asam atau basanya diberikan pada Tabel 4.8.
Tabel 4.8 Unsur, Oksida, Dan Asam/Basa Amfoter Unsur
Amfoter Oksida
Amfoter Basa Asam
Zn ZnO Zn(OH)2 ; seng hidroksida H2ZnO2 ; asam zinkat.
Al Al2O3 Al(OH)3 ; aluminium hidroksida HAlO2 ; asam aluminat.
Si SiO2 Si(OH)4 ; silikon hidroksida H2SiO3 ; asam silikat.
Pb PbO Pb(OH)2 ; plumbi hidroksida H2PbO2 ; asam plumbit.
PbO2 Pb(OH)4 ; plumbi hidroksida H2PbO3 ; asam plumbat.
Sn SnO Sn(OH)2 ; stanno hidroksida H2SnO2 ; asam stannit.
SnO2 Sn(OH)4 ; stanni hidroksida H2SnO3 ; asam stannat.
As As2O3 As(OH)3 ; arseno hidroksida H3AsO3 ; asam arsenit.
As2O5 As(OH)5 ; arseni hidroksida H3AsO4 ; asam arsenat.
Sb Sb2O3 Sb(OH)3 ; antimono hidroksida H3SbO3 ; asam antimonit.
Sb2O5 Sb(OH)5 ; antimoni hidroksida H3SbO4 ; asam antimonat.
Catatan:
Semua basa amfoter (berarti asamnya juga) tergolong sukar larut dalam air.
Reaksi:
Na2O
natrium oksida + H2O
air
2 NaOH
natrium hidroksida
CaO
kalsium oksida + H2O
air
Ca(OH)2
kalsium hidroksida
Sb2O5
antimoni oksida + 5 H2O
air
2 Sb(OH)5
antimoni hidroksida
NH3(g) + H2O(l) NH4OH(aq) Na2O(s) + H2O(l) 2 NaOH(aq) CaO(s) + H2O(l) Ca(OH)2(aq) Sb2O5(s) + 5 H2O(l) 2 Sb(OH)5(s)
c. Oksida Asam
Oksida bukan-logam ada yang dapat dan ada yang tidak dapat membentuk asam dengan pelarut air. Oksida bukan-logam yang dapat membentuk asam dengan pelarut air disebut oksida asam.
Sebagian besar oksida asam (yang berasal dari oksida bukan logam) berwujud gas pada suhu kamar dan umumnya larut dalam air. Oleh karena itu adanya oksida-oksida asam di udara menyebabkan air murni bila terbuka menjadi bersuasana asam. Hanya tidak semua asam larut baik di dalam pelarut air (lihat Tabel 4.10 tentang sifat-sifat asam).
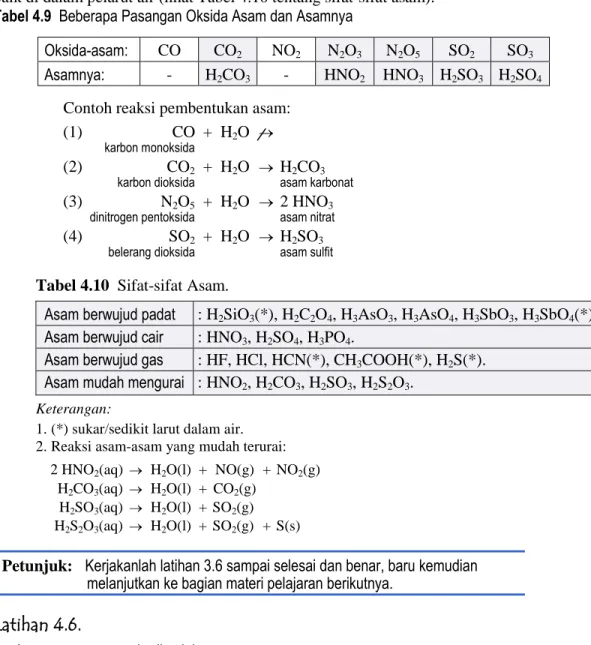
Tabel 4.9 Beberapa Pasangan Oksida Asam dan Asamnya
Oksida-asam: CO CO2 NO2 N2O3 N2O5 SO2 SO3
Asamnya: - H2CO3 - HNO2 HNO3 H2SO3 H2SO4
Tabel 4.10 Sifat-sifat Asam.
Asam berwujud padat : H2SiO3(*), H2C2O4, H3AsO3, H3AsO4, H3SbO3, H3SbO4(*).
Asam berwujud cair : HNO3, H2SO4, H3PO4.
Asam berwujud gas : HF, HCl, HCN(*), CH3COOH(*), H2S(*).
Asam mudah mengurai : HNO2, H2CO3, H2SO3, H2S2O3. Keterangan:
1. (*) sukar/sedikit larut dalam air.
2. Reaksi asam-asam yang mudah terurai:
2 HNO2(aq) H2O(l) + NO(g) + NO2(g) H2CO3(aq) H2O(l) + CO2(g)
H2SO3(aq) H2O(l) + SO2(g) H2S2O3(aq) H2O(l) + SO2(g) + S(s)
Petunjuk: Kerjakanlah latihan 3.6 sampai selesai dan benar, baru kemudian melanjutkan ke bagian materi pelajaran berikutnya.
Latihan 4.6.
1. Apa nama senyawa berikut ini.
a. H2C2O4. b. Ba(OH)2. c. HAlO2. 2. Tuliskan rumus kimia senyawa berikut:
a. litium oksida. b. amonium hidroksida. c. asam bromat.
Contoh reaksi pembentukan asam:
(1) CO
karbon monoksida + H2O
(2) CO2
karbon dioksida + H2O H2CO3
asam karbonat
(3) N2O5
dinitrogen pentoksida + H2O 2 HNO3
asam nitrat
(4) SO2
belerang dioksida + H2O H2SO3
asam sulfit
3. Mana di antara oksida berikut yang merupakan oksida basa, oksida amfoter, dan oksida asam.
a. P2O3 b. As2O3 c. Co2O3
4.
Isilah bagian kosong pada tabel-tabel di bawah ini.O2- OH- Cl- SO42-
PO43-
H+ H2O …………. …………. …………. H3PO4
air air asam klorida ……… ………
K+ K2O …………. …………. K2SO4 ………….
……… kalium hidroksida ……… ……… kalium fosfat
Ca2+ …………. …………. CaCl2 …………. Ca3(PO4)2
kalsium oksida ……… ……… ……… ………
Fe2+ …………. Fe(OH)2 …………. …………. ………….
besi(II)oksida ……… ……… ferro sulfat ………
Fe3+ Fe2O3 …………. …………. …………. ………….
……… ……… ferri klorida ……… ………
REAKSI KIMIA SEDERHANA
Air merupakan pelarut universal; hampir sebagian besar zat dapat melarut ke dalam air.
Oleh karena itu, sebagian reaksi-reaksi kimia banyak yang dilangsungkan dalam pelarut air.
Berikut ini pembahasan beberapa jenis reaksi sederhana yang berlangsung dalam pelarut air.
1. Reaksi Asam Dan Basa
asam + basa garam + air2. Reaksi Oksida-basa Dan Asam
oksida-basa + asam garam + airContoh:
Na2 O + 2 H Cl 2 NaCl + H2O Secara lengkap reaksi ini dapat ditulis sebagai:
Na2O(s) + 2 HCl(aq) 2 NaCl(aq) + H2O(l)
natrium klorida
Contoh lain:
3 CaO + 2 H3PO4 Ca3(PO4)2 + 3 H2O
kalsium fosfat (perhatikan jawaban latihan 4.6 nomor 4).
Contoh:
Na OH + H Cl NaCl + H2O Secara lengkap reaksi ini dapat ditulis sebagai:
NaOH(aq) + HCl(aq) NaCl(aq) + H2O(l)
natrium hidroksida asam klorida natrium klorida
Contoh lain:
3 NaOH + H3PO4 Na3PO4 + 3 H2O
natrium fosfat
Latihan 4.7.
Tuliskan persamaan reaksi berikut ini.
1. KOH(aq) + H2SO4(aq).
2. Padatan barium oksida dimasukkan ke dalam larutan asam nitrat.
3. Reaksi Oksida-asam Dan Basa
oksida-asam + basa garam + air4. Reaksi Oksida Amfoter Dan Asam/Basa
oksida-amfoter + asam garam + air oksida-amfoter + basa garam + air Contoh:Latihan 4.8.
Tulislah persamaan reaksi yang terjadi.
1. Gas karbon dioksida dialirkan ke dalam larutan Ba(OH)2. 2. Padatan timah(II)oksida dilarutkan ke dalam larutan asam sulfat.
3. Padatan stanno oksida dan larutan natrium hidroksida.
Contoh:
(1) CO2 + 2 NaOH Na2CO3 + H2O (2) CO2 + Ca(OH)2 CaCO3 + H2O
(3) SO3(g) + 2 KOH(aq) K2SO4(aq) + H2O(l)
ZnO + 2 HCl
ZnO + 2 NaOH ZnCl2 + H2O
Na2ZnO2 + H2O Al2O3 + 6 HNO3
Al2O3(s) + 2 KOH(aq)
2 Al(NO3)3(aq) + 3 H2O(l)
aluminium nitrat
2 KAlO2(aq) + H2O(l)
kalium aluminat
Lambang atom unsur diturunkan dari:
huruf awal kapital dari nama Latin unsurnya, atau
huruf awal kapital + satu huruf kecil dari nama Latin unsurnya.
Rumus kimia zat menyatakan jenis dan jumlah atom-atom pembentuknya.
Rumus kimia unsur umumnya sama dengan lambang atom unsurnya; kecuali unsur-unsur dari H, O, N, F, Cl, Br, I, P, dan S (lihat bagan).
Rumus kimia senyawa sesuai dengan lambang molekulnya yang ditentukan oleh jenis dan jumlah atom pembentuk molekul itu. Rumus kimia senyawa sering disebut sebagai rumus molekul.
Persamaan reaksi merupakan pernyataan singkat suatu perubahan kimia. Persamaan reaksi memiliki arti dan peran penting dalam perhitungan kimia. Arti dari persamaan reaksi adalah kesetaraan perubahan antara pereaksi dan zat hasil reaksi. Persamaan reaksi berperan sebagai acuan perhitungan (kuantitatif) terhadap perubahan zat yang terlibat reaksi.
Oksida merupakan senyawa antara suatu unsur dan oksigen.
Oksida dapat dibagi menjadi oksida logam dan oksida bukan-logam. Oksida logam umumnya dapat membentuk basa dengan air (disebut oksida basa) sedangkan hanya sebagian oksida bukan-logam larut dalam air membentuk asam (disebut oksida asam). Oksida yang dapat bersifat sebagai oksida basa maupun oksida asam disebut oksida amfoter.
Asam merupakan senyawa yang dapat melepaskan ion H+; sedangan basa merupakan senyawa yang dapat melepaskan ion OH- di dalam air.
Garam merupakan senyawa antara ion logam dan ion sisa asam. Garam dapat dihasilkan antara lain dari reaksi antara asam dan basa. Garam dapat dibentuk dari reaksi antara kedua peraksi berikut:
asam dan basa logam dan asam
oksida basa dan asam logam dan garam
oksida asam dan basa garam dan garam
oksida amfoter dan basa garam dan basa
oksida amfoter dan asam garam dan asam
amoniak dan asam
IKHTISAR
PILIHAN BERGANDA (Hanya ada satu jawaban yang benar).
01. Kelompok lambang atom yang langsung menjadi rumus kimia unsurnya adalah:
A. Na, Fe, S C. K, Cu, Br E. Si, C, H B. Al, Co, I D. Mg, Pt, Ni
02. Unsur natrium, nitrogen, dan neon berturut-turut mempunyai rumus kimia:
A. Na, N, dan Ne D. Na, N2, dan Ne2
B. Na, N2, dan Ne E. Na2, N2, dan Ne2
C. Na, N, dan Ne2
03. Manakah di antara pernyataan berikut yang tepat ?
A. Semua unsur berwujud gas terdiri dari molekul diatom.
B. Rumus kimia belerang dan fosfor adalah S4 dan P8. C. Unsur brom berwujud cair dengan rumus kimia Br2.
D. Hg adalah rumus kimia dari unsur merkurium berwujud padat E. Salah satu unsur berwujud gas adalah iodium dengan rumus kimia I2. 04. Semua pasangan rumus kimia berikut berwujud gas kecuali:
A. H2 dan N2. C. O2 dan F2. E. Cl2 dan I2. B. N2 dan O2. D. F2 dan Cl2.
05. Kelompok unsur padat berikut ini yang berpartikel dasar molekul adalah:
A. fosfor, belerang, iodium D. fosfor, nitrogen, raksa B. belerang, iodium, brom E. klor, fluor, brom C. iodium, klor, karbon
06. Rumus kimia belerang, fosfor, dan iodium berturut-turut adalah ….
A. S, P, dan I C. S, P4, dan I2. E. S8, P4, dan I.
B. S, P, dan I2. D. S8, P4, dan I2.
07. Suatu senyawa terdiri dari unsur hidrogen, nitrogen, dan oksigen memiliki perbandingan jumlah atom H : N : O = 2 : 1 : 1. Senyawa ini mempunyai rumus molekul yang memenuhi adalah:
A. HNO2 C. NH4OH E. NH4NO3
B. HNO3 D. NH4NO2
08. Deretan senyawa mempunyai rumus molekul C2H4, C3H6, C4H8, dan C5H10. Rumus empirik kelompok senyawa ini dapat dinyatakan sebagai:
A. CH2 C. C5H10. E. (CH2)n
B. C2H4 D. CnH2n
09. Dalam senyawa berikut ini, senyawa mana yang memiliki jumlah atom paling banyak ? A. Al2(SO4)3 C. Na2CO3.10H2O E. C12H22O11
B. NH4NO3 D. CuSO4.5H2O
SOAL-SOAL
10. Gas nitrogen bereaksi dengan gas hidrogen membentuk gas amoniak, NH3. Persamaan reaksi yang memenuhi Hukum kekekalan Massa untuk perubahan kimia ini adalah:
A. NH3 N + 3 H D. N2 + H2 NH3
B. 2 NH3 N2 + 3 H2 E. ½ N2 + 1½ H2 NH3
C. N + 3 H NH3
11. Manakah di antara persamaan reaksi berikut yang telah setara ?
A. Al2O3 + CO 2 Al + 2 CO2 D. 4 HNO2 2 H2O + NO + 2 NO2
B. 2 Fe + 3 O2 2 Fe2O3 E. KClO3 KCl + O2
C. Ba(OH)2 + 2 HCl BaCl2 + 2 H2O
12. Berikut ini yang bukan senyawa biner maupun senyawa terner adalah ….
A. H2O C. H2SO4 E. KCNS
B. NaCl D. Al(OH)3
13. Diketahui BO unsur-unsur dalam senyawanya seperti berikut: H = +1; O = -2; K = +1; dan S = -2. Rumus molekul senyawa di bawah yang tidak tepat adalah:
A. H2O C. K2O. E. K2S
B. S2O2 D. H2S
14. Manakah di antara rumus molekul di bawah ini yang tergolong asam?
A. NH4OH C. LiOH E. KOH
B. CH3COOH D. AgOH
15. Rumus molekul dari strontium oksida adalah:
A. SrO C. Sr2O2 E. SrO2
B. Sr2O D. Sr2O3
16. Diklor heptoksida memiliki rumus molekul:
A. Cl2O C. Cl2O5 E. Cl2O9
B. Cl2O3 D. Cl2O7
17. Manakah yang merupakan rumus molekul dari timbal(II)oksida?
A. Pb2O C. PbO2 E. Pb2O4
B. PbO D. Pb2O2
18. Manakan di antara oksida berikut ini yang dapat membentuk asam nitrat?
A. N2O C. NO2 E. N2O5
B. NO D. N2O3
19. Manakah oksida berikut yang bukan merupakan oksida asam ? A. Karbon monoksida D. Diklor monoksida
B. Dinitrogen trioksida E. Fosfor pentoksida C. Sulfur trioksida
20. Basa berikut ini yang tidak mempunyai oksida basa adalah ….
A. KOH C. Al(OH)3 E. NH4OH
B. Mg(OH)2 D. Sn(OH)4
21. Jika asam bromida direaksikan dengan kasium hidroksida akan membentuk senyawa ….
A. Ca2Br C. CaBr2 E. CaBr3
B. Ca2Br2 D. Ca2Br3
22. Reaksi antara larutan asam klorida dan larutan natrium hidroksida adalah:
A. 2 NaOH(aq) + 2 HCl(aq) 2 NaCl(s) + 2 H2(g) + O2(g) B. 2 NaOH(aq) + 2 HCl(aq) 2 NaCl(aq) + 2 H2(g) + O2(g) C. NaOH(aq) + HCl(aq) NaCl(s) + H2O(g)
D. NaOH(aq) + HCl(aq) NaCl(aq) + H2O(g) E. NaOH(aq) + HCl(aq) NaCl(aq) + H2O(l)
23. Rumus basa yang dapat terbentuk dari oksida kobal adalah:
A. CoOH dan Co(OH)2 D. Co(OH)2 dan Co(OH)4 B. Co(OH)2 dan Co(OH)3 E. Co(OH)3 dan Co(OH)5 C. CoOH dan Co(OH)3
24. Silikon hidroksida dalam suasana basa dapat berubah bersifat asam sebagai asam silikat dengan rumus molekul:
A. HSiO3 C. H2SiO4 E. H3SiO4
B. H2SiO3 D. H3SiO3
25. Asam nitrat dapat bereaksi dengan barium hidroksida membentuk garam barium nitrat dengan rumus molekul:
A. BaNO2 C. BaNO3 E. Ba(NO3)3
B. Ba(NO2)2 D. Ba(NO3)2
ESSAY
Lambang Atom
01. Isilah bagian kosong dengan nama unsur atau lambang atomnya.
No. Nama Unsur Lambang
Atom No. Nama Unsur Lambang
Atom No. Nama Unsur Lambang Atom
1. tembaga 11. stibium 21. Mn
2. Ni 12. hydrargyrum 22. cuprum
3. perak 13. Sn 23. mercurium
4. As 14. kalsium 24. Ca
5. N 15. seng 25. stannum
6. barium 16. antimon 26. Sb
7. ferrum 17. Hg 27. nitrogen
8. Na 18. besi 28. Zn
9. timah 19. S 29. nikel
10. H 20. kalium 30. K
Rumus Kimia Zat
02. Sebutkan persamaan dan perbedaan antara molekul unsur dan molekul senyawa.
03. Diketahui zat-zat:
gas nitrogen gas helium iodium air fosfor
krom belerang gas oksigen merkurium gula Kelompokkanlah, mana di antara zat-zat tersebut yang memiliki:
a. rumus kimia paling sederhana.
b. 2 buah atom sejenis per rumus kimianya.
c. 2 jenis atom berbeda per rumus kimia.
d. lebih dari 3 atom per rumus kimianya.
04. Tuliskan rumus kimia (di kolom A) dan pernyataan yang menunjuk pada jumlah dan jenis atom (di kolom B) serta jumlah atom per molekulnya (di kolom C) sehingga keduanya memiliki hubungan yang sesuai.
A B C
…… 1 molekulnya tersusun dari 8 atom sulfur ……
P4 ………
……… ……
…… satu molekulnya terbentuk dari 2 atom hidrogen,
1 atom belerang, dan 3 atom oksigen ……
Al(OH)3 ………
……… ……
…… 1 molekulnya tersusun dari 1 atom kalium, 1 atom besi,
6 atom C, dan 6 atom nitrogen ……
(CH3)2Hg ………
……… ……
05. Isilah bagian kosong pada tabel di bawah ini dengan jawaban yang benar! Jika tidak ada jawabannya berilah tanda strip (tanda: ).
No. Nama zat Jenis
Partikel Rumus
Kimia Rumus
Molekul No. Nama zat Jenis
Partikel Rumus
Kimia Rumus Molekul
1. ……… …… S8 ….. 6. ……… …… Au …..
2. stannum …… ….. ….. 7. brom …… ….. …..
3. ……… ion ….. ….. 8. ……… …… ….. H2
4. argon …… ….. ….. 9. karbon dioksida …… ….. …..
5. ……… …… ….. P4 10. ……… …… H2O …..
06. Kelompokkanlah zat dengan rumus kimia berikut menurut kelompok zat sebagaimana disajikan menurut tabel di bawah ini.
Ca(OH)2 NO2 P4 KClO3 Xe Cu
HCl Fe H2SO4 CO2 KMnO4 CuSO4
H2 H2O2 O3 H2SO3 S8 Mg
CCl4 C2H5OH Pb NH3 C12H22O11 NaOH Jenis Zat Jenis partikel Rumus Kimia
Unsur Atom unsur Unsur Molekul unsur Senyawa Molekul Senyawa
Persamaan Reaksi
07. Periksalah, apakah persamaan reaksi berikut ini telah setara.
a. SO3 + H2O H2SO4 setara / belum
b. B2O3 + H2O 2 H3BO3 setara / belum c. OPCl3 + 6 NH3 OP(NH2)3 + 2 NH4Cl setara / belum d. Al2O3 + 2 NaOH + 7 H2O 2 NaH8AlO6 setara / belum e. 3 NaNH2 + NaNO3 2 NaN3 + 3 NaOH + NH3 setara / belum 08. Ubahlah pernyataan berikut ini menjadi sebuah persamaan reaksi yang benar.
a. Belerang dibakar menghasilkan gas belerang dioksida, SO2.
b. Padatan bijih besi, Fe2O3 direduksi oleh gas karbon monoksida menjadi besi cair dan gas karbon dioksida, CO2.
c. Padatan KClO3 terurai menjadi lelehan KCl dan gas oksigen yang dikatalisis oleh MnO2. d. Gas NOCl akan terurai menjadi gas NO dan gas klor pada suhu 1300C.
e. Serbuk pengembang kue, NaHCO3 dapat dibuat dengan mereaksikan kristal natrium karbonat, Na2CO3; air; dan gas karbon dioksida.
09. Setarakan persamaan reaksi yang belum tepat ini.
a. Fe + O2 Fe2O3 f. Cu2O + Cu2S Cu + SO2
b. CaC2 + H2O Ca(OH)2 + C2H2 g. Ca(OH)2 + NO Ca(NO3)2 + N2 + H2O c. ZnS + O2 ZnO + SO2 h. NaIO3 + SO2 + H2O I2 + Na2SO4 + H2SO4
d. P4O10 + H2O H3PO4 i. Ca3(PO4)2 + SiO2 + C CaSiO3 + P4 + CO e. SnO2 + Al Sn + Al2O3 j. CrI3 + KOH + Cl2 K2CrO4 + KIO4 + KCl + H2O