PENETAPAN KADAR AMPISILLIN
DALAM SEDIAAN KAPLET
I. TUJUAN
Menetapkan kadar ampisillin dalam sediaan kaplet dengan metode Iodometri.
II. PENDAHULUAN
Antibiotik merupakan senyawa kimia khas yang dihasilkan oleh organisme hidup, termasuk turunan senyawa dan struktur analognya yang dibuat secara sintetik, dan dalam kadar rendah mampu menghambat proses penting dalam kehidupan satu spesies atau lebih mikroorganisme. Antibiotik dapat dikelompokkan berdasarkan spectrum aktivitas, tempat kerja, dan struktur kimianya (Siswandono, 2000).
Klasifikasi antibiotika dan kemoterapetika yang sering dianjurkan dan digunakan adalah berdasarkan bagaimana kerja antibiotika tersebut terhadap kuman, yakni antibiotika yang bersifat primer bakteriostatik dan antibiotika yang bersifat primer bakterisid. Yang termasuk bakteriostatik di sini misalnya sulfonamida, tetrasiklin, kloramfenikol, eritromisin, trimetropim, linkomisin, klindamisin, asam paraaminosalisilat, dan lain-lain. Obat-obat bakteriostatik bekerja dengan mencegah pertumbuhan kuman, tidak membunuhnya, sehingga pembasmian kuman sangat tergantung pada daya tahan tubuh. Sedangkan antibiotika yang bakterisid, yang secara aktif membasmi kuman meliputi misalnya penisilin, sefalosporin, aminoglikosida (dosis besar), kotrimoksazol, rifampisin, isoniazid dan lain-lain. Pembagian lain juga sering dikemukakan berdasarkan makanisme atau tempat kerja antibiotika tersebut pada kuman, yakni :
1. Antibiotika yang bekerja menghambat sintesis dinding sel kuman, termasuk di sini adalah basitrasin, sefalosporin, sikloserin, penisilin, ristosetin dan lain-lain.
2. Antibiotika yang merubah permeabilitas membran sel atau mekanisme transport aktif sel. Yang termasuk di sini adalah amfoterisin, kolistin, imidazol, nistatin dan polimiksin. 3. Antibiotika yang bekerja dengan menghambat sintesis protein, yakni kloramfenikol,
eritromisin (makrolida), linkomisin, tetrasiklin dan aminogliosida.
4. Antibiotika yang bekerja melalui penghambatan sintesis asam nukleat, yakni asam nalidiksat, novobiosin, pirimetamin, rifampisin, sulfanomida dan trimetoprim.
kuman Gram negatif. Golongan penisilin masih dapat terbagi menjadi beberapa kelompok, yakni:
Penisilin yang rusak oleh enzim penisilinase, tetapi spektrum anti kuman terhadap Gram
positif paling kuat. Termasuk di sini adalah Penisilin G (benzil penisilin) dan derivatnya yakni penisilin prokain dan penisilin benzatin, dan penisilin V (fenoksimetil penisilin). Penisilin G dan penisilin prokain rusak oleh asam lambung sehingga tidak bisa diberikan secara oral, sedangkan penisilin V dapat diberikan secara oral. Spektrum antimikroba di mana penisilin golongan ini masih merupakan pilihan utama meliputi infeksi-infeksi streptokokus beta hemolitikus grup A, pneumokokus, meningokokus, gonokokus, Streptococcus viridans, Staphyloccocus, pyoneges (yang tidak memproduksi penisilinase), Bacillus anthracis, Clostridia, Corynebacterium diphteriae, Treponema pallidum, Leptospirae dan Actinomycetes sp.
Penisilin yang tidak rusak oleh enzime penisilinase, termasuk di sini adalah kloksasilin,
flukloksasilin, dikloksasilin, oksasilin, nafsilin dan metisilin, sehingga hanya digunakan untuk kuman-kuman yang memproduksi enzim penisilinase.
Penisilin dengan spektrum luas terhadap kuman Gram positif dan Gram negatif, tetapi
rusak oleh enzim penisilinase. Termasuk di sini adalah ampisilin dan amoksisilin. Kombinasi obat ini dengan bahan-bahan penghambat enzim penisiline, seperti asam klavulanat atau sulbaktam, dapat memperluas spektrum terhadap kuman-kuman penghasil enzim penisilinase.
Penisilin antipseudomonas (antipseudomonal penisilin). Penisilin ini termasuk
karbenisilin, tikarsilin, meklosilin dan piperasilin diindikasikan khusus untuk kuman-kuman Pseudomonas aeruginosa.
Turunan penisilin merupakan pilihan pertama untuk infeksi bakteri yang peka terhadap penisilin karena efek toksiknya terhadap organ tubuh relatif kecil bila dibandingkan dengan antibiotik lain. Turunan penisilin yang banyak digunakan dalam klinik salah satunya adalah ampisillin.
Semua penisilin mempunyai rumus
bangun dasar sebagai berikut:
Penisilin mengandung cincin tazolidina
(A) dan cincin beta laktam (B). H’ dapat diganti dengan kation anorganik atau organic membentuk suatu garam. Penggantian gugus R mempengaruhi terhadap kelarutannya dalam pelarut organik, stabilitas terhadap asam dan resistensi terhadap penisilinase.
Salah satu metode penetapan Ampicilin secara kimia adalah metode iodometri. Iodometri merupakan titrasi tidak langsung dan digunakan untuk menetapkan senyawa-senyawa yang mempunyai potensial oksidasi lebih besar dari sistem iodium-iodida atau senyawa-senyawa yang bersifat oksidator seperti CuSO4.5H2O. Pada iodometri, sampel bersifat oksidator direduksi dengan kalium iodida berlebih dan akan menghasilkan iodium yang selanjutnya dititrasi dengan larutan baku tiosulfat. Banyaknya volume tiosulfat yang digunakan sebagai titran setara dengan iod yang dihasilkan dan setara dengan banyaknya sampel.
Cincin β-laktam pada Ampicilin akan dipecah oleh alkali atau β-laktamase. Senyawa yang terbentuk dapat ditetapkan kadarnya karena dapat mengikat iodium sedangkan Ampicilin tidak dapat mengikat iodium. Metode ini merupakan metode titrasi tidak langsung di mana kelebihan iodium akan dititrasi dengan baku natrium tiosulfat. Metode iodometri agak spesifik, karena senyawa bukan penisilina yang ada tidak ikut tertetapkan dengan cara melakukan blanko. Juga metode ini cukup peka karena jumlah iod yang bereaksi cukup besar. Dengan mempelajari sifat kimia dan rumus bangun dari suatu antibiotik maka dapat disusun penetapan secara kimiawi yang lebih baik. Metode yang paling baik adalah metode yang dapat menetapkan suatu senyawa secara kuantitatif tanpa diganggu oleh hasil peruraiannya atau senyawa lain yang mempunyai sifat kimia yang serupa.
Metode penetapan kadar secara iodometri
a. Sampel
± 50 mg sampel ditimbang seksama, dimasukkan labu takar
Ditambah aquades sampai 100 ml
Diambil 5 ml larutan, dimasukkan labu bersumbat
Ditambah 1 ml NaOH 1 N, dibiarkan selama 20 menit
Ditambah 5 ml larutan dapar pH 4,5 yang terdiri dari : 5 ml asam asetat 12%
5 ml Na asetat 27% 15 ml aquades
Ditambah 1 ml HCl 1 N dan 10 ml Yodium 0,01 N
Dibiarkan 20 menit terlindung dari cahaya
Dititrasi dengan baku Na2S2O3 0,01N dengan 1 ml indikator kanji 0,5%
b. Blanko
5,0 ml larutan sampel dimasukkan labu bersumbat kaca
Ditambah 5 ml dapar pH 4,5
Ditambah 10,0 ml yodium 0,01 N
Dibiarkan 20 menit terlindung dari cahaya
Dititrasi dengan baku Na2S2O3 0,01 N dengan 1 ml indikator kanji 5%
c. Analisis
Selisih volume larutan baku tiosulfat blanko dengan volume tiosulfat awal setara dengan jumlah iodium yang bereaksi dengan ampisilin.
Tiap ml Na2S2O3 0,01 N setara dengan 3,714 mg ampisilin.
d. Pembakuan N Na2S2O3
Dimasukkan 25 ml kalium bromat 0,1 N ke dalam labu bersumbat kaca
Diencerkan dengan 50 ml aquadest
Ditambah 5 ml HCl pekat
Ditambah 2 gram KI
Ditutup selama 5 menit di tempat gelap
Dititrasi dengan N Na2S2O3 sampai warna kuning pucat
Ditambah 3 ml indikator amilum
V. DATA DAN PERHITUNGAN
Kesetaraan
V Na2S2O3 . N Na2S2O3 = mgrek Na-Ampisilin : BE Na-ampisilin
1 ml . 0,01 N = mgrek Na-ampsilin : (BM Na-ampisilin : valensi) mgrek Na-ampisilin = 1 . 0,01 . (374,1 : 1)
mgrek Na-ampisilin = 3,741 mg
Pembuatan larutan baku Na2S2O3
1. KBrO3 0,1 N
Ditimbang 0,2784 gram KBrO3 ad 25 ml
2. Na2S2O3 0,1 N
Ditimbang 12,4095 gram Na2S2O3. 5 H2O ad 500 ml aquades
3. Volume titrasi KBrO3:
32,5 ml
26,5 ml
26 ml
Rata-rata volume titrasi = 28,333 ml
4. V KBrO3 . N KBrO3 = V Na2S2O3 . N Na2S2O3 25 ml . 0,1 N = 28,33 ml . N Na2S2O3 N Na2S2O3 = 0,08 N
Pembuatan Dapar Asetat
Asam asetat 12 % = 12 gram/100 ml H2O
Na-asetat 27 % = 27 gram/100 ml H2O
Volume aquadest = 15 ml
Pembuatan HCl 1 N dari HCl 37% (BJ HCl= 1,190 kg/L)
HCl 37% = 37gram 100ml .
1,190kg L
= 37gram 100ml ×
1,19×103gram 103ml
= 44,03100gramml
37=44,03gram
0,1L =440,3 g L Molaritas HCl
M=n
Perhitungan volume HCl yang diperlukan
V HCl 37% . N HCl 37% = V HCl . N HCl V HCl 37% . 12,06 N = 100 ml . 1 N
V HCl 37% = 8,3 ml
Untuk membuat 25 ml HCL 1 N, dibutuhkan 2,073 ml HCl pekat ad 25 ml aquades
Untuk membuat 25 ml NaOH 0,1 N, dibutuhkan 1 g NaOH ad 25 ml aquadest
Pembuatan larutan I2 0,1 N
N = gramBM .1000
Pembuatan indikator kanji 0,5 %
0,5 % = 0,5gram/100 ml H2O
Penimbangan sampel
1. Sampel I
Bobot kertas = 0,5800g Bobot sampel = 0,1280 g + Bobot kertas+sampel = 0,7080 g Bobot kertas+sisa = 0,5839 g -Bobot sampel analisis = 0,1241 g
= 124,1 mg 2. Sampel II
Bobot kertas = 0,5770 g Bobot sampel = 0,1265 g + Bobot kertas+sampel = 0,7035 g
Bobot kertas+sisa = 0,5878 g -Bobot sampel analisis = 0,1157 g
= 115,7 mg 3. Sampel III
Bobot kertas = 0,5787g Bobot sampel = 0,1250 g + Bobot kertas+sampel = 0,7037 g Bobot kertas+sisa = 0,5798 g -Bobot sampel analisis = 0,1239 g
= 123,9 mg
Analisis sampel
1. Data sampel
Obat generik : sirup kering ampisilin 125 mg/5 ml Organoleptis
Warna : putih
Bau : seperti perasa strawberry Penampakan : serbuk kering
Rasa : manis agak pahit
Volume titrasi
Blanko 1 = 9,5 ml
Blanko 2 = 9,6 ml
Blanko 3 = 9,6 ml
Sampel 1 = 8,4 ml
Sampel 2 = 8,6 ml
Sampel 3 = 8,5 ml
Kadar =
(Volume Na2S2O3blanko−Volume Na2S2O3sampel). N Na2S2O3. BE
mg sampel . bobot rata−rata tablet
1. Kadar I = (9,5ml−8,4ml).0,08.371,4
124,1mg .646,720mg
= 170,321 mg
2. Kadar II = (9,6ml−8,6ml).0,08.371,4
115,7mg .646,720mg
= 166,079 mg
3. Kadar III = (9,6ml−8,5ml).0,08.371,4
123,9mg .646,720mg
= 170,596 mg
Rata-rata kadar = 168,999 mg
SD = 2,532
SE=SD
√
N =2,532
√3 = 1,462
CV = 0,015 %
¿=±t . SE
= ±4,3.1,462 = ± 6,287
Rentang kadar
Rata-rata – LE ≤ x ≤ rata-rata + LE 162,712 mg ≤ x ≤ 175,286 mg
VI. PEMBAHASAN
Percobaan ini bertujuan untuk mengetahui apakah sediaan yang diuji (kaplet ampisilin) masih layak dipakai dalam artian apakah sediaan tersebut masih memenuhi syarat-syarat sediaan yang baik sehingga mampu memberikan aktifitas yang sama seperti saat sediaan tersebut dibuat (sesuai dengan yang tertera pada etiket). Namun demikian dalam percobaan kali ini tidak semua uji fisika-kimia dapat dilakukan karena keterbatasan alat dan waktu praktikum, sehingga uji yang dilakukan lebih mengarah pada uji kuantitatif dari sediaan.
Sediaan kaplet merupakan salah satu jenis sediaan farmasi (dosage form) yang memerlukan berbagai macam uji, meliputi uji kualitas dan kuantitas sebelum dipasarkan. Ampisilin sebagai antibiotik yang bersifat tahan terhadap asam dan lebih luas spektrum kerjanya (broad spectrum), efektif terhadap bakteri gram positif, bakteri gram negatif dan chlamydias. Ampisilin mampu menghambat pertumbuhan mikroba dengan menghambat biosintesis dinding sel mikroba dengan cara berlaku sebagai substrat palsu dan menghambat transpeptidase sehingga tidak terjadi pembentukan ikatan silang lisin-alanin (peptidoglikan). (Pratiwi, 2004)
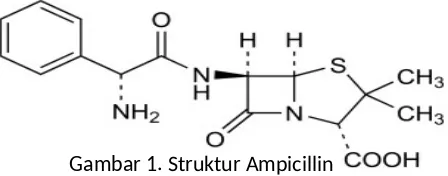
Berikut pemerian dari sampel ampisilin :
Gambar 1. Struktur Ampicillin
Ampisilin berbentuk anhidrat atau trihidrat. Mengandung tidak kurang dari 900 µg dan tidak lebih dari 1050 µg per mg C16H19N3O4S, dihitung terhadap zat anhidrat.
Pemerian : Serbuk hablur, putih; praktis tidak berbau.
Kelarutan : Sukar larut dalam air dan dalam metanol; tidak larut dalam benzena, dalam karbon tetraklorida dan dalam kloroform.
Penetapan kadar :
Prosedur Lakukan seperti yang tertera pada Penetapan Kadar Antiibiotik secara Iodometri <521>, menggunakan Ampisilin BPFI.
(Anonim, 1995)
1. Metode asidi – alkalimetri
Metode asidi-alkalimetri didasarkan atas reaksi asam-basa, dimana penisilin dirubah menjadi asam penisilinoat dengan bantuan penisilinase. Setiap molekul penisilin akan membentuk satu gugus karboksil yang dapat dititrasi dengan baku alkali. Sedangkan metode spektrofotometri dapat dilakukan karena molekul ampisilin mampu mengabsorpsi sinar UV. Hal ini disebabkan karena dalam molekul ampisilin terdapat gugus kromofor (ikatan rangkap terkonjugasi) yang bertanggung jawab terhadap absorpsi sinar UV tersebut.
2. Metode Iodomeri
Merupakan metode titrasi reduksi-oksidasi yang dilakukan untuk zat-zat dengan potensial oksidasi yang lebih besar dari sistem iodium-iodida. Iodium akan mengoksidasi zat-zat tersebut, tetapi iodium sendiri akan mengalami reduksi menjadi iodida. Iodium yang tersisa dititrasi kembali menggunakan larutan baku Na2S2O3. Dari sini hanya dapat diketahui iodium yang tersisa sehingga untuk mengetahui iodium yang bereaksi dengan analit (dalam hal ini ampisilin) perlu dilakukan titrasi blanko. Oleh karena itu iodometri dinamakan juga metode titrasi tidak langsung. Cincin ß laktam pada penisilin dipecah oleh alkali atau penisilinase. Asam penisiloat yang terjadi dapat ditetapkan kadarnya karean asam ini dapat mengikat iod sedangkan penisilin tidak dapat mengikat iod. Kemudian kelebihan iodium dititrasi dengan baku Na-tiosulfat.
Pemilihan Metode Analisis :
Metode analisis ampicillin yang dipilih adalah titrasi iodometri, yang menurut sumber Farmakope Indonesia Edisi IV adalah metode yang paling sesuai. Metode ini merupakan metode yang sederhana dan mudah. Selain itu bahan-bahan yang dibutuhkan juga murah. Pemilihan metode iodometri ini mengacu pada literature yaitu Farmakope Indonesia edisi IV. Metode iodometri ini didasarkan pada reaksi reduksi-oksidasi, yaitu berdasarkan perpindahan elektron yang terjadi pada reaksinya. Suatu reaksi dikatakan mengalami reaksi oksidasi apabila memenuhi satu atau lebih kriteria, yaitu :
1. Mengalami kenaikan bilangan oksidasi. 2. Bertambahnya atom oksigen.
3. Berkurangnya jumlah atom hidrogen (dehidrogenasi).
Sedangkan suatu reaksi mengalami reduksi apabila terjadi penurunan bilangan oksidasi, pengurangan atom oksigen, dan bertambahnya jumlah atom hidrogen.
Dari reaksi di atas, terdapat tiga tahap yang diperlukan untuk menganalisis turunan penisilin (termasuk ampicillin) secara iodometri, yaitu :
Tahap 1 : Turunan penisilin diubah menjadi bentuk asam penisiloat (suatu asam dikarboksilat) dengan cara hidrolisis dalam larutan NaOH. Dalam reaksi ini, terjadi pembukaan cincin β-laktam.
Tahap 2 : Asam penisiloat dalam suasana asam akan menjadi D-penisilamin dan asam benzilpenisilin.
Tahap 3 : D-penisilamin dioksidasi secara kuantitatif oleh iodin dan menghasilkan senyawa disulfida. Kemudian kelebihan iodine dititrasi kembali menggunakan titran berupa larutan natrium tiosulfat (Na2S2O3).
Berdasarkan reaksi tersebut, diketahui bahwa valensi ampisilin adalah sama dengan satu. Pada reaksi dapat dilihat bahwa diperlukan dua mol D-penisilamin untuk bereaksi dengan satu mol iodium (I2), dimana dua mol D-penisilamin ini diperoleh dari dua mol ampisilin. Satu mol iodium setara dengan 2 elektron sesuai dengan reaksi :
I2 + 2e- → 2I -Sehingga urutannya menjadi sebagai berikut :
2 mol ampisilin ~ 2 mol asam penisiloat ~ 2 mol D-penisilamin ~ 1 mol I2 ~ 2 elektron
dilepaskan oleh 1 mol senyawa obat. Dengan demikian, karena 2 mol ampisilin setara dengan
2 elektron, valensinya menjadi : 22=1
.
Keaktifan senyawa turunan ampisilin terletak pada cincin β-laktamnya. Apabila cincin tersebut masih utuh maka senyawa turunan penisilin berefek biologis. Namun bila cincin ini rusak maka senyawa turunan penisilin tidak lagi berefek. Perusakan (pembukaan) cincin β-laktam ini dapat terjadi karena reaksi dengan basa atau dengan enzim penisilinase (Sudjadi, 1979).
Metode titrasi iodometri adalah metode yang baik digunakan untuk analisis kuantitatif senyawa turunan penisilin, bahkan bila dibandingkan dengan metode spektrofotometri. Hal ini disebabkan karena metode iodometri ini dapat mengukur hanya senyawa turunan penisilin yang masih aktif (cincin β-laktamnya masih utuh) karena digunakan blangko, yang berupa senyawa turunan penisilin (sampel yang dianalis) namun tanpa ditambahkan alkali atau enzim penisilinase. Dengan ini dapat diketahui kadar dari sampel antibiotik turunan penisilin utuh berapa, sedangkan pada spektrofotometri hal ini tidak dapat dilakukan.
Pada metode spektrofotometri sampel dianalisis berdasarkan keberadaan kromofornya. Kromofor yang terdeteksi ini (data berupa absorbansi) sebanding dengan kadar dari sampel. Padahal pada turunan senyawa penisilin, baik yang masih aktif maupun tidak, keduanya mengandung kromofor yang sama, yaitu gugus R yang terdapat pada rantai samping struktur turunan penisilin. Sedangkan cincin β-laktam tidak bertindak sebagai kromofor, sehingga apabila terdapat cincin yang terbuka tidak terdeteksi menggunakan metode spektrofotometri. Misalkan pada senyawa benzilpenisilin berikut :
Sedangkan metode HPLC dan mikrobiologi dapat mendeteksi kadar senyawa turunan penisilin utuh seperti halnya iodometri. Hal ini disebabkan karena pada HPLC terjadi pemisahan antara senyawa utuh dan inaktif tersebut karena kepolaran keduanya berbeda. Sedangkan pada metode mikrobiologis diuji aktivitas biologis dari senyawa, sehingga adanya senyawa yang tidak aktif dapat terdeteksi.
Pada metode ini digunakan metode titrasi iodometri, bukan HPLC yang jauh lebih sensitif dibandingkan dengan titrasi. Hal ini disebabkan karena metode titrasi selain sederhana, juga masih termasuk sensitif untuk mendeteksi kadar senyawa sampel ampisilin
kromofor kromofor
basa atau
yang diujikan. Batas deteksi dari metode titrasi adalah semimikro s.d mili, masih bisa ditolerir karena kadar dari sampel yang ditetapkan adalah 500 mg (sesuai yang tercantum dalam label kemasan), lebih besar dari batas deteksi titrasi yang berarti sampel dapat terdeteksi kadarnya dengan metode titrasi ini. Kadar ampisilin yang terdapat dalam sediaan adalah ±10% dari label claim (Anonim, 1995).
Kadar sebesar 500 mg ini masih dapat dideteksi menggunakan metode titrasi karena titrasi dapat mendeteksi kadar hingga semimikro. Sehingga metode titrasi dikatakan metode yang cukup sensitif untuk ampisilin.
Tidak semua senyawa turunan penisilin dapat dianalisis menggunakan spektrofotometri UV. Apabila gugus R rantai samping turunan penisilin tidak mengandung gugus auksokrom, kromofor berupa benzen yang terdapat pada rantai samping R masih belum cukup untuk
dapat dideteksi karena harga
ε
(epsilon) yang dihasilkan terlalu kecil. Suatu senyawa dapatdianalisis menggunakan spektrofotometri apabila memiliki nilai epsilon lebih dari 1000. Ampisilin adalah salah satu senyawa turunan penisilin yang tidak dapat dianalisis menggunakan metode spektrofotometri UV karena tidak memiliki auksokrom pada strukturnya dan memiliki harga epsilon kurang dari 1000. Perhitungan harga epsilonnya dinyatakan sebagai berikut :
ε =
A x BM10 =¿ 9,2x349,4010 =¿ 321,448
Dari perhitungan terbukti bahwa harga epsilon dari ampisilin kurang dari 1000 (hanya 321,448); sehingga ampisilin tidak dapat dianalisis menggunakan metode spektrofotometri.
(Clarke, 2006)
digunakan sebagai titran setara dengan iodium yang dihasilkan dan setara dengan banyaknya sampel.
Pada penetapan kadar sediaan sirup ampisilin langkah pertama yang dilakukan adalah pembakuan larutan Na2S2O3. Larutan Na2S2O3 merupakan larutan baku sekunder atau larutan yang akan digunakan untuk mentitrasi sample. Larutan ini perlu dibakukan karena konsentasinya cepat berubah oleh pengaruh lingkungan karena senyawa yang digunakan sebagai larutan baku sekunder umumnya tidak stabil, misalnya saja bersifat higroskopis, sensitive terhadap cahaya atau mudah terdegradasi oleh udara. Pengaruh ketidakstabilan ini tidak hanya bersifat kimia tetapi juga dapat bersifat fisik seperti misalnya saat penimbangan sering tidak tepat karena senyawa ini memiliki berat molekul relative kecil dan mudah menyerap uap air di udara.
Kalium bromat merupakan senyawa baku primer yang tidak perlu dibakukan lagi terhadap senyawa lain. KBrO3 dapat digunakan sebagai baku primer karena memiliki sifat-sifat sebagai berikut :
Murni atau mudah dimurnikan
Memiliki massa molekul relative yang besar
Stabil dan tidak higroskopis
kering, tidak terpengaruh oleh udara/lingkungan(zat tersebut stabil);
mudah larut dalam air;
mempunyai massa ekivalen yang tinggi.
Pembakuan menggunakan KBrO3 0,1 N yang dibuat dengan cara melarutkan 0,2783 gram serbuk KBrO3 ke dalam 100 ml aquadest, Sedangkan standardisasinya dilakukan dengan memasukkan 25 ml KBrO3 ke dalam labu erlenmeyer bertutup, kemudian ditambahkan 2 g KI dan 5 ml HCl encer. Pada pembakuan ini digunakan larutan baku kalium iodida karena larutan ini cukup stabil dan lebih mudah larut daripada iodium, serta dapat menghasilkan iodium bila ditambahkan asam. Larutan baku kalium iodida yang digunakan harus selalu dibuat baru karena mudah teroksidasi oleh udara sehingga jumlah yang lepas menjadi lebih banyak dan diperlukan titran yang lebih banyak pula. Akibatnya penetapan kadar menjadi tidak akurat lagi. Oleh karena iodium mudah menguap dan iodida dalam larutan asam mudah dioksidasi oleh udara, maka labu harus selalu ditutup dan titrasinya tidak boleh terlalu lama. Penambahan KI diharuskan berlebih, apabila tidak maka Br2 masih bersisa dan akan terjadi reaksi sampingan antara Br2 dan Na2S2O3 yang membuat titik akhir titrasi tidak tercapai. Apabila penambahan KI berlebih, reaksinya adalah sebagai berikut :
KBrO3 + 6 KBr + 6 HCl → 3Br2 + 6 KCl + 3 H2O
Br2 + 2 KI → I2 + 2KBr
2Na2S2O3 + I2 2NaI + Na2S4O6
sehingga warna coklat akan semakin pudar. Titrasi dihentikan sementara ketika warna larutan titrat menjadi kuning pucat. Kemudian ditambahkan larutan kanji sebagai indikator sehingga larutan titrat berwarna biru. Titrasi dilanjutkan kembali hingga warna biru tepat hilang (titik akhir titrasi).
Pembakuan Na2S2O3 ini direplikasi sebanyak 3 kali, agar parameter validasi metode analisis dapat dihitung. Dengan replikasi dapat diketahui jenis kesalahan yang terjadi berdasarkan harga koefisien variasi dan perolehan kembali. Dari hasil pembakuan, diperoleh volume titran yang dibutuhkan pada masing-masing replikasi adalah 32,5 ml ; 26,5 ml dan 26,0 ml; sehingga volume titran rata-rata yang diperlukan adalah 28,33 ml. Sehingga diperoleh normalitas Na2S2O3 sebesar 0,088 N berdasarkan perhitungan :
N Na2S2O3 = 25×0,1
28,33 = 0,088 N
Dengan demikian kesetaraannya menjadi : tiap ml larutan Na2S2O3 0,088 N setara dengan 32,9208 mg ampisilin, berdasarkan perhitungan :
BE = valensiBM =374,1
1
=
374,1Kesetaraan = BE × N = 374,1 × 0,088= 32,9208 mg
Larutan iodium bukan merupakan larutan titran dalam metode iodometri (konsentrasi iodium tidak digunakan dalam perhitungan kuantitatif). Iodium hanya berfungsi untuk membentuk I2 bebas yang nantinya akan dititrasi dengan larutan Na2S2O3.
Larutan indicator kanji yang digunakan dibuat dengan cara melarutkan 500 mg amilum ke dalam 100 ml air dingin. Kemudian suspensi amilum tersebut dipanaskan hingga semua amilum larut dan terbentuk larutan yang jernih, kemudian didinginkan dan baru digunakan sebagai indikator. Keuntungan penggunaan kanji adalah harganya murah dan mudah didapat. Sedangkan kerugiannya adalah tidak mudah larut dalam air, tidak stabil pada suspensi dengan air (sehingga selalu dibuat baru), membentuk kompleks yang sukar larut dalam air bila bereaksi dengan iodium sehingga tidak boleh ditambahkan pada awal titrasi tapi harus ditunggu hingga warna titrat kuning pucat. Penambahan indicator pada awal titrasi dapat menimbulkan titik akhir titrasi yang tiba-tiba atau titik akhir palsu. Indikator ini bersifat reversible, artinya warna biru yang timbul akan hilang lagi apabila iodium direduksi oleh Na2S2O3 atau reduktor lainnya.
ampisilin dan kertas timbang nya ditimbang dengan neraca analitik, lalu serbuk di pindah ke dalam labu takar 100 ml, lalu kertas timbang nya ditimbang lagi dengan menggunakan neraca analitik. Kemudian serbuk ampisilin dilarutkan dengan 100 ml aquadest dan di homogenkan dengan menggunakan sonikator.
Untuk membuat larutan uji, diambil 5.0 ml larutan sampel dan dimasukkan ke dalam labu tertutup (iodine flask). Kemudian ditambahkan 5.0 ml NaOH 0.1 N. Ampisilin tidak dapat langsung ditetapkan dengan iodometri karena tidak bereaksi dengan iodium. Oleh karena itu harus dihidrolisis terlebih dahulu dengan NaOH untuk memutus ikatan β-laktam. Dibiarkan 15 menit agar reaksi hidrolisis terjadi sempurna dan dilakukan di dalam tempat gelap. Asam ampisilinoat yang terjadi dapat ditetapkan kadarnya dengan iodometri karena dapat direduksi oleh iod. Kemudian ditambah dapar pH 4,5 sebanyak 5,0 ml dan 1,0 ml HCl 1 N untuk menetralkan atau bahkan membuat suasana menjadi sedikit lebih asam. Penambahan HCl ini harus dilakukan karena titrasi iodometri tidak boleh dilakukan pada pH > 8. Dalam lingkungan alkalis iodium akan bereaksi dengan hidroksida membentuk iodida dan hipoiodit. Selanjutnya terurai menjadi iodida dan iodat. Ion ini akan mengoksidasi thiosulfat menjadi sulfat. Setelah itu ditambahkan 10 ml iodium 0.1 N, segera tutup labu agar iodium tidak menguap dan biarkan selama 15 menit terlindung dari cahaya agar terjadi reaksi antara asam ampisilinoat dengan iodium. Iodium akan mengoksidasi asam ampisilinoat sedangkan iodium sendiri akan tereduksi menjadi iodida.
Larutan dapar asetat berfungsi untuk menjaga kestabilan pH larutan untuk mencegah terhidrolisanya penisilin, paling tidak penisilin stabil selama 20 menit. Larutan HCl akan bereaksi dengan senyawa asam ampisilinat hasil inaktivasi, menghasilkan senyawa D-penisilamin dan asam benzilpenisilat. Senyawa D-D-penisilamin ini yang akan dapat bereaksi (dioksidasi) dengan iodium, menghasilkan senyawa disulfida dan asam iodida dalam larutan. Penempatan larutan di tempat gelap (terlindung dari cahaya) selama 20 menit dimaksudkan untuk menghindari I2 teroksidasi oleh cahaya matahari. Waktu 20 menit diperuntukkan agar reaksi berlangsung secara sempurna.
Larutan I2 ditambahkan secara berlebih (pada percobaan ditambahkan sebanyak 10 ml), kemudian kelebihan I2 ini dititrasi kembali dengan Na2S2O3 0,088 N menggunakan indikator kanji (amilum) untuk meningkatkan kepekaan titik akhir titrasi. Titrasi iodometri harus dilakukan dengan cepat dan digojog kuat untuk untuk meminimalisasi terjadinya oksidasi iodide oleh udara bebas. Penggojogan yang cepat menimbulkan gerakan molekul yang cepat sehingga frekuensi molekul bertabrakan makin banyak dan reaksi berlangsung lebih cepat.
kanji-iodium, dan titik ekivalen ditandai dengan penambahan 1 tetes larutan Na2S2O3 tepat menghilangkan warna biru (larutan menjadi bening). Penyusun utama kanji adalah amilosa dan amilopektin, amilosa dengan iodium membentuk warna biru sedangkan amilopektin dengan iodium membentuk warna merah.
Untuk blangko pada percobaan ini, digunakan larutan yang dibuat dengan mencampurkan 5,0 larutan sampel ampisilin, 5,0 ml dapar pH 4,5; 10,0 ml iodium 0,1 N kemudian didiamkan selama 20 menit terlindung cahaya, lalu dititrasi dengan Na2S2O3 dengan indikator kanji. Pada larutan blangko tidak ditambahkan NaOH sehingga tidak terjadi hidrolisa pada ampisilin.
Reaksi yang terjadi pada ampisilin lengkapnya adalah sebagai berikut :
H
diperlukan untuk mencapai titik ekivalen pada blangko adalah sebesar 9,5 ml; 9,6 ml; dan 9,6 ml. Kemudian dicari kadar ampicillin dengan rumus:
Kadar =
(Volume Na2S2O3blanko−Volume Na2S2O3sampel). N Na2S2O3. BE
mg sampel . bobot rata−rata tablet
Dari perhitungan, diperoleh kadar ampicillin sebesar 168,999 mg dengan rentang kadar 162,713 ≤ x ≤ 175,285. SD yang diperoleh sebesar 2,532, Sedangkan CV (koefisien variasi) yang diperoleh sebesar 0,015 % (CV < 5 %). CV yang kecil menunjukkan kecilnya kesalahan acak yang berarti hasil presisi. Percobaan dapat dikatakan presisi mengindikasikan bahwa pada percobaan, nilai kesalahan acak kecil. Kesalahan acak adalah kesalahan yang nilainya tidak dapat diramalkan dan tidak ada aturan yang mengaturnya serta nilanya berfluktuasi. Kesalahan acak merupakan jenis kesalahan yang selalu terjadi dalam analisis.
Hasil kadar yang diperoleh (168,999 mg) lebih kecil daripada kadar yang tertera dalam label 500 mg. Jadi dapat disimpulkan bahwa metode iodometri kurang selektif untuk penentuan kadar ampicillin dalam sediaan kaplet.
VII. KESIMPULAN
1. Penetapan kadar kaplet ampisilin dapat dilakukan melalui metode titrasi iodometri.
2. Pemilihan metode iodometri ini mengacu pada literatur yaitu Farmakope Indonesia edisi IV. Metode ini merupakan metode yang sederhana dan mudah. Selain itu bahan-bahan yang dibutuhkan juga murah.
3. Kadar yang diperoleh dari penetapan secara iodometri adalah 168,999 mg. 4. Kadar yang tertera dalam etiket sediaan adalah 500 mg.
5. Hasil analisis tidak sesuai dengan kadar yang tertera dalam etiket, sehingga dapat dikatakan bahwa metode iodometri kurang selektif untuk penentuan kadar ampicillin dalam sediaan kaplet.
VIII. DAFTAR PUSTAKA
Anonim, 1995, Farmakope Indonesia Edisi IV, Depkes RI, Jakarta
Anonim, 2005, United State Pharmacopeia, The USP Convention, Rockville
Bhattacharjee A, Anupurba S, Gaur A, Sen MR. Prevalence of Inducible AmpC -lactamase-Producing Pseudomonas aeruginosa in a Tertiary Care Hospital in Northern India. Indian J Med Microbiol 2008; 26(1): 89-90
Brooks GF, Butel JS, Morse SA., 2004, Jawetz, Melnick & Adelberg’s Medical Microbiology, 23rd Ed, Mc Graw Hill, Boston
Jerome, I. et al., 1961, Pharmaceutical Analysis, Interscience Publishers, USA
Nash, R.A, 1988, Pharmaceutical Suspensions, Di dalam: Lieberman H.A., Rieger,M..M, dan Banker, G.S. (eds.), Pharmaceutical Dosage Forms: Disperse Systems, Vol 1, Marcel Dekker, Inc, New York
Ofner III, C.M., Schnaare, R.L., dan Schwartz, J.B, 1989, Pharmaceutical Suspensions, Di dalam: Lieberman H.A., Rieger,M..M, dan Banker, G.S. (eds.), Pharmaceutical Dosage Forms: Disperse Systems. Vol 2, Marcel Dekker, Inc, New York
Pratiwi, Silvia J., 2004, Buku Ajar Mikrobiologi Farmasi, Fakultas Farmasi UGM, Yogyakarta
Rohman, Abdul dkk., 2012, Analisis Makanan dan Lingkungan Secara Fisika-Kimia, Pustaka Pelajar, Yogyakarta
Roth, Hermann J. dan Gottfried Blaschke, 1998, Analisis Farmasi, Gadjah Mada University Press, Yogyakarta
Siswandono, 2000, Kimia Medisinal, Airlangga University Press, Surabaya Sudjadi, 1979, Analisa Obat dan Makanan I, Fakultas Farmasi UGM, Yogyakarta