PENGARUH TINGGI PENYERONGAN BATANG BAWAH DAN ZAT PENGATUR TUMBUH BENZILAMINOPURINE (BAP )
TERHADAP PERTUMBUHAN TUNAS OKULASI KARET (HEVEA BRASILIENSIS MUELL ARG.)
PADA PEMBIBITAN POLIBAG
T E S I S
Oleh
BAYU PRATOMO 117001011/MAET
PROGRAM MAGISTER AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
2016
PENGARUH TINGGI PENYERONGAN BATANG BAWAH DAN ZAT PENGATUR TUMBUH BENZILAMINOPURINE (BAP)
TERHADAP PERTUMBUHAN TUNAS OKULASI KARET (Hevea brasiliensis Muell Arg.) PADA PEMBIBITAN POLIBAG
T E S I S
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Magister Dalam Program Magister Agroekoteknologi Pada Fakultas Pertanian
Universitas Sumatera Utara
Oleh
BAYU PRATOMO 117001011/MAET
PROGRAM MAGISTER AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
2016
Judul Tesis : PENGARUH TINGGI PENYERONGAN BATANG BAWAH DAN ZAT PENGATUR
TUMBUH BENZILAMINOPURINE (BAP)
TERHADAP PERTUMBUHAN TUNAS OKULASI KARET (Hevea brasiliensis Muell Arg.) PADA PEMBIBITAN POLIBAG
Nama Mahasiswa : Bayu Pratomo N I M : 117001011
Program Studi : Magister Agroekoteknologi
Menyetujui, Komisi Pembimbing
(Dr. Ir. Chairani Hanum, MP) (Dr. Ir. Lollie Agustina P. Putri, M.Si) Ketua Anggota
Ketua Program Studi, Dekan,
(Prof. Dr. Ir. Abdul Rauf, MP) (Prof. Dr. Ir. Darma Bakti, MS)
Tanggal lulus : 23 Desember 2015
Telah diuji pada
Tanggal : 23 Desember 2015
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Chairani Hanum, MP
Anggota : 1. Dr. Ir. Lollie Agustina P. Putri, M.Si 2. Prof. Dr. Ir. Rosmayati Tanjung, MS 3. Prof. Dr. Ir. T. Chairunnisa B., M.Sc 4. Dr. Diana Sofia Hanafiah, SP., MP
PERNYATAAN
JUDUL TESIS
“PENGARUH TINGGI PENYERONGAN BATANG BAWAH DAN ZAT PENGATUR TUMBUH BENZILAMINOPURINE (BAP)
TERHADAP PERTUMBUHAN TUNAS OKULASI KARET (Hevea brasiliensis Muell Arg.) PADA PEMBIBITAN POLIBAG”
Dengan ini penulis menyatakan bahwa Tesis ini disusun sebagai syarat untuk memperoleh gelar Magister Pertanian pada Program Magister Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara adalah benar merupakan hasil karya penulis sendiri.
Adapun pengutipan-pengutipan yang penulis lakukan pada bagian-bagian tertentu dari hasil karya orang lain dalam penulisan Tesis ini, telah penulis cantumkan sumbernya secara jelas sesuai dengan norma, kaidah, dan etika penulisan ilmiah.
Apabila di kemudian hari ternyata ditemukan seluruh atau sebagian Tesisi ini bukan hasil karya penulis sendiri atau adanya plagiat dalam bagian-bagian tertentu, penulis bersedia menerima sanksi pencabutan gelar akademik yang penulis sandang dan sanksi-sanksi lainnya sesuai dengan peraturan perundangan yang berlaku.
Medan, April 2016 Penulis,
Bayu Pratomo
ABSTRAK
Bayu Pratomo, Pengaruh Tinggi Penyerongan Batang Bawah dan Zat Pengatur Tumbuh Benzilaminopurine (BAP) terhadap Pertumbuhan Tunas Okulasi Karet (Hevea brasiliensis, Muell Arg.) pada Pembibitan Polibeg. Dibimbing oleh Dr.Ir.Chairani Hanum, MP dan Dr.Ir.Lollie Agustina P. Putri, M.Si.
Pada okulasi bibit muda yaitu tingginya kematian tanaman setelah tahapan penyerongan cukup tinggi.Penelitian ini menggunakan Rancangan Acak Kelompok (RAK) Faktorial dengan dua faktor dan tiga ulangan. Penyerongan batang bawah (10, 20 dan 30 cm) dan konsentrasi BAP (15, 30, 45 dan 60 mg / 200 g Lanolin). Hasil penelitian waktu muncul tunas okulasi, tinggi tunas okulasi, diameter tunas okulasi, jumlah tangkai daun, kadar klorofil a dan b, jumlah tunas liar dan jumlah okulasi hidup berpengaruh nyata terhadap interaksi perlakuan penyerongan dan BAP. Hasil penelitian menunjukkan bahwa penyerongan batang bawah 30 cm dan pemberian BAP 60 g / 200 g Lanolin adalah perlakuan terbaik untuk tinggi tunas (410,67 mm) dan persentase okulasi hidup (66,67%).
Kata kunci : tunas okulasi, penyerongan batang bawah, benzilaminopurine (BAP)
ABSTRACT
Bayu Pratomo, The Effect of Rootstock Stumped Height and The Growth Regulator Benzilaminopurine (BAP) on Growth of The Rubber Budding Shoots (Hevea brasiliensis Muell Arg.) in Polybag Nursery. Supervised by Dr.
Ir.Chairani Hanum, MP and Dr. Ir. Lollie Agustina P. Putri, M.Si.
At young budding of seedling, the number of death plants after stumping is quite high. This research used Factorial Radomized Complete Block Design (RCBD) with two factors and three replications. The height of rootstock stumped (10, 20 and 30 cm) and the concentration of BAP (15, 30, 45 and 60 mg / 200 g Lanolin). Results of the researchshowed the time of bud emergence, height of budding shoots, diameter budding shoots, the number of the petiole, the levels of chlorophyll a and b, the number of wild shoots, and the number of lifebudding shoots significantly affect the interaction of stumping and BAP. The results showed that rootstock stumped 30 cm and BAP 60 g / 200 g Lanolin is the best treatment for height of budding shoots (410.67 mm) and the percentage of life budding shoots (66.67%).
Keywords: budding shoot, rootstock stumped , benzilaminopurine (BAP)
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 27 Januari 1988. Ayahanda bernama Ir. H. Rajikan dan Ibunda Dra. Hj. Sri Hayati. Penulis merupakan anak pertama dari tiga bersaudara.
Penulis lulus Sekolah Dasar pada SD Negeri 2 Padangsidimpuan tahun 2000, lulus Sekolah Menengah Pertama pada SMP Negeri 5 Padangsidimpuan tahun 2003, lulus Sekolah Menengah Atas pada SMA Negeri 1 Matauli Pandan, lulus Sarjana DIV pada program studi Budidaya Perkebunan dari Sekolah Tinggi Ilmu Pertanian Agrobisnis Perkebunan tahun 2010.
Penulis mengikuti pendidikan Program Magister Pertanian pada Fakultas Pertanian Agroekoteknologi Univ ersitas Sumatera Utara sejak tahun 2011.
Pada tahun 2010-2012, penulis bekerja sebagai staff dan asisten dosen pada Sekolah Tinggi Ilmu Pertanian Agrobisnis Perkebunan. Mulai Juli 2012 menjadi pengelola di Program Studi Agroteknologi pada Fakultas Agro Teknologi Universitas Prima Indonesia sampai dengan sekarang.
KATA PENGANTAR
Penulis mengucapkan puji dan syukur kehadirat Allah SWT yang telah memberikan berkah-Nya kepada penulis sehingga penulis dapat menyelesaikan penulisan tesis ini.
Selama melakukan penelitian dan penulisan tesis ini, penulis banyak memperoleh bantuan moril dan materil dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis menyampaikan ucapan terima kasih yang tulus kepada : 1. Bapak Prof. Dr. Runtung Sitepu, SH., M. Hum., selaku Rektor Universitas
Sumatera Utara.
2. Bapak Prof. Dr. Ir. Darma Bakti, MS., selaku Dekan Fakultas Pertanian Universitas Sumatera Utara.
3. Bapak Prof. Dr. Ir. Abdul Rauf, MP., selaku Ketua Program Studi Magister Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara.
4. Ibu Dr. Ir. Chairani Hanum, MP., selaku Ketua Komisi Pembimbing yang telah membimbing dan mengarahkan penulis dalam menyelesaikan penulisan tesis ini.
5. Ibu Dr. Ir. Lollie Agustina P. Putri, M.Si., selaku Anggota Komisi Pembimbing yang telah membimbing dan mengarahkan penulis dalam menyelesaikan penulisan tesis ini.
6. Ibu Prof. Dr. Ir. Rosmayati Tanjung, MS., Prof. Dr. Ir. T. Chairunnisa B., M.Sc.,dan Ibu Dr. Diana Sofia Hanafiah, SP., MP., selaku Komisi Pembanding/Penguji atas saran dan kritik yang diberikan terhadap penulisan tesis ini.
Penulis menyadari tesis ini masih banyak memiliki kekurangan dan jauh dari sempurna. Namun harapan penulis semoga tesis ini bermanfaat kepada seluruh pembaca. Semoga kiranya Tuhan Yang Maha Esa memberkati kita semua. Amin.
Medan, April 2016 Penulis,
Bayu Pratomo
DAFTAR TABEL
No. Judul Halaman
1. Waktu muncul tunas okulasi dengan perlakuan tinggi
penyerongandan konsentrasi BAP ... 28
2. Tinggi tunas okulasi karet dengan perlakuan penyerongan dan konsentrasi bap pada beberapa umur pengamatan ... 30
3. Diameter tunas okulasi dengan perlakuan penyerongan dan BAP ... 33
4. Jumlah tangkai daun dengan perlakuan penyerongan dan BAP 34 5. Kadar klorofil a dengan perlakuan penyerongan dan BAP (mg/L) ... 35
6. Kadar klorofil b dengan perlakuan penyerongan dan BAP (mg/L) ... 36
7. Bobot kering total dengan perlakuan penyerongan dan BAP (g) ... 37
8. Bobot kering tunas dengan perlakuan penyerongan dan BAP (g) ... 38
9. Serapan N tunas dengan perlakuan penyerongan dan BAP (mg) ... 39
10. Serapan P tunas dengan perlakuan penyerongan dan BAP (mg) ... 40
11. Jumlah tunas liar dengan perlakuan penyerongan dan BAP... 41
12. Jumlah okulasi hidup dengan perlakuan penyerongan dan BAP... 43
13. Persentase tunas okulasi hidup ... 43
DAFTAR GAMBAR
No. Judul Halaman
1. Grafik pertambahan tinggi tunas okulasi per pengamatan ... 31
DAFTAR LAMPIRAN
No. Judul Halaman
1. Data waktu muncul tunas okulasi (hari) ... 48 2. Data waktu muncul tunas okulasi (hari) dengan menggunakan
transformasi (√x+0,5) ... 48 3. Daftar sidik ragam waktu muncul tunas ... 49 4. Data tinggi tunas okulasi (mm) pada 85 hari setelah perlakuan
(hsp) ... 49 5. Data tinggi tunas okulasi (mm) pada 85 hari setelah perlakuan
(hsp) dengan menggunakan transformasi (√x+0,5) ... 50 6. Daftar sidik ragam tinggi tunas okulasi pada 85 hari setelah
perlakuan (hsp)... 50 7. Data tinggi tunas okulasi (mm) pada 99 hari setelah perlakuan
(hsp) ... 51 8. Data tinggi tunas okulasi (mm) pada 99 hari setelah perlakuan
(hsp) dengan menggunakan transformasi (√x+0,5) ... 51 9. Daftar sidik ragam tinggi tunas okulasipada 99 hari setelah
perlakuan(hsp)... 52 10. Data tinggi tunas okulasi (mm) pada 113 hari setelah perlakuan
(hsp) ... 52 11. Data tinggi tunas okulasi (mm) pada 113 hari setelah perlakuan (hsp) dengan menggunakan transformasi (√x+0,5) ... 53 12. Daftar Sidik Ragam tinggi tunas okulasi (mm) pada 113 hari
setelah perlakuan (hsp) ... 53 13. Data tinggi tunas okulasi (mm) pada 127 hari setelah perlakuan (hsp) ... 54 14. Data tinggi tunas okulasi (mm) pada 127 hari setelah perlakuan
(hsp) dengan menggunakan Transformasi (√x+0,5) ... 54 15. Daftar sidik ragam tinggi tunas okulasi (mm) pada 127 hari
setelah perlakuan (hsp) ... 55 16. Data diameter tunas okulasi (mm) ... 55 17. Data diameter tunas okulasi (mm) dengan menggunakan
transformasi (√x+0,5) ... 56 18. Daftar sidik ragam diameter tunas okulasi ... 56 19. Data jumlah tangkai daun ... 57 20. Data jumlah tangkai daun dengan menggunakan transformasi
(√x+0,5) ... 57 21. Daftar sidik ragam jumlah tangkai daun ... 58 22. Data kadar klorofil a (mg/L) ... 58 23. Data kadar klorofil a (mg/l) dengan menggunakan transformasi
(√x+0,5) ... 59 24. Daftar sidik ragam kadar klorofil a ... 59 25. Data kadar klorofil b (mg/l) ... 60 26. Data kadar klorofil b dengan menggunakan transformasi
(√x+0,5) ... 60 27. Daftar sidik ragam klorofil b ... 61 28. Data bobot kering total (g) ... 61
29. Data bobot kering total (g) dengan menggunakan transformasi
(√x+0,5) ... 62
30. Daftar sidik ragam bobot kering total ... 62
31. Data bobot kering tunas (g) ... 63
32. Data bobot kering tunas (g) dengan menggunakan transformasi (√x+0,5) ... 63
33. Daftar sidik ragam bobot kering tunas ... 64
34. Data serapan N tunas (mg/tanaman) ... 64
35. Data serapan N tunas (mg/tanaman) dengan menggunakan transformasi (√x+0,5) ... 65
36. Daftar sidik ragam serapan N tunas ... 65
37. Data serapan P tunas (mg/tanaman) ... 66
38. Data serapan P tunas (mg/tanaman) dengan menggunakan transformasi (√x+0,5) ... 66
39. Daftar sidik ragam serapan P tunas ... 67
40. Data jumlah tunas liar ... 67
41. Data transformasi tunas liar dengan menggunakan transformasi (√x+0,5) ... 68
42. Daftar sidik ragam tunas liar ... 68
43. Data okulasi hidup (tanaman) ... 69
44. Data okulasi hidup (tanaman) dengan menggunakan transformasi (√x+0,5) ... 69
45. Daftar sidik ragam okulasi hidup ... 70
46. Batang bawah bibit karet RRIC 100 ... 70
47. Sumber mata entres okulasi PB 260 ... 70
48. Sketsa Plot di Lapangan ... 71
49. Sketsa penyerongan ... 71
50. Areal pelaksanaan penelitian ... 72
51. Mata tunas yang sudah muncul/pecah ... 72
52. Tunas okulasi yang telah tumbuh ... 73
53. Tinggi tunas okulasi ... 73
54. Tunas liar yang tumbuh ... 74
55. Bibit dengan pertumbuhan tunas okulasi terbaik ... 74
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KARA PENGANTAR ... iv
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
DAFTAR ISI ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Rumusan Masalah ... 4
Tujuan Penelitian ... 5
Hipotesis ... 5
Manfaat Penelitian ... 5
Kegunaan Penelitian ... 6
TINJAUAN PUSTAKA ... 7
Teknik Okulasi ... 7
Stum Mata Tidur ... 8
Okulasi Tanaman Muda di Polibeg ... 9
Penyerongan dan Dominansi Apikal ... 13
Sitokinin ... 17
METODE PENELITIAN ... 19
Tempat dan Waktu Penelitian ... 19
Bahan dan Alat ... 19
Rancangan Penelitian ... 20
Pelaksanaan Penelitian ... 21
Parameter Penelitian ... 23
HASIL DAN PEMBAHASAN ... 28
Waktu Muncul Tunas Okulasi ... 28
Tinggi Tunas Okulasi ... 30
Diameter Tunas Okulasi ... 32
Jumlah Tangkai Daun ... 34
Kadar Klorofil a ... 35
Kadar Klorofil b ... 36
Bobot Kering Total ... 37
Bobot Kering Tunas ... 38
Serapan N Tunas ... 39
Serapan P Tunas ... 39
Tunas Liar ... 40
Okulasi Hidup ... 42
KESIMPULAN DAN SARAN ... 44
Kesimpulan ... 44
Saran ... 44
DAFTAR PUSTAKA ... 45
LAMPIRAN ... 48
PENDAHULUAN Latar Belakang
Penyiapan bahan tanam karet berupa bibit yang baik akan menghasilkan pertanaman yang tumbuh baik serta memberikan produksi tinggi secara berkesinambungan. Bahan tanam karet untuk perkebunan dibuat dengan cara okulasi batang bawah dengan entres terpilih. Okulasi bertujuan untuk menyatukan sifat-sifat baik yang dimiliki oleh batang bawah (rootstock) dengan batang atas (scion) yang ditempelkan kepadanya, yang diharapkan dari batang bawah adalah sifat perakaran yang baik, dari batang atas adalah produksi lateks yang baik (Indraty, 2010).
Jenis klon karet unggul yang dianjurkan di daerah Sumatera adalah PB 260 dan RRIC 100. Klon PB 260 merupakan klon penghasil lateks, pertumbuhan jagur, resisten terhadap Corynospora, Colletotricum dan Oidium, produksi lateks 1,5 – 2,5 ton/ha/tahun (Balitbang Pertanian, 2010). Entres klon PB 260 lebih respon terhadap batang bawah dari klon apa saja (Marchino et al. 2010)
Penggunaan bahan tanam klon dibandingkan dengan bibit semaian, sangat menguntungkan karena produktivitas tanaman lebih tinggi, masa tanaman belum menghasilkan lebih cepat, tanaman lebih seragam sehingga produksi pada tahun sadap pertama lebih tinggi serta memiliki sifat sekunder yang diinginkan seperti relatif tahan terhadap penyakit tertentu, batang tegap, volume kayu per pohon tinggi (Sagala, 2009).
Bibit okulasi karet yang dianjurkan selama ini dan telah dilaksanakan dalam praktek adalah stum okulasi mata tidur, stum tinggi dan bibit okulasi hijau.
Siagian (2006) menyatakan bahwa bahan tanam yang diproduksi melalui
pembibitan polibag diharapkan dapat tumbuh lebih jagur ketika telah berada di lapangan. Hal ini karena perakarannya lebih utuh dan tidak diganggu dengan pemotongan sebagaimana pada stum okulasi mata tidur.
Pertumbuhan ujung batang sering mendominasi pertumbuhan bagian lain sehingga pembentukan cabang lateral dihambat. Pada pembibitan batang bawah tanaman karet, selama bagian ujung tanaman masih ada dominansi tersebut terus terjadi. Fenomena ini disebut sebagai dominansi apikal. Pada sebagian besar tanaman, apabila pertumbuhan batang sudah cukup, secara alami cabang lateral akan tumbuh pada nodus bagian bawah yang cukup jauh dari ujung batang, hal ini disebabkan karena semakin jauh dari ujung batang, pengaruh dominansi apikal semakin berkurang (Darmanti et al. 2008)
Dominansi apikal dipengaruhi oleh keseimbangan hormon. Sintesis auksin terjadi pada bagian tanaman yang sedang mengalami pertumbuhan atau pada bagian meristematis, terutama pada ujung batang. Auksin yang disintesis pada ujung batang ini ditransport secara basipetal ke bagian batang yang lebih bawah.
Hal ini menyebabkan terakumulasinya auksin pada ketiak daun di bawah yang berakibat inisiasi pembentukan tunas lateral pada ketiak daun terhambat atau terjadi dormansi tunas lateral (Darmanti et al. 2008). Tujuan penyerongan ialah untuk mematahkan sifat dominansi apikal tersebut, sehingga tunas okulasi yang akan tumbuh dari mata entres dapat lebih cepat tumbuh (Siagian et al. 2006).
Pada okulasi bibit muda yaitu tingginya kematian tanaman setelah tahapan penyerongan yaitu berkisar 15% sampai 40% (Siagian dan Sunarwidi, 1987).
Penyerongan membentuk sudut 450 berlawanan dengan arah mata okulasi. Tunas akan tumbuh lebih jagur pada tanaman yang diserong lebih tinggi karena
ketersediaan cadangan makanan lebih banyak pada batang bawah yang diserong lebih tinggi. Untuk menumbuhkan tunas okulasi sampai stadia dua payung daun, energi dipasok dari batang bawah (Siagian et al. 2006).
Secara alamiah, selain keberadaan hormon auksin yang disintesis di ujung tanaman, disintesis juga hormon pertumbuhan lainnya oleh ujung-ujung perakaran yaitu sitokinin. Sitokinin adalah suatu kelas hormon tumbuhan yang saling berhubungan dengan hormon lain dan menghambat penuaan dan bertindak bersama-sama dengan auksin untuk merangsang pembelahan sel, mempengaruhi jalur differensiasi dan mengontrol dominansi apikal (Campbell et al. 2002).
Hormon sitokinin mempunyai peran yang penting pada pembentukan cabang lateral, karena sitokinin yang terdapat pada ujung akar akan ditransport secara akropetal melalui bagian xilem ke bagian atas tanaman. Hal ini lebih jauh dikemukakan oleh Takei et al. (2001), bahwa sitokinin akan merangsang pembelahan sel pada tanaman dan sel-sel yang membelah tersebut akan berkembang menjadi tunas, cabang dan daun.
Jenis sitokinin biasanya digunakan untuk merangsang pertumbuhan dan perkembangan. Yang termasuk ke dalam jenis sitokinin yang sering digunakan adalah benzilaminopurine (BAP) (Sato dan Mori, 2001). Salah satu golongan sitokinin yang aktif adalah BAP. 6-benzilaminopurine (BAP) digunakan karena aktif pada konsentrasi rendah, relatif stabil, dan mudah diserap.
Dengan pelaksanaan penyerongan pada ujung batang bawah tanaman karet sehingga terputusnya sintesis auksin dan penambahan sitokinin eksogen,maka terjadi peningkatan kandungan sitokinin dan meningkatkan jumlah sel yang bersama-sama dengan hasil fotosintat yang meningkat di awal penanaman akan
mempercepat proses pertumbuhan vegetatif tanaman (termasuk pembentukan tunas-tunas baru).
Rumusan Masalah
Pertumbuhan tunas okulasi pada tanaman karet akan terjadi setelah batang bawah tempat menempelnya mata entres dilakukan penyerongan. Tunas okulasi pada pembibitan tanaman karet diharapkan dapat tumbuh jagur setelah dilaksanakannya penyerongan. Pada okulasi bibit muda (3-5 bulan) di dalam polibag keberhasilan tumbuh tunas okulasi diharapkan dapat lebih tinggi. Namun kematian tunas dapat terjadi sebelum dan sesudah terbentuknya payung daun pertama dan juga sering ditemui mata okulasi tidak tumbuh sama sekali. Banyak peneliti berpendapat bahwa hal ini terjadi sehubungan dengan persediaan cadangan makanan di dalam batang yang tidak mencukupi untuk pertumbuhan tunas dari mata okulasi.
Selain daripada itu, diduga bahwa faktor hormon pertumbuhan tanaman sangat berperan. Pertumbuhan tunas tanaman karet ditentukan juga oleh adanya interaksi zat-zat pengatur tumbuh yaitu auksin dan sitokinin. Senyawa ini dapat memobilisasi hara dan asimilat untuk pertumbuhan.
Atas dasar itu, diperlukan suatu penelitian dengan perlakuan tinggi penyerongan batang bawah dan konsentrasi BAP pada pembibitan karet di dalam polibag. Dari penelitian ini diharapkan dapat dijawab permasalahan antara lain :
1. Tinggi penyerongan berpengaruh terhadap keberhasilan dan pertumbuhan tunas okulasi karet.
2. Konsentrasi BAP berpengaruh terhadap keberhasilan okulasi dan pertumbuhan tunas okulasi karet.
3. Interaksi perlakuan tinggi penyerongan dan konsentrasi BAP berpengaruh terhadap keberhasilan okulasi dan pertumbuhan tunas okulasi karet.
Tujuan Penelitian
1. Mengetahui pengaruh tinggi penyerongan batang bawah terhadap keberhasilan dan pertumbuhan tunas okulasi.
2. Mengetahui pengaruh konsentrasi benzilaminopurine (BAP) terhadap keberhasilan okulasi dan pertumbuhan tunas okulasi karet.
3. Mengetahui interaksi perlakuan tinggi penyerongan dan konsentrasi benzilaminopurine (BAP) terhadap keberhasilan okulasi dan pertumbuhan tunas okulasi karet.
Hipotesis
1. Semakin tinggi penyerongan batang bawah, semakin tinggi keberhasilan dan pertumbuhan tunas okulasi karet.
2. Semakin tinggi konsentrasi BAP, semakin tinggi keberhasilan dan pertumbuhan tunas okulasi karet.
3. Ada interaksi perlakuan antara tinggi penyerongan batang bawah dan konsentrasi BAP terhadap keberhasilan dan pertumbuhan tunas okulasi karet.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi referensi dalam pengelolaan pembibitan tanaman karet agar dapat meningkatkan keberhasilan okulasi.
Kegunaan Penelitian
1. Untuk memperoleh tinggi penyerongan dan rekomendasi konsentrasi BAP dalam meningkatkan keberhasilan okulasi karet.
2. Sebagai salah satu syarat untuk menyelesaikan studi di Progam Magister Agoekoteknologi Fakultas Pertanian Universitas Sumatera Utara.
TINJAUAN PUSTAKA Teknik Okulasi
Di Indonesia, pengadaan bibit karet klonal dengan cara okulasi masih merupakan metode perbanyakan terbaik. Hal ini karena tanaman karet yang berasal dari biji, meskipun dari jenis unggul, tidak menjamin keturunannya akan memiliki sifat baik seperti pohon induknya akibat terjadinya segregasi dari hasil persarian sendiri (selfing) dan atau silang luar (outcrossing) dari genotipe heterozigot. Oleh karena itu, keturunan yang berasal dari biji akan memiliki pertumbuhan dan produksi yang bervariasi. Untuk mendapatkan keseragaman dan mempertahankan sifat-sifat baik dari pohon induk, tanaman karet diperbanyak secara vegetatif dengan teknik okulasi (Hadi dan Setiono, 2006).
Tanaman karet hasil okulasi terdiri atas dua bagian, yaitu batang bawah (rootstock) dan batang atas (scion) (Amypalupy, 2010). Klon sebagai batang atas diperoleh melalui proses seleksi dan kemudian diperbanyak secara klonal melalui teknik okulasi. Sementara batang bawah merupakan tanaman dari biji klon tertentu yang dianjurkan sebagai benih untuk batang bawah.
Pada tanaman karet hasil okulasi diketahui adanya proses translokasi substansi tertentu dari batang bawah ke batang atas atau sebaliknya (Toruan et al.
2000). Ada dugaan bahwa substansi juvenilitas yang terdapat pada batang bawah juga ditranslokasikan ke batang atas, sehingga pada derajat tertentu dapat memperbaiki tingkat juvenilitas klon yang dihasilkan. Atas dasar itu, jendela okulasi sebaiknya dibuat sedekat mungkin dengan leher akar, karena jaringan sekitar leher akar diketahui mempunyai tingkat juvenilitas paling tinggi dibanding jaringan yang lebih jauh letaknya (Songquan et al., 1990). Selain itu penggunaan
batang bawah yang lebih muda diduga memberi pengaruh perbaikan juvenilitas yang lebih baik, sehingga teknik sambung dini perlu diteliti lebih lanjut.
Stum Mata Tidur
Bibit stum mata tidur adalah bibit yang diokulasi di lahan persemaian dan dibiarkan tumbuh selama kurang dari dua bulan setelah penyerongan batang atas pada posisi 10 cm di atas mata okulasi. Akar tunggang tunggal lebih bagus dibandingkan dengan akar tunggang bercabang, sehingga petani karet biasanya memotong akar tunggang bercabang yang lebih kecil. Dengan demikian tinggal satu akar tunggang besar yang panjangnya sekitar 40 cm dan akar lateral yang panjangnya 5 cm (Setiawan dan Andoko, 2005).
Bibit dalam polibag adalah bibit okulasi yang ditumbuhkan dalam polibag yang mempunyai satu atau dua payung daun. Bibit polibag dapat dibuat dengan menanam stum mata tidur atau dengan pembibitan batang bawah di polibag.
Kelebihan dalam pembibitan di polibag adalah lebih seragam ketika dipindah ke lapangan, memudahkan penyiraman dan dapat menghemat air ketika penyiraman.
Sangat penting diperhatikan bahwa tunas yang tumbuh bukan dari mata tempelan (tunas liar) harus dibuang dan diperiksa 1 x 2 minggu (Sagala, 2009).
Pada proses okulasi, pencabutan stum, proses pengemasan dan pengiriman merupakan faktor-faktor yang menyebabkan adanya perubahan metabolisme dalam jaringan stum. Perubahan metabolisme tersebut menyebabkan perubahan dalam viabilitas stum untuk tumbuh dan berkembang kembali. Pencabutan stum dari tanah di pembibitan lapangan mengakibatkan pelukaan pada sebagian besar akar, terutama pada stum tanpa akar lateral (Sutanto, 2008). Pencabutan stum dari tanah di pembibitan mengakibatkan pelukaan besar di bagian akar. Pelukaan ini
meningkatkan efektifitas sintesa etilen sebagai respon pertahanan, yang juga berguna dalam memecah dormansi tunas, serta menginduksi pembentukan akar (Davies, 2004)
Pada stum mata tidur, pembentukan akar pertama kali didorong oleh cadangan makanan yang ada di batang bawah. Setelah terbentuk, akar akan menyerap air yang ada di dalam tanah, kemudian cadangan makanan yang tersimpan di dalam batang diubah menjadi sumber energi untuk pertumbuhan tunas-tunas baru tersebut. Karena sebelumnya telah tumbuh selama satu tahun di pembibitan batang bawah sehingga memiliki cadangan energi untuk pertumbuhan awal di lapangan. Pertumbuhan tanaman yang diperbanyak melalui stum, setelah bahan tanaman ditanam, substrat yang terdapat di dalam batang seperti karbohidrat, lemak dan protein akan mengalami perombakan secara enzimatik untuk mendukung aktifitas embrio atau tunas pembentuk bakal tanaman.
Kemudian membentuk organ-organ utama tanaman seperti batang, akar dan daun.
Pertumbuhan awal organ-organ ini sangat tergantung pada cadangan makanan (karbohidrat dan unsur-unsur lainnya) serta efisiensi metabolisme. Setelah substrat awal habis digunakan, penyediaan substrat selanjutnya tergantung pada daun dan efisiensi memfiksasi CO2 (Marchino et al. 2010).
Okulasi Tanaman Muda di Polibag
Bahan tanam karet yang digunakan untuk penanaman secara komersial biasanya adalah bahan tanam polibag berpayung daun dua yang diproduksi melalui pembibitan lapangan (menghasilkan SOMT) dan diikuti dengan pembibitan polibag. Bahan tanam polibag berpayung daun dua dapat juga
diproduksi dengan menanam langsung kecambah di polibag, memelihara dan mengokulasinya sampai mencapai stadia dua payung daun.
Penemuan teknik okulasi tanaman muda di polibag telah memberikan alternatif pengadaan bahan tanam karet bagi pekebun. Kalau pada pembibitan lapangan (Siagian, 2006) bibit mulai diokulasi pada umur 7 bulan, pada pembibitan langsung di polibag, batang bawah di polibag sudah dapat diokulasi pada umur yang lebih muda yaitu pada umur 3 sampai dengan 4,5 bulan.
Deswanto (2010) menyatakan bahwa pada saat mata tunas pecah diperlukan energi asimilat dari batang bawah dan ditunjang dengan perkembangan mata tunas yang telah siap untuk muncul. Umur batang bawah yang sama dan dari genetik yang sama, memperlihatkan pertumbuhan yang sama. Hal ini ditunjukkan oleh muncul tunas di lapangan hampir pada waktu bersamaan.
Pada tanaman karet, daun tumbuh secara bertahap dan setiap pertumbuhannya meninggalkan bekas tangkai daun dan membentuk nodus. Setiap karangan daun disebut payung daun. Payung daun dibentuk sejalan dengan bertambahnya umur tanaman. Pembentukan setiap payung daun memerlukan 2-3 bulan. Pertumbuhan payung daun mengikuti tinggi tanaman. Bila lahan disiapkan dengan baik dan diberi pupuk maka pertumbuhan tanaman akan lebih baik (Indraty, 2010).
Faktor lingkungan seperti kekurangan air dan suhu tinggi, atau perubahan genotif dapat mempengaruhi pertumbuhan dan hasil tanaman bukan hanya sekedar mempengaruhi proses fisiologis dan kondisi tanaman. Jadi untuk mengerti mengapa spesies lain gagal, perlu memahami bagaimana proses fisiologis dipengaruhi berbagai faktor lingkungan (Dalimunthe, 2004).
Pembibitan Batang Bawah di Polibag
Batang bawah untuk tujuan okulasi tanaman muda dipelihara di pembibitan polibag. Ukuran polibag (dalam keadaan terlipat) yang digunakan adalah lebar 18 cm, panjang 38 cm dan tebal 0,1 mm. Polibag diisi dengan tanah subur yang diambil dari lapisan atas yang diayak dan dicampur dengan 30 g pupuk posfat alam per polibag. Berat polibag berisi tanah adalah 4-5 kg. Syarat lokasi untuk pembibitan polibag adalah sebagai berikut: Beberapa syarat penting untuk menjamin keberhasilan pembibitan dengan sistem OMdP, antar lain :
1. Ketersediaan air yang cukup sepanjang masa pembibitan 2. Lahan yang relatif rata
3. Karena menggunakan mata okulasi dari tunas muda maka lokasi kebun entres diharuskan dekat dengan lokasi pembibitan
4. Juru okulasi yang terampil untuk menjamin keberhasilan okulasi, karena umur tanaman masih merah muda serta
5. Disiplin yang ketat di dalam pelaksanaannya
Areal untuk pembibitan polibag dibersihkan dan diratakan terlebih dahulu.
Polibag yang telah berisi tanah disusun secara barisan ganda. Antara satu baris polibag ganda dengan barisan ganda yang lain diberi jarak 1 meter untuk jalan pemeliharaan. Arah barisan adalah Timur-Barat. Jika diameter setiap polibag berisi tanah adalah 15 cm, maka untuk 2 polibag membutuhkan areal yang lebarnya 30 cm. Panjang barisan setiap dua polibag yang dibuat adalah 1 m, dikosongkan 1 m dan kemudian dibuat barisan polibag berikutnya sepanjang 1 m lagi. Hal ini berarti bahwa setiap barisan ganda dapat menampung sebanyak (1900/15) x 2 = 253 polibag.
Tiap 1 hektar bibitan (tidak termasuk jalan angkutan) berisi (10000/130) x 5 = 385 barisan ganda. Berarti tiap hektar bibitan dapat menampung sebanyak 385 x 253 = 97.405 polibag. Sebelum barisan polibag disusun, diberi alat plastik tranparant berukuran lebar 40 cm, panjang sesuai kebutuhan dan tebal 0,25 cm.
gunanya untuk mencegah tembusnya akar selama pembibitan, sehingga pada waktu pemindahan dan penanaman dilapangan tidak mengalami stagnasi.
Penanaman Kecambah
Tiap polibag ditanam dua batang kecambah yang memenuhi persyaratan.
Tujuan menanam dua kecambah per polibag adalah untuk mendapatkan bahan tanam yang terbaik dan untuk menjamin tersedianya bahan penyisip. Pada umur 3-4 minggu setelah tanam, dipilih satu kecambah yang paling jagur untuk dipelihara selanjutnya. Dengan penyiraman yang rutin selama pembibitan polibag, pemilihan kecambah sesuai anjuran dan pengendalian hama dan penyakit yang tepat akan menghasilkan persentase keberhasilan hidup tanaman di polibag cukup tinggi.
Pemeliharaan
Pemeliharaan tanaman selama di pembibitan polibag adalah penyiraman, pemupukan, pencegahan/pemberantasan penyakit, pengendalian gulma di polibag maupun di areal pembibitan. Salah satu kunci keberhasilan dalam pembangunan pembibitan polibag untuk tujuan okulasi tanaman muda ialah tersedianya air dalam kolom tanah polibag selama periode pembibitan. Untuk memenuhi kebutuhan tersebut, salah satu cara yang dilakukan adalah dengan membangun sistem pengairan. Dari lokasi sumber air, air dialirkan melalui pipa besar dengan menggunakan mesin pompa pertama dan selanjutnya dengan menggunakan mesin
pompa kedua air dinaikkan ke bak penampungan. Dari bak penampungan, air dialirkan keareal pembibitan menggunakan pipa yang lebih kecil ukurannya. Pada areal pembibitan dibuat keran-keran untuk disambungkan dengan selang yang digunakan untuk penyiraman.
Sebelum membangun pembibitan polibag, kalkulasi kebutuhan air perlu dilakukan. Jika per polibag misalnya diperlukan 0,5 liter air per hari, maka dalam pembibitan polibag skala besar, misalnya 100.000 bibit polibag, diperlukan air sebanyak 50.000 liter/hari. Untuk menjamin tersedianya air di sepanjang kolom tanah polibag, pengawasan yang ketat dan intensif harus dilakukan.
Pada umur 1 , 2 dan 3 bulan diberikan pupuk majemuk NPKMg 12:12:7:2+
unsur mikro dengan dosis masing-masing 4g, 6g dan 6g per polibag. Pemupukan dilakukan dengan cara tugal dan selanjutnya lubang ditutup dengan sedikit tanah.
Pada umur 1,2 dan 3 bulan setelah okulasi tanaman dipupuk dengan menggunakan pupuk daun. Pengendalian gulma di areal pembibitan maupun polibag dilakukan secara manual dengan rotasi dua minggu.
Penyakit yang umum menyerang tanaman di pembibitan polibag adalah penyakit gugur daun Colletotrichum, Oidium, dan Corynespora. Pengendalian dan pemberantasan penyakit-penyakit tersebut sama seperti yang diuraikan pada pembibitan lapangan.
Penyerongan dan Dominansi Apikal
Pada beberapa tanaman, pertumbuhan ujung batang sering mendominasi pertumbuhan bagian lain sehingga pembentukan cabang lateral dihambat.
Fenomena ini disebut sebagai dominansi apikal. Pada sebagian besar tanaman, apabila pertumbuhan batang sudah cukup, secara alami cabang lateral akan
tumbuh pada nodus bagian bawah yang cukup jauh dari ujung batang, hal ini disebabkan karena semakin jauh dari ujung batang pengaruh dominansi apikal semakin berkurang. Berdasarkan kekuatan dominansi apikal, tanaman dibedakan menjadi dua yaitu dominansi apikal yang kuat seperti pada tanaman Kalanchoedan Bryophyllum dan dominansi apikal yang lemah seprti pada Solanum tuberosum L. dan Solanum lycopersicu. Dominansi apikal dan pembentukan cabang lateral ini dipengaruhi oleh keseimbangan konsentrasi hormon (Khrishnamoorthy, 1981; Taiz dan Zeiger, 1998; dan Hopkins, 1995).
Sebagaimana defenisi dan tujuan penyerongan yang disampaikan sebelumnya, defoliasi sebagai salah satu teknik budidaya yang dapat dilakukan untuk memperbanyak cabang, agar diperoleh bahan untuk stek dalam jumlah yang maksimal. Defoliasi adalah pemangkasan ujung batang (Hopkins, 1995). Prinsip dari perlakuan tersebut adalah untuk mengatur keseimbangan hormon antara lain sitokinin dengan auksin pada ketiak daun di bawah ujung batang (Taiz dan Zeiger, 1998; dan Hopkins, 1995).
Untuk menumbuhkan tunas okulasi, 1-2 hari setelah pembukaan pembalut, batang dipotong/diserong pada ketinggian 30-35 cm dari permukaan tanah.
Mempertinggi titik penyerongan adalah salah satu cara untuk mengatasi masalah yang sering ditemui pada okulasi muda, yaitu tingginya kematian tanaman setelah penyerongan. Tunas akan tumbuh lebih jagur pada tanaman yang diserong lebih tinggi karena ketersediaan cadangan makanan lebih banyak pada batang bawah yang diserong lebih tinggi. Untuk menumbuhkan tunas okulasi sampai dengan stadia satu payung daun, energi dipasok dari batang bawah. Sampai dengan stadia
tersebut, biasanya akar tanaman (terutama jika berasal dari stum mata tidur) belum berkembang sempurna (Siagian, 2006).
Setelah dilakukan pemangkasan/penyerongan pada ujung batang, suplai auksin dari tunas apikal tidak terjadi lagi, sehingga kadar auksin dalam ruas dibawahnya berkurang. Sebagai akibatnya terjadi ekpresi IPT (isopentenil transferase) pada tanaman. IPT merupakan enzim yang bertanggung jawab sebagai biokatalisator pada biosintesis sitokinin. Sitokinin yang dihasilkan dari ruas tanaman memasuki tunas lateral dan menyebabkan pertumbuhan tunas lateral (Sato dan Mori, 2001). Peningkatan kadar sitokinin dalam tunas lateral dapat mendorong penyempurnaan hubungan berkas pembuluh antara tunas lateral dan batang tumbuhan sehingga dapat dikatakan bahwa sitokinin menyebabkan terjadinya diferensiasi jaringan pengangkut tunas lateral (Heddy, 1990).
Terbentuknya jaringan pengangkut tersebut memungkinkan terjadinya transport nutrien dari batang ke tunas lateral, sehingga tunas lateral dapat tumbuh.
Pertumbuhan memanjang cabang lateral dipengaruhi oleh auksin yang dihasilkan oleh ujung apikal tunas lateral sendiri dan sitokinin yang ditransport dari akar.
Siokinin akan merangsang pembelahan sel melalui peningkatan laju sintesis protein (Lakitan, 2011), dengan adanya pembelahan sel maka jumlah sel akan menjadi banyakdan dengan adanya auksin sel dapat membesar dan memanjang.
Auksin dapat menyebabkan pemanjangan sel dengan cara mempengaruhi plastisitas dinding sel. Auksin akan memacu protein yang ada dimembran sel untuk memompa ion H+ ke dinding sel. Ion H+ ini akan mengaktifkan enzim sehingga memutuskan beberapa ikatan silang hidrogen rantai molekul selulosa.
Tumbuhan kemudian memanjang akibat air yang masuk secara osmosis. Setelah
pemanjangan ini, sel terus tumbuh dengan mensintesis kembali material dinding sel dan sitoplasma (Campbell et al. 2002).
Selain adanya jaringan meristem, hormon dan nutrisi juga berpengaruh terhadap pertumbuhan tanaman. Hormon dan nutrisi yang semula berada di bagian apikal dipindahkan ke jaringan meristem yang sedang aktif tumbuh (Lakitan, 2011).
Teori ”Nutrien Diversion” menyatakan bahwa dominansi apikal terjadi karena gerakan nutrien ke atas diarahkan ke tunas apikal bukan ke tunas lateral, hal ini sebagai akibat adanya produksi auksin di apikal tanaman. Daun dan beberapa tunas yang terbebas dari dominansi apikal akan mulai tumbuh dan menghasilkan auksin. Adanya sitokinin akan memacu pembelahan sel dan produksi auksin sehingga terbebas dari dominansi (Darmanti et al. 2008).
Salah satu pekerjaan yang harus dilakukan secara rutin setelah penyerongan batang adalah penunasan. Penunasan dilakukan dengan menggunakan pisau tunas.
Penunasan dimaksudkan untuk mencegah timbulnya persaingan energi yang diperlukan untuk pertumbuhan dari mata okulasi. Pertumbuhan tunas okulasi (Siagian, 2006) akan lebih jagur pada tanaman yang diserong lebih tinggi jika diikuti dengan penunasan terhadap tunas liar secara intensif dan tepat waktu.
Apabila tunas liar tidak segera dibuang, maka pertumbuhan tunas okulasi akan terhambat atau tidak tumbuh sama sekali. Penunasan dilakukan ketika tunas liar panjangnya kurang dari 5 mm. Rotasi penunasan adalah 5 hari sekali.
Sitokinin
Sitokinin merupakan zat pengatur tumbuh tanaman yang merangsang inisiasi mata tunas dan perkembangannya (Hartmann et al. 1997; Harjadi, 2009).
Salisbury dan Ross (1995) menyatakan bahwa fungsi utama sitokinin adalah memacu pembelahan sel (sitokinesis) dan pembentukan organ. Pemacuan sitokinesis merupakan salah satu respon sitokinin yang terpenting, oleh karena itu sitokinin sering dimanfaatkan secara komersial dalam perbanyakan kultur jaringan. Hopkins (1995) menambahkan pemberian sitokinin akan merangsang perkembangan mata tunas aksilar dari dominansi apikal.
Benzilaminopurine (BAP) merupakan sitokinin sintetik pertama yang dibentuk, dengan rumus kimia 6-benzilaminopurine (6-BAP). Bentuk fisik BAP berupa kristal putih dengan kemurnian 99 % dan titik lebur 230-233oC. Fungsi BAP adalah menghambat degradasi klorofil, asam nukleat dan protein, merangsang pengiriman asam amino, garam anorganik dan zat pengatur tumbuh.
Konsentrasi sitokonin yang dibutuhkan untuk merangsang tunas tanaman di lapangan umumnya lebih tinggi daripada konsentrasi sitokinin untuk perbanyakan in vitro. Iwagaki (1997) menyatakan bahwa konsentrasi BAP yang digunakan untuk merangsang tunas Satsuma, jeruk asal Jepang, yaitu 75-300 ppm. Ngamau (2001) dalam penelitiannya mengemukakan bahwa pemberian BAP 150 mg/l dan GA3 250 mg/l, tunggal maupun dikombinasikan dapat merangsang munculnya tunas samping, mempercepat munculnya tunas, dan meningkatkan jumlah serta perkembangan tunas Zantedeschia aethiopica.
Karintus (2011) melakukan pemberian BAP diberikan dengan cara menyemprotkan pada kapas dan ditempelkan pada tunas jendela okulasi, dengan pemberian pada sore hari untuk mengurangi penguapan yang terjadi.
Sitokinin, diproduksi dalam jaringan yang sedang tumbuh aktif, khususnya pada akar, embrio, dan buah. Sitokinin yang diproduksi di dalam akar, akan
sampai ke jaringan yang dituju, dengan bergerak ke bagian atas tumbuhan didalam cairan xylem. Bekerja bersama-sama dengan auksin dan sitokinin menstimulasi pembelahan sel dan mempengaruhi lintasan diferensiasi. Efek sitokinin terhadap pertumbuhan sel di dalam kultur jaringan, memberikan petunjuk tentang bagaimana jenis hormon ini berfungsi di dalam tumbuhan yang lengkap (Dewi, 2008).
Pada perlakuan defoliasi, sintesis auksin ditiadakan sehingga tidak terjadi trasnsport auksin kebawah sehingga konsentrasi auksin di ketiak daun semakin rendah. Dengan turunnya auksin di ketiak daun akan memacu pembentukan hormon sitokinin (Taiz dan Zeiger, 1998). Sato dan Mori (2001) menyatakan bahwa pemacuan sintesis sitokinin oleh turunnya konsentrasi auksin ini tidak secara langsung, tetapi melalui pengaktifan enzim isopentenil transferase yang merupakan katalisator pada pembentukan sitokinin.
Secara prinsip penyerongan dan defoliasi adalah sama, untuk mematahkan dominansi apikal. Jika pada penyerongan diharapkan pertumbuhan tunas okulasi, sedangkan defoliasi bertujuan untuk mendapat jumlah tunas lateral yang maksimal.
METODE PENELITIAN Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Kelurahan Limau Sundai, Kecamatan Binjai Barat, Kota Binjai, Provinsi Sumatera Utara. Secara geogafis Kota Binjai terletak pada posisi 3° 31' 31" - 3° 40' 2" LU dan 98° 27' 3" - 98° 32' 32" BT dan terletak
± 28 m di atas permukaan laut. Pelaksanaan penelitian dari bulan April sampai dengan Agustus 2015.
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini adalah bibit karet okulasi hijau (green budding) berumur 4-5 bulan (Siagian, 2012) dengan batang bawah klon RRIC 100 yang ditanam di polibag dan mata entres okulasi yang berasal dari kebun entres dengan klo PB 260 (berumur 4-5 bulan). Batang bawah dan mata entres berasal dari kebun entres yang diusahakan oleh para petani karet rakyat di Desa Galang Suka. Kebun entres petani karet rakyat ini telah dimurnikan klonnya oleh petugas dari Balai Penelitian Karet Sungei Putih. Zat Pengatur Tumbuh yang digunakan adalah kelompok sitokinin yaitu benzilaminopurine (BAP) dengan menggunakan lanolin sebagai carriernya. Alat yang digunakan dalam penelitian ini adalah cat, gergaji serong, gunting stek, meteran, polibag, penggaris, kuas, wadah, pisau, cangkul, timbangan, oven, kertas koran, kertas nama, jangka sorong.
i : 1,2,3 j : 1,2,3 k : 1,2,3,4,5 Rancangan Penelitian
Gomez dan Gomez (2007) menyatakan model linier yang diasumsikan untuk Rancangan Acak Kelompok (RAK) Faktorial adalah :
Yi j k = μ + βi+ Pj + Bk + (PB)jk+ ԑ i j k
Dimana :
Yi j k = Hasil pengamatan dari faktor P pada taraf ke-j dan faktor B pada taraf
ke-K dalam ulangan ke-i μ = Efek nilai tengah
βi = Efek dari blok pada taraf ke-i Pj = Efek dari faktor P pada taraf ke-j Bk = Efek dari faktor B pada taraf ke-k
(PB)jk = Efek interaksi dari faktor P pada taraf ke-j dan faktor B pada taraf ke-k
ԑ i j k = Efek eror dari faktor P pada taraf ke-j dan faktor B pada taraf
ke-k
dalam ulangan ke-i
Data yang diperoleh diuji secara statistsik dengan uji F dengan perangkat lunak SAS 9.1.3. Jika berbeda nyata, maka akan dilakukan uji lanjut dengan Duncan Multiple Range Test (DMRT) pada taraf nyata 5%.
Faktor I Perlakuan yang diberikan adalah perbedaan tinggi penyerongan dari pertautan okulasi seperti pada lampiran 26 :
P1 : penyerongan dengan tinggi 10 cm dari pertautan okulasi, kemiringan 450 (Sutardi dan Setiono, 1986; Setiawan dan Andoko, 2005)
P2 : penyerongan dengan tinggi 20 cm dari pertautan okulasi, kemiringan 450 (Atmojo et al. 2013)
P3 : penyerongan dengan tinggi 30 cm dari pertautan okulasi, kemiringan 450
(Siagian, 2012)
Faktor II Perlakuan pemberian BAP pada beberapa konsentrasi : B0 : Kontrol
B1 : 15 mg/200 g Lanolin B2 : 30 mg/200 g Lanolin B3 : 45 mg/200 g Lanolin B4 : 60 mg/200 g Lanolin
Kombinasi perlakuan tinggi penyerongan dan BAP adalah 15 dan pengulangan 3 kali, plot percobaan berjumlah 45. Setiap plot terdiri 4 tanaman, sehingga jumlah yang diamati 180 tanaman.
D. Pelaksanaan Penelitian
1. Melakukan pemilihan bibit karet batang bawah klon RRIC 100 di pembibitan dalam polibag yang berumur 4-5 bulan (green buding). Dimana biji langsung ditanam di polibag dan dipelihara (Siagian, 2005 ; Siagian et al. 2005)
2. Pemilihan bibit karet batang bawah ini berdasarkan keseragaman dengan lilit batang +30mm, diameter +10 mm dapat dilihat pada Lampiran 25.
3. Pelaksanaan okulasi, dengan menempelkan mata entres klon PB 260.
4. Pada 3 minggu setelah okulasi (Udayakumara dan Seneviratne, 2005; Sutardi dan Setiono, 1986; Siagian 2012), dilakukan pengecekan terhadap mata okulasi dan okulasi yang berhasil, ditandai dengan mata entres yang tetap hijau setelah plastik pembalut okulasi dibuka.
5. Kemudian bibit karet disusun berdasarkan Rancangan Acak Kelompok, dapat dilihat pada Lampiran 48.
6. Berikutnya pada1 bulan (Udayakumara dan Seneviratne, 2005; Sutardi dan Setiono, 1986; Siagian 2012) setelah okulasi, setiap bibit dilakukan
penyerongan sesuai dengan perlakuan 10 cm (Sutardi dan Setiono, 1986), 20 cm (Lestari et al. 2013) dan 30 cm (Siagian, 2012) dari pertautan okulasi (Lampiran 49). Luka pada penyerongan ditutup dengan pemolesan kolter mencegah penguapan dan menghindarkan dari hama penyakit.
7. Pemberian BAP
BAP diberikan dalam bentuk campuran lanolin. Lanolin dalam wadah sebanyak 200 g diencerkan dengan air yang dihangatkan. Sehingga diperoleh 4 campuran BAP lanolin. Pemberian BAP dilakukan pada saat sore hari setelah penyerongan batang bawah dengan memoleskan pada mata okulasi dengan dosis 1,5 g campuran lanolin BAP, dan ditutup dengan kapas.
8. Pemeliharaan
1. Penyiraman dilakukan setiap hari jika tidak turun hujan yaitu pada pagi dan sore hari.
2. Penyiangan dilakukan dengan mencabut gulma-gulma yang tumbuh di dalam polibag, dilakukan dengan hati-hati agar tidak menggangu tanaman.
9. Pengamatan tanaman
1. Pengamatan pertumbuhan dilakukan setiap 7 hari sejak pemberian penyerongan dan pemberian BAP sampai dengan 3 bulan (masa terbentuknya payung daun di pembibitan polibag).
2. Pengamatan terakhir adalah dengan mendestruksi tanaman yaitu mengambil akar dan tunas tanaman. Tunas diambil dari mata okulasi yang merupakan batang atas.
E. Parameter Penelitian
Pengambilan data dilakukan pada setiap tanaman, tiap satu (1) plot empat (4) tanaman. Parameter pengamatan yang diamati adalah sebagai berikut :
1. Waktu muncul tunas okulasi
Waktu kemunculan tunas okulasi (Lampiran 51 dan 52) dihitung sejak dimulainya perlakuan penyerongan dan pemberian BAP pada bibit okulasi di polibag ditandai dengan tinggi tunas mencapai 0,5cm. Satuan yang digunakan adalah hari.
2. Persentase okulasi hidup
Bibit okulasi yang hidup adalah yang dapat tumbuh sejak dari fase melentis atau pecahnya mata entres/tunas okulasi, sehingga terbentuk payung daun. Persentase bibit okulasi hidup dihitung pada akhir pengamatan yaitu hari ke-127 setelah perlakuan.
3. Tinggi tunas okulasi.
Tinggi tunas diukur dari titik pangkal tumbuhnya tunas okulasi (Lampiran 53) pada pertautan okulasi, sampai ujung tunas okulasi. Pengamatan dan pengambilan data dimulai dari hari ke-29 setelah perlakuan sampai dengan hari ke-127 dan dilakukan setiap 7 hari. Satuan yang digunakan adalah milimeter (mm).
4. Jumlah tunas liar yang tumbuh.
Tunas liar adalah tunas-tunas yang tumbuh selain daripada tunas pada pertautan okulasi. Pada setiap pengamatan, tunas liar (Lampiran 54) yang tumbuh dihitung dan kemudian dibuang. Pengamatan dan pengambilan data dilakukan setiap 7 hari. Data jumlah tunas liar yang dihitung,
dijumlahkan dan dirata-ratakan sampai hari ke-127 setelah perlakuan yaitu pada akhir pengamatan.
5. Jumlah tangkai daun.
Pengambilan data dilakukan pada akhir pengamatan yaitu hari ke 127 setelah perlakuan, dengan menghitung jumlah tangkai daun yang terbentuk pada tunas okulasi yang tumbuh.
6. Diameter
Diameter tunas diukur 1 cm dari pangkal tumbuh tunas okulasi dengan menggunakan jangka sorong. Satuan yang digunakan adalah milimeter (mm). Pengambilan data dilakukan pada pengamatan terakhir yaitu hari ke-127 setelah perlakuan penyerongan dan pemberian BAP.
7. Bobot kering total
Bobot kering total adalah bagian keseluruhan tanaman yang terdiri dari batang hasil okulasi, tangkai daun, daun dan akar, diperoleh setelah tanaman dibongkar dan dibersihkan dari sisa tanah yang melekat di perakaran. Seluruh bagian tanaman kemudian dikeringkan pada suhu 700C selama 2 x 24 jam menggunakan oven (pengering) sampai didapatkan bobot kering yang konstan, dan kemudian ditimbang. Pengamatan bobot kering total dilakukan pada akhir penelitian yaitu hari ke-127 setelah perlakuan. Satuan yang digunakan adalah gram (g) (Salisbury dan Ross, 1995).
8. Bobot kering tunas
Bobot kering tunas adalah bagian tanaman yang terdiri dari batang hasil okulasi, tangkai daun dan daun. Tunas di potong dari batang bawah. Tunas
kemudian dikeringkan pada suhu 700C selama 2 x 24 jam menggunakan oven (pengering) sampai didapatkan bobot kering yang konstan, dan kemudian tunas ditimbang. Pengamatan bobot kering tunas dilakukan pada akhir penelitian. Satuan yang digunakan adalah gram (g) (Salisbury dan Ross, 1995).
9. Serapan N diperoleh dengan analisa tajuk tanaman di laboratorium BPTP.
Kadar N tajuk didapatkan dengan metode Kjeldahl. Tajuk yang dijadikan sampel untuk diukur berasal dari tanaman yang masih hidup sampai pada hari pengamatan ke 127, pada setiap plot pengamatan. Pada dasarnya metode ini dibagi menjadi tiga tahapan yaitu proses destruksi, destilasi dan titrasi. Tahap destruksi. Pada tahap ini sampel yang digunakan dihaluskan dan ditimbang sebanyak 1 gram. Sampel tersebut dimasukkan ke dalam labu Kjeldahl dan ditambahkan K2SO4 sebanyak 7,5 gram. Kalium sulfat berperan sebagai penyerap air. Setelah itu ke dalam labu dimasukkan HgO sebanyak 0,35 gram, zat ini berguna sebagai katalisator. Kemudian dimasukkan 15 mL H2SO4 ke dalam labu tersebut, H2SO4 berperan sebagai oksidator. Hasil dari destruksi ini adalah (NH4)2SO4, CO2 dan H2O.
Tahap destilasi. Pada tahap ini sampel didestilasi yang sebelumnya telah ditambahkan aquades sebanyak 100 mL, Kalium sulfat 4% dan NaOH 50% yang telah didinginkan di dalam lemari es. Di sini NaOH berperan sebagai alkalis kuat yang akan membebaskan amoniak dari ammonium sulfat.
Tahap titrasi. Pada tahap ini yang dilakukan adalah pembakuan NaOH oleh asam oksalat, kemudian didapat N NaOH untuk kemudian dicari mL NaOH blanko (HCl). Setelah itu data dari hasil tahap titrasi ini dimasukkan ke persamaan :
( ) ( )
( )
10. Serapan P diperoleh dengan analisa tajuk tanaman di laboratorium BPTP.
Kadar P tajuk didapatkan dengan teknik analisis atomic absorption spectrophotometry (AAS). Tajuk yang dijadikan sampel untuk diukur berasal dari tanaman yang masih hidup sampai pada hari pengamatan ke 127, pada setiap plot pengamatan. Pada tahapan ini timbang sampel tajuk yang telah digerus dengan cawan petri sebanyak 1 gram. Kemudian dimasukkan ke dalam botol, ditambah 20 mL pengekstrak Olsen, diaduk selama 30 menit dengan shaker, untuk selanjutnya disaring. Ekstrak dipipet 2 mL ke dalam tabung reaksi. Kemudian ditambahkan 10 mL pereaksi pewarna fosfat (H2SO4 5 N, larutan molibdat 4%, asam askorbat dan K-antimontil tartat) diaduk hingga homogen dan biarkan 30 menit.
Selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 693 nm dengan menggunakan larutan deret standar dihidrogen fosfat : 0; 10; 20; 30; 40 dan 50 ppm. Kemudian dari deret larutan standar dihidrogen fosfat tersebut dibuat kurva kalibrasi. Dengan membandingkan absorbansi sampel terhadap kurva kalibrasi fosfor maka didapatkan kadar forfor dalam destruat.
11. Kadar Klorofil
Kadar klorofil diperoleh dengan metode colorimetri dengan Spektrofotometer UV. Daun yang dijadikan sampel untuk diukur berasal dari tanaman yang masih hidup sampai pada hari pengamatan ke 127, pada setiap plot pengamatan. Daun yang digunakan untuk diekstrak (digerus dengan cawan porselin) sebanyak 1 gram. Ekstraksi dilakukan dengan pelarut aceton 85%. Untuk filtrasi digunakan centrifuge dengan kecepatan 1200 rpm. Pengukuran kadar klorofil secara spektrofotometrik didasarkan pada hukum Lamber-Beer. Dan metode untuk menghitung kadar klorofil total, klorofil a dan klorofil b adalah metode Arnon (1949), menggunakan pelarut aceton 85% dan mengukur nilai absorbansi larutan klorofil pada panjang gelombang (λ) = 663 dan 645 nm.
Rumus Arnon (1949) :
Klorofil a (mg L-1) = 0.0127 × A663 – 0.00269 × A645;
Klorofil b (mg L-1) = 0.0229 × A645 – 0.00468 × A663;
Total Klorofil (mg L-1) = 0.0202× A645 + 0.00802 × A663.
HASIL DAN PEMBAHASAN Waktu Muncul Tunas Okulasi
Data hasil pengamatan waktu muncul tunas okulasi tertera pada Lampiran 1, dan data hasil transformasi pada Lampiran 2. Hasil analisis statistik yang tertera pada Lampiran 3 diketahui, terdapat interaksi yang nyata antar perlakuan tinggi penyerongan dengan konsentrasi BAP pada peubah amatan waktu muncul tunas.
Rataan waktu muncul tunas pada perlakuan tinggi penyerongan dan konsentrasi BAP tertera pada Tabel 1.
Tabel 1.Waktu muncul tunas okulasi dengan perlakuan tinggi penyerongan dan konsentrasi BAP
Penyerongan (P)
BAP (B)
Rataan B0 (0mg) B1 (15mg) B2 (30mg) B3 (45mg) B4 (60mg)
Waktu muncul tunas (hari)
P1(10cm) 25,00 cd 14,33 e 0,00 e 0,00 e 19,00 de 11,67 P2(20cm) 41,33 bc 62,67 ab 71,33 ab 70,00 ab 63,67 ab 61,80 P3(30cm) 66,00 ab 81,00 a 76,33 ab 80,33 a 74,33 ab 75,60 Rataan 44,11 52,67 49,22 50,11 52,33 Keterangan : Data dianalisis setelah ditransformasikan dengan (√x+0,5). Nilai yang diikuti
huruf yang sama menunjukkan tidak berbeda nyata pada DMRT taraf 5%.
Bibit pada perlakuan penyerongan 10 cm dan konsentrasi BAP 30 dan 40 mg tidak bertunas sejak awal. Hal ini diduga karena faktor teknis pada pelaksanaan okulasi. Kemungkinan pada waktu pelaksanaan pembalutan okulasi, terjadi gesekan pada mata okulasi sehingga memar dan mati. Dalam hal ini mungkin saja kelihatan bahwa perisai secara keseluruhan masih hidup, yaitu berwarna hijau, tetapi mata okulasi sudah memar (Siagian dan Sunarwidi, 1987).
Rerata waktu muncul tunas yang paling lama diperoleh pada perlakuan tinggi penyerongan 30 cm dengan konsentrasi BAP 15 mg, sedangkan yang paling cepat pada perlakuan tinggi penyerongan 10 cm dengan konsentrasi BAP 15 mg.
Hasil penelitian mengindikasikan semakin tinggi penyerongan maka kebutuhan BAP untuk memicu pertumbuhan tunas semakin meningkat. Munculnya tunas
atau aktivasi basipetal sangat terkait dengan dominansi apikal. Terdapat hipotesis yang menyatakan bahwa meristem apikal menghambat pertumbuhan tunas lateral pada bagian bawah. Beberapa hasil penelitian ditemukan bahwa pertumbuhan tunas bagian pucuk akan terus berlangsung, berbeda halnya dengan tunas lateral yang pertumbuhannya sangat dipengaruhi oleh beberapa faktor. Hasil penelitian Collien et al. (1994), menyatakan bahwa munculnya tunas lateral sangat dipengaruhi oleh defoliasi. Pemunculan tunas akan terjadi jika bagian pucuk tanaman dipotong. Sinyal penghambatan pertumbuhan tunas lateral diduga disebabkan oleh hormon auksin yang diproduksi apeks pucuk dan secara aktif diangkut ke bagian yang membutuhkan. Auksin yang diproduksi di apeks pucuk, diduga memainkan peran utama dalam dominansi apikal dengan bergerak ke batang bawah melalui transportasi polar menghambat perkembangan dari tunas lateral oleh beberapa mekanisme tidak langsung yang mungkin juga melibatkan sinyal lain (Beveridge, 2000; Leyser, 2003; Schmitz dan Theres, 2005). Pada tajuk yang panjang gaya dorongnya lebih lemah dibandingkan tinggi penyerongan yang pendek. Pemberian BAP eksogen tidak memberikan pengaruh yang nyata.
Pertumbuhan ujung batang mendominasi pertumbuhan bagian lain sehingga pembentukan cabang lateral dihambat. Hal ini dikarenakan fenomena dominansi apikal. Pada pembibitan batang bawah tanaman karet, selama bagian ujung tanaman masih ada dominansi apikal tersebut terus terjadi (Muller dan Ottoline, 2011). Ujung batang merupakan tempat diproduksinya auksin. Tunas okulasi mulai membengkak dan pecah setelah dilakukan penyerongan pada ujung batang bawah tanaman karet, sehingga tidak lagi terjadi suplai auksin dari tunas apikal sehingga kadar auksin dalam ruas dibawahnya berkurang (Tanaka et al. 2006).
Sebagai akibatnya, terjadi ekspresi IPT (Isopentenil Transferase) pada tanaman (Hirose et al. 2008). IPT merupakan enzim yang bertanggung jawab sebagai biokatalisator pada biosintesis sitokinin (Takei et al. 2004).
Tinggi Tunas Okulasi
Data hasil pengamatan tinggi tunas okulasi untuk 85, 99, 113 dan 127 hari setelah perlakuan (hsp) tertera pada Lampiran 4, 7, 10 dan 13, dan data hasil transformasinya pada Lampiran 5, 8, 11 dan 14. Hasil analisis statistik yang tertera pada Lampiran 6, 9, 12 dan 15, diketahui terdapat interaksi yang nyata antar perlakuan tinggi penyerongan dengan konsentrasi BAP pada peubah amatan tinggi tunas okulasi. Rataan tinggi tunas okulasi pada interaksi perlakuan tinggi penyerongan dan konsentrasi BAP tertera pada Tabel 2.
Tabel 2.Tinggi tunas okulasi karet dengan perlakuan tinggi penyerongan dan konsentrasi BAP pada beberapa umur pengamatan
Perlakuan
Tinggi Tunas Okulasi Karet (mm) pada beberapa Umur Pengamatan (hsp)
85 99 113 127
P1B0 302,33 a 337,33 a 366,67 a 366,67 a P1B1 48,33 de 48,33 cd 67,00 cd 68,33 c
P1B2 0,00 e 0,00 d 0,00 d 0,00 c
P1B3 0,00 e 0,00 d 0,00 d 0,00 c
P1B4 40,67 de 41,33 cd 43,33 cd 45,00 c P2B0 260,00 ab 260,67 a 316,67 a 388,00 a P2B1 224,67 ab 228,33 ab 234,00 ab 251,67 ab P2B2 205,00 abc 205,00 ab 243,67 ab 246,67 ab P2B3 166,67 abc 186,67 ab 200,00 ab 210,67 ab P2B4 74,00 cde 94,00 bc 103,33 bc 136,67 b P3B0 196,67 abc 200,00 ab 275,00 a 362,67 a P3B1 151,00 abc 189,00 ab 300,00 a 313,33 ab P3B2 103,67 bcd 203,00 ab 232,00 ab 294,33 ab P3B3 107,33 bcd 178,67 ab 239,67 ab 271,33 ab P3B4 248,33 ab 252,00 a 306,00 a 410,67 a Keterangan : Data dianalisis setelah ditransformasikan dengan (√x+0,5). Nilai pada kolom
yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada DMRT taraf 5%.
Secara umum peningkatan konsentrasi BAP akan menurunkan tinggi tunas pada tingkat penyerongan rendah (10 cm) dan sedang (20 cm). Hal ini
dikarenakan BAP aktif pada konsentrasi rendah dan menjadi penghambat pada konsentrasi tinggi. Berbeda halnya dengan tingkat penyerongan yang tinggi (30 cm), peningkatan konsentrasi BAP meningkatkan tinggi tunas. Siagian et al.
(2006) menyatakan bahwa pertumbuhan tunas okulasi akan lebih jagur pada tanaman yang diserong lebih tinggi karena ketersediaan cadangan makanan lebih banyak pada batang bawah yang diserong lebih tinggi.
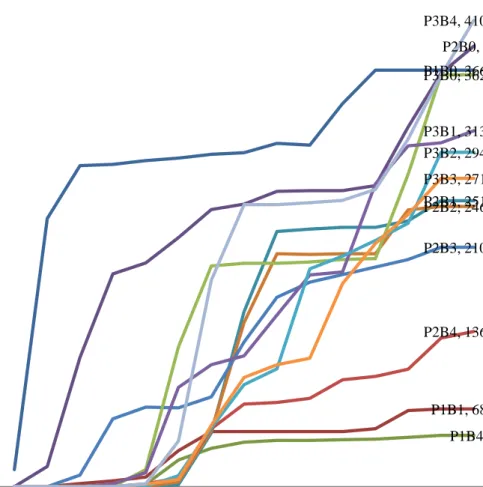
Gambar 1. Grafik pertambahan tinggi tunas okulasi per pengamatan
Dari grafik pertambahan tinggi tunas okulasi yang ditampilkan pada Gambar 1, perlakuan penyerongan tinggi (30 cm) dengan konsentrasi 60 mg menunjukkan pertambahan tinggi tunas okulasi paling tinggi sedangkan perlakuan penyerongan
P1B0, 366.67
P1B1, 68.33 P1B4, 45 P2B0, 388
P2B1, 251.67 P2B2, 246.67 P2B3, 210.67
P2B4, 136.67 P3B0, 362.67
P3B1, 313.33 P3B2, 294.33 P3B3, 271.33 P3B4, 410.67
0 50 100 150 200 250 300 350 400 450
29 36 43 50 57 64 71 78 85 92 99 106 113 120 127
Tinggi Tunas (mm)
rendah (10 cm) dengan konsentrasi BAP 60 mg, menunjukkan pertambahan tinggi tunas okulasi paling rendah. Pada periode awal pengamatan yaitu hari ke 29 setelah perlakuan, perlakuan tinggi penyerongan yang rendah (10 cm) dan sedang (20 cm) dengan tanpa pemberian konsentrasi BAP mengalami pertumbuhan paling cepat. Kemudian diikuti oleh bibit yang diberi perlakuan penyerongan tinggi 20 cm dengan konsentrasi BAP 15, 30, 45 dan 60 mg pada pengamatan hari ke 36 dan 43 setelah perlakuan. Hal ini dikarenakan pertumbuhan tunas lateral (tunas liar) sedikit yang menjadi pesaing terhadap tunas okulasi (Siagian, 2012).
Berbeda halnya dengan tanaman yang diberi perlakuan tinggi penyerongan paling tinggi (30 cm) dengan konsentrasi BAP 15, 30, 45 dan 60 mg. Pada periode awal pertumbuhan hari ke 29 sampai dengan hari ke 40 setelah perlakuan bibit belum bertunas. Namun pada hari ke 50 setelah perlakuan bibit mulai bertunas dan mengalami pertumbuhan tunas yang pesat. Hal ini dikarenakan akumulasi tunas lateral yang tumbuh menekan pertumbuhan tunas okulasi pada masa awal pengamatan. Perawatan dilakukan dengan merempel semua tunas liar yang tumbuh untuk mengurangi tekanan terhadap tunas okulasi (Siagian dan Sunarwidi, 1987). Peningkatan konsentrasi BAP dibutuhkan untuk mengatasi tekanan tunas liar agar pertumbuhan tunas okulasi lebih jagur.
Diameter Tunas Okulasi
Data hasil pengamatan diameter tunas okulasi dapat dilihat pada Lampiran 16, dan data hasil transformasinya pada Lampiran 17. Hasil analisis statistik yang tertera pada Lampiran 18 diketahui, terdapat interaksi yang nyata antar perlakuan tinggi penyerongan dengan konsentrasi BAP pada peubah amatan diameter tunas