LAPORAN PRAKTIKUM KIMIA ANALITIK II
PERCOBAAN I
PEMISAHAN DENGAN JALAN PENGENDAPAN
I. Tujuan
a. Memahami prinsip pemisahan dengan jalan pengendapan
b. Melakukan pemisahan terhadap beberapa senyawa
c. Menghitung kadar unsur dalam sampel
II. Landasan Teori
Suatu analisis kimia umumnya terdiri dari 5 tahap utama yaitu : sampling,
pengubahan bentuk analit ke dalam bentuk yang sesuai dengan cara analisis, pengukuran, perhitungan, dan interpretasi data. Tahap kedua merupakan tahap yang menentukan dalam suatu analisis. Dalam tahap ini sampel diperlakukan sedemikan rupa sehingga sesuai dengan cara atau teknis analisis yang dipergunakan. Perlakuan yang dimaksud disini salah satunya adalah memisahkan analit dari zat-zat yang dapat mengganggu kegiatan analisis. Pemisahan dengan cara pengendapan merupakan teknis yang secara luas digunakan khususnya jika analit akan dianalisis dengan metode gravimetri. Pengendapan suatu kation dan anion dalam suatu larutan sampel yang terdiri dari berbagai jenis kation atau anion dapat dilakukan berbagai cara. Satu diantaranya adalah dengan penambahan suatu ion sehingga terjadi reaksi yang menghasilkan senyawa berbentuk Kristal, gelatin atau gumpalan amorf. (Tim Kimia Analitik II. 2014 : 2-3)
Terbentuknya endapan dimulai dari terbentuknya larutan lewat jenuh (super
Proses pengendapan selanjutnya merupakan kompetisi antara nukleasi dan
partikel growth (partikel besar). Apabila nukleasi yang lebih dominan maka partikel kecil yang banyak. Bila partikel growth yang lebih dominan maka partikel besar yang lebih banyak. (Vogel. 1995 : 125)
Dasar pemisahan pengendapan adalah perbedaan kelarutan analit (komponen atau konstituen yang dicari) dengan zat-zat komponen lain yang tidak diinginkan. Metode pengendapan membutuhkan pemahaman yang memadai tentang reaksi pengendapan meliputi :
a) Kelarutan endapan
Kelarutan endapan bergantung pada suhu, tekanan, kemurnian larutan dan komposisi pelarut. Umumnya kelarutan endapan meningkat dengan kenaikan suhu sehingga perubahan kelarutan dengan perubahan suhu dapat menjadi dasar pemisahan.
b) Hasil kali kelarutan
Rumus umum hasil kali kelarutan menunjukkan bahwa hasil kali kelarutan konsentrasi ion-ion pembentuk endapan jenuh yang sangat sedikit larut pada setiap suhu tertentu adalah konstan.
c) Penerapan hubungan hasil kali kelarutan
Hubungan hasil kali kelarutan memungkinkan untuk menerangkan dan meramalkan reaksi-reaksi pengendapan. Jika hasil kali ion dengan sengaja dibuat lebih besar dari hasil kali kelarutannya dengan menambahkan suatu garam lain dan dengan satu ion sekutu, sistem akan menyesuaikan diri melalui pengendapan garam padat.
(Anonim. 2010)
membentuk garam. Kebanyakan pengendap organik tergolong pembentuk khelat. Khelat mudah larut dalam pelarut organik seperti karbon tertraklorida dan kloroform. Penggunaan pereaksi pengendap organik memiliki keuntungan dan sebagai berikut :
a. Pengendapan ion logam secara kuantitatif, sebab kebanyakan khelat yang terbentuk tidak larut dalam air.
b. Berat molekul besar
c. Cukup selektif dan spesifik terutama dengan pengaturan pH dan
pemakaian masking agent.
d. Endapan kasar dan bervolume besar sehingga mudah ditangani (Rifai. 1995 : 85)
Salah satu metode pemisahan pengendapan yang paling sering dilakukan adalah metode gravimetri. Suatu cara analisa gravimetri biasanya berdasarkan reaksi kimia seperti :
aA + rR AaRr
dengan ketentuan a adalah molekul analit A, bereaksi dengan r molekul pereaksi R. Hasil AaRr biasanya merupakan zat dengan kelarutan yang kecil yang dapat ditimbang dalam bentuk yang lain setelah dikeringkan atau yang dapat dibakar menjadi senyawa lain dengan susunan yang diketahui dan kemudian ditimbang. Misalnya kalsium dapat ditentukan secara gravimetri dengan pengendapan dari kalsium oksalat dan pembakaran oksalat menjadi kalsium oksida. Suatu pereaksi R biasanya ditambahkan untuk menekan kelarutan endapan . Persyaratan yang harus dipenuhi agar gravimetri berhasil :
Proses pemisahan harus cukup sempurna hingga kuantitas analit yang
tidak mengendap secara analitik tidak ditemukan
Zat harus mempunyai susunan tertentu dan harus murni.
III. Prosedur Percobaan
Sampel yang mengandung ion
3.2 Skema Kerja
A. Pemisahan dan Penentuan Perak
dimasukkan ke dalam gelas beaker
ditetesi sedikit demi sedikit kedalam sampel
diaduk perlahan dan pertahankan agar temperatur tetap konstan
diambil larutan atas yang berwarna bening dan uji dengan NaCl
disaring endapan yang terbentuk
dituangkan ke dalam endapan sebagai reagen pencuci endapan
dipanaskan endapan dalam oven dengan suhu 110o – 130o C
dinginkan dan keringkan
ditimbang endapan sebagai berat AgCl HASIL
100 ml larutan sampel
NaCl 5%
B. Pemisahan Besi
dimasukkan ke dalam gelas beker
dituangkan ke dalam gelas beker dengan pengadukan konstan
didihkan campuran selama ± 3 menit dinginkan pada temperatur kamar
ditambahkan ke dalam campuran dan didihkan kembali
disaring endapan
dituangkan ke dalam endapan sebagai reagen pencuci endapan
dipisahkan filtratnya
dituangkan ke dalam endapan sebagai reagen pelarut endapan
ditambahkan
didihkan selama satu menit disaring endapan
dituangkan ke dalam endapan sebagai reagen pencuci endapan
HASIL
100 ml larutan NaOH 5% panas.
IV. Hasil dan Pembahasan 4.1 Tabel Pengamatan
Tabel 4.1.1 Pemisahan Perak
Tabel 4.1.2 Pemisahan Besi
Massa endapan Kadar perak dalam sampel 0,41 gram 8,2 %
4.2 Pembahasan
1. Pemisahan dan Penentuan Perak
Perak merupakan logam berwarna putih, dapat ditempa dan liat. Rapatan tinggi
(10,5 g/ml ) dan melebur pada 9600C, tidak larut dalam asam klorida, asam sulfat
encer (1M) atau asam nitrat encer (2M). Perak merupakan salah satu kation yang
berada pada golongan IA bersama-sama dengan Pb2+ dan Hg2+. Dalam larutan asam
nitrat yang lebih pekat (8M) atau asam pekat panas, kation ini akan melarut dengan reaksi sebagai berikut :
6Ag + 8HNO3 6Ag+ + 2NO + 6NO3- + 4H2O
2Ag + 2H2SO4 2Ag+ + SO42- + SO2 + 2H2O
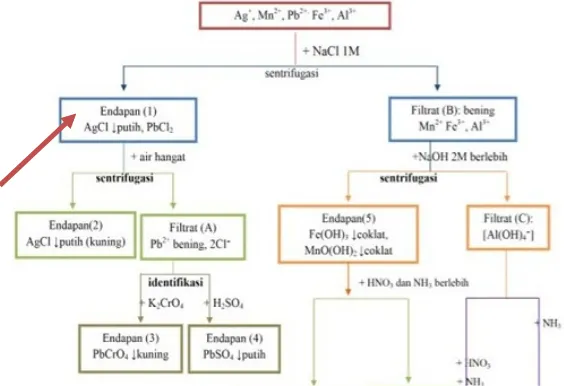
Kation golongan ini akan terendapkan dengan reagen asam klorida (HCl). Pada
percobaan ini, sampel yang diberikan diduga mengandung ion Ag+ sehingga akan
dilakukan pemisahan melalui cara pengendapan. Ag+ akan terendapkan dengan
penambahan reagen tertentu, sementara filtratnya akan disisihkan untuk pengujian kation lebih lanjut. Tujuan dari penambahan NaCl 5 % dalam percobaan ini adalah agar AgNO3 terendap dalam bentuk kationnya. Endapan yang terbentuk dari
penambahan NaCl dalam percobaan ini adalah endapan garam klorida (AgCl) yang berwarna putih.
Reaksi yang terjadi sebagai berikut :
Ag+ + Cl- AgCl
2AgCl 2Ag + Cl2
Reaksi ini lambat dan mekanisme reaksi yang sesungguhnya sangat rumit. Halida perak yang lain menunjukkan sifat-sifat yang serupa. Setelah disaring, filtrat dari reaksi ini disisihkan untuk diuji kembali sebagai sampel pada pengujian kation golongan selanjutnya. Endapan AgCl ini kemudian dicuci menggunakan asam nitrat
(HNO3) 0,02 M. Tujuan pencucian endapan adalah menghilangkan kontaminasi pada
permukaan. Untuk pencucian, digunakan larutan elektrolit kuat dan harus mengandung ion sejenis dengan endapan untuk mengurangi kelarutan endapan.
Ada baiknya sebelum dicuci dengan HNO3, endapan ditambahkan dengan larutan
amonia encer untuk membentuk ion kompleks diaminaargentat. Filtrat diasamkan dengan HNO3 melalui reaksi sebagai berikut :
[Ag(NH3)2]Cl + 2HNO3 AgCl + NH4NO3
Kompleks [Ag(NH3)2]Cl memiliki Kstab(tetapan kestabilan) yang tinggi sehingga
sulit terdisosiasi. Penambahan asam akan meningkatkan disosiasi kompleks [Ag(NH3)2]Cl menghasilkan kation Ag+ sehingga Ksp AgCl (10-10) terlewati.
[Ag(NH3)2]+ Ag+ + 2NH3
NH3 + H+ NH4+
Penambahan H+ mengubah NH
3 menjadi NH4+ sehingga meningkatkan disosiasi
kompleks garam klorida.
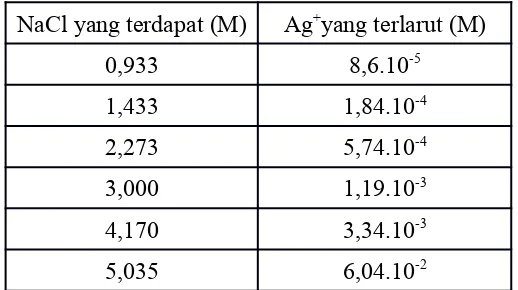
Setelah endapan dicuci dan dikeringkan maka endapan ditimbang. Pada percobaan ini, berat endapan yang didapat adalah 1,19 gram dengan kadar perak klorida (AgCl) adalah 23,8 % (perhitungan terlampir). Kadar AgCl yang sangat kecil (yakni dibawah 50%) bisa terjadi karena penambahan reagensia NaCl yang berlebih sehingga mempengaruhi hasil kelarutan.
NaCl yang terdapat (M) Ag+ yang terlarut (M)
0,933 8,6.10-5
Percobaan ini menggunakan filtrat sisa yang didapat dari percobaan sebelumnya (pemisahan perak). Metode pemisahan yang digunakan masih tetap sama, yakni menambahkan pereaksi spesifik agar kation besi terendapkan. Besi yang murni
merupakan logam berwarna putih-perak yang melebur pada 15350C.
Asam klorida encer atau pekat dan asam sulfat encer mampu melarutkan besi menghasilkan garam-garam besi(II) dan gas hidrogen.
Fe + 2H+ Fe2+ + H
2
Asam sulfat pekat yang panas menghasilkan ion-ion besi(III) dan belerang dioksida : 2Fe + H2SO4 + 6H+ 2Fe3+ + 3SO2 + 6H2O
hidroksida, Fe(OH)2 bila tidak terdapat udara sama sekali. Endapan ini tidak larut
dalam reagensia berlebih, tetapi larut dalam asam. Dalam percobaan yang praktikan lakukan, tidak ada sedikitpun endapan putih yang terbentuk. Hal ini dikarenakan endapan terkena udara dan teroksidasi dengan cepat menghasilkan besi(III) hidroksida yang berwarna cokelat-kemerahan. Fungsi penambahan hidrogen peroksida (H2O2) adalah sebagai reagen pereduksi (oksidator). Seharusnya pada
penambahan hidrogen peroksida akan terbentuk endapan berwarna hijau kotor. Namun, sampai kepada penambahan 5 mL hidrogen peroksida endapan belum juga terbentuk. Reaksi yang seharusnya tejadi pada saat penambahan hidrogen peroksida (H2O2) adalah sebagai berikut :
Fe2+ + 2OH- Fe(OH) 2
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
2Fe(OH)2 + H2O2 2Fe(OH)3
Endapan kemudian dicuci dengan air panas. Tujuan dari pencucian endapan ini adalah menghilangkan kontaminasi pada permukaan endapan. Pencuci yang digunakan adalah air panas, karena endapan Fe(OH)3 tidak larut dalam air panas. Hal
ini memungkinkan senyawa pengotor lain larut tetapi kuantitas endapan tidak berkurang. Endapan kemudian dilarutkan dalam HCl dan ditambahkan amoniak. Penambahan amoniak ini bertujuan agar endapan mengendap sempurna. Namun, penambahan larutan amoniak harus dengan volume yang tepat. Karena jika terdapat ion ammonium dalam jumlah yang lebih banyak, disosiasi ammonium hidroksida akan tertekan dan konsentrasi ion hidroksil menjadi semakin besar, sehingga hasil kali kelarutan besi(III) hidroksida tidak akan tercapai dan endapan yang terbentuk justru akan larut. Endapan yang didapat disaring dan dicuci kembali menggunakan ammonium nitrat.
Dalam percobaan kali ini, praktikan tidak berhasil memisahkan kation Fe karena tidak ada endapan yang terbentuk. Sehingga, data kelompok ini diambil dari kelompok lain yang melakukan percobaan yang sama. Berdasarkan data pengamatan
diketahui bahwa endapan FeCl3 yang didapatkan sebesar 0,41 gram dengan kadar
Gambar 4.2.1.2 Skema Pemisahan Kation Golongan IIIA (Fe)
2. Pemisahan Krom
Percobaan ini menggunakan filtrat sisa yang didapat dari percobaan sebelumnya (pemisahan besi). Metode pemisahan yang digunakan yakni dengan melakukan titrasi oksida-reduksimetri terhadap iodium bebas yang terbentuk dari larutan sampel. Percobaan ini tidak dilakukan karena tidak tersedianya bahan. Sehingga, pembahasan diambil dari literatur.
Kromium adalah logam kristalin yang berwarna putih, tidak begitu liat dan tidak dapat ditempa. Kromium melebur pada suhu 17650C. Pada percobaan
pemisahan kromium ini, filtrat sisa ditambahkan dengan asam klorida 1:1. Fungsi penambahan HCl yakni untuk membuat logam ini larut, kromium akan larut dalam asam klorida (HCl) encer maupun pekat. Reaksi ini kila tidak terkena udara, akan membentuk ion-ion kromium(II)
Reaksinya sebagai berikut : Cr2+ + 2H+ Cr2+ + H
2
Dengan adanya oksigen dari atmosfer, kromium sebagian atau seluruhnya menjadi teroksidasi ke keadaan tervalen :
4Cr2+ + O
2 + 2H+ 4Cr3+ + 2H2O
Selain itu, penambahan asam juga akan mengubah kromat menjadi dikromat dengan reaksi sebagai berikut :
2CrO42- + 2H+ Cr2O72- + H2O
Reaksi ini bersifat reversibel. Dalam larutan netral (atau basa) ion kromat cenderung stabil, sedangkan jika diasamkan akan membentuk ion-ion kromat yang berwarna kuning. (G.Svehla. 1995)
Dilihat dari berbagai reaksi diatas, krom bersifat sebagai zat pengoksidasi yang kuat. Sehingga, penentuan kadar krom dapat dilakukan dengan menggunakan metode titrasi oksida-reduksimetri. Titrasi oksidametri merupakan metode titrasi dimana larutan baku standar yang digunakan mengalami oksidasi dan titrasi reduksimetri merupakan metode titrasi dimana larutan baku standar yang digunakan mengalami reduksi. Penambahan kalium iodida (KI) dalam larutan, bertujuan sebagai pereduksi pada sampel yang bersifat oksidator. Sampel yang bersifat Oksidator akan direduksi oleh KI (kalium iodida) secara berlebih dan akan menghasilkan I2 (Iodium) yang
selanjutnya akan di titrasi oleh Na2S2O3 ( natrium thiosulfat).Banyaknya volume
Na2S2O3 ( natrium thiosulfat) yang digunakan sebagai titran setara dengan I2 (iodium)
yang dihasilkan dan setara dengan kadar sampel. Larutan standard yang digunakan dalam metode ini adalah Na2S2O3 (natrium thiosulfat). Garam ini biasanya berbentuk
pentahidrat (Na2S2O3.5H2O).
Indikator pada metode ini menggunakan amilum. Amilum memiliki sifat sukar larut dalam air serta tidak stabil dalam suspensi air membentuk senyawa kompleks yang sukar larut dalam air jika bereaksi dengan iodium.Sehingga penambahan amilum sebagai Indikator tidak boleh ditambahkan pada awal reaksi. Penambahan amilum sebagai indikator sebaiknya diberikan menjelang titik akhir titrasi (pada saat larutan berwarna kuning pucat).
I3- + 2S2O32- 3I- + S4O6
2-S2O32- + I3- S2O3I- + 2I
-2S2O3I- + I- S4O62- + I3
-S2O3I- + S2O32- S4O62- + I
-Titik akhir titrasi ditandai dengan perubahan warna biru menjadi larutan bening (dari warna biru sampai warna biru hilang). Jadi penambahan amilum yang dilakukan saat mendekati titik akhir titrasi dimaksudkan agar amilum tidak membungkus iod karena akan menyebabkan amilum sukar dititrasi untuk kembali ke senyawa semula. Proses titrasi harus dilakukan sesegera mungkin, hal ini disebabkan sifat dari I2 yang mudah menguap (http://www.academia.edu).
Pada percobaan pemisahan kromium ini, kadar kromium tidak bisa ditentukan karena praktikan tidak melakukan percobaan ini. Keseluruhan pembahasan diambil dari literatur. kelarutan suatu senyawa ketika ditambahkan suatu ion sehingga terjadi reaksi yang menghasilkan senyawa berbentuk kristal, gelatin atau gumpalan amorf.
2. Pemisahan dengan jalan pengendapan yang dilakukan dalam percobaan ini
adalah :
Pemisahan perak
Dengan cara menambahkan reagen pengendap tertentu. Endapan yang didapatkan sebesar 1,19 gram dengan kadar perak 23,8%.
Dengan cara menambahkan reagen pengendap tertentu. Endapan yang didapatkan sebesar 0,41 gram dengan kadar besi 8,2%.
5.2 Saran
Setelah melakukan percobaan, maka saran-saran yang dapat diberikan yaitu : 1) Lamanya percobaan untuk setiap kelompok hendaknya dibedakan. Hal ini
dikarenakan setiap kelompok melakukan percobaan yang berbeda. Beberapa kelompok melakukan percobaan dengan waktu yang tidak terlalu lama sementara kelompok lain memerlukan waktu lebih untuk menyelesaikan percobaannya.
VI. DAFTAR PUSTAKA
Anonim. 2010. Pemisahan dengan Cara Pengendapan. Diakses tanggal 12 April 2014.
http://www.academia.edu/4527993/2013/pemisahan-dengan-cara-pengendapanh.
Rifai. 1995. Asas-Asas Pemeriksaan Kimia. Padang : Universitas Indonesia Press
Tim Kimia Analitik II. 2014. Penuntun Praktikum Kimia Analitik II. Jambi :
Universitas Jambi
Underwood. 1995. Analisia Kimia Kuantitatif. Jakarta : Erlangga