VALIDASI DAN PENETAPAN KADAR ASETOSAL DALAM SEDIAAN TABLET SECARA SPEKTROFOTOMETRI
FOURIER TRANSFORM INFRA RED (FTIR)
SKRIPSI
HALAMAN JUDUL
OLEH:
WILDO CAHYA ASHIDIQI TAMBUNAN NIM 171501118
PROGRAM SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
VALIDASI DAN PENETAPAN KADAR ASETOSAL DALAM SEDIAAN TABLET SECARA SPEKTROFOTOMETRI
FOURIER TRANSFORM INFRA RED (FTIR)
HALAMAN USULAN PENELITIAN
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
WILDO CAHYA ASHIDIQI TAMBUNAN NIM 171501118
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
PENGESAHAN SKRIPSI
VALIDASI DAN PENETAPAN KADAR ASETOSAL DALAM SEDIAAN TABLET SECARA SPEKTROFOTOMETRI
FOURIER TRANSFORM INFRA RED (FTIR)
OLEH:
WILDO CAHYA ASHIDIQI TAMBUNAN 171501118
Dipertahankan di Hadapan Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara pada Tanggal: 3 Januari 2022
Disetujui oleh: Panitia Penguji:
Pembimbing I,
Prof. Dr. Masfria M.S., Apt.
Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt NIP 195707231986012001 NIP 195306191983031001
Pembimbing II,
Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt NIP 195306191983031001
Henny Sri Wahyuni S.Farm., M.Si., Apt NIP 198509222018032001
Drs. Fathur Rahman Harun, M.Si., Apt.
Ketua Program Studi Sarjana Farmasi, NIP 195201041980031002
Dr. Sumaiyah, M.Si., Apt Henny Sri Wahyuni S.Farm., M.Si., Apt
NIP 197712262008122002 NIP 198509222018032001
Medan, 3 Januari 2022 Diahkan oleh:
Dekan
Khairunnisa, S.Si., M.Pharm., Ph.D., Apt.
NIP 197802152008122001
KATA PENGANTAR
Puji dan syukur kehadirat Allah yang Maha Kuasa yang telah melimpahkan rahmat, karunia, dan ridhoNya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Validasi dan Penetapan Kadar Asetosal dalam sediaan tablet secara spektrofotometri Fourier Transform Infra Red (FTIR)”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, saya menyampaikan rasa hormat dan terima kasih kepada Ibu Khairunnisa, S.Si., M.Pharm., Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas untuk menyelesaikan skripsi penulis, kepada Ibu Prof. Dr. Masfria, M.Si., Apt., selaku Mantan Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas selama masa Pendidikan. Saya juga ingin menyampaikan rasa terima kasih yang setulus-tulusnya kepada Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt., dan Ibu Henny Sri Wahyuni, S.Farm., M.Si., Apt., selaku dosen pembimbing yang telah membimbing dengan penuh kesabaran, tulus dan ikhlas selama penelitian dan penulisan skripsi ini berlangsung. Kepada Ibu Prof. Dr. Masfria, M.Si., Apt., dan Bapak Drs. Fathur Rahman Harun, M.Si., Apt.
selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini. Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah mendidik selama perkuliahan dan Ibu Prof. Dr. Poppy Anjelisa Zaitun Hasibuan S.Si., M.Si., Apt., selaku penasehat akademik yang selalu memberi bimbingan, perhatian dan motivasi kepada penulis selama masa perkuliahan.
Penulis juga mengucapkan terima kasih dan penghargaan yang tulus kepada kedua orangtua, Ayahanda Sahnan Tambunan dan Ibunda Desniwati, abangda Heru Utama Tambunan, dan juga adik Naufal Tambunan yang telah memberikan cinta dan kasih sayang, doa, semangat, dorongan motivasi kepada penulis selama ini.
Terima kasih juga penulis ucapkan kepada rekan penelitian Ricky, Karmila, Egik dan Dandy, kepada Shabrina Alifah Siregar atas waktu, motivasi dan doa yang telah diberikan kepada penulis selama menjalani pendidikan dan penelitian, kepada teman seperjuangan Yogik, Kevin, Dika, Dimas, Muliandi, Wildo, Rahmat, Amri, Raja, Jose, Ade, Enry, Ella, Anggi, Keluarga Bersama, Asisten Laboratorium Statistik dan Metodologi Penelitian serta sahabat-sahabat stambuk 2017 Fakultas Farmasi USU atas kebersamaan, perhatian, do’a, dorongan, semangat serta cinta yang diberikan kepada penulis selama ini, hingga akhirnya penulis dapat menyelesaikan skripsi ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 3 Januari 2021 Penulis,
Wildo Cahya Ashidiqi Tambunan 171501118
SURAT PERNYATAAN ORISINALITAS
Saya yang bertanda tangan dibawah ini :
Nama : Wildo Cahya Ashidiqi Tambunan
Nomor Induk Mahasiswa : 171501118 Program studi : Sarjana Farmasi
Judul Skripsi : Validasi Dan Penetapan Kadar Asetosal Dalam Sediaan Tablet Secara Spektrofotometri Fourier Transform Infra Red (FTIR)
Dengan ini menyatakan bahwa skripsi yang saya buat adalah asli karya sendiri dan bukan plagiat. Apabila di kemudian hari diketahui bahwa skripsi saya tersebut terbukti plagiat karena kesalahan sendiri, maka saya bersedia diberi sanksi apapun oleh Program Studi Sarjana Fakultas Farmasi Universitas Sumatera Utara, Saya tidak akan menuntut pihak manapun atas perbualan saya tersebut.
Demikian Surat pernyataan ini saya perbuat dengan sebenarnya dan dalam keadaaan sehat.
Medan, 3 Januari 2022 Penulis,
Wildo Cahya Ashidiqi Tambunan 171501118
VALIDASI DAN PENETAPAN KADAR ASETOSAL DALAM SEDIAAN TABLET SECARA SPEKTROFOTOMETRI FOURIER TRANSFORM
INFRA RED (FTIR) ABSTRAK
Latar belakang: Asetosal atau Asam Asetilsalisilat merupakan salah satu obat antiinlfamasi non steroid yang sering digunakan didunia. Asetosal digunakan untuk meredakan nyeri ringan sampai sedang dan gangguan inflamasi akut. Fourier Transform Infra Red (FTIR) memiliki sensitifitas yang lebih baik, pengukuran yang lebih singkat, persiapan sampel sederhana, dan mudah dalam pengoperasian.
Fourier Transform Infra Red (FTIR) memiliki sifat yang khas sebagai spektrum sidik jari, yang mana tidak ada dua buah senyawa atau sampel yang berbeda mempunyai spektrum yang sama. Pemeriksaan kadar zat aktif merupakan syarat yang harus dipenuhi untuk menjamin kualitas sediaan obat.
Tujuan: Tujuan dari penelitian ini adalah untuk menetapkan kadar asetosal dalam sediaan tablet serta untuk mengetahui kesesuaian kadar terhadap persyaratan Farmakope Indonesia.
Metode: Penetapan kadar asetosal secara spektrofotometri Fourier Transform Infra Red (FTIR) dilakukan dengan pembuatan kalibrasi dan validasi 5 konsentrasi yang diukur pada rentang bilangan gelombang 4000-400 cm-1.
Hasil: Hasil penelitian menunjukkan bahwa kadar asetosal dalam sediaan tablet Aptor® (96,81±0,95) %, tablet Astika® (101,90±1,59) %, tablet Cardioasetosal® (105,75±1,83)%, dan tablet Farmasal® (98,36±1,50) %. Kadar yang diperoleh memenuhi persyaratan yang ditetapkan pada Farmakope Indonesia edisi VI tahun 2020. Validasi metode yang dilakukan didapat hasil uji perolehan kembali 100,77
%, RSD 0,57%, dan LOD dan LOQ masing-masing adalah 0,7761% dan 2,5870%.
Hasil ini menunjukkan bahwa metode yang dilakukan memberikan hasil akurat dan teliti.
Kesimpulan: Hasil penelitian dapat disimpulkan bahwa penetapan kadar asetosal dapat dilakukan secara spektrofotometri Fourier Transform Infra Red (FTIR) dan kadar tablet asetosal telah memenuhi persyaratan Farmakope Indonesia Edisi VI tahun 2020.
Kata Kunci: Asetosal, FTIR, spektrofotometri, penetapan kadar
VALIDATION AND DETERMINATION OF ASETOSAL IN TABLET BY FOURIER TRANSFORM INFRA RED SPECTROPHOTOMETRY (FTIR)
ABSTRACT
Background:Acetosal or Acetylsalicylic Acid is one of the most widely used non- steroidal anti-inflammatory drugs in the world. Acetosal is used to relieve mild to moderate pain and acute inflammatory disorders. Fourier Transform Infra Red (FTIR) has better sensitivity, shorter measurements, simple sample preparation, and is easy to operate. Fourier Transform Infra Red (FTIR) has a characteristic as a fingerprint spectrum, in which no two compounds or different samples have the same spectrum. Examination of active substance levels is a requirement that must be met to ensure the quality of drug preparations.
Objective: The purpose of this study was to determine asetosal levels in tablet and to determine the suitability of the requirements of Indonesian Pharmacopoeia.
Methods: Determination of asetosal levels by Fourier Transform Infra Red (FTIR) spectrophotometry used to made a chemometric calibration and validation of each of the 5 concentrations measured absorbance in the wave number range 4000-400 cm-1.
Results: The results showed that the levels of asetosal in Aptor® tablets (96,81±0,95)%, Astika® tablets (101,90±1,59)%, Cardioasetosal® tablets (105,75±1,83)%, and Farmasal® tablets (98,36±1,50)%. The content obtained meets the requirements set in the Indonesian’s Pharmacopeia 5th edition 2014. The validation method showed the result of the recovery test was 100.77%, RSD was 0,57%, and LOD and LOQ were 0,7761% and 2,5870% respectively. These results indicate that the method was accurate and precise.
Conclusion: The results of this study concluded that the determination of asetosal levels could be carried out by Fourier Transform Infra Red (FTIR) spectrophotometry and the levels of asetosal tablets had met the requirements of the Indonesian’s Pharmacopeia 6th edition 2020.
Keywords: Asetosal, FTIR, spectrophotometry, content determination
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR GAMBAR DALAM LAMPIRAN ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Asetosal ... 5
2.1.1 Sifat Fisika Kimia ... 5
2.1.2 Farmakologi ... 6
2.1.3 Farmakokinetika ... 6
2.2 Tablet... 7
2.3 Spektrofotometri ... 7
2.3.1 Definisi ... 7
2.3.2 Klasifikasi Spektrofotometri ... 8
2.4 Spektrofotometri FTIR ... 11
2.5 Vibrasi Molekul Inframerah ... 15
2.6 Pengolahan Sampel pada FTIR ... 16
2.7 Interpretasi Spektrum Infra Merah ... 19
2.8 Interpretasi Spektrum Infra Merah Asetosal ... 21
2.9 Validasi Metode ... 21
2.9.1 Akurasi ... 22
2.9.2 Presisi ... 22
2.9.3 Batas Deteksi dan Batas Kuantitasi... 22
2.9.4 Linearitas ... 23
BAB III METODE PENELITIAN... 24
3.1 Jenis Penelitian ... 24
3.2 Waktu dan Tempat Penelitian ... 24
3.3 Alat-alat ... 24
3.4 Bahan-bahan ... 24
3.5 Pengambilan Sampel ... 25
3.6 Prosedur Penelitian... 25
3.6.1 Pembuatan Spektrum Serapan Baku Asetosal ... 25
3.6.2 Pembuatan Kurva Kalibrasi ... 25
3.6.3 Penetapan Kadar Tablet Asetosal... 26
3.7 Validasi Metode ... 26
3.7.1 Linearitas ... 26
3.7.2 Akurasi ... 26
3.7.3 Presisi ... 27
3.7.4 Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 27
3.7.5 Analisis Data Penetapan Kadar secara Statistik ... 28
BAB IV HASIL DAN PEMBAHASAN ... 29
4.1 Penentuan Spektrum Serapan Baku Asetosal ... 29
4.2 Penentuan Kurva Kalibrasi Asetosal ... 32
4.3 Hasil Pembuatan Kurva Kalibrasi Asetosal ... 33
4.4 Hasil Penetapan Kadar Asetosal dalam Sediaan Tablet ... 35
4.5 Hasil Validasi Metode ... 38
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 42
DAFTAR TABEL
4.1 Puncak gugus fungsional asetosal ... 30 4.2 Hasil pengolahan data dari sediaan tablet asetosal dengan nama dagang.. ... 36 4.3 Data kadar asetosal dalam sediaan tablet ... 37
DAFTAR GAMBAR
2.1 Struktur kimia asetosal ... 5
2.2 Komponen utama dalam FTIR ... 13
2.3 Jenis-jenis vibrasi molekul ... 15
2.4 Daerah fundamental pada spektrum infra merah ... 16
2.5 Vibrasi Bond Strecthing ... 17
2.6 Vibrasi Bond Bonding ... 17
2.7 Spektrum inframerah propanol (CH3CH2CH2OH) ... 18
2.8 Daerah-daerah perkiraan frekuensi vibrasi yang mana berbagai jenis ikatan menyerap sinar IR (disini hanya vibrasi ulur; sementara berbagai jenis vibrasi tekuk dihilangkan untuk membuat lebih jelas) ... 20
4.1 Tampilan puncak daerah gugus fungsional asetosal ...30
4.2 Spektrum Serapan Baku Asetosal 10% ...31
4.3 Tampilan transmittan spektrum asetosal dengan bilangan gelombang spesifik ..32
4.4 Tampilan transmittan spektrum asetosal dengan bilangan gelombang spesifik Menurut Literatur ...33
4.5 Tampilan spektrum tumpang asetosal dengan berbagai konsentrasi (6-14%) ...34
4.6 Grafik kurva kalibrasi baku asetosal ...35
DAFTAR GAMBAR DALAM LAMPIRAN
1. Spektrofotometer Inframerah (IRPrestige-21 Shimadzu) ... 43
2. Timbangan (Sartorius) ... 43
3. Kalium bromida ... 44
4. Tablet Aptor® ... 50
5. Spektrum Tumpang Tindih Baku Asetosal dan Tablet Aptor® ... 50
6. Tablet Astika® ... 55
7. Spektrum Tumpang Tindih Baku Asetosal dan Tablet Astika® ... 55
8. Tablet Cardioasetosal® ... 60
9. Spektrum Tumpang Tindih Baku Asetosal dan Cardioasetosal® ... 60
10. Tablet Farmasal® ... 65
11. Spektrum Tumpang Tindih Baku Asetosal dan Tablet Farmasal® ... 65
DAFTAR LAMPIRAN
1. Gambar Alat dan Bahan ... 43
2. Bagan Alir Prosedur Penelitian ... 45
3. Bagan Alir Prosedur Penelitian secara Keseluruhan... 47
4. Data Perhitungan Kalibrasi, Persamaan Regresi, dan Koefisien Korelasi Asetosal ... 48
5. Hasil Pengujian Asetosal 100 mg Merek Aptor® ... 50
6. Hasil Pengujian Asetosal 100 mg Merek Astika® ... 55
7. Hasil Pengujian Asetosal 100 mg Merek Cardioasetosal® ... 60
8. Hasil Pengujian Asetosal 100 mg Merek Farmasal® ... 65
9. Perhitungan Validasi Metode ... 70
10. Perhitungan Simpangan Baku, Batas Deteksi (LOD), dan Batas Kuantitasi (LOQ) Asetosal ... 79
11. Daftar Nilai Distribusi t ... 80
12. Sertifikat Pengujian Asetosal ... 81
BAB I PENDAHULUAN 1.1 Latar Belakang
Asetosal merupakan obat yang memiliki sifat analgesik, antiinflamasi, dan antipiretik. Asetosal digunakan untuk meredakan nyeri ringan sampai sedang, kondisi demam ringan, dan untuk gangguan inflamasi akut dan kronis seperti osteoartritis, artritis reumatoid, artritis idiopatik remaja, dan spondilitis ankilosa (Sweetman, 2009). Asetosal merupakan salah satu obat yang paling banyak digunakan didunia. Selain mempunyai harga yang relatif murah, asetosal mempunyai banyak kegunaan. Asetosal termasuk dalam golongan obat antiinflamasi non steroid yang memiliki efek analgesik, antipiretik dan antiinflamasi (Rahmadanita dan Sumarno, 2019).
Menurut UU Nomor 36 (2009), tentang Kesehatan pada pasal 105 ayat 1, Sediaan farmasi yang berupa obat dan bahan baku obat harus memenuhi syarat Farmakope Indonesia atau buku standar lainnya. Pemeriksaan kadar zat aktif merupakan persyaratan yang harus dipenuhi untuk menjamin kualitas sediaan obat, dan untuk melakukan penetapan kadar obat dibutuhkan suatu metode yang telah divalidasi (Uno, dkk., 2015).
Penetapan kadar tablet asetosal dilakukan dengan cara kromatografi cair kinerja tinggi. Sistem kromatograf cair kinerja tinggi dilengkapi dengan detektor 280 nm dan kolom berukuran 4,0 mm x 30 cm. Laju alir lebih kurang 2 mL per menit. Lakukan kromatografi terhadap larutan baku, rekam kromatogram dan ukur respons puncak seperti tertera pada prosedur, dan simpangan baku relatif tidak lebih dari 2,0%. (Ditdjen KAK, 2020).
Berdasarkan penelitan terdahulu yang telah dilakukan oleh Murtaza, dkk., (2011), penetapan kadar asetosal dilakukan secara spektrofotometri UV menunjukkan kadar asetosal dalam sediaan tablet yang diuji memliki kadar 99,16
% dan dinyatakan memenuhi syarat Farmakope Indonesia Edisi VI. Selanjutnya, berdasarkan penelitan terdahulu yang dilakukan Gandhimathi dan Ravi (2007), penetapan kadar asetosal menggunakan KCKT dengan kolom C18 dengan perbandingan fase gerak triethylamine (pH 4): acetonitril (25:75). Didapatkan
%Recovery sebesar 101,62% dinyatakan memenuhi syarat Farmakope Indonesia Edisi VI. Penetapan kadar menggunakan FTIR, antara lain penetapan kadar isoniazid (Gunasekaran, dkk., 2009), lorazepam (Konoz, dkk., 2012), azitromisin (Robaina, dkk., 2013), dan asam folat (Raouf dkk., 2014). Menurut Nugrahani, dkk (2019), pentepanan kadar Kafein, Paracetamol, dan Asetosal dalam tablet kombinasi dapat dilakukan menggunakan Spektrofotometri FTIR. Namun belum ada dijumpai penelitan penetapan kadar senyawa tunggal tablet menggunakan spektofotometri FTIR.
Menurut Mallah, dkk (2012), metode titrasi, spektrofotometri turunan, spektrofluororimetri, kromatografi cair, kromatografi cairan kinerja tinggi/
spektrofotometri massa membutuhkan prosedur yang panjang dan sejumlah pelarut organik yang berkontribusi terhadap tingginya biaya analisis dan menghasilkan limbah.
Salah satu keunggulan spektroskopi IR dengan spektroskopi lainnya yaitu karena sifatnya yang khas sebagai spektrum sidik jari, yang mana tidak ada dua buah senyawa atau sampel yang berbeda mempunyai spektrum yang sama (Rohman, 2014). Spektroskopi IR Juga memiliki sensitifitas yang lebih baik,
pengukuran yang lebih singkat, persiapan sampel sederhana, mudah dalam pengoperasian. Spektroskopi FTIR juga telah menjadi pilihan utama untuk meminimalisir isu lingkungan mengenai limbah kimia industri karena tidak memerlukan banyak pelarut (Mallah, dkk., 2012).
Pemeriksaan kadar sampel senyawa obat menggunakan daerah sidik jari bertujuan untuk menentukan kesesuaian sampel dengan standar Farmakope.
Spektroskopi Infra merah merupakan teknik analis yang sangat popular untuk analisis berbagai sampel, baik sampel produk farmasetik, makanan, cairan biologis, maupun sampel lingkungan dan untuk menentukan tingkat kesesuaian sampel dengan standar Farmakope bisa dilakukan dengan penyiapan sampel pada daerah sidik jari menggunakan KBr atau KCl (Gandjar dan Rohman, 2012).
Berdasarkan uraian diatas, peneliti memilih metode FTIR untuk penetapan kadar asetosal dalam sediaan tablet secara Spektrofotometri Fourier Transform Infra Red (FTIR) pada daerah sidik jari (1300–900 cm-1) menggunakan serbuk KBr (Kalium Bromida) sesuai persyaratan kadar yang ditetapkan pada Farmakope Indonesia edisi VI tahun 2020.
1.1 Perumusan Masalah
Berdasarkan uraian diatas, maka permasalahan pada penelitian ini dapat dirumuskan sebagai berikut:
a. Apakah daerah sidik jari pada asetosal dapat digunakan untuk penetapan kadar secara Spektrofotometri Fourier Transform Infra Red (FTIR)?
b. Apakah metode penetapan kadar dengan pelet KBr menggunakan daerah sidik jari secara Spektrofotometri Fourier Transform Infra Red (FTIR) memenuhi persyaratan validasi dengan parameter akurasi, presisi, batas deteksi dan batas kuantifikasi ?
c. Apakah kadar asetosal dalam sediaan tablet memenuhi persyaratan yang ditetapkan pada Farmakope Indonesia edisi VI tahun 2020?
1.2 Hipotesis
Berdasarkan perumusan masalah diatas, maka hipotesis dari penelitian ini sebagai berikut:
a. Daerah sidik jari pada asetosal dapat digunakan untuk penetapan kadar secara Spektrofotometri Fourier Transform Infra Red (FTIR).
b. Metode penetapan kadar dengan pelet KBr menggunakan daerah sidik jari secara Spektrofotometri Fourier Transform Infra Red (FTIR) memenuhi persyaratan validasi dengan parameter akurasi, presisi, batas deteksi dan batas kuantifikasi ?
c. Kadar asetosal dalam sediaan tablet memenuhi persyaratan kadar yang ditetapkan pada Farmakope Indonesia edisi VI tahun 2020.
1.3 Tujuan Penelitian
Berdasarkan hipotesis di atas, maka tujuan dilakukannya penelitian ini adalah:
a. Untuk mengetahui bahwa daerah sidik jari pada asetosal dapat digunakan sebagai penetapan kadar secara Spektrofotometri Fourier Transform Infra Red (FTIR).
b. Untuk mengetahui bahwa metode penetapan kadar dengan pelet KBr menggunakan daerah sidik jari secara Spektrofotometri Fourier Transform Infra Red (FTIR) memenuhi persyaratan validasi dengan parameter akurasi, presisi, batas deteksi dan batas kuantifikasi ?
c. Untuk mengetahui kesesuaian hasil kadar asetosal dalam sediaan tablet yang diperoleh dengan persyaratan kadar yang ditetapkan pada Farmakope Indonesia edisi VI tahun 2020.
1.4 Manfaat Penelitian
Berdasarkan tujuan penelitian di atas, maka manfaat penelitian ini adalah : a. Untuk memberikan informasi bahwa Spektrofotometri Fourier
Transform Infra Red (FTIR) dapat digunakan sebagai salah satu penetapan kadar asetosal.
b. Penelitian ini diharapkan dapat memberikan kontribusi untuk industri farmasi dan Badan Pengawas Obat dan Makanan (BPOM).
BAB II
TINJAUAN PUSTAKA 2.1 Asetosal
2.1.1 Sifat Fisika Kimia Rumus Struktur :
Gambar 2.1 Struktur Kimia Asetosal
Berdasarkan Ditjend KAK (2020), Uraian tentang asetosal adalah sebagai berikut:
Nama Kimia : Asam asetilsalisilat (50-78-2) Rumus Molekul : 𝐶9𝐻8𝑂6
Berat Molekul : 180,16
Persyaratan : Tablet Asam Asetilsalisilat mengandung Asam Asetilsalisilat tidak kurang dari 90,0 % dan tidak lebih dari 110% dari jumlah yang tertera pada etiket.
Pemerian : Hablur, seperti jarum atau lempengan tersusun, atau sebuk hablur; putih; tidak berbau atau berbau lemah.
Kelarutan : Sukar larut dalam air; mudah larut dalam etanol;
larut dalam kloroform dan dalam eter; agak sukar
larut dalam eter mutlak.
Baku Pembanding : Asam Asetilsalisilat BPFI; lakukan pengeringan diatas silica gel P selama 5 jam, sebelum digunakan.
Simpan dalam wadah tertutup rapat.
2.1.2 Farmakologi 2.1.3 Farmakokinetika
Asetosal dan salisilat lainnya diserap dengan cepat dari saluran pencernaan saat diminum tetapi penyerapan setelah dosis rektal kurang dapat diandalkan.
Asetosal dan salisilat lainnya juga bisa diserap melalui kulit. Setelah dosis oral, absorpsi asetosal yang tidak terionisasi terjadi di lambung dan usus. Beberapa asetosal dihidrolisis menjadi salisilat di dinding usus. Setelah diserap, asetosal dengan cepat diubah menjadi salisilat, tetapi selama 20 menit pertama setelah dosis oral asetosal adalah bentuk obat dalam plasma. Asetosal 80 sampai 90% terikat pada protein plasma dan didistribusikan secara luas; volume distribusinya dilaporkan 170 mL / kg pada orang dewasa. Saat konsentrasi obat dalam plasma meningkat, tempat pengikatan pada protein menjadi jenuh dan volume distribusinya meningkat. Baik asetosal dan salisilat memiliki aktivitas farmakologis meskipun hanya asetosal yang memiliki efek anti-platelet. Salisilat terikat secara luas pada protein plasma dan dengan cepat didistribusikan ke seluruh bagian tubuh. Salisilat muncul dalam ASI dan melewati plasenta (Sweetman, 2009)
Salisilat terutama dieliminasi oleh metabolisme hati; metabolitnya termasuk asam salisilat, glukuronida fenolik salisil, asil glukuronida salisilat, asam gentisat, dan asam gentisurat. Pembentukan metabolit utama, asam salisilat dan glukuronida fenolik salisil, mudah jenuh dan mengikuti kinetika MichaelisMenten; rute
metabolisme lainnya adalah proses orde pertama. Akibatnya, konsentrasi plasma- salisilat meningkat secara tidak proporsional dengan dosis. Setelah dosis asetosal 325 mg, eliminasi adalah proses urutan pertama dan waktu paruh salisilat plasma sekitar 2 sampai 3 jam; pada dosis asetosal tinggi, waktu paruh meningkat menjadi 15 sampai 30 jam. Salisilat juga diekskresikan tidak berubah dalam urin; jumlah yang dikeluarkan melalui jalur ini meningkat dengan peningkatan dosis dan juga tergantung pada pH urin, sekitar 30% dosis diekskresikan dalam urin alkali dibandingkan dengan 2% dosis dalam urin asam. Ekskresi ginjal melibatkan filtrasi glomerulus, sekresi tubulus ginjal aktif, dan reabsorpsi tubular pasif. Salisilat dihilangkan dengan hemodialysis (Sweetman, 2009)
2.2 Tablet
Tablet adalah sediaan padat mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatan, dapat digolongkan sebagai tablet cetak dan tablet kempa. Tablet dapat dibuat dalam berbagai ukuran, bentuk dan penandaan, permukaan tergantung pada desain cetakan (Ditjen KAK, 2020).
2.3 Spektrofotometri 2.3.1 Definisi
Spektroskopi Infra merah merupakan teknik analisis yang sangat popular untuk analisis berbagai jenis sampel, baik sampel produk farmasetik, makanan, cairan biologis, maupun sampel lingkungan. Instrument infra merah mulai tersedia dipasaran pada tahun 1940-an. Spektroskopi infra merah merupakan jenis spektroskopi yang bersifat: (1) spesifik terhadap suatu molekul; yang akan memberikan informasi yang menyatu (inheren) tentang gugus-gugus fungsional yang ada dalam molekul, termasuk macamnya, interaksi-interaksinya dan orientasi-
orientasinya; (2) selektif terhadap isomer, yang disebabkan oleh adanya kisaran daerah sidik jari (fingerprint); (3) bersifat kuantitatif dan non-destruktif (tidak merusak) bahkan terhadap senyawa-senyawa yang sangat labil dengan kisaran kerja yang utama antara 0,1-100% dan (4) bersifat universal, dalam persyaratan pengambilan sampelnya, baik sampel padat, cair, gas, sampel antara padat dan cair atau gas, sampel permukaan, maupun sampel ruahan (bulk) (Gandjar dan Rohman, 2012).
Tujuan analisis kuantitatif pada Spektorskopi Infra Merah adalah untuk menentukan konsentrasi analit dalam suatu sampel. Tinggi puncak atau luas puncak suatu spektrum IR dalam bentuk absorbansi secara langsung berhubungan dengan konsentrasinya. Analisis kuantitatif dilakukan dengan membuat rajah (plot) hubungan antara konsentrasi analit dengan absorbansinya yang disebut kalibrasi.
Untuk membuat hubungan antara absorbansi dengan konsentrasi, spektra IR analit dengan konsentrasi tertentu yang telah diketahui, yang disebut dengan standar disiapkan (Gandjar dan Rohman, 2012)..
2.3.2 Klasifikasi Spektrofotometri a. Spektrofotometri UV-VIS
Spektrofotometer UV-Vis adalah pengukuran bilangan gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV-Vis biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini. Tetapi spektrum
ini sangat berguna untuk pengukuran secara kuantitatif. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada bilangan gelombang tertentu dengan menggunakan hukum Lambert-Beer (Dachriyanus, 2004)
b. Spektroskopi Infra Merah
Spektroskopi infra merah (infrared, untuk selanjutnya disingkat IR) merupakan spektroskopi vibrasional (getaran). Spektrum IR merupakan jenis spektrum yang bersifat: (1) spesifik terhadap suatu molekul; yang akan memberikan informasi yang menyatu (inheren) tentang gugus-gugus fungsional yang ada dalam molekul, termasuk jenis dan interaksi-interaksinya; (2) sidik jari (fingerprint); (3) bersifat kuantitatif, yang mana intensitas puncak berkorelasi dengan konsentrasi, (4) non-destruktif (tidak merusak), yang berarti bahwa pada jenis penanganan sampel tertentu seperti dengan attenuated total reflectance (ATR), sampel yang dianalisis dapat dianalisis dengan metode analisis yang lain, dan (5) bersifat universal, baik sampel padat, cair, gas, sampel antara padat dan cair atau gas (Rohman, 2014).
c. Spektrometer massa
Jika suatu benda yang bergerak lurus diberi tenaga dari luar, maka gerakannya tidak akan lurus lagi seperti biasanya karena akan terjadi defleksi atau perubahan arah. Besarnya perubahan arah ini tergantung dari massa benda yang bergerak itu. Jika kita mengetahui besar benda yang bergerak, kecepatannya, dan jumlah tenaga luar yang diberikan; maka kita bisa menghitung massa benda tersebut. Makin besar perubahan arah gerak, makin ringan benda tersebut. Prinsip ini bisa diaplikasikan dalam menentukan massa suatu molekul.
Gerakan suatu atom atau molekul bisa didefleksikan oleh medan magnet.
Agar bisa dipengaruhi oleh medan magnet maka atom atau molekul ini harus diubah menjadi bentuk ion. Partikel yang bermuatan dapat dipengaruhi oleh medan magnet sedangkan yang tidak bermuatan tidak dipengaruhi. Spektrometer massa pada umumnya digunakan untuk: 1. Menentukan massa suatu molekul. 2. Menentukan rumus molekul dengan menggunakan Spektrum Massa Beresolusi Tinggi (High Resolution Mass Spectra) 3. Mengetahui informasi dari struktur dengan melihat pola fragmentasinya (Dachriyanus, 2004).
d. Spektroskopi Resonansi Magnet Inti / Spektroskopi H1-NMR
Spektroskopi H1-NMR paling banyak digunakan oleh kimiawan organic.
Spektroskopi ini didasarkan pada kenyataan bahwa setiap kelompok proton (H) dalam molekul organic akan beresonansi pada frekwensi yang tidak identic atau beresonansi pada frekwensi yang spesifik. Hal ini disebabkan kelompok proton suatu molekul organic dikelilingi electron yang berbeda (lingkungan elektroniknya berbeda). Makin besar kerapatan electron yang mengelilingi inti maka makin besar pula medan magnet yang digunakan. Karena setiap atom H (proton) suatu molekul organic mempunyai lingkungan elektronik (kimia) yang berbeda maka akan menyebabkan frekwensi resonansi yang berbeda (Sitorus, 2017).
e. Spektroskoskopi Resonansi Inti Karbon 13C RMI
Seperti diketahui bahwa spektroskopi RMI tidak hanya terbatas terhadap inti hidrogen. Setiap inti yang memiliki jumlah proton dan atau neutron yang ganjil bisa diukur dengan spektroskopi RMI. Nukleus yang biasa dipakai adalah karbon.
Karena karbon memiliki nomor proton yang genap maka yang digunakan adalah isotopnya, yaitu karbon-13. Pada spektrum 1H RMI, sinyal yang dilihat berasal dari
hidrogen yang hadir pada karbon tertentu dan pola spin kopling tergantung pada atom hidrogen yang terletak pada karbon tetangga (H-C-C-H). Pada spektrum RMI karbon, sinyal karbon dapat dilihat secara langsung. Spektrometer resonansi magnet inti karbon pada umumnya digunakan untuk: 1. Menentukan jumlah karbon yang memiliki lingkungan kimia yang sama pada suatu senyawa organik 2. Mengetahui informasi mengenai struktur suatu senyawa organic (Dachriyanus, 2004).
f. Spektrofotometri emisi nyala dan spektrofotometri absorbsi atom
Spektroskopi serapan atom (SSA) dan spektroskopi emisi atom (SEA), disebut juga dengan fotometri nyala, merupakan 2 metode pengukuran analitik yang mendasarkan pada proses eksitasi dan emisi. Pada analisis kuantitatif, metode ini digunakan untuk mengukur kurang lebih 70 elemen (logam atau non-logam).
Dengan beberapa model instrumen fotometer nyala ini, dimungkinkan untuk melakukan pengukuran dengan kedua teknik ini (serapan atom dan emisi atom), meskipun prinsipnya berbeda. Dalam SSA, konsentrasi dapat diperoleh dari pengukuran serapan sinar oleh atom yang tertinggal dalam keadaan dasar ketika atom disinari dengan sumber sinar yang menyebabkan eksitasi yang sesuai. Dalam SEA, konsentrasi dapat diperoleh dari intensitas radiasi yang diemisikan oleh sebagian atom yang telah melewati keadaan tereksitasi (Gandjar dan Rohman, 2012)
2.4 Spektrofotometer FTIR
Spektofotometer FTIR didasarkan pada ide adanya interforensi radiasi antara 2 berkas sinar untuk menghasilkan suatu interferogram. Inteferogram merupakan sinyal yang dihasilkan sebagai fungsi perubahan pathlength antara 2 berkas sinyal.
Dua domain (jarak dan frekuensi) dapat ditukar balikkan dengan metode matematik
yang disebut tranformasi Fourier (Rohman, 2014).
Komponen – komponen utama dalam FTIR :
Gambar 2.2 Komponen utama dalam FT-IR (Sumber: Rohman, 2014)
a. Sumber sinar
Sumber cahaya yang umum digunakan adalah batang yang dipanaskan oleh listrik berupa Nerst Glower yang merupakan campuran logam: Zr, Y, Er dan lain-lain;
Globar yang merupakan silikon karbida: dan berbagai bahan keramik lainnya (Sitrous, 2017).
b. Interferometer Michelson
Tujuan interferometer adalah untuk membawa berkas sinar, lalu memecahnya ke dalam dua berkas sinar, dan membuat salah satu berkas sinar berjalan dengan jarak yang berbeda dengan yang lain. Interferometer Michelson mempunyai 2 buah cermin, yakni cermin statik/tetap (tidak bergerak) dan cermin yang selalu bergerak. Diantara 2 cermin ini terdapat pemecah berkas sinar (beam splitter), yang dirancang untuk mentransmisikan setengah radiasi yang mengenainya dan merefleksikan atau memantulkan yang setengahnya. Berkas sinar yang muncul dari interferometer pada sudut 90o ke berkas sinar yang ditransmisikan merupakan berkas sinar yang terdeteksi dalam spektrofotometer FTIR (Gandjar dan Rohman, 2012).
Sumber
Sinar Interferometer Sampel Detektor
Pengubah analog ke
digital Komputer
c. Detektor
Ada 2 jenis detektor yang umum digunakan pada spektrofotometer FTIR.
Detektor normal pada penggunaan rutin adalah alat piroelektrik yang didalamnya terdapat deuterium triglisin sulfat (DTGS) pada jendela alkali halida yang tahan terhadap panas. Untuk pekerjaan yang memerlukan sensistifitas lebih, dapat digunakan detektor merkuri kadmium tellurida (MCT). Untuk pengukuran spektra IR di daerah dekat (NIR), detektor yang digunakan adalah fotokonduktor timbal sulfida (Rohman, 2014).
d. Komputer
Komputer akan mengendalikan instrumen, misalkan dalam hal kecepatan, batas, serta awal dan akhir scanning. Komputer akan membaca spektra dari instrumen begitu spektrum di-scanning. Hal ini bermakna bahwa spektrum telah digitalisasikan. Komputer juga dapat digunakan untuk memanipulasi spektrum, misalkan untuk melakukan derivatisasi, pengurangan, dan penjumlahan spektra, serta untuk overlay antar spektra (Rohman, 2014).
Spektrofotometer FTIR merupakan instrumen single beam. Pengukuran background dilakukan sebelum pengukuran sampel. Pengukuran background ini merupakan pengukuran spektrum lingkungan, yang terdiri dari gas yang mampu mengabsorpsi sinar inframerah seperti gas karbon dioksida dan uap air. Perangkat lunak komputer akan mengurangi spektra hasil pengukuran dengan spektra background secara otomatis untuk menghasilkan spektra sampel yang dianalisis (Rohman, 2014).
Ada beberapa keunggulan spektrofotometer FTIR dibandingkan spektrofotometer dispersif, dua keuntungan utama adalah: (1) keuntungan Felgett (multiplex) disebabkan karena adanya peningkatan pengukuran rasio signal to noise (SNR), dan (2) keuntungan Jacquinot adalah spektrofotometer FTIR tidak memerlukan penggunaan celah monokromator dimana output sumber total dapat dilewatkan secara terus menerus sehingga menghasilkan energi yang sampai ke detektor cukup tinggi dan meningkatkan signal to noise (SNR) (Rohman, 2014).
2.5 Vibrasi Molekul Inframerah
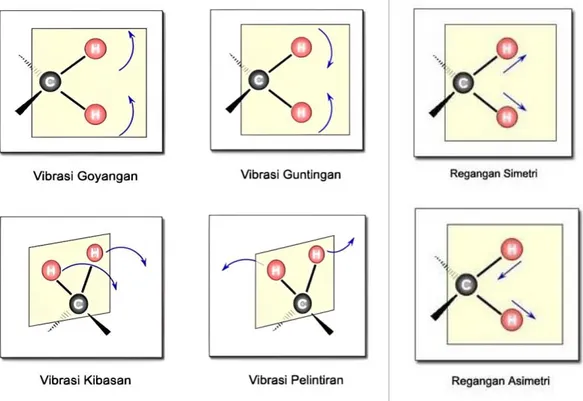
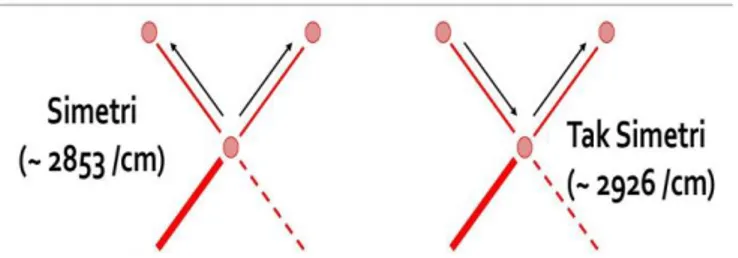
Bila suatu molekul dilewatkan sinar pada panjang daerah IR, maka atom-atom yang terikat dalam molekul mengalami vibrasi (Bergetar). Vibrasi molekul terdiri atas vibrasi ulur dan vibrasi tekuk. Vibrasi ulur (Strecthing) terjadi antara dua atom sepanjang sumbu ikatan (Gerakan Simetri dan anti simetri), sedangkan vibrasi tekuk terjadi akibat berubahnya sudut antara dua ikatan (Khaldun, 2018).
Gambar 2.3 Jenis-jenis Vibrasi Molekul
Vibrasi tekuk hanya terjadi pada pada molekul yang mempunyai lebih dari dua atom. Vibrasi ini terdiri atas scissoring, rocking, wagging, dan twisting. Bilangan gelombang setiap gugus fungsi dalam molekul bersifat khas, oleh sebab itu dapat dipakai sebagai dasar analisis kualitatif untuk mengidentifikasinya. Secara umum, daerah IR tengah (4000-400 cm-1) dapat dikelompokkan menjadi empat daerah penting yang terdiri dari (1) vibrasi ulur ikatan tunggal (Strecthing single bond), (2) ikatan rangkap tiga (triple bonds), (3) ikatan ganda (double bonds), dan daerah sidik jari (fingerprint region) (Khaldun, 2018).
Gambar 2.4 Daerah fundamental pada spektrum infra merah
Setiap frekuensi cahaya, termasuk inframerah, mempunyai energi tertentu.
Apabila frekuensi cahaya yang dilewatkan diserap oleh senyawa yang diinvestigasi, berarti energi tersebut ditransfer pada senyawa. Besarnya energi yang diserap senyawa akan mempengaruhi kondisi molekul senyawa tersebut. Energi radiasi inframerah berhubungan dengan energi yang dibutuhkan untuk terjadinya vibrasi dari suatu ikatan (Dachriyanus, 2009).
a) Peregangan Ikatan (Bond Stretching)
Pada suatu ikatan kovalen, atom tidak terikat dengan suatu hubungan yang rigid. Dua atom yang berhubungan satu sama lain disebabkan karena kedua inti atom terikat pada pasangan elektron yang sama. Kedua inti ini bisa mengalami vibrasi kedepan-kebelakang dan atau kesamping-keatas satu sama lain (Dachriyanus, 2009).
Gambar 2.5 Vibrasi Bond Strecthing
Energi yang terlibat pada vibrasi tergantung pada panjang ikatan dan massa atom-atom yang saling berikatan. Ini berarti bahwa setiap ikatan yang berbeda akan tervibrasi dengan cara yang berbeda dan jumlah energi yang berbeda pula. Pada dasarnya, ikatan-ikatan akan bervibrasi sepanjang waktu. Apabila ikatan tersebut diberi sejumlah energi yang tepat sama dengan besarnya energi pada ikatan maka energi ini akan menyebabkan vibrasi pada keadaan yang lebih tinggi. Jumlah energi yang dibutuhkan bervariasi pada setiap ikatan sehingga setiap ikatan akan menyerap pada frekuensi yang berbeda- beda pada radiasi inframerah (Dachriyanus, 2009).
b) Pengerutan Ikatan (Bond Bending)
Seperti halnya peregangan, ikatan juga bisa bergerak naik-turun (bend).
Gambar 2.6 Vibrasi Bond Bending
Ikatan bisa bervibrasi naik-turun sepanjang waktu dan jika diberikan energi yang tepat pada ikatan ini maka vibrasinya akan semakin kuat. Naik turunnya suatu ikatan melibatkan sejumlah energi sehingga setiap ikatan akan menyerap energi pada frekuensi yang berbedabeda dari radiasi inframerah (Dachriyanus, 2009).
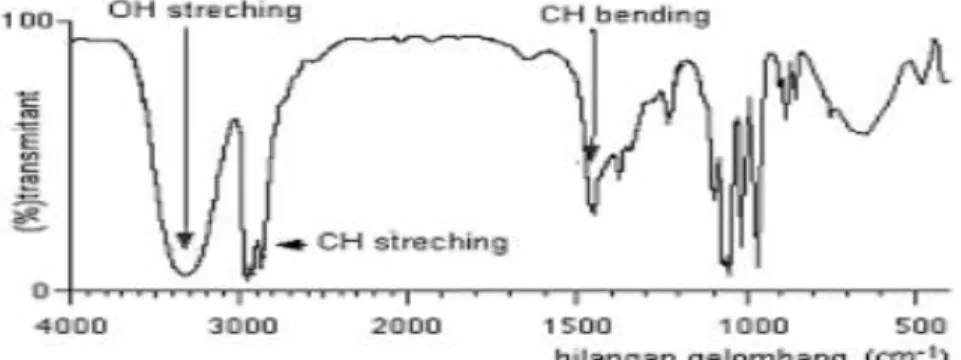
Gambar 2.7 Spektrum inframerah propanol (CH3CH2CH2OH)
Pada spektrum diatas, terlihat adanya tiga jenis serapan yang disebabkan karena adanya vibrasi ikatan (Dachriyanus, 2009).
2.6 Pengolahan Sampel pada FTIR
Teknik transmisi berdasarkan jenis sampel yang akan dianalisis sebagai berikut:
a. Spektra transmisi sampel padat
Ada tiga cara umum untuk mengolah sampel yang berupa padatan, yaitu:
(1) dengan lempeng kalium bromida, (2) “mull”, dan (3) lapisan tipis. (1) Pelet KBr digunakan dengan cara menumbuk cuplikan (0,1-2,0%) lalu ditekan dengan
tekanan tinggi sampai membentuk pelet KBr yang transparan dalam cetakan, (2) Mull atau pasta digunakan dengan mencampur cuplikan dengan minyak pasta kemudian dilapis pada dua keping NaCl, (3) Lapisan Tipis digunakan dengan melarutkan padatan dalam pelarut yang mudah menguap, lalu diteteskan pada pelat NaCl. Bila pelarut sudah menguap maka akan diperoleh lapisan tipis pada pelat (Sitorus, 2017).
b. Spektra transmisi cairan
Sebelum memperoleh spektrum IR sampel dalam larutan, maka pelarut yang sesuai harus dipilih. Faktor-faktor yang harus diperhatikan ketika memilih pelarut, yakni: pelarut harus melarutkan sampel, pelarut yang digunakan sedapat mungkin non-polar untuk meminimalkan interaksi solut-pelarut, serta pelarut tersebut tidak menyerap spektrum IR secara kuat. Sebanyak 1-5% larutan dimasukkan dalam sel larutan yang mempunyai jendela transparan dengan alat pengatur ketebalan. Tebal sel biasanya antara 0,1-1,0 mm. Selain itu, dengan mengatur konsentrasi dan tebal sel maka bentuk dan pita serapan yang penting dapat ditonjolkan dengan jelas (Rohman, 2014).
c. Spektra transmisi gas
Untuk pengolahan sampel berbentuk gas, sampel dimasukkan pada sel khusus yang menghadap langsung pada sumber sinar IR. Dalam bentuk modifikasi, cermin internal digunakan untuk memantulkan berkas sinar berulangkali untuk menaikkan sensitivitas (Sastrohamidjojo, 2013).
Teknik-teknik reflektans (pantulan) dapat digunakan untuk sampel-sampel yang susah dianalisis dengan teknik transmitans. Metode pantulan dapat dibagi menjadi 2 kategori, yaitu: (1) pengukuran pantulan internal dengan menggunakan sel
attenuated total reflectance (ATR) yang bersinggungan (kontak) langsung dengan sampel; dan (2) pengukuran pantulan eksternal yang melibatkan berkas sinar IR yang dipantulkan secara langsung dari permukaan sampel (Rohman, 2014).
2.7 Interpretasi Spektrum Inframerah
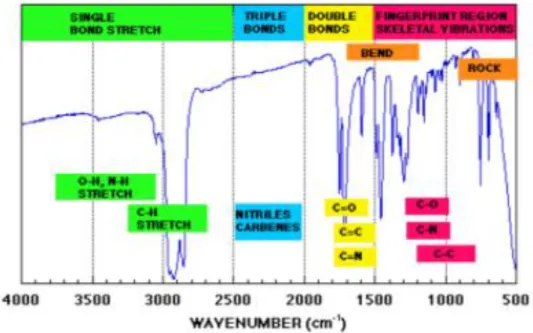
Berdasarkan Rohman (2014), spektrum daerah Inframerah tengah dapat dibagi menjadi 4 daerah, dan sifat frekuensi gugus secara umum dapat ditentukan dengan daerah-daerah serapan, yang mana gugus-gugus tersebut terdapat didalamnya.
Daerah-daerah tersebut adalah sebagai berikut: daerah ulur X–H (4000-2500 cm-1), yang mana X berupa O, N dan C daerah ikatan rangkap tiga (2500-2000 cm-1), daerah ikatan rangkap dua (2000-1500 cm-1) dan daerah sidik jari (1500-600 cm1).
Secara visual daerah serapan gugus-gugus fungsional yang utama dapat dilihat pada Gambar 2.3 berikut:
Frekuensi (cm-1)
4000 2500 2000 1800 1650 1550 650
O–H C–H N–H
C≡C C≡N X=C=Y (C, O, N, S)
Sangat sedikit pita
C=O C=N
C=C N=O
C–Cl C–O C–N C–C N=O 2,5 4,0 5,0 5,5 6,1 6,5 15,4
Panjang gelombang (mikron)
Gambar 2.8 Daerah-daerah perkiraan frekuensi vibrasi yang mana berbagai jenis ikatan menyerap sinar IR (disini hanya vibrasi ulur; sementara berbagai jenis vibrasi tekuk dihilangkan untuk membuat lebih jelas) (Sumber: Rohman, 2014)
Spektroskopi IR memiliki salah satu keunggulan dengan spektroskopi lainnya yaitu karena sifatnya sebagai spektrum sidik jari, yang mana tidak ada dua buah senyawa atau sampel yang berbeda mempunyai spektrum yang sama (Rohman, 2014). Menurut Sitorus, (2017) serapan sidik jari pada daerah sekitar 1200-500 cm-1 memiliki molekul dan serapan yang sangat kompleks dan biasanya digunakan untuk mengkonfirmasi apakah gugus fungsinya ada. Misalkan bila molekul mempunyai gugus fungsional hidroksi (-OH) pada sekitar 3400 an cm-1 biasanya intentitasnya kuat dengan puncak melebar, diperkuat serapan C-O tunggal pada sekitar 1200 cm-1 yang tajam dan intensitasnya kuat.
Sampel yang disiapkan untuk penentuan sidik jari bertujuan untuk meningkatkan kesesuaian sampel dengan standar farmakope, penyiapan sampel untuk tujuan ini dilakukan dalam pelet KBr atau KCl (Gandjar dan Rohman, 2012).
2.8 Interpretasi Spektrum Inframerah Asetosal
Menurut Moffat dkk., (2011) Asetosal atau aspirina mempunyai bilangan gelombang spesifik, yaitu 1183 cm-1, 1688 cm-1, 1305 cm-1, 1755 cm-1, 925 cm-1, 1219 cm-1. Daerah sidik jari berada dalam daerah 1300-600 cm-1 daerah yang memasuki rentang tersebut yaitu 925 cm-1, 1183 cm-1, 1219 cm-1 dan 1305 cm-1. 2.9 Validasi Metode
Validasi metode merupakan suatu tahapan penting dalam penjaminan mutu analisis kuantitatif. Validasi metode menurut United States Pharmacopeia (USP) dilakukan untuk menjamin bahwa metode analisis bersifat akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis. Validasi metode analisis ditujukan untuk menjamin bahwa metode analisis memenuhi spesifikasi yang dapat diterima sesuai dengan tujuan yang diharapkan (Rohman, 2019).
2.8.1 Akurasi
Akurasi adalah kedekatan antara nilai terukur (measured value) dengan nilai sebenarnya yang diterima (accepted true value), baik nilai konvensi, nilai sebenarnya, maupun nilai rujukan. Kriteria keberterimaan akurasi dengan 3 replikasi untuk pengujian ±2% (98,0%-102,0%) (Rohman, 2019).
2.8.2. Presisi
Presisi diukur sebagai simpangan baku atau simpangan baku relative berdasarkan penelitian yang dilakukan terhadap replikasi sampel yang diambil dari campuran yang homogen. Presisi dapat menghasilkan nilai rata-rata yang sangat dekat dengan nilai yang sebenarnya, simpangan baku relatif atau disebut juga Relatif Standard Deviasi (RSD) digunakan sebagai parameter ukur dari presisi (Arikalang dkk., 2018).
2.8.3. Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah nilai parameter, yaitu konsentrasi analit terendah yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harmita, 2004).
Batas deteksi dapat dihitung dengan rumus sebagai berikut (Harmita, 2004):
Batas deteksi (LOD) = 3 ×𝑆𝐵
𝑠𝑙𝑜𝑝𝑒
Menurut Harmita (2004), batas kuantitasi adalah jumlah analit terkecil dalam sam pel yang masih dapat diukur dalam kondisi percobaan yang sama dan memenuhi kriteria cermat dan seksama.
Batas kuantitasi (LOQ) = 10 ×𝑆𝐵
𝑠𝑙𝑜𝑝𝑒
Penentuan batas deteksi dan batas kuantifikasi dilaku kan berdasarkan kemiringan (slope) kurva kalibrasi (Arikalang dkk., 2018).
2.8.4. Linearitas
Linieritas merupakan kemampuan suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit pada kisaran yang diberikan. Pada uji linieritas paling tidak 5 konsentrasi yang berbeda digunakan pada pengujian (Rohman, 2019).
Persamaan garis yang digunakan pada kurva kalibrasi diperoleh dari persamaan y = ax + b. Persamaan ini yang akan menghasilkan koefisien korelasi (r). Koefisien korelasi inilah yang digunakan untuk parameter linearitas (Ryanto, 2016).
BAB III
METODOLOGI PENELITIAN 3.1 Jenis Penelitian
Penelitian ini termasuk jenis penelitian deskriptif dengan metode Spektrofotometri Fourier Transform Infra Red (FTIR) terhadap penetapan kadar asetosal yang terkandung dalam sediaan tablet, dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.2 Waktu dan Tempat Penelitian
Penelitian dilaksanakan ada bulan Februari sampai Juni 2021 di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.3 Alat–alat
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometer inframerah (IRPrestige-21 Shimadzu) yang dilengkapi dengan Komputer dan Software IRsolution, software Minitab versi 18.2.4.4., Neraca Analitik (Sartorius), Lumpang dan Alu, serta alat-alat lainnya yang diperlukan dalam penyiapan sampel.
3.4 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah Baku Asetosal (BPFI), Kalium Bromida (KBr), tablet Aptor® (PT. Nicholas), dan tablet Astika® (PT.Ikapharmindo Putramas), tablet Cardioasetosal® (PT. Bayer Healthcare), dan tablet Farmasal® (PT. Fahrenheit).
3.5 Pengambilan Sampel
Pengambilan sampel secara purposif yaitu tanpa membandingkan antara satu tempat dengan tempat yang lain, karena tempat pengambilan sampel dianggap homogen.
Menurut Sudjana (2002), sampling purposif dikenal juga sebagai sampling pertimbangan peneliti.
3.6 Prosedur Penelitian
3.6.1 Pembuatan Spektrum Serapan Baku Asetosal
Ditimbang baku Asetosal (BPFI) sebanyak 30 mg dicukupkan dengan KBr hingga 300 mg dan digerus sampai homogen. Kemudian diukur serapan pada bilangan gelombang 4000-400 𝑐𝑚−1
3.6.2 Pembuatan Kurva Kalibrasi
Kurva kalibrasi dibuat dari enam standar internal yang berbeda konsentrasi dalam kisaran 1:10 b / b sebanyak 18 mg, 24 mg, 30 mg, 36 mg, 42 mg dan masing- masing dicukupkan dengan KBr hingga 300 mg dan digerus untuk mengurangi ukuran partikelnya. Inframerah spektra dari setiap pengukuran dikonversi ke spektrum turunan pertama. Absorbansi dari setiap kalibrasi standar diukur dalam range bilangan gelombang 1755 cm-1, 1688 cm-1, 1305 cm-1, 1219 cm-1, 1183 cm-1 dan 925 cm-1.
3.6.3 Penetapan Kadar Tablet Asetosal
Ditimbang 20 tablet, kemudian digerus dalam lumpang sampai halus dan homogen. Ditimbang seksama sejumlah serbuk setara 30 mg Asetosal dan dicukupkan dengan KBr sampai 300 mg dan dihomogenkan. Diukur serapannya pada bilangan gelombang 4000- 400 𝑐𝑚−1.
Konsentrasi sampel (X) dapat dihitung dengan mensubstitusikan vibrasi yang diperoleh pada (Y) dari persamaan regresi: Y = aX + b, sehingga diperoleh X dan ini disebut dengan konsentrasi perolehan.
3.7 Validasi Metode 3.7.1 Linearitas
Baku asetosal yang telah dibuat, diukur absorbansinya pada bilangan gelombang yang telah ditentukan. Nilai absorbansi ditentukan dengan menggunakan persam-aan regresi yang dioperasikan pada data konsentrasi dan absorbansi masing-masing komponen pada setiap bilangan gelombang pengukuran.
Dari persamaan regresi yang diperoleh : Y = aX + b Keterangan:
Y = Absorbansi
a = Koefisien regresi yang menunjukkan nilai luas area X = Kadar (mg/mL)
b = Konstanta 3.7.2 Akurasi
Menurut Harmita (2004), uji akurasi dilakukan dengan metode penambahan baku (Standart Addition Method), yaitu dengan membuat konsentrasi analit sampel pada tiga rentang spesifik, yakni: 80%, 100% dan 120% dihitung dari kesetaraan penimbangan pada penetapan kadar sampel, masing-masing rentang spesifik terdiri dari tiga kali pengulangan yang mengandung 70% analit asetosal dari tablet yang dianalisis dan 30% penambahan baku. Pada metode penambahan bahan baku, sejumlah sampel yang dianalisis ditambah analit dengan konsentrasi yang
diperlukan dari kadar analit yang diperkirakan, dicampur dan dianalisis kembali.
Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya. Kadar yang diperoleh dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya:
%Perolehan Kembali = CF − CA
C*A × 100%
Keterangan:
CF = Konsentrasi perolehan sampel setelah penambahan baku CA = Konsentrasi teoritis sampel sebelum penambahan baku C*A = Konsentrasi baku yang ditambahkan
3.7.3 Presisi
Menurut Harmita (2004), penentuan presisi berdasarkan nilai Relative Standard Deviation (RSD) dengan persyaratan simpangan baku relatif bernilai kurang dari 2% dan dirumuskan sebagai:
RSD =SD
X̅ 100%
Keterangan:
RSD = Standar deviasi relatif (%) SD = Standar deviasi
X̅= Kadar rata-rata zat dalam sampel
3.7.4 Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Menurut Harmita (2004), berdasarkan absorbansi pada bilangan gelombang analisis dilakukan pula perhitungan LOD dan LOQ.
SY
X= SB = √∑(Y − Yi)2
n−2
LOD = 3 SY
X/ Slope
LOQ = 10 SY
X / Slope Keterangan:
SY
X= SB = Simpangan baku
Slope = a (pada persamaan garis Y = aX + b) 3.7.5 Analisis Data Penetapan Kadar secara Statistik
Data perhitungan kadar asetosal dianalisis secara statistik dengan menggunakan uji ttabel.
Menurut Sudjana (2002), rumus yang digunakan adalah:
SD = √∑(X −X̅)2
n − 1
Untuk mencari thitung digunakan rumus:
thitung = | X −X̅
SD √n⁄ |
Data diterima jika thitung< ttabel pada taraf kepercayaan 99% dengan nilai α = 0,01.
Keterangan:
SD = Standar deviasi/simpangan baku x = Kadar dalam satu perlakuan X̅ = Kadar rata-rata dalam satu sampel n = Jumlah pengulangan
α = Tingkat kepercayaan
Menurut Sudjana (2002), untuk menghitung kadar Asetosal sebenarnya dapat digunakan rumus:
μ= X̅ ±ttabel SD
√n
Keterangan:
SD = Standar deviasi/simpangan baku X̅ = Kadar rata-rata dalam satu sampel n = Jumlah pengulangan
t =Harga tabel sesuai dengan derajat kepercayaan
BAB IV
HASIL DAN PEMBAHASAN 4.1 Penentuan Spektrum Serapan Baku Asetosal
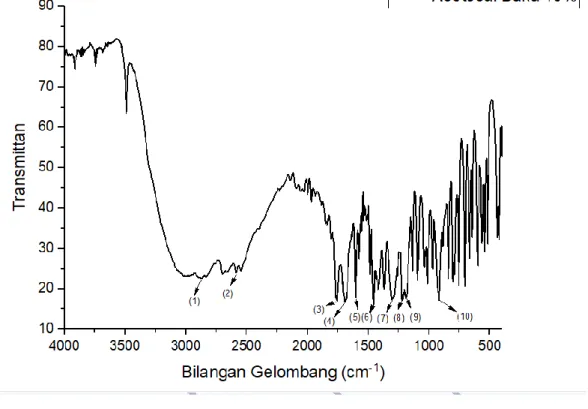
Penelitian ini diawali dengan melakukan pengukuran serapan baku pada konsentrasi 10%. Penentuan spektrum serapan baku dilakukan pada bilangan gelombang 4000-500 cm-1. Pengukuran spektrum baku asetosal dilakukan dengan menentukan spektrum vibrasi asetosal konsentrasi 10% dalam KBr. Tampilan puncak gugus fungsional asetosal konsentrasi 10% dapat dilihat pada Gambar 4.1.
Gambar 4.1 Tampilan Puncak Daerah Gugus Fungsional Asetosal Tabel 4.1 Puncak Gugus Fungsional Asetosal
No. Peak No. Peak
1. 2870,07 6.. 1462,04 2. 2588,47 7. 1303,97 3. 1755,22 8. 1219,01 4. 1689,64 9. 1184,29 5. 1604,77 10. 925,83
Menurut Gandjar dan Rohman (2012), pada spekturm IR asetosal bilangan gelombang 3300-2400 cm-1 (2870,07 cm-1 dan 2588,47 cm-1)memiliki gugus fungsional O-H karboksilat ulur yang memiliki pita serapan yang sangat lebar, bilangan gelombang 1757 cm-1 (1755,22 cm-1) memiliki gugus fungsional C=O Ester ulur, bilangan gelombang 1690 cm-1 (1689,64 cm-1) memiliki gugus fungsional C=O asam karboksilat terkonjugasi ulur, bilangan gelombang 1608 cm-
1 (1604,77 cm-1 ) memiliki gugus fungsional C=C aromatic ,bilangan gelombang 1460 cm-1 (1462,04 cm-1) memiliki gugus fungsional C=C aromatic tekuk, bilangan gelombang 1325-1285 cm-1 (1303,87 cm-1 dan 1219,01 cm-1) memiliki gugus fungsional C-O ulur dan bilangan gelombang 1200-900 cm-1 (1184,29 cm-1 dan 925,83 cm-1) memiliki gugus fungsional C-O (Fessenden dan Fessenden, 1986).
Menurut Moffat dkk., (2011) asetosal mempunyai bilangan gelombang spesifik, yaitu 1755 cm-1, 1688 cm-1, 1305 cm-1, 1219 cm-1, 1183 cm-1 dan 925 cm-
1. Menurut Sitorus, (2017) daerah sidik jari berada dalam daerah 1200-500 cm-1 daerah yang memasuki rentang tersebut yaitu 925 cm-1, 1183 cm-1, dan 1219 cm-1. Sehingga dilakukan analisis pada titik spesifik yang memenuhi rentang daerah sidik jari saja. Spektrum vibrasi asetosal konsentrasi 10% dapat dilihat pada gambar 4.2.
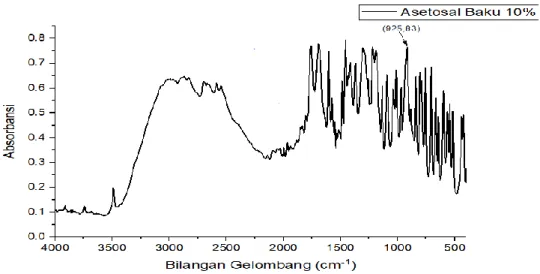
Gambar 4.2 Spektrum Serapan Baku Asetosal 10%
Spektroskopi IR memiliki salah satu keunggulan dengan spektroskopi lainnya yaitu karena sifatnya sebagai spektrum sidik jari, yang mana tidak ada dua buah senyawa atau sampel yang berbeda mempunyai spektrum yang sama (Rohman, 2014). Menurut Sitorus, (2017) serapan sidik jari pada daerah sekitar 1200-500 cm-
1 memiliki molekul dan serapan yang sangat kompleks dan biasanya digunakan untuk mengkonfirmasi apakah gugus fungsinya ada. Misalkan bila molekul mempunyai gugus fungsional hidroksi (-OH) pada sekitar 3400 an cm-1 biasanya intentitasnya kuat dengan puncak melebar, diperkuat serapan C-O tunggal pada sekitar 1200 cm-1 yang tajam dan intensitasnya kuat.
Kebanyakan sampel yang disiapkan untuk penentuan sidik jari bertujuan untuk meningkatkan kesesuaian sampel dengan standar farmakope, penyiapan sampel untuk tujuan ini dilakukan dalam pelet KBr atau KCl (Gandjar dan Rohman, 2012).
Berikut ini merupakan perbandingan antara spektrum transmitan dan bilangan gelombang hasil penelitian dengan spektrum transmitan berdasarkan literatur.
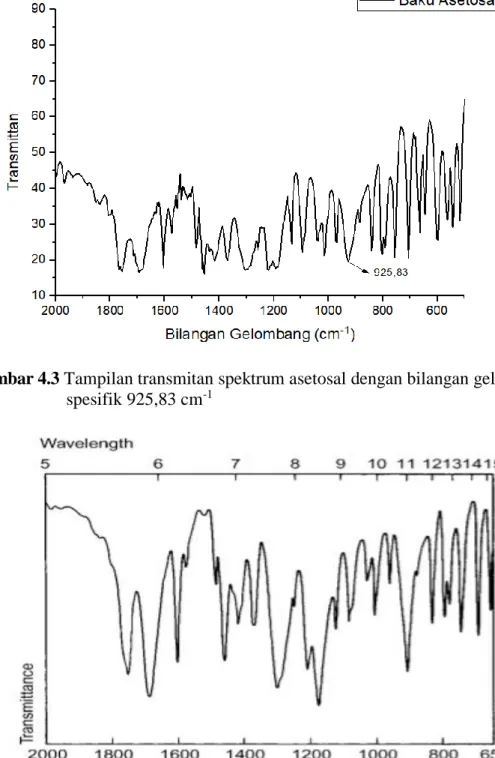
Gambar 4.3 Tampilan transmitan spektrum asetosal dengan bilangan gelombang spesifik 925,83 cm-1
Gambar 4.4 Tampilan transmitan spektrum asetosal dengan bilangan gelombang spesifik menurut literatur (Sumber: Moffat dkk., 2011).
Berdasarkan Gambar 4.3 dan Gambar 4.4 tersebut, terlihat bahwa terdapat perbedaan antara pergeseran bilangan gelombang atau pita absorbansi spektrum transmitan yang diperoleh dari penelitian dengan spektrum transmitan berdasarkan literatur.
Sebelum dilakukan penetapan kadar, terlebih dahulu baku asetosal dianalisis secara kualitatif dengan cara membandingkan bilangan gelombang dari serapan baku asetosal konsentrasi 10% dengan bilangan gelombang dari literatur. Hal ini dilakukan untuk memastikan bahwa sampel yang digunakan pada penelitian ini adalah sampel asetosal di mana terdapat kesesuaian pada beberapa bilangan gelombang asetosal dengan literatur yaitu 1755,23 cm-1, 1689,64 cm-1, 1307,737, cm-1, 1219,01 cm-1, 1184,29 cm-1 dan 925,83 cm-1.
Menurut Rohman, (2014), semua pengukuran mengandung kesalahan dalam level tertentu, tanpa memperhatikan seberapa baik kita melakukan suatu percobaan ataupun seberapa hebat instrumen yang kita gunakan. Akurasi dari bilangan gelombang spektrum atau pita absorbansi spektrum IR adalah ± 2 cm-1. Sehingga hal ini memberikan perbedaan bentuk antara spektrum transmitan atau pita absorbansi hasil penelitian dengan spektrum berdasarkan literatur.
4.2 Penentuan Kurva Kalibrasi Asetosal
Spektrum vibrasi standar asetosal yang dibuat dengan 4 variasi konsentrasi masing-masing ditentukan pada daerah bilangan gelombang spesifik pada rentang 925 cm-1, 1183 cm-1, dan 1219 cm-1.Dilakukan analisis kuantitatif pada bilangan gelombang tersebut.
Pengukuran kurva kalibrasi asetosal secara kuantitatif telah diorientasikan pada 3 bilangan gelombang spesifik sidik jari baku asetosal konsentrasi 10%. Hasil pengujian yang diperoleh menunjukkan pada bilangan gelombang 1219,01 cm-1 dengan koefisien korelasi yaitu 0,9974 , bilangan gelombang 1184,29 cm-1 dengan koefisien korelasi yaitu 0,9982 , dan bilangan gelombang 925,83 cm-1 dengan koefisien korelasi yaitu 0,9997.
Menurut penelitian yang dilakukan oleh Robaina dkk, (2017), pemilihan bilangan gelombang didasarkan pada bilangan gelombang yang memberikan puncak spesifik, karena pada daerah ini memberikan selektifitas dan sensitifitas yang paling baik untuk penetapan kadar sediaan farmasi.
Berdasarkan hal tersebut dipilih bilangan gelombang 925,83 cm-1 untuk penetapan kadar sediaan asetosal dimana bilangan tersebut memiliki linieritas yang paling baik daripada bilangan gelombang spesifik lainnya dengan koefisien korelasi r = 0,9997.
Selain itu, pemilihan bilangan gelombang 925,83 cm-1 untuk penetapan kadar asetosal didasari pada sifatnya sebagai sidik jari. Hal ini dibuktikan dengan adanya vibrasi C-O yang muncul pada daerah 1200-900 cm-1 yaitu pada bilangan gelombang 925,83 cm-1, dan sebagai bentuk konfirmasi adanya gugus fungsi O-H yang muncul pada daerah 3700-3000 cm-1 yaitu 3491,15 cm-1 (Ewing, 1975;
Fesssenden dan Fessenden, 1986).
4.3 Hasil Pembuatan Kurva Kalibrasi Asetosal
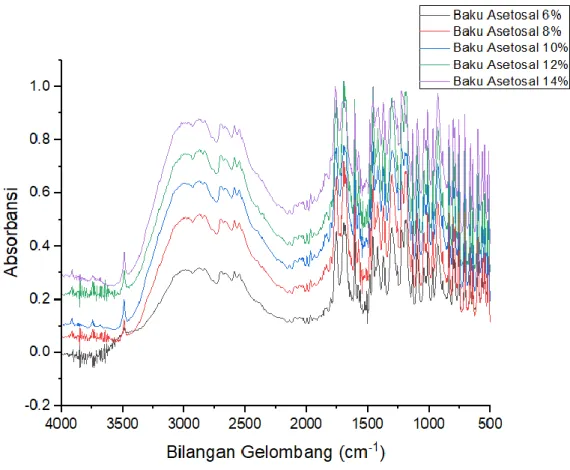
Baku Asetosal ditimbang dalam berbagai konsentrasi, diukur serapannya pada wilayah spesifik asetosal. Spektrum asetosal pada berbagai konsentrasi dapat dilihat pada Gambar 4.5.
Gambar 4.5 Tampilan spektrum tumpang tindih Asetosal dengan berbagai konsentrasi (6-14%)
Dari gambar diatas dapat dilihat bahwa semakin tinggi konsentrasi maka semakin tinggi pula absorbansi yang dihasilkan. Spektrum vibrasi asetosal pada berbagai konsentrasi dalam KBr menunjukkan bahwa konsentrasi tidak mengubah bentuk spektrum dari masing-masing zat, sehingga dapat dikatakan penggunaan analisis dengan KBr stabil terhadap asetosal.
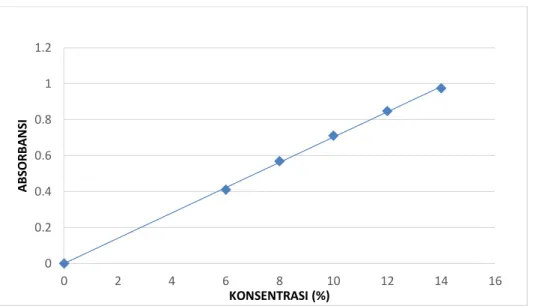
Pembuatan kurva kalibrasi baku asetosal dilakukan dengan memplot konsentrasi (sumbu x) dengan absorbansi (sumbu y), kemudian titik tersebut dihubungkan dengan garis lurus. Berdasarkan kurva diatas, diperoleh persamaan regresi Asetosal Y = 0,070299527X + 0,000888916 dengan koefisien korelasi (r) 0,9997. Dari gambar berikut dapat dilihat bahwa semakin tinggi konsentrasi maka
semakin tinggi pula absorbansi yang dihasilkan. Kurva kalibrasi asetosal dapat dilihat pada Gambar 4.6.
Gambar 4.6 Grafik kurva kalibrasi baku Asetosal
Pengukuran kurva kalibrasi juga dilakukan pada absorbansi pada bilangan gelombang yang lain dan tidak didapatkan hasil yang memenuhi persyaratan koefisien korelasi. Sehingga, dalam penelitian ini dipilih bilangan gelombang yang memberikan linearitas yang paling baik yaitu absorbansi pada bilangan gelombang 925,83 cm-1. Data kalibrasi, persamaan regresi dan koefisien korelasi dapat dilihat pada Lampiran 4.
4.4 Hasil Penetapan Kadar Asetosal dalam Sediaan Tablet
Penetapan kadar asetosal dilakukan secara spektrofotometri Fourier Transform Infra Red (FTIR). Konsentrasi asetosal dalam sampel ditentukan berdasarkan persamaan regresi kurva kalibrasi pada bilangan gelombang 925,83 cm-1 dari baku yaitu Y = 0,070299527X + 0,000888916. Sediaan asetosal yang digunakan untuk analisis adalah tablet Aptor® (PT. Nicholas), dan tablet Astika® (PT.Ikapharmindo Putramas), tablet Cardioasetosal® (PT. Bayer Healthcare), dan tablet Farmasal®
0 0.2 0.4 0.6 0.8 1 1.2
0 2 4 6 8 10 12 14 16
ABSORBANSI
KONSENTRASI (%)