LAPORAN PRAKTIKUM
KEAMANAN PANGAN
Oleh : KELOMPOK : 7
EUIS NOVI SOLIHATI 25010113120082
UMI ALFIANI 25010113120104
ELISA MAHARANI 25010113120112 ACHMAD RIZKI AZHARI 25010113140258 CRISTIN OKTAVIANA G.Y.A 25010113140266
TITI HAPSARI 25010113140357
ILYA FAROKHA RIZQYANA 25010113130387 AGUSTINA RATRI MAHARANI 25010113130416
FAKULTAS KESEHATAN MASYARAKAT
UNIVERSITAS DIPONEGORO
SEMARANG
ii
2. Penyusun : Kelompok 7
3. Laboratorium/Bagian : Laboratorium Terpadu FKM Undip/ Bagian Kesehatan Lingkungan
4. Lokasi Kegiatan : Laboratorium Terpadu Fakultas Kesehatan Masyarakat Universitas Diponegoro
5. Waktu Kegiatan : 18 April 2016 – 22 April 2016 Sudah diperiksa isi materi keilmuan dan disetujui.
Semarang, 10 Juni 2016
Kepala Laboratorium Bagian Dosen Pembimbing/Penguji Kesehatan Lingkungan/
Laboratorium Kesmas FKM Undip
Yusniar Hanani Darudianti, STP, M.Kes Dr.Dra. Sulistiyani, M.Kes.
NIP. 197109091995032001 NIP. 196809111993032013
Menyetujui,
Kordinator Laboratorium Terpadu
Ir. Laksmi Widajanti, M.Si
iii
KATA PENGANTAR
Dengan memanjatkan puji syukur kepada Tuhan Yang Maha Esa penulis dapat menyelesaikan tugas pembuatan laporan yang berjudul “Praktikum Keamanan Pagan Kesehatan Lingkungan”. Dalam pembuatan makalah ini, praktikan mendapat bantuan dari berbagai pihak, maka pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Dr. Dra. Sulistiyani, M. Kes selaku dosen praktikum yang telah memberikan kesempatan dan memberi fasilitas sehingga laporan ini dapat selesai dengan lancar.
2. Semua pihak yang tidak dapat praktikan sebutkan satu persatu yang membantu pembuatan laporan ini.
Semoga laporan praktikum ini bisa bermanfaat bagi pembaca pada umumnya dan praktikan pada khususnya, praktikan menyadari bahwa dalam pembuatan laporan ini masih jauh dari sempurna untuk itu penulis menerima saran dan kritik yang bersifat membangun demi perbaikan kearah kesempurnaan. Akhir kata praktikan sampaikan terima kasih.
Semarang, 10 Juni 2016
iv
Parameter I Pengenalan Alat & Teknik Pengambilan Sampel Secara Aseptik BAB I PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan ... 2
C. Manfaat ... 2
BAB II TINJAUAN PUSTAKA ... 3
A. Keamanan Pangan ... 3
B. Penjamah Makanan ... 4
C. Pemeriksaan Mikrobiologi Penjamah Makanan ... 4
BAB III METODE PRAKTIKUM ... 6
A. Waktu Praktikum ... 6
B. Tempat Praktikum ... 6
C. Alat ... 6
D. Bahan... 6
E. Teknik Sampling ... 6
F. Metode yang Digunakan ... 7
G. Prosedur Kerja ... 7
BAB IV HASIL DAN PEMBAHASAN ... 8
v
Parameter II Isolasi, Inokulasi, dan Morfologi Bakteri
BAB I PENDAHULUAN ... 26
A. Latar Belakang ... 26
B. Tujuan ... 27
C. Manfaat ... 27
BAB II TINJAUAN PUSTAKA ... 28
A. Isolasi ... 28
G. Gangguan Kesehatan Akibat Bakteri ... 33
H. Pencegahan ... 35
BAB III METODE PRAKTIKUM ... 37
A. Waktu Praktikum ... 37
B. Tempat Praktikum ... 37
C. Alat ... 37
D. Bahan... 38
E. Teknik Sampling ... 39
F. Metode yang Digunakan ... 39
G. Prosedur Kerja ... 40
BAB IV HASIL DAN PEMBAHASAN ... 46
A. Hasil Pengamatan ... 46
Parameter III Formalin
BAB I PENDAHULUAN ... 59
A. Latar Belakang ... 59
B. Tujuan ... 60
C. Manfaat ... 60
BAB II TINJAUAN PUSTAKA ... 61
A. Pengertian Formalin ... 61
B. Fungsi Formalin ... 61
C. Karakteristik Formalin ... 62
D. Sifat Fisik Kimia Dari Formalin ... 62
E. Dampak Formalin Bagi Kesehatan ... 62
F. Tanda dan Gejala Keracunan Formalin... 63
G. Tindakan Pencegahan... 63
H. Karakteristik Sampel ... 63
BAB III METODE PRAKTIKUM ... 65
A. Waktu Praktikum ... 65
B. Tempat Praktikum ... 65
C. Alat ... 65
D. Bahan... 65
E. Teknik Sampling ... 66
F. Metode yang Digunakan ... 66
G. Prosedur Kerja ... 67
BAB IV HASIL DAN PEMBAHASAN ... 68
A. Hasil Pengamatan ... 68
vii
BAB II TINJAUAN PUSTAKA ... 79
A. Definisi Pangan ... 79
B. Keamanan Pangan ... 79
C. Definisi Borak ... 80
D. Karakteristik Boraks... 80
E. Peraturan Terkait Boraks... 80
F. Uji Kandungan Boraks pada Makanan ... 80
G. Dampak Boraks Bagi Kesehatan ... 81
BAB III METODE PRAKTIKUM ... 82
A. Waktu Praktikum ... 82
B. Tempat Praktikum ... 82
C. Alat ... 82
D. Bahan... 82
E. Teknik Sampling ... 83
F. Metode yang Digunakan ... 83
G. Prosedur Kerja ... 83
BAB IV HASIL DAN PEMBAHASAN ... 84
A. Hasil Pengamatan ... 84
Parameter V Rhodamin B
BAB I PENDAHULUAN ... 92
A. Latar Belakang ... 92
B. Tujuan ... 93
C. Manfaat ... 93
BAB II TINJAUAN PUSTAKA ... 94
A. Definisi Pangan ... 94
B. Pewarna Makanan ... 94
C. Peraturan Penggunaan Pewarna Pada Makanan ... 95
D. Rhodamin B ... 96
E. Dampak Mengkonsumsi Rhodamin B ... 96
BAB III METODE PRAKTIKUM ... 98
A. Waktu Praktikum ... 98
B. Tempat Praktikum ... 98
C. Alat ... 98
D. Bahan... 98
E. Teknik Sampling ... 99
F. Metode yang Digunakan ... 99
G. Prosedur Kerja ... 100
BAB IV HASIL DAN PEMBAHASAN ... 101
A. Hasil Pengamatan ... 101
ix
Parameter VI Metode Hitungan Cawan
BAB I PENDAHULUAN ... 111
A. Latar Belakang ... 111
B. Tujuan ... 111
C. Manfaat ... 112
BAB II TINJAUAN PUSTAKA ... 113
A. Pengertian Metode Hitung Cawan ... 113
B. Pengertian Mikroorganisme Pada Tangan ... 115
C. Peraturan yang Berkaitan Dengan Praktikum ... 116
D. Dampak Terhadap Kesehatan dan Lingkungan ... 116
E. Faktor-faktor yang Mempengaruhi ... 117
BAB III METODE PRAKTIKUM ... 119
A. Waktu Praktikum ... 119
B. Tempat Praktikum ... 199
C. Alat ... 119
D. Bahan... 119
E. Teknik Sampling ... 120
F. Metode yang Digunakan ... 120
G. Prosedur Kerja ... 124
BAB IV HASIL DAN PEMBAHASAN ... 125
A. Hasil Pengamatan ... 125
x
Parameter I Pengenalan Alat & Teknik Pengambilan Sampel Secara Aseptik Tabel 4.1 Hasil Praktikum Pengenalan Alat ... 8 Tabel 4.2 Pengambilan Sampel Secara Aseptis dengan Teknik Swab ... 14
Parameter II Isolasi, Inokulasi, dan Morfologi Bakteri
Tabel 4.1 Hasil Pengamatan Isolasi dan Inokulasi Mikroorganisme ... 46 Tabel 4.2 Hasil Pengamatan Praktikum Morfologi Bakteri ... 47
Paramater III Formalin
Tabel 4.1 Hasil Uji Kandungan Formalin dalam Tahu Kuning... 68
Parameter IV Boraks
Tabel 4.1 Hasil Pengamatan Praktikum Boraks pada Cilok ... 77
Parameter V Rhodamin B
Tabel 2.1 Pewarna Sintetik yang Diizinkan dan Dilarang di Indonesia ... 95 Tabel 4.1 Hasil Uji Rhodamin B ... 101
Parameter VI Metode Hitungan Cawan
xi
DAFTAR GAMBAR
Parameter I Pengenalan Alat & Teknik Pengambilan Sampel Secara Aseptik Gambar 3.1 Skema Kerja Pengambilan Sampel Secara Aseptis Permukaan
Sela-Sela Jari Responden ... 7
Parameter II Isolasi, Inokulasi, dan Morfologi Bakteri Gambar 3.1 Skema Kerja Pengambilan Sampel Mikroba (Sela Jari Tangan) .... 40
Gambar 3.2 Skema Kerja Teknik Pengenceran Bertingkat ... 41
Gambar 3.3 Skema Kerja Isolasi Mikroogranisme ... 42
Gambar 3.4 Skema Kerja Inokulasi Biakan Murni ... 43
Gambar 3.5 Skema Kerja Pembuatan Film pada Morfologi Bakteri ... 44
Gambar 3.6 Skema Kerja Pewarnaan Gram pada Morfologi Bakteri ... 45
Gambar 4.1 Pengenceran Pada 10-3,10-4, 10-5 ... 47
Gambar 4.2 Hasil Isolasi Pada Media PCA 10-4 ... 47
Paramater III Formalin Gambar 3.1 Skema Kerja Pengujian Kandungan Formalin ... 67
Gambar 4.1. Hasil dari pengujian Formalin ... 68
Parameter IV Boraks Gambar 3.1 Skema Kerja Pada Metoda Uji Warna Dengan Tes Kit Boraks ... 83
Gambar 4.1 Hasil Uji Tes Kit Boraks Pada Sampel Cilok ... 84
Parameter V Rhodamin B Gambar 3.1 Skema Prosedur Kerja Uji Khusus untuk Rhodamin B ... 100
Gambar 4.1 Fase Ether Setelah Diberi HCl 10% ... 101
Parameter VI Metode Hitungan Cawan Gambar 2.1 Hasil Identifikasi Bakteri ... 121
1 A. Latar Belakang
Dalam melakukan percobaan kimia pastinya digunakan alat-alat pada laboratorium seperti gelas ukur, timbangan, tabung reaksi, autoclave dan lainnya.Penggunaan alat-alat ini dimaksudkan untuk mendukung kerja praktikan dalam melakukan percobaan. Dalam melakukan percobaan kimia pastinya praktikan tidak terlepas dari zat-zat atau larutan kimia yang berbahaya, beracun,dan mudah terbakar.Dalam praktikum diharapkan tidak terjadinya kesalahan dalam penggunaan karenaakan mengancam keselamatan praktikan saat bekerja.
Untuk menghindari kecelakaan saat praktikum, praktikan harus mempunyai pengetahuaan dan kemapuan yang cukupuntuk menggunakan alat-alat praktikum secara baik, karena setiapa alat memiliki prosedur yang berbeda-beda.Oleh karena itu pengenalan alat-alat laboratorium seperti fungsi dan cara penggunaannya sangat dibutuhkan untuk memudahkan praktikan dalam melakukan praktikum, memeroleh data yang akurat dan juga untuk keselamatan praktikan.
2
B. Tujuan Praktikum
Tujuan dari praktikum ini adalah agar praktikan daat mengetahui alat laboratorium yag digunaka untuk praktikum keamanan pangan dan mampu mengambil sampel secara aseptik dari permukaan tubuh (tangan)
C. Manfaat Praktikum
1. Praktikan mampu mengetahui fungsi alat laboratorium 2. Praktikan mampu mengoperasikan alat-alat laboratorium
3. Praktikan mampu mengetahui prinsip kerja dari alat-alat laboratorium 4. Praktikan mampu mengambil sampel secara aseptik dari media
3 A. Keamanan Pangan
Makanan yang aman merupakan factor yang penting untuk meningkatkan derajat kesehatan.1 Dalam Undang-Undang RI Nomor 18 Tahun 2012 tentang keamanan pangan, keamanan pangan didefinisikan sebagai kondisi dan upaya yang diperlukan untuk mencegah pangan dari kemungkinan cemaran biologi, kimia, benda-benda lain yang dapat mengganggu, merugikan, dan membahayakan kesehatan masnusia serta tidak bertentangan dengan agama, keyakinan, dan budaya masyarakat sehingga aman dikonsumsi.1
Adapun prasyarat utama dalam menentukan mutu pangan yang baik adalah keamanan pangannya.2 Prasyarat pangan yang lain seperti nilai gizi, mutu fisik, dan mutu organoleptic baru dipertimbangkan kemudian setelah aspek keamanan pangan yang baik telah terpenuhi.2
Keamanan pangan merupakan aspek yang penting dalam kehidupan sehari-hari.3 Kurangnya perhatian terhadap hal ini sering berdampak pada gangguan kesehatan.3 Contohnya adalah kejadian keracunan pangan akibat tidak higienisnya proses pengolahan hingga dengan penyajiannya dan pengunaan bahan kimia berbahaya yang berisiko menimbulkan penyakit degeneratif, kanker, bahkan kematian.3
Salah satu masalah keamanan pangan yang sering dijumpai adalah praktek hygiene dan sanitasi yang masih rendah sehingga bahaya mikrobiologi sangat mungkin berada pada produk pangan.4 Keberadaan Escherichia coli pada pangan dapat menunjukkan praktek sanitasi lingkungan
yang buruk, sedangkan adanya Staphylococcus aurens mengidentifikasi praktek hygiene yang kurang.4
4
kebersihan dari subjeknya.5 Misalnya menyediakan tempat sampah untuk mewaspadai sampah agar tidak dibuang sembarangan.5
B. Penjamah Makanan
Penjamah makanan adalah setiap orang yang terlibat dalam bisnis makanan, yang menangani makanan padalam proses pekerjaannya, atau sebagai bagian dari tugas mereka sampai batas tertentu, baik makanan tersebut terbuka atau sebelum dibungkus.6
Perilaku penjamah makanan harus mengikuti kaidah hygiene dan sanitasi dalam kesahariannya. Kaedah tersebut adalah sebagai berikut:7
a) Tidak makan, minum atau mengunyah (termasuk permen), kecuali memang bertugas mencicip
b) Tidak memakai perhiasan (termasuk jam tangan), karena dapat menjadi persinggahan bakteri dan kemudian menkontaminasi makanan
c) Tidak menggunakan fasilitas yang bukan untuk keperluannya
d) Selalu mencuci tangan sebelum dan setelah bekerja juga setelah keluar makanan yang akan dan telah diolah
g) Selalu menjaga kuku tetap pendek, bersih, dan rapih. Tidak menggunakan kuku palsu, pewarna kuku, maupun riasan yang berlebihan.
C. Pemeriksaan Mikrobiologi Penjamah Makanan
Suatu penelitian di beberapa negara industry menunjukkan bahwa lebih dari 60% penyakit bawaan makanan disebabkan karena buruknya kemampuan penjamah untuk mengolah makanan.9 Penyakit-penyakit yang dapat ditularkan oleh penjamah makanan dari mikroorganisme yang ada di permukaan atau di dalam tubuh dapat membanyak diri hingga dosis efektif, kondisi yang tepat, dan kontak langsung makanan atau ketika penyajian makanan.9
Tangan merupakan factor terpenting dalam transmisi semua penyakit menular.10 Tangan manusia merupakan media kontak beragam pathogen dalam lingkungan sekitar dan diatas permukaan tubuh yang sering bersentuhan dengan tangan.10 Makanan dapat terkontaminasi melalui tangan yang kotor penjamah makanan yang memiliki hygiene yang rendah dalam penanganan makanan.10 Pemeriksaan mikrobiologis pada tangan penjamah makanan sering dilakukan yaitu pemeriksaan E. Coli atau Coliform dan S. aureus.10
6 BAB III
METODE PRAKTIKUM
A. Waktu Praktikum
Praktikum pengenalan, penyiapan, dan penggunaan alat dilaksanakan pada Senin, 18 April 2016 pukul 13:00-16:00 WIB dan praktikum teknik pengambilan sampel secara aseptik dari permukaan tangan dilaksankan pada hari Selasa, 19 April 2016 pukul 08:30 WIB.
B. Tempat Praktikum
Praktikum pengenalan, penyiapan, dan penggunaan alat serta pengambilan sampel secara aseptik dari permukaan tangan dilaksankan di Laboratorium Terpadu Fakultas Kesehatan Masayarakat Universitas Diponegoro.
C. Alat
a) Cotton bud steril b) Tabung reaksi c) Kapas
D. Bahan
a) Na fisiologis steril b) Alkohol 70%
c) Sampel (mikroba pada telapak tangan salah satu praktikan)
E. Teknik Sampling
F. Metode yang Digunakan
Metode pengambilan sampel mikroba pada permukaan tangan (sela-sela jari) yaitu metode swab usap menggunakan cotton bud.
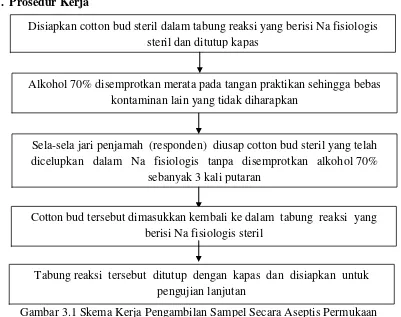
G. Prosedur Kerja
Gambar
Gambar 3.1 Skema Kerja Pengambilan Sampel Secara Aseptis Permukaan Sela-Sela Jari Responden
Sela-sela jari penjamah (responden) diusap cotton bud steril yang telah dicelupkan dalam Na fisiologis tanpa disemprotkan alkohol 70%
sebanyak 3 kali putaran
Tabung reaksi tersebut ditutup dengan kapas dan disiapkan untuk pengujian lanjutan
Cotton bud tersebut dimasukkan kembali ke dalam tabung reaksi yang berisi Na fisiologis steril
Disiapkan cotton bud steril dalam tabung reaksi yang berisi Na fisiologis steril dan ditutup kapas
8 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Pengamatan
1. Pengenalan Alat dan Bahan Praktikum Mikrobiologi Tabel 4.1 Hasil Praktikum Pengenalan Alat
No Alat Gambar Fungsi
1 Autoclave Untuk sterilisasi alat
dan media
2 Gelas Ukur (250 ml)
Mengukur Larutan secara Kuantitatif
3 Erlenmeyer (500 ml)
No Alat Gambar Fungsi 4 Beaker
Glass
Tempat Reaksi Larutan
5 Pipet tetes Memindahkan larutan
dalam jumlah kecil
6 Penjepit Menjepit tabung reaksi
khususnya saat proses pemanasan
7 Bunsen Sterilisasi jarum
10
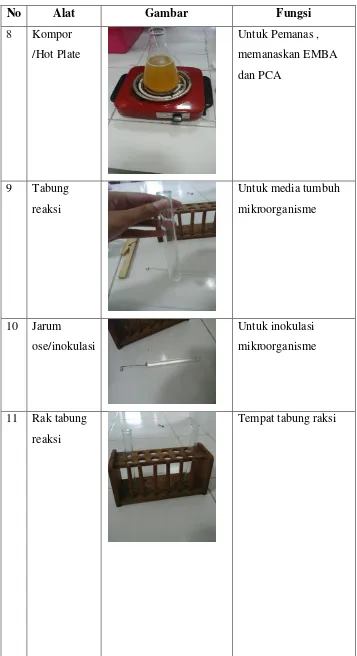
No Alat Gambar Fungsi
8 Kompor /Hot Plate
Untuk Pemanas , memanaskan EMBA dan PCA
9 Tabung reaksi
Untuk media tumbuh mikroorganisme
10 Jarum
ose/inokulasi
Untuk inokulasi mikroorganisme
11 Rak tabung reaksi
No Alat Gambar Fungsi
12 Cawan petri Tempat penanaman/
media tumbuh mikroorganisme
13 Colony Counter
Untuk menghitung koloni bakteri
14 Vortex Untuk
menghomogenkan larutan
15 Objek Glass Untuk meletakkan
12
No Alat Gambar Fungsi
16 Desk Glass Untuk menutupi
preparat
17 Mikroskop Untuk mengamati
benda/objek renik.
18 Kapas Untuk menyumbat
/membersihkan tabung reaksi tabung
No Alat Gambar Fungsi
19 Jas Lab Pakaian standar
laboratorium
20 Masker Melindungi tubub dari
kontaminan
21 Oven Mensterilisaasi
alat-alat praktikum sebelum alat digunakan
22 Inkubator Untuk menginkubasi
14
2. Teknik Pengambilan Sampel Secara Aseptis
Tabel 4.2 Pengambilan Sampel Secara Aseptis dengan Teknik Swab
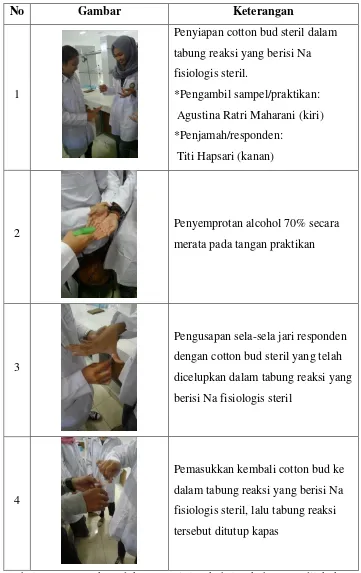
No Gambar Keterangan
1
Penyiapan cotton bud steril dalam tabung reaksi yang berisi Na fisiologis steril.
*Pengambil sampel/praktikan: Agustina Ratri Maharani (kiri) *Penjamah/responden:
Titi Hapsari (kanan)
2 Penyemprotan alcohol 70% secara
merata pada tangan praktikan
3
Pengusapan sela-sela jari responden dengan cotton bud steril yang telah dicelupkan dalam tabung reaksi yang berisi Na fisiologis steril
4
Pemasukkan kembali cotton bud ke dalam tabung reaksi yang berisi Na fisiologis steril, lalu tabung reaksi tersebut ditutup kapas
B. Pembahasan
Teknik aseptis sangat diperlukan untuk menghindari mikroorganisme dari kontaminan yang dapt menghambat pertumbuhan sampel mikroba. Teknik aseptis pada praktikum ini digunakan sepanjang kegiatan baik alat, bahan, lingkungan sekitar maupun praktikannya.
Alat dan bahan praktikum diterapkan sterilisasi. Sterilisasi dalam mikrobiologi berart membebaskan tiap benda atau substansi dari semua kehidupan dalam bentuk apapun. Cotton bud, tabung reaksi, dan Na fisiologis pada praktikum ini dilakukan sterilisasi dengan alat yaitu autoclave. Autoclave menggunakan prinsip mematikan mikroba dengan uap panas. Na fisiologis dimasukkan ke tabung reaksi, lalu cotton bud steril dimasukkan ke tabung reaksi tersebut. Kemudian tabung reaksi ditutup kapas sehingga cotton dan Na fisiologis yang ada didalamnya tidak terkontaminasi lingkungan sekitar.
Praktikan dalam kegiatan ini juga disterilasi dengan menyemprotkan alcohol 70% secara merata pada kedua tangan. Selain melalui panas, mikroba dapat dihilangkan dengan bahan kimia (disinfektan) salah satunya dengan alcohol 70%..
Tangan penjamah/responden tidak dilakukan penyemprotan alcohol 70% karena akan menghilangkan sampel mikroba yang diambil pada praktikum ini. Kriteria responden yaitu seseorang tidak kontak dengan sabun, alcohol, dan bahan disinfektan lainnya dalam jangka waktu satu jam sebelum praktikum dimulai. Hal ini bertujuan mencegah sampel mikroba yang didapatkan pada permukaan sela-sela jari responden terlalu sedikit untuk diamati pada praktikum pengamatan morfologi mikroba nantinya.
16 BAB V PENUTUP
A. Kesimpulan
1. Alat alat praktikum yang digunakan saat praktikum keamanan pangan yaitu autoclave, inkubator, oven , vortex, gelas ukur, erlenmeyer, beaker Dglass, pipet tetes dan ukur, penjepit, bunsen, tabung reaksi, rak tabung reaksi jarum inokulasi, kompor listrik, colony counter, cawan petri, objek glass, kapas , masker, jas laboratorium, desk glass, dan mikroskop.
2. Setiap alat laboratorium memiliki prinsip kerja dan fungsi yang berbeda
3. Dalam melakukan pengambilan sampel mikroorganisme harus dilakukan secara aseptis baik dari segi alat dan bahan yang digunakan maupun kondisi lingkungan pengambilan sampel.
B. Saran
1. Praktikan diharapkan dapat memahami fungsi dan cara kerja dari alat-alat laboratorium
2. Praktikan diharapkan dapat mematuhi segala instruksi dalam laboratorium baik dari asisten praktikum , PLP ,dan dosen .
17
1. Undang-Undang Republik Indonesia Nomor 18 Tahun 2012 Tentang Pangan 2. Yusuf A.L. Studi Keamanan Mikrobiologis Makanan Di Kantin Asrama Putri
Tingkat Persiapan Bersama Institut Pertanian Bogor [Skripsi]. Bogor: Institut
Pertanian Bogor; 2004.
3. Badan Pengawas Obat dan Makanan. Keamanan Pangan Jajanan Anak Sekolah (PJAS) Serta Upaya Penanggulangannya. Info POM. 2008; 9 (6).
4. R. Wijaya. Penerapan Peraturan Dan Praktik Keamanan Pangan Jajanan Anak Sekolah Di Sekolah Dasar Kota Dan Kabupaten Bogor [Skirpsi]. Bogor:
Institut Pertanian Bogor; 2009.
5. Hiasinta A.P. Sanitasi Higiene Dan Keselamatan Kerja Dalam Pengolahan Makanan. Yogyakarta: Kanisius; 2001.
6. National Disease Survellance Centre (NDSC). Preventing Foodborne Disease: A Focus on the Infected Food Handler. ISBN 0-9540177-5-7; 2004.
7. Fida E. Gambaran Penerapan Food Safety Pada Pengolahan Makanan Untuk Kru Pesawat Di Aerofood ACS Tahin 2012 [Skripsi]. Depok: Universitas
Indonesia; 2012.
8. Titin A. Pentingnya Higiene Penjamah Makanan Tradisional [Seminar Nasional Membangun Citra Pangan Tradisional]. Semarang: Universitas Negeri Semarang; 2005.
9. Sulistyani. Modul Penyehatan Makanan dan Minuman. Semarang: Universitas Diponegoro; 2002.
10.S.L Tan, H.Y. Lee, F. Abu Bakar, M.S. Abdul Karim, Y. Rukayadi, N.A. Mahyudin. Short Communication Microbial Quality On Food Handlers’ Hands At Primary School in Hulu Langat District, Malaysia. International
Food Research Journal. 2013; 20 (5): 2973-2977.
11.Anisman. Keracunan Makanan: Buku Ajar Ilmu Gizi. Jakarta: EGC; 2008. 12.Char Palezar. Elements Of Microbiology. New York: Mc Graw Hill Company;
2008
18
14.Dina Rahayuning Pangestuti, M. Zen Rahfiludin, Sulistyawati. Petunjuk Praktikum Keamanan Pangan. Semarang: Laboratorium Terpadu Fakultas
19
A. Dokumentasi Praktikum Pengenalan Alat dan Teknik Pengambilan Sampel Secara Aseptis
Autoclave Colony Counter
Inkubator Vortex
20
Penyemprotan alcohol 70% secara merata pada tangan praktikan
22
26 BAB I
PENDAHULUAN
A. Latar Belakang
Diketahui bahwa mikroba tersebar di alam, terdapat di lingkungan mana saja dalam populasi campuran. Boleh dikatakan amat jarang mikroba dijumpai sebagai satu spesies tunggal di alam. Untuk mencirikan dan mengidentifikasikan suatu spesies mikroorganisme tertentu, pertama-tama spesies tersebut harus dapat dipisahkan dari organisme lain, lalu ditumbuhkan menjadi biakan murni.
Dalam mengisolasi suatu mikroorganisme, dilakukan dengan cara yang aseptis untuk menghindari terjadinya kontaminasi dengan mikroorganisme lain. Kebanyakan mikroorganisme dapat diisolasi dan diinokulasi dalam biakan murni dengan memindahkan suatu koloni secara cermat, mensuspensikan kembali dalam cairan dan menanamnya kembali pada medium yang selektif.
pewarna kristal violet, larutan iodium, larutan alkohol (bahan pemucat), dan zat pewarna tandingannya berupa safranin.
B. Tujuan Praktikum
1. Praktikan memahami dan mampu melakukan proses isolasi dan inokulasi mikroorganisme pada sampel bagian permukaan tubuh (sela jari tangan) dengan media PCA (Plate Count Agar) dan Media EMBA (Eosin Methylene Blue Agar).
2. Praktikan memahami dan mampu melakukan proses pengenceran bertingkat.
3. Praktikan mengetahui morfologi bakteri secara mikroskopis melalui metode pewarnaan gram.
C. Manfaat Praktikum
1. Mahasiswa dapat mengetahui cara isolasi dan inokulasi mikroorganisme pada sampel bagian permukaan tubuh (sela jari tangan) dengan media PCA (Plate Count Agar) dan Media EMBA (Eosin Methylene Blue Agar).
2. Mahasiswa dapat melakukan pengenceran bertingkat.
3. Mahasiswa dapat mengetahui langkah-langkah morfologi bakteri dengan metode pewarnaan gram.
4. Mahasiswa dapat mengetahui perbedaan bakteri gram positif dan bakteri gram negatif.
28 BAB II
TINJAUAN PUSTAKA
A. Isolasi
Dalam kehidupan sehari hari kita selalu berhubugan dengan berbagai macam mikroorganisme, baik bakteri, kapang maupun khamir. Untuk mempermudah dalam mempelajari jenis dan sifat mikroorganisme, maka mikroorganisme tersebut harus diisolasi dari lingkungan dan dipelihara pada medium yang sesuai untuk pertumbuhannya1.
Isolasi bakteri merupakan suatu cara untuk memisahkan atau memindahkan mikroba tertentu dari lingkungan sehingga diperoleh kultur murni atau biakan murni. Ada beberapa cara yang dapat dilakukan yaitu dengan cara goresan (streak plate), cara tuang (pour plate), cara sebar (spread plate), dan mikromanipulator2. Teknik isolasi mikroorganisme adalah suatu usaha untuk menumbuhkan mikroba diluar dari lingkungan alamiahnya. Pemisahan mikroorganisme dari lingkungannya ini bertujuan untuk memperoleh biakan bakteri yang sudah tidak bercampur lagi dengan bakteri lainya, dan ini disebut dengan biakan murni3.
Di alam, populasi mikroorganisme tidak terpisah sendiri menurut jenisnya, tetapi terdiri dari campuran berbagai macam sel. Dalam laboratorium, populasi bakteri ini dapat diisolasi dari ekosistem tanah, air, maupun udara. Selain itu, isolasi mikroorganisme pun dapat dilakukan dari berbagai sampelbahan atau jaringan tubuh menjadi kultur murni yang terdiri darisatu jenis yang dapat dipelajari morfologi, sifat, dan kemampuan biokimiawinya4.
B. Inokulasi
Teknik isolasi mikroba yaitu inokulasi yang merupakan suatu teknik pemindahan suatu biakan tertentu dari medium yang lama ke medium yang baru dengan tujuan untuk mendapatkan suatu biakan yang murni tanpa adanya kontaminasi dari mikroba yang lain6.
Inokulasi penanaman bakteri atau biasa disebut juga inokulasi adalah pekerjaan memindahkan bakteri dari medium yang lama ke medium yang baru dengan tingkat ketelitian yang sangat tinggi. Untuk melakukan penanaman bakteri (inokulasi) terlebih dahulu diusakan agar semua alat yang ada dalam hubungannya dengan medium agar tetap steril, hal ini agar menghindari terjadinya kontaminasi7. Teknik penanaman (inokulasi), teknik ini merupakan lanjutan dari pengenceran bertingkat. Pengambilan suspensi dapat diambil dari pengenceran mana saja tapi biasanya utuk tujuan isolasi (mendapatkan koloni tunggal) diambil bebrapa pengenceran terakhir.
Ada beberapa metode untuk menginokulasi bakteri sesuai dengan jenis medium tujuannya. Pada medium agar tegak, dilakukan metode tusuk menggunakan jarum ose. Pada medium agar miring,dilakukan metode gores dengan menggunakan loop ose. Pada medium petridisk, dapat digunakan metode streak plate (metode gores), pour plate (metode tuang) atau spread plate (metode sebar). Setelah inokulasi, dilakukan proses inkubasi, yaitu
menyimpan medium pada alat atau kontainer pada temperatur tertentu dan periode tertentu, sehingga tercipta lingkungan yang menyediakan kondisi cocok untuk pertumbuhan bakteri. Metode gores atau streak plate menggunakan loop ose dan menggoreskannya ke permukaan medium agar dengan pola tertentu dengan harapan pada ujung goresan, hanya sel-sel bakteri tunggal yang terlepas dari ose dan menempel ke medium. Sel-sel bakteri tunggal ini akan membentuk koloni tunggal yang kemudian dapat dipindahkan ke medium selanjutnya agar didapatkan biakan murni8.
C. Media PCA (Plate Count Agar)
30
dibatasi, seperti mikroorganisme pada saluran pembuangan limbah dan juga mikroorganisme pada makanan atau produk susu jumlahnya harus mengikuti standar-standar yang sudah ditetapkan. Untuk menghitung jumlah mikroorganisme tersebut biasanya sampel dari makanan atau produk susu atau dari air limbah tersebut di uji menggunakan media Plate Count Agar (PCA) dengan metode Total Plate Count (TPC)9.
Plate Count Agar (PCA) atau yang juga sering disebut dengan Standard
Methods Agar (SMA) merupakan sebuah media pertumbuhan mikroorganisme
yang umum digunakan untuk menghitung jumlah bakteri total (semua jenis bakteri) yang terdapat pada setiap sampel seperti makanan, produk susu, air limbah dan sampel-sampel lainnya yang juga biasanya menggunakan metode Total Plate Count (TPC). Plate Count Agar (PCA) merupakan media padat,
yaitu media yang mengandung agar sehingga setelah dingin media tersebut akan menjadi padat. Plate Count Agar (PCA) pertama kali dikembangkan oleh Buchbinder, Baris, dan Goldstein pada tahun 1953 atas permintaan dari American Public Health Association (APHA)9.
Komposisi Plate Count Agar (PCA) dapat bervariasi, tetapi biasanya mengandung: 0,5% trypton, 0,25% ekstrak ragi, 0,1% glukosa, 1,5% agar-agar. Plate Count Agar (PCA) mengandung glukosa dan ekstrak ragi yang digunakan untuk menumbuhkan semua jenis bakteri. Plate Count Agar (PCA) mengandung nutrisi yang disediakan oleh trypton, vitamin dari ekstrak ragi, dan glukosa yang digunakan sebagai sumber energi bagi mikroorganisme sehingga mendukung pertumbuhan dari bakteri. Plate Count Agar (PCA) bukan merupakan media selektif karena media ini tidak hanya ditumbuhi oleh satu jenis mikroorganisme tertentu9.
D. Media EMBA
menghasilkan koloni dengan inti berwarna gelap dengan kilap logam. Sedangkan mikroba lain yang dapat tumbuh koloninya tidak berwarna10.
Fungsi dari eosin dan metilen blue membantu mempertajam perbedaan warna. Namun demikian, jika media ini digunakan pada tahap awal, kuman lain bisa juga tumbuh terutama P. Aerugenosa dan Salmonella sp. Hal ini dapat menimbulkan keraguan. Bagaiamanapun media ini sangat baik untuk mengkonfirmasi bahwa kontaminan tersebut adalah E.coli10.
Media EMBA adalah medium selektif dan diferensial digunakan untuk mengisolasi coliform fecal. Eosin Y dan metilen blue adalah pewarna indikator pH yang bergabung untuk membentuk endapan ungu gelap pada pH rendah (asam), mereka juga berfungsi untuk menghambat muncul berwarna ungu tua sampai hitam. Escherichia coli, suatu fermentor yang kuat, sering menghasilkan warna koloni hijau metalik. Fermentor lambat atau lemah akan menghasilkan koloni merah muda mukoid atau berlendir. Biasanya koloni berwarna atau tidak berwarna menunjukkan bahwa organisme fermentor laktosa atau sukrosa terserbut bukan merupakan coliform fecal11.
E. Bakteri
32
Bakteri merupakan salah satu contoh organisme yang memilikisel tipe prokariotik. Bakteri memiliki ukuran (panjang) berkisar antara 0,15-15μ. Struktur sel bakteri terdiri dari bagian luar sebagai penutup sel dan sitoplasma13. Bakteri adalah yang paling berkelimpahan dari semua organisme. Bakteri ada dimana-mana, di tanah, air, bahkan di dalam tubuh makhluk hidup14.
F. Jenis Bakteri
Untuk memahami beberapa kelompok organisme, diperlukan klasifikasi. Tes biokimia, pewarnaan gram, merupakan kriteria yang efektif untuk klasifikasi. Hasil pewarnaan mencerminkan perbedaan dasar dan kompleks pada sel bakteri (struktur dinding sel), sehingga dapat membagi bakteri menjadi 2 kelompok, yaitu bakteri Gram-positif dan bakteri Gram-negatif12.
1. Bakteri Gram Negatif
a. Bakteri Gram Negatif Berbentuk Batang (Enterobacteriacea).
Bakteri gram negatif berbentuk batang habitatnya adalah usus manusia dan binatang. Enterobacteriaceae meliputi Escherichia, Shigella, Salmonella, Enterobacter, Klebsiella, Serratia, Proteus). Beberapa organisme seperti Escherichia coli merupakan flora normal dan dapat menyebabkan penyakit sedangkan yang lain seperti salmonella dan shigella merupakan patogen yang umum bagi manusia.
b. Pseudomonas, Acinobacter dan Bakteri Gram Negatif Lain.
c. Vibrio Campylobacter, Helicobacter, dan Bakteri lain yang berhubungan.
Mikroorganisme ini merupakan spesies berbentuk batang Gram-negatif yang tersebar luas di alam. Vibrio ditemukan didaerah perairan dan permukaan air. Aeromonas banyak ditemukan di air segar dan terkadang pada hewan berdarah dingin.
Berbentuk batang pendek Gram-negatif yang pleomorfik. Organisme ini bersifat katalase positif, oksidase positif, dan merupakan bakteri anaerob fakultatif.
2. Bakteri Gram Positif
a. Bakteri gram positif pembentuk spora : Spesies Bacillus dan Clostridium
b. Bakteri Gram-positif Tidak Membentuk Spora: Spesies
Corynebacterium, Listeria, Propionibacterium, Actinomycetes.
c. Staphylococcus: Berbentuk bulat, biasanya tersusun bergerombol yang tidak teratur seperti anggur.
d. Streptococcus: Merupakan bakteri gram-positif berbentuk bulat yang mempunyai pasangan atau rantai pada pertumbuhannya12.
G. Gangguan Kesehatan Akibat Bakteri 1. Tuberkulosis Paru (TBC)
Tuberkulosis Paru atau TBC adalah penyakit yang di sebabkan bakteri Mycobacterium tuberculosi dan Mycrobacterium bovis. Bakteri tersebut mempunyai ukuran 0,5-4 Mikron x 0,3-0,6, micron dengan bentuk tipis, lurus atau agak bengkok, bergranular atau tidak mempunyai selabung, tetapi mempunyai lapisan luar tebal yang terdiri dari lipoid. Penyakit ini di tularkan melaului udara (droplet nuclei) saat seorang pasien TBC batuk dan percikan ludah yang mengandung bakteri tersebut terhirup oleh orang lain saat bernafas.
2. Difteri
Difteria merupakan infeksi akut yang disebabkan oleh Corynebacterium diphtheriae. Lesi primer biasanya terdapat pada
34
menyebabkan manifestasi sistemik yang sering berhubungan dengan penyakit yang berat atau mematikan.
C. diphtheriae merupakan bakteri bentuk batang ramping,
gram-positif, yang tidak tahan-asam dan tidak membentuk spora. Sel berukuran 0,5-1,0 (m. Pada apusan pewarnaan, terlihat sebagai sel tunggal, atau palisade (pagar) dan satu dengan yang lainnya membentuk formasi sudut V atau L. Formasi mirip-huruf Cina ini disebabkan oleh "snapping" pergerakan yang dilibatkan ketika dua sel membelah. Bentuk C. diphtheriae secara umum berupa batang ketika tumbuh pada media nutrisi yang lengkap.
3. Pertusis
Penyakit infeksi saluran napas akut yang terutama menyerang anak-anak. Penyakit ini disebabkan oleh bakteri Bordetella pertusis (Haemophilus pertusis). Bordetella pertusis termasuk kelompok kokobasilus Gram-negatif, tidak bergerak dan tidak berspora. Bakteri ini memerlukan media untuk tumbuh seperti media darah-gliserin-kentang (Bordet-Gengou) yang di tambah penisilin untuk menghambat pertumbuhan organism lainnya. Bakteri ini berukuran panjang 0,5-1µm dan diameternya 0,2-0,3µm. Penularan penyakit ini melalui droplet dan sebagian besar bayi tertular oleh saudaranya dan kadang-kadang oleh orangtuanya.
4. Tetanus Neonatoru
Tetanus adalah penyakit kekakuan otot (spasme) yg disebabkan oleh eksotoksin (tetanospasmin) dari organism penyebab penyakit tetanus dan bukan oleh organismenya sendiri. Penyakit ini disebabkan oleh bakteri Clostridium tatani yang merupakan bakteri Gram-positif berbentuk batang
oksigen) sebagai akibat dari kecelakaan, luka tusuk, luka oprasi, karies gigi, pemotong tali pusat, dll.
5. Demam Tifoid
Demam Tifoid adalah infeksi akut pada saluran pencernaan yang di sebabkan oleh bakteri Salmonella typhi. Salmonella adalah bakteri Gram-negatif, tidak berkapsul, mempunyai flagella dan tidak membentuk spora, Penularan Penyakit adalah melalui air dan makanan. Bakteri salmonella dapat bertahan lama dalam makanan. Penggunaan air minum secara masal yang tercemar bakteri sering menyebabkan terjadinya KLB. Vektor berupa serasngga juga berperan dalam penularan penyakit.
6. Kusta
Penyebab penyakit kusta adalah bakteri Mycobacterium leprae yang berbentuk batang dengan ukuran panjang 1-8 mikron, lebar 0,2-0,5 mikron, biasanya berkelompok dan ada yang tersebar satu-satu, hidup dalam sel, fan bersifat tahan asam (BTA). Bakteri kusta banyak terdapat pada kulit tangan, daun telinga dan mukosa hidung.
7. Leptospirosis
Leptospirosis adalah infeksi akut yang di sebabkan oleh bakteri leptospira. Penyakit ini di sebut juga Weil disease, Canicola fever,
Hemorrhagic jaundice, Mud fever, atau Swineherd disease. Genus
Lestospira yang termasuk dalam ordo Spirochaete dari family Trepanometaceae adalah bakteri yang berbentuk seperti benang dengan panjang 6-12 µm. spesies Leptospira interrogans adalah spesies yang dapat menginfeksi manusia dan hewan. Infeksi pada manusia dapat terjadi melalui kontak dengan air, tanah, dan lumpur yang tercemar bakteri, kontak dengan organ, darah,dan urine hewan terinfeksi15.
H. Pencegahan
Tindakan pencegahan dapat dilakukan dengan vaksinasi, sterilisasi, dan pasteurisasi, dan pengawetan bahan makanan.
36
Vaksinasi adalah pencegahan penyakit dengan pemberian vaksin, bakteri yang sudah dilemahkan, sehingga tubuh menerima dapat terhadap bakteri penyebab penyakit tertentu. Beberapa contoh vaksin untuk pencegahan penyakit yang disebabkan oleh bakteri adalah vaksin kolera untuk mencegah penyakit kolera, vaksin tifus untuk mencegah penyakit tifus, vaksin BCG (Bacile Calmette-Guerin) untuk mencegah penyakit TBC, vaksin DTP (Dipteria-Tetanus-Pertusis vaccines) untuk mencegah penyakit difterie, pertusis (batuk rejan), dan tetanus), dan vaksin TCD (Typus Chorela Disentry) untuk mencegah penyakit typus, kholera, dan desentri.
2. Sterilisasi
Sterilisasi adalah pemusnahan bakteri misalnya dalam pengawetan makanan. Tujuannya adalah untuk mendapatkan kondisi steril (suci hama), metodenya disebut aseptis. Sterilisasi dapat dilakukan melalui pemanasan dengan menggunakan udara panas atau uap air panas bertekanan tinggi. Sterilisasi dengan udara panas menggunakan oven dengan temperatur 170 – 180°C. Cara ini digunakan untuk mensterilisasikan peralatan di laboratorium . Sterilisasi dengan uap air panas bertekanan tinggi dilakukan dengan menggunakan alat yang disebut autoklaf, pada temperatur 115 – 134°C. Autoklaf digunakan untuk sterilisasi bahan dan peralatan. Sterilisasi pada umumnya digunakan pada industri makanan atau minuman kaleng, penelitian bidang mikrobiologi, dan untuk memperoleh biakan murni suatu jenis bakteri.
3. Pasteurisasi
Pasteurisasi adalah pemanasan dengan suhu 63 – 72 derajat celsius selama 15 - 30 menit. Pasteurisasi dilakukan pada bahan makanan yang tidak tahan pemanasan dalam suhu tinggi, misalnya susu. Sehingga untuk mematikan bakteri patogen (Salmonella dan Mycobacterium) dari susu dilakukan pasteurisasi. Dengan pasteurisasi, rasa dan aroma khas susu dapat dipertahankan.
37 BAB III
METODE PRAKTIKUM
A. Waktu Praktikum
Praktikum Isolasi dan Inokulasi Mikroorganisme dilaksanakan pada Selasa, 19 April 2016 pukul 09.00 sampai selesai dan Praktikum Morfologi Bakteri dilaksanakan pada Jumat, 22 April 2016 pukul 10.30 sampai selesai.
B. Tempat Praktikum
Praktikum Isolasi dan Inokulasi Mikroorganisme dilaksanakan di Laboratorium Terpadu Fakultas Kesehatan Masyarakat Universitas Diponegoro.
C. Alat
38
1. Bahan Isolasi dan Inokulasi Bakteri a. PCA media tegak
a. Biakan bakteri PCA 10-4
b. Pewarna Gram (Gram A = GV/Kristal violet, Gram B = Lugol, Gram C = Alkohol, Gram D = Air Fuchin)
e. Alkohol f. Aquadest
E. Teknik sampling
Pada praktikum isolasi dan inokulasi bakteri, sampel yang digunakan yaitu bagian permukaan tubuh (sela jari tangan) dari salah satu anggota. Waktu pengambilan sampel yaitu pada hari Selasa, 19 April 2016 pukul 08.30 WIB. Pada praktikum morfologi bakteri, sampel yang digunakan adalah agar tegak PCA dan EMBA.
F. Metode yang Digunakan
40
G. Prosedur Kerja
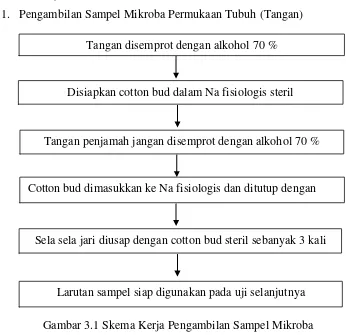
1. Pengambilan Sampel Mikroba Permukaan Tubuh (Tangan)
Gambar 3.1 Skema Kerja Pengambilan Sampel Mikroba (Sela Jari Tangan)
Tangan disemprot dengan alkohol 70 %
Disiapkan cotton bud dalam Na fisiologis steril
Tangan penjamah jangan disemprot dengan alkohol 70 %
Sela sela jari diusap dengan cotton bud steril sebanyak 3 kali Cotton bud dimasukkan ke Na fisiologis dan ditutup dengan
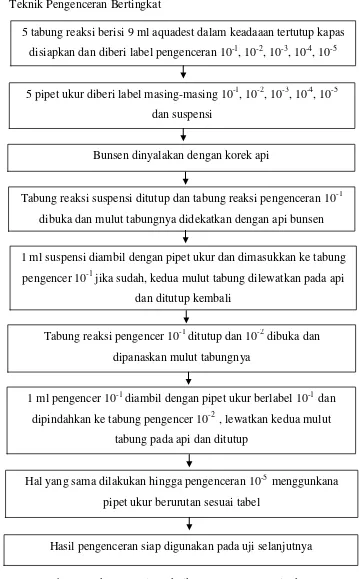
2. Teknik Pengenceran Bertingkat
Gambar 3.2 Skema Kerja Teknik Pengenceran Bertingkat 5 tabung reaksi berisi 9 ml aquadest dalam keadaaan tertutup kapas
disiapkan dan diberi label pengenceran 10-1, 10-2, 10-3, 10-4, 10-5
5 pipet ukur diberi label masing-masing 10-1, 10-2, 10-3, 10-4, 10-5 dan suspensi
Bunsen dinyalakan dengan korek api
Tabung reaksi suspensi ditutup dan tabung reaksi pengenceran 10-1 dibuka dan mulut tabungnya didekatkan dengan api bunsen
1 ml suspensi diambil dengan pipet ukur dan dimasukkan ke tabung pengencer 10-1 jika sudah, kedua mulut tabung dilewatkan pada api
dan ditutup kembali
Tabung reaksi pengencer 10-1 ditutup dan 10-2 dibuka dan dipanaskan mulut tabungnya
1 ml pengencer 10-1 diambil dengan pipet ukur berlabel 10-1 dan dipindahkan ke tabung pengencer 10-2 , lewatkan kedua mulut
tabung pada api dan ditutup
Hal yang sama dilakukan hingga pengenceran 10-5 menggunkana pipet ukur berurutan sesuai tabel
42
3. Skema Kerja Isolasi Mikroorganisme
Gambar 3.3 Skema Kerja Isolasi Mikroogranisme Media tegak dipanaskan diatas kompos hingga cair
1 ml suspensi pengenceran 10-3, 10-4, 10-5 dimasukkan ke dalam masing-masing cawan petri steril (3 buah cawan)
Media cair ditungkan ke masing-masing cawan petri yang berisi suspensi
Media diratakan dengan menggoyangkan cawan perlahan membentuk angka 8
Diamkan hingga media padat, semua perlakuan dalam suasana aseptis
4. Skema Kerja Inokulasi Biakan Murni
Gambar 3.4 Skema Kerja Inokulasi Biakan Murni Jarum inokulasi dipanaskan hingga pijar lalu didinginkan
Jarum inokulasi dimasukkan pada tabung pengenceran 10-3 hingga membentuk gelembung pada jarum ose
Segera disentuhkan pada permukaan media baru, jangan menekan media hingga rusak
Jarum inokulasi ditarik ke luar perlahan secara zig zag
Mulut tabung dipanaskan dan tabung disumbat kapas
Jarum inokulasi dibakar hingga pijar dan diletakkan pada tempatnya
Cawan yang berisi media dibungkus dengan kertas buram dalam posisi terbalik dan diinkubasi 2 x 24 jam
Diamati perubahannya
Media EMBA disiapkan dan bunsen dinyalakan
44
5. Skema kerja Morfologi Bakteri a) Pembuatan Film
Gambar 3.5 Skema Kerja Pembuatan Film pada Morfologi Bakteri
Objek glass dibilas alkohol, dikeringkan dan diberi tanda bulatan dengan spidol
Diberi satu tetes NaCl fisiologis pada objek glass
Jarum ose dipanaskan hingga pijar, diangin- anginkan
Jarum ose digesekkan zig zag pada biakan bakteri PCA 10-4
Jarum ose yang sudah ada bakteri, diletakkan pada tetesan NaCl fisiologis lalu diratakan
b) Pewarnaan Gram
Gambar 3.6 Skema Kerja Pewarnaan Gram pada
Morfologi Bakteri
Film ditetesi 1 tetes gram A (CGV) selama 30 detik
Dibilas dengan air dan dikeringkan dengan hairdryer
Ditetesi dengan 1 tetes gram B (Lugol) selama 30 detik, dibilas dengan air dan dikeringkan dengan hairdryer
Ditetesi dengan 1 tetes gram C (Alkohol) selama 30 detik, dibilas dengan air dan dikeringkan dengan
hairdryer
Ditetesi dengan 1 tetes gram D (Air Fuchin) selama 30 detik, dibilas dengan air dan dikeringkan dengan
hairdryer
Preparat ditetesi dengan 1 tetes minyak imersi
Desk glass dipasang dan jangan sampai terdapat gelembung udara
46
46 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Pengamatan
1. Isolasi dan Inokulasi Bakteri Mikroorganisme
Tabel 4.1 Hasil Pengamatan Isolasi dan Inokulasi Mikroorganisme
No Pengamatan Sampel Metode Hasil
Gambar 4.1 Pengenceran Gambar 4.2 Hasil Isolasi Pada
10-3,10-4, 10-5 Media PCA 10-4
Gambar 4.1 Menunjukkan pengenceran yang dilakukan secara bertingkat mulai dari 10-3,10-4, dan 10-5 . Sementara itu, Gambar 4.2 Menunjukkan hasil isolasi pada salah satu pengenceran yaitu 10-4 terlihat koloni bakteri yang berwarna putih dan kekuningan.
2. Morfologi Bakteri
Tabel 4.2 Hasil Pengamatan Praktikum Morfologi Bakteri No Media Warna Bentuk Gambar Gram 1. Agar
tegak PCA 10-4
Merah Batang koma
Negatif
48
B. Pembahasan
1. Deskripsi Pengujian
a. Metode Isolasi dan Inokulasi
Sampel yang digunakan adalah bagian permukaan tubuh (sela jari tangan). Suspensi sampel dilakukan dengan pengenceran bertingkat (10-1 sampai 10-5). Proses isolasi dan inokulasi dilakukan dengan cara aseptis untuk menghindari kontaminasi silang. Dalam proses isolasi mikroorganisme digunakan media PCA yang dituangkan ke cawan petri dan di tuang suspensi pengenceran 10-3, 10-4 dan 10-5 lalu cawan tersebut dibungkus dengan kertas buram dan diinkubasi 2 x 24 jam ke dalam inkubator.
Metode inokulasi menggunakan media EMBA dan menggunakan suspensi pengenceran 10-3 . Jarum ose yang sudah dipanaskan, dimasukkan ke tabung pengenceran dan disentuhkan pada media EMBA dengan bentuk zig zag. Lalu diinkubasi 2 x 24 jam ke dalam inkubator.
b. Metode Morfologi Bakteri
Metode yang digunakan dalam morfologi bakteri yaitu dengan media PCA 10-4 karena dalam media EMBA tidak ditemukan adanya bakteri. Media PCA 10-4 digunakan karena yang paling banyak ditumbuhi bakteri. Pertama dilakukan pembuatan film dengan memindahkan bakteri pada media PCA 10-4 ke objek glass dan ditetesi dengan NaCl fisiologis lalu dikeringkan di atas api. Kemudian dilakukan pewarnaan gram berturut – turut dari pewarnaan gram A (Kristal Violet), gram B (Iodium), gram C (Alkohol) dan gram D (Safranin), selanjutnya ditetesi dengan minyak imersi lalu preparat diamati dengan menggunakan mikroskop (perbesaran 100x).
2. Gambaran umum sampel
Fisiologis dan ditutup dengan kapas. Kemudian dilakukan pengenceran dengan teknik pengenceran bertingkat sebanyak 5 kali pengenceran (10-1 sampai 10-5). Pengenceran 10-3, 10-4 dan 10-5 dimasukkan ke dalam media PCA pada cawan petri yang akan digunakan untuk isolasi mikrorganisme. Pengenceran 10-3 dimasukkan ke dalam media EMBA pada pada cawan petri yang akan digunakan untuk inokulasi biakan murni. Mikroogranisme pada PCA 10-4 diambil dan diletakkan pada preparat yang akan digunakan untuk morfologi mikroorganisme.
3. Hasil Pengujian
a. Isolasi dan Inokulasi
Hasil praktikum isolasi mikroorganisme biakan bakteri sampel sela jari tangan penjamah terdapat biakan mikroorganisme yang berkoloni. Hal ini dapat dilihat pada cawan dengan pengenceran 10-3, 10-4 dan 10 -5
yang sudah diinkubasi selama 2x 24 jam. Sedangkan hasil inokulasi biakan murni terdapat sedikit biakan mikroorganisme sehingga diasumsikan terdapat kesalahan saat praktikum.
b. Morfologi bakteri
Pada morfologi bakteri menggunakan media PCA 10-4 yang paling banyak ditumbuhi bakteri. Berdasarkan hasil praktikum secara mikroskopis, dengan metode pewarnaan gram didapatkan bahwa biakan bakteri memiliki ciri-ciri yaitu bentuk bakteri batang berbentuk koma, warna bakteri berwarna merah. Dari ciri-ciri tersebut menandakan bahwa biakan bakteri pada media PCA 10-4 merupakan jenis bakteri gram negatif.
4. Faktor - Faktor yang Mempengaruhi Pengujian
a. Saat pengambilan sampel inokulasi pada media EMBA jarum ose, diduga gelembung telah menghilang terlebih dahulu sebelum disentuhkan ke media EMBA, yang menyebabkan sedikitnya bakteri pada media EMBA.
50
5. Dampak
Bakteri yang hidup pada media PCA 10-4 termasuk ke dalam bakteri gram negatif. Bakteri ini bersifat patogen, contoh bakteri gram negatif adalah Escherichia, Shigella, Salmonella, Enterobacter, Klebsiella, Serratia, Proteus, dll yang dapat menyebabkan penyakit pada manusia meliputi diare, salmonellosis, dan sebagainya.
51 BAB V PENUTUP
A. Kesimpulan
1. Praktikum isolasi mikroorganisme menggunakan tangan penjamah (sela jari tangan) sebagai sampel serta metode yang digunakan adalah metode tuang. Isolasi mikroorganisme menghasilkan biakan bakteri yang berkoloni ada yang berwarna kuning dan putih.
2. Praktikum inokulasi mikroorganisme biakan murni menggunakan tangan penjamah (sela jari tangan) sebagai sampel dan menggunakan media tegak. Hasil inokulasi biakan murni menghasilkan biakan bakteri yang kurang sempurna. Hal ini dapat disebabkan beberapa kemungkinan seperti hilangnya gelembung pada jarum ose sebelum disentuhkan zig zag pada media baru dan kemungkinan lain disebabkan kurang terampilnya praktikan dalam pengujian di laboratorium.
3. Praktikum morfologi bakteri menggunakan media tegak PCA dengan pengenceran 10-4 . Pengamatan morfologi bakteri secara mikroskopis melalui metode pewarnaan gram. Hasil dari praktikum ini yaitu terbentuk biakan bakteri batang koma, warna yang terlihat merah dan ciri-ciri tersebut menandakan bahwa biakan bakteri termasuk golongan gram negatif.
B. Saran
1. Praktikan lebih memahami prosedur kerja sebelum melakukan praktikum agar dapat meminimalkan kesalahan pada pelaksanaannya. 2. Dalam praktikum, semua harus aseptis untuk menghindari adanya
52
DAFTAR PUSTAKA
1. Rusli. Penuntun Praktikum Mikrobiologi Dasar. Makassar: Universitas Muslim Indonesia. 2014
2. Buckel, KA. Ilmu Pangan. Jakarta: Universitas Indonesia. 2007
3. Dwyana, Zaraswati. Bahan Ajar Mikrobiologi Dasar. Makassar: Universitas Hasanuddin. 2011
4. Saskia, Sinta; dkk. Praktikum Mikrobiologi Dasar. Makassar. 2006
5. https://www.academia.edu/16740977/LAPORAN_ISOLASI_DAN_INOK
ULASI_MIKROBIOLOGI_DASAR (Diakses tanggal 4 Mei 2016)
6. Ghoni, Achmad. Isolasi dan Inokulasi Bakteri. 2013
7. Dwidjoseputro. Dasar-Dasar Mikrobiologi. Jakarta: Djambatan. 1998 8. Oetomo, Hadi dan Ratna Sari. Mikrobiologi Dasar dalam Praktek. Jakarta:
PT. Gramedia. 1990
9. http://repository.usu.ac.id/bitstream/123456789/41660/4/Chapter%20II.pd
f (Diakses tanggal 4 Mei 2016)
10.EMB Agar. http://www.mediaagar.com/blog/emb-agar/. 2012 (Diakses tanggal 4 Mei 2016)
11.http://digilib.unila.ac.id/1374/7/BAB%20II.pdf (Diakses tanggal 4 Mei
2016)
12.http://digilib.unila.ac.id/5690/11/13.BAB%20II.pdf (Diakses tanggal 4
Mei 2016)
13.Dwyana, Zaraswati. Buku Ajar Biologi Sel dan Molekular. Makassar: Universitas Hasanuddin. 2014
14.Gana, D Mahata. Rahasia Bakteri. Jakarta: PT. Gramedia. 2008
15.
53 LAMPIRAN 1. Isolasi dan Inokulasi Mikroorganisme
Persiapan Pengenceran Tahap Pengenceran Larutan di vortex
Media PCA Pemasukkan larutan Pemasukkan media PCA ke
pengencer ke cawan cawan
54
Mengambil media baru Membungkus media EMBA Menginkubasi media EMBA
media EMBA dari dan PCA
2. Morfologi Bakteri
Objek glass dibilas alkohol Diberi 1 tetes Na Jarum ose dipanaskan hingga
lalu dibuat bulatan fisiologis pijar
Digesekkan zigzag pada Objek glass dikeringkan Objek glass diwarnai Gram
55
Objek glass dibilasi air Objek glass dikeringkan Objek glass kering A sampai Gram D dengan hairdryer
59 A. Latar Belakang
Keamanan pangan dapat ditentukan oleh ada tidaknya kontaminasi dari bahan-bahan yang tidak dapat dicerna seperti plastik, logam, maupun bahan yang dapat mengganggu pencernaan manusia, secara kimiawi dapat berasal dari zat-zat kimia berbahaya yang tidak boleh digunakan sebagai pangan seperti formalin, boraks, dan insektisida serta bahan tambahan makanan yang dibatasi penggunaannya seperti asam benzoat, askorbat, laktat sitrat dan bahan tambahan pangan lainnya sesuai dengan SNI 01-0222-1995. Bahaya mikrobiologi berasal dari adanya bakteri-bakteri patogen maupun racun yang ditimbulkannya pada bahan pangan.
Tahu merupakan salah satu makanan yang menyehatkan karna kandungan proteinya yang tinggi serta mutuhnya setara dengan mutu protein hewani. Hal ini biasa dilihat dari nilai NPU ( net protein utility ) tahu mencerminkan banyaknya protein yang dapat dimanfaatkan tubuh, yaitu sekitar 65%, disamping mempunyai daya cerna tinggi sekitar 85-98%. Oleh karna itu, tahu dapat dikonsumsi oleh segala lapisan masyarakat. Tentu juga mengandung zat guzi yang penting lainya, seperti lemak, vitamin, dan mineral dalam jumlah yang cukup tinggi.
Tahu selain memiliki kelebihan juga memiliki kelemahan, yaitu kandungan airnya yang tinggi sehingga mudah rusak karena mudah ditumbuhi mikroba. Untuk memperpanjaang masa simpan, kebanyakan industry tahu yang ada di Indonesia menambahkan pengawet. Bahan pengawet yang ditambahkan tidak terbatas pada pengawet yang diizinkan, tetapi banyak penggusaha yang nakal yang dengan sengaja menambahkan formalin.
60
dilarang, serta 42 jenis permen dan manisan impor China yang mengandung formalin. Dengan demikian dibutuhkan suatu pengujian terhadap kandungan formalin pada tahu yang beredar didaerah semarang.
B. Tujuan Praktikum
Tujuan dari praktikum uji kandungan formalin dalam makanan adalah untuk mengetahui kandungan formalin dalam makanan ( tahu kuning)
C. Manfaat Praktikum
Manfaat dari praktikum uji kandungan formalin dalam bahan makanan seperti tahu kuning adalah :
1. Memberikan informasi tentang ada atau tidaknya formalin dalam makanan seperti lontong
2. Menambah wawasan dan dapat mengetahui tahu kuning yang mengandung formalin berdasarkan hasil reaksi saat praktikum
3. Menambah pengetahuan tentang pengujian dan tata cara menguji kandungan formalin pada bahan makanan tahu kuning.
61 A. Pengertian Formalin
Formalin sebenarnya adalah bahan pengawet yang digunakan dalam dunia kedokteran, misalnya bahan pengawet mayat, selain itu juga digunakan untuk mengawetkan hewan-hewan untuk keperluan penelitian1. Bahan pengawet formalin adalah bahan tambahan pangan yang dapat mencegah atau menghambat proses fermentasi, pengasaman atau penguraian lain terhadap yang disebabkan oleh mikroorganisme. Bahan tambahan pangan ini biasanya ditambahkan pada makanan yang mudah rusak, atau makanan yang disukai bakteri atau jamur sebagai media pertumbuhan2. Formalin mempunyai kemampuan untuk mengawetkan makanan karena gugus aldehida yang bersifat mudah bereaksi dengan protein membentuk senyawa methylene. Sehingga protein yang sudah terikat oleh gugus aldehida tidak bias digunakan oleh bakteri pembusuk dan membuat makanan tersebut menjadi awet3.
Formalin dikenal sebagai bahan pembunuh hama (desinfektan) dan banyak digunakan dalam industry. Nama lain dari formalin adalah Formol, methylene, aldehide, parafonin, morbicid, oxomethane, polyoxymethylene, glycols, methanol, formoform, superlysoform, formaldehyde, dan formalith4.
B. Fungsi Formalin
Formalin banyak digunakan dalam berbagai jenis industry seperti pembuatan perabot, pengawet mayat, dan agen fiksasi di laboratorium. Penggunaan formalin diantaranya adalah sebagai berikut:
1. Pembunuh kuman sehingga digunakan sebagai pembersih lantai, gudang, pakaian, dan kapal.
2. Pembasmi lalat dan serangga
62
4. Bahan pembentuk pupuk
5. Bahan pembuatan produk parfum 6. Pencegah korosi untuk sumur minyak 7. Bahan perekat untuk produk kayu lapis5
C. Karakteristik Formalin
Karakteristik dari zat ini adalah mudah larut dalam air, mudah menguap, mempunyai bau yang tajam dan iritatif, mudah terbakar bila terjadi kontak dengan udara panas atau api. Rumus kimia formalin adalah HCHO6.
D. Sifat Fisik Kimia Dari Formalin
Formalin merupakan aldehid dengan struktur yang sederhana, berupa gas atau cairan tidak berwarna, bersih, bau pedas membusuk, sangat mudah larut dalam ir hingga 55%, rumus bangun HCHO. Berat melekul 30,03; titik didih -6oF (-21oC) ; titik beku – 134oF (-92oC) untuk bentuk anhidrat ; beratjenis pada -20oC ( air ˭ 1) 0,815 ; tekanan uap pada
– 33oC 400 mmHg ; bearat jenis uap (udara ˭ 1) 1,03 untuk larutan cair dan 1,075 untuk gas, tidak tercampur dengan asam, basa, reduktor, logam, garam logam, halogen, bahan yang mudah terbakar, proksida, oksidar, larut dalam alcohol, eter, aseton, benzene, kloroform; TLV 1 ppm.7
E. Dampak Formalin Bagi Kesehatan
Menurut internasional programme on chemical safety (IPCS) ambang batas formalin dalam tubuh adalah 1mg dalam pangan, formalin yang boleh masuk dalam tubuh antara 1,4-14 mg.8
F. Tanda dan Gejala Keracunan Formalin
1. Menyebabkan rasa terbakar pada mulut, saluran pernapasan dan perut, sulit menelan, diare, sakit perut, hipertensi, kejang dan koma.
2. Kerusakan hati, jantung, otak, limpa, pancreas, system susunan saraf pusat, dan gangguan ginjal.
3. Berdasarkan temuan patologis, formal dehid merusak jaringan dan menyusutkan selaput lenderga merusak hati, gijal, jantung, dan otak. 10
G. Tindakan Pencegahan 1 Terhirup
Untuk mencegah agar tidak terhirup gunakan alat perlindung untuk pernapasan sepertti masker, kain atau alat pelindung lainya yang dapat mencegah kemungkinan masuknya formalin kedalam hidung atau mulut. Bangunan dilengkapi ventilasi ruangan dengan penghisap udara yang tahan ledakan.
2 Terkena Mata
Gunakan pelindung mata atau kaca mata, penahan yang tahan terhadap percikan, sediakan Kran air untuk mencuci mata ditempat kerja yang berguna apabila terjadi keadaan darurat.
3 Terkena kulit
Gunakan pakaian pelindung bahan kimia yang cocok, gunakan sarung tangan yang tahan bahan kimia.
4 Tertelan
Hindari makan, minum, dan merokok selama bekerja, cuci tangan sebelum makan.11
H. Karakteristik Sampel
64
Tahu termasuk bahan makanan yang bekadar air tinggi. Besarnya kadar air dipengaruhi oleh bahan penggumpal yang dipakai pada saat pembuatan tahu. Bahan penggumpal asam menghasilkan tahu dengan kadar air lebih tinggi disbanding garam kalsium. Makanan-makanan yang berkadar air tinggi umumnya kandungan protein agak rendah. Selain air, protein juga merupakan media yang baik untuk pertumbuhan mikroorganisme pembusuk yang menyebabkan bahan mempunyai daya awet rendah13.
65
Praktikum dilaksanakan di Laboratorium Terpadu Fakultas Kesehatan Masyarakat Universitas Diponegoro
66
E. Teknik Sampling
Sampel yang diuji diambil pagi hari sebelum praktikum dilaksanakan dari salah satu pedagang sayur di Jalan Cinde Utara Semarang. Tahu kuning tersebut diproduksi dari pabrik tahu didaerah tersebut dengan kemasaan seharga 5 ribu rupiah per plastik.
F. Metode yang Digunakan
G. Prosedur Kerja Pengujian Kandungan Formalin
Gambar 3.1 Skema Kerja Pengujian Kandungan Formalin Sampel makanan (tahu kuning) dengan menggunakan
mortar dan penggerus
Dimasukkan sampel 10 gr kedalam beaker glass dan ditambahkan 30 ml air panas
Sampel diaduk hingga larut
Sampel disaring menggunakan kertas saring
Diambik 2 ml filtrat dan dimasukkan ke dalam tabung reaksiDiteteskan larutan
KMnO4 sebanyak 1 tetes
Kemudian dikocok hingga tercampur rata
Diamati perubahannya, adanya formalin ditunjukkan dengan hilangnya warna
pink dari KMnO4
Dibuat larutan pembanding, larutan 10ml sampel ditambah 1 tetes formalin dan
1 tetes KMnO4, dikocok hingga tercampur rata
68 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Pengamatan
Berikut adalah hasil praktikum uji kandungan formalin dalam sampel tahu kuning.
Tabel 4.1 Hasil Uji Kandungan Formalin dalam Tahu Kuning No Nama
Keterangan Gambar : gambar diatas menunjukkan persamaan warna pada larutan sampel dan larutan pembanding yaitu berwarna coklat muda dan itu menunjukkan bahwa sampel positif mengandung formalin.
B. Pembahasan 1. Deskripsi Pengujian
Dalam praktikum ini dilakukan uji kandungan formalin yang terdapat didalam tahu kuning yang dijual oleh pedagang di daerah Semarang. Langkah pertama yang dilakukan yaitu menghaluskan sampel tahu dengan mortar dan penggerus. Setelah itu 10 gram sampel dimasukkan kedalam beaker glass dan dicampur dengan 30 ml aquadest. Selanjutnya larutan tersebut disaring dan filtratnya ditambahkan dengan 1 tetes KMno4. Lalu dihomogenkan dengan vortex. Jika warna pink dalam KMno4 berubah warna maka sampel positif mengandung formalin.
2. Kandungan Formalin Pada Sampel
Dari hasil pengamatan pada tahu kuning, warna sampel mula-mula berwarna putih kemudian setelah ditetesi dengan KMnO4 sebanyak 1 tetes terjadi perubahan warna yaitu menjadi berwarna coklat muda. Dengan demikian, membuktikan bahwa sampel yaitu tahu kuning mengandung formalin ditandai dengan hilangnya warna pink dari KMnO4. Pada analisis kuantitatif, perubahan warna pada larutan KMnO4 disebabkan karena aldehid mereduksi KMnO4 sehingga warna larutan yang asalnya pink menjadi coklat muda. Berdasarkan pengamatan dibuktikan bahwa warna larutan sampel dan larutan pembanding sama.
Dalam penggunaan formalin di masyarakat, khususnya pedagang tahu kuning terdapat faktor perilaku yang mempengaruhi. Berkaitan dengan perilaku, beberapa hal yang mempengaruhi adalah pengetahuan dan sikap. Pengetahuan merupakan dominan yang sangat penting dalam terbentuknya tindakan seseorang. Sikap merupakan komponen yang sangat penting dalam melakukan tindakan
70
tiga hari pada suhu kamar (25 derajat Celsius) dan bertahan lebih dari 15 hari pada suhu lemari es ( 10 derajat Celsius), terlampau keras, namun tidak padat, bau agak menyengat.
Efek jangka pendek yang dialami apabila mengkonsumsi makanan yang mengandung formalin yaitu :
a. Jika terkena mata, maka akan terjadi iritasi, gatal dan penglihatan kabur.
b. Jika tertelan maka dapat menimbulkan kerusakan hati, jantung, otak, limpa, ginjal, dll.
c. Jika terhirup maka dapat menyebabkan iritasi pada hidung, tenggorokan, batuk, diare dan gangguan paru- paru/ pernafasan. d. Gangguan menstruasi dan kemandulan pada perempuan.
e. Luka pada ginjal, gangguan pernafasan, daya ingat terganggu, sulit tidur hingga kanker otak.
f. Jika bersentuhan dengan kulit dapat menyebabkan panas, mati rasa hingga radang kulit
3. Faktor-faktor yang mempengaruhi pengujian
71 A. Kesimpulan
1. Hasil uji kandungan formalin pada sampel makanan tahu kuning adalah positif. Hal tersebut dibuktikan dengan perubahan warna yang terjadi pada sampel setelah ditetesi KMno4 yang semula putih menjadi coklat muda
2. Berdasarkan peraturan Menteri Kesehatan Nomor 1168/Menkes/per/x/1999 ditegaskan bahwa formalin dilarang digunakan dalam makanan
B. Saran
1. Selalu menjaga kebersihan dari alat-alat yang digunakan selama praktikum agar tidak terjadi kontaminasi
2. Dibutuhkan keakuratan dalam proses penambahan zat – zat yang digunakan sebagai pereaksi untuk menghindari kesalahan hasil akhir 3. Diperlukan ketelitian dalam pengamatan perubahan warna