BAB II
TINJAUAN PUSTAKA
II.1. STROKE ISKEMIK
II.1.1. Definisi
Stroke adalah suatu episode disfungsi neurologi akut disebabkan oleh iskemik atau perdarahan berlangsung 24 jam atau meninggal, tapi
tidak memiliki bukti yang cukup untuk diklasifikasikan (Sacco dkk, 2013). Stroke iskemik adalah episode disfungsi neurologis disebabkan infark fokal serebral, spinal dan infark retinal. Dimana infark SSP adalah
kematian sel pada otak, medulla spinalis, atau sel retina akibat iskemia, berdasarkan :
• Patologi, imaging atau bukti objektif dari injury fokal iskemik
pada serebral, medula spinalis atau retina pada suatu distribusi vaskular tertentu.
• Atau bukti klinis dari injury fokal iskemik pada serebral, medulla
spinalis atau retina berdasarkan simptom yang bertahan ≥24
jam atau meninggal dan etiologis lainnya telah dieksklusikan
(Sacco dkk, 2013).
II.1.2. Epidemiologi
Insidensi stroke iskemik pertama kali pada 100.000 penduduk adalah 88 untuk kulit putih dan 191 pada kulit hitam, 149 pada hispanik,
dan ini berdasarkan data yang dikumpulkan kelompok studi Northern Manhattan Study (NOMAS) dan National Institutes of Neurological Disorders and Stroke (NINDS). Pada keseluruhan kulit hitam dibandingkan kulit putih kejadian stroke rata-rata: stroke dengan aterosklerosis intracranial 5,85; stroke dengan aterosklerosis ekstrakranial 3,18; stroke
lakunar 3,09; stroke kardioemboli 1,58 (Roger dkk, 2011).
World Health Organization (WHO) memperkirakan insidensi stroke ini akan meningkat dari 1,1 juta di tahun 2000 menjadi 1,5 juta jiwa pada 2025, berdasarkan proyeksi populasi penduduk. Di Indonesia insiden stroke sebesar 51,6/100.000 penduduk. Penderita laki-laki lebih banyak
daripada perempuan dan profil usia dibawah 45 tahun : 11,8%, usia 45-64 tahun : 54,2% dan usia lebih dari 65 tahun 33,5%. Stroke menyerang usia
produktif dan lanjut usia, yang berpotensi menimbulkan masalah baru dalam pembangunan kesehatan secara nasional di kemudian hari (Truelsen, 2006; Misbach dkk, 2011).
II.1.3 Faktor Resiko
Faktor- faktor resiko untuk terjadinya stroke dapat diklasifikasikan sebagai berikut : (Sjahrir, 2003).
1. Non modifiable risk factors :
a. Usia
b. Jenis Kelamin
2. Modifiable risk factors a. Behavioral risk factors
1. Merokok
2. Unhealthy diet : lemak, garam berlebihan, asam urat, kolesterol, low fruit diet.
3. Alkoholik
4. Obat – obatan: narkoba (kokain), antikoagulansia, antiplatelet,
obat kontrasepsi. b. Physiological risk factors
1. Penyakit hipertensi
2. Penyakit jantung 3. Diabetes mellitus
4. Infeksi/lues, arthritis, traumatic , AIDS, lupus 5. Gangguan ginjal
6. Kegemukan (obesitas)
7. Polisitemia, viskositas darah meninggi dan penyakit perdarahan 8. Kelainan anatomi pembuluh darah
9. Dan lain-lain.
II.1.4. Klasifikasi
Dasar klasifikasi yang berbeda – beda diperlukan, sebab setiap jenis stroke mempunyai cara pengobatan, pencegahan dan prognosa
I. Berdasarkan patologi anatomi dan penyebabnya : 1. Stroke iskemik
a. Transient Ischemic Attack (TIA)
b. Thrombosis serebri c. Emboli serebri
2. Stroke Hemoragik
a. Perdarahan intraserebral
b. Perdarahan subarachnoid
II. Berdasarkan stadium / pertimbangan waktu 1. Transient Ischemic Attack (TIA)
2. Stroke in evolution 3. Completed stroke
III. Berdasarkan sistem pembuluh darah 1. Sistem karotis
2. Sistem vertebrobasiler
IV. Klasifikasi Bamford untuk tipe infark yaitu : 1. Partial Anterior Circulation Infarct (PACI) 2. Total Anterior Circulation Infarcy (TACI)
3. Lacunar Infarct (LACI)
4. Posterior Circulation Infarct (POCI)
V. Klasifikasi Stroke Iskemik berdasarkan kriteria kelompok peneliti TOAST (Sjahrir, 2003)
Gejala klinik dan penemuan imejing otak yang signifikan (>50%) stenosis atau oklusi arteri besar di otak atau cabang arteri di korteks disebabkan oleh proses aterosklerosis. Gambaran computed tomography (CT) sken
kepala MRI menunjukkan adanya infark di kortikal, serebellum, batang otak, atau subkortikal yang berdiameter lebih dari 1,5 mm dan potensinya
berasal dari aterosklerosis arteri besar. 2. Kardioembolisme
Oklusi arteri disebabkan oleh embolus dari jantung. Sumber embolus dari jantung terdiri dari :
a. Resiko tinggi
• Prostetik katub mekanik
• Mitral stenosis dengan atrial fibrilasi
• Fibrilasi atrial (other than lone atrial fibrillation)
• Atrial kiri / atrial appendage thrombus • Sick sinus syndrome
• Miokard infark baru (<4 minggu) • Thrombus ventrikel kiri
• Kardiomiopati dilatasi
• Segmen ventricular kiri akinetik • Atrial myxoma
• Infeksi endokarditis b. Resiko sedang
• Kalsifikasi annulus mitral
• Mitral stenosis tanpa fibrilasi atrial
• Turbulensi atrial kiri • Aneurisma septal atrial • Patent foramen ovale
• Atrial flutter
• Lone atrial fibrillation
• Katub kardiak bioprostetik
• Trombotik endokarditis nonbacterial • Gagal jantung kongestif
• Segmen ventrikuler kiri hipokinetik • Miokard infark (> 4minggu, < 6 bulan)
3. Oklusi Arteri Kecil
Sering disebut juga infark lakunar, dimana pasien harus mempunyai satu gejala klinis sindrom lakunar dan tidak mempunyai gejala gangguan
disfungsi kortikal serebral. Pasien biasanya mempunyai gambaran CT Sken/MRI kepala normal atau infark lakunar dengan diameter <1,5 mm di
daerah batang otak atau subkortikal.
4. Stroke Akibat dari Penyebab Lain yang Menentukan a. Non-aterosklerosis Vaskulopati
• Non inflamasi
• Inflamasi non infeksi
b. Kelainan Hematologi atau Koagulasi
5. Stroke Akibat dari Penyebab Lain yang Tidak Dapat Ditentukan
II.1.5. Patofisiologi
Pada stroke iskemik, hilangnya perfusi ke otak dalam beberapa
detik sampai menit menyebabkan terjadinya kaskade iskemik yang menyebabkan gambaran pusat sentral area infark irreversible yang dikelilingi area penumbra (potensial reversible) (Gofir, 2009).
Secara umum daerah regional otak yang iskemik terdiri dari bagian inti (core) dengan tingkat iskemia terberat dan berlokasi di sentral. Daerah
ini akan menjadi nekrotik dalam waktu singkat jika tidak ada reperfusi. Di luar daerah core iskemik terdapat daerah penumbra iskemik. Sel – sel
otak dan jaringan pendukungnya belum mati akan tetapi sangat berkurang fungsi–fungsinya dan menyebabkan juga defisit neurologis. Tingkat iskemiknya makin ke perifer makin ringan. Daerah penumbra iskemik, di
luarnya dapat dikelilingi oleh suatu daerah hiperemis akibat adanya aliran darah kolateral (luxury perfusion area). Daerah penumbra iskemik inilah
yang menjadi sasaran terapi stroke iskemik akut supaya dapat di reperfusi dan sel-sel otak berfungsi kembali. Reversibilitas tergantung pada faktor waktu dan jika tidak terjadi reperfusi, daerah penumbra dapat
Iskemik otak mengakibatkan perubahan dari sel neuron otak secara bertahap, yaitu (Sjahrir, 2003):
Tahap 1 :
a. Penurunan aliran darah otak. b. Pengurangan O2.
c. Kegagalan energi.
d. Terminal depolarisasi dan kegagalan homeostasis ion.
Tahap 2 :
a. Eksitoksisitas dan kegagalan homeostasis ion. b. Spreading depression.
Tahap 3 : Inflamasi
Respon inflamatorik pada stroke iskemik akut mempunyai pengaruh
buruk yang memperberat bagi perkembangan infark serebri. Berbagai penelitian menunjukkan adanya perubahan kadar sitokin pada penderita stroke iskemik akut. Mikroglia merupakan makrofag serebral yang
merupakan sumber sitokin utama di serebral. Sitokin adalah mediator peptida molekuler, merupakan protein atau glikoprotein yang dikeluarkan
oleh suatu sel dan mempengaruhi sel lain dalam suatu proses inflamasi, contohnya limfokin dan interleukin (IL-1 beta, IL-6, IL-8, TNF-α) yang
merupakan sitokin pro inflamatorik. Adanya IL-8 tersebut merupakan diskriminator terkuat yang membedakan kasus stroke dengan non stroke. Produksi sitokin yang berlebihan mengakibatkan plugging mikrovaskuler
memperberat penurunan aliran darah, juga mengakibatkan eksaserbasi kerusakan blood brain barrier dan parenkim melalui pelepasan enzim
hidrolitik, proteolitik dan produksi radikal bebas yang akan menambah neuron yang mati (Sjahrir, 2003; Harukuni dkk, 2006; Farhoudi M dkk, 2012).
Tahap 4 : Apoptosis
II.2 C-Reactive Protein
II.2.1. Pengenalan C – Reactive Protein
C-Reactive Protein (CRP) pertama kali ditemukan tahun 1930 oleh William Tillet dan Thomas Francis. Pada penelitian darah pasien yang mengidap infeksi streptokokus pneumoni akut ditemukan serum yang
membentuk presipitan dengan ekstrak dari bakteri streptokokus. Ekstrak ini mula-mula dinamakan fraksi C dan kemudian diketahui sebagai polisakarida. Oleh karena itu substansi dalam serum hasil dari reaktivitas
C-polisakarida dari dinding sel streptokokus disebut CRP. Ikatan kalsium dari CRP yang berikatan dengan afinitas tinggi terhadap phosphocholine (unsur dasar membran sel phospholipid, phosphatidylcholine). Jika terjadi
II.2.2. Struktur C- Reactive Protein (CRP)
C – Reactive Protein merupakan protein fase akut dengan struktur homopentametric dan ikatan kalsium yang spesifik untuk phospocholine (PCh). C – Reactive protein merupakan bagian dari family pentraxin nonglikosilasi yang termasuk dalam “lectin fold superfamily”. Molekul
human CRP terdiri dari 5 subunit polipeptida nonglikosilasi (promoter) yang berkeliling nonkovalen, tersusun secara cyclic pentametric simetris
dan dirakit keliling dengan sebuah poros sentral dengan konfigurasi seperti sebuah piringan. Setiap subunit mempunyai massa 23,027 Da (terdiri dari 206 asam amino residu) dan secara keseluruhan massa
human CRP adalah 115,135 Da (Pepys dkk, 2003;Hirschfield dkk, 2003).
Lektin terdiri dari dua struktur lapisan protein β dengan dua ikatan
kalsium dan mampu mengenali dan berikatan dengan fosfokolin residu dari fraksi polisakarida – C dari pemecahan Streptococcus pneumonia (Husain dkk, 2002; Semple dkk, 2006).
Ikatan autolog termasuk native dan modified plasma lipoprotein, sel membran yang rusak, beberapa ikatan fosfolipid dan komponen yang
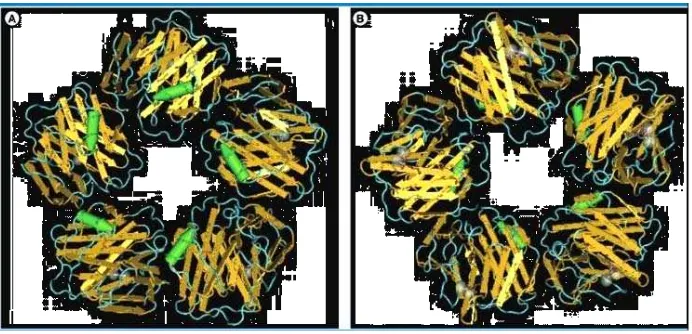
Gambar 1. Struktur CRP
Keterangan Gambar : struktur Pentametric C-Reactive Protein (Di Napoli dkk, 2011)
A. Menunjukkan penampang efektor (sisi tempat ikatan untuk C1q dan FcɣRs) dari pentamer C-reactive protein dengan heliks penghubung berwarna hijau.
B. Penampang rekognisi (recognition face) Merupakan model gambaran C-reactive protein yang menunjukkan sisi ikatan untuk molekul phospocholine (merah) dengan dua molekul kalsium (abu-abu) yang berlokasi pada sisi ikatan dari masing masing protomer pada penampang pengenalan, bagian tengah terdapat kantung hidrofobik pada tiap protomer.
Dikutip dari : Di Napoli, M., Elkind, M. S., Godoy, D.A., Singh, P.,Papa, F., Popa-Wagner, A. 2011. Role of C-Reactive Protein in Cerebrovascular Disease. Expert Rev Cardiovasc Ther. 9(12):1565-1584.
II.2.3. Pembentukan C-Reactive Protein
Pada orang dewasa yang sehat konsentrasi median dari CRP
adalah 0,8mg/l dan persentil 90 adalah 3,0mg/l dan persentil 99 adalah 10mg/l namun akibat stimulus fase akut kadarnya dapat meningkat kurang dari 50µg/l sampai dengan 500 mg/l (kenaikan 10.000 kali). C-Reactive
Protein disintesa dalam bentuk pecahan dari hepatosit predominan dibawah kendali transkripsi oleh cytokine IL-6 walaupun di bagian lain sintesa lokal dan sekresinya dapat terjadi. C-reactive protein lalu
terhadap CRP dengan memberikan sinyal melalui reseptor pada sel hepatik dan mengaktivasi kinase dan phosphatase yang berbeda,
mengarah pada translokasi dari berbagai faktor transkripsi pada gen promoter dan produksi dari CRP (Di Napoli dkk, 2011, Pepys dkk, 2003).
Pembersihan CRP dari plasma dan katabolisme oleh hati serta
plasma half life adalah sekitar 19 jam sama pada semua individu dan konstan pada semua kondisi sehat dan sakit. Perbedaan dari konsentrasi
plasma adalah dalam hal kecepatan sintesanya (Semple dkk, 2006; Hirschfield dkk, 2003, Pepys dkk, 2003).
Peningkatan CRP darah setelah jaringan mengalami cedera secara
cepat, kadar dalam plasma meningkat 2 kali lipat tiap 8 jam dan kadar puncak pada 36-50 jam, walaupun ini sangat tergantung pada pencetus
dan beratnya cedera (Di Napoli dkk, 2011; Roudbary dkk, 2011).
Biomarker inflamasi C-Reactive Protein adalah protein reaktan fase akut yang diproduksi oleh hepatosit dibawah pengaruh sitokin. Regulasinya
akan meningkat pada plak atheromatous yang mencetuskan pengambilan kolesterol LDL oleh makrofag yang merupakan langkah kunci dalam
aterogenesis (Dewan dkk, 2011).
Pada dekade terdahulu, CRP telah menjadi fokus investigasi untuk mengidentifikasi peranannya secara kompleks pada penyakit
digunakan sebagai biomarker resiko penyakit serebrovaskular, sebagai faktor risiko determinan dengan peranan kausal secara langsung pada patogenesis stroke dan sebagai prediktor outcome stroke baik jangka
pendek maupun jangka panjang (Elkind dkk, 2010; Di Napoli dkk, 2011).
II.2.4. Faktor Yang mempengaruhi kadar C-Reactive Protein
Pada subjek yang normal, CRP adalah suatu bentuk plasma
protein. Di Amerika Serikat pernah dilaporkan bahwa nilai median CRP adalah 2mg/L pada usia 17 tahun keatas. Di Skotlandia dan Jerman rata-rata konsentrasi CRP adalah 0,81 – 1,25mg/L. Dibandingkan benua Eropa
kadar CRP basal lebih tinggi di Asia, namun penyebab dari perbedaan ini belum pasti. Pada individu normal tidak ada bukti perbedaan konsentrasi
diurnal dari CRP baik pada pria maupun wanita ( Di Napolli dkk, 2011). C reactive protein yang standard digunakan untuk menilai proses inflamasi yang aktif yang kronis seperti artritis, menilai proses infeksi yang baru, dan
monitoring respon pengobatan terhadap kondisi ini. Jenis CRP yang lain yaitu high sensitivity C reactive protein (hs-CRP), substansi ini
dipertimbangkan sebagai marker inflamasi vaskular dalam kadar yang rendah yang merupakan faktor kunci pada perkembangan dan ruptur dari plak ateromatous ( Roudbary dkk, 2009).
Pada individu yang pernah melakukan pemeriksaan serial bulanan kadar CRP kadar rata-rata CRP secara umum pada rentang 0,1 – 3 mg/L,
namun peningkatan kadar CRP berhubungan dengan berbagai kondisi patologis, dapat dilihat pada tabel 1 (Di Napoli dkk, 2011).
Tabel 1. Kondisi yang berhubungan dengan peningkatan/penurunan kadar hs-CRP
Dikutip dari : Pearson, T.A., Mensah, G., Alexander, W., Anderson, J.L., Cannon R, Criqui, M., et al. Markers of inflammation and cardiovascular disease: Aplication to Clinical and Public Health Practice : A statement for healthcare Professionals from the centers for disease control and prevention and American Heart Association. Circulation.2003;107:499-511.
II.2.5. Fungsi C-Reactive Protein
Fungsi utama CRP adalah berikatan dan detoksifikasi terhadap
II.2.6. Patobiologi aterosklerosis
Peranan inflamasi sangat berkembang pada dekade terakhir dan
banyak teori yang memaparkan proses penyakit aterosklerosis. Melalui sudut pandang patologis seluruh tahapan inisiasi, pertumbuhan dan komplikasi plak aterosklerosis diduga merupakan respon inflamasi
terhadap adanya cedera. Hal yang paling awal terjadi pada proses aterogenesis adalah disfungsi dari sel endotel (Jialal I dkk, 2001).
Cedera mayor yang dapat menyebabkan aterogenesis antara lain perokok, hipertensi, lipoprotein aterogenik, dan hiperglikemia. Faktor risiko ini meningkatkan stimulus noxius yang beragam yang menyebabkan
sekresi dari molekul leukocyte soluble adhesion yang memfasilitasi pertambahan sel monosit terhadap sel endotel dan faktor kemotaksis yang
mendorong migrasi monosit kedalam ruang sub intima. Transformasi monosit menjadi makrofag dan pengambilan kolesterol lipoprotein diduga mencetuskan pembentukan fatty streak. Stimulus cedera yang berlanjut
lebih lama akan menyebabkan pembentukan dan akumulasi dari makrofag, sel mast, aktifasi sel T pada daerah pertumbuhan lesi
aterosklerotik. Oksidasi LDL mungkin merupakan salah satu dari beberapa faktor yang berkontribusi dalam hal hilangnya otot polos melalui proses apoptosis untuk penutup plak aterosklerosis dan sekresi metalloproteinase
dan enzim jaringan ikat lainnya yang diaktivasi oleh makrofag yang dapat menghancurkan kolagen, melemahkan penutup sehingga cenderung
terpaparnya pusat ateronekrotik pada aliran darah arteri yang merangsang terjadinya trombosis. Setiap tahap dari aterogenesis ini dianggap
melibatkan sitokin, molekul bioaktif dan sel – sel inflamasi lainnya (Pearson dkk,2003; Jialal I dkk, 2001).
Peningkatan pengenalan komponen inflamasi ini menyediakan
target potensial untuk pengukuran dan penilaian beberapa proses inflamasi. Target potensial mencakup pengukuran faktor risiko pro
inflamasi seperti LDL teroksidasi, sitokin proinflamasi (contohnya interleukin-1, tumor necrosis factor-α), molekul adhesi (contohnya molekul intracellular adhesion-1, selectins), stimulus inflamasi dengan efek hepatik (interleukin-6), atau produk stimulasi hepatik seperti serum amiloid A, C-Reactive Protein (CRP)) dan reaktan fase akut lainnya (Pearson dkk, 2003).
Beberapa pengamatan menyatakan bahwa CRP secara aktif berpartisipasi dalam inisiasi, kemajuan dan destabilisasi dari lesi
aterosklerotik termasuk ruptur plak, dan perkembangan komplikasi ateroma (Ahuja dkk, 2012).
Studi sebelumnya menunjukkan CRP di produksi pada daerah vaskularisasi oleh sel jaringan otot halus dan makrofag dan dapat menginduksi adhesi ekspresi molekul pada sel endotel yang mempunyai
chemokine receptor-2) pada monosit manusia, yang menyebabkan pengurangan ekspresi dan bioaktivitas langsung dari endothelial Nitrit Oxide Synthase (eNOS) pada sel endotel aorta manusia dan menyebabkan pembentukan foam cell, secara terpisah diambil oleh CRP-opsonized native LDL. Fakta mengenai peran CRP pada aterosklerosis tidak timbul walaupun beberapa laporan memaparkan secara luas mengenai proinflamasi, protrombotik. Efek potensial CRP sebagai
proaterogenik dan proaterotrombotik telah terlihat pada tikus percobaan (Di Napoli dkk, 2011).
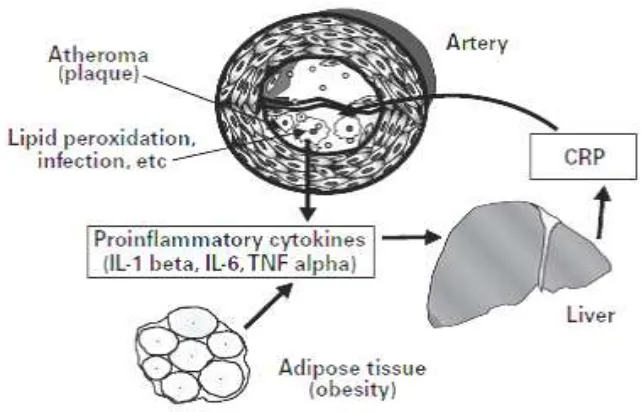
Gambar 2. Skema yang menggambarkan peran highly sensitivity c-reactive protein pada inflamasi dan aterosklerosis. IL: Interleukin, TNF: tumor necrosis factor
Dikutip dari : Jialal, I., Devaraj, S. 2001. Inflammation and AtherosclerosisThe Value of the High-Sensitivity C-Reactive Protein Assay as a Risk Marker Am J ClinPathol;116 (Suppl 1):S108-S115
II.2.7. Patogenesis CRP pada Stroke Iskemik
Segera setelah onset stroke iskemik akut, peningkatan kadar CRP
mencerminkan reaksi inflamasi ikutan, proses inflamasi ini mempunyai peranan penting dalam patofisiologi dari stroke. Iskemik serebri merangsang respon inflamasi yang ditandai dengan aktivasi dan
pelepasan protein fase akut seperti C-Reactive Protein dan sitokin. Proses inflamasi ini dimulai dalam 2 jam setelah onset stroke dan bertahan
beberapa hari dan berperan pada kerusakan jaringan otak yang mengalami iskemik walaupun masih tahap awal. Kadar CRP tidak hanya mencerminkan luasnya kerusakan jaringan namun juga mengindikasikan
peningkatan bagian yang berisiko akibat peningkatan inflamasi ataupun kelebihan sitokin. Studi eksperimental terbaru menunjukkan CRP
berkontribusi pada kerusakan jaringan otak secara sekunder setelah iskemik serebri fokal, yang kemungkinan terjadi melalui eksaserbasi complement-mediated dari jaringan yang cedera (Di Napoli dkk, 2011).
Peningkatan kadar CRP menggambarkan luasnya daerah otak yang mengalami cedera. Dan kadar CRP juga dapat menjadi indikator
kecenderungan kerusakan jaringan otak secara sekunder setelah iskemik serebri lokal. Hal ini juga menunjukkan peningkatan CRP setelah stroke bukan hanya merupakan konsekuensi dari infark jaringan otak namun
berkontribusi juga pada kerusakan jaringan (Hertog dkk, 2009).
Mekanisme patogenesis dari CRP yaitu ikatan yang berlebihan
merangsang aktivasi substansi komplemen dengan pelepasan faktor kemotaksis dan opsonisasi sel dan sekeliling lesi, yang mendorong
peningkatan infiltrasi sel inflamasi sebagai akibat kerusakan jaringan sekitarnya (lihat gambar 3). Model ini didukung oleh berbagai data yang mengindikasikan bahwa CRP mengaktivasi makrofag dan merangsang
leukosit pada jaringan yang rusak dengan ikatan FcɣR yang muncul pada sel fagositik dan leukosit (Di Napoli, 2011).
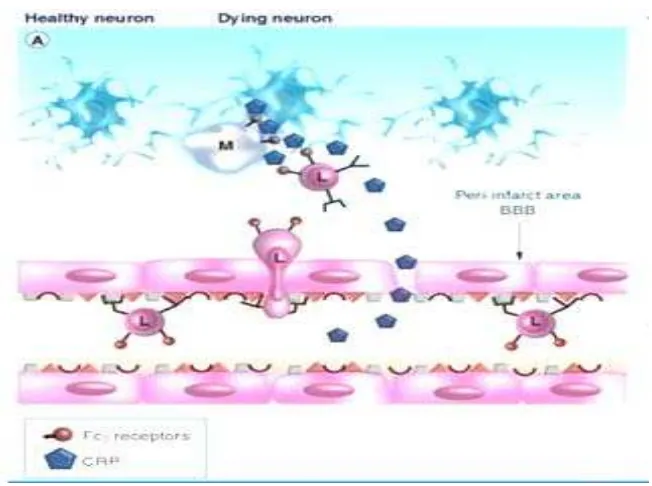
Gambar 3. Mekanisme patogenisitas C-reactive protein pada susunan saraf pusat
(A) Ikatan yang banyak dari CRP dengan ligan yang terekspos pada sel yang mati dan rusak yang merangsang aktivasi komplemen dengan pelepasan faktor kemotaktik dan opsonisasi sel dalam dan sekeliling lesi yang menyebabkan aktivasi makrofag dan infiltrasi melalui inflamasi sel via ikatan dengan reseptor FcɣR pada leukosit dan makrofag yang ada pada daerah lesi. Kadar dari CRP dalam serum berhubungan dengan jumlah dari makrofag dan limfosit T dalam plak.
II.3. Computed Tomography (CT) Scan dan Volume Infark
CT sken tanpa kontras (Non-Contrast Computed Tomography/
NCCT) merupakan pemeriksaan radiologi rutin yang pertama di unit gawat darurat untuk menilai penderita dengan stroke akut, dan masih tetap merupakan pemeriksaan imejing stroke akut yang standar. Dengan CT
memungkinkan dengan jelas membedakan iskemik otak dengan perdarahan dan menentukan ukuran dan lokasi dari infark dan hemoragik
(Caplan, 2009).
Pada infark otak akut menurut standar pendidikan bahwa CT adalah normal dalam 24 jam pertama setelah onset stroke (Furlan dkk,
2001). Pada iskemia, pada stadium awal sering normal atau hanya sedikit abnormalitas. Selama hari-hari pertama onset stroke, infark biasanya bulat
atau oval dan batasnya kurang tegas. Kemudian menjadi lebih hipodense dan gelap, dan lebih seperti baji (wedge-like) dan berbatas. Sebagian infark yang tadinya hipodens menjadi isodens setelah minggu kedua dan
ketiga onset stroke. Hal ini yang disebut sebagai fogging effect kadang-kadang dapat mengaburkan lesi. Kemudian infark akan menjadi hipodens
lagi (Caplan, 2009).
Pantano dkk (1999) meneliti 450 dari 620 pasien yang ikut dalam studi European Cooperative Acute Stroke Study 1 (ECASS1), menemukan
bahwa sekitar dua pertiga penderita ukuran infarknya dapat ditegakkan dalam 24-36 jam setelah onset stroke, sedangkan sisanya perubahan
digunakan untuk menghitung volume infark adalah AxBxC/2, dimana diameter terbesar (A) dikali dengan diameter tegak lurus terhadapnya (B)
pada lesi dan dikali dengan diameter ketiga (C) yang diukur dengan menjumlahkan ketebalan slice dimana lesi masih terlihat, kemudian dibagi dua.
Pada suatu penelitian disimpulkan bahwa rumus AxBxC/2 adalah akurat dan merupakan perhitungan geometri terbaik untuk menghitung volume infark. Rumus AxBxC/2 memiliki positive predictive value yang
tinggi dan mudah digunakan (Sims dkk, 2010).
II.4. Hubungan Volume Infark dengan Outcome Stroke
Menurut penelitian yang dilakukan Saver dkk (1999), volume infark berhubungan dengan outcome klinis setelah 3 bulan yang dinilai dengan
neurological and functional assessments scales. Dari hasil penelitian didapati 132 pasien memiliki infark baru didaerah supratentorial dengan
volume infark median 28,0cm3 (range interkuartil 9-93cm3). Sebanyak 59 pasien memiliki infark baru yang tidak terlihat. Hubungan dengan skala
outcome setelah 3 bulan dan kematian adalah sebagai berikut : Barthel Index r=0.43; Glasgow outcome scale r=0.53; NIHSS r=0.54; dan angka mortalitas r=0,31. Untuk infark yang terlihat , hubungan dengan outcome
BI r=0,46; GOS r=0,59; NIHSS r=0,56; mortalitas r=0,32.
berdasarkan volume infarknya dan dilakukan pengukuran infark dengan menggunakan sken diffusion weighted imaging (DWI). Pada 169 kasus
dijumpai bahwa setiap peningkatan 10 cm3 dari volume infark didapatkan OR untuk mencapai outcome yang baik adalah 0,57(95% CI, 0,37 – 0,88) untuk mRS dan 0,75 (95% CI, 0,56 – 1,01) untuk nilai Barthel Index (BI)
setelah dilakukan penyesuaian terhadap kondisi klinis lainnya. Sebagai kesimpulan didapatkan semakin meningkat volume infark maka kemungkinan untuk mencapai outcome yang baik akan semakin menurun.
Attye dkk (2012) melakukan penelitian yang bertujuan untuk mencari hubungan antara volume infark pada saat masuk rumah sakit
(diukur dengan sken DWI) dengan outcome fungsional dalam 90 hari melalui skor mRS. Untuk setiap peningkatan 10 cm3 volume infark
dijumpai OR untuk mRS kurang atau sama dengan 1 adalah 10,1 (95% CI, 3-33,9). Dimana hasil penelitian ini menunjukkan bahwa terdapat hubungan yang terbalik antara peningkatan volume infark dengan
outcome fungsional yang baik dalam 90 hari.
II.5. PENILAIAN OUTCOME STROKE
Kehilangan fungsi yang terjadi setelah stroke sering digambarkan sebagai impairments, disabilitas dan handicaps. Oleh WHO membuat
batasan sebagai berikut (Caplan, 2009) :
1. Impairments : menggambarkan hilangnya fungsi fisiologis,
psikoterapi, fisioterapi, terapi okupasional ditujukan untuk menetapkan kelainan ini.
2. Disabilitas adalah setiap hambatan, kehilangan kemampuan untuk
berbuat sesuatu yang seharusnya mampu dilakukan orang yang sehat seperti : tidak bisa berjalan, menelan dan melihat akibat
pengaruh stroke.
3. Handicaps adalah halangan atau gangguan pada seseorang
penderita stroke berperan sebagai manusia normal akibat ”impairment” atau “disability” tersebut .
Studi ini akan menggunakan modified Rankin Scale (mRS) sebagai skala
pengukuran outcome.
Skala mRS lebih mengukur ketergantungan daripada performasi
aktifitas spesifik, dalam hal ini mental demikian juga adaptasi fisik digabungkan dengan defisit neurologi. Skala ini terdiri dari beberapa derajat, yaitu dari 0-5, dimana 0 berarti tidak ada gejala dan 5 berarti
cacat/ketidakmampuan yang berat, dan 6 (outcome fatal). Skala mRS adalah lebih sensitif untuk penilaian pada penderita dengan disabilitas
II.6. KERANGKA TEORI
(Lakhan E, 2009)respon iskemik →aktivasi
mikroglia→pelepasan sitokin proinnflamasi (TNF α,IL 1β,IL-6, molekul sitotoksik.
(Di Napoli, 2003)respon inflamasi akut stlh stroke→(sitokin&CRP)→inflamasi berhub dgn patobiologi stroke iskemik
Inflamasi
(Elkind, 2010) inflamasi: peran dalam aterosklerosis,ruptureplak,stroke.biomarker inflamasi(hs-CRP)→prediktor stroke I kali dan prognosa setelah stroke
(Roudbary,2011) → iskemik kardiak, kerusakan jar otak dan infark→proses inflamasi→eksistensi sel inflamasi & produksi protein akut (CRP) bbrp jam stlh stroke
↑
Kadar hs-CRP
Volume infark
Outcome
fungsional
(Saver,1999)Vol Infark→outcome klinis stlh 3 bln
CRP ↑→marker independen outcome buruk
(Nighoghossian,2007)respon inflamasi sistemik→respon jar nekrotik.
II.7. KERANGKA KONSEP
Stroke Iskemik Akut
Kadar hs-CRP