BAB II
TINJAUAN PUSTAKA
2.1. Penyakit Paru Obstruktif Kronik (PPOK) 2.1.1 Defenisi PPOK
Penyakit Paru Obstruktif Kronik (PPOK) adalah penyakit paru yang dapat
dicegah dan diobati, ditandai oleh hambatan aliran udara yang persisten, bersifat
progresif dan berhubungan dengan respons inflamasi paru terhadap partikel atau gas
yang beracun/berbahaya, disertai efek ekstraparu yang berkontribusi terhadap derajat
berat penyakit.14
2.1.2 Epidemiologi PPOK
Di Indonesia tidak ditemukan data yang akurat tentang kekerapan PPOK. Survei
Kesehatan Rumah Tangga (SKRT) 1992 menemukan angka kematian emfisema,
bronkitis kronik dan asma menduduki peringkat ke-6 dari 10 penyebab tersering
kematian di Indonesia. Pada tahun 1997 penderita PPOK yang dirawat inap di RSUP
Persahabatan sebanyak 124 (39,7%), sedangkan rawat jalan sebanyak 1837 atau 18,95%.
Di RSUD dr. Moewardi Surakarta ditemukan penderita PPOK rawat inap sebanyak 444
(15%), dan rawat jalan 2368 (14%).
Penyakit paru obstruktif kronik merupakan penyebab morbiditas dan kematian
ke-4 terbesar di dunia dan WHO memperkirakan bahwa pada tahun 2020 PPOK menjadi
penyebab kematian ketiga tertinggi di dunia. Angka prevalensi, morbiditas, dan
mortalitas PPOK bervariasi antar negara dan di antara kelompok populasi, umumnya
berkaitan dengan prevalensi perokok serta kondisi polusi udara akibat pembakaran yang
juga telah diidentifikasi sebagai faktor risiko PPOK. 15
Menurut Raherison (2009) prevalensi PPOK diperkirakan 7,6% (95% CI 6 -
9,2%. Berdasarkan 38 penelitian, prevalensi bronkitis kronis diperkirakan 6,4% (95% CI
5,3-7,7%). Prevalensi emfisema (melalui rontgen dada) diperkirakan 1,8% (95% CI
1,3-2,6%) berdasarkan delapan studi. Mayoritas studi (62%) menunjukkan umur pasien lebih
dari 40 tahun, dengan rentang usia antara 40 dan 64 tahun. Prevalensi PPOK meningkat
sesuai dengan usia, dengan peningkatan risiko menjadi lima kali lipat bagi mereka yang
berusia di atas 65 tahun dibandingkan dengan pasien berusia kurang dari 40 tahun.
Prevalensi PPOK meningkat sesuai dengan status merokok, tetapi perlu ditekankan
bahwa prevalensi PPOK pada perokok adalah 4%, menunjukkan adanya faktor risiko
lain, seperti merokok pasif, atau faktor paparan akibat kerja. PPOK terjadi pada laki-laki
dua kali lebih banyak dibanding perempuan, tetapi perbedaan ini akan berkurang,
mengingat fakta bahwa semakin banyak perempuan yang merokok terutama di negara
berkembang, dan bahwa perempuan yang tidak merokok terkena produk hasil
pembakaran dari biomassa di negara berkembang.
Menurut Purba (2010) berdasarkan studinya menemukan penderita PPOK stabil
yang berobat jalan di Poli RS H. Adam Malik sekitar 82 orang dalam satu tahun,
laki-laki sekitar 85,4%, umur lebih dari 60 tahun sekitar 63,4%. 16
17
Kondisi tersebut
menunjukkan angka kematian yang disebabkan PPOK terus mengalami peningkatan
tanpa disadari masyarakat.
2.1.3 Patogenesis PPOK
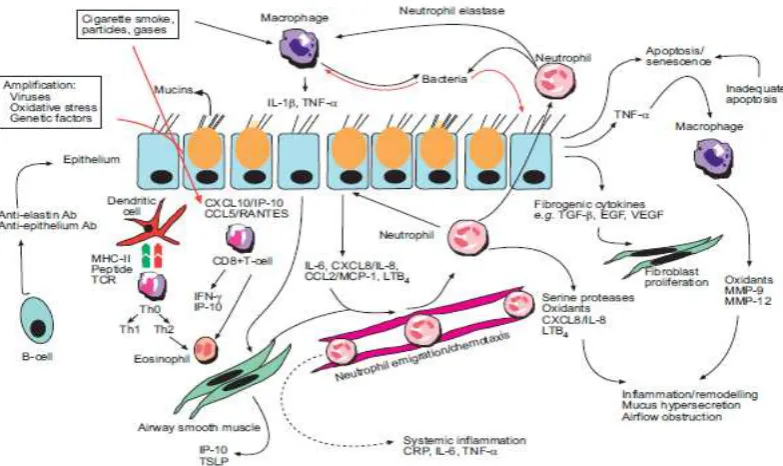
Inflamasi saluran napas pada pasien PPOK merupakan amplifikasi dari respon
inflamasi akibat iritasi kronik seperti asap rokok. Mekanisme untuk amplifikasi ini
belum diketahui, kemungkinan dapat disebabkan faktor genetik. Pada pasien PPOK yang
diketahui. Inflamasi paru diperberat oleh tekanan oksidatif dan kelebihan proteinase.
Semua mekanisme ini mengarah pada karakteristik perubahan patologis PPOK.
Mikroba tidak sendirian dalam memicu sistem imunitas tubuh melainkan terdapat
keterlibatan tekanan selular, kerusakan jaringan akibat dari infeksi TLR. Hasil dari sel
epitel yang cedera ini dapat bertindak sebagai ligan untuk TLR4 dan TLR2 yang akan
mengaktifkan NF-kB. NF-kB ini akan menginduksi sel epitel untuk memproduksi
mediator peradangan. Mediator ini akan mengaktifkan makrofag dan neutrofil, yang
pada gilirannya akan mensekresikan enzim proteolitik dan bersama dengan ROS akan
merusak jaringan paru-paru. Pada sebagian besar perokok proses penyakit ini tidak akan
berkembang jika peradangan ini diminimalkan dan peristiwa pada tahap selanjutnya
tidak terjadi.
14
Pada perokok dengan PPOK, terjadi peningkatan sel dendritik yang matang di
saluran napas perifer yang berhubungan dengan tingginya ekspresi chemoattractant dari
sel dendritik di paru. Terdapat juga peningkatan sel T CD4+ yang mengekspresikan
STAT4 di paru-paru. Ekspresi STAT4 dan IFN-γ berkorelasi dengan hambatan aliran
napas pada PPOK. Pada paru-paru perokok, material yang berasal dari sel yang
mengalami stres, cedera, nekrosis dan apoptosis diambil oleh sel dendritik dan disajikan
melalui MHC-I ke sel T CD8+ yang menyebabkan sel T melimpah di paru-paru
penderita PPOK. 18
Selanjutnya sel T CD8+ dan CD4+ akan mengekspresikan reseptor
kemokin spesifik jaringan seperti CXCR3, CCR5, dan CXCR6 dimana ekspresi dari
reseptor dan ligan ini berkorelasi dengan keparahan penyakit PPOK.Kegagalan ringan
dari mekanisme pengaturan ini menghasilkan GOLD derajat 1 atau derajat 2; kegagalan
berat menjadi GOLD derajat 3 atau tahap 4.18
Asap rokok dapat mencetuskan pelepasan sitokin inflamasi dari berbagai sel
menyebabkan terjadinya ROS yang akan manghambat aktivitas mediator anti protease
terutama α1-antitripsin yang menyebabkan defisiensi anti protease. Masuknya IL-8 dan
netrofil ke parenkim paru akan diikuti oleh makrofag dan sel T CD8+. Makrofag akan
aktif dan melepaskan sejumlah MMP (MMP1, MMP2, MMP9, MMP12 dan MMP15)
yang akan mendegradasi baik elastin dan kolagen. Netrofil juga berperan menghasilkan
oksidan endogen dengan konsentrasi tinggi. Oksidan ini bersama dengan sitokin masuk
ke sistem vaskular.19
Efek nikotin di seluruh saluran napas diperkirakan memicu pelepasan fibronektin
yang mengakibatkan terjadinya fibrosis yang dimediasi oleh IL-8 dan TGF-β1. Pada
penderita PPOK terjadi apoptosis struktur sel (sel epitel dan endotel) dan sel-sel
inflamasi (neutrofil polimorfik) yang tidak teratur, sehingga terjadi peningkatan IL-6 dan
IL-8. Aktivasi NF-kB berkaitan dengan penghambatan apoptosis, sehingga akan
memperpanjang umur netrofil dan remodeling.
Jumlah sel CD4+ mengekspresikan IFN-γ dan berkorelasi dengan derajat
obstruksi aliran napas. Perekrutan dan aktivasi sel-sel inflamasi, makrofag, neutrofil,
eosinofil, sel T CD4+ dan CD8+, dan sel B memperburuk PPOK. Pada PPOK interaksi
antara kemokin CXCL10 dan CXCL9, akan meningkatkan produksi MMP-12 sehingga
menyebabkan kerusakan paru-paru. Fungsi sel dendritik yang meningkat, kecenderungan
genetik, dan kegagalan regulasi imunitas adaptip dan penyakit berat (GOLD tahap 3 atau
tahap 4).
19
Gambar 1. Inflamasi pada PPOK. Paparan rokok yang kronik mengakibatkan aktifasi netrofil, makrofag, sel epitel, sel dendritik, sel T, sel B, fibroblast dan sel otot polos saluran napas sehingga terjadi pengeluaran sitokin, kemokin, dan protease. Amplifikasi sinyal sangat berperan dalam hal menambah respon inflamasi yang akan mempengaruhi derajat berat PPOK.20
1. Tekanan Oksidatif
Tekanan oksidatif dapat menjadi mekanisme penting dalam PPOK. Biomarker
tekanan oksidatip (misalnya, peroksida hidrogen, 8-isoprostan) meningkat dalam sputum,
hembusan napas dan sirkulasi sistemik pada pasien PPOK. Tekanan oksidatip ini lebih
meningkat pada eksaserbasi. Oksidan bisa dihasilkan oleh asap rokok dan partikel
lainnya serta partikel yang dilepaskan dari sel-sel inflamasi seperti makrofag dan
neutrofil, dan dapat juga terjadi penurunan antioksidan endogen pada pasien PPOK.
Tekanan oksidatip menyebabkan aktifasi gen inflamasi, antiprotease menjadi tidak aktip,
2. Ketidakseimbangan protease-antiprotease
Proteinase berperan penting dalam patogenesis PPOK. Hipotesa
proteinase-antiproteinase menyatakan bahwa kerusakan paru-paru penderita PPOK terjadi jika aksi
proteinase tidak lagi dikendalikan oleh antiproteinase. Ini dapat terjadi ketika ada
kelainan genetik antiproteinase, seperti defisiensi α1-antitrypsin, atau kehilangan fungsi
antiproteinase dikarenakan proteolitik atau kerusakan oksidatip. Ketidakseimbangan juga
dapat terjadi karena perekrutan yang berlebihan atau aktivasi proteinase.
Proteinase diklasifikasikan sebagai serine proteinase, sistein proteinase, dan
MMP. Peran MMP dalam PPOK adalah mendegradasi protein matriks, antiproteinase
seperti α1-antitipsin dan α1-antichymotrypsin, memodifikasi sitokin dan menurunkan
sejumlah protein seperti faktor adhesi dan substansi P.
21
21
3. Remodeling saluran napas kecil
Interaksi antara inflamasi dan remodeling saluran napas kecil telah diketahui
mekanismenya melalui binatang percobaan. Ekspresi berlebihan dari Th2 sitokin IL-10
menyebabkan metaplasia sel mukus, sel B, sel T dan fibrosis subepitel saluran napas.
Respon ini melibatkan banyak mekanisme. Metaplasia mukus tergantung pada sinyal
IL-13/IL-4 reseptor-α / STAT6. Selanjutnya ekspresi berlebihan dari IL-1β menginduksi
fibrosis peribronkial. Pada kultur trakea tikus, asap rokok menyebabkan peningkatan
regulasi TGF-β1.
Sinyal faktor pertumbuhan fibroblast dan reseptor FGF (FGFR) tampaknya
terkait dengan saluran napas dan remodeling pembuluh darah pada bronkitis kronis.
Studi imunohistokimia jaringan paru-paru dari pasien PPOK menunjukkan bahwa
napas serta sel epitel saluran napas. Dasar FGF/FGF-2 terlokalisasi di sitoplasma, inti
epitel saluran napas, otot polos pembuluh darah dan sel endotel.22
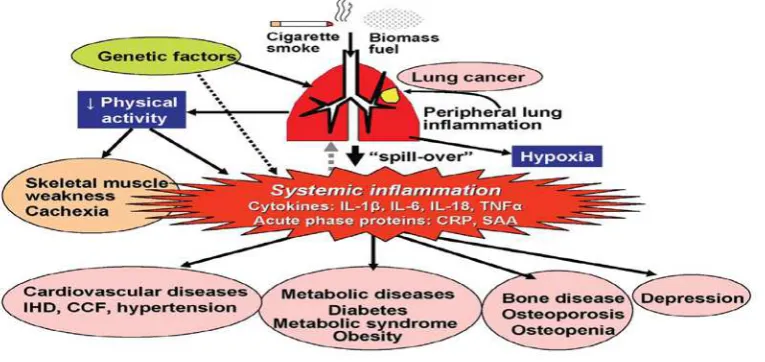
Gambar 2. Inflamasi perifer di paru dapat masuk ke sirkulasi sistemik.
Pada pasien PPOK terutama saat eksaserbasi terdapat keterlibatan dari beberapa
sitokin inflamasi mencakup TNFα, IL-6, CXCL8 (IL-8), IL-18, dan protein fase akut
(CRP, SAA, fibrinogen) pada inflamasi sistemik. Sitokin ini juga mengalami
peningkatan di sputum dan cairan BAL pasien PPOK, hal ini menjadikan sebagian ahli
memandang bahwa sitokin sistemik berasal dari tumpahan mediator inflamasi perifer
(paru). Namun hubungan antara mediator di sputum dan di darah tidaklah erat, sehingga
keterlibatan faktor lain diperkirakan berperan dalam proses ini. Akibat dari keterbatasan
aliran udara yang progresif menimbulkan aktivitas
23
fisik menjadi tidak aktif, hal ini
merupakan faktor penting dalam mencetuskan beberapa penyakit penyerta, seperti
kelemahan otot rangka, osteoporosis, dan penyakit kardiovaskular.
PPOK mencakup proses inflamasi dan aterosklerosis diketahui berperan penting
sebagai komponen inflamasi kronik, CRP yang merupakan petanda inflamasi sistemik
dan indikator penting pada penyakit kardiovaskular ditemukan juga meningkat pada
sebagian ahli memandang bahwa proses inflamasi di paru adalah salah satu bagian dari
manisfestasi atau ekspresi proses inflamasi sistemik pada penderia PPOK. Akibat
perbedaan konsep ini maka berbeda pula cara pandangnya terhadap penanganan PPOK,
dimana konsep pertama menekankan terapi pada paru sedangkan pada konsep yang
kedua lebih menekankan pengendalian inflamasi sistemik.24
2.1.4. Patologi
1. Saluran napas sentral
Perubahan morfologi dan seluler di saluran napas sentral telah menjadi fokus
suatu studi yang dilakukan pada perokok dengan gejala bronkitis kronis. Epitel biasanya
utuh dan menunjukkan perubahan skuamosa metaplastik serta peningkatan jumlah sel
goblet. Dalam subepitelium, sel-sel mononuklear muncul menjadi sel utama, dengan
hanya sedikit neutrofil. Komponen mononuklear terdiri dari limfosit dan makrofag,
peningkatan yang signifikan dilaporkan terjadi pada jumlah CD45+ (leukosit total),
CD3+ (Limfosit T), CD25+ (aktivasi awal), sel VLA-1+ (akhir aktivasi) dan makrofag.
Selain itu, ada juga laporan terdapatnya eosinofilia pada bronkitis kronis, khususnya
selama eksaserbasi. Sitokin IL-10 berperan dalam mengurangi respon inflamasi dan
kadarnya menurun dalam dahak perokok dengan PPOK, sitokin IL-8 berperan
merangsang kemotakis neutrofil, sitokin TNF-α berperan mengaktifkan molekul adhesi,
dimana kadar ketiga sitokin ini mengalami peningkatan. Peningkatan regulasi terhadap
molekul adhesi E-selektin dan ICAM-1 pada subepitel pembuluh darah dan epitel
bronkus pada perokok dengan bronkitis kronis mengarahkan pada mekanisme
pengambilan neutrofil dari sirkulasi dan bermigrasi ke lumen saluran napas melalui
2. Saluran napas perifer
Pada perokok hambatan aliran udara yang terkait dengan perubahan patologis
lebih lanjut di saluran napas perifer termasuk remodeling saluran napas (fibrosis dan
hipertrofi otot polos) dan inflamasi. Selain itu, peradangan dinding saluran napas dapat
berkontribusi terhadap kerusakan dinding alveolar yang melekat pada saluran napas
yang memungkinkan kerusakan dinding saluran napas dan penyempitan lumen.
Mekanisme selanjutnya berkontribusi terhadap keterbatasan aliran udara pada
perokok yang melibatkan sekresi mukus. Hiperplasia sel goblet pada perokok dapat
berkontribusi terhadap pengembangan keterbatasan aliran udara kronis dengan
memproduksi kelebihan mukus yang bisa mengubah tegangan permukaan jalan napas.
Menariknya, pada epitel aliran udara perifer perokok, hiperplasia sel goblet
berhubungan dengan peningkatan jumlah neutrofil. Sebagaimana neutrofil elastase
adalah penghasil sekresi mediator inflamasi yang sangat potensial, lokasi neutrofil dalam
epitel dapat berperan penting untuk mengaktifkan fungsi sekresi sel goblet. 25
25
3. Parenkim paru
Komponen yang paling penting dari definisi emfisema adalah proses destruksi.
Tergantung pada bagaimana asinus hancur, emfisema dapat diklasifikasikan menjadi dua
jenis: (1) emfisema sentriasinar (atau sentrilobular), yang ditandai dengan kehancuran
terbatas pada bronkiolus dan bagian tengah dari asinus, dikelilingi oleh parenkim
paru-paru normal, dan (2) emfisema panasinar (atau emfisema panlobular), di mana
keseluruhan asinus terlibat.
25
Saat ini telah diketahui dengan jelas tentang mekanisme patofisiologis yang
mendasari PPOK sampai terjadinya gejala yang khas, misalnya penurunan VEP1 yang
disebabkan peradangan dan penyempitan saluran napas perifer, sementara transfer gas
yang menurun terjadi akibat kerusakan parenkim paru pada emfisema.14
1. Keterbatasan aliran udara dan hambatan udara
Tingkat peradangan, fibrosis dan cairan eksudat di lumen saluran napas kecil
berkorelasi dengan penurunan VEP1 dan rasio VEP1/KVP. Penurunan VEP1 merupakan gejala yang khas pada PPOK, obstruksi jalan napas perifer ini menyebabkan udara
terperangkap dan mengakibatkan hiperinflasi.
Hiperinflasi mengurangi kapasitas inspirasi seperti peningkatan kapasitas residual
fungsional, khususnya selama latihan (kelainan ini dikenal sebagai hiperinflasi dinamis),
yang terlihat sebagai sesak napas dan keterbatasan kapasitas latihan. Hiperinflasi yang
berkembang pada awal penyakit merupakan mekanisme utama timbulnya sesak napas
pada aktifitas. Bronkodilator yang bekerja pada saluran napas perifer mengurangi
hambatan udara, sehingga mengurangi volume residu dan gejala serta meningkatkan
keterbatasan kapasitas latihan.
14
14
2. Mekanisme pertukaran gas
Pada PPOK yang lanjut kombinasi dari obstruksi saluran napas perifer, destruksi
parenkim dan kelainan pembuluh darah pulmonal mengurangi kapasitas paru untuk
pertukaran gas, menyebabkan hipoksemia pada tahap lanjut penyakit juga menyebabkan
hiperkapnia. Korelasi antara tes fungsi paru rutin dan gas darah arteri memburuk.
Hipoksemia biasanya terjadi jika melakuan aktifitas, tetapi jika penyakit terus
Ketidaksamaan rasio ventilasi/perfusi merupakan mekanisme utama yang
menyebabakan hipoksemia pada PPOK, dengan tanpa melihat tingakatan penyakit.
Hiperkapnia kronik biasanya menunjukkan disfungsi otot inspirasi dan hipoventilasi
alveolar.
Hipertensi pulmonal dapat terjadi pada PPOK dikarenakan vasokonstriksi yang
diakibatkan hipoksia dari arteri pulmonal yang kecil, yang mengakibatkan perubahan
struktural termasuk hiperplasia intima dan selanjutnya hipertropi otot polos dan
hiperplasia. Adanya respons inflamasi dalam pembuluh darah sering terlihat di saluran
napas dan merupakan bukti dari disfungsi sel endotel. Jika hipertensi pulmonal terus
berlangsung dapat menyebabkan hipertropi ventrikel kanan dan biasanya menjadi gagal
jantung kanan (cor pulmonale). 26
14
3. Eksaserbasi
Eksaserbasi merupakan peningkatan lebih lanjut respons inflamasi dalam saluran
napas pasien PPOK. Keadaan ini dapat dipicu oleh infeksi bakteri atau virus atau polusi
lingkungan. Mekanisme inflamasi yang mengakibatkan eksaserbasi PPOK masih banyak
yang belum diketahui. Pada eksaserbasi ringan dan sedang terdapat peningkatan netrofil,
beberapa studi lainnya juga menemukan eosinofil dalam sputum dan dinding saluran
napas. Hal ini berkaitan dengan peningkatan konsentrasi mediator tertentu, termasuk
TNF-α, LTB4 dan IL-8, serta peningkatan biomarker stress oksidatip.
Pada eksaserbasi berat masih banyak hal yang belum jelas, meskipun salah satu
penelitian menunjukkan peningkatan neutrofil pada dinding saluran napas dan
peningkatan ekspresi kemokin. Selama eksaserbasi terlihat peningkatan hiperinflasi dan
peningkatan sesak napas. Terjadi juga perburukan yang mengakibatkan hipoksemia
berat.14
2.1.6 Diagnosis
Beberapa hal yang berhubungan dengan risiko timbulnya PPOK sampai saat ini
yaitu asap rokok, polusi udara (dalam ruangan, diluar ruangan) tekanan oksidatif, gen,
tumbuh kembang paru, sosial ekonomi. Risiko PPOK pada perokok tergantung dari dosis
rokok yang dihisap, usia mulai merokok, jumlah batang rokok pertahun dan lamanya
merokok (Indeks Brinkman). Tidak semua perokok berkembang manjadi PPOK secara
klinis, karena dipengaruhi oleh faktor resiko genetik pada setiap individu. Gejala dan
tanda PPOK sangat bervariasi, mulai dari tanda dan gejala ringan hingga berat. Gejala
klinis yaitu berupa:
1. Sesak napas yang progresip dan bertambah berat seiring berjalannya waktu dan
aktifitas, dan persisten
2. Batuk kronik yang hilang timbul dan mungkin tidak berdahak.
3. Batuk kronik berdahak
4. Riwayat terpajan faktor resiko berupa asap rokok, debu, bahan kimia di tempat kerja,
asap dapur.
Pemeriksaan fisis pada PPOK dini umumnya tidak dijumpai kelainan. Dari
inspeksi dapat ditemukan: 27
1. Pursed-lips breathing (mulut setengah terkatup/mencucut) yaitu sikap seseorang
yang bernapas dengan mulut mencucu dan ekspirasi yang memanjang.
2. Barrel chest (diameter anteroposterior dan transversal sebanding).
3. Penggunaan otot bantu napas.
5. Pelebaran sela iga.
6. Bila telah terjadi gagal jantung kanan terlihat denyut vena jugularis di leher dan
edema tungkai.
7. Penampilan pink puffer yaitu gambaran yang khas pada emfisema, pasien kurus, kulit
kemerahan dan pernapasan pursed-lips breathing, atau blue bloater yaitu gambaran
khas pada bronkitis kronik, pasien gemuk sianosis, terdapat edema tungkai dan ronki
basah di basal paru, sianosis sentral dan perifer.
Pada palpasi biasanya ditemukan fremitus melemah, sela iga melebar. Perkusi
pada emfisema hipersonor dan batas jantung mengecil, letak diafragma rendah, hepar
terdorong ke bawah. Pada Auskultasi terdengar suara napas vesikuler normal atau
melemah dan terdapat ronki dan atau mengi pada waktu bernapas biasa atau pada
ekspirasi paksa, ekspirasi memanjang, bunyi jantung terdengar jauh. 27
27
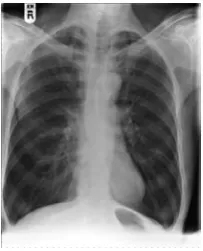
Gambar 3. Gambaran radiologi penderita PPOK.
Foto toraks PA dan lateral tidak direkomendasikan untuk mendiagnosis PPOK
tetapi dapat digunakan untuk menyingkirkan penyakit lain yang juga dapat menimbulkan
gejala obstuksi saluran napas (bronkiektasis, kanker paru dan lain-lain). Temuan pada
foto toraks dapat berupa: hiperinflasi, hiperlusen, ruang retrosternal melebar, diafragma
mendatar, jantung pendulum (jantung menggantung). 28
Spirometri merupakan baku emas untuk mendiagnosa PPOK. Hasil pengukuran
spirometri penderita PPOK, didapati penurunan volume ekspirasi paksa 1 detik (VEP 27
dan penurunan kapasitas vital paksa (KVP). Nilai VEP1/KVP selalu kurang dari 80%
nilai normal. VEP1% merupakan parameter yang paling umum dipakai untuk menilai
beratnya PPOK dan memantau perjalanan penyakit.
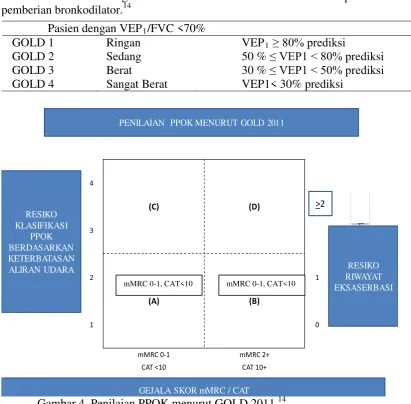
Tabel 1. Pembagian hambatan aliran udara berdasarkan spirometri setelah pemberian bronkodilator.
Note: When assessing risk, choose the highest risk according to GOLD grade or exacerbation history PENILAIAN PPOK MENURUT GOLD 2011
RESIKO
Gambar 4. Penilaian PPOK menurut GOLD 2011.14
2.1.7. Penatalaksanaan PPOK
Tujuan penatalaksanaan PPOK adalah meliputi beberapa komponen yaitu:
mengurangi gejala, mencegah progresivitas penyakit, meningkatkan toleransi latihan,
meningkatkan status kesehatan, mencegah dan menangani komplikasi, mencegah dan
menangani eksaserbasi, menurunkan kematian. Penatalaksanaan secara umum PPOK Pasien dengan VEP1/FVC <70%
GOLD 1 Ringan VEP1 ≥ 80% prediksi
GOLD 2 Sedang 50 % ≤ VEP1 < 80% prediksi
GOLD 3 Berat 30 % ≤ VEP1 < 50% prediksi
GOLD 4 Sangat Berat VEP1< 30% prediksi
meliputi beberapa hal yaitu edukasi, berhenti merokok, obat-obatan, rehabilitasi, terapi
oksigen, ventilasi mekanis, dan nutrisi.27
2.2 C-reactive protein (CRP)
CRP ditemukan oleh Tillett dan Francis pada tahun 1930, dinamai CRP karena
kemampuannya untuk mengendapkan C-polisakarida dari Streptococcus pneumoniae.
CRP merupakan protein fase akut yang memiliki kemampuan untuk mengikat bakteri
kemudian memfasilitasi pengikatan komplemen yang diperlukan untuk memfagositosis
bakteri. CRP merupakan penanda sistemik yang sangat peka terhadap reaksi inflamasi dan kerusakan jaringan. Respon fase-akut meliputi respon nonspesifik yang fisiologis
dan biokimia terhadap berbagai bentuk kerusakan jaringan, infeksi, peradangan, dan
keganasan. Protein fase-akut terdiri atas penghambat proteinase, koagulasi, komplemen
dan protein transport, tetapi hanya molekul protein SAA yang memiliki sensitifitas, dan
kecepatan respon yang sebanding dengan CRP.1
2.2.1 Struktur dan filogeni CRP
CRP termasuk dalam famili pentraksin dari protein plasma calcium-dependent
ligand-binding, yang pada manusia merupakan komponen dari SAP. Molekul CRP pada
manusia terdiri dari lima polipeptida yang identik, masing-masing terdiri atas 206 residu
asam amino.
Secara struktural CRP adalah molekul simetris yang terdiri dari lima protomers
tidak kovalen yang berhubungan dengan promoter. Setiap protomer memiliki dua ion
kalsium yang bertanggung jawab untuk pengikatan posfoklorin spesifik. Posfoklorin
sel membran biologis, seperti residu posfoklorin dari C (kapsuler)-polisakarida dari
Streptococcuspneumoniae. Protein ini dinamakan "C-reactive" karena reaksi ini.
Monosit memiliki reseptor untuk CRP dan selanjutnya CRP akan meningkatkan
produksi sitokin. CRP berperan juga dalam proses atherogenesis. Aktifasi CRP lebih
lanjut dapat mengakibatkan produksi sitokin pro-inflamasi dan diferensiasi monosit
menjadi makrofag. Dengan keberadaan lipoprotein teroksidasi densitas rendah, CRP
akan memfasilitasi produksi sel-sel busa yang akan menjadi plak aterosklerotik. 30
31
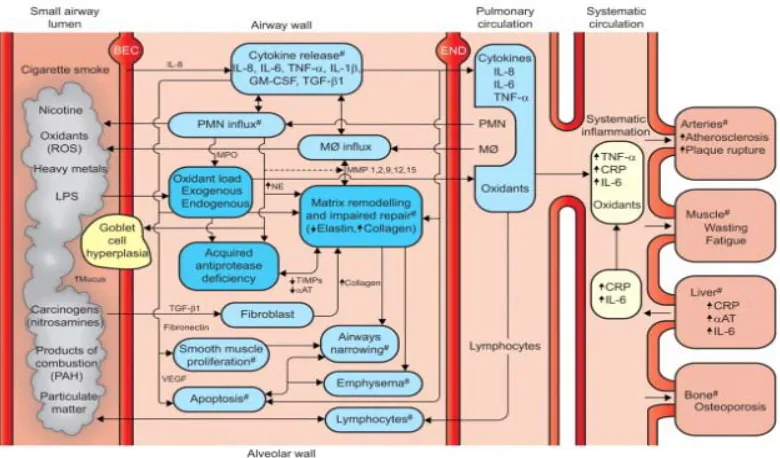
Gambar 5. CRP pada patogenesis PPOK. LPS: lipopolisakarida; PAH:
polyaromatic hydrocarbons; BEC: bronchial epithelial cell; GM-CSF: granulocyte-monocyte colony-stimulating factor; MPO: myeloperoxidase; MØ: macrophage; TIMP:
tissue inhibitors of metalloproteinase; aAT: a1-antitrypsin; VEGF: vascular endothelial growth factor; END: endothelial cell; CRP: C-reactive protein.19
2.2.2 Fungsi CRP
CRP berperan dalam pertahanan tubuh manusia melalui respon inflamasi alamiah
yang merupakan pertahanan tubuh pertama. CRP bekerja secara bersamaan dengan
antigen melalui mekanisme yang melibatkan kalsium yang berperan menambah aktifitas
proses fagositosis. Konsentrasi serum CRP mencapai kadar patologis jika diatas 5 mg/l.
CRP dapat digunakan untuk memonitor inflamasi akibat dari infeksi maupun tidak
infeksi, dan untuk menilai kemajuan terapi.
Nakou
32
dkk (2008) dalam analisanya menyimpulkan CRP dapat berperan dalam
menginduksi apoptosis sel otot polos pembuluh darah koroner, dapat menginduksi
pelepasan IL-1 dan TNFα oleh monosit, meningkatkan pembentukan radikal oksigen
dengan monosit dan netrofil, menginduksi aktivasi komplemen, menginduksi ekspresi
dari molekul adhesi melalui sel endotel (ICAM-1, VCAM-1, E-selektin) dan
menginduksi produksi dari tissue factor dari monosit.33
Gan dkk. (2004) dalam studi metaanalisanya menganalisa 14 studi original
dengan membandingkan kadar serum CRP, fibrinogen, leukosit dan TNF-α , IL-6, dan
IL-8 pada pasien PPOK dan kontrol sehat. Hasilnya adalah pasien PPOK secara
signifikan mengalami peningkatan kadar CRP, fibrinogen, leukosit dan TNF-α
dibandingkan dengan kontrol yang sehat, yang mengindikasikan bahwa inflamasi
sistemik persisten terjadi pada PPOK. Ditemukan juga bahwa pada pasien PPOK yang
telah berhenti merokok terdapat bukti adanya inflamasi sistemik yang rendah. Hal ini
menjelaskan bahwa ketika terjadi PPOK, berhenti merokok tidak sepenuhnya menepis
proses inflamasi yang berhubungan dengan kondisi ini.34
Bagaimana dan kenapa pasien PPOK mengalami inflamasi sistemik masih belum
dapat dijelaskan. PPOK dikarakteristikkan dengan proses inflamasi yang kuat pada
saluran napas, parenkim, dan pembuluh darah paru. Ada kemungkinan dalam beberapa
kasus bahwa proses inflamasi ini meluas ke sirkulasi sistemik yang selanjutnya
menimbulkan reaksi inflamasi yang luas. Bagaimanapun mekanismenya, proses
kehilangan berat badan, kaheksia, osteoporosis, dan penyakit kardiovaskular. Hubungan
antara PPOK, peradangan sistemik, dan penyakit kardiovaskular sangat erat dimana
lebih dari setengah pasien dengan PPOK meninggal karena penyakit kardiovaskular.
Selain itu, selama periode eksaserbasi terjadi peningkatan secara signifikan kadar
plasma CRP, fibrinogen dan kadar serum IL-6, yang selanjutnya dapat menyebabkan
peningkatan morbiditas dan mortalitas kardiovaskular pada pasien dengan PPOK.
Olafsdottir dkk. (2007) dalam studi kohort mengikutsertakan 53 pasien PPOK.
Dengan hasil bahwa kadar CRP lebih besar pada penderita PPOK dibanding yang tidak
(1,4 mg/l vs 1,0 mg/l, p=0,003), subjek dengan peningkatan kadar CRP (OR (95% CI)
3.21 (1.13–9.08)) memiliki resiko menderita PPOK dan penurunan FEV
34
1 pada laki-laki (rata-rata 44 mL) dan perempuan (rata-rata 31 mL). Laki-laki dengan kadar CRP > 0,46
mg/l mengalami penurunan FEV1 sementara pada kadar yang sama perempuan tidak
mengalami penurunan FEV1 yang signifikan. Hubungan negatif antara CRP dan FEV1
terjadi lebih besar pada laki-laki dibanding perempuan (p=0,04), terdapat hubungan
kadar CRP dan FVC (p=0,01) pada laki-laki saja.
Olafsdottir (2011) dalam disertasinya menyimpulkan terdapat hubungan antara
kadar CRP dan gejala respirasi seperti mengi, sesak napas yang berhubungan dengan
aktifitas, batuk malam hari, dimana hal ini menunjukkan bahwa penanda inflamasi
sistemik tidak hanya bermanfaat sebagai penanda penyakit tahap lanjut tetapi juga untuk
menilai perjalanan penyakit.
35
36
2.2.3 Kadar CRP
Secara tradisional, kadar serum CRP dapat diukur dengan nephelometry, yang
memiliki batas deteksi dari 6 sampai 10 mg / L yang disebut test "serum CRP". Bentuk
deteksi sesuai dengan nama dagangnya seperti metode immulite automated analyzer
dengan batas deteksi pengukuran 0,10 – 500 mg/l, berdasarkan BNA nephelometer
dengan batas deteksi pengukuran 0,18-115 mg/l, berdasarkan immage dengan batas
deteksi pengukuran 0,2-1440 mg/l.
Kao dkk. (2006) menuliskan bahwa populasi Asia memiliki kadar serum CRP
yang lebih rendah dibandingkan dengan populasi Eropa sehingga diperlukan
pemeriksaan yang lebih sensitif untuk menilai kadar CRP pada populasi Asia. 37
30
Jika ada perangsangan terhadap protein fase akut ini, nilainya dapat meningkat antara lebih < 50
ug/l sampai > 500 mg/l, yaitu 10.000 kali lipat. Kadar CRP plasma diproduksi oleh sel
hati, terutama di bawah kontrol transkripsi sitokin IL-6, TNF-a dan IL-1 meskipun telah
pernah dikemukakan kemungkinan sumber lain dapat membentuk CRP lokal.38 Broz BR dalam studinya menyatakan bahwa parenkim paru dan jaringan bronkus juga dapat
mensintesa CRP.
Hutchinson dkk. (2000) dalam studi epidemiologi menilai kadar CRP pada
populasi dewasa dari Augsburg (2291 laki-laki, 2203 perempuan, usia 25-74 tahun),
Glasgow (604 laki-laki, 650 perempuan, usia 25-64 tahun) dengan hasil bahwa kadar
CRP hampir sama pada kedua populasi yaitu 1 mg/l pada usia muda dan 2 mg/l pada usia
tua, dimana kadarnya lebih tinggi pada wanita. Rata-rata kadar CRP pada kedua populasi
yaitu 0,75 sampai 2,40 mg/l. 39
Dalam semua kondisi (baik normal ataupun dalam kondisi sedang mengalami
inflamasi) maka waktu paruh plasma CRP adalah sekitar 19 jam, hal ini menunjukkan
bahwa peningkatan kadar CRP dalam sirkulasi akan berkurang dalam sebanyak 50%
setiap 19 jam jika individu tersebut diberi stimulus yang memperbaiki penyebab
peningkatan CRP, jika dibanding dengan parameter biokimia lain (viskositas plasma atau
sedimentasi eritrosit), maka kadar sirkulasi CRP lebih akurat. 40
Lacoma dkk. (2011) dalam studinya memeriksa kadar PCT, CRP dan neopterin,
pada 46 pasien PPOK stabil, 217 PPOK eksaserbasi, 55 PPOK dengan pneumonia
dengan hasil PCT dan CRP meningkat pada pasien pneumonia kemudian eksaserbasi
(p<0,0001), sementara neopterin tidak menunjukkan perubahan. Ketiga biomarker ini
meningkat lebih tinggi pada pasien yang meninggal dalam waktu satu bulan setelah
pemeriksaan darah dibanding dengan yang meninggal dalam waktu lebih dari satu bulan.
Dari 217 pasien PPOK eksaserbasi, 23 orang pasien diperiksakan kembali menemukan
kadar PCT, CRP dan neopterinnya satu bulan kemudian dan hasilnya bahwa kadar PCT
(P=0.0788) dan CRP (P=0.0181) mengalami penurunan setelah satu bulan episode
eksaserbasi (fase pemulihan) sementara kadar neopterin meningkat (P =0.0325).
Halvani dkk. (2006) dalam studi komperatif-deskriptif pada 45 pasien PPOK
stabil dengan jenis kelamin laki-laki tanpa penyakit jantung iskemi dan 45 orang sehat
sebagai kontrol menemukan bahwa kadar hsCRP pada pasien PPOK secara signifikan
(p=0,04) berhubungan dengan derajat sesak napas dengan berdasarkan skala MMRC
dimana derajat I, II, III masing-masing 22,78 ng/ml; 28,88 ng/ml dan 36.90 ng/ml. Tidak
ada perbedaan yang signifikan antara kadar CRP dan beratnya penyakit, episode
eksaserbasi dan penggunaan kortikosteroid inhalasi. CRP merupakan marker inflamasi
sistemik dan faktor utama yang menyebabkan komplikasi ekstrapulmonal.
41
42
2.2.4 Cut off CRP
Hurst dkk. dalam studi kohort menyimpulkan bahwa cutoff CRP dapat dipilih
untuk memaksimalkan sensitivitas dan spesifisitas sesuai kebutuhan. Namun CRP saja
tidak cukup sensitif maupun spesifik untuk mengkonfirmasi eksaserbasi.
Bircan dkk. (2008) dalam studinya pada 30 pasien PPOK stabil, 51 pasien PPOK
laki normal sebagai control, dengan kesimpulan bahwa nilai cutoff CRP untuk
mendiagnosa PPOK atau infeksi bakteri sebagai penyebab eksaserbasi akut masih belum
diketahui. Dalam studinya Bircan dkk. menggunakan cutoff CRP 10 mg/l untuk
eksaserbasi akut dengan sensitivitas dan spesifisitas 72,5% dan spesifisitas 100%. Nilai
kisaran normal yang digunakan adalah 0-10 mg/l. Hasilnya yaitu rata-rata kadar CRP
pada PCOPD adalah 108.1 + 61.8 mg/l, SCOPD: 3,9 + 1,4 mg/l, AECOPD: 36,8+ 43,9
mg/l, kontrol normal : 2.1+ 0.9 mg/l. Hasil ini menunjukkan tidak satupun dari kontrol
yang sehat dan pasien PPOK stabil memiliki kadar CRP >10 mg/l, sementara semua
pasien PPOK eksaserbasi memiliki kadar CRP >10 mg/l.
Broekhuizen dkk (2006) dalam studinya pada 102 penderita PPOK dengan hasil
penderita PPOK dengan GOLD derajat III dan IV memiliki kadar CRP yang lebih tinggi
dibanding GOLD derajat II (II: 1.92 (0.36–16.00) mg/l; III: 4.43 (0.47–75.60) mg/l; IV:
4.90 (0.47–65.70) mg/l; p<0.03). Nilai cut off yang digunakan untuk membedakan
kadar CRP orang normal (rata-rata 1,49 mg/l) dan yang mengalami peningkatan (rata –
rata 12,50 mg/l) adalah 4,21 mg/l.
43
44
2.2.5 Faktor – faktor yang mempengaruhi kadar CRP
Telah banyak laporan bahwa pada beberapa populasi kadar CRP pada wanita
lebih tinggi dibanding pria. Data dari Ausburg juga menunjukkan demikian bahwa kadar
CRP pada wanita (2,9 mg/L) secara signifikan lebih tinggi dibanding pria (1,5 mg/L) dan
kebalikannya ditemukan pada populasi di Jepang.
Alavi dkk. (2011) berdasarkan studinya menyatakan bahwa kadar hsCRP
meningkat pada penderita PPOK eksaserbasi dengan BMI yang dibawah normal dan
diatas normal dibandingkan dengan yang normal, pasien dengan PaCO 45
Sin dkk. (2004) dalam studinya mengikutsertakan 41 pasien PPOK ringan sampai
sedang, menemukan efek prednisolon oral 30 mg/hari menurunkan kadar CRP 71% dan
kortikosteroid inhalasi dosis tinggi (flutikason 1000 dan 2000 μg/hari) menurunkan kadar
CRP 50% pada pasien PPOK ringan sampai berat.
Pinto-plata dkk. (2006) dalam studinya mengikutsertakan 88 pasien PPOK dan
33 kontrol merokok dan 38 kontrol tidak merokok, dengan hasil bahwa kadar CRP
sekitar 20% lebih rendah pada pasien yang menggunakan dosis tinggi kortikosteroid
inhalasi budesonid 800-1200 μg/hari, kadar CRP lebih tinggi pada pasien PPOK (rata
-rata 1,51 mg/l) dibanding orang sehat baik merokok (1,04 mg/l) maupun tidak merokok
(1,04 mg/l).
46
47
Sementara itu Karadag dkk. (2008) menemukan tidak ada perbedaan kadar
serum CRP, TNF-alfa atau IL-6 pada pasien PPOK yang sedang ataupun yang sudah
berhenti menggunakan steroid inhalasi dengan dosis medium budesonide 400-800
μg/hari. Kadar CRP juga diketahui secara signifikan lebih tinggi pada pasien PPOK
dengan BMI yang rendah.
Kherad dkk. (2010) dalam studinya memeriksa kadar CRP (86 orang) dan PCT
(81orang) penderita AECOPD dengan hasil medium kadar CRP 33 mg/l dan PCT 0,06
μg/l pada kasus yang ditemukan infeksi bakteri. Dan pada kasus yang ditemukan infeksi
virus kadar medium CRP dan PCT adalah 45 mg/l dan 0,08 μg/l, namun hasil ini tidak
ada perbedaan secara signifikan dengan pasien tanpa infeksi bakteri maupun virus. 48
2.3. Kerangka konsep
Gambar 6. Kerangka konsep penelitian
2.4 Hipotesis
Hipotesis dalam penelitian ini adalah:
1) Terdapat perbedaan kadar CRP pada penderita PPOK stabil dan eksaserbasi