TESIS
MODIFIKASI METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) PADA ANALISIS PARASETAMOL,
PROPIFENAZON DAN KAFEIN DALAM SEDIAAN FARMASI
OLEH:
IKA JULIANTI TAMBUNAN NIM 167014004
PROGRAM STUDI MAGISTER FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
MODIFIKASI METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) PADA ANALISIS PARASETAMOL,
PROPIFENAZON DAN KAFEIN DALAM SEDIAAN FARMASI
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Magister dalam Ilmu Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
IKA JULIANTI TAMBUNAN NIM 167014004
PROGRAM STUDI MAGISTER FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
PENGESAHAN TESIS
MODIFIKASI METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) PADA ANALISIS PARASETAMOL,
PROPIFENAZON DAN KAFEIN DALAM SEDIAAN FARMASI
OLEH:
IKA JULIANTI TAMBUNAN NIM 167014004
Disetuji oleh :
Komisi Pembimbing, Komisi Penguji,
Prof. Dr.rer.nat. E. D. Lux Putra, S.U., Apt. Prof. Dr. Ginda Haro, M.Sc., Apt.
NIP 195306191983031001 NIP 195108161980031002
Prof. Dr. Siti Morin S., M.Sc.Apt. Prof. Dr. Muchlisyam, M.Si., Apt.
NIP 195908281976032002 NIP 195006221980021001
Prof. Dr. Effendy D. L. P, S.U., Apt. NIP 195306191983031001
Prof. Dr. Siti Morin S., M.Sc.Apt.
NIP 195908281976032002
Medan, 22 Januari 2021
Mengetahui: Disahkan Oleh:
Ketua Program Studi, Dekan,
Prof. Dr. Urip Harahap, Apt. Prof. Dr. Masfria, M.S., Apt.
NIP 195301011983031004 NIP 19570723198601200
PERSETUJUAN TESIS
Nama Mahasiswa : Ika Julianti Tambunan Nomor Induk Mahasiswa : 167014004
Program Studi : Magister (S-2) Ilmu Farmasi
Judul Tesis : Modifikasi Metode Kromatografi Cair Kinerja Tinggi (KCKT) Pada Analisis Parasetamol, Propifenazon Dan Kafein Dalam Sediaan Farmasi Telah diuji dan dinyatakan LULUS didepan Komisi Penguji Tesis Pada hari Selasa, tanggal Dua Puluh Delapan bulan Juli tahun Dua Ribu Dua Puluh.
Menyetujui :
Komisi Penguji Tesis
Ketua : Prof. Dr. rer.nat. Effendy De Lux Putra, S.U., Apt.
Sekretaris : Prof. Dr. Siti Morin Sinaga, M.Sc., Apt.
Anggota : Prof. Dr. Ginda Haro, M.Sc., Apt.
Prof. Dr. Muchlisyam, M.Si., Apt.
PERNYATAAN ORISINALITAS
Saya yang bertada tangan di bawah ini:
Nama Mahasiswa : Ika Julianti Tambunan Nomor Induk Mahasiswa : 167014004
Program Studi : Magister (S-2) Ilmu Farmasi
Judul Tesis : Modifikasi Metode Kromatografi Cair Kinerja Tinggi (KCKT) Pada Analisis Parasetamol, Propifenazon Dan Kafein Dalam Sediaan Farmasi
Dengan ini menyatakan bahwa hasil penelitian pada Tesis yang saya buat adalah asli karya saya sendiri bukan plagist dan dikemudian hari diketahui Tesis saya tersebut plagist karena kesalahan saya sendiri, maka saya bersedia di beri sanksi apapun oleh Program Studi Magister Ilmu Farmasi Fakultas Farmasi Universitas Sumatera Utara. Saya tidak akan menuntut pihak manapun atas perbuatan saya tersebut.
Demikian pernyataan ini saya buat dengan sebenarnya dan dalam keadaan sehat.
Medan, 28 Juli 2020 Yang Menyatakan
Ika Julianti Tambunan NIM : 167014004
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat, karunia, dan ridho-Nya sehingga penulis dapat menyelesaikan Tesis yang berjudul
“Modifikasi Metode Kromatografi Cair Kinerja Tinggi (KCKT) Pada Analisis Parasetamol, Propifenazon Dan Kafein Dalam Sediaan Farmasi ”. Tesis ini diajukan sebagai salah satu syarat untuk memperoleh gelar Magister Ilmu Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Kombinasi obat dalam sediaan multikomponen perlu diimbangi dengan peningkatan pengawasan mutu, agar obat yang beredar tersebut dapat dijamin keamanan dan khasiatnya. Salah satu parameternya adalah penetapan kadar.
Metode kromatografi merupakan cara paling baik untuk memisahkan komponen kimia yang bercampur dalam sampel. Kondisi instrumen KCKT yang digunakan pada penetapan kadar campuran parasetamol, propifenazon dan kafein harus dalam keadaan yang optimum. Tujuan Optimalisasi tersebut untuk mengurangi waktu analisis, meminimalkan jumlah pelarut, serta mempertahankan umur peralatan dan kolom. Penelitian ini diharapkan memperoleh data awal untuk kemudian dikembangakan dalam publikasi ilmiah.
Pada kesempatan ini penulis menyampaikan terima kasih yang sebesar-besarnya kepada Prof. Dr. rer.nat. apt. Effendy De Lux Putra, S.U dan Prof. Dr. apt. Siti Morin Sinaga, M.Si. atas waktu, arahan, dan bimbingan yang diberikan selama penyelesaian Tesis ini. Pada kesempatan juga peneliti menyampaikan terima kasih kepada Prof. Dr. apt. Masfria, M.S. selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas selama menjalani pendidikan di Program Magister Ilmu Farmasi/Doktor Ilmu Farmasi. Kepada kedua orang tua, Ayahanda H. M.P Tambunan dan Ibunda Hj. Siti Hawa Hasibuan, S.E tercinta, penulis menyampaikan terima kasih dan penghargaan yang setinggi-tingginya atas semua pengorbanan, doa, dan dorongannya sehingga Tesis ini dapat diselesaikan.
Medan, 28 Juli 2020 Penulis,
Ika Julianti Tambunan NIM : 167014004
MODIFIKASI METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) PADA ANALISIS PARASETAMOL, PROPIFENAZON
DAN KAFEIN DALAM SEDIAAN FARMASI
ABSTRAK
Kombinasi obat dalam suatu sediaan memberikan potensi dan aksi obat yang makin meningkat sehingga mampu meringankan sakit dengan lebih cepat serta efek samping lebih ringan. Parasetamol dan propifenazon merupakan obat yang digunakan dalam penanganan rasa nyeri (analgetika) dan demam (antipiretika). Kafein sering dikombinasikan dengan parasetamol dan propifenazon untuk memperkuat efek analgetikanya karena terjadi efek potensiasi, maka dosis masing-masing komponennya diturunkan sehingga efek samping dapat dikurangi. Kombinasi obat tersebut perlu diimbangi dengan peningkatan pengawasan mutu, agar obat yang beredar dapat dijamin keamanan dan khasiatnya. Penelitian ini bertujuan untuk melakukan analisis dengan metode kromatografi cair kinerja tinggi (KCKT) yang dilakukan modifikasi untuk mendapatkan sistem KCKT yang optimal untuk menentukan kadar parasetamol, propifenazon dan kafein pada sediaan tablet yang beredar dipasaran.
Penelitian ini dilakukan dengan mengoptimalisasi perbandingan fase gerak metanol:air (10:90), (20:80), (30:70), (40:60), (50:50), (60:40), (70:30), (80:20), (90:10), laju alir 0,5-2,0 mL/menit dan suhu kolom 30,40, dan 50°C. Hasil yang diperoleh dari optimasi digunakan pada penetapan kadar sediaan tablet dan uji validasi. Parameter analisis pada uji validasi antara lain akurasi, presisi, limit deteksi (LOD), limit kuantitasi (LOQ).
Hasil penelitian menunjukkan bahwa perbandingan fase gerak metanol:air (70:30) dan laju alir 1 mL/menit dengan suhu kolom 30°C merupakan hasil optimasi yang baik untuk digunakan dalam penelitian ini, karena waktu retensi yang singkat yaitu parasetamol 3,093 menit; propifenazon 5,845 menit; kafein 3,808 menit serta tailing factor ≤ 2 dan Resolusi (resolution) ≥ 1,5. Rata-rata hasil penetapan kadar parasetamol, propifenazon dan kafein dalam sediaan tablet Bodrex Migraine® adalah 101,35±0,16%, 99,24±0,14%, 97,95±0,16%, dan tablet Saridon® adalah 99,50±0,07%, 100,25±0,12%, 98,94±0,06%. Hasil parameter validasi yang dilakukan pada parasetamol, propifenazon dan kafein adalah 99,66%, 98,89%, 100,24% untuk hasil rata-rata recovery dan 0,01738; 0,01751;
0,02557 untuk hasil rata-rata presisi dan 1,00026; 0,69104; 0,38920 untuk hasil rata-rata LOD dan 3,33423; 2,30347; 1,29735 untuk hasil rata-rata LOQ.
Modifikasi yang dilakukan menghasilkan optimasi terbaik pada perbandingan fase gerak metanol:air (70:30), laju alir 1 mL/menit dan suhu kolom 30°C untuk melakukan analisis campuran parasetamol, propifenazon dan kafein yang memenuhi persyaratan kadar umumnya suatu sediaan tablet dan persyaratan uji validasi.
Kata kunci: Parasetamol, propifenazon, kafein, modifikasi dan validasi
MODIFICATION METHOD HIGH PERFORMANCE LIQUID CHROMATOGRAPHY (HPLC) IN ANALYSIS OF PARACETAMOL,
PROPIFENAZON AND CAFFEINE IN PHARMACEUTICAL REPARATIONS
ABSTRACT
The combination of drugs in a preparation provides increased potential and action of the drug so that it can relieve pain more quickly and have fewer side effects. The combination of these drugs needs to be balanced with increased quality control, so that the drugs in circulation can be guaranteed of their safety and efficacy. This study aims to analyze by high performance liquid chromatography (HPLC) method which was modified to obtain an optimal HPLC system to determine the levels of simultaneous mixture of paracetamol, propifenazon and caffeine in tablet dosage in the market.
This research was conducted by optimizing the ratio of the mobile phase of methanol: water (10:90), (20:80), (30:70), (40:60), (50:50), (60:40), (70: 30), (80:20), (90:10), flow rates 0,5-2,0 mL/min and column temperatures 30, 40, and 50°C. The results of the optimization of the assay used in tablet dosage form and test validation. Analysis parameters in the validation test include accuracy, precision, limit of detection (LOD), limit of quantitation (LOQ).
The results showed that the ratio of the mobile phase of methanol: water (70:30) and a flow rate of 1 mL / min with a column temperature of 30°C is a good optimization results for use in this study, because of the short retention time of paracetamol 3.093 minutes; propifenazon 5,845 minutes; caffeine 3,808 minutes, and tailings factor ≤ 2 and resolution ≥ 1,5. The average results of the assay of paracetamol, propifenazon and caffeine in tablet dosage Bodrex Migraine® was 101,35 ± 0,16%, 99,24 ± 0,14%, 97,95 ± 0,16%, and the tablet is Saridon® 99,50
± 0,07%, 100,25 ± 0,12%, 98,94 ± 0,06%. The results of the validation parameters performed on paracetamol, propifenazon and caffeine were 99,66%, 98,89%, 100,24% for the average recovery results and 0,01738; 0,01751; 0,02557 for the average precision results and 1,00026; 0,69104; 0,38920 for the average LOD results and 3,33423; 2,30347; 1,29735 for LOQ average results.
The modifications made resulted in the best optimization of the mobile phase ratio of methanol: water (70:30), flow rate of 1 mL/minute and column temperature of 30°C to analyze a mixture of paracetamol, propifenazone and caffeine which met the general level requirements of a tablet preparation and requirements validation test.
Keywords: Paracetamol, propifenazon, caffeine, modification and validation
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN PENGESAHAN TESIS ... iii
HALAMAN PERNYATAAN ORISINALITAS ... iv
KATA PENGANTAR ... v
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL. ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Kerangka Pikir Penelitian ... 3
1.3 Perumusan Masalah ... 5
1.4 Hipotesis ... 5
1.5 Tujuan Penelitian ... 6
1.6 Manfaat Penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1 Kromatografi ... 7
2.2 Jenis-jenis Kromatografi ... 7
2.2.1 Kromatografi cari-cair (KCC)... 8
2.2.2 Kromatografi cair-padat (KCP) ... 8
2.2.3 Kromatografi penukar ion ... 8
2.2.4 Kromatografi pemisahan berdasarkan ukuran molekul ... 9
2.3 Penggunaan Kromatografi ... 9
2.4 Kromatografi Cair Kinerja Tinggi (KCKT) ... 9
2.4.1 Prinsip Kerja Kromatografi Cair Kinerja Tinggi ... 10
2.4.2 Instrumen KCKT ... 10
2.4.2.1 Wadah Fase Gerak ... 11
2.4.2.2 Pompa ... 12
2.4.2.3 Injektor ... 13
2.4.2.4 Kolom ... 14
2.4.2.5 Detektor... 17
2.4.2.6 Fase Gerak ... 18
2.4.2.7 Elusi Gradien dan Isokratik ... 19
2.4.2.8 Jenis Pemisahan KCKT ... 2.5 Parameter Kromatografi Cair Kinerja Tinggi ... 22
2.5.1 Waktu retensi (tR) ... 22
2.5.2 Faktor tailing dan puncak asimetris ... 22
2.5.3 Resolusi ... 24
2.6 Pengembangan Metode Kromatografi Cair Kinerja Tinggi Regresi Komponen Utama Dalam Sediaan Farmasi ... 25
2.7 Validasi ... 27
2.7.1 Ketepatan (Accuracy) ... 27
2.7.2 Ketelitian (Precision) ... 28
2.7.3 Selektivitas (Spesifisitas) ... 29
2.7.4 Linieritas dan Rentang ... 29
2.7.5 Batas Deteksi (LOQ)... 30
2.7.6 Batas Kuantifikasi (LOQ) ... 30
2.7.7 Kekerasan ... 30
2.7.8 Ketahanan ... 31
2.8 Analisa Data Kadar Secara Statistik ... 31
2.9 Monografi Parasetamol, Propifenazon dan Kafein ... 32
2.9.1 Parasetamol ... 32
2.9.1.1 Metode penetapan kadar parasetamol ... 33
2.9.2 Propifenazon ... 33
2.9.2.1 Metode penetapan kadar propifenazon ... 34
2.9.3 Kafein ... 34
2.9.3.1 Metode penetapan kadar kafein ... 34
BAB III METODE PENELITIAN... 36
3.1 Alat dan Bahan ... 36
3.1.1 Alat ... 36
3.1.2 Bahan ... 36
3.2 Pengambilan Sampel ... 36
3.3 Prosedur Penelitian ... 37
3.3.1 Pembuatan Pelarut ... 37
3.3.2 Pembuatan Fase Gerak Metanol:Air ... 37
3.3.3 Optimasi Fase Gerak ... 37
3.3.4 Optimasi Waktu Alir . ... 37
3.3.5 Optimasi Suhu Kolom ... 37
3.4 Prosedur Analisa Kuantitatif. ... 38
3.4.1 Pembuatan Larutan Induk Baku... 38
3.4.2 Pembuatan Induk Baku Campuran Parasetamol, Propifenazon, dan Kafein ... 38
3.4.3 Pembuatan Kurva Kalibrasi Campuran Parasetamol, Propifenazon dan Kafein ... 38
3.4.4 Identifikasi Sampel ... 39
3.4.5 Penetapan Kadar Tablet Campuran Parasetamol, Propifenazon dan Kafein ... 39
3.4.6 Validasi Metode Dengan Parameter Akurasi, Presisi, Linieritas, LOD dan LOQ. ... 40
3.4.6.1 Akurasi dengan persen perolehan kembali ( % recovery) ... 40
3.4.6.2 Uji Presisi ... 42
3.4.6.3 Penentuan LOD dan LOQ ... 42
3.5 Definisi Operasional Penelitian ... 43
BAB IV HASIL DAN PEMBAHASAN ... 45
4.1 Pengembangan Metode Kromatografi Cair Kinerja Tinggi ... 45
4.2 Identifikasi Baku Pembanding Parasetamol, Propifenazon Dan Kafein ... 50
4.3 Pembuatan Dan Penentuan Kurva Kalibrasi Campuran Parasetamol,
Propifenazon dan Kafein ... 52
4.4 Penetapan Kadar Campuran Parasetamol, Propifenazon dan Kafein Dalam Sediaan Tablet ... 54
4.5 Uji Validasi Metode Kromatografi Cair Kinerja Tinggi ... 56
BAB V KESIMPULAN DAN SARAN ... 60
5.1 Kesimpulan ... 60
5.2 Saran ... 60
DAFTAR PUSTAKA ... 61
LAMPIRAN ... 65
DAFTAR TABEL
2.1 Macam-macam Kolom KCKT ... 15 2.2 Pengembangan Metode Kromatografi Cair Kinerja Tinggi Untuk
Penentuan Parasetamol, Propifenazon dan Kafein ... 26 3.1 Definisi Operasional Penelitian ... 44 4.1. Data Optimasi Fase Gerak Metanol:Air dengan Laju Alir 1 mL/Menit
dan Suhu Kolom ... 46 4.2. Data Optimasi Laju Alir dengan Perbandingan Fase Gerak Metanol
:Air (70:30) dan Suhu Kolom 30°C ... 47 4.3. Data Optimasi Suhu Kolom dengan Perbandingan Fase Gerak
Metanol:Air (70:30) dengan Laju Alir 1,0 mL/Menit ... 48 4.4. Hasil Penetapan Kadar Parasetamol, Propifenazon dan Kafein dalam
Sediaan Tablet Bodrex Migraine® (Tempo Scan Pacifik) ... 55 4.5. Hasil Penetapan Kadar Parasetamol, Propifenazon dan Kafein dalam
Sediaan Tablet Saridon® (Roche) ... 55 4.6. Data Validasi Metode Kromatografo Cair Kinerja Tinggi Pada Pene-
tapan Kadar Parasetamol dengan Metode Penambahan Baku Standar
(Standard Addition Method) ... 57 4.7. Data Validasi Metode Kromatografo Cair Kinerja Tinggi Pada Pene-
tapan Kadar Propifenazon dengan Metode Penambahan Baku Standar (Standard Addition Method) ... 58 4.8. Data Validasi Metode Kromatografo Cair Kinerja Tinggi Pada Pene-
tapan Kadar Kafein dengan Metode Penambahan Baku Standar
(Standard Addition Method) ... 58
DAFTAR GAMBAR
1.1. Kerangka Pikir Penelitian ... 4
2.1. Instrumen Dasar KCKT ... 10
2.2. Seperangkat Alat Penyaring dan Alat Degasser... 11
2.3. Jenis Kolom ... 14
2.4. Perbedaan Diameter dan Panjang Dari Kolom Analitik dan Kolom Prepertif ... 16
2.5. Pompa Isokratik dan Gradien ... 19
2.6. Pola Kromatogram Pemisahan Campuran Benzene Terklorinasi dengan Pelarut Isopropanolol (a) Sistem Elusi Gradien dan (b) Elusi Isokratik Menggunakan Kolom Permaphase ® ODS ... 20
2.7. Kolom Fase Normal dan Kolom Fase Terbalik ... 21
2.8. Pengukuran Derajat Asimetris Puncak... 24
2.9. Pengukuran Derajat Resolusi ... 24
2.10. Rumus Parasetamol ... 32
2.11. Rumus Propifenazon ... 33
2.12. Rumus Kafein ... 34
4.1. Kromatogram Optimasi Perbandingan Fase Gerak Metanol : Air (70:30), Laju Alir 1 mL/Menit dan Suhu Kolom 30°C ... 49
4.2. Kromatogram Baku Pembanding Parasetamol ... 50
4.3. Kromatogram Baku Pembanding Propifenazon... 50
4.4. Kromatogram Baku Pembanding Kafein ... 51
4.5. Kromatogram Sampel yang Mengandung Parasetamol, Propifenazon Dan Kafein ... 51
4.6. Kurva Kalibrasi Parasetaamol ... 53
4.7. Kurva Kalibrasi Propifenazon ... 53
4.8. Kurva Kalibrasi Kafein ... 53
DAFTAR LAMPIRAN
1. Kromatogram Optimasi Perbandingan Fase Gerak Metanol: Air
(40:60),(50:50),(60:40),(70:30),(80:20) ... 65 2. Kromatogram Optimasi Laju Alir (0,5), (0,75),(1,0),(1,5) mL/menit ... 68 3. Kromatogram Optimasi Suhu Kolom (30° C), (40° C) dan (50° C) ... 70 4. Kromatogram Penyuntikan Baku Pembanding dan Sampel yang
Mengandung Parsetamol, Propifenazon dan Kafein ... 72 5. Kromatogram Penyuntikan Campuran Parasetamol, Propifenazon
Kafein Pada Pembuatan Kurva Kalibrasi ... 74 6. Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi
Parasetamol ... 77 7. Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi
Parasetamol ... 78 8. Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi
Parasetamol ... 79 9. Data Penimbangan, Kadar Perolehan dan Kadar Campuran Sediaan
Tablet Bodrex Migraine® (Tempo Scan Pasifik) ... 80 10. Data Penimbangan, Kadar Perolehan dan Kadar Campuran Sediaan
Tablet Saridon® (Roche) ... 81 11. Contoh Perhitungan Penimbangan dan Persen Kadar Sampel Tablet
Saridon® (Roche) ... 82 12. Analisa Data Statistik Untuk Menentukan Kadar Parasetamol, Propi-
Fenazon dan Kafein Dalam Sediaan Tablet Bodrex Migraine®
(Tempo Scan Pasifik) ... 85 13. Analisa Data Statistik Untuk Menentukan Kadar Parasetamol, Propi-
Fenazon dan Kafein Dalam Sediaan Tablet Saridon® (Rohce) ... 88 14. Data Hasil Persen Perolehan Kembali (%Recovery) Standard Deviasi
(SD) dan Relative Standard Deviation (RSD) Parasetamol Pada Tablet Saridon® (Rohce) dengan Metode Penambahan Baku Standar
(Standard Addition Method) ... 91 15. Data Hasil Persen Perolehan Kembali (%Recovery) Standard Deviasi
(SD) dan Relative Standard Deviation (RSD) Propifenazon Pada Tablet Saridon® (Rohce) dengan Metode Penambahan Baku Standar
(Standard Addition Method) ... 92 16. Data Hasil Persen Perolehan Kembali (%Recovery) Standard Deviasi
(SD) dan Relative Standard Deviation (RSD) Kafein Pada Tablet Saridon® (Rohce) dengan Metode Penambahan Baku Standar
(Standard Addition Method) ... 93 17. Perhitungan Penimbangan Persen Perolehan Kembali (%Recovery)
Kadar Tablet Saridon® (Rohce) ... 94 18. Perhitungan Persen Perolehan Kembali (%Recovery) Standard Deviasi
(SD) dan Relative Standard Deviation (RSD) Kadar Tablet Saridon® (Rohce) dengan Metode Penambahan Baku Standar (Standard Addition Method) ... 97 19. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Parasetamol ... 101
20. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Propifenazon ... 102
21. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Kafein ... 103
22. Kromatogram Penyuntikan Tablet Saridon® (Roche) ... 104
23. Kromatogram Penyuntikan Tablet Bodrex Migra® (Tempo Scan Pasifik) ... 107
24. Kromatogram Penyuntikan Validasi Rentang 80% Sebelum Penambahan Baku ... 110
25. Kromatogram Penyuntikan Validasi Rentang 80% Setelah Penambahan Baku ... 112
26. Kromatogram Penyuntikan Validasi Rentang 100% Sebelum Penambahan Baku ... 114
27. Kromatogram Penyuntikan Validasi Rentang 100% Setelah Penambahan Baku ... 116
28. Kromatogram Penyuntikan Validasi Rentang 120% Sebelum Penambahan Baku ... 118
29. Kromatogram Penyuntikan Validasi Rentang 120% Setelah Penambahan Baku ... 120
30. Tabel Nilai Distribusi t ... 122
31. Sertifikat Baku Pembanding Parasetamol ... 123
32. Sertifikat Baku Pembanding Propifenazon ... 124
33. Sertifikat Baku Pembanding Kafein ... 125
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kombinasi obat dalam suatu sediaan memberikan potensi dan aksi obat yang makin meningkat sehingga mampu meringankan sakit dengan lebih cepat serta efek samping lebih sedikit (Yulyarti, 2018). Parasetamol dan propifenazon merupakan obat yang digunakan dalam penanganan rasa nyeri (analgetika) dan demam (antipiretika). Kafein sering dikombinasikan dengan parasetamol dan propifenazon untuk memperkuat efek analgetikanya memalui mekanisme vasokontriktif guna untuk mengobati nyeri kepala. Karena terjadi efek potensiasi, maka dosis masing-masing komponennya diturunkan sehingga efek samping dapat dikurangi (Nerdy, 2011).
Kombinasi obat dalam sediaan multikomponen perlu diimbangi dengan peningkatan pengawasan mutu, agar obat yang beredar tersebut dapat dijamin keamanan dan khasiatnya. Menurut undang-undang Nomor 36 tahun 2009 tentang Kesehatan pada pasal 105 ayat 1 dinyatakan bahwa sediaan farmasi yang berupa obat dan bahan baku obat harus memenuhi syarat Farmakope Indonesia Edisi V atau buku standar lainnya. Salah satu parameter obat tersebut dikatakan memenuhi standar apabila kadar zat aktif yang terkandung didalamnya sesuai etiket agar dapat memberikan efek yang diinginkan.
Metode yang digunakan untuk penetapan kadar parasetamol, propifenazon dan kafein, salah satunya metode spektrofotometri UV-Visible yang dilakukan Pulungan (2018) dan Dzulfianto (2015). Banyak metode yang dilakukan masih memerlukan proses ekstrasi untuk pemisahan lebih lanjut karena masih
mengandung beberapa senyawa sejenis yang tidak dapat dipisahkan (Wonorahardjo, 2018).
Metode kromatografi merupakan cara paling baik untuk memisahkan komponen kimia yang bercampur dalam sampel. Pemilihan metode KCKT untuk tujuan pengawasan mutu dari sediaan yang mengandung parasetamol, propifenazon dan kafein karena waktu analisis cepat, daya pisah baik, peka, pemilihan kolom dan eluen sangat bervariasi, kolom dapat dipakai kembali, dapat digunakan untuk menganalisis molekul besar dan kecil, cuplikan mudah diperoleh kembali, detektor tidak merusak komponen zat yang dianalisis, dapat digunakan untuk menghitung sampel dengan kadar yang sangat rendah (Harmita, 2015).
Parasetamol dan propifenazon mudah larut dalam metanol dan air sedangkan kafein agak sukar larut dalam metanol dan air (Ditjen POM, 2014). Namun beberapa peneliti sebelumnya telah melakukan penelitian tentang masing-masing ataupun kombinasi parasetamol, popifenazon dan kafein dengan obat yang lain menggunakan kromatografi cair kinerja tinggi (KCKT) dengan berbagai perbandingan fase gerak (Patramurti, 2010; Aman et al, 2011; Tambunan, 2015;
Nafiu et al, 2017), perbandingan laju alir (Mohamed sultan, 2014; Novineet et al, 2017), perbandingan suhu kolom (Mustafa, 2016; Akwasi et al, 2016; Mutaz, 2018).
Kondisi instrumen KCKT yang digunakan pada penetapan kadar campuran parasetamol, propifenazon dan kafein harus dalam keadaan yang optimum.
Tujuan Optimalisasi tersebut untuk mengurangi waktu analisis, meminimalkan jumlah pelarut, serta mempertahankan umur peralatan dan kolom.
Berdasarkan hal tersebut di atas maka peneliti melakukan modifikasi dengan melakukan optimasi fase gerak, laju alir dan suhu kolom. Hasil yang diperoleh dari optimasi yang dilakukan merupakan suatu metode analisa yang baru sehingga perlu dilakukan validasi untuk memastikan bahwa prosedur dapat diterapkan secara objektif, mampu memberikan hasil yang dapat dipercaya dan dikembangkan untuk dapat diaplikasikan dan dijadikan acuan dalam pengujian.
Parameter analisis pada uji validasi antara lain akurasi, presisi, selektifitas, linieritas, limit deteksi (LOD), limit kuantitasi (LOQ) (Rohman, 2007; Harmita, 2015 ).
1.2 Kerangka Pikir Penelitian
Penelitian ini meliputi optimalisasi perbandingan fase gerak (metanol:air), laju alir dan suhu kolom yang digunakan untuk mendapatkan kondisi yang optimum pada instrumen KCKT. Pemilihan hasil optimasi yang dilakukan dalam penelitian ini berdasarkan pada waktu retensi (Retention time) yang singkat, Theoretical plate ≥2000, Tailing factor ≤ 2 dan Resolusi (Resolution) ≥ 1,5. Hasil yang diperoleh dari optimasi yang dilakukan kemudian diaplikasikan dalam (a) identifikasi sampel sebagai uji kualitatif dengan membandingkan waktu retensi masing-masing baku pembanding dengan sampel, (b) penentuan kurva kalibrasi untuk memperoleh persamaan garis regresi, (c) penetapan kadar dan (d) validasi.
Parameter validasi yang dilakukan meliputi : akurasi, presisi, LOD, LOQ. Analisis data kadar secara statistik pada penetapan kadar dilakukan dengan menggunakan uji t. Sampel yang diidentifikasi dalam sediaan tablet dengan berbagai merek dagang yang beredar di pasaran. Secara ringkas kerangka pikir penelitian dapat dilihat pada Gambar 1.1
Gambar 1.1. Kerangka Pikir Penelitian Kondisi Optimum
KCKT
Penetapan Kadar dalam sediaan tablet dengan merek dagang yang mengandung Parasetamol, Propifenazon, dan
Kafein Identifikasi
sampel
Kurva Kalibrasi
- Akurasi (%recovery) - Presisi (% RSD) - LOD - LOQ
Validasi Metode
Analisis Statistik menggunakan uji t
Parasetamol Propifenazon dan
Kafein (BPFI)
Variabel Bebas
Optimasi
Perbandingan Fase Gerak (Metanol: Air)
Optimasi laju alir
Optimasi Suhu Kolom
Variabel Terikat
1. Waktu Retensi (tR < 10 menit) 2. Tailing Factor
(tf < 2) 3. Resolusi (Rs >
2,0)
1.3 Perumusan Masalah
1. Apakah fase gerak metanol : air, laju alir dan suhu kolom dengan perbandingan tertentu dapat memisahkan dan menetapkan kadar campuran parasetamol, propifenazon dan kafein dalam sediaan tablet dengan metode KCKT?
2. Apakah kadar campuran parasetamol, propifenazon dan kafein dalam sediaan tablet dengan nama dagang yang beredar dipasaran yang ditentukan secara KCKT memenuhi persyaratan kadar umumnya suatu sediaan tablet?
3. Apakah metode KCKT yang digunakan untuk menetapkan kadar campuran parasetamol, propifenazon dan kafein memenuhi persyaratan uji validasi?
1.4 Hipotesis
1 Fase gerak metanol : air, laju alir dan suhu kolom dengan perbandingan tertentu dapat memisahkan dan menetapkan kadar campuran parasetamol, propifenazon dan kafein dalam sediaan tablet dengan metode KCKT.
2 Kadar campuran parasetamol, propifenazon dan kafein dalam sediaan tablet dengan nama dagang yang beredar dipasaran yang ditentukan secara KCKT memenuhi persyaratan kadar umumnya suatu sediaan tablet.
3 Metode KCKT yang digunakan untuk menetapkan kadar campuran parasetamol, propifenazon dan kafein memenuhi persyaratan uji validasi.
1.5 Tujuan Penelitian
1. Melakukan optimasi fase gerak, laju alir dan suhu kolom untuk mengetahui kondisi yang optimum dalam memisahkan campuran parasetamol, propifenazon dan kafein dalam sediaan tablet yang beredar dipasaran dengan metode KCKT.
2. Mengetahui kesesuaian kadar campuran parasetamol, propifenazon dan kafein dalam sediaan tablet dengan nama dagang yang terdapat dipasaran secara KCKT dengan persyaratan kadar umumnya suatu sediaan tablet.
3. Mengetahui data dari parameter validasi metode KCKT yang digunakan pada penetapan kadar campuran parasetamol, propifenazon dan kafein.
1.6 Manfaat Penelitian
1 Pengembangan ilmu bahwa penetapan kadar campuran parasetamol, propifenazon dan kafein dalam sediaan tablet dapat dilakukan dengan metode Kromatografi Cair Kinerja Tinggi (KCKT).
2 Sebagai metode alternatif bagi industri farmasi dan Badan Pengawasan Obat dan Makanan (BPOM).
BAB II
TINJAUAN PUSTAKA
2.1 Kromatografi
Kromatografi adalah istilah umum yang digunakan untuk bermacam-macam teknik pemisahan yang didasarkan atas perbedaan adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul, atau kerapatan muatan ion sampel diantara suatu fase gerak yang bisa berupa gas ataupun cair dan fase diam yang juga bisa berupa cairan ataupun suatu padatan. Dengan demikian, masing-masing zat dapat diidentifikasi atau ditetapkan dengan metode analitik (Harmita, 2014).
Kromatografi pertama kali ditemukan dan dikembangkan oleh Michael Tsweet pada tahun 1906 pada saat ahli botani ini hendah memisahkan beberapa jenis klorofil dari ekstrak zat hijau daun dari beberapa jenis tumbuhan. Dalam tumbuhan banyak sekali pemisahan secara alami untuk pigmen-pigmennya dan juga terjadi perubahan secara kimiawi sehingga penampakkan perubahan warna.
Setelah ada kromatografi perubahan-perubahan kimia ini dapat diikuti dengan baik. Ilmu fisika dan matematika membantu perkembangan metode ini dengan mengembangkan instrumentasi modern. Instrumentasi modern memiliki kemampuan kromatografi untuk membantu analisis kimia dan biologi menjadi lebih luas. Demikian pula halnya dengan penggabungan instrumen modern untuk mencapai tujuan analisis yang lebih baik dan cepat juga sudah banyak ditemui (Wonorahardjo, 2018).
2.2 Jenis-jenis Kromatografi
Berdasarkan fase gerak yang digunakan, kromatografi dibedakan menjadi dua golongan besar, yaitu kromatografi gas dan kromatografi cair.
Menurut Harmita (2015), Penggolongan kromatografi berdasarkan fase gerak yang digunakan adalah sebagai berikut :
1. Kromatografi Gas
a) KGC (Kromatografi Gas - Cair) b) KGP (Kromatografi Gas - Padat) 2. Kromatografi Cair
a) KCKT (Kromatografi Cair Kinerja Tinggi )
b) KCC-KK (Kromatografi Cair- Cair- Kromatografi Kertas)
c) KCP-KLT, Kolom (Kromatografi Cair- Padat- Kromatografi Lapis Tipis) d) Pertukaran Ion
e) Pemisahan berdasarkan ukuran molekul 2.2.1 Kromatografi Cair- Cair (KCC)
KCC termasuk kromatografi pembagian, yaitu partisi terjadi antara fase gerak dan fase diam yang kedua-duanya zat cair. Dalam hal ini, fase diam tidak boleh larut dalam fase gerak. Sebagai contoh, pada kromatografi kertas, sebagai fase diam adalah air yang terserap pada serat selulosa dari kertas.
2.2.2 Kromatografi Cair- Padat (KCP)
KCP merupakan kromatografi penyerapan. Teknik ini menggunakan silika gel, alumina, penyaring molekul dalam sebuah kolom sebagai absorben;
komponen campuran dipisahkan oleh fase gerak. Kromatografi Kolom dan KLT merupakan teknik pemisahan yang termasuk dalam golongan ini.
2.2.3 Kromatografi Penukar Ion
Teknik ini menggunkan resin organik atau anorganik sebagai penukar ion.
Senyawa-senyawa yang mempunyai ion-ion dengan afinitas yang berbeda untuk
resin yang digunakan dapat dipisahkan dengan kromatografi ini. Cara ini sering digunakan untuk menganalisis asam amino.
2.2.4 Kromatografi Pemisahan berdasarkan ukuran molekul (Eksklusi) Dalam teknik ini, gel non-ion yang memiliki banyak pori yang berukuran sama digunakan untuk memisahkan campuran berdasarkan perbedaan ukuran molekul, kromatografi ini disebut kromatografi permeasi gel.
2.3 Penggunaan Kromatografi
Menurut Gritter (1991), tujuan penggunaan kromatografi adalah sebagai berikut :
a. Pemakaian untuk tujuan kualitatif mengungkapkan ada atau tidak adanya senyawa tertentu dalam cuplikan.
b. Pemakaian untuk bertujuan kuantitatif menunjukkan banyaknya masing-masing komponen campuran.
c. Pemakaian untuk tujuan preparatif untuk memperoleh komponen campuran dalam jumlah memadai dalam keadaan murni.
2.4 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi merupakan tehnik yang mana solut atau zat-zat terlarut terpisah oleh perbedaan kecepatan selama elusi, dikarenakan solut-solut ini melewati suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi dalam fase gerak dan fase diam. Penggunaan kromatografi cair kinerja tinggi membutuhkan penggabungan secara tepat dari berbagai macam kondisi operasional seperti kolom, fase gerak, panjang dan diameter kolom, kecepatan laju alir fase gerak, suhu kolom dan ukuran sampel (Rohman, 2007).
Keunggulan metoda ini dibanding metoda pemisahan lainnya terletak pada
ketepatan analisis dan kepekaan yang tinggi serta cocok untuk memisahka senyawa-senyawa nonvolatile yang tidak tahan pada pemanasan.
2.4.1 Prinsip Kerja KCKT
Kromatografi merupakan teknik zat terlarut terpisah oleh perbedaan kecepatan elusi, dikarenakan zat terlarut ini melewati suatu kolom kromatografi.
Pemisahan larutan-larutan ini diatur oleh distribusi dalam fase gerak dan fase diam. Penggunaan kromatografi cair membutuhkan penggabungan secara tepat dari berbagai macam kondisi operasional seperti jenis kolom, fase gerak, panjang dan diameter kolom, kecepatan alir gerak fase gerak, suhu kolom dan ukuran sampel (Ganjar dan Rohman, 2007).
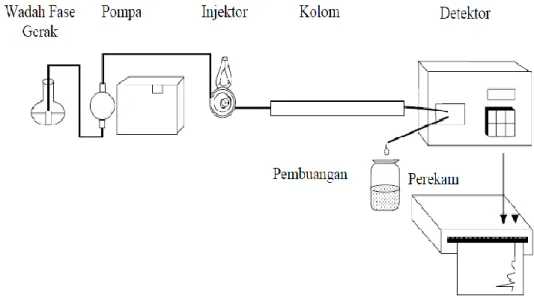
2.4.2 Instrumentasi
Instrumen KCKT tersusun atas 6 bagian dasar, yakni wadah fase gerak (reservoir), pompa (pump), tempat injeksi sampel (injector), kolom (column), detektor (detector) dan perekam (recorder).
Ilustrasi istrumen dasar KCKT dapat dilihat pada gambar 2.1
Gambar 2.1 Instrumen Dasar KCKT (McMaster, 2007)
2.4.2.1 Wadah Fase Gerak (Reservoir)
Wadah fase gerak (reservoir) terbuat dari bahan inert terhadap fase gerak. Bahan yang umum digunakan adalah gelas dan baja anti karat. Wadah fase ini biasanya dapat menampung fase gerak antara 200 mililiter sampai 2 liter pelarut. Pelarut yang digunakan harus bebas dari partikel padat. Hal ini penting karena partikel-partikel halus dapat menimbulkan kerusakan (menyumbat) sistem injektor, pompa dan juga kolom. Biasanya sebelum dimasukkan ke dalam wadah fase gerak pelarut fase gerak disaring dengan penyaring milipore dalam kondisi vakum (Susanti & Dachriyanus, 2014).
Gambar 2.2 Seperangkat Alat Penyaring & Alat Degasser (Susanti & Dachriyanus, 2014)
Degasser digunakan untuk menghilangkan gas terlarut dalam fase gerak dan mengurangi kemungkinan gelembung yang terbentuk pada pompa atau detektor selama proses pemisahan (Putra, 2007). Degasser terdiri dari suatu pompa vakum, system destilasi, alat pemanas dan suatu system pengaduk pelarut.
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Untuk fase normal (fase diam lebih polar dari pada fase gerak), kemampuan elusi
meningkat dengan meningkatnya polaritas pelarut. Sementara untuk fase terbalik (fase diam kurang polar dari pada fase gerak), kemampuan elusi menurun dengan meningkatnya polaritas pelarut (Rohman, 2007).
2.4.2.2 Pompa
Pompa adalah salah satu bagian yang sangat penting dalam semua sistem KCKT. Tujuan penggunaan pompa atau sistem penghantar fase gerak adalah untuk menjamin proses penghantaran fase gerak berlangsung secara tepat, reproduksibel, konstan dan bebas dari gangguan.
Beberapa persyaratan sistem pompa KCKT : 1. Mamberikan tekanan yang tinggi
2. Bebas dari pulsa
3. Memberikan kecepatan aliran 0,1 – 10 ml/menit
4. Aliran terkontrol dengan reprodusibilitas kurang dari 0,5%
5. Tahan karat, oleh karena itu seal pompa terbuat dari bahan baja atau teflon 6. Dapat memberikan aliran sistem isokratik maupun gradient (Susanti &
Dachriyanus, 2014)
Ada dua jenis pompa dalam KCKT yaitu : 1. Pompa dengan tekanan konstan
2. Pompa dengan aliran fase gerak yang konstan.
Tipe pompa dengan aliran fase gerak yang konstan sejauh ini lebih umum dibandingkan dengan pompa dengan tekanan tetap. Permasalahan utama sistem tekanan konstan adalaha kecepatan pertukaran aliran berlawanan dengan variasi sistem kromatografi. Hal ini menjadi masalah serius jika frekuensi pemakaian alat
tinggi, yaitu terjadi perubahan viskositas kolom pelarut selama proses analisis pada kecepatan aliran tersebut (Harmita, 2014).
2.4.2.3 Injektor
Cuplikan harus dimasukkan ke dalam pangkal kolom, diusahakan agar sedikit mungkin terjadi gangguan pada kemasan kolom (Putra, 2007).
Menurut Putra (2007), ada 3 jenis dasar injektor, yaitu : a. Hentikan aliran/ Flow
Aliran dihentikan, injeksi dilakukan pada kinerja atmosfir, sistem tertutup dan aliran dilanjutkan lagi. Teknik ini bisa digunakan karena difusi di dalam aliran kecil dan resolusi tidak dipengaruhi.
b. Septum
Injektor-injektor langsung ke aliran fase gerak umumnya sama dengan yang digunakan pada Kromatografi Gas. Injektor ini dapat digunakan pada kinerja sampai 60-70 atmosfir. Tetapi septum ini tidak tahan dengan semua pelarut-pelarut Kromatografi Cair. Disamping itu, partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat menyebabkan penyumbatan.
c. Katup Putaran Loop Valve
Tipe injektor ini umumnya digunakan untuk menginjeksi volume lebih besar dari 10 µL dan dilakukan dengan cara automatis (dengan adaptor yang sesuai, volume yang lebih kecil dapat diinjeksikan secara manual).
Pada waktu sampel diinjeksikan kedalam kolom, diharapkan agar aliran pelarut tidak mengganggu masuknya keseluruhan sampel ke dalam kolom.
Sampel dapat langsung diinjeksikan kedalam kolom (on column injection) atau digunakan katup injeksi (Meyer, 2004).
2.4.2.4 Kolom
Kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai.
Dalam kromatografi cair kinerja tinggi (KCKT), kolom terdiri atas tabung besi baja tahan karat berkualitas tinggi yang dikemas khusus. Kemampuan pemisahan kolom KCKT pada dasarnya sangat dipengaruhi oleh tipe pengemasan dengan batas-batas kolom.
Gambar 2.3 Jenis Kolom (Susanti & Dachriyanus, 2014)
Suhu kolom dikendalikan untuk alasan tertentu. Variasi suhu kolom akan mempengaruhi volume retensi. Suhu kolom yang baik akan membantu mengurangi tingkat kebisingan beberapa detektor. Dengan munculnya kemasan kolom yang sangat kecil (3 hingga 5 µm), suhu yang lebih tinggi digunakan secara umum untuk mengurangi viskositas fase gerak pelarut yang akan mengurangi tekanan yang diperlukan untuk mendorong pelarut melewati kolom.
Suhu kolom diatur dengan menggunakan oven udara (air oven), penangas air (water bath), dan blok pemanas (heating block). (Harmita, 2014).
Kolom dapat dibagi menjadi dua kelompok yaitu:
1. Kolom analitik
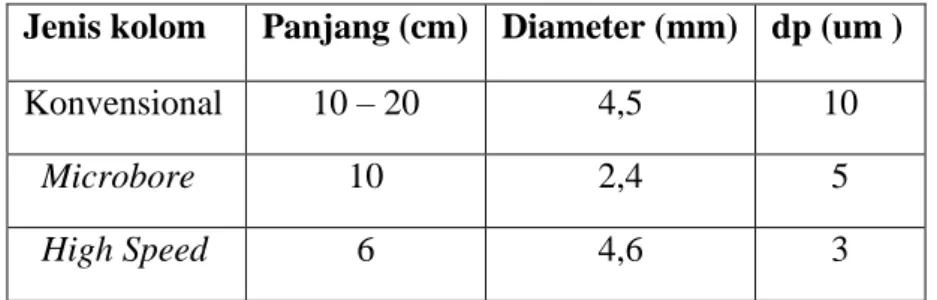
Kolom analitik digunakan untuk penentuan jenis dan jumlah analit yang diperiksa. Ditinjau dari ukurannya (panjang dan diameternya) kolom KCKT dibagi menjadi beberapa bagian sebagaimana terlihat pada Tabel 2.1.
Tabel 2.1 Macam-Macam Kolom KCKT
Jenis kolom Panjang (cm) Diameter (mm) dp (um )
Konvensional 10 – 20 4,5 10
Microbore 10 2,4 5
High Speed 6 4,6 3
Kolom mikrobor/High Speed mempunyai 3 keuntungan yang utama dibanding dengan kolom konvensional, yaitu:
1.
Jumlah fase gerak yang dibutuhkan pada pemisahan menggunakan kolom mikrobor hanya 80% atau lebih kecil dibanding dengan kolom konvensional karena pada kolom mikrobor kecepatan alir fase gerak lebih kecil (10 -100 μl/menit).2.
Aliran fase gerak yang lebih kecil membuat kolom mikrobor lebih ideal jika digabung dengan spektrometer massa.3.
Sensitivitas kolom mikrobor ditingkatkan karena solut lebih pekat, karenanya jenis kolom ini sangat bermanfaat jika jumlah sampel terbatas misal sampel klinis.Meskipun demikian, dalam prakteknya, kolom mikrobor ini tidak setahan kolom konvensional dan kurang bermanfaat untuk analisis rutin. Adapun tujuan kolom dibuat dengan diameter internal sangat kecil (kolom mikro) adalah sebagai berikut (Susanti & Dachriyanus, 2014):
1. Kepekaan menjadi lebih teliti 2. Mencegah difusi fase gerak 3. Memperluas kemampuan detector 4. Sampel yang dianalisis sedikit
Sedangkan tujuan kolom dibuat pendek (high speed) adalah:
1. Menghasilkan resolusi yang baik
2. Memperkecil harga diameter rata-rata partikel fasa diam 3. Waktu retensi (tR) menjadi singkat
2. Kolom Preparatif
Kolom preparatif digunakan untuk memisahkan komponen-komponen analit dalam jumlah besar. Biasanya pada kromatografi preparatif kita dapat mengumpulkan tiap-tiap eluen yang keluar dari kolom. Karena sampel yang dipisahkan pada kromatografi preparatif biasanya dalam jumlah yang relatif lebih besar, maka kolom preparatif biasanya juga memiliki diameter dalam dan panjang relatif lebih besar dari kolom analitik. Umumnya kolom preparatif memiliki diameter dalam 6 mm atau lebih dan panjang 25-100 cm (Susanti, 2013).
Gambar 2.4 Perbedaan Diameter Dan Panjang Dari Kolom Analitik Dan Kolom
2.4.2.5 Detektor
Detektor berfungsi untuk mendeteksi atau mengidentifikasi komponen yang ada eluan dan mengukur jumlahnya. Menurut Harmita (2014) Idealnya, suatu yang baik mempunyai sifat sebagai berikut:
a. Respons universal dan dapat diaplikasikan untuk semua analit b. Sensitivitas tinggi
c. Noisy rendah
d. Respon tidak dipenagruhi oleh variasi parameter (misalnya suhu kolom, tekanan, komposisi fase gerak dan kecepatan alir)
e. Respons stabil untuk jangka panjang
f. Mampu memberikan informasi kualitatif mengenai analit
Ada beberapa pilihan detektor KCKT yang dapat mendeteksi senyawa yang telah dipisahkan kolom. Detektor yang sering digunakan adalah detektor spektrofotometri UV. Senyawa organik biasanya menyerap di wilayah ultraviolet dengan panjang gelombang yang sering digunakan adalah 254 nm karena kebayakan senyawa organik memberikan serapan pada panjang gelombang tersebut (Wonorahardjo, 2018). Detektor lainnya, antara lain : detektor indeks bias, detektor fluoresensi, detektor elektrokimia, detektor ionisasi nyala, detektor hamburan cahaya evaporasi, detektor radioaktif juga telah digunakan.
Aplikasi KCKT sangat luas. Senyawa-senyawa organik dapat dipisahkan dengan baik dalam waktu singkat dan sempurna. Dengan tambahan fitur dari temperatur serta kombinasi pelarut serta kemungkinan melakukan elusi gradien membuat aplikasi sangat terbuka untuk berbagai jenis campuran senyawa organik.
Kepekaan deteksi yang sangat tinggi menyebabkan pelarut juga tidak boleh
mempunyai pengotor karena dalam jumlah sangat kecil pengotor akan mengganggu analisis bahkan terdeteksi sebagai puncak tersendiri (Wonorahardjo, 2018; Harmita , 2014).
2.4.2.6 Fase Gerak
Fase gerak adalah bagian yang lebih mudah untuk dimodifikasi dari pada fase diam. Fase gerak membawa senyawa-senyawa turun pada waktu elusi dan menentukan koefisien distribusi dari masing-masing senyawa dalam campuran yang dipisahkan. Kekuatan pelarut perlu untuk dipertimbangkan karena menentukan kompetisi penyerapan molekul sampel dan molekul pelarut sendiri dipermukaan fase diam (Wonorahardjo, 2018).
Daya elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase diam, dan sifat komponen-komponen sampel. Untuk KCKT fase normal kemampuan elusi meningkat dengan meningkatnya polaritas pelarut.
Sementara untuk KCKT fase terbalik kemampuan elusi menurun dengan meningkatnya polaritas pelarut.
Menurut Harmita (2014) Secara umum, fase gerak yang baik harus mempunyai sifat sebagai berikut :
a. Murni
b. Dapat melarutkan cuplikan dan selektif terhadap komponen c. Viskositas rendah
d. Cuplikan dapat diperoleh kembali dengan mudah jika diperlukan e. Dapat memisahkan zat dengan baik
Pemilihan fase gerak berdasarkan pada :
a. Kesesuaian dengan mekanisme pemisahan b. Kemampuan melarutkan cuplikan
c. Kepolaran yang dapat diubah dengan mengubah komposisi
2.4.2.7 Elusi Gradien dan Isokratik
Menurut Putra (2007) sistem elusi pada KCKT dapat dibagi menjadi dua sistem yaitu:
1. Sistem Elusi Isokratik.
Pada sistem ini, elusi dilakukan dengan satu macam atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap selama elusi).
2. Sistem Elusi Gradien.
Pada sistem ini, elusi dilakukan dengan campuran fase gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi fase gerak berubah-ubah selama elusi)
Gambar 2.5 Pompa Isokratik dan Gradien(Susanti & Dachriyanus, 2014)
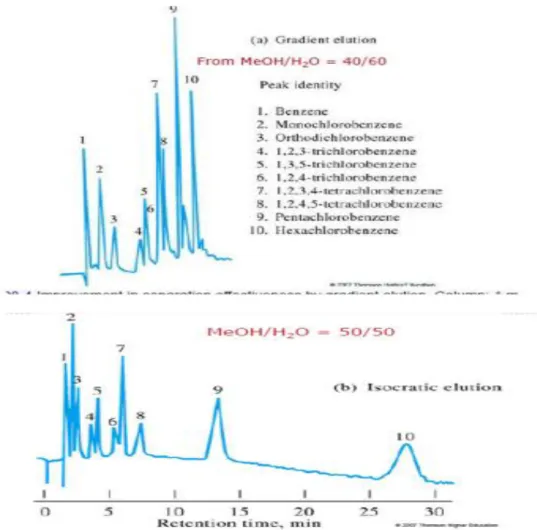
Keuntungan elusi gradient adalah sebagai berikut:
1. Mempersingkat total waktu analisis
2. Meningkatkan resolusi persatuan waktu tiap senyawa 3. Memberikan peak yang tajam (ramping)
4. Meningkatkan sensitivitas
Gambar 2.6 Pola kromatogram pemisahan campuran benzene terklorinasi dengan pelarut isopropanol (a) sistem elusi gradient dan (b) elusi isokratik menggunakan kolom Permaphase ® ODS (Susanti & Dachriyanus, 2014)
2.4.2.8 Jenis Pemisahan Kromatografi Cair Kinerja Tinggi
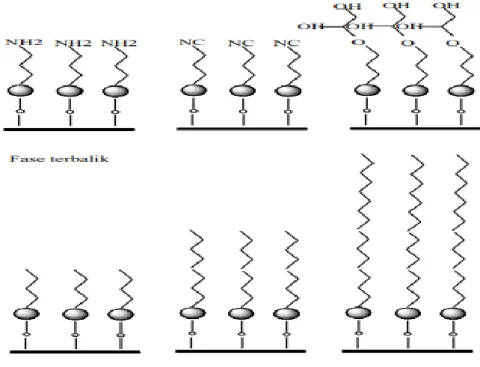
Kromatografi partisi dapat dibedakan berdasarkan pada kepolaran relatif fase diam dan fase gerak. Pada masa awal, penggunaan kromatografi cair menggunakan fase diam yang sangat polar seperti air atau trietilenglikol yang terikat pada partikel silica atau alumina; fase gerak adalah pelarut yang relative kurang polar seperti heksan atau iso propil eter.
Berdasarkan fase gerak dan fase diamnya, jenis pemisahan KCKT dibedakan atas :
1. Kromatografi Fase Normal
Kromatografi dengan kolom yang fase diamnya bersifat polar, misalnya silika gel, alumina, sedangkan fase geraknya bersifat non polar seperti heksan (Munson, 1991).
2. Kromatografi Fase Terbalik
Pada kromatografi fase terbalik, fase diamnya bersifat non polar, yang banyak dipakai adalah oktadesilsilana (ODS atau C18) dan oktilsilan (C8). Sedangkan fase geraknya bersifat polar, seperti air, metanol, asetonitril (Mulja dan Suharman,1995).
Gambar 2.7 Kolom Fase Normal Dan Kolom Fase Terbalik
Adsorpsi zat terlarut oleh fase diam atau adsorben sangat tergantung pada:
1. Struktur kimia zat terlarut atau adanya gugus aktif tertentu yang berinteraksi dengan adsorben.
2. Ukuran partikel adsorben. Semakin kecil ukuran partikel adsorben, maka luas
permukaannya semakin luas sehingga interaksinya dengan zat terlarut juga semakin luas.
3. Kelarutan zat terlarut dalam fase gerak. Zat terlarut yang makin mudah larut dalam fase gerak akan semakin mudah lepas dari fase diam (Munson, 1991).
2.5 Parameter Kromatografi Cair Kinerja Tinggi (KCKT)
Ada beberapa parameter KCKT yang digunakan secara umum antara lain:
2.5.1 Waktu Retensi (tR)
Waktu retensi adalah waktu yang diperlukan oleh analit untuk bergerak sepanjang kolom. Namun pada dasarnya waktu retensi menunjukkan lama dari sebuah komponen berada dalam kesetimbangan fase diam dan fase gerak sepanjang kolom (Wonorahardjo, 2018).
Jika fase gerak mengalir lebih lambat atau kolom semakin panjang, maka waktu retensi akan semakin besar dan sebaliknya fase gerak mengalir lebih cepat atau kolom semakin pendek,waktu retensi akan semakin pendek (Meyer, 2004).
2.5.2 Faktor Tailing dan Faktor Asimetris
Propil konsentrasi zat terlarut yang bermigrasi akan simetris jika rasio distribusi solut konstan selama di kisaran konsentrasi keseluruhan puncak.
Meskipun demikian, kurva akan berubah menjadi 2 jenis puncak asimetris yakni membentuk puncak yang berekor (tailing) dan adanya puncak pendahulu (fronting) jika ada perubahan rasio distribusi zat terlarut yang lebih besar baik tailing maupun fronting tidak dikehendaki karena dapat menyebabkan pemisahan kurang baik dan retensi kurang reprodusibel (Rohman, 2007).
Menurut Rohman (2007), adanya puncak yang simetris dapat disebabkan oleh hal-hal berikut:
1. Ukuran sampel yang dianalisis terlalu besar. Jika sampel terlalu besar maka fase gerak tidak mampu membawa zat terlarut dengan sempurna karenya aka terjadi pengekoran atau tailing.
2. Interaksi yang kuat antara zat terlarut dengan fase diam dapat menyebabkan zat terlarut sukar terelusi sehingga dapat menyebabkan terbentuknya puncak yang mengekor.
3. Adanya kontaminasi dalam sampel yang dapat muncul terlebih dahulu sehingga menimbulkan puncak mendahului (fronting).
Pada menentukan tingkat asimetris puncak dilakukan dengan menghitung faktor asimetris atau disebut juga dengan tailing factor (Tf) yang dinyatakan dengan rasio antara lebar setengah tinggi puncak. Kromatogram yang memberi harga Tf = 1 menunjukkan bahwa kromatogram tersebut bersifat setangkup atau simetris. Harga Tf > 2 menunjukkan bahwa kromatogram mengalami pengekoran (tailing). Semakin besar harga Tf maka kolom yang dipakai kurang efisien (Rohman, 2007).
Baik tinggi puncak maupun luasnya dapat dihubungkan dengan konsentrasi.
Tinggi puncak mudah diukur, akan tetapi sangat dipengaruhi perubahan waktu retensi yang disebabkan oleh variasi suhu dan komposisi pelarut. Oleh karena itu, luas puncak dianggap merupakan parameter yang lebih akurat untuk pengukuran yang kuantitatif (Ditjen POM, 2014).
Puncak kromatografi dalam kondisi ideal akan memperlihatkan derajat simetris yang sempurna. Namun kenyataannya dalam praktik kromatografi, puncak simetris secara sempurna jarang dijumpai. Jika diperhatikan lebih cermat, maka hampir setiap puncak dalam kromatografi memperlihatkan tailing dalam
derajat tertentu (Ornaf dan Dong, 2005; Dolan 2003). Pengukuran derajat asimetris puncak suatu kromatogram dapat dilihat pada Gambar 2.4 di bawah ini:
Gambar 2.8 Pengukuran Derajat Asimetris Puncak 2.5.3 Resolusi
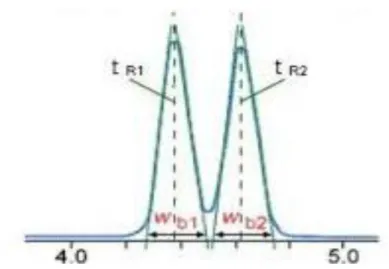
Resolusi menggambarkan derajat keterpisahan dua buah puncak dari senyawa komponen yang mirip, dan dilambangkan dengan Rs. Berdasarkan rumus Resolusi didefinisikan sebagai perbedaan antara waktu retensi dua puncak yang saling beredekatan dibagi dengan rata-rata lebar puncak.
Gambar 2.9 Pengukuran Derajat Resolusi
Nilai resolusi harus mendekati atau lebih dari 2 karena akan memberikan pemisahan puncak yang baik (Rohman, 2009).
2.6 Pengembangan Metode Kromatografi Cair Kinerja Tinggi Regresi Komponen Utama Dalam Sediaan Farmasi
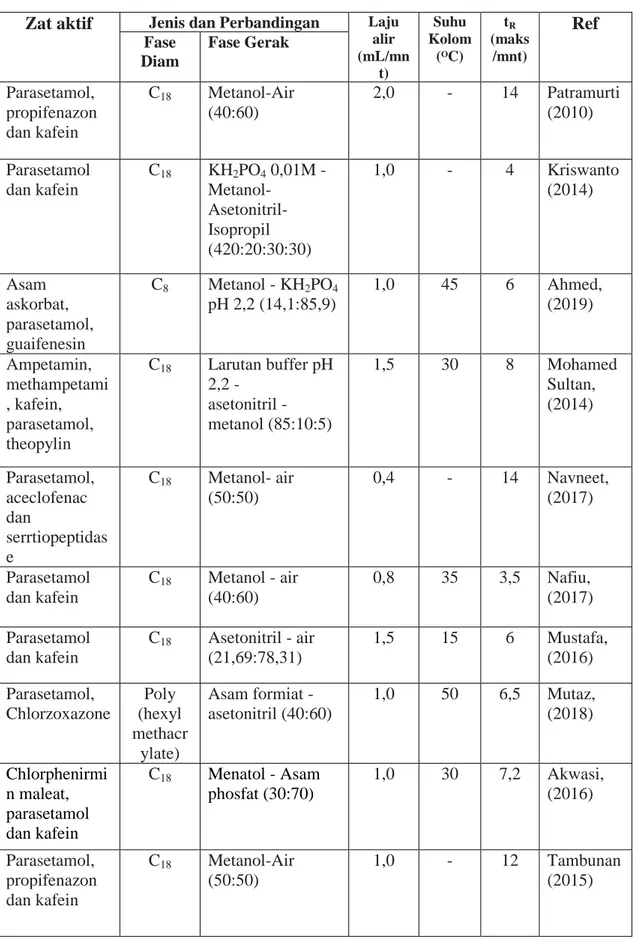
Patramurti (2010) telah melakukan penelitian tentang Penetapan kadar campuran parasetamol, propifenazon dan kafein dengan metode KCKT. Dr.
Muhamed Sultan (2014) telah melakukan penelitian tentang menetapkan kadar ampetamin, metamphetamin, kafein, parasetamol dan theophylline. Mustafa (2016) melakukan penetapan kadar parasetamol dan kafein secara KCKT.
Penetapan kadar secara simultan dari chlorpheniramin maleat, parasetamol dan kafein (Akwasi et al. 2016). Penentuan stabilitas analisis secara simultan parasetamol dan kafein dalam sediaan tablet dengan metode KCKT (Nafiu et al, 2017). Pengembangan dan validasi metode kromatografi baru untuk estimasi simultan serratiopeptidase, aceclofenac dan parasetamol dengan RP-KCKT (Novineet et al. 2017). Penelitian tentang penetapan kadar secara simultan parasetamol dan chlorzoxazone secara KCKT telah dilakukan mengunakan Polymethacrylate monolithic colom (Mutaz, 2018).
Tabel 2.2 Pengembangan Metode Kromatografi Cair Kinerja Tinggi Untuk Penentuan Parasetamol, Propifenazon dan Kafein
Zat aktif Jenis dan Perbandingan Laju alir (mL/mn
t)
Suhu Kolom
(ᴼC) tR (maks
/mnt)
Ref Fase
Diam
Fase Gerak
Parasetamol, propifenazon dan kafein
C18 Metanol-Air (40:60)
2,0 - 14 Patramurti (2010)
Parasetamol dan kafein
C18 KH2PO4 0,01M - Metanol-
Asetonitril- Isopropil (420:20:30:30)
1,0 - 4 Kriswanto
(2014)
Asam askorbat, parasetamol, guaifenesin
C8 Metanol - KH2PO4
pH 2,2 (14,1:85,9)
1,0 45 6 Ahmed,
(2019)
Ampetamin, methampetami , kafein, parasetamol, theopylin
C18 Larutan buffer pH 2,2 -
asetonitril - metanol (85:10:5)
1,5 30 8 Mohamed
Sultan, (2014)
Parasetamol, aceclofenac dan
serrtiopeptidas e
C18 Metanol- air (50:50)
0,4 - 14 Navneet, (2017)
Parasetamol dan kafein
C18 Metanol - air (40:60)
0,8 35 3,5 Nafiu, (2017) Parasetamol
dan kafein
C18 Asetonitril - air (21,69:78,31)
1,5 15 6 Mustafa,
(2016) Parasetamol,
Chlorzoxazone
Poly (hexyl methacr ylate)
Asam formiat - asetonitril (40:60)
1,0 50 6,5 Mutaz, (2018)
Chlorphenirmi n maleat, parasetamol dan kafein
C18 Menatol - Asam phosfat (30:70)
1,0 30 7,2 Akwasi, (2016)
Parasetamol, propifenazon dan kafein
C18 Metanol-Air (50:50)
1,0 - 12 Tambunan
(2015)
2.7 Validasi
Validasi adalah suatu tindakan terhadap parameter tentukan pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk membuktikan bahwa parameter tersebut memeneuhi persyaratan untuk penggunaannya. Validasi dilakukan untuk menjamin bahwa metode analisis yang dilakukan akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis ( Rohman, 2007).
Rujukan validasi yang dikhususkan untuk obat-obatan terdapat dalam petunjuk yang dikeluarkan oleh ICH (International Conference on Harmanization), USP (United State Pharmacopoeia), BP (British Pharmacopoeia), AOAC (Association of Official Analytical Chemists), dan IUPAC (International Union of Pure and Applied Chemistry) (Rohman, 2007).
Menurut USP (United State Pharmacopoeia) ada 8 langkah dalam validasi metode analisis :
2.7.1 Ketepatan (Accuracy)
Ketepatan (Accuracy) merupakan kedekatan antara nilai terukur (nili rata-rata hasil analisis) dengan nilai yang diterima sebagai nilai sebenarnya, baik nilai konvensi, nilai sebenarnya ataupun nulai rujukan.
Ketepatan (Accuracy) dapat ditentukaan dengan dua cara yaitu:
a. Metode Simulasi (Spiked- placebo recovery)
Dalam metode simulasi, sejumlah senyawa analit (senyawa pembanding) ditambahankan kedalam campuran bahan pembawa sediaan farmasi (placebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya).
b. Metode penambahan baku (Standard Addition Method)
Dalam metode penambahan baku, terlebih dahulu sampel dianalisis lalu sejumlah analit dengan konsentrasi tertentu ditambahkan kedalam sampel, dicampur kemudian dianalisis dengan metode tersebut. Persen perolehan kembali ditentukan dari hasil analit yang ditambahkan diperoleh kembali.
Untuk mendokumentasikan akurasi, ICH merekomendasikan pengumpulan data dari 9 kali penetapan kadar dengan 3 konsentrasi yang berbeda (misal 3 konsentrasi dengan 3 replikasi). Ketepatan dinyatakan dalam persen perolehan kembali (persen recovery) pada penetapan kadar dari sejumlah analit yang ditambahkan. Akurasi perolehan kembali yang umum untuk senyawa obat dalam suatu campuran dalam suatu campuran adalah 98-102%. Jika nilai akurasi perolehan kembalinya di luar kisaran ini, maka prosedur analisis harus dikaji ulang (Rohman, 2009).
% Perolehan Kembali =
Keterangan :
A = konsentrasi sampel yang diperoleh setelah penambahan baku B = konsentrasi sampel sebelum penambahan baku
C = konsentrasi baku yang ditambahkan 2.7.2 Ketelitian (Precision)
Ketelitian (Precision) merupakan ukuran kedekatan kesesuaian antara serangkaian hasil analisis yang diperoleh dari beberapa kali pengukuran pada sampel homogen yang sama. Konsep presisi diukur dengan simpangan baku. Nilai simpangan baku relative (Standart deviasi relative) antara 1-2% (Rohman, 2009).
Ketelitian (Precision) dinyatakan dengan 3 cara, yaitu :
a. Keterulangan (repeatability) adalah pengukuran ketelitian dengan metode, peralatan, laboratorium dan dalam selang waktu yang sama.
b. Ketelitian intermediet (intermediate Precision) pengukuran yang dilakukan dalam laboratorium yang sama tetapi dengan operator dan peralatan yang berbeda serta pada hari yang berlainan.
c. Ketertiruan (reproducibility) adalah pengukuran ketelitian yang dilakukan dengan peralatan, operator dan laboratorium yang berbeda.
2.7.3 Selektivitas (Spesifisitas)
Selektivitas atau spesifikasi suatu metode adalah kemampuannya yang hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel. Selektivitas seringkali dinyatakan sebagai derajat penyimpangan (degree of bias) metode yang dilakukan terhadap sempel yang mengandung bahan yang ditambahkan berupa cemaran, hasil urai, senyawa sejenis. Senyawa asing lainnya dan dibandingkan terhadap analisis sampel yang tidak mengandung bahan lain yang ditambahkan (Harmita, 2014).
2.7.4 Linieritas dan Rentang
Linieritas adalah kemampuan suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proposional dengan konsentrasi analit pada kisaran yang diberikan. Linieritas suatu metode merupakan ukuran seberapa baik kurva kalibrasi yang menghubungkan antara respon (y) dengan konsentrasi (x).
linieritas dapat diukur dengan melakukan pengukuran tunggal pada konsentrasi yang berbeda-beda. Data yang diperoleh selanjutnya diproses dengan metode
kuadrat terkecil, untuk selanjutnya dapat ditentukan nilai kemiringan (Slope), Intercep dan koefisien Korelasinya.
Kisaran konsentrasi yang digunakan untuk linieritas harus cukup luas untuk memenuhi kisaran metode yang diharapkan. Minimal 5 kisaran konsentrasi harus diamati. Kisaran konsentrasi yang dipilih untuk uji linieritas haruslah mencakup kisaran analit yang akan dituju (misalkan kisarannya 25%, 50%, 75%, 100%, 125% dan 150% dari konsentasi analit target)(Rohman, 2009).
2.7.5 Batas Deteksi (Limit of Detection atau LOD)
Batas deteksi adalah jumlah (konsentrasi) terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko. (Harmita, 2014).
2.7.6 Batas Kuantifikasi (Limit of Quantitation atau LOQ)
Batas kuantifikasi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan. (Rohman, 2009).
2.7.7 Kekerasan (Ruggedness)
Ketangguhan metode adalah derajat ketertiruan hasil uji yang diperoleh dari analisis sampel yang sama dalam berbagai kondisi uji normal, seperti laboratorium, analisis, instrumen, bahan pereaksi, suhu, hari yang berbeda dan lain-lain. Ketangguhan metode ditentukan dengan menganalisis suatu lot sampel yang homogen dalam laboratorium yang berbeda oleh analisis yang berbeda menggunakan kondisi operasi yang berbeda dan lingkungan yang berbeda tetapi menggunakan prosedur dan parameter uji yang sama.
2.7.8 Ketahanan (Robustness)
Pengujian ketahanan dilakukan untuk mengetahui kestabilan metode analisis tidak terpengaruh oleh variasi parameter metode yang diberikan dan tetap dapat memberikan hasil yang dapat dipercaya. Ketahanan evaluasi dengan melakukan variasi parameter-parameter metode seperti : persentase pelarut organik, pH, kekuatan ionik, suhu, dan sebagainya. Suatu praktik yang baik untuk mengevaluasi ketahanan suatu metode adalah dengan memvariasikan parameter-parameter penting dalam suatu metode secara sistematis lalu mengukur pengaruhnya pada pemisahan, sebagai contoh : jika suatu metode menggunakan asetonitril 36% : air sebagai fase gerak, maka seorang analisis lalu memvariasi persentase asetonitrilnya menjadi mislkan 33%, 36% dan 39% lalu melihat pengaruhnya pada waktu retensi analit yang di uji.
2.8 Analisis Data Kadar Secara Statistik
Kadar yang diperoleh dianalisis secara statistik menggunakan uji t, rumus yang digunakan untuk menghitung standar deviasi (SD) adalah :
SD = √
∑ ̅
Selanjutnya untuk menetukan data diterima atau ditolak digunakan rumus :
t
hitung=
| ̅|√
Dasar penolakan data apabila thitung ttabel pada taraf kepercayaan 99% dengan nilai α = 0,01, dk = n-1
keterangan:
SD = Strandar Deviasi
X = kadar dalam suatu perlakuan ̅̅ = kadar rata-rata dalam satu sampel
Untuk mencari kadar sebenarnya dapat digunakan rumus :
̅
( )
√
Keterangan:
µ = kadar sebenarnya
̅
= kadar rata-rata sampel n = jumlah perlakuant = harga ttabel sesuai dengan derajat kepercayaan dk = derajat kebebasan
2.9 Monografi Parasetamol, Propifenazon dan Kafein 2.9.1 Parasetamol
Menurut Ditjen POM (2014) uraian tentang parasetamol adalah sebagai berikut:
Rumus struktur:
Gambar 2.10 Rumus Parasetamol Nama Kimia : 4-Hidroksiasetanilida
Rumus Molekul : C8H9NO2
Berat molekul : 151, 16 g/mol
Pemerian : serbuk hablur, putih, tidak berbau, rasa sedikit pahit.
Kelarutan : larut dalam air mendidih dan dalam natrium hidroksida 1N, mudah larut dalam etanol.
2.9.1.1 Metode Penetapan Kadar Parasetamol
Parasetamol merupakan obat analgesik-antipiretik yang sangat populer.
Parasetamol dapat tersedian dalam berbagai macam sediaan seperti tablet, kapsul, sirup, eliksir, suspensi dan suppositoria. Parasetamol juga sering dikombinasikan dengan bahan obat lain dalam satu formulasi (Sudjadi dan Rohman, 2012).
Parasetamol dapat ditetapkan kadarnya dengan cara Spektrovotometri UV-Visible, Spektofluorometri (Bosch, 2006), Kromatografi.
2.9.2 Propifenazon
Menurut Moffat, A.C., M.D (2004) uraian tentang propifenazon adalah sebagai berikut:
Rumus struktur
Gambar 2.11 Rumus Propifenazon Nama Kimia : 4-Isopropyl-1,5-dimethyl-2-phenyl pyrazolin Rumus Molekul : C14H18N2O
Berat molekul : 230,3
Pemerian : berupa kristal atau serbuk kristal putih
Kelarutan : sangat mudah larut dalam etanol dan kloroform, larut dalam eter, larut dalam 400 bagian air
Propifenazon adalah derivat fenazon tanpa daya antiradang dengan sifat kelarutan sama. Plasma t1/2-nya 90 menit. Resiko agranulositosis lebih ringan dibandingkan
induknya fenazon. Umumnya dalam bentuk kombinasi dengan analgetik yang lainnya (Tjay dan Rahaja, 2015).
2.9.2.1 Metode Penetapan Kadar Derivat Fenazon
Propifenazon merupakan golongan fenazon yang digunakan sebagai obat antipiretik, analgesik dan antiinflamsi. Propifenazon dalam sediaan farmasi dapat ditetapkan kadarnya secara gravimetri, titrimetri, kolorimetri dan polarografi.
2.9.3 Kafein
Menurut Ditjen POM (2014) uraian tentang kafein adalah sebagai berikut:
Rumus struktur:
Gambar 2.12 Rumus Kafein Nama kimia : 1,3,7-Trimetil xantin
Rumus molekul : C8H10N4O2
Berat molekul : 194,19
Pemerian : serbuk putih atau bentuk jarum mengkilat putih, tidak berbau, rasanya pahit, biasanya menggumpal.
Kelarutan : agak sukar larut dalam air,dalam etanol, mudah larut dalam kloroform, sukar larut dalam eter.
2.9.3.1 Metode Penetapan Kadar Kafein
Berbagai metode digunakan untuk analisis senyawa golongan xantin yaitu kafein seperti volumetri, spektrofotometri, kromatografi dan elektroforesis kapiler. Talik, dkk (2012) telah membuat review tentang berbagai metode analisis
untuk determinasi senyawa golongan xantin yaitu kafein (Sudjadi dan Rohman, 2012). Kafein dapat ditetapkan kadarnya dengan metode Volumetri, Kromatografi Lapis Tipis (Morlock, 2007), Kromatografi Cair Kinerja Tinggi (Pistos dan Stewart, 2004)