PENENTUAN KADAR ION KLORIDA DENGAN METODE
ARGENTOMETRI (metode mohr)
Tujuan: Menentukan kadar ion klorida dalam air dengan metode argentometri
Widya Kusumaningrum (1112016200005), Ipa Ida Rosita, Nurul Mu’nisah Awaliyah,
Ummu Kalsum A.L, Amelia Rachmawati.
Program Studi Pendidikan Kimia
Jurusan Pendidikan Ilmu Pengetahuan Alam
Fakultas Ilmu Tarbiyah dan Keguruan
Universitas lslam Negeri Syarif Hidayatullah Jakarta
ABSTRAK
Ion klorida adalah anion yang dominan di perairan laut. Ion klorida termasuk ke dalam
golongan halida. Penentuan kadar ion klorida dalam air dapat menggunakan metode argentometri
(titrasi pengendapan). Terdapat dua metode dalam menggunakan metode argentometri, yaitu
metode volhard dan metode mohr. Pada percobaan ini menggunakan metode mohr. Metode mohr
ialah titrasi yang digunakan untuk menetukan kadar halida Cl
-Br
-I
-dengan AgNO3 yang
menggunakan indikator asam kromat. Indikator ini berfungsi sebagai penanda apabila tercapai
titik ekuivalen. Setelah mencapai titik ekuivalen kadar klorida yang didapatkan sebesar 129,39
g/L dalam satuan ppm sebesar 129.390 mg/L. Metode mohr cukup akurat dan dapat digunakan
pada konsentrasi klorida yang rendah.
Kata kunci: Argentometri, titrasi pengendapan, metod mohr, kadar klorida, indikator asam
I. PENDAHULUAN
Ion klorida adalah anion yang dominan di perairan laut. Sekitar ¾ dari clorin (Cl2) yang
terdapat di bumi berada dalam bentuk larutan, sedangkan sebagian besar florin (F2) berada
dalam bentuk batuan mineral. Unsur klor dalam air terdapat dalam bentuk ion klorida (Cl-).
Ion klorida adalah salah satu anion anorganik utama yang ditemukan di perairan alami dalam
jumlah lebih banyak daripada anion halogen lainnya. Klorida biasanya terdapat dalam bentuk
senyawa natrium klorida (NaCl), kalium klorida (KCl) dan kalsium klorida (CaCl2). Klorida
tidak bersifat toksik pada makhluk hidup, bahkan berperan dalam pengaturan tekanan
osmotik sel (Hefni Effendi, 2003: 135-136).
Anion Cl- dengan larutan perak nitrat AgNO3 membentuk endapan perak klorida ,
AgCl, yang seperti dadih dan putih. Ia tak larut dalam air dan dalam asam nitrat encer tetapi
larut dalam larutan amonia encer dan dalam larutan-larutan kalium sianida dan tiosulfat (G.
Svehla, 1985: 346).
Ion klorida terdapat dalam bentuk senyawa. Banyak senyawa kimia dalam kehidupan
sehari-hari yang mengandung klorida. Kadar klorida tiap senyawa berbeda-beda. Untuk
menentukan kadar ion klorida dalam air dapat menggunakan metode argentometri.
Titrasi pengendapan adalah golongan titrasi di mana hasil reaksi titrasinya merupakan
endapan atau garam yang sukar larut. Prinsip dasarnya adalah reaksi pengendapan yang
mencapai kesetimbangan pada setiap penambahan titran; tidak ada pengotor yang
mengganggu dan diperlukan indikator untuk melihat titik akhir titrasi. Hanya reaksi
pengendapan yang dapat digunakan pada titrasi. Akan tetapi metode tua seperti penetuan Cl-¸
kurang digunakannya metode tersebut adalah sulitnya memperoleh indikator yang sesuai
untuk menentukan titik akhir pengendapan. Kedua, komposisi endapan tidak selalu diketahui
(S.M Khopkar, 1990: 61).
Titrasi argentometri didasarkan pada reaksi:
AgNO3 + Cl- AgCl(s) + NO3-
Kalium kromat dapat digunakan sebagai indikator, menghasilkan warna merah dengan
kelebihan ion Ag+ titrasi yang lebih banyak dapat digunakan adalah metode titrasi balik
(David G Watson, 2007).
II. ALAT, BAHAN, DAN PROSEDUR KERJA
ALAT DAN BAHAN JUMLAH
1) Masukkan 10 ml larutan Mgcl2 ke dalam labu erlenmeyer.
2) Tambahkan indikator asam kromat.
3) Titrasi dengan larutan AgNO3 0,5 M, sampai endapan berwarna ungu.
4) Panaskan larutan yang terdapat endapat endapan ungu dengan pemanas air (
III. HASIL DAN PEMBAHASAN
Tabel 1
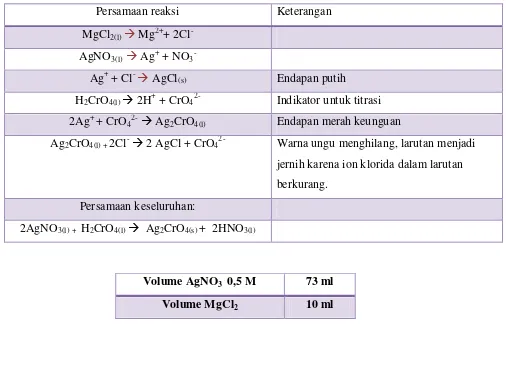
Langkah Kerja Pengamatan
Larutan MgCl2 + indikator K2CrO4 + AgNO3 Terbentuk endapan berwarna keunguan (ungu
muda)
Dipanaskan pada suhu 500C Tetap, tidak terjadi perubahan
Diamkan selama 5 menit Larutan berubah menjadi tidak berwarna (jernih)
dan endapan terpisah
+ CrO42- Indikator untuk titrasi
2Ag+ + CrO42- Ag2CrO4(l) Endapan merah keunguan
Ag2CrO4(l) + 2Cl- 2 AgCl + CrO42- Warna ungu menghilang, larutan menjadi
jernih karena ion klorida dalam larutan
berkurang.
Persamaan keseluruhan:
2AgNO3(l) + H2CrO4(l) Ag2CrO4(s) + 2HNO3(l)
Volume AgNO3 0,5 M 73 ml
Perhitungan
Kadar ion klorida = Molaritas x massa molekul
= 3,65 M x 35,45 g/L
= 129,39 g/L
C. Kadar Ion Klorida dalam ppm = 129,39 x 1000 mg/L
= 129.390 mg/L
Penentuan kadar ion klorida dalam air menggunakan metode argentometri dengan
metode mohr. Prinsipnya dalah reaksi kesetimbangan pada saat penambahan titran. Metode
argentometri merupakan metode yang jarang digunakan karena sulitnya mendapatkan
indikator yang sesuai. Selain itu komposisi endapan tidak selalu diketahui, yang dapat
diketahui ialah hasil akhirnya.
Penggunaan indikator pengendapan
Sebagai contoh adalah ion kromat, yang digunakan pada penentuan argentometri secara
Mohr. Jika suatu klorida atau suatu bromida dititrasi dengan larutan perak nitrat dengan
adanya ion kromat, maka sampai reaksi halogenida. Pada titik ekuivalen maka ion perak
berlebih akan bereaksi dengan ion kromat yang ada memberikan perak kromat yang berwarna
Pada penentuan kadar klorida, titrasi menggunakan indikator asam kromat. Jika
terbentuk endapan berwarna merah keunguan, maka titrasi telah mencapai titik ekuivalen.
Warna endapan yang dihasilkan disebabkan oleh ion perak berlebih bereaksi dengan ion
kromat. Ion kromat yang ada memberikan perak kromat warna coklat merah, tetapi pada
percobaan warna endapan ialah ungu keabu-abuan.
Setelah mencapai titik ekuivalen, maka kadar ion klorida dapat dicari dengan
menggunakan persamaan dan didapatkan molaritas sebesar 3,65 M.
Molaritas tersebut digunakan untuk mencari kadar ion klorida dengan
persamaan . Kadar klorida yang didapatkan sebesar 129,39 g/L
dalam satuan ppm sebesar 129.390 mg/L. Metode mohr cukup akurat dan dapat digunakan
pada konsentrasi klorida yang rendah.
IV. KESIMPULAN
Berdasarkan data hasil percobaan dan pembahasan di atas, maka dapat disimpulkan
bahwa:
1) Penentuan kadar ion klorida dengan metode mohr perlu menggunakan indikator yang
dapat menunjukan terjadi ekuivalen.
2) Endapan yang dihasilkan digunakan untuk menetukan kadar ion klorida dalam air.
3) Kadar ion klorida yang didapatkan sebesar 129,39 g/L dalam satuan ppm sebesar
129.390 mg/L.
V. DAFTAR PUSTAKA
Effendi, Hefni.2003.TELAAH KUALITAS AIR.Yogyakarta: Penerbit Kanisius
J.Roth, Hermann dan Blaschke, Goffried.1985.ANALISIS FARMASI. Penerbit:
Gadjah Mada University Press.
Khopkar, S.M. 1990. KONSEP DASAR KIMIA ANALITIK. Penerbit: UI-Press.
Svehla, G.1985.BUKU TEKS ANALISIS ANORGANIK KUALITATIF MAKRO
DAN SEMIMIKRO EDISI KE LIMA.Jakarta: PT.Kalman Media Pustaka.
Watson,G David.2007.ANALISIS FARMASI EDISI 2.Penerbit: Buku Kedokteran