PENETAPAN KADAR KALIUM, KALSIUM, MAGNESIUM DAN NATRIUM PADA BUAH MANGROVE
(Sonneratia coseolaris) SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ACHMAD NOVYARMAN NIM 131524049
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2018
PENETAPAN KADAR KALIUM, KALSIUM, MAGNESIUM DAN NATRIUM PADA BUAH MANGROVE
(Sonneratia coseolaris) SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ACHMAD NOVYARMAN NIM 131524049
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR KALIUM, KALSIUM, MAGNESIUM, DAN NATRIUM PADA BUAH MANGROVE
(Sonneratia caseolaris) SECARA SPEKTROFOTOMETRI SERAPAN ATOM
OLEH:
ACHMAD NOVYARMAN NIM 131524049
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 27 November 2017
Disetujui oleh:
Pembimbing I Panitia Penguji,
Drs. Fathur Rahman H., M.Si., Apt. Prof. Dr. Muchlisyam, M.Si., Apt.
NIP 195201041980031002 NIP 195006221980021001
Pembimbing II Drs. Fathur Rahman H., M.Si., Apt.
NIP 195201041980031002
Prof. Dr. rer.nat. E. De Lux Putra, S.U., Apt. Dra. Sudarmi, M.Si., Apt.
NIP 195306191983031001 NIP 195409101983032001
Prof. Dr. rer. nat. E. De Lux Putra, S.U., Apt.
NIP 195306191983031001
Medan, Januari 2018 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Prof. Dr. Masfria, M.S., Apt.
NIP 195707231986012001
KATA PENGANTAR
Bismillahirrahmanirrahiim,
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan skripsi yang berjudul “Penetapan Kadar Mineral Kalium, Kalsium, Magnesium dan Natrium pada Buah Mangrove (Sonneratia caseolaris) secara Spektrofotometri Serapan Atom”. Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis hendak menyampaikan rasa hormat dan terima kasih yang sebesar-besarnya kepada Ibu Prof. Dr. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas dan masukan selama masa pendidikan dan penelitian, kepada Bapak Drs.
Fathur Rahman Harun, M.Si., Apt., dan Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U., Apt., selaku dosen pembimbing yang telah banyak memberikan bimbingan, arahan dan bantuan selama masa penelitian dan penulisan skripsi ini berlangsung. Penulis juga menyampaikan ucapan terima kasih kepada Bapak Prof.
Dr. Muchlisyam, M.Si., Apt., dan Ibu Dra. Sudarmi, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini, Bapak Ibu staf pengajar Fakultas Farmasi USU yang telah mendidik selama perkuliahan serta Ibu Dr. Marline Nainggolan, M.Si., Apt., selaku dosen pembimbing akademik yang selalu membimbing selama masa pendidikan.
Penulis juga ingin menyampaikan rasa terima kasih serta penghargaan yang tulus dan tak terhingga kepada orang tua tersayang Alm. Bapak Suhadi dan Ibunda Mazro’ah serta adik Muhammad Aprian Styady, Febry Imaniar, Ikrima Juniarti dan Natasca Rizqy juga seluruh keluarga atas doa dan dukungan baik moril maupun materil dan sahabat-sahabat penulis juga seluruh teman-teman di Fakultas Farmasi Universitas Sumatera Utara yang telah membantu, memberikan dukungan dan menjadi penyemangat bagi penulis atas motivasi dan segala bantuan dalam penyelesaian skripsi ini yang tidak dapat disebutkan satu per satu.
Semoga Tuhan Yang Maha Kuasa memberikan balasan yang berlipat ganda kepada semua pihak yang telah membantu dalam penulisan skripsi ini. Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu, sangat diharapkan kritik dan saran yang bersifat membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang farmasi.
Medan, Januari 2018 Penulis,
Achmad Novyarman NIM 131524049
PENETAPAN KADAR KALIUM, KALSIUM, MAGNESIUM DAN NATRIUM PADA BUAH MANGROVE (Sonneratia caseolaris) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Indonesia memiliki hutan mangrove terluas di dunia yakni 22,6% dari luas total mangrove dunia yang tersebar hampir di seluruh pulau-pulau besar mulai dari Sumatera, Jawa, Kalimantan, Sulawesi, sampai ke Papua. Mangrove adalah tumbuhan berkayu yang hidup diantara daratan dan lautan daerah pasang surut, kondisi tanah berlumpur di daerah tropis dan subtropis. Buah mangrove (Sonneratia caseolaris) banyak dibuat menjadi produk makanan seperti kue, pudding, selain itu buah mangrove memiliki komposisi zat gizi makro dan vitamin A, B1, B2, dan C.
Buah mangrove (Sonneratia caseolaris) telah diteliti memiliki kandungan kalsium, kalium, magnesium, fosfor, mangan, besi, cupri, zink, protein, lemak, air, dan pektin.
Tujuan penelitian ini adalah untuk menetapkan kadar mineral kalium, kalsium, magnesium dan natrium yang terdapat pada buah mangrove (Sonneratia caseolaris) sehingga buah mangrove dapat dikembangkan sebagai produk makanan dan minuman olahan serta produk lain yang berkaitan dengan bidang kefarmasian.
Sebelum dilakukan analisis, sampel buah mangrove didestruksi menggunakan metode destruksi kering, kemudian dilakukan analisis mineral kalium, kalsium, magnesium dan natrium secara kuantitatif dengan menggunakan spektrofotometer serapan atom dengan tipe nyala udara-asetilen pada masing- masing panjang gelombang 766,5 nm, 422,7 nm, 285,2 nm dan 589 nm.
Berdasarkan hasil penelitian diperoleh bahwa kadar mineral masing-masing pada 95,2636 ± 1,0482 mg/100g untuk kalium, 33,8226 ± 0,1998 mg/100g untuk kalsium, 37,4961 ± 0,1891 mg/100g untuk magnesium dan 77,7731 ± 0,3738 mg/100g untuk natrium.
Kata kunci: buah mangrove, kalium, kalsium, magnesium, Natrium, Spektrofotometer serapan atom
DETERMINATION OF POTASSIUM, CALCIUM, MAGNESIUM AND SODIUM VALUE IN MANGROVES FRUIT (Sonneratia caseolaris)
BY ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Indonesia has the world's largest mangrove forest which is 22.6% of the total mangrove worldwide spread to almost all major islands from Sumatra, Java, Kalimantan, Sulawesi, to Papua. Mangroves are woody plants that live between land and sea tidal areas, muddy ground conditions in the tropics and subtropics area.
A lot of mangrove fruits (Sonneratia caseolaris) can be produced as food production like cakes, pudding, besides that mangrove fruits heving the composition macro nutrients and vitamins A, B1, B2, and C. Mangrove fruit (Sonneratia caseolaris) has been studied that it contain calcium, potassium, magnesium, phosphorus, manganese, iron, cupri, zinc, protein, fat, water, and pectin.
The purpose of this study is to establish the levels of minerals potassium, calcium, magnesium and sodium contained in fruit mangrove (Sonneratia caseolaris) so that the mangrove fruit can be developed as processed food and beverage products as well as other products related to the field of pharmacy.
Prior to analysis, samples of fruit mangrove destruction using a dry dectruction method, then analysis of minerals potassium, calcium, magnesium and sodium quantitatively using atomic absorption spectrophotometer with a type of air-acetylene flame at each wavelength of 766.5 nm, 422.7 nm, 285.2 nm and 589 nm.
The result showed that the levels of minerals each at 95.2636 ± 1.0482 mg/100g for potassium, 33.8226 ± 0.1998 mg/100g for calcium, 37.4961 ± 0.1891 mg/100g for magnesium and 77.7731 ± 0.3738 mg/100g for sodium.
Keywords : mangrove fruit, kalium, calcium, magnesium, sodium, Atomic absorption spectrophotometer
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN TIDAK PLAGIAT ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Sistematika Tumbuhan …... ... 5
2.1.2 Nama daerah ... 5
2.1.3 Sinonim ... 5
2.1.4 Morfologi Tumbuhan ... 6
2.1.5 Tempat Tumbuh ... 6
2.1.6 Kandungan Kimia ... 6
2.2 Mineral ... 7
2.2.1 Kalium ... 8
2.2.2 Kalsium ... 8
2.2.3 Magnesium ... 9
2.2.1 Natrium ... 9
2.3 Destruksi ... 10
2.3.1 Destruksi Basah ... 10
2.3.2 Destruksi Kering ... 11
2.4 Spektrofotometri Serapan Atom ... 12
2.5 Validasi Metode Analisis ... 15
BAB III METODE PENELITIAN... 17
3.1 Lokasi Penelitian ... 17
3.2 Bahan-bahan ... 17
3.2.1 Sampel ... 17
3.2.2 Pereaksi ... 17
3.3 Alat-alat ... 18
3.4 Identifikasi Sampel ... 18
3.5 Pembuatan Pereaksi ... 18
3.5.1 Larutan Asam Nitrat dengan akuademineralisata (1:1). . 18
3.6 Prosedur Penelitian ... 18
3.6.1 Metode Pengambilan Sampel ... 18
3.6.3 Proses Destruksi ... 19
3.6.4 Pembuatan Larutan Sampel ... 19
3.6.5 Pembuatan Kurva Kalibrasi ... 20
3.6.5.1 Kalium ... 20
3.6.5.2 Kalsium ... 20
3.6.5.3 Magnesium ... 21
3.6.5.4 Natrium ... 21
3.6.6 Penetapan Kadar Kalium, Magnesium, Kalsium dan Besi dalam Sampel ... 22
3.6.6.1 Penetapan Kadar Kalium Sampel ... 22
3.6.6.2 Penetapan Kadar Kalsium Sampel ... 22
3.6.6.3 Penetapan Kadar Magnesium Sampel ... 22
3.6.6.4 Penetapan Kadar Natrium Sampel ... 23
3.6.6.5 Perhitungan kadar kalium, kalsium, magnesium dan natrium dalam sampel ... 23
3.7 Analisis Data Secara Statistik ... 23
3.7.1 Penerimaan dan Penolakan Hasil Pengamatan ... 23
3.8 Validasi Metode ... 24
3.8.1 Penentuan Batas Deteksi dan Batas Kuantitasi ... 24
3.8.2 Uji perolehan Kembali (Recovery) ... 25
3.8.3 Uji Keseksamaan (Precision) ... 26
BAB IV HASIL DAN PEMBAHASAN ... 27
4.1 Hasil Identifikasi Tumbuhan ... 27
4.2 Kurva Kalibrasi Kalium, Kalsium, Magnesium dan Natrium ... 27
4.3 Analisis Kadar Kalium, Kalsium, Magnesium dan Natrium pada Sampel Buah Mangrove (Sonneratia caseolaris) ... 30
4.4 Uji Perolehan Kembali (Recovery) ... 32
4.5 Simpangan Baku Relatif ... 33
4.6 Batas Deteksi dan Batas Kuantitasi ... 34
BAB V KESIMPULAN DAN SARAN ... 35
5.1 Kesimpulan ... 35
5.2 Saran ... 35
DAFTAR PUSTAKA ... 36
LAMPIRAN ... 38
DAFTAR TABEL
Tabel Halaman
2.1 Rentang Persen Perolehan Kembali Yang Diizinkan Pada Analit
Sampel ... 16
4.1 Kadar Mineral Buah Mangrove yang Dihitung berdasarkan Berat
Basah ... 31 4.2 Hasil Uji Perolehan Kembali Kadar Mineral Sampel ... 32 4.3 Nilai Simpangan Baku, Batas Deteksi dan Batas Kuantitasi Kurva
Kalibrasi ... 33
4.4 Nilai Batas Deteksi dan Batas Kuantitasi Lurva Kalibraasi ... 34
DAFTAR GAMBAR
Gambar Halaman
2.1 Sistem Peralatan Spektrometer Serapan Atom ... 13
4.1 Kurva Kalibrasi Larutan Standar Kalium ... 27
4.2 Kurva Kalibrasi Larutan Standar Kalsium ... 29
4.3 Kurva Kalibrasi Larutan Standar Magnesium ... 29
4.4 Kurva Kalibrasi Larutan Standar Natrium ... 29
DAFTAR LAMPIRAN
Lampiran Halaman
1 Tanaman Mangrove ... 38
2 Hasil Determinasi Tumbuhan ... 39
3 Bagan Alir Proses Destruksi Kering ... 40
4 Bagan Alir Pembuatan Larutan Sampel ... 41
5 Data Kalibrasi Kalium Dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 42
6 Data Kalibrasi Kalsium Dengan Spektrofotometerv Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 44
7 Data Kalibrasi Magnesium Dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 46
8 Data Kalibrasi Natrium Dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 48
9 Hasil Pengukuran Absorbansi Larutan Standar Kalium, Kalsium, Magnesium dan Natrium ... 50
10 Contoh Perhitungan Kadar Mineral Kalium, Kalsium, Mangnesium dan Natrium dalam Sampel ... 51
11 Perhitungan Statistik Kadar Kalium, Kalsium, Magnesium dan Natrium dalam Sampel ... 54
12 Rekapitulasi Data Kadar Kalium, Kalsium, Magnesium dan Natrium pada Buah Mangrove Sebelum Uji-t ... 61
13 Rekapitulasi Data Kadar Kalium, Kalsium, Magnesium dan Natrium pada Buah Mangrove Setelah Uji-t ... 62
14 Perhitungan Jumlah Baku Yang Ditambahkan Untuk Persen Perolehan Kembali Kalium, Kalsium, Magnesium dan Natrium Buah Mangrove ... 63
15 Hasil Uji Perolehan Kembali Kalium, Kalsium, Magnesium dan Natrium Setelah Penambahan Masing-masing Larutan Standar ... 66 16 Perhitungan Uji Perolehan Kembali Kalium, Kalsium,
Mangnesium dan Natrium dalam Larutan Sampel ... 68 17 Perhitungan Simpangan Baku Relatif (RSD) Mineral Kalium,
Kalsium, Magnesium dan Natrium dalam Larutan Sampel ... 72 18 Rekapitulasi Uji Perolehan Kembali Kalium, Kalsium,
Mangnesium dan Natrium Sampel ... 76 19 Perhitungan Batas Deteksi dan Batas Kuantitasi Kalium,
Kalsium, Magnesium dan Natrium pada Buah Mangrove ... 80 20 Spektrofotometer Serapan Atom (SSA) dan Alat Tanur ... 82 21 Tabel Distribusi t ... 83
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara yang memiliki berbagai macam hutan, salah satunya adalah hutan mangrove yang luasnya 22,6% dari luas total magrove dunia yang tersebar di seluruh pulau-pulau besar yang ada di Indonesia seperti Sumatera, Jawa, Kalimantan, Sulawesi, sampai ke Papua. Mangrove adalah tumbuhan berkayu yang hidup diantara daratan dan lautan daerah pasang surut, memiliki kondisi tanah yang berlumpur dan hidup di daerah tropis dan subtropis (Basyuni, 2016).
Menurut Jariyah, dkk., (2014) buah mangrove mengandung karbohidrat 15,95%, air 77,10%, lemak 0,87%, abu 3,85%, protein 2,24%, serat, vitamin dan flavonoid yang khasiatnya digunakan sebagai anti kolesterol dan diabetes. Selain itu, kulit buah mangrove mengandung tanin dan flavonoid yang berfungsi sebagai antioksidan yang mampu menstabilkan fraksi lipida dan aktif dalam penghambatan lipoksigenase.
Mineral merupakan salah satu ion logam yang memegang peran penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ maupun fungsi tubuh secara keseluruhan. Disamping itu mineral berperan dalam berbagai tahap metabolisme, terutama sebagai kofaktor dalam aktivitas enzim-enzim (Almatsier, 2004).
Kalium merupakan ion intraseluler dan dikaitkan dengan mekanisme pertukaran dengan natrium, peningkatan asupan kalium berkaitan dengan
penurunan tekanan darah, pemeliharaan keseimbangan cairan elektrolit serta keseimbangan asam basa. Kalium berfungsi sebagai katalisator terutama dalam metabolisme energi dan sintesis glikogen dan protein serta berperan dalam pertumbuhan sel. Kalium terutama berasal dari sayuran, kentang dan kacang- kacangan, sereal dan daging (Almatsier, 2004; Barasi, 2007).
Kalsium merupakan mineral yang paling banyak terdapat di dalam tubuh yaitu 1,5 - 2% dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg yang berperan dalam pembentukan tulang dan gigi. Selain itu, kalsium berperan sebagai pengatur pembekuan darah (Almatsier, 2004; McMurry, dkk., 2007).
Magnesium memegang peranan penting dalam lebih dari tiga ratus jenis sistem enzim di dalam tubuh, bertindak di dalam semua sel jaringan, sebagai katalisator dalam reaksi-reaksi biologik termasuk yang berkaitan dengan metabolisme energi, karbohidrat, lipida, protein dan asam nukleat serta dalam sintesis, degradasi, dan stabilitas bahan gen DNA. Sumber utama magnesium adalah sayuran hijau, serelia tumbuk, biji-bijian dan kacang-kacangan. Normal kadar magnesium dalam tubuh dapat mempertahankan tonus otot polos, berperan penting dalam sintesis protein, pelepasan energi yang disimpan dalam otot, dan regulasi temperatur tubuh (Almatsier, 2004; Barasi, 2007).
Natrium adalah kation utama dalam cairan ekstraseluler seperti cairan saluran cerna, empedu dan pancreas yang terdapat di dalam kerangka tubuh sekitar 35 - 40%. Mineral ini berfungsi menjaga keseimbangan cairan tubuh, dan mengatur sebagian besar tekanan osmosis (Almatsier, 2004).
Ada beberapa faktor yang menyebabkan terjadinya variasi kadar mineral yang signifikan pada hasil penelitian, jika dibandingkan dengan hasil literatur yaitu
faktor genetik yang berbeda, daerah tempat hidup tanaman, faktor pra-panen (fertilitas tanah-termasuk pH dan ketersediaan nutrien, kelembaban tanah, temperatur tumbuh), waktu penyerbukan, irigasi, usia tanaman (buah), metode pengukuran kadar mineral sampel, dan bagian tanaman yang dianalisa (Florkowski, dkk., 2009).
Metode spektrofotometri serapan atom adalah instrumen yang digunakan untuk analisis kuantitatif dengan pelaksanaan yang relatif cepat, sederhana, dan memiliki kepekaan yang sangat tinggi dengan batas deteksi kurang dari 1 ppm sehingga dapat mendeteksi unsur-unsur mineral dalam jumlah kecil hingga sangat kecil (Gandjar dan Rohman, 2009).
Menurut Hoe dan Siong, (1999), dalam 100 gram sampel buah mangrove mengandung kalium 306 mg, kalsium 42 mg, magnesium 27 mg, fosfor 56 mg, besi 0,9 mg, mangan 24 ppm, cupri 3,1 ppm, dan zink 8,7 ppm. Berdasarkan uraian di atas, penulis tertarik meneliti kandungan kalium, kalsium, magnesium, dan natrium yang terdapat dalam buah mangrove segar. Pemeriksaan logam tersebut dapat menggunakan beberapa metode antara lain gravimetri, titrimetri, namun metode yang dipilih adalah metode spektrofotometri serapan atom karena mempunyai kepekaan yang tinggi dengan batas deteksi kurang dari 1 ppm (Gandjar dan Rohman, 2009).
1.2 Perumusan Masalah
Perumusan masalahan dalam penelitian ini yaitu berapa kadar mineral kalium, kalsium, magnesium, dan natrium pada buah mangrove (Sonneratia caseolaris) yang diperoleh dari Desa Sai Nagalawan, Kecamatan Perbaungan, Kabupaten Serdang Bedagai Sumatera Utara?
1.2 Hipotesis
Hipotesis dalam penelitian ini yaitu:
Buah mangrove (Sonneratia caseolaris) dari Desa Sai Nagalawan, Kecamatan Perbaungan, Kabupaten Serdang Bedagai Sumatera Utara mengandung mineral kalium, kalsium, magnesium, dan natrium dalam jumlah tertentu.
1.2 Tujuan Penelitian
Adapun tujuan dilakukannya penelitian ini yaitu:
Untuk mengetahui kadar mineral kalium, kalsium, magnesium dan natrium pada buah mangrove (Sonneratia caseolaris).
1.2 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi dan pengetahuan tentang kadar mineral kalium, kalsium, magnesium dan natrium yang terkandung pada buah mangrove serta manfaatnya sehingga dapat dikembangkan sebagai produk makanan dan minuman olahan serta produk lain yang berkaitan dengan bidang kefarmasian.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Sistematika Tumbuhan
Menurut Nurwati (2011), sistematika tumbuhan buah mangrove adalah sebagai berikut:
Kingdom : Plantae
Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Myrtales Famili : Lythraceae Genus : Sonneratia
Spesies : Sonneratia caseolaris L.
2.1.2 Nama Daerah
Ada beberapa sebutan nama untuk tumbuhan buah mangrove di beberapa daerah, antara lain: Barembang (Sumatera), Perpat merah, Rambai (Banjarmasin), Bogem (Sunda), Betah, Bidada (Jawa), Bughem, Boghem (Madura), Posi-posi merah (Ternate), dan Wahat merah (Ambon dan Sulawesi) (Kusmana, dkk., 2013).
2.1.3 Sinonim
Aubletia caseolaris Gaertn, Blatti acide Lamk, Blatti caseolaris O.K, B.
Pagatpat Niedenzu, Mangium caseolarerubrum Rumph, Rhizophora caseolaris L, Sonneratia acida Linne, S. Evenia Bl, S. Lanceolata Bl, S. Neglecta Bl, S. Obovata Bl, S. Ovalis Korth, S. Pagatpat Blanco, S. Rubra. (Kusmana, dkk., 2013).
2.1.4 Morfologi Tumbuhan
Tumbuhan Soneratia caseolaris memiliki beberapa ciri morfologis dengan tinggi pohon mencapai 15 meter, memiliki akar nafas berbentuk kerucut hingga mencapai 1 meter yang banyak dan kuat. Tipe daun tanaman ini memiliki susunan tunggal, bersilangan, ujungnya membundar dengan ukuran panjang 4-8 cm dan tipe biji normal. Bunga dewasa memiliki tangkai daun pendek dengan dasar berwarna kemerah-merahan, benang sari berwarna merah dan putih,dan kelopak bunga terdiri dari 6-8 helai. Bunga terbuka menjelang malam hari dan berlangsung sepanjang malam, mengandung banyak madu pada pembuluh kelopak. Buah mangrove memiliki ukuran diameter 6-8 cm dengan warna hijau kekuning-kuningan, dan permukaannya mengkilap (Kusmana, dkk., 2013).
2.1.5 Tempat Tumbuh
Sonneratia caseolaris tumbuh ditepi muara sungai terutama pada daerah dengan salinitas rendah dengan campuran air tawar. Seringkali tanaman ini dapat dijumpai sampai jauh di pedalaman, terutama pinggiran sungai-sungai besar, misalnya Sungai Kapuas, Sungai Barito, Sungai Mahakam, Sungai Siak, Sungai Musi dan sebagainya. Bahkan tanaman ini mampu tumbuh dan berkembang pada lingkungan tawar (Nurwati, 2011).
2.1.6 Kandungan Kimia
Buah mangrove mengandung kabohidrat 15,95%, air 77,10%, lemak 0,87%, abu 3,85%, protein 2,24%, serat, vitamin dan flavonoid yang biasanya digunakan sebagai anti kolesterol dan diabetes. Selain itu, kulit buah mangrove mengandung tanin dan flavonoid yang berfungsi sebagai antioksidan yang mampu menstabilkan fraksi lipida dan aktif dalam penghambatan lipoksigenase (Jariyah, dkk., 2014).
Menurut Hoe dan Siong, (1999), dalam 100 gram sampel buah mangrove mengandung kalium 306 mg, kalsium 42 mg, magnesium 27 mg, fosfor 56 mg, besi 0,9 mg, mangan 24 ppm, cupri 3,1 ppm, zink 8,7 ppm, dan vitamin C 0,6 mg.
2.2 Mineral
Mineral merupakan bagian dari tubuh dan memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ maupun fungsi tubuh secara keseluruhan, juga berperan dalam berbagai tahap metabolisme, terutama sebagai kofaktor dalam aktivitas enzim-enzim, serta menjaga keseimbangan ion-ion tubuh (Almatsier, 2004).
Mineral digolongkan dalam mineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh lebih dari 100 mg sehari seperti natrium, kalium, kalsium, magnesium dan fosfor. Mineral mikro adalah mineral yang dibutuhkan tubuh kurang dari 100 mg sehari seperti tembaga, mangan, besi, zink dan iodium (Almatsier, 2004).
Menurut Budiyanto (2001), mineral dalam tubuh memiliki tiga fungsi yaitu:
a. sebagai konstituen tulang dan gigi, yang memberikan kekuatan kepada jaringan tersebut misalnya besi, posfor dan magnesium
b. mineral membentuk garam-garam yang dapat larut, sehingga dapat mengendalikan komposisi cairan tubuh. Natrium dan klorida merupakan unsur penting dalam cairan ekstraseluler dan darah sedangkan besi, magnesium dan posfor merupakan unsur penting dalam cairan intraseluler.
c. mineral sebagai penunjang yang turut membangun enzim dan protein yang merupakan bagian dari asam amino misalnya cistin.
2.2.1 Kalium
Kalium merupakan ion bermuatan positif yang terdapat didalam sel.
Sebanyak 95% kalium berada di dalam cairanintraseluler (Almatsier, 2004).
Peranan kalium mirip dengan natrium, yaitu bersama–sama dengan klorida membantu menjaga tekanan osmotis dan keseimbangan asam basa. Bedanya, kalium menjaga tekanan osmotik dalam cairan (Winarno, 1991).
Kalium merupakan ion intraseluler yang sangat esensial untuk mengatur keseimbangan asam basa. Selain itu kalium juga mengaktivasi banyak reaksi enzim dan proses fisiologi, seperti transmisi impuls di saraf dan otot, kontraksi otot dan metabolisme karbohidrat. Kalium banyak terdapat dalam sayuran, kentang, dan kacang-kacangan, sedangkan dalam jumlah sedang kalium terdapat dalam serealia dan daging (Barasi, 2007).
2.2.2. Kalsium
Peranan kalsium dalam tubuh pada umumnya dibagi menjadi dua, yaitu membantu dalam pembentukan tulang dan gigi serta proses biologis dalam tubuh.
Keperluan kalsium terbesar dibutuhkan pada proses pertumbuhan, tetapi juga tetap dibutuhkan meskipun sudah mencapai usia dewasa. Pada proses pembentukan tulang, apabila tulang baru dibentuk, maka tulang yang tua dihancurkan secara simultan. Kalsium yang berada dalam sirkulasi darah dan jaringan tubuh berperanan dalam berbagai kegiatan, diantaranya untuk transmisi impuls syaraf, kontraksi otot, penggumpalan darah, pengaturan permeabilitas membran sel serta keaktifan enzim (Winarno, 1991).
2.2.3 Magnesium
Magnesium adalah kation nomor dua paling banyak setelah natrium di dalam cairan interselular. Magnesium di dalam alam merupakan bagian dari klorofil daun.
Peranan magnesium dalam tumbuhan sama dengan peranan zat besi dalam ikatan hemoglobin di dalam darah pada manusia. Magnesium terlibat dalam berbagai proses metabolisme. Magnesium yang banyak terdapat di dalam tulang merupakan cadangan yang siap dikeluarkan apabila bagian lain dari tubuh membutuhkan.
Magnesium mencegah kerusakan gigi dengan cara menahan kalsium di dalam email gigi (Altmatsier, 2004).
Menurut Budiyanto (2001), fungsi dari magnesium adalah sebagai berikut:
a. sebagai aktifator enzim peptidase dan enzim lain yang memecah gugus posfat b. sebagai obat pencuci perut (Laksativa)
c. meningkatkan tekanan osmotik d. membantu mengurangi getaran otot
Kecukupan magnesium rata-rata sehari untuk orang dewasa laki-laki adalah 280 mg/hari dan untuk wanita dewasa 250 mg/hari. Sumber utama magnesium adalah sayuran hijau, serelia tumbuk, biji-bijian, kacang-kacangan, daging, susu dan cokelat yang merupakan sumber magnesium yang baik (Altmatsier, 2004).
2.2.4 Natrium
Natrium adalah kation utama dalam cairan ekstraseluler 35-40% dan terdapat didalam kerangka tubuh. Cairan saluran cerna, sama seperti cairan empedu dan pankreas, mengandung banyak natrium. Sebagai kation utama dalam cairan ekstraselular, natrium menjaga keseimbangan cairan. Bila jumlah natrium di dalam sel meningkat secara berlebihan, air akan masuk ke dalam sel, akibatnya sel akan membengkak. Hal inilah yang menyebabkan terjadinya pembengkakan dalam
jaringan tubuh. Keseimbangan juga akan terganggu bila seseorang kehilangan natrium. Natrium menjaga keseimbangan asam basa di dalam tubuh dengan mengimbangi zat-zat yang membentuk asam. Natrium berperan dalam transmisi saraf dan kontraksi otot. Natrium berperan pula dalam absorpsi glukosa dan sebagai alat angkut zat-zat gizi lain melalui membran, terutama melalui usus sebagai pompa natrium (Almatsier, 2004).
Kekurangan Natrium menyebabkan kejang, apatis, dan kehilangan nafsu makan muntah, diare, keringat berlebihan, dan saat menjalankan diet natrium. Bila kadar natrium darah turun, perlu diberikan natrium dan air untuk mengembalikan keseimbangan. Kelebihan natrium dapat menimbulkan keracunan yang dalam keadaan akut menyebabkan edema dan hipertensi. Hal ini dapat diatasi dengan banyak minum (Almatsier, 2004).
2.3 Destruksi
Destruksi merupakan suatu perlakuan pemecahan senyawa menjadi unsur- unsurnya sehingga dapat dianalisis. Istilah destruksi ini disebut juga perombakan, yaitu dari bentuk organik logam menjadi bentuk logam-logam anorganik. Pada dasarnya ada dua jenis destruksi yang dikenal dalam ilmu kimia yaitu destruksi basah dan destruksi kering. Kedua destruksi ini memiliki teknik pengerjaan dan lama pemanasan atau pendestruksian yang berbeda (Kristianingrum, 2012).
2.3.1 Destruksi Basah
Destruksi basah adalah perombakan sampel dengan asam-asam kuat baik tunggal maupun campuran, kemudian dioksidasi dengan menggunakan zat oksidator.
Pelarut-pelarut yang dapat digunakan untuk destruksi basah antara lain
asam nitrat, asam sulfat, asam perklorat, dan asam klorida. Semua pelarut tersebut dapat digunakan baik tunggal maupun campuran. Kesempurnaan destruksi ditandai dengan diperolehnya larutan jernih pada larutan destruksi, yang menunjukkan bahwa semua konstituen yang ada telah larut sempurna atau perombakan senyawa- senyawa organik telah berjalan dengan baik. Senyawa-senyawa garam yang terbentuk setelah destruksi merupakan senyawa garam yang stabil dan disimpan selama beberapa hari (Kristianingrum, 2012).
2.3.2 Destruksi Kering
Destruksi kering merupakan perombakan organik logam di dalam sampel menjadi logam-logam anorganik dengan jalan pengabuan sampel dalam muffle furnace dan memerlukan suhu pemanasan tertentu. Pada umumnya dalam destruksi kering ini dibutuhkan suhu pemanasan antara 400-8000C, tetapi suhu ini sangat tergantung pada jenis sampel yang akan dianalisis. Untuk menentukan suhu pengabuan dengan sistem ini terlebih dahulu ditinjau jenis logam yang akan dianalisis. Bila oksida-oksida logam yang terbentuk bersifat kurang stabil, maka perlakuan ini tidak memberikan hasil yang baik. Oksida-oksida ini kemudian dilarutkan ke dalam pelarut asam encer baik tunggal maupun campuran, setelah itu dianalisis menurut metode yang digunakan (Kristianingrum, 2012).
Ada beberapa faktor yang harus diperhatikan dalam hal menggunakan metode destruksi terhadap sampel, apakah dengan destruksi basah atau kah kering, antara lain:
a. sifat matriks dan konstituen yang terkandung di dalamnya b. jenis logam yang akan dianalisis
c. metode yang akan digunakan untuk penentuan kadarnya
Selain hal-hal di atas, untuk memilih prosedur yang tepat perlu diperhatikan beberapa faktor antara lain: waktu yang diperlukan untuk analisis, biaya yang diperlukan, ketersediaan bahan kimia, dan sensitivitas metode yang digunakan (Kristianingrum, 2012).
2.4 Spektrofotometri Serapan Atom
Peristiwa serapan atom pertama kali diamati oleh Fraunhofer ketik mengamati garis-garis hitam pada spektrum matahari sedangkan yang memanfaatkan prinsip serapan atom pada bidang analisis oleh seseorang yang berasal dari Australia bernama Alan Walsh pada tahun 1955. Sebelumnya ahli kimia banyak tergantung pada cara-cara spektofotometrik atau metode analisis spektrografik. Beberapa cara ini yang sulit dan memakan waktu, kemudian segera digantikan dengan spektoskopi serapan atom atau atomic absorption spectroscopy (AAS) (Gandjar dan Rohman, 2009).
Spektrofotometri serapan atom adalah suatu metode analisis kuantitatif yang digunakan untuk mendeteksi atom-atom logam dalam fase gas. Cara analisis metodenya dengan memberikan kadar total unsur logam dalam suatu sampel dan tidak tergantung pada bentuk molekul dari logam dalam sampel tersebut. Metode ini mengandalkan nyala untuk mengubah logam dalam larutan sampel menjadi atom-atom logam berbentuk gas (Gandjar dan Rohman, 2009).
Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar oleh atom-atom netral dan sinar yang diserap biasanya sinar tampak atau sinar ultraviolet. Dalam garis besarnya prinsip spektroskopi serapan atom sama saja dengan spektrofotometri sinar tampak dan ultraviolet perbedaannya terletak pada
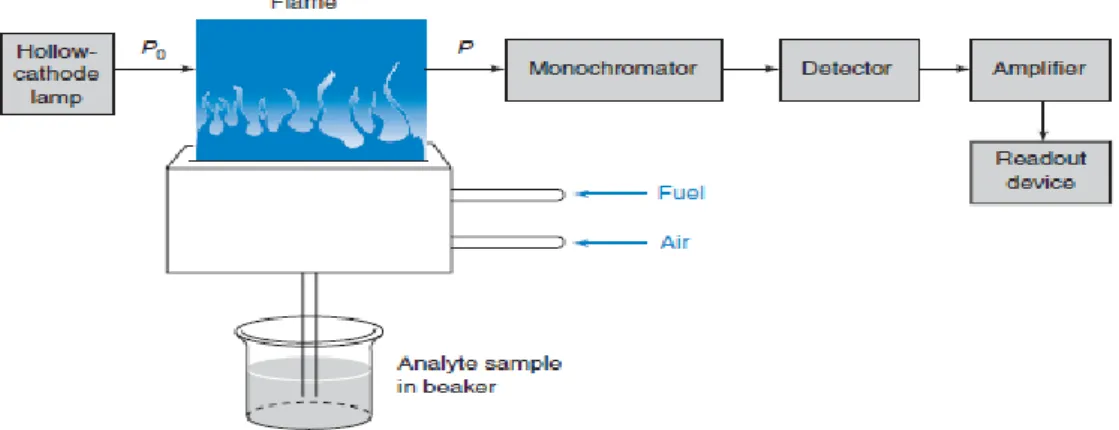
bentuk spektrum, cara pengerjaan sampel dan peralatannya. Metode ini mempunyai kepekaan yang tinggi dengan batas deteksi kurang dari 1 ppm, pelaksanaannya relatif sederhana, tidak perlu adanya pemisahan dan interferensinya sedikit (Gandjar dan Rohman, 2009). Sistem Peralatan Spektrofotometer Serapan Atom dapat dilihat pada Gambar 2.1.
Gambar 2.1 Sistem Peralatan Spektrofotometer Serapan Atom (Harris, 2007) Menurut Gandjar dan Rohman (2009), bagian instrumentasi spektrofotometer serapan atom adalah sebagai berikut ini:
a. Sumber Sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (Hollow cathode lamp) yang mampu menghasilkan garis radiasi resonansi sangat tajam.
Lampu ini tediri atas anoda dan katoda dalam suatu tabung silinder yang berisi gas mulia neon dan argon pada tekanan rendah. Katoda tersebut berbentuk silinder berongga yang permukaannya dilapisi dengan unsur yang sama dengan unsur yang dianalisis
b. Tempat Sampel
Analisis dengan spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral. Ada berbagai macam alat yang dapat
digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu dengan nyala (flame) dan tanpa nyala (flameless)
Nyala berfungsi untuk mengeksitasikan atom dari tingkat dasar ke tingkat yang lebih tinggi. Teknik atomisasi dengan nyala bergantung pada suhu yang dapat dicapai oleh gas-gas yang digunakan. Sumber nyala yang paling banyak digunakan adalah campuran asetilen sebagai bahan pembakar dan udara sebagai pengoksidasi
Teknik atomisasi tanpa nyala dapat dilakukan dengan meletakkan sejumlah sampel didalam tungku dari grafit kemudian dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik pada tabung grafit. Akibat pemanasan ini, zat yang akan dianalisis akan berubah menjadi atom-atom netral dan dilewatkan suatu sinar yang berasal dari lampu katoda berongga sehingga terjadi proses penyerapan energi
c. Monokromator
Monokromator berfungsi untuk memisahkan dan memilih panjang gelombang yang digunakan untuk analisis, didalamnya terdapat suatu alat yang digunakan untuk memisahkan panjang gelombang yang disebut dengan chopper d. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman. Biasanya digunakan tabung penggandaan foton (photomultiplier tube) (Gandjar dan Rohman, 2009).
e. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai pencatat hasil. Hasil pembacaan dapat berupa angka atau berupa kurva yang menggambarkan absorbansi atau intensitas emisi (Gandjar dan Rohman, 2009).
2.5 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis menurut Harmita (2004) adalah sebagai berikut:
a. kecermatan (accuracy)
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan ditentukan dengan dua cara, yaitu:
metode simulasi
Metode simulasi (spiked-placebo recovery) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit bahan murni ke dalam suatu bahan pembawa sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya).
metode penambahan baku
Metode penambahan baku (standard addition method) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode yang akan divalidasi. Hasilnya dibandingkan dengan sampel yang dianalisis tanpa penambahan sejumlah analit. Persen perolehan kembali ditentukan dengan menentukan berapa persen analit yang ditambahkan ke dalam sampel dapat
ditemukan kembali. Rentang persen perolehan kembali yang diizinkan pada setiap konsentrasi analit pada matriks dapat dilihat pada Tabel 2.1.
Tabel 2.1 Rentang persen perolehan kembali yang diizinkan pada analit sampel Jumlah analit pada sampel Persen perolehan kembali yang diizinkan (%)
1 ppm 80-110
100 ppb 80-110
10 ppb 60-115
1 ppb 40-120
b. keseksamaan (precision)
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan.
Dari penelitian yang telah dilakukan, ditemukan bahwa simpangan baku relatif atau RSD meningkat seiring dengan menurunnya kadar analit yang dianalisis.
c. selektivitas (spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuan suatu metode mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel (Harmita, 2004).
d. batas deteksi dan batas kuantitasi
Batas deteksi Limit Of Detection (LOD) adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan, sedangkan batas kuantitasi Limit Of Quantitation (LOQ) adalah kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.
BAB III
METODE PENELITIAN
Jenis penelitian yang dilakukan merupakan penelitian deskriptif yang bertujuan memberikan gambaran sifat dari suatu keadaan secara sistematis, yaitu untuk memeriksa kandungan mineral kalium, kalsium, magnesium dan natrium pada buah mangrove (Sonneratai caseolaris ).
3.1 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan Februari – Mei 2016.
3.2 Bahan-bahan 3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah buah dari tanaman mangrove (Sonneratai caseolaris) yang diambil di Desa Sei Nagalawan, Kecamatan Perbaungan, Kabupaten Serdang Berdagai Sumatera Utara.
3.2.2 Pereaksi
Semua bahan-bahan yang digunakan dalam penelitian ini berkualitas pro analisa keluaran E. Merck yaitu asam nitrat 65% v/v, larutan standar kalium konsentrasi 1000 μg/ml, larutan standar kalsium konsentrasi 1000 μg/ml, larutan standar magnesium konsentrasi 1000 μg/ml, dan larutan standar natrium konsentrasi 1000 μg/ml, kecuali disebutkan lain yaitu akuademineralisata (Laboratorium Penelitian Farmasi USU).
3.3 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometer Serapan Atom (Hitachi Z-2000) lengkap dengan lampu katoda kalium, kalsium, magnesium, dan natrium, alat tanur (BIBBY Stuart), alat pengolah akuademineralisata (Purelab UHQ ELG), hot plate, neraca analitik (BOECO Germany), neraca kasar, kertas saring Whatman no. 42, krus porselen dan alat-alat gelas (Pyrex dan OBEROI).
3.4 Identifikasi Sampel
Identifikasi tumbuhan dilakukan oleh Herbarium Bogoriense, Bidang Botani, Pusat penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, Jalan Raya Jakarta-Bogor Km. 46, Cibinong.
3.5 Pembuatan Pereaksi
3.5.1 Larutan Asam Nitrat dengan akuademineralisata (1:1)
Sebanyak 500 ml larutan asam nitrat65% v/v diencerkan dengan 500 ml akuademineralisata (Isaac, 1990).
3.6 Prosedur Penelitian
3.6.1 Metode Pengambilan Sampel
Metode pengambilan sampel dilakukan dengan cara sampling purposif yang dikenal juga sebagai sampling pertimbangan dimana sampel ditentukan atas pertimbangan bahwa populasi sampel adalah homogen dan sampel yang tidak diambil mempunyai karakteristik yang sama dengan sampel yang sedang diteliti (Sudjana, 2005).
3.6.2 Penyiapan Sampel
Buah mangrove sebanyak 500 g dibersihkan dari pengotornya, dicuci bersih dengan akuademineralisata lalu ditiriskan hingga kering, dipotong, lalu dihaluskan dengan blender.
3.6.3 Proses Destruksi
Sampel yang telah dihaluskan ditimbang sebanyak 25 g didalam krus porselen, diarangkan di atas hot plate, lalu diabukan di tanur dengan temperatur awal 100oC dan perlahan-lahan temperatur dinaikkan menjadi 500oC dengan interval 25oC setiap 5 menit. Pengabuan dilakukan selama 48 jam (dihitung saat suhu sudah 500℃), lalu setelah suhu tanur ±27 ℃ krus porselen dikeluarkan. Abu yang diperoleh ditambahkan 5 ml HNO
3 (1:1) secara hati-hati. Kemudian kelebihan HNO3 diuapkan pada hot plate dengan suhu 100-120oC sampai kering. Krus porselen dimasukkan kembali ke dalam tanur dengan temperatur awal 100℃ dan perlahan – lahan temperatur dinaikkan hingga suhu 500℃ dengan interval 25℃ setiap 5 menit.
Pengabuan dilakukan selama 1 jam (Isaac, 1990). Bagan alir proses destruksi kering buah mangruve dapat dilihat pada Lampiran 3 halaman 40.
3.6.4 Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 5 ml HNO3 (1:1) hingga diperoleh larutan bening. Kemudian dimasukkan kedalam labu tentukur 50 ml dan krus porselen dibilas dengan akuademineralisata sebanyak 3 kali. Hasil pembilasan dimasukkan kedalam labu tentukur. Setelah itu dicukupkan volumenya dengan akuademineralisata hingga garis tanda. Lalu disaring dengan kertas saring Whatman No.42 dengan membuang ± 5 ml larutan pertama hasil penyaringan untuk menjenuhkan kertas saring dan selanjutnya ditampung ke dalam botol (Isaac, 1990).
Larutan ini digunakan untuk uji kuantitatif kalium, kalsium, magnesium, dan natrium (Bagan alir pembuatan larutan sampel dapat dilihat pada Lampiran 4 halaman 41).
3.6.5 Pembuatan Kurva Kalibrasi 3.6.5.1 Kalium
Larutan baku kalium (konsentrasi 1000 µg/ml) dipipet sebanyak 1 ml, dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 10 µg/ml).
Larutan untuk kurva kalibrasi kaliumdibuat dengan memipet (0,5 ml; 1 ml;
1,5 ml; 2 ml dan 2,5 ml) dari larutan baku 10 µg/ml, masing-masing dimasukkan ke dalam labu 25 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (larutan ini mengandung konsentrasi 0,2 µg/ml; 0,4 µg/ml; 0,6 µg/ml; 0,8 µg/ml;
dan 1 µg/ml) dandiukur pada panjang gelombang 766,5 nm dengan tipe nyala udara-asetilen.
3.6.5.2 Kalsium
Larutan baku kalsium (konsentrasi 1000 µg/ml) dipipet sebanyak 1 ml, dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 10 µg/ml).
Larutan untuk kurva kalibrasi kalsium dibuat dengan memipet (2,5 ml, 5 ml, 7,5 ml, 10 ml, dan 12,5 ml) dari larutan baku 10 µg/ml, masing-masing dimasukkan ke dalam labu 25 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (larutan ini mengandung konsentrasi 1 µg/ml; 2 µg/ml; 3 µg/ml; 4 µg/ml; dan 5 µg/ml) dandiukur pada panjang gelombang 422,7 nm dengan tipe nyala udara- asetilen.
3.6.5.3 Magnesium
Larutan baku magnesium (konsentrasi 1000 µg/ml) dipipet sebanyak 1 ml, dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 10 µg/ml).
Larutan untuk kurva kalibrasi magnesium dibuat dengan memipet (2,5 ml;
5 ml; 7,5 ml; 10 ml; dan 12,5 ml) dari larutan baku 10 µg/ml, masing-masing dimasukkan ke dalam labu 25 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (larutan ini mengandung konsentrasi 1 µg/ml; 2 µg/ml; 3 µg/ml;
4 µg/ml dan 5 µg/ml) dan diukur pada panjang gelombang 285,2 nm dengan tipe nyala udara-asetilen. Kurva kalibrasi diperoleh karena adanya hubungan antara konsentrasi dan absorbansi, sehingga dapat dihitung persamaan regresi dan koefisien korelasi.
3.6.5.4 Natrium
Larutan baku natrium (konsentrasi 1000 µg/ml) dipipet sebanyak 1 ml, dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 10 µg/ml).
Larutan untuk kurva kalibrasi natrium dibuat dengan memipet (0,5 ml; 1,0 ml; 1,5 ml; 2,0 ml dan 2,5 ml) dari larutan baku 10 µg/ml, masing-masing dimasukkan ke dalam labu 25 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (Larutan ini mengandung konsentasi 0,2 µg/ml; 0,4 µg/ml; 0,6 µg/ml; 0,8 µg/ml; 1,0 µg/ml) dandiukur pada panjang gelombang 589,0 nm dengan tipe nyala udara-asetilen. Kurva kalibrasi diperoleh karena adanya hubungan antara konsentrasi dan absorbansi, sehingga dapat dihitung persamaan regresi dan koefisien korelasi.
3.6.6 Penetapan Kadar Kalium, Kalsium, Magnesiumdan Natrium dalam Sampel
Sebelum dilakukan penetapan kadar mineral kalium,kalsium, magnesium dan natrium dalam sampel, terlebih dahulu instrumen yaitu spektrofotometer serapan atom dan perangkat lainnya dikondisikan dan diatur metodenya sesuai dengan mineral yang diperiksa.
3.6.6.1 Penetapan Kadar Kalium Sampel
Larutan sampel hasil destruksi dipipet sebanyak 0,25 ml dimasukkan kedalam labu tentukur 100 ml dan di cukupkan dengan akuademineralisata hingga garis tanda dengan faktor pengenceran 400 kali. Diukurabsorbansinya dengan spektrofotometer serapan atom pada panjang gelombang 766,5 nm dengan nyala udara-asetilen. Nilai bsorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalium. Konsentrasi kalium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.6.6.2 Penetapan Kadar Kalsium Sampel
Larutan sampel hasil destruksi dipipet sebanyak 0,25 ml dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan dengan akuademineralisata hingga garis tanda dengan faktor pengenceran 100 kali. Diukur absorbansinya dengan spektrofotometer serapan atom pada panjang gelombang 422,7 nm dengan nyala udara-asetilen. Nilai absorbansinya yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium. Konsentrasi kalsium dalam sampel ditentukan berdasarkan persamaan regresi dari kurva kalibrasi.
3.6.6.3 Penetapan Kadar Magnesium Sampel
Larutan sampel hasil destruksi dipipet sebanyak 0,2 ml dimasukkan kedalam labu tentukur 25 ml dan di cukupkan dengan akuademineralisata hingga
garis tanda dengan faktor pengenceran 125 kali. Diukur absorbansinya dengan spektrofotometer serapan atom pada panjang gelombang 285,2 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus beradadalam rentang kurva kalibrasi larutan baku magnesium. Konsentrasi magnesium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.6.6.4 Penetapan Kadar Natrium Sampel
Larutan sampel hasil destruksi dipipet sebanyak 0,25 ml dimasukkan ke dalam labu tentukur 100 ml dan di cukupkan dengan akuademineralisata hingga garis tanda dengan faktor pengenceran 400 kali. Diukur absorbansinya dengan spektrofotometer serapan atom pada panjang gelombang 589,0 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku natrium. Konsentrasi natrium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.6.6.5 Perhitungan Kadar Kalium, Kalsium, Magnesium, dan Natrium dalam Sampel
Menurut Harmita (2004), kadar kalium, kalsium, magnesium, dan natrium dapat dihitung dengan mensubstitusikan absorbansi ke dalam persamaan regresi yang diperoleh dari kurva kalibrasi. Kadar kalium, kalsium, magnesium dan natrium dalam sampel dapat dihitung dengan persamaan berikut ini:
Kadar (µg/g) =Konsentrasi (µg ⁄ ml) × Volume(ml) × Faktor Pengenceran Berat Sampel (g)
3.7 Analisis Data Secara Statistik
3.7.1 Penerimaan dan Penolakan Hasil Pengamatan
Kadar kalium, kalsium, magnesium, dan natrium yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis dengan menggunakan
SD = √∑(Xi− X̅i)² n − 1
parameter standar deviasi. Kemudian dilakukan uji-t satu arah (one-tailed t-test) arah pada interval kepercayaan 99% untuk mengamati bias (perbedaan) hasil kadar sampel penelitian secara analitik pada metode yang digunakan.
Menurut Harmita (2004) simpangan baku dapat dihitung dengan rumus berikut ini:
Keterangan : Xi = Kadar sampel
X̅i = Kadar rata-rata sampel N = Jumlah perulangan
Menurut Sudjana (2005) nilai thitung dapat dicari dengan menggunakan rumus:
Untuk mencari thitung digunakan rumus:
Sedangkan untuk menentukan kadar mineral di dalam sampel dengan interval kepercayaan 99%, α = 0.01, dk = n-1, dapat digunakan rumus :
Keterangan: X̅i = kadar rata-rata sampel SD = standar Deviasi
dk = derajat Kebebasan (dk = n-1) α = interval Kepercayaan
n = jumlah Perulangan.
3.8 Validasi Metode
3.8.1 Penentuan Batas Deteksi dan Batas Kuantitasi
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi
thitung =|Xi− X̅i| SD/√n
Kadar mineral: µ = X̅i± (t(α
2, dk)×SD
√n)
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.
Menurut Harmita (2004) batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus:
3.8.2 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali ditetapkan pada larutan tertentu yang sesuai (larutan blanko atau larutan matriks) dimana analit yang ditambahkan telah diketahui jumlahnya (konsentrasi pertengahan rentang validasi. Dalam metode ini, kadar mineral dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan kadar mineral dalam sampel setelah penambahan larutan standar dengan konsentrasi tertentu (Ermer dan McB. Miller, 2005).
Metode adisi dilakukan bila tidak memungkinkan membuat sampel plasebo karena matriks sampel yang dianalisa tidak diketahui. Pengerjaan metode adisi dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dilakukan analisis pada sampel tersebut (Harmita, 2004)
Larutan baku yang ditambahkan 2 ml larutan standar kalium (konsentrasi 1000 µg/ml), 1 ml larutan standar kalsium (konsentrasi 1000 µg/ml), 1 ml larutan standar magnesium (konsentrasi 1000 µg/ml) dan 2 ml larutan standar natrium (konsentrasi 1000 µg/ml).
Simpangan Baku = √∑(Y̅ − Yi)² n − 2 Batas Deteksi (LOD) =3 × SB
Slope Batas Kuantitasi (LOQ) =10 × SB
Slope
RSD =SD
X̅i × 100%
Buah mangrove yang telah diiris ditimbang secara seksama sebanyak 10 gram, kemudian dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya. Setelah itu ditambahkan larutan standar kalium. Langkah kerja yang sama diilakukan untuk uji perolehan kembalikalium, kalsium, magnesium dan natrium dengan penambahan larutan baku masing-masing.
Menurut Harmita (2004) persen perolehan kembali dapat dihitung dengan rumus di bawah ini berikut ini:
CA = kadar logam dalam sampel sebelum penambahan baku (mg/100g) CF = kadar logam dalam sampel setelah penambahan baku (mg/100g) C*A = kadar larutan baku yang ditambahkan (mg/100g)
3.8.3 Uji Keseksamaan (Precision)
Menurut Harmita (2004), keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang beragam. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan. Adapun rumus untuk menghitung simpangan baku relatif sebagai berikut:
Keterangan: X̅i = kadar rata-rata sampel SD = standar Deviasi
RSD = relative standard deviation (simpangan baku relatif) Persen Perolehan Kembali = 𝐶𝐹 − 𝐶𝐴
𝐶𝐴∗
𝑥 100 %
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh Herbarium Bogoriense, Bidang Botani, Pusat Penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bogor, JalanRaya Jakarta–Bogor Km. 46, Cibinong. Disebutkan bahwa tumbuhan yang digunakan adalah buah mangrove (Sonneratai caseolaris L.) suku Lythraceae. Surat hasil identifikasi tumbuhan dapat dilihat pada Lampiran 2 halaman 39.
4.2 Kurva Kalibrasi Kalium,Kalsium, Magnesium dan Natrium
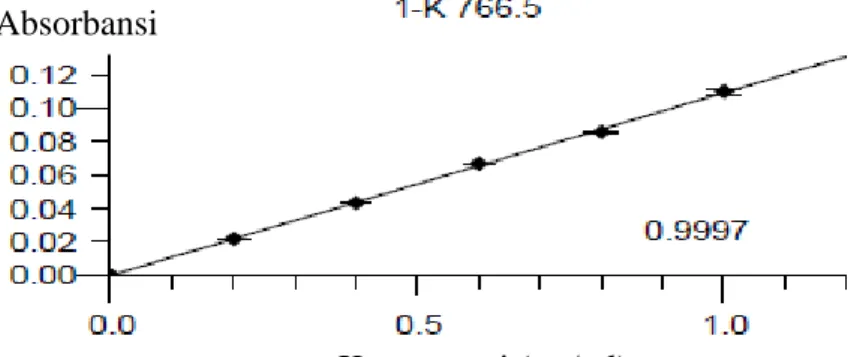
Kurva kalibrasi kalium, kalsium, magnesium dan natrium diperoleh dengan mengukur larutan standar kalium,kalsium, magnesium dan natrium pada panjang gelombang masing-masing. Kurva kalibrasi kalium, kalsium, magnesium dan natrium dapat dilihat pada Gambar 4.1; 4.2; 4.3 dan 4.4 dibawah ini. Hasil pengukuran absorbansi danperhitungan persamaan regresi larutan standar dapat dilihat pada Lampiran 5 halaman 42 sampai Lampiran 8 halaman 48.
Gambar 4.1. Kurva Kalibrasi Larutan Standar Kalium Konsentrasi (µg/ml)
Absorbansi
Menurut Ermer dan McB. Miller (2005), nilai koefisien korelasi (r) harus sama atau lebih besar dari 0,97 untuk menunjukkan adanya korelasi linier yang menyatakan adanya hubungan antara konsentrasi dan absorbansi. Nilai koefesien korelasi digunakan untuk mengukur kekuatan dan arah hubungan linier antara dua variabel dalam hal ini konsentrasi dan absorbansi larutan standar kalium, kalsium, magnesium dan natrium. Nilai r berada pada rentang -1 < r < +1. Korelasi positif menunjukkan terdapat hubungan antar variabel yang searah, dimana jika nilai satu variabel dinaikkan maka nilai variabel yang lain juga meningkat. Sebaliknya, jika r bernilai negatif menunjukkan adanya korelasi negatif. Dimana hubungan antar variabel saling berkebalikan. Jika nilai suatu variabel dinaikkan, maka nilai variabel yang lain akan turun.
Dari kurva kalibrasi kalium diatas, diperoleh persamaan regresi standar kalium sebagai berikut Y =0,10936 X – 0,000029 dengan nilai koefisien korelasi kalium (r)=0,9997. Terdapat hubungan positif yang sangat kuat antara konsentrasi standar kalium terhadap absorbansinya. Dari persamaan regresi di atas diperoleh nilai slope (kemiringan) garis regresi sebesar 0,10936.
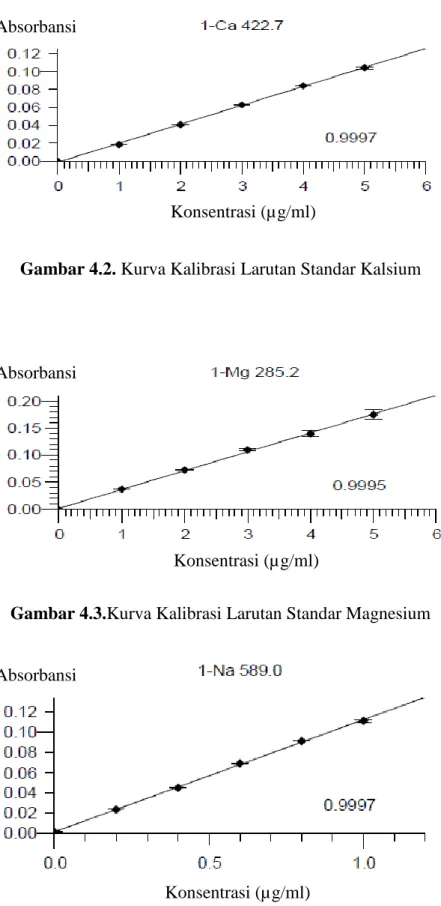
Gambar 4.2 dibawah ini merupakan kurva kalibrasi larutan standar kalsium dengan persamaan regresi Y= 0,02118 X – 0,0013 dan nilai r = 0,9997. Nilai koefisien korelasi dari kalibrasi magnesium tersebut menunjukkan terdapat hubungan searah yang sangat kuat antara variabel konsentrasi terhadap absorbansi larutan. Sedangkan nilai slope garis regresi sebesar 0,02118.
Gambar 4.2. Kurva Kalibrasi Larutan Standar Kalsium
Gambar 4.3.Kurva Kalibrasi Larutan Standar Magnesium
Gambar 4.4. Kurva Kalibrasi Larutan Standar Natrium Konsentrasi (µg/ml)
Konsentrasi (µg/ml) Konsentrasi (µg/ml) Absorbansi
Absorbansi
Absorbansi
Kurva kalibrasi pada Gambar 4.3 dan 4.4 merupakan kurva kalibrasi magnesium dan natrium dengan persamaan regresi masing masing Y = 0,03493 X + 0,0014 dan Y = 0,11123X + 0,0010. Nilai koefisien korelasi untuk kalibrasi magnesium dan natrium masing-masing adalah 0,9995 dan 0,9997. Nilai r magnesium dan natrium menunjukkan adanya hubungan positif yang sangat kuat antar variabel, yaitu korelasi searah antara konsentrasi terhadap absorbansinya.
Nilai slope untuk garis regresinya yaitu 0,03493 dan 0,11128.
4.3 Analisis Kadar Kalium, Kalsium, Magnesium dan Natrium pada Buah Mangrove
Penetapan kadar mineral kalium, kalsium, magnesium dan natrium dilakukan secara spektrofotometri serapan atom. Konsentrasi kalium, kalsium, magnesium dan natrium ditentukan berdasarkan perhitungan menggunakan persamaan regresi larutan standar masing-masing mineral yang diperoleh dari kurva kalibrasi. Absorbansi sampel yang ditetapkan kadarnya harus berada pada dalam rentang absorbansi larutan baku kalibrasi. Sehingga dilakukan pengenceran yang berbeda-beda untuk larutan sampel sesuai dengan mineral yang diukur.
Pengenceran larutan sampel untuk penentuan kadar kalium pada buah mangrove dilakukan sebanyak 400 kali (faktor pengenceran 400 kali) dan diukur pada rentang konsentrasi kalibrasi 0,2-1,0 ppm, untuk kalsium dilakukan pengenceran sebanyak 100 kali dan diukur pada rentang konsentrasi kalibrasi 1,0- 5,0 ppm. Sedangkan faktor pengenceran yang diperoleh untuk penetapan kadar mineral magnesium 125 kali dan natrium masing-masing 400 kali dengan diukur pada rentang konsentrasi kalibrasi masing-masing 1,0-5,0 ppm dan 0,2-1,0 ppm.
Menurut Ermer dan McB. Miller (2005) pengukuran sampel dilakukan sebanyak enam perulangan untuk masing-masing mineral yang diperiksa dengan tidak boleh kurang dari lima larutan sampel yang ditetapkan berada disekitar batasan konsentrasi yang ditetapkan pada kalibrasi.Hasil pengukuran kadar sampel dapat dilihat pada Lampiran 9 halaman 50. Perhitungan penetapan kadar mineral dalam buah mangrovedapat dilihat pada Lampiran 10 halaman 51.
Analisis penetapan kadar mineral kemudian dilanjutkan secara statistik dengan menggunakan uji-t satu arah pada tingkat kepercayaan 99,0% (α=0,01) (perhitungan dapat dilihat pada Lampiran 11 halaman 56). Hasil analisis secara kuantitatif mineral kalium, kalsium, magnesium dan natrium pada buah mangrove dapat dilihat pada Tabel 4.1 di bawah ini.
Uji-t atau significance test digunakan untuk menentukan data yang diperoleh dari hasil pengukuran dapat diterima atau tidak berdasarkan interval kepercayaan atau nilai signifikansi yang ditetapkan dengan membandingkannya terhadap nilai t tabel. Penentuan hasil dapat diterima atau tidak disebabkan karena adanya variabilitas yang besar selama rangkaian analisis. Tujuan penetapan uji-t ini juga untuk menjaga keakurasian selama rangkaian analisis (Ermer dan McB. Miller, 2005).
Tabel 4.1 Kadar mineral buah mangrove (Sonneratai caseolaris) yang dihitung berdasarkan berat basah.
Mineral
Kalium Kalsium Magnesium natrium
kadar (mg/100 g)
95,2636 ± 1,0482
33,8226 ± 0,2040
37,4961 ± 0,1953
77,7731 ± 0,3738
Berdasarkan data penelitian Hoe dan Siong (1999) kadar mineral kalium 306 mg/100 g, kalsium 42 mg/100 g, dan magnesium 27 mg/100g dalam buah
mangrove (Sonneratia Caseolaris). Jika dibandingkan dengan hasil yang diperoleh dalam penelitian saya kadar kalium, kalsium, magnesium dan natrium yang diperoleh sebesar 95,2636 ± 1,0482mg/100 g, 33,8226 ± 0,2040 mg/100g, 37,4961
± 0,1953 mg/100 g, dan 77,7731 ± 0.3738 mg/100 g. dari perbandingan data-data diatas dapat disimpulkan bahwa terdapat perbedaan kadar antara data yang diperoleh dari penelitian dengan literatur.
Ada beberapa faktor yang dapat menyebabkan terjadinya variasi (fluktuasi) kadar mineral yang signifikan pada hasil penelitian jika dibandingkan dengan hasil literatur atau hasil penelitian lain diantaranya faktor genetik yang berbeda, daerah tempat hidup tanaman, faktor pra-panen (fertilitas tanah-termasuk pH dan ketersediaan nutrien, kelembaban tanah, temperatur tumbuh), waktu penyerbukan, irigasi, usia tanaman (buah), metode pengukuran kadar mineral sampel, dan bagian tanaman yang dianalisa (Florkowski, dkk., 2009).
4.4 Uji Perolehan Kembali (Recovery)
Hasil uji perolehan kembali (recovery) kadar kalium, kalsium, magnesium, dan natrium setelah penambahan masing-masing larutan baku kalium, kalsium, magnesium, dan natrium dalam sampel dapat dilihat pada Tabel 4.2. Lampiran 15 halaman 66.
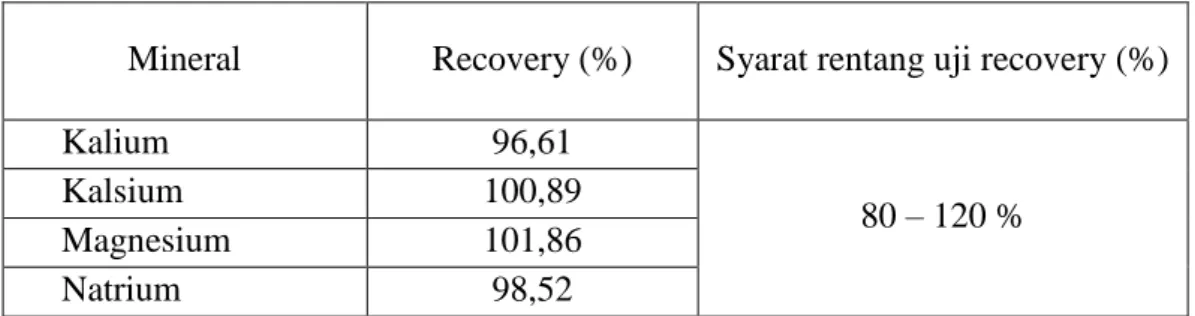
Tabel 4.2 Hasil uji perolehan kembali kadar mineral sampel
Mineral Recovery (%) Syarat rentang uji recovery (%)
Kalium 96,61
80 – 120 %
Kalsium 100,89
Magnesium 101,86
Natrium 98,52
Berdasarkan Tabel 4.2 dapat dilihat bahwa rata-rata hasil uji perolehan kembali kalium sebesar 96,61%, untuk mineral kalsium sebesar 100,89%, untuk magnesium adalah 101,86%, sedangkan hasil uji perolehan kembali untuk natrium sebesar 98,52%. Uji perolehan kembali (recovery) digunakan untuk menentukan tingkat akurasi (kecermatan) dalam pengerjaan penetapan kadar mineral sampel.
Hasil di atas menunjukkan persen perolehan kembali semua mineral yang diukur masih berada pada rentang persen recovery yang dipersyaratkan oleh Ermer dan McB. Miller (2005).
Menurut Ermer dan McB. Miller (2005), hasil uji akurasi (recovery) yang digunakan pada spektofotometri serapan atom berada pada kisaran 80 - 120 %.
Adapun uji akurasi digunakan untuk membandingkan hasil uji secara statistik dengan nilai teoritis pada interval kepercayaan. Perhitungannya uji perolehan kembali kadar mineral kalium, kalsium, magnesium dan natrium dapat dilihat pada Lampiran 16 halaman 67.
4.5 Simpangan Baku Relatif
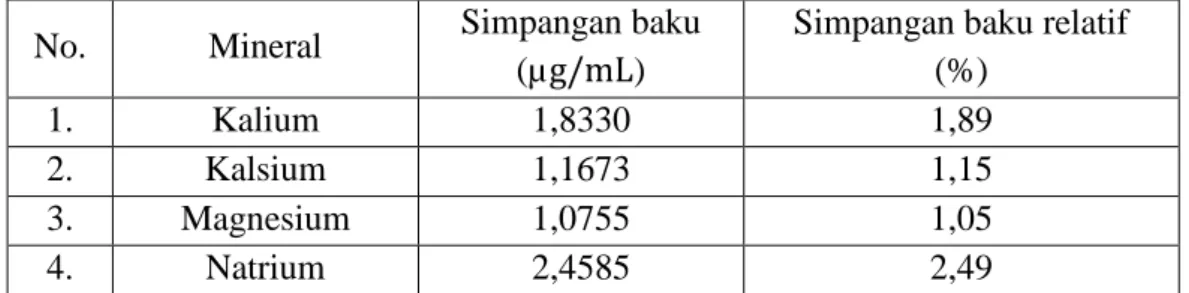
Nilai simpangan baku dan simpangan baku relatif untuk mineral kalium, kalsium, magnesium dan natrium dapat dilihat pada Tabel 4.3
Tabel 4.3 Nilai simpangan baku dan simpangan baku relatif mineral kalium, kalsium, magnesium dan natrium
No. Mineral Simpangan baku
(µg/mL)
Simpangan baku relatif (%)
1. Kalium 1,8330 1,89
2. Kalsium 1,1673 1,15
3. Magnesium 1,0755 1,05
4. Natrium 2,4585 2,49
Simpangan baku relatif dihitung berdasarkan data hasil uji perolehan kembali dalam persen mineral kalium, kalsium, magnesium dan natrium dalam sempel. Nilai simpangan baku atau standar deviasi untuk keempat mineral yang
diperiksa masing-masing adalah 1,8330 µg/ml, 1,1673 µg/ml, 1,0755 µg/ml dan 2,4585 µg/ml. Nilai simpangan baku relatif mineral kalium, kalsium, magnesium dan natrium masing-masing 1,89%; 1,15%; 1,05% dan 2,49%. Perhitungan simpangan baku dan simpangan baku relatif dapat dilihat pada Lampiran 17 halaman 72.
Menurut Harmita (2004) nilai simpangan baku relatif dikatakan memenuhi syarat jika nilai RSD yang diperoleh tidak lebih dari 16% untuk larutan dalam satuan ppm. Dari hasil yang diperoleh memenuhi presisi yang baik. Hal ini dinyatakan dengan nilai simpangan baku relatif yang berada jauh dibawah batas yang dipersyaratkan yaitu 16%. Perhitungan simpangan baku dan simpangan baku relatif dapat dilihat pada Lampiran 17 halaman 72.
4.6 Batas Deteksi dan Batas Kuantitasi
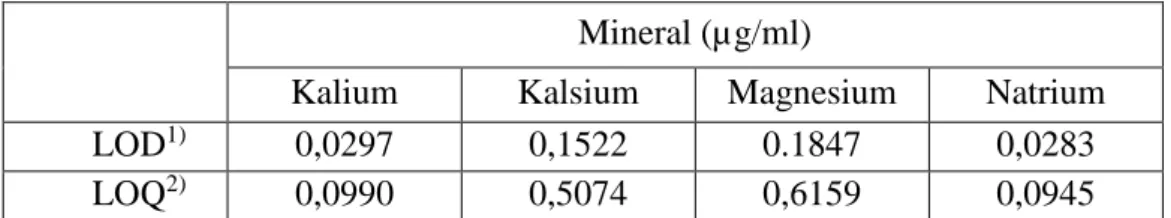
Berdasarkan data kurva kalibrasi diperoleh batas deteksi dan batas kuantitasi dari mineral kalium, kalsium, magnesium, dan natrium pada sampel dapat dilihat pada Tabel 4.4 sebagai berikut:
Tabel 4.4 Nilai Batas Deteksi dan Batas Kuantitasi Kurva Kalibrasi Mineral (µg/ml)
Kalium Kalsium Magnesium Natrium
LOD1) 0,0297 0,1522 0.1847 0,0283
LOQ2) 0,0990 0,5074 0,6159 0,0945
1)Batas deteksi 2)Batas kuantitasi
Batas deteksi merupakan jumlah terkecil analit (mineral) dalam sampel yang mampu dideteksi tanpa bisa ditetapkan jumlahnya dengan nilai yang tepat sedangkan batas kuantitasi ialah jumlah terkecil analit dalam sampel yang mampu ditetapkan secara kuantitatif dengan nilai presisi dan akurasi yang pantas.
BAB V
KESIMPULAN DAN SARAN
5.1.Kesimpulan
Kesimpulan yang diperoleh dari hasil penelitian yang dilakukan yaitu kadar mineral kalium, kalsium, magnesium dan natrium pada buah mangrove dilakukan secara spektrofotometri serapan atom, dari hasil pengukuran yang dilakukan pada buah magrove diperoleh kadar mineral kalium sebesar (95,2636 ± 1,0482) mg/100g, kalsium sebesar (33,8226 ± 0,2040) mg/100g, magnesium sebesar (37,4961 ± 0,1953) mg/100g, dan natrium (77,7731 ± 0.3738) mg/100g.
5.2.Saran
Disarankan kepada peneliti selanjutnya untuk meneliti mineral lain yang terdapat pada buah mangrove, seperti fosfor dan zat besi, maupun dari bagian tumbuhan yang lainnya, misalnya pada daun, batang dan bagian lainnya.