POTENSI PENU
NURUNAN KADAR GLUKOSA DARAH E DAUNMacaranga tanariusL. TERHADAP M
A TIKUS PUTIH JANTAN GALUR WISTA TERBEBANI GLUKOSA
SKRIPSI
iajukan untuk Memenuhi Salah Satu Syarat emperoleh Gelar Sarjana Farmasi (S.Farm.)
i
NURUNAN KADAR GLUKOSA DARAH E DAUNMacaranga tanariusL. TERHADAP M
A TIKUS PUTIH JANTAN GALUR WISTA TERBEBANI GLUKOSA
SKRIPSI
iajukan untuk Memenuhi Salah Satu Syarat emperoleh Gelar Sarjana Farmasi (S.Farm.)
ii
iii
iv
Be joyful in
hope
, patient in
affliction,
faithful in
prayer
.
To my Almighty Jesus
Christ,
Mom, Dad, Intan, Vita
my friends,
and my alma mater.
Romans 8:24-25
“I am not discouraged, because everywrongattempt discarded is another
step forward
.”v
LEMBAR PERNYATAAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
vi
PERNYATAAN KEASLIAN KARYA
vii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Esa atas segala bimbingan, penyertaan dan perlindungan yang tak henti-hentinya kepada penulis sehingga dapat menyelesaikan skripsi ini untuk memenuhi salah satu syarat guna memperoleh gelar Sarjana Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam penyusunan skripsi ini penulis telah banyak memperoleh bimbingan, pengarahan, bantuan, dari berbagai pihak. Untuk itu penulis ingin menyampaikan rasa terima kasih kepada semua pihak yang telah bersedia meluangkan waktu, tenaga, dan pikiran dalam proses penyelesaian skripsi ini. Penulis menyampaikan rasa terima kasih yang sebesar-besarnya kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu Phebe Hendra, M.Si., Ph.D., Apt. selaku Dosen Pembimbing yang telah bersedia meluangkan waktu dan tenaga untuk berdiskusi serta memberikan segala masukan dalam penyusunan skripsi ini.
3. Bapak Prof. Dr. C.J. Soegihardjo, Apt. sebagai Dosen Penguji skripsi atas bantuan, masukan, dan perhatian yang diberikan kepada penulis demi kemajuan skripsi ini.
viii
5. Ibu Rini Dwiastuti, M.Si., Apt. selaku Pimpinan Laboratorium Farmasi yang telah memberikan ijin penggunaan semua fasilitas laboratorium guna memperlancar penelitian ini.
6. Bapak Yohanes Dwiatmaka, M.Si. yang telah membantu dalam determinasi tanamanMacaranga tanariusL.
7. Semua dosen Fakultas Farmasi yang telah memberikan bimbingan dan ilmu kepada penulis.
8. Dokter Ari, Pak Wagiran, Pak Heru, Pak Parjiman, Pak Kayat, Mas Yohanes, dan Mas Yuwono yang telah banyak membantu dalam menyediakan fasilitas yang dibutuhkan dalam melalukan penelitian ini. 9. Dian Prasanti, sebagai sahabat seperjalanan yang tak pernah selesai, atas
doa, kasih sayang, perhatian, bantuan, motivasi, dan waktunya.
10. Teman-teman “Team Macaranga 2” Stephanie Irena Nugrahesti, Triana Oktavia, Rio Bagus Permadi, Martina Tri Handayani, Ana Puspita, dan Viviane Theresia atas kerja sama, bantuan, suka duka, dan perjuangan dalam menyelesaikan penelitian ini sampai ahkir.
11. Teman-teman Kelas C 2008 dan FKK B angkatan 2008 dan semua teman Fakultas Farmasi USD atas kebersamaan selama menempuh S1 di Fakultas Farmasi Universitas Sanata Dharma.
12. Semua pihak yang telah membantu dan tidak dapat disebutkan satu persatu
ix
sempurnanya skripsi ini. Semoga skripsi ini bermanfaat untuk pembaca dan semoga skripsi ini dapat menjadi salah satu sumbangan bagi ilmu pengetahuan.
Yogyakarta, 20 Februari 2012
x
DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN PERSETUJUAN PUBLIKASI ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA... vii
DAFTAR ISI... x
DAFTAR TABEL... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN... xv
DAFTAR ISTILAH DAN SINGKATAN ... xvi
INTISARI... xvii
ABSTRACT... xviii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan... 3
2. Keaslian penelitian ... 4
3. Manfaat penelitian... 5
B. Tujuan Penelitian ... 6
BAB II. PENELAAH PUSTAKA ... 7
A. TanamanM.tanarius ... 7
1. Keterangan botani ... 7
xi
3. Kandungan kimia ... 7
4. Kegunaan... 8
5. Ekologi penyebaran dan budidaya ... 9
B. Transport Glukosa... 9
E. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah ... 23
1. Teknik uji diabetik ... 23
2. Metode penetapan kadar glukosa ... 23
F. Metformin ... 24
G. Uji Toleransi Glukosa Oral (UTGO) ... 25
H. Landasan Teori... 26
I. Hipotesis... 27
BAB III. METODOLOGI PENELITIAN ... 28
A. Jenis dan Rancangan Penelitian ... 28
B. Variabel Penelitian dan Definisi Operasional ... 28
1. Variabel penelitian ... 28
2. Definisi operasional ... 29
C. Bahan dan Alat Penelitian... 30
1. Bahan penelitian... 30
2. Alat penelitian ... 32
D. Tata Cara Penelitian ... 32
E. Tata Cara Analisis Hasil... 40
BAB IV. HASIL DAN PEMBAHASAN ... 41
xii
B. Hasil Pembuatan Ekstrak Metanol-air DaunM.tanarius ... 41
C. Uji Pendahuluan ... 43
D. Efek Penurunan Kadar Glukosa Ekstrak Metanol-air DaunM.tanarius... 46
BAB V. KESIMPULAN DAN SARAN... 54
A. Kesimpulan ... 54
B. Saran... 54
DAFTAR PUSTAKA ... 55
LAMPIRAN... 59
xiii
DAFTAR TABEL
Tabel I. Isi pereaksi enzimGlucoseGOD-PAP... 31
Tabel II. Keseragaman bobot tablet ... 35 Tabel III. Volume pengukuran kadar glukosa darah ... 39 Tabel IV. Hasil UTGO dan perhitungan prosentase selisih LDDK0-240
larutan metformin ... 43 Tabel V. Nilai LDDK0-240 ekstrak metanol-air daunM.tanariussebelum
UTGO ... 45 Tabel VI. Persen perbedaan rerata LDDK0-240masing-masing kelompok .... 50 Tabel VII. Hasil uji Scheffe LDDK0-240 glukosa darah tikus jantan
xiv
DAFTAR GAMBAR
Gambar 1. Sekresi insulin akibat peningkatan kadar glukosa darah ... 10 Gambar 2. Insulin memperantarai transport glukosa ke dalam sel ... 12 Gambar 3. Diagram penentuan selang waktu pemberian metformin
terhadap LDDK ... 44 Gambar 4. Diagram penentuan selang waktu pemberian ekstrak
metanol-air daunM.tanariusterhadap LDDK... 46
xv
DAFTAR LAMPIRAN
Lampiran 1. DaunM.tanarius... 59
Lampiran 2. Ekstrak metanol-air daunM.tanarius... 59
Lampiran 3. Hewan uji (tikus putih jantan galur wistar) ... 59
Lampiran 4. Alat penelitian... 60
Lampiran 5. Hasil determinasiMacaranga tanariusL... 61
Lampiran 6. Preparasi bahan... 62
Lampiran 7. Perhitungan volume pemberian ... 63
Lampiran 8. Hasil uji validasi dan reliabilitasinstrumen penelitian... 64
Lampiran 9. Rendemen ekstrak... 64
Lampiran 10. Perhitungan perbedaan rerata LDDK0-240masing-masing kelompok ... 64
Lampiran 11. Hasil uji normalitas data LDDK0-240dengan Kolmogorov-Smirnov ... 65
Lampiran 12. Hasil ujiOne Way Anova danuji variansi data ... 65
Lampiran 13. Hasil ujiScheffe... 66
xvi
DAFTAR SINGKATAN, ARTI LAMBANG, DAN ISTILAH
MTME : M.tanariusL.leaf methanol–water extract
CMC : Carboxy Methyl Cellulose
GOD-PAP : Glucose-Oxydase–Phenol Antipirin
LDDK : Luas Daerah di Bawah Kurva, kadar glukosa dalam darah vs waktu
LDDK0-240 : Luas Daerah di Bawah Kurva dari menit ke-0 sampai menit ke-240
ANOVA : Analyisis of Varian
xvii
INTISARI
Tujuan penelitian ini adalah untuk mengetahui apakah ekstrak metanol-air daun M. tanarius mempunyai aktivitas penurunan glukosa darah dan mengetahui
seberapa besar potensi ekstrak metanol-air daun M.tanarius yang efektif dalam
menurunkan kadar glukosa pada tikus terbebani glukosa.
Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Penelitian ini menggunakan tikus jantan galur Wistar, umur 2-3 bulan. Dua puluh lima ekor tikus dibagi secara acak dalam lima kelompok perlakuan. Kelompok I (kontrol negatif) diberi CMC 1%; Kelompok II (kontrol positif) diberikan metformin 76,5 mg/kg BB; Kelompok III-V diberikan ekstrak metanol-air daun M.tanarius dosis 0,11 g/kg BB; 0,22 g/kg BB; dan 0,44 g/kg
BB. Semua pemberian dilakukan secara per-oral. Efek hipoglikemik dari ekstrak metanol-air daunM.tanariusdiuji menggunakan metode uji toleransi glukosa oral
(UTGO). Kadar glukosa darah ditetapkan pada menit ke-0 sebelum UTGO dan menit ke-15, 30, 45, 60, 90, 180 dan 240 setelah UTGO dari hewan uji yang sebelumnya telah mendapatkan pra-perlakuan kontrol negatif, positif, dan ekstrak metanol-air daun M.tanarius. LDDK 0-240 diuji dengan one way ANOVA dan
dilanjutkan dengan ujiScheffebertaraf kepercayaan 95%.
Ekstrak metanol-air daun M.tanarius memberikan efek penurunan kadar glukosa darah tikus terbebani glukosa sebesar 77,0% jika dibandingkan dengan metformin.
xviii
ABSTRACT
The purpose of this research was to find out the effect of M.tanarius leaf methanol-water extract has effect to decrease blood glucose level and how much potential for M.tanarius leaf methanol-water extract as an effective on lowering
blood glucose level on burdened glucose rats.
The research was pure experimental with direct sampling design. The research was using Wistar male rats, age 2-3 months. Twenty five rats was divided into five groups. First group (negative control) given CMC 1%; second group (positive control) given metformin 76,5 mg/KgBB; third group given
M.tanarius leaf methanol-water extract 0,11 g/KgBB; fourth group given M.tanarius leaf methanol-water extract 0,22 g/KgBB; fifth group given M.tanarius leaf methanol-water extract 0,44 g/KgBB. All of the processes were given through the oral method. The hypoglycemic effect of M.tanarius leaf
methanol-water extract was tested by following the Oral Glucose Tolerance Test (OGTT) method. The blood-glucose contents were taken, at the 0 minute before the OGTT and also taken at minutes of 15, 30, 45, 60, 90, 180, and 240 after the OGTT, from the tested animal that had been gotten the pre treatment of the negative control, positive, andM.tanariusleaf methanol-water extract. The AUC
0-240was statistically analyzed using the one way Anova test and continued by using Scheffe test with 95% level of confidence.
M.tanarius leaf methanol-water extract gave 77,0% decrease of blood
glucose levels on burdened glucose rats compared to metformin.
1
BAB I PENGANTAR
A. Latar Belakang
Masa transisi demografi akibat keberhasilan upaya menurunkan angka kematian, dapat menimbulkan transisi epidemiologis, dimana pola penyakit bergeser dari infeksi akut ke penyakit degeneratif yang menahun. Salah satu diantaranya yang berkaitan erat dengan penyakit metabolisme dan cenderung akan mengalami peningkatan sebagai dampak adanya pergeseran perilaku pola konsumsi makanan adalah diabetes melitus.
Diabetes melitus merupakan sekumpulan gejala yang timbul pada seseorang, ditandai dengan kadar glukosa yang melebihi nilai normal (hiperglikemia) akibat tubuh kekurangan insulin baik absolut maupun relatif. Penyakit ini bersifat menahun atau kronis, dan penderitanya dari semua lapisan umur serta tidak membedakan orang kaya ataupun miskin. Dalam keadaan tak terkendali penyakit ini ditandai oleh trias 3 P, yaitu: poliuri, polidipsi dan polifagi. Secara klinis diabetes melitus dibedakan menjadiInsulin Dependent Diabetes mellitus (IDDM)
atau diabetes melitus tergantung insulin (DMTI) dan Non-Insulin Dependent
Diabetes mellitus (NIDDM) atau diabetes melitus tidak tergantung insulin
(DMTTI) (Suryohudoyo dan Purnomo, 1996).
pada tahun 2005, dan sebagian besar peningkatan itu akan terjadi di negara-negara yang sedang berkembang seperti Indonesia.
Populasi penderita diabetes di Indonesia diperkirakan berkisar antara 1,5 sampai 2,5% kecuali di Manado 6%. Dengan jumlah penduduk sekitar 200 juta jiwa, berarti lebih kurang 3-5 juta penduduk Indonesia menderita diabetes. Tercatat pada tahun 1995, jumlah penderita diabetes di Indonesia mencapai 5 juta jiwa. Pada tahun 2005 diperkirakan akan mencapai 12 juta penderita (Suyono, 2007).
Eksplorasi tanaman yang berefek antidiabetes semakin berkembang dan semakin banyak dilakukan untuk mendapatkan informasi dalam pengembangan dunia pengobatan. Tanaman yang mungkin jarang dikenal oleh sebagian besar masyarakat namun masih dapat dieksplorasi sebagai tanaman alternatif pengobatan, yaituMacaranga tanariusL.
Puteri dan Kawabata (2010) melaporkan ekstrak metanol-air daun
M.tanarius mempunyai aktivitas penghambatan α-glukosidase. Alfa-glukosidase diketahui mampu menghambat perubahan polisakarida menjadi monosakarida dalam hal ini adalah glukosa.Adanya kandungan α-glukosidase pada ekstrak daun
M. tanarius berpeluang sebagai agen antidiabetes pada hewan uji. Handayani
(2012) juga melaporkan mengenai pengaruh ekstrak metanol-air daun M.tanarius
pada tikus putih galur Wistar yang dapat memberikan penurunan kadar gula signifikan pada dosis 0,44 g/KgBB. Oleh karena itu, dalam penelitian ini dilakukan uji potensi penurunan kadar glukosa darah ekstrak metanol-air daun
M.tanarius dengan dosis rendah terhadap metformin pada hewan uji tikus putih
jantan galur Wistar terbebani glukosa.
1. Permasalahan
Permasalahan yang akan diteliti adalah :
a. Apakah ekstrak metanol air dari daun M.tanarius memiliki efek
penurunan kadar glukosa darah pada tikus jantan galur Wistar?
2. Keaslian penelitian
Phommart, Sutthivaiyakit, Chimnoi, Ruchirawat, dan Sutthivaiyakit (2005) melaporkan salah satu konstituen dari ekstrak n-heksana dan kloroform dari daun M.tanarius berupa flavonoid mempunyai aktivitas
antioksidan terhadap DPPH dan nymphaeols B sebagai agen antiinflamasi
pada uji siklooksigenase-2. Phommart, dkk (2005) melaporkan dari daun
M.tanarius ditemukan 3 kandungan senyawa baru, yaitu tanarifuranonol, tanariflavanon C, dan tanariflavanon D bersama dengan 7 kandungan yang telah diketahui, yaitu nymphaeol A, nymphaeol B, nymphaeol C,
tanariflavanon B,blumenol A (vomifoliol),blumenol B(7,8 dihydrovomifoliol
dan annuionon). Matsunami, Takamori, Shinzato, Aramoto, Kondo, Otsuka,
dkk (2006) melaporkan 4 kandungan baru dari M. tanarius, yaitu macarangiosida A-C, dan malofenol B, yang diisolasi dari ekstrak metanol
M.tanariusmenunjukkan aktivitas penangkapan radikal terhadap DPPH.
Penelitian terkait pengujian daun M.tanarius dilaporkan kandungan
metanol M.tanarius berupa mallotinic acid, corilagin, macatannin A,
chebulagic acid, dan macatannin B mempunyai aktivitas potensial
menghambat α-glukosidase yang dapat dimanfaatkan sebagai antidiabetes
(Puteri dan Kawabata, 2010).
M.tanarius pernah dilakukan penelitian secara in vivo diantaranya,
Handayani (2012) melaporkan mengenai pengaruh pemberian ekstrak metanol-air daun M.tanarius terhadap penurunan kadar glukosa darah pada tikus yang terbebani glukosa. Pada penelitian ini Handayani menggunakan dosis 0,44; 1,32; dan 3,96 g/KgBB dengan kontrol positif glibenklamid. Dan pada kesimpulan didapat dosis 0,44 g/kgBB mempunyai efek yang lebih besar dibanding dosis lain yang lebih besar.
Sejauh pengamatan penulis, penelitian tentang potensi penurunan kadar glukosa darah ekstrak metanol-air daunM.tanariusterhadap metformin
pada tikus jantan galur Wistar belum pernah dilakukan.
3. Manfaat penelitian a. Manfaat teoritis.
Penelitian ini diharapkan dapat memberikan informasi yang berguna tentang penggunaan tumbuhan alternatif yang dapat digunakan sebagai antidiabetes.
b. Manfaat praktis.
Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat tentang dosis ekstrak metanol air daun M.tanarius yang dapat
B. Tujuan Penelitian
1. Untuk mengetahui efek penurunan glukosa darah dari ekstrak metanol-air daunM.tanariuspada tikus jantan galur Wistar.
7
BAB II
PENELAAH PUSTAKA
A. TanamanMacaranga tanariusL. 1. Keterangan botani
Macaranga tanarius L. termasuk dalam famili Euphorbiaceae dengan
sinonim Ricinus tanarius L., Macaranga molliuscula Kurz, Macaranga
tomentosa Druce,Mappa tanarius Blume (World Agroforestry Centre, 2002).
Dikenal di beberapa daerah dengan nama tutup ancur (Jawa), mapu (Batak), mara (Sunda) (Anonim, 2010).
2. Morfologi
Merupakan pohon kecil sampai sedang, dengan dahan agak besar. Daun berseling, agak membundar, dengan tangkai daun besar yang luruh. Perbungaan bermalai di ketiak, bunga ditutupi oleh daun gagang. Buah kapsul berkokus 2, ada kelenjar kekuningan di luarnya. Biji membulat, menggelembung. Jenis ini juga mengandung tanin yang cukup untuk menyamak jala dan kulit (Anonim, 2010).
3. Kandungan kimia
Uji kimia dari tanin dalam daun M.tanarius dilaporkan 7 hydrolyzable
tannin yang baru, bersama dengan 21 tanin yang telah diketahui sebelumnya
(Lim, Nonaka, dan Nishioka, 1990). Dari daun M.tanarius dilaporkan
yaitunymphaeol A, nymphaeol B, nymphaeol C, tanariflavanon B, blumenol A
(vomifoliol), blumenol B (7,8-dihydrovomifoliol), dan annuionone E
(Phommart, dkk, 2005).
Dilaporkan 4 kandungan baru dari daun M.tanarius megastigman
glucoside, dinamai macarangiosida A-D bersama dengan campuran mallophenol B, lauroside E, methyl brevifolin carboxylate, dan hyperin dan
isoquercitrin (Matsunami dkk, 2006), serta lignan glukosida, (+)-pinoresinol 4-O-[6n-O-galloyl]-β-D-glucopyranoside, dan 2 megastigman glukosida,
dinamai macarangiosida E dan F, bersama dengan 15 komponen lain yang telah diketahui dilaporkan terdapat pada daun M.tanarius (Matsunami,
Otsuka, Kondo, Shinzato, Kawahata, Yamaguchi, dkk, 2009).
Dilaporkan pula kandungan ekstrak metanol M.tanariusberupamallotinic
acid, corilagin, macatannin A, cheebulagic acid, dan macatannin B
mempunyai aktivitas potensial menghambat α-glukosidase yang dapat
dimanfaatkan sebagai antidiabetes (Puteri dan Kawabata, 2010).
4. Kegunaan
Secara tradisional, tumbuhan M.tanarius digunakan sebagai fermentasi pada tempe dan pakan hewan (Puteri dan Kawabata, 2010). Kulit batang dan daun M.tanarius diketahui banyak mengandung tanin yang telah digunakan
digunakan untuk menutupi luka pada pencegahan inflamasi (Lim, Lim, dan Yule, 2009).
5. Ekologi penyebaran dan budidaya
M. tanarius tersebar luas, dari Kepulauan Andaman dan Nicobar,
Indo-Cina, Cina Selatan, Taiwan dan Kepulauan Ryukyu, seluruh Malaysia, sampai ke Australia Utara dan Timur dan Melanesia. Jenis ini umum dijumpai di daratan Asia Tenggara (Thailand Selatan, Semenanjung Malaya), dan pada banyak pulau di Indonesia (yaitu Sumatra, Kalimantan, Kepulauan Sunda Kecil, Sulawesi, Nugini, seluruh Kepulauan Filipina) (Anonim, 2010).
B. Transport Glukosa
Glukosa merupakan karbohidrat yang paling penting. Glukosa merupakan karbohidrat dalam makanan yang diserap dalam jumlah besar kedalam darah (Mayes, Murray, dan Granner, 2000). Glukosa merupakan bahan bakar utama jaringan tubuh yang pada akhirnya digunakan oleh sel tubuh untuk membentuk ATP. Glukosa merupakan jenis monosakarida yang paling banyak diabsorbsi oleh usus biasanya mencakup 80% dari kalori karbohidrat yang diabsobsi. Alasannya adalah bahwa glukosa merupakan produk cerna terakhir dari makanan (Guyton dan Hall, 2006). Glukosa diserap usus melalui dua tahap, yaitu masuknya glukosa melewati membran apikal usus dan kemudian dari sel masuk melewati membrane basal. Absobsi glukosa melewati membrane apikal difasilitasi oleh
Masuknya glukosa melewati membran apical, melalui SGLT1 dengan cara
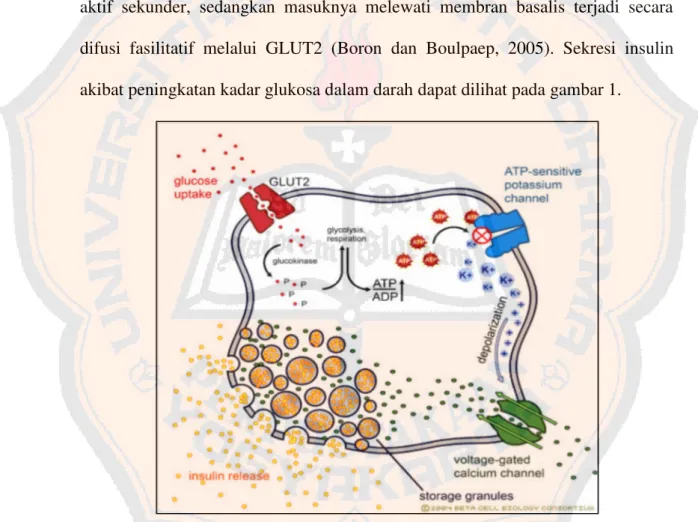
transport aktif, sebab masuknya glukosa ke dalam sel epitel usus, terjadi melawan gradient kadar konsentrasi glukosa. Glukosa masuk melewati membran basalis diberi energi oleh gradient elektrokimia Na+, yang mana pada gilirannya dijaga oleh tekanan Na+ yang melewati membran basolateral dengan pompa Na-K. Sistem transport glukosa dengan Na+ini adalah salah satu contoh proses transport aktif sekunder, sedangkan masuknya melewati membran basalis terjadi secara difusi fasilitatif melalui GLUT2 (Boron dan Boulpaep, 2005). Sekresi insulin akibat peningkatan kadar glukosa dalam darah dapat dilihat pada gambar 1.
Gambar 1. Sekresi insulin akibat peningkatan kadar glukosa darah (Cartailler, 2004)
Sekresi insulin oleh sel ß (beta) tergantung oleh 3 faktor utama, yaitu kadar glukosa darah, ATP-sensitive K+ channels dan Voltage-sensitive Calsium
berikut: pada keadaan puasa, kadar glukosa darah turun, ATP-sensitive K+
channels pada membran sel ß akan terbuka sehingga ion kalium akan meninggalkan sel ß, dan Ca-channels tertutup, akibatnya kalsium tidak dapat
masuk ke dalam sel ß, dan perangsangan sel ß untuk mensekresi insulin menurun (Merentek, 2006).
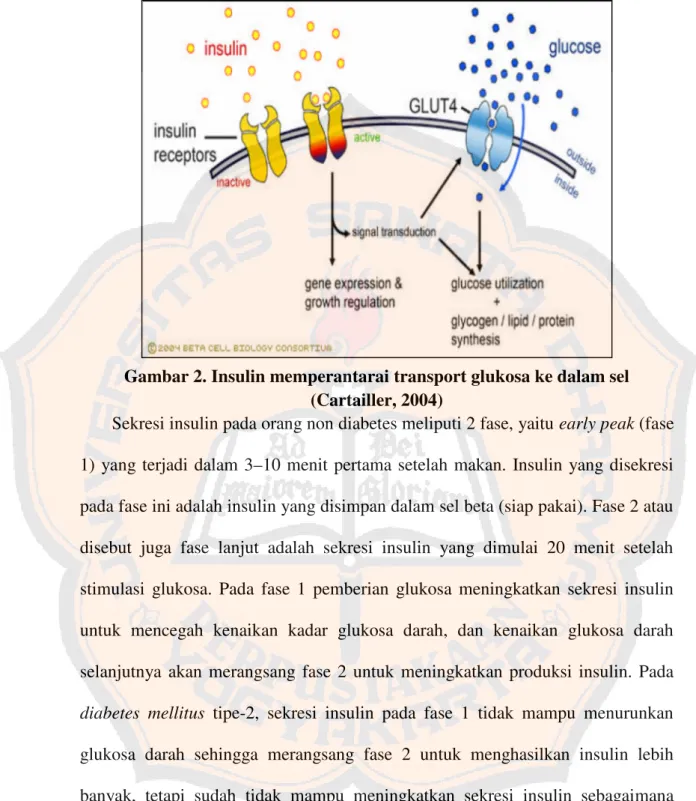
Gambar 2. Insulin memperantarai transport glukosa ke dalam sel (Cartailler, 2004)
Sekresi insulin pada orang non diabetes meliputi 2 fase, yaituearly peak(fase
1) yang terjadi dalam 3–10 menit pertama setelah makan. Insulin yang disekresi
pada fase ini adalah insulin yang disimpan dalam sel beta (siap pakai). Fase 2 atau disebut juga fase lanjut adalah sekresi insulin yang dimulai 20 menit setelah stimulasi glukosa. Pada fase 1 pemberian glukosa meningkatkan sekresi insulin untuk mencegah kenaikan kadar glukosa darah, dan kenaikan glukosa darah selanjutnya akan merangsang fase 2 untuk meningkatkan produksi insulin. Pada
diabetes mellitus tipe-2, sekresi insulin pada fase 1 tidak mampu menurunkan
C. DiabetesMellitus
Diabetes Melitus (DM) merupakan suatu penyakit atau gangguan metabolisme kronis dengan multi etiologi yang ditandai dengan tingginya kadar gula darah (hiperglikemia) disertai dengan gangguan metabolisme karbohidrat, lipid dan protein sebagai akibat insufisiensi fungsi insulin. Insufisiensi fungsi insulin dapat disebabkan oleh gangguan atau defisiensi produksi insulin oleh sel-sel beta Langerhans kelenjar pankreas, atau disebabkan oleh kurang responsifnya sel-sel tubuh terhadap insulin (WHO, 1999).
1. Klasifikasi
Berdasarkan etiologi, American Diabetes Association (ADA)
mengklasifikasikan Diabetes Melitus menjadi:
a. Diabetes Melitus tipe 1 atau Insulin Dependent Diabetes Mellitus
(IDDM)
Diabetes Melitus tipe 1 merupakan diabetes yang tergantung pada
insulin yang disebabkan oleh adanya reaksi autoimun sehingga sel beta (β)
penghasil insulin pada pulau-pulau Langerhans pankreas menjadi rusak, akibatnya tubuh menjadi kekurangan insulin (Triplitt, Reasner, dan Isley, 2005).
Destruksi autoimun dari sel β Langerhans kelenjar pankreas melibatkan
defisiensi sekresi insulin sehingga menyebabkan gangguan metabolisme yang
menyertai DM tipe 1. Selain itu, sel alfa (α) kelenjar pankreas pada penderita
tinggi walaupun dalam keadaan hiperglikemi. Hal ini memperparah keadaan ketoasidosis diabetik jika tidak mendapat terapi insulin (Direktorat Bina Farmasi Komunitas dan Klinik Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan Departemen Kesehatan RI, 2005).
b. Diabetes Melitus tipe 2 atau Non-Insulin-Dependent Diabetes Mellitus
(NIDDM)
Pada diabetes tipe ini terjadi penurunan kemampuan insulin bekerja di jaringan perifer ( resistensi insulin dan disfungsi sel β). Akibatnya, pankreas
tidak mampu memproduksi insulin yang cukup untuk mengkompensasi resistensi insulin. Kedua hal ini menyebabkan terjadinya defisiensi insulin relatif (Widijanti, 2006).
Berbeda dengan DM tipe 1, pada penderita DM tipe 2 terutama yang berada pada tahap awal, umumnya dapat terdeteksi jumlah insulin yang cukup di dalam darahnya, di samping kadar glukosa yang tinggi. Jadi, awal patofisiologis DM tipe 2 bukan karena kurangnya sekresi insulin, tapi karena sel-sel sasaran insulin tidak mampu merespon insulin secara normal. Apabila tidak ditangani dengan baik, pada perkembangannya penderita DM tipe 2 akan mengalami kerusakan sel-sel β pankreas yang terjadi secara progesif yang
c. Diabetes Melitus Tipe Spesifik
Meliputi individu dengan gangguan genetik fungsi sel β, gangguan genetik kerja insulin, penyakit endokrin pankreas, endokrinopati (akromegali, sindrom Chusing), diabetes melitus karena obat atau bahan kimia, infeksi dan sindrom genetik (Triplitt dkk, 2005)
d. Diabetes Melitus Gestasional
Diabetes Melitus gestasional adalah diabetes yang dialami oleh wanita terutama pada masa kehamilan yang diakibatkan adanya intoleransi glukosa selama kehamilan. Diabetes gestasional terjadi pada 7% dari seluruh wanita hamil (Triplitt dkk, 2005).
2. Gejala
Pada DM Tipe 1 gejala awalnya adalah rasa haus dan berkemih yang berlebihan, mual, muntah, lelah dan nyeri perut (terutama pada anak-anak). Pernafasan menjadi dalam dan cepat karena tubuh berusaha untuk memperbaiki keasaman darah. Tanpa pengobatan, ketoasidosis diabetikum bisa berkembang menjadi koma, kadang dalam waktu hanya beberapa jam. Bahkan setelah mulai menjalani terapi insulin, penderita Diabetes tipe I bisa mengalami ketoasidosis jika mereka melewatkan satu kali penyuntikan insulin atau mengalami stres akibat infeksi, kecelakaan atau penyakit yang serius (Anonim, 2008).
sangat tinggi (sampai lebih dari 1.000mg/dL, biasanya terjadi akibat stres misalnya infeksi atau obat-obatan), maka penderita akan mengalami dehidrasi berat, yang bisa menyebabkan kebingungan mental, pusing, dan kejang (Anonim, 2008).
3. Diagnosis
Menurut American Association of Clinical Endocrinologists (2007),
diagnosa Diabetes Melitus baru dapat dipastikan jika :
a. Adanya gejala seperti poliuria, polidipsia dan penurunan berat badan yang cepat tanpa sebab yang jelas dan kadar glukosa darah acak = 200mg/dl atau
b. Kadar glukosa darah puasa (GDP) (dengan menggunakan plasma vena) = 126mg/dl. Puasa didefinisikan sebagai tidak adanya masukan kalori selama setidaknya 8 jam atau
c. Kadar glukosa plasma = 200mg/dl pada 2 jam sesudah beban glukosa 75 gram pada tes toleransi glukosa oral (TTGO).
4. Penatalaksanaan
Tujuan umum penatalaksanaan Diabetes Melitus adalah memperbaiki kelainan metabolisme pasien sehingga dapat mempertahankan status kesehatan pasien dan memperpanjang harapan hidup pasien. Pendekatan penatalaksanaan terapi Diabetes Melitus yang lain dipusatkan pada adanya resistensi insulin dan usaha untuk meningkatkan kemampuan insulin yang tersedia dalam memacu pengambilan glukosa oleh jaringan (Foster, 2000).
Pada penatalaksanaan terapi Diabetes Melitus terdapat terapi primer dan terapi sekunder. Penatalaksanaan terapi primer meliputi edukasi, diet, dan olahraga sedangkan terapi sekunder dengan insulin, obat hipoglikemia oral dan cangkok pankreas (Foster, 2000).
Apabila penatalaksanaan terapi tanpa obat (pengaturan diet dan olahraga) belum berhasil mengendalikan kadar glukosa darah penderita, maka perlu dilakukan langkah berikutnya berupa penatalaksanaan terapi obat, baik dalam bentuk terapi obat hipoglikemik oral, terapi insulin, atau kombinasi keduanya (Direktorat Bina Farmasi Komunitas dan Klinik Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan Departemen Kesehatan RI, 2005).
a. Terapi non farmakologik 1.) Diet
untuk mencapai dan menjaga berat badan yang ideal. Pada pasien DM tipe 2 dilakukan pembatasan kalori untuk mencapai penurunan berat badan. Penurunan berat badan dapat menurunkan faktor risiko pada orang DM tipe 2 (Triplitt dkk, 2005).
2.) Olahraga
Berolah raga secara teratur dapat menurunkan dan menjaga kadar gula darah tetap normal. Prinsipnya, tidak perlu olah raga berat, olah raga ringan asalkan dilakukan secara teratur akan bagus pengaruhnya bagi kesehatan. Olahraga akan memperbanyak jumlah dan meningkatkan aktivitas reseptor insulin dalam tubuh dan juga meningkatkan penggunaan glukosa (Direktorat Bina Farmasi Komunitas dan Klinik Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan Departemen Kesehatan RI, 2005).
b. Terapi farmakologik 1.) Terapi insulin
Bagi penderita DM Tipe 1 terapi insulin sangat dibutuhkan karena pada penderita DM Tipe 1, sel-sel β Langerhans kelenjar pankreas penderita
Dahulu terapi insulin untuk pasien DM tipe 2 dianggap sebagai pilihan yang terakhir, tetapi, hal tersebut mulai berubah seiring dengan waktu. Blonde (2007) menyatakan bahwa terapi insulin intensif pada DM tipe 2 yang baru terdiagnosa dapat meningkatkan kontrol glukosa darah dalam jangka waktu lama menurunkan risiko mikrovaskular dan makrovaskuler, serta potensial meningkatkan fungsi selβ pankreas.
Insulin yang disekresikan oleh sel-sel β pankreas akan langsung
diinfusikan ke dalam hati melalui vena porta, lalu didistribusikan ke seluruh tubuh melalui sirkulasi sistemik yang selanjutnya berperan untuk membantu transpor glukosa dari darah ke dalam sel. Kekurangan insulin menyebabkan glukosa darah tidak dapat atau terhambat masuk ke dalam sel. Akibatnya, glukosa darah akan meningkat, dan sebaliknya sel-sel tubuh kekurangan bahan sumber energi sehingga tidak dapat memproduksi energi sebagaimana seharusnya (Direktorat Bina Farmasi Komunitas dan Klinik Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan Departemen Kesehatan RI, 2005).
2.) Obat hipoglikemi oral
Berdasarkan mekanisme kerjanya, obat-obat hipoglikemik oral dapat dibagi menjadi beberapa golongan, yaitu:
a. Golongan sulfonilurea
sekresi insulin. Oleh sebab itu, obat-obat golongan sulfonilurea sangat bermanfaat untuk penderita diabetes yang kelenjar pankreasnya masih mampu memproduksi insulin, tetapi karena sesuatu hal terhambat sekresinya (Direktorat Bina Farmasi Komunitas dan Klinik Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan Departemen Kesehatan RI, 2005). Obat golongan sulfonilurea berisiko tinggi terjadi hipoglikemia jika pasien berusia lanjut dan mengalami insufisiensi renal atau gangguan hati (Triplitt dkk, 2005).
Golongan sulfonilurea terdiri dari 2 agen generasi. Agen generasi pertama meliputi klorpropamid, tolbutamid, karbutamid, asetoxamid, tolazamid dan glikodiazin. Agen generasi kedua meliputi glibenklamid, glipizid, gliklazid dan glimepirid (Karam, 1998).
b. Golongan meglitinida dan Turunan fenilalanin
Obat golongan glinida ini merupakan obat hipoglikemik generasi baru yang kerjanya mirip dengan golongan sulfonilurea. Kedua golongan senyawa hipoglikemik oral ini bekerja meningkatkan sintesis dan sekresi insulin oleh kelenjar pankreas. Umumnya senyawa obat hipoglikemik golongan meglitinida dan turunan fenilalanin ini dipakai dalam bentuk kombinasi dengan obat-obat antidiabetik oral lainnya (Karam, 1998).
c. Golongan biguanida
menyebabkan hipoglikemia. Satu-satunya senyawa biguanida yang masih dipakai sebagai obat hipoglikemik oral di United State adalah metformin. Kerja obat ini adalah meningkatkan sensitivitas insulin pada hati dan jaringan perifer, sehingga meningkatkan ambilan glukosa (Triplitt dkk, 2005).
Sangat penting untuk memulai dosis dari dosis rendah dan dapat ditingkatkan secara bertahap digunakan bersamaan waktu makan hal ini dilakukan untuk mengurangi risiko gangguan saluran pencernaan yang mungkin dapat terjadi (Karam, 2007). Tablet 500 mg dapat digunakan 3 kali sehari bersamaan dengan waktu makan, atau 850 mg digunakan 2 kali sehari namun pada beberapa pasien dapat digunakan 3 kali sehari (Semla, Beizer, Higbee, 2002).
d. Golongan inhibitor α-glukosidase
Golongan obat ini bekerja dengan cara menghambat enzim alfa glukosidase yang terdapat di dinding usus halus. Enzim-enzim α-glukosidase
(maltase, isomaltase, glukomaltase dan sukrase) berfungsi untuk menghidrolisis oligosakarida, pada dinding usus halus. Inhibisi kerja enzim ini secara efektif dapat mengurangi pencernaan karbohidrat kompleks dan absorbsinya, sehingga obat dapat mengurangi peningkatan kadar glukosa post prandial pada penderita Diabetes. Senyawa inhibitor α-glukosidase juga
menghambat enzim α-amilase pankreas yang bekerja menghidrolisis
merupakan obat yang termasuk dalam golongan ini, tersedia dalam tablet 50 mg dan 100 mg. Dosis awal pengunaan dapat dimulai dengan pemberian 50 mg 3 kali sehari, secara bertahap dapat ditingkatkan hingga 100 mg untuk 3 kali sehari. Obat ini memiliki keuntungan untuk mengatasi hiperglikemia postprandial, sehingga alangkah baik jika digunakan setelah suapan pertama saat makan (Karam, 1998).
D. Metode Penyarian
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian rupa hingga memenuhi baku yang telah ditetapkan (Departemen Kesehatan Republik Indonesia, 1995).
E. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah 1. Teknik Uji Diabetik
Pada suatu penelitian yang bertujuan untuk membuktikan khasiat suatu obat antidiabetes, hewan uji yang digunakan perlu diubah keadaannya menjadi diabetes baik DMTI maupun DMTTI. Suatu keadaan DMTI dapat dibuat secara pankreatektomi dan juga secara kimia dengan menggunakan zat kimia sebagai induktor (diabetogen) seperti aloksan, streptozosin, adrenalin, glukagon, dan EDTA yang diberikan secara parenteral. Diabetogen-diabetogen tersebut mampu menginduksi diabetes secara permanen yang ditandai dengan terjadinya hiperglikemi yang diakibatkan oleh rusaknya sel β
pada pankreas (Balai Pengembangan dan Pemanfaatan Obat Bahan Alam, 1991).
2. Metode Penetapan Kadar Glukosa Darah
Secara umum menurut Widowati, Dzulkarnain, dan Sa’roni(1997) metode
penentuan glukosa darah dapat ditentukan dengan beberapa cara, yaitu: a. Metode kondensasi gugus amina
Prinsip: aldosa dikondensasikan dengan orto-toluidin dalam suasana asam dan menghasilkan larutan berwarna hijau setelah dipanaskan. Kadar glukosa darah dapat ditentukan sesuai dengan intensitas warna yang terjadi diukur secara spektrofotometri.
b. Metode enzimatik
dioksidasi oleh udara (O2) menjadi asam glukuronat disertai pembentukan hidrogen peroksida. Dengan adanya enzim peroksidase (POD), H2O2 akan membebaskan O2 yang mengoksidasi akseptor kromogen yang sesuai serta memberikan warna merah. Akseptor kromogennya dapat berupa senyawa aminoantipirin dan fenol atau orthodianisidin, kadar glukosa darah ditentukan berdasarkan intensitas warna yang terjadi, diukur secara spektrofotometri. c. Metode oksidasi-reduksi
Kadar glukosa darah ditentukan dengan cara dioksidasi dengan menggunakan suatu oksidan ferrisianida. Oksida ini direduksi menjadi ferrosianida oleh glukosa dalam suatu suasana basa dengan pemanasan, kemudian kelebihan garam ferri dititrasi secara iodometri.
F. Metformin
Metformin merupakan obat hipoglikemik oral yang termasuk golongan biguanid. Golongan biguanid bekerja meningkatkan kepekaan reseptor insulin, sehingga absorbsi glukosa di jaringan perifer meningkat dan menghambat glukoneogenesis dalam hati dan meningkatan penyerapan glukosa di jaringan perifer (Tjay dan Rahardja, 2007).
Pada pemakaian tunggal, metformin dapat menurunkan kadar glukosa darah sampai 20%. Pada pasien dengan berat lebih, dapat dikombinasi dengan obat golongan sulfonilurea. Kombinasi sulfonilurea dan metformin merupakan kombinasi yang rasional karena cara kerja berbeda yang saling aditif. Efek samping yang sering terjadi adalah nausea, muntah, kadang-kadang diare dan dapat menyebabkan asidosis laktat (Soegondo, 2006).
Metformin dikontraindikasikan pada pasien dengan gangguan fungsi ginjal (kreatinin serum > 1,5) dan hati, serta pasien-pasien dengan kecenderungan hipoksemia, misalnya penyakit serebrovaskular, sepsis, syok, gagal jantung (Soegondo, 2006).
G. Uji Toleransi Glukosa Oral (UTGO)
Uji toleransi glukosa oral (UTGO), yaitu suatu analisis kuantitatif yang bertujuan mengukur kemampuan sel-sel individu untuk pengambilan dan memetabolisme glukosa setelah suatu dosis glukosa oral diberikan (Kacsoh, 2000).
digambarkan pada suatu kurva hubungan kadar glukosa plasma dengan masa (Masharani dan Karam, 2001).
H. Landasan Teori
Diabetes Melitus merupakan suatu penyakit atau gangguan metabolisme kronis dengan multi etiologi yang ditandai dengan tingginya kadar gula darah (hiperglikemia) disertai dengan gangguan metabolisme karbohidrat, lipid dan protein sebagai akibat insufisiensi fungsi insulin (WHO, 1999). Dari hasil penelitian Puteri dan Kawabata (2010) yang menyatakan bahwa senyawa hasil isolasi ekstrak metanol-air daun M.tanarius menghasilkan senyawa inhibitor α
-glikosidase. Hasil penelitian Handayani (2011) menyatakan bahwa ekstrak metanol-air daun M.tanarius dosis 0,44g/kgBB mempunyai efek menurunkan kadar glukosa darah pada tikus jantan terbebani glukosa dibandingkan dosis lain yang lebih tinggi.
Metformin merupakan obat hiperglikemi oral golongan biguanid yang masih biasa digunakan pada saat ini. Golongan ini bekerja dengan meningkatkan sensitivitas insulin pada hati dan jaringan perifer, sehingga meningkatkan ambilan glukosa (Triplitt dkk, 2005). Pada penelitian ini digunanakan dosis metformin sebesar 76,5 mg/KgBB.
Pada penelitian ini menggunakan dosis ekstrak metanol-air daun M.tanarius
dengan dosis kurang dari 0,44 g/kgBB dengan kontrol positif metformin.
I. Hipotesis
Ekstrak metanol-air daunM.tanariusmemiliki efek penurunan glukosa darah
28
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian tentang potensi penurunan kadar glukosa darah ekstrak metanol-air daun M.tanarius terhadap metformin pada tikus putih jantan galur Wistar
terbebani glukosa merupakan jenis penelitian eksperimental murni dengan menggunakan rancangan acak lengkap pola searah.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel utama 1) Variabel bebas
Variabel bebas dari penelitian ini adalah ekstrak metanol-air daun
M.tanarius.
2) Variabel tergantung
b. Variabel Pengacau 1. Variabel pengacau
Variabel pengacau terkendali dalam penelitian ini adalah jenis kelamin hewan uji, galur hewan uji, umur, berat badan dari hewan uji. Hewan uji yang digunakan adalah tikus putih jantan galur Wistar dengan berat badan 200-300 g dan umurnya 2-3 bulan, jalur pemberian ekstrak metanol-air dilakukan secara peroral, jalur pemberian rangsang diabetes secara peroral.
2. Variabel pengacau tak terkendali
Variabel pengacau tak terkendali dalam penelitian ini adalah keadaan patofisiologis hewan uji yang digunakan, kemampuan hewan uji untuk mengabsorbsi ekstrak metanol-air daun M.tanarius, serta kemampuan hewan
untuk beradaptasi dengan diabetes melitus.
2. Definisi operasional
a. Daun M. tanarius adalah daun yang diambil dari tanaman M. tanarius,
memiliki daun yang berwarna hijau, tidak berlubang dan segar.
b. Ekstrak metanol-air daunM. tanariusberupa ekstrak kental yang diperoleh
dengan mengekstraksi serbuk kering daun M. tanarius seberat 10 g yang dilarutkan dalam 100 ml pelarut metanol 50% secara maserasi selama 72 jam. Kemudian disaring dengan kertas saring dan diuapkan di oven selama 24 jam.
c. Larutan ekstrak metanol-air daunM. tanarius pekat adalah larutan dengan
d. LDDK0-240 kadar glukosa dalam darah adalah besaran yang menggunakan kadar glukosa dalam darah pada rentang waktu mulai menit 0 samapi menit ke-240 yang dihitung dengan metode trapezoid.
e. Dosis ekstrak metanol-air daun M. tanariusadalah sejumlah berat ekstrak
metanol-air daun M. tanarius tiap satuan berat badan hewan uji dengan satuan
mg/kgBB.
f. Efek penurunan glukosa darah adalah kemampuan zat untuk mengurangi kadar glukosa dalam darah akibat terbebani glukosa.
C. Bahan dan Alat Penelitian 1. Bahan penelitian
a. Hewan uji
Hewan uji yang digunakan berupa tikus jantan galur Wistar dengan umur 2-3 bulan dan berat badan 200 hingga 250 g yang diperoleh dari Laboratorium Imono Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
b. Bahan Uji
Daun M. tanarius yang diperoleh dari Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta pada Agustus 2011.
c. Senyawa Pembanding
d. Pereaksi untuk pengukuran kadar glukosa darah
Pereaksi yang digunakan adalah enzim Glucose GOD FS*(DiaSys,Germany) yang komposisinya terdiri atas:
Tabel I. Isi pereaksi enzimGlucoseGOD-PAP Reagen :
Phosphat buffer pH 7,5 250 mmol/l
Phenol 5 mmol/l
4-aminoantipyrine 0,5 mmol/l
Glukosa oksidase (GOD) ≥10 kU/l
Phenol Amino Antipirin
Peroksidase (PAP) ≤1 kU/l
Glukosa standar 100mg/dl (5,5 mmol/dl)
e. Lain- lain
1) Aquadest sebagai cairan pelarut untuk pembuatan CMC 1% yang diperoleh dari Laboratorium Farmakologi Toksikologi Fakultas Farmasi Universitas Sanata Dharma.
2) Glukosa monohidrat p.a (Merck) dengan dosis 1,75 g/kgBB sebagai larutan untuk uji toleransi glukosa oral yang diperoleh dari Laboratorium Biokimia Fakultas Farmasi Universitas Sanata Dharma. 3) Parafin cair sebagai pelancar aliran darah dalam pengambilan sampel
darah dari hewan uji, yang diperoleh dari Laboratorium Biofarmasetika dan Bioanalisis Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Alat penelitian
1) Seperangkat alat gelas (Beaker glass, labu takar, gelas ukur, pengaduk) merk Pyrex
2) Mortir dan stamper 3) Jarum Suntik 4) Mikropipet
5) Sentrifuge (Centurion Scientific)
6) Micro vitalab(Microlab 200, Merck),blue tipe, dan yellow tipe
7) Alat timbang elektrik (Mettler Toledo AB 204,Switzerland)
8) Vortex (GENIE, Merck) 9) Mesin penyerbuk
10) Stopwatch(Olympic)
D. Tata Cara Penelitian
1. Determinasi tanaman
Tanaman M.tanarius yang digunakan dalam penelitian ini telah
dideterminasi dengan cara mencocokkan ciri-ciri tanaman yang ada dengan buku acuan (Backer dan Van Den Brink, 1963) hingga ke tingkat spesies. Determinasi dilakukan oleh Bapak Yohanes Dwiatmaka, M.Si, Dosen Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta.
2. Pengumpulan bahan
yang dipetik hanya berasal dari Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma pada Agustus 2011.
3. Pembuatan simplisia
Daun M.tanarius yang telah dipetik, dicuci dengan air mengalir, kemudian
ditiriskan dengan sinar matahari, untuk meniadakan air pada daun. Setelah kering, daun dimasukkan ke dalam ovendengan suhu 40-50°C selama 24 jam
dan daun yang sudah kering kemudian diserbuk menggunakan mesin penyerbuk di Laboratorium Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma. Kemudian serbuk simplisia diayak dengan ayakan no. 40.
4. Pembuatan ekstrak metanol-air daunM.tanarius
Seberat 10 g serbuk kering daun M.tanarius dilarutkan dengan 100 ml metanol 50% pada erlenmeyer bersumbat. Kemudian diektraksi secara maserasi selama 72 jam. Setelah 72 jam saring larutan hasil maserasi tadi pada cawan porselen menggunakan kertas saring. Kemudian diuapkan di oven
dengan suhu 40°C selama 24 jam hingga diperoleh bobot tetap ekstrak.
5. Penetapan konsentrasi pekat ekstrak metanol-air daunM.tanarius Ekstrak metanol-air daun M.tanarius yang kental dihitung rata-rata
rendemennya dari ke-6 replikasi yang telah dibuat.
Rendemen tiap replikasi = Berat can ekstrak kental − Berat cawan kosong
Rata − rata rendemen = Rep. 1 + Rep. 2 + Rep. 3 + Rep. 4 + Rep. 5 + Rep. 6 6
dibuat dan dapat dimasukkan serta dikeluarkan dari spuit oral 1 ml adalah dengan cara melarutkan ekstrak percawannya yaitu 1,92 g dalam labu ukur terkecil dengan pelarut yang sesuai yaitu CMC Na 1%. Labu ukur terkecil yang tersedia yaitu labu ukur 5 ml sehingga dapat ditetapkan konsentrasi ekstrak metanol-air dari daunM.tanariussebesar 0,384 atau 38,4%
6. Pembuatan larutan CMC 1%
Timbang serbuk CMC sebanyak 0,1 g dilarutkan dengan aquadest hangat sampai 10 ml dalam labu takar, kemudian diaduk hingga diperoleh larutan yang homogen.
7. Penentuan keseragaman bobot tablet Metformin
Penentuan keseragaman bobot kaplet glibenklamida mengacu pada Depkes 1979. Timbang 20 tablet, hitung bobot tablet. Jika ditimbang satu-satu, tidak boleh lebih dari 2 tablet yang masing-masing bobotnya menyimpang dari bobot rata-ratanya lebih besar dari harga yang ditetapkan kolom A, dan tidak satu tablet pun menyimpang dari bobot rata-ratanya lebih dari harga yang ditetapkan kolom B. Nilai penyimpangan bobot rata-rata kolom A dan B dapat dilihat pada tabel II
Tabel II. Keseragaman bobot tablet
Bobot Rata-Rata Penyimpangan bobot rata-rata dalam %
A B
25 mg atau kurang 15% 30%
26 mg sampai dengan 150 mg 10% 20%
151 mg sampai dengan 300 mg 7,5% 15%
8. Penentuan dosis Metformin
Dosis metformin yaitu 850 mg pada manusia dengan berat badan 70 kg, dikonversikan ke tikus 200 g dengan faktor konversi 0,018.
850 mg metformin x 0,018 = 15,3 mg metformin/200 g = 76,5 mg metformin/kgBB
Berdasarkan perhitungan maka besarnya dosis metformin pada hewan uji tikus yaitu 76,5 mg/ kgBB
9. Pembuatan larutan Metformin 19,125 mg/ml
Timbang serbuk metformin setara dengan 850,0 mg metformin murni, larutkan dengan CMC 1% dalam labu takar 10 ml sampai tanda sebagai larutan induk metformin. Buat dengan konsentrasi 19,125 mg/ml dalam labu takar 10 ml dari larutan induk metformin tersebut.
10.Validasi dan reliabilitas instrument penelitian
Hasil pengukuran yang baik dari suatu parameter kuantitas kimia, dapat dilihat dari tingkat presisi dan akurasi yang dihasilkan. Akurasi menunjukkan kedekatan nilai hasil pengukuran dengan nilai sebenarnya. Presisi menunjukkan tingkat reliabilitas dari data yang diperoleh, hal ini dapat dilihat dari standar deviasi yang diperoleh dari pengukuran.
dari hasil pengukuran kadar secara berulang menunjukkan kedekatan nilai hasil pengukuran dengan nilai sebenarnya. Hal ini menunjukkan bahwa alat memenuhi akurasi yang baik.
11.Pembuatan larutan stok glukosa p.a 15% b/v
Glukosa monohidrat p.a. ditimbang sebanyak 15,0 g dan dilarutkan dengan aquadest dalam labu takar 100 ml sampai tanda.
12.Penetapan dosis ekstrak metanol-air daunM.tanarius
Dalam penelitian ini, ekstrak metanol-air daun M.tanarius dibuat dalam
tiga peringkat dosis, yaitu 0,11; 0,22; dan 0,44 g/Kg BB.
Pemilihan dosis ini berdasarkan penelitian Handayani (2012) dimana dosis paling efektif ekstrak metanol-air daun M.tanarius adalah 0,44 g/KgBB
dibanding dosis lain yang lebih tinggi, sehingga peneliti ingin mengetahui efek hipoglikemik ekstrak metanol-air daun M.tanarius dengan dosis yang lebih
rendah dengan kontrol pembanding yang berbeda.
13.Penetapan waktu pemberian metformin
kedua. Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 15% b/v; 1,75 g/kgBB. Pengambilan cuplikan darah dilakukan sesaat sebelum perlakuan sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 120, dan 240 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDKK0-240.
14.Penetapan waktu pemberian ekstrak metanol-air daunM.tanarius Penetapan waktu pemberian ekstrak metanol-air M.tanarius digunakan
untuk melihat pengaruh waktu pemberian terhadap efek penurunan kadar glukosa darah, agar pada saat dilakukan UTGO ekstrak metanol-air M.tanarius
sudah memberikan efek dalam merurunkan kadar glukosa darah. Orientasi ini menggunakan 6 ekor tikus yang terbagi dalam 2 kelompok yang masing-masing diberi ekstrak metanol-air M.tanariuspada menit ke-0 dan 15 sebelum
UTGO. Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 15% b/v; 1,75 g/kgBB. Pengambilan cuplikan darah dilakukan sesaat sebelum perlakuan sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 180, dan 240 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDKK0-240. Penentuan waktu pemberian ekstrak metanol-air daun M.tanarius didasarkan
15.Penyiapan hewan uji
Hewan uji yang dibutuhkan adalah 40 ekor tikus jantan galur Wistar, umur 2-3 bulan, berat badan 150-300 g. Hewan uji dibagi secara acak menjadi 2 kelompok. Kelompok untuk uji pendahuluan sebanyak 15 ekor dan kelompok perlakuan sebanyak 25 ekor. Sebelum digunakan, hewan uji dipuasakan selama 12-18 jam tanpa menghentikan pemberian minum. Kelompok perlakuan terdiri dari 5 kelompok yang masing-masing terdiri dari 5 ekor.
16.Pengelompokan dan perlakuan hewan uji
Penelitian ini mengikuti rancangan acak lengkap pola searah, yang mana 25 ekor tikus dibagi secara acak menjadi 5 kelompok, masing-masing kelompok terdiri dari 5 ekor. Tiap hewan uji diadaptasikan dengan kondisi yang sama, jauh dari kebisingan dan dihindarkan dari stress. Sebelum mendapat perlakuan, masing-masing kelompok dipuasakan selama 12-18 jam dengan tetap diberi minum, lalu diberi perlakuan sebagai berikut:
a. Kelompok I
Larutan CMC 1% b/v 5ml/KgBB (Kelompok kontrol negatif) b. Kelompok II
Larutan metformin 76,5mg/KgBB (Kelompok kontrol positif) c. Kelompok III
Ekstrak metanol-air daunM.tanariusdosis 0,11 g/KgBB
d. Kelompok IV
e. Kelompok V
Ekstrak metanol-air daunM.tanariusdosis 0,44 g/KgBB
Semua pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa monohidrat 15% b/v; 1,75 g/kgBB. Pengambilan cuplikan darah dilakukan sesaat sebelum UTGO sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 180, dan 240 setelah UTGO. Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat kurva UTGO dan perhitungan harga LDDK0-240
17.Penetapan kadar glukosa darah
Kadar glukosa darah ditetapkan dengan metode GOD-PAP. Pada tiap kelompok dilakukan pengambilan cuplikan darah sebanyak 0,5 ml melalui vena
lateralis ekor dan ditampung dalam efendrof. Kemudian darah ini dipusingkan 3000 rpm selama 10 menit. Selanjutnya diambil 10 µl plasma darah, kemudian dilakukan pengukuran seperti dalam tabel III.
Tabel III. Volume pengukuran kadar glukosa darah
Bahan Sampel (µl) Standar (µl) Blangko (µl)
Supernatan 10 -
-Larutan baku glukosa - 10
-Akuabides - - 10
Pereaksi GOD-PAP 1000 1000 1000
Bahan-bahan tersebut dicampur dan diinkubasi selama operating time.
Kemudian aktivitas serum diukur dengan Microlab-200 pada panjang gelombang 546nm.
Selanjutnya dibuat kurva dengan mem-plot-kan nilai kadar glukosa darah
LDDKt0-tn : ( + 1)+ ( + − 1)
Keterangan:
t : waktu (jam-1/menit-1)
C : konsentrasi zat dalam darah (mg/ml)
LDDKt0-tn : luas daerah dibawah kurva dari waktu ke-0 sampai ke-n
E. Tata Cara Analisis Hasil
Dari harga kadar glukosa darah dilakukan uji distribusi menggunakan uji
Kolmogorov Smirnov kemudian jika distribusinya normal dilanjutkan dengan
analisis Anova One Way dan post hoc tests Scheffe dengan tingkat kepercayaan
95%. Jika nilai kadar glukosa darah mempunyai variansi yang berbeda maka dilakukan uji Kruskal Wallis dan dilanjutkan uji Mann Whitney dengan tingkat
41
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Bahan yang digunakan dalam penelitian ini adalah serbuk daun
M.tanarius. Sebelum daun M.tanarius ini digunakan dalam pengujian efek
penurunan kadar glukosa darah maka diperlukan determinasi tanaman untuk memastikan bahwa tanaman yang digunakan adalah benar-benar tanaman
M.tanarius, yang biasa dikenal oleh sebagian masyarakat Indonesia sebagai
tanaman Senu yang biasa dimanfaatkan sebagai pakan ternak hewan. Bagian tanaman yang digunakan dalam determinasi adalah bagian batang, daun, biji dan bunga.
Determinasi dilakukan sesuai dengan buku acuan hingga katagori jenis (species) untuk membuktikan bahwa batang, daun, biji dan bunga yang
dideterminasi adalah benar M.tanarius. Berdasarkan hasil determinasi tersebut
maka terbukti bahwa tanaman yang diuji ini benar merupakan tanaman
Macaranga tanariusL.
B. Hasil Pembuatan Ekstrak Metanol-air DaunM.tanarius
Ekstrak metanol-air daun M.tanarius dibuat dengan cara menyari serbuk
kering daun M.tanarius secara maserasi. Pemilihan ekstrak metanol-air dalam
(2006) yang hanya menggunakan ekstrak metanol. Pemilihan metode maserasi disebabkan metode penyarian ini sederhana, mudah, dan efisien. Hal lain yang menjadi dasar adalah senyawa yang diduga terlarut lebih banyak sehingga kadarnya akan menjadi lebih besar. Dan karena belum diketahui apakah senyawa yang diduga larut dapat tahan terhadap pemanasan atau tidak, maka digunakan metode maserasi ini.
Sebelum dilakukan ekstraksi, dilakukan penyerbukan daun M.tanarius
terlebih dahulu. Hal ini ditujukan supaya kandungan fitokimia yang terkandung dalam daun M.tanarius lebih mudah terekstrak karena luas permukaan serbuk
yang kontak dengan pelarut semakin besar. Serbuk daun M. tanarius seberat 10
C. Uji Pendahuluan
Sebelum dilakukan perlakuan uji antidiabetes dari ekstrak metanol-air daun M.tanarius, maka dilakukan serangkaian uji pendahuluan terlebih dahulu.
Uji pendahuluan dilakukan untuk menetapkan hal-hal yang akan dilakukan pada pengujian yang sebenarnya. Uji pendahuluan yang dilakukan meliputi penetapan waktu pemberian metformin dan penetapan waktu pemberian dosis ekstrak metanol air daun M.tanarius. Selain itu, dilakukan pula penetapan dosis ekstrak metanol-air daunM.tanariusyang akan diujikan dalam penelitian ini.
1. Orientasi penetapan waktu pemberian metformin
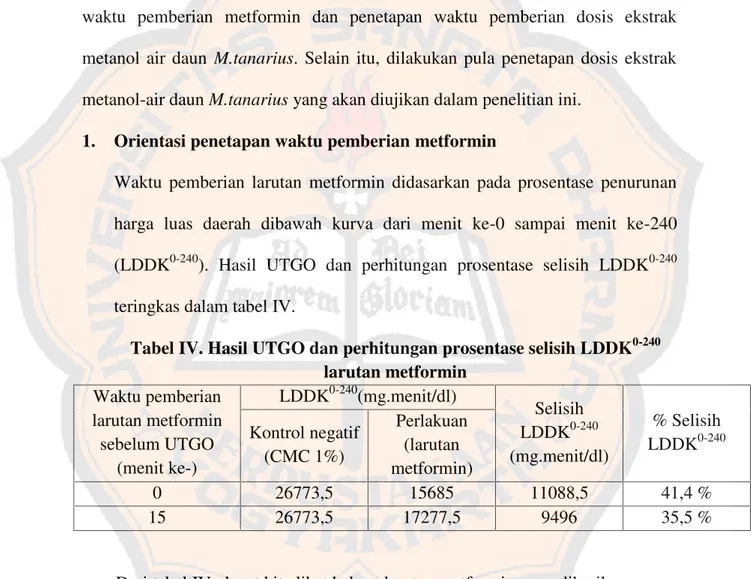
Waktu pemberian larutan metformin didasarkan pada prosentase penurunan harga luas daerah dibawah kurva dari menit ke-0 sampai menit ke-240 (LDDK0-240). Hasil UTGO dan perhitungan prosentase selisih LDDK0-240 teringkas dalam tabel IV.
Tabel IV. Hasil UTGO dan perhitungan prosentase selisih LDDK0-240 larutan metformin
0 26773,5 15685 11088,5 41,4 %
15 26773,5 17277,5 9496 35,5 %
daunM.tanarius yang paling efekt menit ke-0. Jika di
us yang digunakan yaitu 0 menit sebelum UTG
dilihat pada gambar 3.
. Diagram penentuan selang waktu pemberian terhadap LDDK
3 diatas dapat diamati bahwa pada menit ke prosentase selisih LDDK0-240yang paling besar t
menit ke-15. Pada menit ke-0 inilah metformin a kemampuan untuk menurunkan kadar glukosa ngkan dengan menit yang lainnya. Jadi, kemam
fektif dalam menurunkan kadar glukosa dar ka dibandingkan dengan menit ke-15, kemampua
darah tidak berbeda banyak dengan menit ke memberikan nilai LDDK0-240 yang lebih kecil di
a digunakan menit ke-0 dalam perlakuan kontrol
2. Orientasi penetapan waktu pemberian ekstrak metanol-air daun M.tanarius
Waktu pemberian ekstrak metanol-air daun M.tanarius didasarkan pada
prosentase penurunan harga luas luas daerah di bawah kurva dari menit ke-0 sampai menit ke-240 (LDDK0-240). Hasil UTGO dan perhitungan prosentase selisih LDDK0-240teringkas pada tabel V.
Tabel V. Nilai LDDK0-240ekstrak metanol-air daunM.tanariussebelum UTGO
Waktu Pemberian Ekstrak Metanol-Air Daun
M.tanariusSebelum UTGO (Menit ke-)
LDDK0-240 (mg.menit/dl)
0 23680
15 29947,5
Dari tabel V, dapat kita lihat bahwa ekstrak metanol-air daun M.tanarius
yang diberikan secara peroral pada menit ke-0 sebelum UTGO memberikan harga LDDK0-240 sebesar 23680 yang nilainya paling kecil dibandingkan pemberian pada menit yang lain sehingga ditetapkan pemberian ekstrak metanol-air daun M.tanarius yang digunakan yaitu 0 menit sebelum UTGO.
Gambar 4. D me Pada gambar 4 ekstrak metanol-paling kecil diba ekstrak metanol kontrol negatif diberi
0
4. Diagram penentuan selang waktu pemberi metanol-air daunM.tanariusterhadap LDDK
4 diatas dapat diamati bahwa pada menit ke nol-air daun M.tanarius memberikan nilai L
dibandingkan menit-menit lainnya. Pada me nol-air daun M.tanarius telah mencapai ons
untuk menurunkan kadar glukosa darah dengan yang lainnya. Berdasarkan data berian ekstrak metanol-air daun M. Tanarius
sebelum UTGO.
nan Kadar Glukosa Ekstrak Metanol-Air Dau litian ini dilakukan penetapan kadar glukosa beri larutan CMC 1%; kontrol positif diberi lar ukosa darah dengan
larutan metformin
dengan dosis 76,5mg/kgBB; dan tiga kelompok perlakuan yaitu kelompok I-III diberi ekstrak metanol-air daunM.tanariusdosis 0,11; 0,22; dan 0,430 g/KgBB.
Kadar glukosa darah diukur menggunakan alat mikro-vitalab. Dimana prinsip kerja alat ini adalah mengukur serapan dari larutan standar yang nanti akan diproyeksikan dalam satuan kadar glukosa darah pada umumnya. Sebelum melakukan pengukuran resapan sampel, terlebih dahulu dilakukan pengukuran resapan dari standar glukosa. Perhitungan kadar glukosa dilakukan berdasarkan perbandingan relatif antara resapan standar dengan resapan perlakuan.
Selanjutnya grafik hubungan antara kadar glukosa darah dan waktu sampling dari tiap-tiap kelompok perlakuan yaitu larutan CMC 1%, larutan metformin, dan ekstrak metanol-air daunM.tanariusdapat dilihat pada gambar 5.
Gambar 5. Kurva hubungan antara waktu sampling dan kadar rata-rata glukosa darah akibat pemberian CMC, metformin, dan ekstrak
Gambar 5 memaparkan respon kadar glukosa darah hewan uji akibat pembebanan glukosa saat UTGO pada berbagai perlakuan. Pada kelompok kontrol negatif larutan CMC 1% menunjukkan rata-rata kadar glukosa paling tinggi dibandingkan perlakuan lainnya. Hal ini dikarenakan pada kontrol negatif CMC, tikus hanya diberi larutan CMC 1% yang tidak memiliki efek terapetik, sehingga kadar glukosa darah ditentukan oleh kemampuan tubuh tikus sendiri untuk menurunkan kadar glukosa tanpa adanya penambahan obat ataupun ekstrak metanol-air daun M.tanarius. Ini terlihat dari rerata nilai LDDK0-240 kontrol
negatif sebesar 26773,5 mg.menit/dL (Tabel. IV).
Hasil percobaan menunjukkan bahwa kadar glukosa darah mencapai maksimum pada menit ke-30 sampai menit ke-60, kemudian kadar glukosa darah menurun kembali setelah dua sampai tiga jam setelah pemberian glukosa oral. Hal ini sesuai dengan teori Mayes dkk. (2000) dimana kadar glukosa darah pada individu normal meningkat dalam satu jam setelah pemberian glukosa oral. Absorpsi glukosa menjadi normal kembali setelah dua sampai tiga jam setelah pemberian glukosa. Hal ini berarti bahwa tubuh hewan uji tersebut berada dalam keadaan sehat karena masih dapat mentoleransi pembebanan glukosa UTGO pada tingkat normal.
Dari kelompok perlakuan I sampai III, ternyata kelompok perlakuan III dengan dosis 0,44 g/kgBB dapat memberikan penurunan kadar glukosa darah yang paling baik dibandingkan perlakuan dengan ekstrak metanol-air daun
M.tanariuslainnya. Hal ini terlihat dari nilai LDDK0-240kelompok tersebut paling
kecil dari nilai LDDK0-240 perlakuan ekstrak metanol-air daunM.tanariuslainnya
(I dan II). Perlakuan ekstrak metanol-air daun M.tanarius lain hampir sama
nilainya satu sama lain, hanya mempunyai selisih sedikit antara perlakuan satu dengan yang lainnya.
Kemampuan ekstrak metanol-air daun M.tanarius dalam menurunkan
Tabel VI. Persen perbedaan rerata LDDK0-240masing-masing kelompok
Kontrol Negatif CMC 26773,5 ± 1636,0 -
-Kontrol Positif Metformin 16333,5 ± 487,38 -63,9 100
Perlakuan I 22954,5 ± 1052,5 -16,6 71,2
Perlakuan II 22747,5 ± 898,88 -17,7 71,9
Perlakuan III 21201 ± 494,14 -26,3 77,0
Keterangan:
Kontrol negatif : CMC 1 %
Kontrol positif : metformin dosis 76,5 mg/kgBB
Perlakuan I : ekstrak metanol-air daunM.tanariusdosis 0,11 g/kgBB Perlakuan II : ekstrak metanol-air daunM.tanariusdosis 0,22 g/kgBB
Perlakuan III : ekstrak metanol-air daunM.tanariusdosis 0,44 g/kgBB
Pada tabel diatas menunjukkan adanya perbedaan antara semua kelompok perlakuan bila dibandingkan dengan kontrol negatif CMC. Perbedaan kelompok perlakuan I, II, dan III dengan kontrol negatif CMC 1% secara berturut-turut adalah 16,3; 17,7; dan 26,3. Perbedaan yang paling besar terlihat pada kontrol positif dengan pemberian metformin dibandingkan dengan kontrol negatif CMC 1% yaitu sebesar 63,9%, sedangkan pada kelompok perlakuan penurunan paling besar terjadi pada perlakuan III dosis 0,44 g/kgBB.
Dari harga LDDK0-240 darah dilakukan uji distribusi menggunakan uji
Kolmogorov Smirnov kemudian jika distribusinya normal dilanjutkan dengan analisis Anova One Way dan post hoc tests Scheffe dengan tingkat kepercayaan
dilakukan uji Kruskal Wallis dan dilanjutkan uji Mann Whitney dengan tingkat
kepercayaan 95% untuk mengetahui perbedaan masing-masing kelompok.
Pada uji distribusi menggunakan Kolmogorov Smirnov didapat bahwa
distribusi data LDDK0-240dari masing-masing perlakuan adalah normal. Normalitas data LDDK0-240 memberikan nilai p > 0,005. Sebelum dilajutkan dengan ujiOne Way Anova, perlu diketahui homogenitas variansi data LDDK0-240.
Hal ini dilakukan karena syarat dari uji One Way Anova adalah data yang terdisribusi normal dan variansi data yang sama. Nilai p dari LDDK0-240 adalah lebih dari 0,05 yaitu 0,118. Berdasarkan hasil tersebut dapat dikatakan bahwa nilai variansi antar kelompok data yang dibandingkan tidak ada perbedaan atau dengan kata lain data tersebut memiliki variansi yang sama sehingga dapat dilanjutkan dengan analisisOne Way Anova.
Pada uji One Way Anovadidapat nilai p dari data LDDK0-240 adalah 0,000
yang artinya adanya perbedaan yang bermakna yang terdapat dalam kelompok perlakuan. Untuk dapat mengetahui perbedaan yang terjadi dalam tiap kelompok, hasil uji One Way Anova ini dilanjutkan dengan uji Scheffe untuk melihat di
Tabel VII. Hasil ujiScheffeLDDK0-240glukosa darah tikus jantan terbebani glukosa pada masing-masing perlakuan
Perlakuan 1 2 3 4 5
1 : kontrol negatif CMC 1%
2 : kontrol positif metformin dosis 76,5 mg/KgBB
3 : ekstrak metanol-air daunM.tanariusdosis 0,11 g/KgBB 4 : ekstrak metanol-air daunM.tanariusdosis 0,22 g/KgBB
5 : ekstrak metanol-air daunM.tanariusdosis 0,44 g/KgBB
Hasil uji Scheffe LDDK0-240 glukosa darah pada tabel VII menunjukan perbedaan yang bermakna antara kelompok negatif CMC 1% terhadap kontrol positif metformin dan kelompok ekstrak metanol-air daun M.tanariusdosis 0,44
g/KgBB. Hal ini berarti kontrol positif metformin dan ekstrak metanol-air daun
M.tanariusdosis 0,44 g/KgBB memberikan efek penurunan glukosa berturut-turut
sebesar 63,9% dan 26,3% jika dibandingkan dengan kontrol negatif CMC 1%. Kelompok perlakuan dosis 0,11 g/KgBB dan 0,22 g/KgBB menunjukkan perbedaan tidak bermakna dibandingkan dengan kontrol negatif CMC 1%. Hal ini berarti bahwa pada ekstrak metanol-air daunM.tanariusdosis 0,11 dan 0,22 g/Kg
BB tidak dapat menurunkan kadar glukosa darah, walaupun rerata LDDK0-240 menunjukkan penurunan glukosa, namun secara statistik menunjukkan penurunan yang terjadi tidak signifikan.
Semua kelompok perlakuan ekstrak metanol-air daun M.tanarius
sebanding dengan kontrol positif metformin. Hal ini terlihat dari perbedaan dosis 0,11; 0,22; dan 0,44 g/KgBB perlakuan ekstrak metanol-air daun M.tanarius
dengan kontrol positif metformin sebesar 71,2; 71,9; dan 77,0%. Lebih kecil dari kontrol positif metformin yang memberikan penurunan kadar glukosa darah sebesar 100%.
Berdasarkan hasil yang didapat, terlihat bahwa pada dosis kecil atau kurang dari 0,44 g/KgBB ekstrak metanol-air daun M.tanarius tidak memberikan efek penurunan kadar glukosa darah, hanya ekstrak metanol-air daun M.tanarius
54
BAB 5
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan data yang telah diperoleh dan analisis yang dilakukan maka dapat disimpulkan bahwa ekstrak metanol-air daunM.tanarius dapat memberikan
efek penurunan glukosa darah pada tikus putih jantan galur Wistar pada dosis 0,44 g/kgBB.
Potensi penurunan kadar glukosa darah ekstrak metanol-air daun
M.tanariusdosis 0,44 g/KgBB sebesar 77,0% terhadap metformin.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut tentang efek dariekstrak metanol-air daun
M.tanariusjika dibandingkan OHO lainnya.
2. Perlu adanya pengukuran kadar glukosa pada waktu 120 menit untuk melihat
kadar glukosa post prandial, dan juga perpanjangan waktu pengamatan kadar