SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Tony Handoyo NIM : 068114056
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
VALIDASI METODE ANALISIS PENETAPAN KADAR CAMPURAN PARASETAMOL DAN IBUPROFEN DENGAN PERBANDINGAN 7:4 MENGGUNAKAN METODE SPEKTROFOTOMETRI ULTRAVIOLET (UV)
APLIKASI METODE DERIVATIF
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Tony Handoyo NIM : 068114056
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
You are my rock, on You i stand
Safe from the storm that surrounds me
You are my only rock, in You i can
Don’t have to rely on my own strength
(Hillsong London)
vii
telah Dia berikan sehingga penulis dapat menyelesaikan skripsi dengan judul: “Validasi Metode Analisis Penetapan Kadar Campuran Parasetamol dan Ibuprofen dengan Perbandingan 7:4 Menggunakan Metode Spektrofotometri Ultraviolet (UV) Aplikasi Metode Derivatif” sebagai salah satu syarat memperoleh gelar Sarjana Farmasi Fakultas Farmasi Universitas Sanata Dharma.
Penulis menyadari bahwa skripsi ini tidaklah mungkin dapat terselesaikan dengan baik tanpa bantuan dan dukungan dari berbagai pihak. Oleh karena itu pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Dekan Fakultas Farmasi Universitas Sanata Dharma, Bapak Ipang Djunarko, M.Sc., Apt. yang telah memperlancar jalannya penelitian.
2. Ibu Christine Patramurti, M.Si., Apt. yang telah bersedia menjadi dosen pembimbing yang begitu perhatian dalam memberikan bimbingan dan juga banyak masukan selama proses pembuatan skripsi ini.
3. Bapak Jeffry Julianus, M.Si. selaku dosen penguji skripsi yang telah memberikan banyak kritik dan saran yang sangat berarti bagi penulis dalam penyusunan skripsi ini.
4. Ibu Dra. M.M. Yetty Tjandrawati, M.Si. selaku dosen penguji skripsi yang telah memberikan banyak kritik dan saran yang sangat berarti bagi penulis dalam penyusunan skripsi ini.
viii
6. Penolong kecilku, Citra Dewi Ariani, terima kasih atas tiap pertolongan yang sadar atau tidak sadar banyak sekali membantuku.
7. Rekan seperjuanganku Andreas Wilasto Anggit “Boim”, terima kasih buat setiap proses skripsi ini yang kita lalui.
8. Teman-teman satu bimbingan, Pungki, Micell, Angel, Yoki, dan Aang, terima kasih buat supportnya.
9. Mas Bimo, Pak Parlan, Mas Kunto, Mas Ottok, Pak Timbul ,dan bapak-ibu karyawan yang telah membantu saya selama proses skripsi ini berlangsung. 10. Teman-teman “Bocah Rolas” buat tawa dan tawa dan tawa lagi yang membuat
semangat itu kembali ada.
11. Teman-teman Squadra viola dari yang tua sampai muda, semoga pertemanan kita tetap terjalin sampai tua.
12. Teman-teman farmasi yang tidak saya bisa sebut satu persatu, terima kasih buat segalanya.
13. Dan semua pihak yang tidak bisa saya sebut satu per satu.
Penulis menyadari penyusunan skripsi ini masih memiliki banyak kekurangan. Untuk itu, penulis mengharapkan adanya masukan saran dan kritik tentang skripsi ini. Semoga skripsi ini bermanfaat bagi perkembangan ilmu kefarmasian dan bagi semua pembaca.
Penulis
x
VALIDASI METODE ANALISIS PENETAPAN KADAR CAMPURAN PARASETAMOL DAN IBUPROFEN DENGAN PERBANDINGAN 7:4 MENGGUNAKAN METODE SPEKTROFOTOMETRI ULTRAVIOLET (UV)
APLIKASI METODE DERIVATIF
INTISARI
Parasetamol dan ibuprofen sebagai zat tunggal dapat ditetapkan kadarnya dengan menggunakan spektrofotometri ultraviolet (UV). Namun, jika parasetamol dan ibuprofen dijadikan sebuah campuran dengan perbandingan 7:4, maka akan menghasilkan spektrum normal yang saling overlapping. Hal ini menyebabkan kadar dari masing-masing senyawa sukar ditetapkan. Oleh karena itu, dalam penelitian ini dilakukan pengembangan spektrofotometri uv aplikasi metode derivatif dimana kadar parasetamol dan ibuprofen dapat ditetapkan meskipun dalam bentuk campuran.
Penelitian ini penelitian noneksperimental dengan rancangan deskriptif. Pada penelitian ini, dilakukan dengan membuat spektrum serapan normal dan derivatif masing-masing senyawa, kemudian ditentukan daerah zero crossing kedua senyawa yang dilihat dari spektrum derivatifnya. Spektrum derivatif merupakan plot dA/dλ terhadap λ. Untuk menentukan kevalidan metode, digunakan parameter seperti, akurasi, presisi, linearitas, dan spesifisitas.
Hasil penilitian didapatkan panjang gelombang zero crossing untuk parasetamol di 261,5 nm dan ibuprofen di 227 nm. Nilai koefisien korelasi (r) dari kurva baku parasetamol sebesar -0,9996 sedangkan ibuprofen sebesar –0,9979. Rentang nilai recovery dari parasetamol adalah 99,14-100,86% sedangkan untuk ibuprofen adalah 97,98-103,53%. Nilai CV dari parasetamol sebesar 0,575% dan untuk nilai CV dari ibuprofen sebesar 0,995%. Maka dapat disimpulkan metode ini memiliki akurasi, presisi, linearitas, dan spesifisitas yang baik.
xi
APPLICATION DERIVATIVE OF METHODS
Abstract
Paracetamol and ibuprofen as a single substance can be set levels by using ultraviolet (UV). However, if paracetamol and ibuprofen are used as a mixture with a ratio of 7:4, it will produce the normal spectrum are overlapping each other. This causes the concentration of each compound is difficult to determine. Therefore, in this research is to develop methods of application of derivative UV spectrophotometry where the concentration of paracetamol and ibuprofen may be set even in mixture.
This research is descriptive research design noneksperimental. In this study, done by making the normal and derivative absorption spectra of each compound, later determined the second zero crossing is seen from the spectrum of compound derivatives. Derivative spectrum is a plot of dA / dλ for λ. To determine the validity of the method, used parameters such as accuracy, precision, linearity, and specificity.
Research results obtained zero crossing wavelengths of 261.5 nm for paracetamol and ibuprofen at 227 nm respectively. Correlation coefficient (r) of standard curves for paracetamol ibuprofen while registration -0.9979 -0.9996. The range of recovery values were 99.14-100.86%, whereas paracetamol to ibuprofen is 97.98-103.53%. CV values of 0575% of paracetamol and ibuprofen for the value of CV of 0995%. So we can conclude this method has an accuracy, precision, linearity, and good specificity.
xii DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING. ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ...vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... x
ABSTRACT... ... xi
DAFTAR ISI... ... xii
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN. ... xvii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian Penelitian ... 3
3. Manfaat Penelitian ... 3
B. Tujuan Penelitian ... 4
BAB II. PENELAAHAN PUSTAKA... 5
xiii
E. Validasi Metode ... 13
1. Spesifisitas ... 13
2. Linearitas ... 14
3. Akurasi ... 14
4. Presisi ... 14
5. LOD dan LOQ ... 15
F. Landasan Teori ... 16
G. Hipotesis ... 17
BAB III. METODOLOGI PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel ... 18
C. Definisi Operasional ... 18
D. Bahan Penelitian ... 19
E. Alat yang Digunakan ... 19
F. Tata Cara Penelitian ... 19
1. Pembuatan Larutan Baku Parasetamol ... 19
2. Pembuatan Larutan Baku Ibuprofen ... 20
3. Penentuan Spektrum Masing-masing Senyawa ... 20
4. Penentuan Panjang Gelombang Zero Crossing ... 20
xiv
6. Penetapan Kadar Parasetamol dan Ibuprofen dalam Campuran ... 21
G. Analisis Hasil ... 22
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 24
A. Pembuatan Larutan Baku Parasetamol dan Ibuprofen ... 24
B. Penentuan Spektrum Senyawa ... 25
C. Penentuan Panjang Gelombang Zero Crossing ... 29
D. Pembuatan Kurva Baku ... 31
E. Penetapan Kadar Sampel ... 33
F. Analisis Parameter Validasi ... 37
1. Spesifisitas ... 37
2. Linearitas ... 38
3. Akurasi ... 39
4. Presisi ... 39
BAB V. KESIMPULAN DAN SARAN ... 40
A. Kesimpulan ... 40
B. Saran ... 40
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 43
xv
Tabel III. Parameter Validasi Metode ... 16
Tabel IV. Data Kurva Baku Parasetamol ... 32
Tabel V. Data Kurva Baku Ibuprofen ... 32
xvi
DAFTAR GAMBAR
Gambar 1. Rumus Bangun Parasetamol ... 5
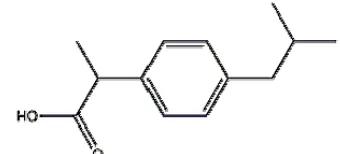
Gambar 2. Rumus Bangun Ibuprofen ... 6
Gambar 3. Diagram Tingkat Energi Elektronik ... 8
Gambar 4. Gugus Kromofor dan Auksokrom pada Parasetamol ... 26
Gambar 5. Gugus Kromofor pada Ibuprofen... 26
Gambar 6. Spektrum Serapan Normal Ibuprofen ... 27
Gambar 7. Spektrum Serapan Normal Parasetamol ... 27
Gambar 8. Spektrum Serapan normal Ibuprofen dan Parasetamol ... 28
Gambar 9. Spektrum Derivatif Pertama dari Parasetamol dan Ibuprofen ... 30
Gambar 10. Spektrum Derivatif Kedua dari Ibuprofen dan Parasetamol ... 31
Gambar 11. Spektrum Normal Senyawa Campuran ... 33
Gambar 12. Spektrum Gabungan Sampel dan Baku pada Serapan Normal ... 34
Gambar 13. Spektrum Gabungan Sampel dan Baku pada Derivate Pertama ... 36
xvii
Lampiran 3. Data Penimbangan Bahan ... 45
Lampiran 4. Contoh Perhitungan Kadar Larutan Baku Parasetamol ... 46
Lampiran 5. Contoh Perhitungan Kadar Larutan Baku Ibuprofen ... 48
Lampiran 6. Contoh Perhitungan Derivatif ... 50
Lampiran 7. Data Perhitungan Kadar Parasetamol dan Ibuprofen ... 54
1
BAB I
PENGANTAR
A. Latar Belakang Penelitian
Obat-obat yang beredar di pasaran pada saat ini, tersedia dengan berbagai bentuk sediaan antara lain berupa tablet, kaplet, kapsul, dan larutan. Beberapa produk obat yang beredar di pasaran tersebut ada yang mengandung satu macam zat aktif tapi ada juga yang mengandung lebih dari satu macam zat aktif. Tujuan dipakainya lebih dari satu macam zat aktif diharapkan antar zat aktif saling mendukung untuk memberikan efek terapetik yang lebih baik. Salah satu contoh obat yang memiliki dua macam zat aktif sekaligus adalah tablet obat analgesik-antipiretik yang mengandung parasetamol dan ibuprofen dengan komposisi parasetamol (350 mg) dan ibuprofen (200 mg). Dari segi efek terapetik sediaan obat dengan dua macam zat aktif akan lebih menguntungkan. Tetapi dari segi penetapan kadarnya justru akan lebih susah dikarenakan zat aktif yang diteliti tidak hanya satu. Padahal untuk menjamin kualitas obat perlu diketahui kesesuaian komposisi dari kandungan-kandungan yang ada di dalam obat. Komposisi yang ada di dalam obat harus sesuai dengan ketentuan yang berlaku misalnya ketentuan dari farmakope. Oleh karena itu diperlukan sebuah metode penetapan kadar yang dapat menetapkan beberapa macam zat aktif sekaligus.
senyawa tunggal. Namun telah dikembangkan analisis spektrofotometri multikomponen yaitu spektrofotometri UV derivatif. Pada metode spektrofotometri UV derivatif, spektrum didapatkan dengan membuat kurva hubungan antara derivatif serapan (dnA/dλn) terhadap panjang gelombang (λ). Hal ini dimaksudkan supaya mendapatkan spektrum yang lebih tajam dari spektrum normalnya, sehingga diharapkan ditemukan panjang gelombang yang nilai absorbansinya spesifik untuk satu analit saja dan nilai absorbansi analit lainnya bernilai nol, atau biasa disebut panjang gelombang zero crossing. Dengan pengembangan metode spektrofotmetri UV ini, maka penetapan kadar campuran parasetamol dan ibuprofen dapat ditetapkan secara bersamaan dan lebih cepat.
Metode ini belum pernah digunakan untuk penetapan kadar parasetamol dan ibuprofen maka diperlukan validasi metode terlebih dahulu sebelum dilakukan penetapan kadar untuk sediaan tablet yang mengandung parasetamol dan ibuprofen.
3
1. Permasalahan
Apakah penetapan kadar campuran parasetamol dan ibuprofen dengan perbandingan 7:4 menggunakan metode spektrofotometri UV aplikasi metode derivatif memenuhi parameter akurasi, presisi, spesifisitas, dan linearitas yang baik ?
2. Keaslian Penelitian
Sebelum penulis, sudah ada beberapa peneliti yang menetapkan kadar campuran parasetamol dan ibuprofen. Penelitian yang telah ada mengenai penetapan kadar campuran parasetamol dan ibuprofen antara lain Optimasi Pemisahan Campuran Parasetamol dan Ibuprofen dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik (Prabowo, 2010), Validasi Metode Penetapan Kadar Campuran Parasetamol dan Ibuprofen dengan Perbandingan 7:4 Menggunakan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik (Micell, 2010), Penetapan Kadar Campuran Parasetamol dan Ibuprofen dalam Tablet Merk ”X” dengan Metode Kromatografi Cair Kinerja Tinggi Fase terbalik (Kumalasari, 2010), Validasi Metode Penetapan Kadar Campuran Parasetamol dan Ibuprofen secara Spektrofotometri UV dengan Metode Panjang Gelombang Berganda (Andrianto, 2010), dan Penetapan Kadar Campuran Parasetamol dan Ibuprofen dalam Tablet merk ”X” secara Spektrofotometri UV dengan Aplikasi Metode Panjang Gelombang Berganda (Setiawan, 2010).
3. Manfaat Penelitian
spektrofotometri UV aplikasi metode derivatif, secara khusus terhadap campuran paraseramol dan ibuprofen.
b. Manfaat praktis. Penelitian ini diharapkan dapat digunakan sebagai metode yang praktis dan valid untuk menetapkan kadar campuran parasetamol dan ibuprofen dengan metode spektofotometri ultraviolet dengan aplikasi metode derivatif.
B. Tujuan Penelitian
5
BAB II
PENELAAH PUSTAKA
A. Parasetamol
Sinonim dari parasetamol adalah asetaminofen; p-Hidroksiasetanilida; p -asetamidofenol; N-asetil-p-aminofenol; C6H9NO2, dengan berat molekul 151,16 g/mol (Anonim, 1995). Rumus bangun dari parasetamol adalah sebagai berikut
Gambar 1. Rumus Bangun Parasetamol (Anonim, 1995)
Parasetamol mengandung tidak kurang dari 98,0% dan tidak lebih dari 101,0% C8H9NO2, dihitung terhadap zat anhidrat. Pemerian: serbuk hablur, putih, tidak berbau, rasa sedikit pahit. Kelarutan: larut dalam air mendidih dan dalam natrium hidroksida 1 N, mudah larut dalam etanol. Parasetamol yang terlarut memiliki serapan maksimum pada panjang gelombang 243 nm (Anonim, 1995).
B. Ibuprofen
Sinonim lain dari ibuprofen adalah 2-(p-isobutilfenil) asam propionat, C13H18O2, dengan berat molekul 206,28 g/mol. Rumus bangun dari ibuprofen sebagai berikut:
Gambar 2. Rumus Bangun Ibuprofen (Anonim,1995)
Ibuprofen mengandung tidak kurang dari 97,0% dan tidak lebih dari 103,0% C13H18O2, dihitung terhadap zat anhidrat. Pemeriaan: serbuk hablur, putih hingga hampir putih, berbau khas lemah. Kelarutan: praktis tidak larut dalam air, sangat mudah larut dalam etanol, dalam metanol, dalam aseton dan dalam kloroform, sukar larut dalam etil asetat. Ibuprofen terlarut memiliki serapan maksimum pada panjang gelombang 221 nm (Anonim, 1995).
Ibuprofen mempunyai berat molekul 206 g/mol. Ibuprofen termasuk NSAID (non-steroidal anti inflammantory drug), biasa digunakan untuk gejala arthritis, primary dysmenorrheal, demam dan sebagai analgesik (Battu and Reddy, 2009).
C. Spektrofotometri Ultraviolet (UV)
7
elektromagnetik dapat digambarkan oleh suatu grafik yang menghubungkan banyaknya radiasi elektromagnetik yang diserap dengan panjang gelombangnya, yang disebut dengan spektrum absorpsi (Mulja dan Suharman, 1995).
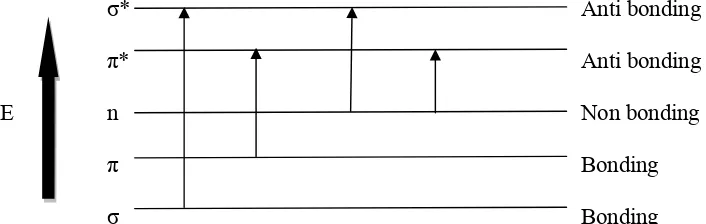
Teknik spektroskopi adalah salah satu teknik analisis fisiko-kimia yang mengamati interaksi atom atau molekul dengan radiasi elektromagnetik. Setiap spesies molekul mempunyai keadaan energi yang unik dan keadaan terendah elektron disebut ground state. Apabila pada molekul tersebut dikenakan foton yang sesuai dengan perbedaan energi elektron dari keadaan ground state ke tingkat energi yang lebih tinggi dari suatu radiasi elektromagnetik, maka akan terjadi absorbsi energi. Tingkat energi yang lebih tinggi ini dikenal sebagai orbital elekron antibonding. Energi yang dibutuhkan tersebut sesuai dengan pesamaan:
E = h. υ = (1)
Keterangan: E = tenaga foton dalam erg
υ = frekuensi radiasi elektromagnetik dalam hertz h = tetapan planck (6.624 X 10-34 J/det)
λ = panjang gelombang (cm) c = tetapan cahaya (3.1010 cm/s)
(Christian, 2004) Karena elektron dalam molekul memiliki tenaga yang tak sama, maka tenaga yang diserap dalam proses eksitasi dapat mengakibatkan terjadinya satu atau lebih transisi tergantung pada jenis elektron yang terlihat (Sastrohamidjojo, 2001).
σ* Anti bonding
π* Anti bonding
E n Non bonding
π Bonding
σ Bonding
Gambar 3. Diagram tingkat energi elektronik (Mulja dan Suharman, 1995)
9
Gugus atom yang mengabsorpsi radiasi UV-Vis disebut sebagai kromofor (Mulja dan Suharman, 1995). Kromofor menyatakan gugus tak jenuh kovalen yang dapat menyerap radiasi dalam daerah-daerah ultraviolet dan terlihat. Senyawa yang mengandung kromofor disebut dengan kromogen. Auksokrom adalah heteroatom yang langsung terikat pada kromofor, misal: -OCH3, -Cl, -OH, dan –NH2 dan memberikan transisi (n→σ*). Auksokrom tidak mengabsorpsi radiasi tetapi jika terdapat dalam molekul, auksokrom dapat meningkatkan absorpsi kromofor atau merubah panjang gelombang absorpsi jika terikat dengan kromofor. Auksokrom mempunyai elektron n yang akan berinteraksi dengan elektron π pada kromofor. Perubahan spektra dapat dikelompokkan menjadi: a. Bathocromic shift, panjang gelombang absorpsi maksimum berubah ke
panjang gelombang yang lebih panjang. Pergeseran ini juga disebut pergeseran merah.
b. Hipsochromic shift, panjang gelombang absorpsi maksimum berubah ke panjang gelombang yang lebih pendek. Pergeseran ini juga disebut pergeseran biru.
c. Hyperchromis, peningkatan daya serap molar (ε). d. Hypochromism, penurunan daya serap molar (ε).
T = = 10 -ε.b.c (2)
Keterangan : It = Intensitas radiasi yang ditransmisikan I0 = Intensitas radiasi mula-mula
ε = daya serap molar b = tebal kuvet
c = konsentrasi larutan dalam (Molar)
Intensitas dari suatu berkas radiasi akan berkurang sehubungan dengan jarak yang ditempuhnya melalui medium penyerap. Intensitas tersebut akan berkurang sehubungan dengan kadar molekul atau ion yang terserap dalam medium tersebut. Kedua faktor tersebut menentukan proporsi dari kejadian total energi yang timbul. Penurunan daya radiasi monokromatis yang melalui medium penyerap yang homogen dinyatakan secara kuantitatif oleh hukum Lambert-Beer (Anonim, 1995).
A = log10 ( )= ε.b.c (3)
Keterangan : A = absorbansi ε = daya serap b = tebal kuvet
c = konsentrasi sampel (Molar)
Harga ε didefinisikan sebagai daya serap molar atau koefisien ekstingsi molar. Harga ε adalah karakteristik untuk molekul atau ion penyerap dalam pelarut tertentu, pada panjang gelombang tertentu dan tidak bergantung pada konsentrasi dan panjang gelombang lintasan radiasi (Sastrohamidjojo, 2001). Harga ε dapat diganti dengan a yang disebut sebagai daya serap, bila konsentrasi larutan dalam gram/liter hubungan ε dan a adalah sebagai berikut:
ε = a M (4)
11
terjadinya transisi energi yang diserap (P). Hubungan ε dan variabel tersebut adalah sebagai berikut:
ε = 8,7 x 1019PA (5)
Keterangan: P = probabilitas terjadinya transisi energi yang diserap A = luas penampang senyawa yang terkena radiasi
Nilai harga P adalah 0,1 sampai 1 yang menunjukkan kekuatan pita absorbansi akibat transisi elektronik yang diperbolehkan dengan memberikan nilai ε > 104 . Sedangkan untuk harga ε < 103 atau harga P< 0,01 forbidden transition. Secara umum dapat dikatakan bahwa harga sangat mempengaruhi puncak spektrum suatu zat. Rincian harga ε terhadap puncak spektrum adalah sebagai berikut:
1-10: sangat lemah; 10-102: lemah; 102 -103: sedang; 103-104: kuat; 104-105: sangat kuat (Mulja dan Suharman, 1995).
Untuk pelaksanaan teknik analisis spektroskopi dipakai instrumen sebagai pengukur dan perekam sinyal hasil interaksi molekul dengan radiasi elektromagnetik (Mulja dan Suharman, 1995).
D.Metode derivatif zero crossing
Derivat pertama atau yang lebih tinggi dari transmitan atau serapan, seringkali dimaksudkan untuk mendapatkan spektra yang lebih spesifik yang tidak diperoleh dengan spektra biasa. Dengan alasan ini, penggunaan spektra derivatif dapat meningkatkan sensitivitas deteksi pada bentuk spektra minor dan mengurangi kesalahan yang disebabkan oleh tumpang tindih pita spektra analit yang terganggu spesies lain dalam sampel (Aberasturi et al., 2001; Skoog, 1985). Lebih jauh, spektra ini dapat digunakan untuk analisis kuantitatif, untuk mengukur konsentrasi dari analit yang mempunyai konsentrasi tersembunyi, misalnya bertumpang tindih dengan puncak analit lain dalam sampel (Willard et al., 1988). Untuk analisis kuantitatif, jika serapan sesuai hukum Lambert-Beer maka derivatif pada panjang gelombang tertentu terkait dengan persamaan:
b c (6)
Dimana: A = serapan pada panjang gelombang tertentu
= serapan jenis pada panjang gelombang tertentu b = tebal lapisan penyerap
c = kadar zat terlarut yang menyerap
(Anonim, 1995) Panjang gelombang maksimum suatu senyawa akan menjadi panjang gelombang zero crossing pada spektrum derivatif pertama, panjang gelombang tersebut tidak mempunyai serapan atau dA/dλ = 0. Pada prinsipnya, tinggi puncak (dnA/dλn ) proporsional terhadap konsentrasi analit. Hal inilah yang menjadi dasar analisis kuantitatif pada spektrofotometri derivatif (Aberasturi et al., 2001).
13
(7)
Nilai absolut spektrum derivatif salah satu senyawa dapat diukur jika senyawa lain bernilai nol. Teknik analisis ini disebut teknik zero crossing yaitu pengukuran amplitudo spektrum pada titik zero crossing. Titik zero crossing adalah titik dimana salah satu komponen bernilai nol sehingga pengukuran komponen tidak terpengaruh senyawa lain. Panjang gelombang yang mempunyai titik zero crossing disebut panjang gelombang zero crossing. Kurva baku dibuat pada panjang gelombang zero crossing ini (Aberastuari et al., 2001)
E. Validasi Metode
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004). Untuk itu diperlukan suatu pedoman mengenai kesahihan metode analisis yang didukung oleh parameter-parameter yaitu spesifisitas, linearitas, akurasi, presisi, LOD dan LOQ.
1. Spesifisitas
2. Linearitas
Linearitas merupakan kemampuan suatu metode (pada rentang tertentu) untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel (Anonim, 2007). Persyaratan data linearitas yang bisa diterima jika memenuhi nilai koefisien korelasi (r) > 0,99 atau r2≥ 0,997 (Chan et al, 2004). Hubungan linier yang baik ditunjukkan dengan nilai r =1 atau r = -1 tergantung arah garis (Harmita, 2004).
3. Akurasi
Akurasi atau kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analis dengan kadar analit yang sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004).
Tabel I. Kriteria rentang recovery yang dapat diterima
Analit pada matriks sampel (%)
Rentang recovery
yang diperoleh 100 > 10 > 1 > 0,1 0,01 0,001
0,0001 (1 ppm) 0,00001 (100 ppb) 0,000001 (10 ppb) 0,0000001 (1 ppb)
98-102 % 98-102 % 97-103 % 95-105 % 90-107 % 90-107 % 80-110 % 80-110 % 60-115 % 40-120 % 4. Presisi
15
diambil dari campuran yang homogen. Presisi biasanya dinyatakan dalam koefisien variasi (KV) atau persen Relative Standard Deviation (RSD) (Harmita, 2004).
Tabel II. Kriteria KV yang dapat diterima
Kadar Analit KV (%)
≥ 1 % 0,1 % 1 ppm 1 ppb
2,5 5 16 32
5. LOD (limit of detection) dan LOQ (limit of quantitation)
LOD adalah jumlah terkecil analit dalam sampel yang dapat dideteksi dan masih memberikan respon signifikan dibandingkan dengan blanko. LOQ merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria akurasi dan presisi. LOD dan LOQ dapat dihitung secara statistik melalui garis regresi linier dari kurva kalibrasi (Harmita, 2004).
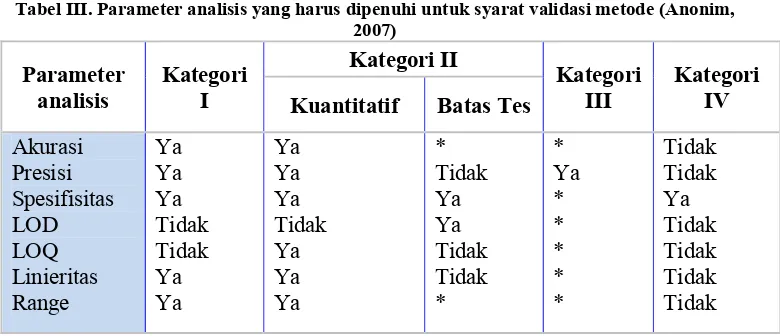
Menurut The United States Pharmacopeia 30 The National Formulary 28 tahun 2007, metode/prosedur analisis dapat dibedakan menjadi 4 kategori, yaitu:
a. Kategori I. Mencakup prosedur analisis kuantitatif, untuk menetapkan kadar komponen utama bahan obat atau zat aktif dalam sediaan farmasi.
c. Kategori III. Mencakup prosedur analisis yang digunakan untuk menentukan karakteristik penampilan suatu sediaan farmasi, misalnya disolusi dan pelepasan obat.
d. Kategori IV (tes identifikasi).
Tabel III. Parameter analisis yang harus dipenuhi untuk syarat validasi metode (Anonim, 2007) Parameter analisis Kategori I Kategori II Kategori III Kategori IV Kuantitatif Batas Tes
Akurasi Presisi Spesifisitas LOD LOQ Linieritas Range Ya Ya Ya Tidak Tidak Ya Ya Ya Ya Ya Tidak Ya Ya Ya * Tidak Ya Ya Tidak Tidak * * Ya * * * * * Tidak Tidak Ya Tidak Tidak Tidak Tidak
* = Mungkin diperlukan (tergantung sifat spesifik tes)
F. Landasan Teori
Parasetamol merupakan obat antipiretik- analgesik yang diindikasikan untuk menyembuhkan demam dan nyeri. Ibuprofen merupakan obat antiinflamasi (NSAID) dan obat analgesik yang diindikasikan untuk meredakan demam dan gejala arhtritis (Anonim, 1995).
17
campuran parasetamol dan ibuprofen dengan spektrofotometri UV tanpa melalui pemisahan terlebih dahulu. Oleh karena itu, perlu pengembangan metode spektrofotometri untuk analisis multikomponen, salah satu contohnya adalah dengan menggunakan aplikasi metode derivatif. Aplikasi metode derivatif, akan mengubah penampilan spektrum normal menjadi spektrum derivatifnya. Spektrum derivatif ini akan memperuncing puncak-puncak spektrum yang normal untuk masing-masing senyawa.
Validasi metode merupakan ukuran pembuktian bahwa metode yang digunakan memenuhi akurasi, presisi, linearitas, dan spesifisitas yang memenuhi persyaratan untuk penggunaannya sehingga data yang diperoleh dapat dipercaya.
G. Hipotesis
18
A. Jenis dan Rancangan Penelitian
Penelitian yang dilakukan bersifat noneksperimental deskriptif karena tidak adanya perlakuan terhadap subjek uji.
B. Variabel Penelitian
1. Variabel bebas dalam penelitian ini adalah panjang gelombang yang digunakan (variable continuous).
2. Variabel tergantung dalam penelitian ini adalah kadar parasetamol dan ibuprofen yang digunakan untuk analisis hasil validasi (variable continuous) 3. Variabel pengacau terkendali adalah pelarut yang digunakan
C. Definisi Operasional
1. Spektrofotometri derivatif merupakan metode manipulatif terhadap spektra pada spektrofotometri metode spektrofotometri UV aplikasi metode derivatif ultraviolet dan tampak (Connors, 1982) dengan mentransformasikan plot A vs λ, menjadi dA/dλ vs λ, untuk derivatif pertama, dan d2A/dλ2 vs λ, untuk
derivatif kedua.
2. Panjang gelombang zero-crossing adalah panjang gelombang yang mempunyai nilai spektrum nol pada spektrum derivatif.
19
4. Parameter validasi yang digunakan adalah akurasi, presisi, spesifisitas dan linearitas.
5. Campuran parasetamol dan ibuprofen adalah campuran antara parasetamol dan ibuprofen dengan perbandingan (7:4).
6. Nilai serapan derivatif adalah nilai serapan normal yang diderivatif (dnA/dλn).
D. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini yaitu baku parasetamol working standar (No. COA 0920032), ibuprofen mutu working standar (No.COA 50909135) dari PT. KONIMEX, dan pelarut yang digunakan adalah metanol pro analisis.
E. Alat yang Digunakan
Alat-alat yang dipergunakan dalam penelitian ini adalah spektrofotometer (OPTIMA SP3000F), neraca analitik (SARTORIUS), pipet gondok, pipet tetes, pipet volume, labu takar, beker glass, pengaduk, sendok, gelas ukur, pipet tetes, corong, flakon, kuvet, dan oven.
F. Tata Cara Penelitian
1. Pembuatan Larutan Baku Parasetamol
1,5; 2; 2,5; 3; 3,5 mg/100ml, yakni dengan mengencerkan 1; 1,5; 2; 2,5; 3; 3,5 ml dalam aquadest hingga 10,0 ml.
2. Pembuatan Larutan Baku Ibuprofen
Lebih kurang 10 mg ibuprofen ditimbang seksama dan dilarutkan dalam metanol hingga 10,0 ml. Kemudian 2,5 ml larutan tersebut diencerkan dengan aquadest hingga 25,0 ml. Setelah itu, dibuat larutan dengan seri kadar 1,5; 2; 2,5; 3; 3,5; 4 mg/100ml, yakni dengan mengencerkan 1,5; 2; 2,5; 3; 3,5; 4 ml dalam metanol hingga 10,0 ml.
3. Penentuan Spektrum Masing-masing Senyawa
Dari seri kadar yang telah diperoleh pada penetapan rentang kadar parasetamol-ibuprofen, masing-masing diambil salah satu konsentrasi (parasetamol konsentrasi 3,5 mg/100ml dan ibuprofen konsentrasi 2 mg/100ml) dan dilakukan pengukuran absorbansi kedua larutan pada rentang panjang gelombang 220-280 nm, sehingga dapat diketahui absorbansi dari parasetamol konsentrasi 3,5 mg/100ml dan ibuprofen konsentrasi 2 mg/100ml pada berbagai panjang gelombang.
4. Penentuan Panjang Gelombang Zero-crossing
21
5. Pembuatan Kurva Baku
Masing-masing larutan baku parasetamol dan ibuprofen yang telah dibuat, diukur nilai serapan derivatifnya pada panjang gelombang zero crossing masing-masing senyawa tersebut. Kemudian dibuat kurva baku antara nilai serapan derivatif terhadap seri konsentrasi larutan baku senyawa pada panjang gelombang pengukuran masing-masing senyawa.
6. Penetapan Kadar Parasetamol dan Ibuprofen dalam Campuran
a. Pembuatan sampel parasetamol. Ditimbang sebanyak lebih kurang seksama 10 mg parasetamol dan dilarutkan dalam metanol hingga 10,0 ml. Kemudian diambil 2,5 ml dan diencerkan dengan aquadest hingga 25,0 ml (larutan intermediet parasetamol).
b. Pembuatan sampel ibuprofen. Ditimbang sebanyak lebih kurang seksama 10 mg ibuprofen dan dilarutkan dalam metanol hingga 10,0 ml. Kemudian diambil 2,5 ml dan diencerkan dengan aquadest hingga 25 ml (larutan intermediet ibuprofen).
c. Pembuatan larutan campuran parasetamol dan ibuprofen. Dari larutan intermediet parasetamol diambil 3,5 ml dan dari larutan intermediet ibuprofen diambil 2 ml kemudian diencerkan sampai 10 ml.
serapan derivatif dari masing-masing senyawa dibaca pada panjang gelombang zero crossing yang telah ditetapkan sebelumnya. Kemudian dilakukan penetapan kadar masing-masing senyawa dalam campuran dengan memasukkan nilai serapan derivatif campuran parasetamol dan ibuprofen ke persamaan kurva baku masing-masing senyawa.
G. Analisis Hasil
Kesahihan dari metode yang digunakan dalam penetapan kadar parasetamol dan ibuprofen dalam campuran secara KCKT fase terbalik dapat ditentukan berdasarkan parameter berikut :
a. Akurasi
Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Recovery dihitung dari kadar yang terukur pada kurva baku dibandingkan dengan kadar yang diketahui dikalikan 100%.
Recovery =
b. Presisi
Presisi diukur sebagai simpangan baku relatif (koefisien variansi).
c. Linearitas
Linearitas dinyatakan dengan koefisien korelasi (r) pada analisis regresi linear.
23
d. Spesifisitas
24
A. Pembuatan Larutan Baku Parasetamol dan Ibuprofen
Larutan baku parasetamol dan ibuprofen dibuat dengan menggunakan pelarut metanol. Metanol dipilih menjadi pelarut parasetamol dan ibuprofen karena parasetamol dan ibuprofen larut dalam metanol. Selain itu, metanol dapat digunakan untuk pelarut untuk metode spektrofotometri UV karena metanol mempunyai serapan pada panjang gelombang di bawah 210 nm, sehingga metanol tidak mengganggu spektrum absorbansi parasetamol dan ibuprofen pada 220-280 nm. Metanol yang digunakan untuk penelitian ini adalah metanol pro analisis, dikarenakan metode spektrofotometri membutuhkan kemurnian yang tinggi.
25
B. Penentuan Spektrum Senyawa
Spektrum serapan normal diambil dari larutan baku parasetamol 3,5 mg/100ml dan larutan baku ibuprofen 2 mg/100ml. Konsentrasi dari parasetamol dan ibuprofen dibuat seperti itu karena menyesuaikan perbandingan parasetamol dan ibuprofen pada sampel yang nanti akan diuji, dengan perbandingan parasetamol dan ibuprofen 7:4. Spektrum serapan normal dibuat antara absorbansi terhadap panjang gelombang. Pembacaan absorbansi dari senyawa dilakukan pada panjang gelombang 220-280 nm. Dipilih panjang gelombang 220 nm sebagai batas bawah pembacaan absorbansi bertujuan untuk menjamin absorbansi dari kedua senyawa tidak dipengaruhi oleh absorbansi pelarutnya yaitu metanol. Rentang ini dibuat dengan mempertimbangkan bahwa serapan maksimum dari parasetamol dan ibuprofen masuk dalam rentang 220-280 nm.
Gambar 4. Gugus kromofor dan auksokrom pada parasetamol
Gambar 5. Gugus kromofor pada ibuprofen
Keterangan: = kromofor
_ _ _ _ = auksokrom
Parasetamol dan ibuprofen memberikan serapan di daerah UV dikarenakan kromofor yang dipunyai parasetamol dan ibuprofen tidak cukup panjang untuk sampai kedaerah visibel (400-700 nm) . Kromofor dari parasetamol dan ibuprofen didapatkan dari cincin benzene yang memberikan panjang gelombang maksimum sekitar 210 nm.
27
Spektrum serapan normal ibuprofen konsentrasi 2 mg/100ml dan parasetamol konsentrasi 3,5 mg/100ml dapat dilihat sebagai berikut:
Gambar 6. Spektrum serapan normal ibuprofen konsentrasi 2mg/100ml (λ maks = 223 nm)
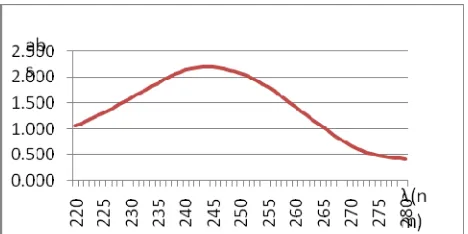
Gambar 7. Spektrum serapan normal parasetamol konsentrasi 3,5 mg/100ml (λ maks = 244 nm)
Pergeseran panjang gelombang serapan maksimum untuk ibuprofen sebesar 2 nm dan parasetamol sebesar 1 nm. pergeseran ini masih memenuhi persyaratan yang ditetapkan oleh farmakope IV, di mana jika ada pergeseran panjang gelombang serapan maksimum dengan rentang pergeseran ± 2 nm dengan pelarut yang sama dengan baku pembanding maka panjang gelombang tersebut dapat digunakan sebagai panjang gelombang serapan maksimum.
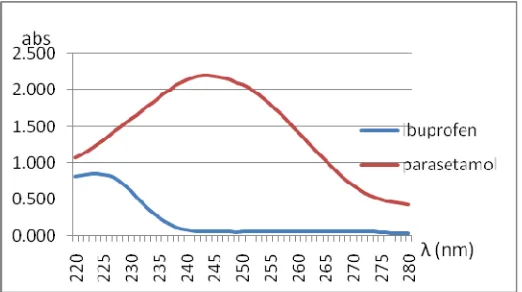
Spektrum overlapping dari parasetamol dan ibuprofen dapat dilihat sebagai berikut:
Gambar 8. Spektrum normal parasetamol 3,5 mg/100ml
dan ibuprofen konsentrasi 2 mg/100ml
29
menggunakan spektrum normal biasa karena tidak ada panjang gelombang yang spesifik untuk satu senyawa saja. Jika kedua senyawa memberikan serapan pada panjang gelombang tertentu, maka pengukuran spektrofotometri akan memberikan harga penjumlahan serapan dari masing-masing senyawa.
Spektrum normal kedua senyawa tumpang tindih secara total maka salah satu cara yang dapat digunakan untuk menetapkan kadar masing-masing komponen tersebut adalah dengan menggunakan aplikasi metode derivatif.
C. Penentuan Panjang Gelombang zero crossing
Salah satu cara untuk menetapkan kadar parasetamol dan ibuprofen yang pada spektrum normalnya mengalami tumpang tindih secara total adalah dengan menggunakan aplikasi metode derivatif. Spektrum normal dari parasetamol dan ibuprofen yang normal dibuat mejadi spektrum derivatifnya sampai ditemukan zero crossing untuk masing-masing senyawa. Pembuatan spektrum derivatif dengan memplotkan nilai serapan derivatif (dnA/dλn) terhadap panjang gelombang. Nilai serapan derivatif ditentukan dengan cara membagi delta absorbansi (ΔA= Aλ2-Aλ1) dengan delta panjang gelombang (Δλ= λ2-λ1). Delta panjang gelombang yang digunakan adalah 1 nm.
absis sehingga nilainya nol. Panjang gelombang zero crossing inilah yang diambil sebagai panjang gelombang pengukuran.
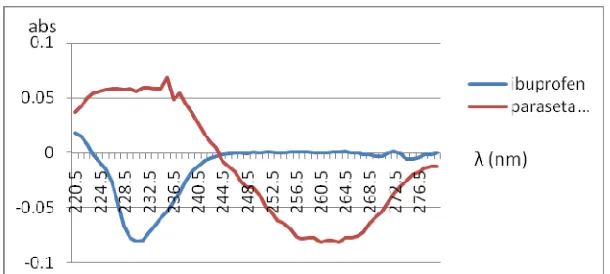
Spektrum derivatif pertama dari ibuprofen konsentrasi 2 mg/100ml dan parasetamol 3,5 mg/100ml :
Gambar 9. Spektrum derivatif pertama dari parasetamol konsentrasi 3.5 mg/100ml dan ibuprofen konsentrasi 2 mg/100ml
Pada spektrum derivat pertama hanya ditemukan panjang gelombang zero crossing untuk ibuprofen. Di mana spektrum derivatif pertama dari ibuprofen memotong absis dan parasetamol memberikan nilai serapan derivatifnya minimum. Panjang gelombang zero crossing ibuprofen terletak pada panjang gelombang 246,5 nm, 247,5 nm, 250,5 nm, 253,5 nm, 254,5 nm, 259,5 nm, 260,5 nm, 261,5 nm, 265,5 nm, 266,5 nm, 271,5 nm, dan 279,5 nm. Panjang gelombang yang dipilih untuk pengukuran adalah pada panjang gelombang 261,5 nm nilai serapan derivatif parasetamol paling minimum.
31
Gambar 10. Spektrum derivatif kedua dari parasetamol 3,5 mg/100ml dan ibuprofen konsentrasi 2 mg/100ml
Pada spektrum derivatif kedua terlihat penajaman puncak. Pada spektrum derivatif kedua didapatkan panjang gelombang zero crossing untuk parasetamol dimana terdapat spektrum parasetamol yang memotong absis dan di panjang gelombang tersebut nilai serapan derivatif dari ibuprofen minimum. Panjang gelombang zero crossing untuk parasetamol ada pada panjang gelombang 227 nm, 232 nm, 234 nm, 249 nm, 259 nm, 262 nm, 265 nm, dan 279 nm. Panjang gelombang yang dipilih adalah panjang gelombang 227 nm karena nilai serapan derivatif dari ibuprofen bernilai paling minimum.
D. Pembuatan Persamaan Kurva baku
kurva baku terbaik dilihat dari koefisien korelasi (r) yang didapat dari persamaan regresi. Koefisien korelasi yang mendekati 1 atau -1 (tergantung arah garis) adalah yang paling baik karena koefisien korelasi menujukkan hubungan linieritas antara absis (dalam penelitian ini absisnya adalah kadar) dan ordinat (dalam penelitian ini ordinatnya adalah nilai serapan derivatif). Semakin mendekati 1 atau -1, maka artinya dengan sedikit perubahan kadar maka nilai serapan derivatifnya juga akan ikut berubah.
Tabel IV. Data kurva baku parasetamol Kadar
(mg/100ml) Nilai serapan derivatif
Replikasi I Replikasi II Replikasi III
1 -0.022 -0.023 -0.028
1.5 -0.034 -0.035 -0.038
2 -0.045 -0.05 -0.051
2.5 -0.055 -0.071 -0.063
3 -0.067 -0.09 -0.074
3.5 -0.079 -0.105 -0.084
A 0.0003238 0.014295 -0.00490476
B -0.0225 -0.034057 -0.022857
r -0.9996 -0.9968 -0.9992
Tabel V. Data kurva baku ibuprofen
Kadar
(mg/100ml) Nilai serapan derivatif
Replikasi I Replikasi II Replikasi III
1.5 -0.014 -0.014 -0.015
33
2.5 -0.025 -0.025 -0.029
3 -0.029 -0.029 -0.030
3.5 -0.034 -0.034 -0.036
4 -0.038 -0.041 -0.045
A -0.00058 0.001276 0.00147
B -0.0094857 -0.01 -0.0112
r -0.9979 -0.9970 -0.9853
Maka persamaan kurva baku parasetamol yang dipilih untuk penetapan kadar campuran parasetamol dan ibuprofen adalah y = -0,0225x + 0,0003238 dengan r = -0,9996 sedangkan kurva baku ibuprofen yang dipakai untuk penetapan kadar campuran parasetamol dan ibuprofen adalah y = 0,0094857x -0,00058 dengan r = -0,9979.
E. Penetapan Kadar Sampel
Konsentrasi parasetamol dan ibuprofen pada sampel dibuat menjadi 3,5 mg/100ml parasetamol dan 2 mg/100ml ibuprofen. Larutan sampel kemudian diukur pada rentang panjang gelombang 220-280 nm dan dibuat spektrum normalnya terlebih dahulu. Spektrum normal larutan sampel, ditunjukan pada gambar berikut:
Spektrum normal sampel menggambarkan dua puncak yang mewakili serapan maksimum dari kedua komponen sampel yaitu parasetamol dan ibuprofen. Puncak tersebut berada pada panjang gelombang 228 nm dan 244 nm. Jika spektrum normal dari larutan sampel dibandingkan dengan spektrum normal larutan baku parasetamol dan ibuprofen maka akan terlihat bahwa sebenarnya kedua puncak pada spektrum normal sampel adalah penggambaran serapan maksimum dari parasetamol dan ibuprofen.
Spektrum overlapping dari parasetamol 3,5 mg/100ml, ibuprofen 2 mg/100ml, dan sampel dapat dilihat sebagai berikut:
Gambar 12. Spektrum gabungan larutan sampel dan baku pada serapan normal
35
sama, maka pengukuran spektrofotometri akan memberikan hasil penjumlahan dari setiap komponen senyawa (Sastrohamidjojo, 2001). Pada panjang gelombang serapan maksimum ibuprofen bergeser 5 nm menjadi 228 nm dikarenakan adanya serapan parasetamol yang menambah nilai absorbansi dari ibuprofen. Sedangkan pada parasetamol tidak berubah panjang gelombang serapan maksimumnya dikarenakan nilai absorbansi dari ibuprofen yang seharusnya dijumlahkan dengan nilai absorbansi dari parasetamol terlalu kecil nilainya dan memang setelah panjang gelombang 240 nm, absorbansi ibuprofen tidak mengalami penurunan atau kenaikan secara berarti.
Spektum overlapping dari spektrum derivatif satu dan dua dari parasetamol konsentrasi 3,5 mg/100ml, ibuprofen konsentrasi 2 mg/100ml, dan sampel campuran parasetamol dan ibuprofen:
Gambar 13. Spektrum gabungan sampel dan baku pada derivate pertama
Gambar 14. Spektrum gabungan sampel dan baku pada derivate kedua
37
Tabel VI. Data parasetamol dan ibuprofen dalam campuran
Sampel Ibuprofen Parasetamol Kadar benar (mg/100 ml) Kadar terukur (mg/100ml) Recovery Kadar benar (mg/100ml) Kadar terukur (mg/100ml) Recovery
1 2 2,05 102,5 3,5 3,53 100,86
2 1,96 1,94 98,97 3,43 3,44 100,29
3 2 2,05 102,5 3,5 3,53 100,86
4 1,98 1,94 97,98 3,47 3,44 99,14
5 1,98 2,05 103,53 3,47 3,48 100,29
6 1,98 2,05 97,98 3,47 3,44 99,14
Rerata ± SE 100,58±1,0
4 100,1±0,32
CV kadar terukur 0,995% 0,575%
F. Analisis Parameter Validasi
Parameter-parameter validasi yang digunakan untuk metode penetapan kadar campuran parasetamol dan ibuprofen dengan spektrofotometri UV aplikasi metode derivatif antara lain: spesifisitas, linearitas, akurasi, dan presisi.
1. Spesifisitas
komponen yaitu ibuprofen, parasetamol, metanol, dan aquadest. Metanol dan aquadest digunakan sebagai pelarut. Metanol dan aquadest tidak mengganggu serapan dari parasetamol dan ibuprofen karena mempunyai panjang gelombang serapan di bawah 210 nm. Pada spektrum normal, spesifisitas dari parasetamol dan ibuprofen tidak baik. Pada spektrum normal, spektrum dari parasetamol dan ibuprofen masing-masing saling tumpang tindih sehingga sulit untuk menentukan nilai serapan dari masing-masing senyawa. Oleh karena itu, spektrum normal kedua senyawa tersebut dibuat menjadi spektrum derivatif pertama dan kedua untuk menentukan titik zero crossing dari masing-masing senyawa. Titik zero crossing inilah yang menjadi jaminan spesifisitas dari metode ini. Pada masing-masing titik zero crossing dari senyawa, nilai serapan derivatif dari salah satu senyawa saja yang terukur dikarenakan senyawa yang lain memiliki nilai serapan derivatif yang bernilai nol. Parasetamol memiliki titik zero crossing pada panjang gelombang 227 nm di spektrum derivatif pertama (Gambar. 13), sedangkan ibuprofen memiliki titik zero crossing pada panjang gelombang 261,5 nm di spektrum derivatif kedua (Gambar. 14).
2. Linearitas
39
-0,0094857x – 0,00058 dengan r = -0,9979. Dari hasil yang didapatkan, nilai r dari kurva baku parasetamol dan ibuprofen bernilai negatif. Hal tersebut dikarenakan arah garis dari kurva baku parasetamol dan ibuprofen kearah negatif. Spesifisitas dari kurva baku parasetamol dan ibuprofen memenuhi persyaratan yang berlaku dimana nilai r yang baik adalah yang mendekati 1 atau -1 sesuai dengan arah garisnya (Harmita, 2004).
3. Akurasi
Akurasi dari sebuah metode analisis dapat dilihat dari recovery yang didapatkan. Berdasarkan hasil percobaan yang ditunjukan pada tabel VI, diperoleh rentang recovery dari parasetamol adalah 99,14-100,86%. Sedangkan rentang recovery untuk ibuprofen adalah 97,98-103,53%. Hasil yang didapat masih memenuhi syarat recovery untuk analit dalam sampel besar yaitu 95-105% (Mulja & Suharman, 1995).
4. Presisi
Presisi dari suatu metode dilihat dari nilai coefficient varians (CV). Metode ini memiliki presisi yang baik untuk menetapkan kadar parasetamol dan ibuprofen dalam campuran. Hal ini dapat dilihat dari tabel VI, dimana diperoleh nilai CV parasetamol sebesar 0,575% dan nilai CV ibuprofen sebesar 0,995%. Berdasarkan hasil yang didapat, nilai CV yang diperoleh telah memenuhi syarat presisi yang baik (CV < 2%) (Mulja & Suharman, 2003).
40
A. KESIMPULAN
Penetapan kadar campuran parasetamol dan ibuprofen dengan perbandingan 7:4 menggunakan metode spektrofotometri ultraviolet aplikasi metode derivatif memiliki akurasi, presisi , linearitas, dan spesifisitas yang baik.
B. SARAN
Perlu dilakukan penelitian lebih lanjut mengenai penetapan kadar campuran parasetamol dan ibuprofen dengan spektrofotometri UV aplikasi metode derivatif dalam sediaan obat, misalnya tablet.
41
Daftar Pustaka
Aberasturi, F., Jimenez, A. I., Arias, J. J., 2001, UV-visible First-Derivative Spectrophotometry Applied to an Analysis of a Vitamin Mixture, JchemEd., Vol. 78, no. 6, 793-795
Andrianto, Y. C., 2010, Validasi Metode Penetapan Kadar Campuran Parasetamol dan Ibuprofen secara Spektrofotometri UV dengan Metode Panjang Gelombang Berganda, Skripsi, Universitas Sanata Dharma, Yogyakarta Anonim, 1995, Farmakope Indonesia, edisi IV, 449, 649, 1009, Departemen
Kesehatan Republik Indonesia, Jakarta
Anonim, 2007, The United States Pharmacopeia 30th The National Formulary 25th, United States Pharmacopeal Convention, Inc., New York
Battu, P. R., and Reddy, MS, 2009, RP-HPLC Method for Simultaneous Estimation of Paracetamol and Ibuprofen in Tablets, http ://www.ajrconline.org, diakses tanggal 29 Agustus 2009
Chan, C.C., Lam, H., Lee, Y.C., and Zhang, X., 2004, Analytical Method Validation and Instrumen Performance Verification, 16, John Wiley & Sons, Inc., U.S.A.
Christian, G.D., 2004, Analytical Chemistry, 6th Ed.,465, Jhon Wiley & Sons, Inc., U.S.A.
Connors, K.A., 1982, Textbook of PharmaceuticalAnalysis, 3th Ed., 221, Wiley, New York
Harmita, 2004, Petunjuk Pelaksanaan Validasi Metode dan Cara, Majalah Ilmu Kefarmasian, Vol.I, No.3, 117-135
Kumalasari, M. A. R., 2010, Penetapan Kadar Campuran Parasetamol dan Ibuprofen dalam Tablet Merk ”X” dengan Metode Kromatografi Cair Kinerja Tinggi Fase terbalik, Skripsi, Universitas Sanata Dharma, Yogyakarta
Micell, J., 2010, Validasi Metode Penetapan Kadar Campuran Parasetamol dan Ibuprofen dengan Perbandingan 7:4 Menggunakan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik, Skripsi, Universitas Sanata Dharma, Yogyakarta
Mulja, M., dan Hanwar, D., 2003, Prinsip-Prinsip Cara Berlaboratorium Yang Bail (Good Laboratory Practice), Majalah Farmasi Airlangga¸Vol III, no.2, 71-76
Prabowo, Y. P., 2010, Optimasi Pemisahan Campuran Parasetamol dan Ibuprofen Dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik, Skripsi, Universitas Sanata Dharma, Yogyakarta
Sastrohamidjojo, H., 2001, Spektroskopi, 1-43, Liberty, Yogyakarta
Setiawan, A. A., 2010, Penetapan Kadar Campuran Parasetamol dan Ibuprofen dalam Tablet merk ”X” secara Spektrofotometri UV dengan Aplikasi Metode Panjang Gelombang Berganda, Skripsi, Universitas Sanata Dharma, Yogyakarta
Skoog, D. A., 1985, Principles of Instrumenal Analysis, 3rd Ed., 182-215, Saunders College publishing, Philadelphia
Willard, H. H., Merritt, J. R. L., Dean, J. A., dan Settle J. F. A., 1988, Instrumenal Methods of Analysis, 7th Ed., 148-150, 159-178, Wadsworth Publishing Company, California
43
Lampiran 1. Sertifikat Bahan
Sertifikat parasetamol
Lampiran 2. Sertifikat Bahan
45
Lampiran 3. Data Penimbangan Bahan Data Penimbangan Bahan
a. Ibuprofen baku Replikasi 1 : 0,0100 g Replikasi 2 : 0,0098 g Replikasi 3 : 0,0099 g
b. Parasetamol baku Replikasi 1 : 0,0099 g Replikasi 2 : 0,0099 g Replikasi 3 : 0,0098 g
c. Data penimbangan sampel
Replikasi Parasetamol (g) Ibuprofen (g)
1 0,0100 0,0100
2 0,0098 0,0098
3 0,0100 0,0100
4 0,0099 0,0099
5 0,0099 0,0099
6 0,0099 0,0099
Lampiran 4. Contoh Perhitungan Kadar Larutan Baku Parasetamol
Contoh perhitungan kadar larutan baku parasetamol: a. Skema pembuatan
Kurang lebih 10 mg parasetamol ditimbang secara seksama Larutkan dalam 10 ml metanol p.a.
Pipet 2,5 ml
Larutkan dengan aquadest hingga 25 ml Pipet 1; 1.5; 2; 2.5; 3; dan 3.5 ml
Encerkan dengan aquadest hingga volumenya tepat 10 ml
b. Perhitungan seri kadar parasetamol
Bobot parasetamol hasil penimbangan = 9,9 mg
Kadar parasetamol dalam larutan metanol = 9,9 mg : 10 ml = 0,99 mg/ml Kadar parasetamol dalam larutan aquadest = C1.V1 =C2.V2
47
Seri kadar Perhitungan kadar parasetamol
1 x 0,099 mg/ml = 0,0099 mg/ml = 0,99 mg/100ml
2 x 0,099 mg/ml = 0,01485 mg/ml = 1,485 mg/100ml
3 x 0,099 mg/ml = 0,0198 mg/ml = 1,98 mg/100ml
4 x 0,099 mg/ml = 0,02475 mg/ml = 2,475 mg/100ml
5 x 0,099 mg/ml = 0,0297 mg/ml = 2,97 mg/100ml
6 x 0,099 mg/ml = 0,03465 mg/ml = 3,465 mg/100ml
Lampiran 5. Contoh Perhitungan Kadar Larutan Baku Ibuprofen Contoh perhitungan kadar larutan baku ibuprofen:
a. Skema pembuatan
Kurang lebih 10 mg ibuprofen ditimbang secara seksama Larutkan dalam 10 ml metanol p.a.
Pipet 2,5 ml
Larutkan dengan aquadest hingga 25 ml
Pipet 1.5; 2; 2.5; 3; 3.5; dan 4 ml
Encerkan dengan aquadest hingga volumenya tepat 10 ml
b. Perhitungan seri kadar ibuprofen
Bobot ibuprofen hasil penimbangan = 10 mg
Kadar ibuprofen dalam larutan metanol = 10 mg : 10 ml = 1 mg/ml Kadar ibuprofen dalam larutan aquadest = C1.V1 =C2.V2
49
Seri kadar Perhitungan kadar ibuprofen
1 x 0,1 mg/ml = 0,015 mg/ml = 1,5 mg/100ml
2 x 0,1 mg/ml = 0,02 mg/ml = 2 mg/100ml
3 x 0,1 mg/ml = 0,025 mg/ml = 2,5 mg/100ml
4 x 0,1 mg/ml = 0,03 mg/ml = 3 mg/100ml
5 x 0,1 mg/ml = 0,035 mg/ml = 3,5 mg/100ml
6 x 0,1 mg/ml = 0,04 mg/ml = 4 mg/100ml
Lampiran 6. Contoh Perhitungan Derivatif
Derivatif pertama:
=
λ A λ = dA/dλ
220
0,811 220,5 0,018221
0,829 221,5 0,015222
0,844 222,5 0,007223
0,851 223,5 -0,002224
0,849 224,5 -0,008225
0,841 225,5 -0,015226
0,826 226,5 -0,027227
0,799 227,5 -0,047228
0,752 228,5 -0,066229
0,686 229,5 -0,077230
0,609 230,5 -0,08231
0,529 231,5 -0,079232
0,450 232,5 -0,072233
0,378 233,5 -0,066234
0,312 234,5 -0,059235
0,253 235,5 -0,053236
0,200 236,5 -0,044237
0,156 237,5 -0,036238
0,120 238,5 -0,026239
0,094 239,5 -0,017240
0,077 240,5 -0,012241
0,065 241,5 -0,007242
0,058 242,5 -0,005243
0,053 243,5 -0,003244
0,050 244,5 -0,002245
0,048 245,5 -0,001246
0,047 246,5 0247
0,047 247,5 0248
0,047 248,5 -0,001249
0,046 249,5 0,00151
251
0,047 251,5 0,001252
0,048 252,5 0,001253
0,049 253,5 0254
0,049 254,5 0255
0,049 255,5 0,001256
0,050 256,5 0,001257
0,051 257,5 0,001258
0,052 258,5 0,001259
0,053 259,5 0260
0,053 260,5 0261
0,053 261,5 0262
0,053 262,5 0,001263
0,054 263,5 0,001264
0,055 264,5 0,002265
0,057 265,5 0266
0,057 266,5 0267
0,057 267,5 -0,002268
0,055 268,5 -0,002269
0,053 269,5 -0,003270
0,050 270,5 -0,003271
0,047 271,5 0272
0,047 272,5 0,002273
0,049 273,5 -0,001274
0,048 274,5 -0,006275
0,042 275,5 -0,006276
0,036 276,5 -0,004277
0,032 277,5 -0,002278
0,030 278,5 -0,002279
0,028 279,5 0Derivatif kedua:
λ dA/dλ λ = d2A/d2λ
220,5 0,018 221 -0,0030000
221,5 0,015 222 -0,0080000
222,5 0,007 223 -0,0090000
223,5 -0,002 224 -0,0060000
224,5 -0,008 225 -0,0070000
225,5 -0,015 226 -0,0120000
226,5 -0,027 227 -0,0200000
227,5 -0,047 228 -0,0190000
228,5 -0,066 229 -0,0110000
229,5 -0,077 230 -0,0030000
230,5 -0,08 231 0,0010000
231,5 -0,079 232 0,0070000
232,5 -0,072 233 0,0060000
233,5 -0,066 234 0,0070000
234,5 -0,059 235 0,0060000
235,5 -0,053 236 0,0090000
236,5 -0,044 237 0,0080000
237,5 -0,036 238 0,0100000
238,5 -0,026 239 0,0090000
239,5 -0,017 240 0,0050000
240,5 -0,012 241 0,0050000
241,5 -0,007 242 0,0020000
242,5 -0,005 243 0,0020000
243,5 -0,003 244 0,0010000
244,5 -0,002 245 0,0010000
245,5 -0,001 246 0,0010000
246,5 0 247 0,0000000
247,5 0 248 -0,0010000
248,5 -0,001 249 0,0020000
249,5 0,001 250 -0,0010000
250,5 0 251 0,0010000
251,5 0,001 252 0,0000000
252,5 0,001 253 -0,0010000
253,5 0 254 0,0000000
254,5 0 255 0,0010000
255,5 0,001 256 0,0000000
256,5 0,001 257 0,0000000
257,5 0,001 258 0,0000000
258,5 0,001 259 -0,0010000
259,5 0 260 0,0000000
53
261,5 0 262 0,0010000
262,5 0,001 263 0,0000000
263,5 0,001 264 0,0010000
264,5 0,002 265 -0,0020000
265,5 0 266 0,0000000
266,5 0 267 -0,0020000
267,5 -0,002 268 0,0000000
268,5 -0,002 269 -0,0010000
269,5 -0,003 270 0,0000000
270,5 -0,003 271 0,0030000
271,5 0 272 0,0020000
272,5 0,002 273 -0,0030000
273,5 -0,001 274 -0,0050000
274,5 -0,006 275 0,0000000
275,5 -0,006 276 0,0020000
276,5 -0,004 277 0,0020000
277,5 -0,002 278 0,0000000
278,5 -0,002 279 0,0020000
279,5 0 280 -0,0280000
Lampiran 7. Data Perhitungan Kadar Parasetamol dan Ibuprofen dalam Campuran Parasetamol dan Ibuprofen dengan Perbandingan 7 : 4
Data perhitungan kadar parasetamol dan ibuprofen a. Skema pembuatan
Timbang seksama parasetamol dan ibuprofen masing-masing lebih kurang 10 mg
Larutkan parasetamol dan ibuprofen secara terpisah dengan metanol hingga 10 ml
Pipet masing-masing 2,5 ml larutan parasetamol dan larutan ibuprofen masukkan dalam labu ukur 25 ml secara terpisah antara parasetamol dan
ibuprofen
tambahkan aquadest hingga tanda
pipet 3,5 ml larutan parasetamol dan 2 ml larutan ibuprofen, masukkan dalam satu labu
ukur 10 ml
tambahkan aquadest hingga tanda
b. Contoh perhitungan kadar parasetamol dan ibuprofen terukur Persamaan kurva baku parasetamol; y = -0,0225x + 0,0003238 Persamaan kurva baku ibuprofen; y = -0,0094857x – 0,00058
Nilai serapan derivatif parasetamol (Y) = -0,079 (pada λ = 261,5 nm) Nilai serapan derivatif ibuprofen (Y) = -0,020 (pada λ = 227 nm)
55
Lampiran 8. Perhitungan Recovery a. Skema pembuatan
Timbang seksama parasetamol dan ibuprofen masing- masing lebih kurang 10 mg
Larutkan parasetamol dan ibuprofen secara terpisah dengan metanol hingga 10 ml
Pipet masing-masing 2,5 ml larutan parasetamol dan larutan ibuprofen masukkan dalam labu ukur 25 ml secara terpisah antara parasetamol dan
ibuprofen
tambahkan aquadest hingga tanda
pipet 3,5 ml larutan parasetamol dan 2 ml larutan ibuprofen, masukkan dalam satu labu
ukur 10 ml
tambahkan aquadest hingga tanda
b. Contoh perhitungan kadar parasetamol dan ibuprofen sebenarnya Bobot parasetamol hasil penimbangan : 10 mg
Kadar sebenarnya parasetamol dalam campuran parasetamol dan ibuprofen : 3,5 mg/100ml
Kadar terukur parasetamol dalam campuran parasetamol dan ibuprofen : 3,53 mg/100ml
Recovery parasetamol:
Bobot ibuprofen hasil penimbangan : 10 mg
Kadar sebenarnya ibuprofen dalam campuran parasetamol dan ibuprofen : 2
mg/100ml
Kadar terukur ibuprofen dalam campuran parasetamol dan ibuprofen : 2,05
mg/100ml
Recovery
ibuprofen:
(kadar terukur : kadar sebenarnya) x 100% =
=102,5 %
a.
Perhitungan
coefficient of variancy
(CV)
Contoh perhitungan CV
Replikasi
Kadar terukur mg/100ml
1 2,05
2 1,94
3 2,05
4 1,94
5 2,05
6 2,05
Rata-rata kadar terukur = 2,01
SD = 0,006
SE = 0,02
CV = 0,995 %
Rata-rata = 2,01 CV = (SE : rata-rata kadar terukur) x 100 %
SD = 0,006
CV = 0,995 %
SE =
57
Biografi Penulis
Tony Handoyo lahir di Semarang 16 Juni 1989. Anak
kedua dari bapak alm. Handoyo dan ibu Soewaryati.
Pendidikan TK ditempuh di TK Tunas Rimba Pucak
Wangi, kemudian melanjutkan di SDN 3 Pucak Wangi.
Pendidikan SMP ditempuh di SMP Keluarga Juana dan
lulus tahun 2003, kemudian menamatkan SMA di SMA
Kolese De Britto pada tahun 2006.
Setelah lulus SMA, penulis melanjutkan studi di Universitas Sanata Dharma Fakultas
Farmasi. Selama kuliah penulis mengikuti beberapa kegiatan fakultas, diantaranya
menjadi seksi dampok TITRASI 2007, ketua umum TITRASI 2009, manajer UKF