MODUL
ANALISIS
MIKROBIOLOGI
Yusi Nurmayasari, S.Si
DAFTAR ISI
DEFINISI DAN SEJARAH MIKROBIOLOGI ... 3
ANGGOTA DUNIA MIKROBA ... 7
BAB 1 MEDIA PERTUMBUHAN ... 13
BAB 2 STERILISASI ... 21
BAB 3 ISOLASI DAN INOKULASI MIKROORGANISME ... 29
BAB 4 MORFOLOGI MIKROORGANISME ... 36
BAB 5 PEMINDAHAN DAN PENGAWETAN MIKROORGANISME ... 58
BAB 6 PENGARUH LINGKUNGAN TERHADAP PERTUMBUHAN MIKROORGANISME ... 68
BAB 7 MENENTUKAN JUMLAH DAN UKURAN MIKROORGANISME ... 80
BAB 8 UJI REAKSI ENZIMATIS ... 95
BAB 9 ANALISA MIKROBA DALAM AIR ... 108
BAB 10 ANALISA MIKROBA DALAM MAKANAN ... 115
BAB 11 DAYA KERJA ANTI MIKROBA ... 125
KATA PENGANTAR
Puji syukur kami panjatkan ke hadirat Allah swt., karena atas ridha dan hidayahNya penulisan modul Analisis Mikrobiologi untuk SMK Bina Putera Nusantara ini dapat terselesaikan dengan baik. Tidak lupa kami ucapkan terima kasih kepada semua pihak yang telah membantu terlaksananya penulisan modul hingga dapat digunakan sebagai bahan ajar di jurusan Kimia Analisis SMK Bina Putera Nusantara Tasikmalaya.
Modul ini kami susun dengan harapan dapat membantu siswa untuk memahami materi dasar mikrobiologi dan menguasai cara-cara untuk melaksanakan análisis dalam mikrobiologi. Penyajian materi modul ini disesuaikan dengan silabus pembelajaran sebagaimana tertuang dalam kurikulum SMK Bina Putera Nusantara.
Semoga modul ini dapat memberi motivasi baru kepada peserta didik untuk belajar dengan lebih baik. Penulis menyadari bahwa penulisan modul ini masih jauh dari sempurna. Oleh karena itu kami mengharapkan kritik dan saran yang sifatnya membangun demi perbaikan modul ini di masa yang akan datang.
Tasikmalaya, Agustus 2010
Mikrobiologi adalah sebuah cabang dari ilmu biologi yang mempelajari organisme yang terlalu kecil untuk dapat dilihat dengan jelas menggunakan mata telanjang; kajian ini mencakup bakteri, archaea, protozoa, algae mikroskopik, dan fungi. Beberapa mikroba (seperti algae dan jamur) cukup besar untuk dapat dilihat dengan mata telanjang, namun kedua organisme masih dimasukkan dalam kajian mikrobiologi, hal ini karena teknik yang digunakan untuk mengkajinya (seperti isolasi, sterilisasi, kultivasi dalam media artifisial) sama seperti anggota mikroorganisme lainnya. Virus sering juga dimasukkan walaupun sebenarnya tidak sepenuhnya dapat dianggap sebagai makhluk hidup.
Mikrobiologi adalah ilmu yang mempelajari mikroba. Mikrobiologi adalah salah satu cabang ilmu dari biologi, dan memerlukan ilmu pendukung kimia, fisika, dan biokimia. Mikrobiologi sering disebut ilmu praktek dari biokimia. Dalam mikrobiologi dasar diberikan pengertian dasar tentang sejarah penemuan mikroba, macam-macam mikroba di alam, struktur sel mikroba dan fungsinya, metabolisme mikroba secara umum, pertumbuhan mikroba dan faktor lingkungan, mikrobiologi terapan di bidang lingkungan dan pertanian. Mikrobiologi lanjut telah berkembang menjadi bermacammacam ilmu yaitu virologi, bakteriologi, mikologi, mikrobiologi pangan, mikrobiologi tanah, mikrobiologi industri, dan sebagainya yang mempelajari mikroba spesifik secara lebih rinci atau menurut kemanfaatannya.
Whittaker membagi jasad hidup menjadi tiga tingkat perkembangan, yaitu: (1)Jasad prokariotik yaitu bakteri dan ganggang biru (Divisio Monera), (2) Jasad eukariotikuniseluler yaitu algae sel tunggal, khamir dan protozoa (Divisio Protista), dan (3) Jasadeukariotik multiseluler dan multinukleat yaitu Divisio Fungi, Divisio Plantae, dan DivisioAnimalia. Sedangkan Woese menggolongkan jasad hidup
Definisi &
terutama berdasarkansusunan kimia makromolekul yang terdapat di dalam sel. Pembagiannya yaitu terdiri Arkhaebacteria, Eukaryota (Protozoa, Fungi, Tumbuhan dan Binatang), dan Eubacteria.
Ciri Umum Mikroba
Mikroba di alam secara umum berperanan sebagai produsen, konsumen, maupun redusen. Jasad produsen menghasilkan bahan organik dari bahan anorganik dengan energi sinar matahari. Mikroba yang berperanan sebagai produsen adalah algae dan bakteri fotosintetik. Jasad konsumen menggunakan bahan organik yang dihasilkan oleh produsen. Contoh mikroba konsumen adalah protozoa. Jasad redusen menguraikan bahan organik dan sisa-sisa jasad hidup yang mati menjadi unsur-unsur kimia (mineralisasi bahan organik), sehingga di alam terjadi siklus unsur-unsur kimia. Contoh mikroba redusen adalah bakteri dan jamur (fungi).
Sel mikroba yang ukurannya sangat kecil ini merupakan satuan struktur biologi. Banyak mikroba yang terdiri dari satu sel saja (uniseluler), sehingga semua tugas kehidupannya dibebankan pada sel itu. Mikroba ada yang mempunyai banyak sel (multiseluler). Pada jasad multiseluler umumnya sudah terdapat pembagian tugas diantara sel atau kelompok selnya, walaupun organisasi selnya belum sempurna.
Setelah ditemukan mikroskop elektron, dapat dilihat struktur halus di dalam sel hidup, sehingga diketahui menurut perkembangan selnya terdapat dua tipe jasad, yaitu:
1. Prokariota (jasad prokariotik/ primitif), yaitu jasad yang perkembangan selnya belum sempurna.
2. Eukariota (jasad eukariotik), yaitu jasad yang perkembangan selnya telah sempurna.
Selain yang bersifat seluler, ada mikroba yang bersifat nonseluler, yaitu virus. Virus adalah jasad hidup yang bersifat parasit obligat, berukuran super kecil atau submikroskopik. Virus hanya dapat dilihat dengan mikroskop elektron. Struktur virus terutama terdiri dari bahan genetik. Virus bukan berbentuk sel dan tidak dapat membentuk energi sendiri serta tidak dapat berbiak tanpa menggunakan jasad hidup lain.
Sejarah Mikrobiologi
1626-1697 Francesco Redi, membantah konsep generasi spontan dengan menunjukkan bahwa belatung pada daging busuk berasal dari telur lalat yang meletakkan telur pada daging tersebut, bukan dari daging itu sendiri
1713-1781 John Needham, mendukung teori generasi spontan dengan menunjukkan bahwa kaldu yang dipanaskan dalam labu dan kemudian ditutup masih
1729-1799 Lazzaro Spallanzani, menunjukkan bahwa labu yang ditutup dan kemudian dididihkan tidak ada mikroorganisme yang tumbuh, dan menyatakan bahwa udara yang masuk ke labu medium membawa benih, dan udara mungkin diperlukan untuk mendukung pertumbuhan organisme yang sudah ada di medium.
1822-1895 Louis Pasteur, menjebak organisme yang terbawa udara dalam kapas, dia juga memanaskan leher labu angsa, mensteril meida, membiarkan labu terbuka; hasil percobaan menunjukkan tidak ada pertumbuhan organisme sebab partikel debu yang membawa organisme tidak mencapai medium; namun debu terjebak dalam leher labu; jika leher labu dipecah, debu akan mencapai medium dan organisme akan tumbuh; dengan cara ini, Pasteur telah mematahkan teori generasi spontan
1820-1893 John Tyndall, menunjukkan bahwa debu membawa mikroba dan jika debu tidak ada, medium tetap steril, bahkan jika medium terkena udara. Tydall juga memberikan bukti keberadaan bakteri yang resisten panas.
1773-1856 Agostino Bassi , menunjukkan bahwa penyakit ulat sutra disebabkan jamur
± 1845 M. J. Berkeley, menunjukkan bahwa penyakit kentang (the Great Potato Blight) Irlandian disebabkan oleh jamur
1822-1895 Louis Pasteur, menunjukkan bahwa penyakit (péine) ulat sutra disebabkan oleh parasit protozoa
1872-1912 Joseph Lister, menunjukkan suatu sistem pembedahan yang dirancang untuk mencegah mikroorganisme menginfeksi luka bedah, sehingga pasien jauh lebih sedikit yang terinfeksi pascaoperasi; Lister memberikan bukti tidak langsung bahwa mikroorganisme adalah agen penyebab penyakit manusia
1843-1910 Robert Koch, yang menggunakan kritetia yang dikembangkan oleh gurunya, Jacob Henle (1809-1895), dapat menjelaskan hubungan antara Bacillus anthracis and anthrax; kriterianya dikenal sebagai postulat Koch dan masih digunakan untuk menjelaskan hubungan antara mikroorganisme tertentu dengan penyakit tertentu.
Robert Koch dan kawan-kawan mengembangkan teknik, reagen, dan materi lain untuk mengkultur patogen bakteri pada media padat pertumbuhan, dengan demikian mikrobiologis dapat mengisolasi mikroba untuk mendapatkan kultur murni (tunggal).
Postulat Koch:
o Mikroorganisme harus ada di setiap kasus penyakit tetapi tidak ada pada individu sehat.
o Mikroorganisme yang dicurigai (suspected) harus dapat diisolasi dan ditumbuhkan dalam kultur murni.
o Penyakit yang sama harus timbul jika mikroorganisme hasil isolasi diinokulasi tersebut pada individu sehat.
o Mikroorganisme yang sama harus ditemukan lagi dari individu yang sakit tersebut
1851-1908 Charles Chamberland, membuat filter (saringan) bakteri untuk menapis bakteri dan mikroba yang lebih besar dari spesimen; melalui teknik ini juga memungkinkan ditemukannya virus sebagai agen penyebab penyakit.
±1798 Edward Jenner , menggunakan prosedur vaksinasi untuk melindungi individu dari penyakit cacar (smallpox)
1822-1895 Louis Pasteur, mengembangkan vaksin lain untuk penyakit kolera ayam, antraks, dan rabies
1854-1917 Emil von Behring dan Shibasaburo Kitasato (1852-1931), menginduksi pembentuk antitoksin toksin diptera pada kelinci; antitoksin digunakan secara efektif untuk mengobati manusia dan memberikan bukti imunitas humoral
1845-1916 Elie Metchnikoff, menunjukkan keberadaan sel fagositik dalam darah, yang menunjukkan imunitas dimediasi sel
1856-1953 Sergei Winogradsky, yang bekerja dengan bakteri tanah menemukan bahwa bakteri tanah dapat oksidasi besi, belerang, dan amonia untuk mendapatkan energi; Winogradsky juga mengkaji fiksasi nitrogen anaerobik dan dekomposisi selulosa
1851-1931 Martinus Beijerinck, mengisolasi bakteri pengikat nitrogen aerobik, suatu bakteri bintil akar yang mampu menambat nitrogen, and bakteri pereduksi sulfat. Beijerinck and Winogradsky memperkenalkan pertama kali penggunaan kultur yang diperkaya dan media selektif.
Bakteri
Bakteri merupakan organisme yang paling banyak jumlahnya dan lebih tersebar luas dibandingkan mahluk hidup yang lain . Bakteri memiliki ratusan ribu spesies yang hidup di darat hingga lautan dan pada tempat-tempat yang ekstrim.
Bakteri ada yang menguntungkan tetapi ada pula yang merugikan. Bakteri memiliki ciri-ciri yang membedakannya dengan mahluk hidup yang lain. Bakteri adalah organisme uniselluler dan prokariot serta umumnya tidak memiliki klorofil dan berukuran renik (mikroskopis).
Ciri-ciri Bakteri:
1. Organisme uniselluler
2. Prokariot (tidak memiliki membran inti sel ) 3. Umumnya tidak memiliki klorofil
4. Memiliki ukuran tubuh yang bervariasi antara 0,12 s/d ratusan mikron umumnya memiliki ukuran rata-rata 1 s/d 5 mikron.
5. Memiliki bentuk tubuh yang beraneka ragam 6. Hidup bebas atau parasit
7. Yang hidup di lingkungan ekstrim seperti pada mata air panas,kawah atau gambut dinding selnya tidak mengandung peptidoglikan
8. Yang hidupnya kosmopolit diberbagai lingkungan dinding selnya mengandung peptidoglikan
Bentuk Bakteri
Bentuk dasar bakteri terdiri atas bentuk bulat (kokus), batang (basil),dan spiral (spirilia) serta terdapat bentuk antara kokus dan basil yang disebut kokobasil. Berbagai macam bentuk bakteri :
1. Bakteri Kokus :
Anggota
a. Monokokus/ mikrokokus, yaitu berupa sel bakteri kokus tunggal b. Diplokokus, yaitu dua sel bakteri kokus berdempetan
c. Tetrakokus yaitu empat sel bakteri kokus berdempetan berbentuk segi empat sebagai hasil pembelahan sel ke dua arah.
d. Sarkina/ sarsina yaitu delapan sel bakteri kokus berdempetan membentuk kubus hasil pembelahan sel ke tiga arah
e. Streptokokus yaitu lebih dari empat sel bakteri kokus berdempetan membentuk rantai sebagai hasil pembelahan sel ke satu atau dua arah dalam satu garis.
f. Stafilokokus yaitu lebih dari empat sel bakteri kokus berdempetan seperti buah anggur
a. Monobasilus, yaitu berupa sel bakteri basil/ batang tunggal
b. Diplobasilus, yaitu berupa dua sel bakteri basil/ batang berdempetan c. Streptobasilus, yaitu beberapa sel bakteri basil berdempetan membentuk rantai
3. Bakteri Spirilia atau lengkung:
a. Spiral/ spirillium yaitu bentuk sel bergelombang, spiralnya tebal dan kaku b. Spiroseta / spirochaeta yaitu bentuk sel seperti sekrup, spiralnya halus dan lentur
c. Vibrio yaitu bentuk sel seperti tanda baca koma
Archaea
Archaea atau arkea dikenal juga sebagai arkeabakteria, merupakan organisme uniseluler yang tidak mempunyai nucleus (inti selnya tidak memiliki membran inti) sehingga digolongkan sebagai prokariot.
Dulu arkea digolongkan sebagai kelompok bakteri yang tidak biasa dan dinamakan arkeabakteria, tapi karena ternyata arkea mempunyai system biokimiawi yang berbeda dengan bakteri, maka arkea diklasifikasikan sebagai domain yang berbeda.
Arkea dan bakteri mempunyai kesamaan dalam hal ukuran dan bentuk,
walaupun beberapa jenis arkea mempunyai bentuk yang sangat tidak biasa, seperti bentuk rata dan kotak (seperti Haloquadra walsbyi.). arkea bereproduksi secara aseksual dan melakukan pembelahan biner, fragmentasi atau pertunasan (budding), tapi berbeda dengan bakteri dan eukariot lain, arkea tidak membentuk spora
Awalnya arkea ditemukan di lingkungan yang ekstrem, seperti di sumber air panas dan danau air asin, tapi sekarang sudah banyak dijumpai di berbagai habitat seperti lumpur, laut dan rawa-rawa. Belum ditemukan adanya arkea yang bersifat pathogen atau parasite, biasanya arkea bersimbiosis secara mutualisme atau komensalisme dengan organisme lain.
Protozoa
Istilah protozoa berasal dari bahasaYunani, yaitu protos artinya pertama dan zoon artinya hewan. Jadi,Protozoa adalah hewan pertama. Protozoa merupakan kelompok lainprotistaeukariotik. Kadang-kadang antara algae dan protozoa kurang jelas perbedaannya. Kebanyakan Protozoa hanya dapat dilihat di bawah mikroskop. Beberapa organisme mempunyai sifat antaraalgaedan protozoa.
Protozoa dibedakan dariprokariotkarena ukurannya yang lebih besar, dan selnya eukariotik. Protozoa dibedakan dari algae karena tidak berklorofil, dibedakan darijamurkarena dapat bergerak aktif dan tidak berdinding sel, serta dibedakan dari jamur lendir karena tidak dapat membentuk badan buah.
Kelas Utama Protozoa:
Kelompok
Utama (Nama
Utama)
Cara Gerak
Cara
Berkembang
Biak
Ciri-ciri Lain
Mastighophora (Flagelata)Flagela (satu atau lebih) Pembelahan biner membujur, pada beberapa kelompok ada reproduksi seksual Nutrisinya fototropik, heterotropik atau keduanya Sarcodina (Amoeba) Pseudopodia Pembelahan biner, tak ada reproduksi seksual
Kebanyakan spesies hidup bebas,
heterotropik
Ciliata (siliata) Silia (banyak)
Pembelahan biner melintang, reproduksi seksual dengan konjugasi Kebanyakan spesies hidup bebas, heterotropik
Sporozoa (sporozoa) Gerak dengan meluncur atau tidak bergerak Pembelahan bahurangkap, mungkin ada mikro gamet berflagela pada reproduksi seksual Semua spesies parasit
Algae Mikroskopik
Algae adalah organisme eukariotik fotosintetik aerobic. Ukuran algae sangat beragam, dari beberapa micrometer hingga beberapa meter. Organisme ini mengandung klorofil serta pigmen-pigmen lain untuk melangsungkan fotosintesis. Kebanyakan algae berukuran mikroskopis atau disebut sebagai algae mikroskopis. Dan ilmu yang mempelajarinya disebut fikologi.
Algae biasanya terdapat sebagai sel tunggal yang berbentuk bola, batang, gada atau kumparan. Ada yang dapat bergerak (dengan flagella) dan ada yang tidak, bereproduksi secara asekaual dan seksual. Untuk yang berukuran makro, ada yang multiseluler.
Di dunia mikrobia, algae termasuk eukariotik, umumnya bersifat fotosintetik dengan pigmen fotosintetik hijau (klorofil), coklat (fikosantin), biru kehijauan (fikobilin), dan merah (fikoeritrin). Morfologi algae ada yang berbentuk uniseluler, ada pula yang multiseluler tetapi belum ada pembagian tugas pada sel-sel komponennya. Algae dibedakan dari tumbuhan hanya karena hal tersebut.
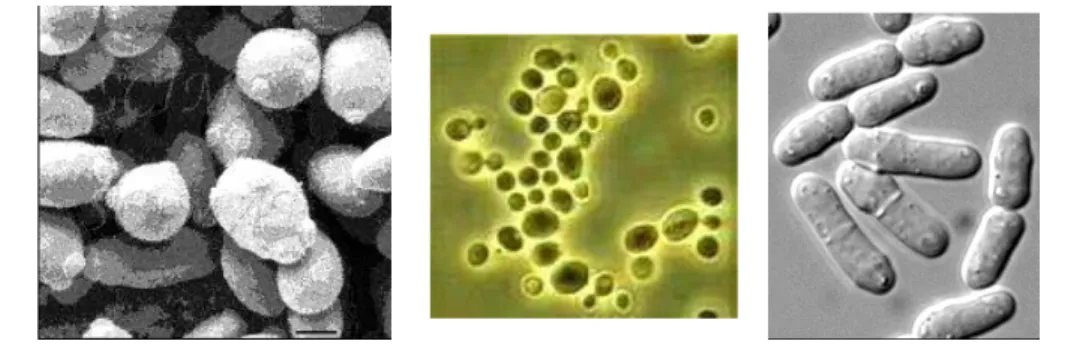
Khamir
Pada umumnya, sel khamir lebih besar daripada kebanyakan bakteri, tapi khamir yang paling kecil tidak sebesar bakteri paling besar. Ukurannya berkisar antara 1-5 mikron (lebar) dan 5-30 mikron (panjang). Biasanya berbentuk bulat telur tapi beberapa ada yang memanjang atau berbentuk bola. Khamir tidak dilengkapi flagella atau alat gerak lainnya.
Pada dasarnya, tubuhnya hanya terdiri dari dua bagian, yaitu miselium dan spora (sel resisten, istirahat atau dorman). Miselium merupakan kumpulan beberapa filament yan g dinamakan hifa. Setiap hifa lebarnya 5-10 mikron (sel bakteri biasanya berdiameter 1 mikron). Ada tiga macam morfologi
Khamir atau disebut yeast, merupakan jamur bersel satu yang mikroskopik,tidak berflagela. Beberapa genera membentuk filamen (pseudomiselium). Carahidupnya sebagai saprofit dan parasit. Hidup di dalam tanah atau debu di udara, tanah,daun-daun, nektar bunga, permukaan buah-buahan, di tubuh serangga, dan cairan yangmengandung gula seperti sirup, madu dan lain-lain.Khamir berbentuk bulat (speroid), elips, batang atau silindris, seperti buahjeruk, sosis, dan lain-lain. Bentuknya yang tetap dapat digunakan untuk identifikasi.Khamir dapat dimasukkan ke dalam klas Ascomycetes, Basidiomycetes danDeuteromycetes.
Pengertian dan Fungsi
Media pertumbuhan mikroorganisme adalah suatu bahan yang terdiri dari campuran zat-zat makanan (nutrisi) yang diperlukan mikroorganisme untuk pertumbuhannya. Mikroorganisme memanfaatkan nutrisi media berupa molekul-molekul kecil yang dirakit untuk menyusun komponen sel. Dengan media pertumbuhan dapat dilakukan isolat mikroorganisme menjadi kultur murni dan juga memanipulasi komposisi media pertumbuhannya.
Bahan-bahan media pertumbuhan
1. Bahan dasar
air (H2O) sebagai pelarut
agar (dari rumput laut) yang berfungsi untuk pemadat media. Agar sulit didegradasi oleh mikroorganisme pada umumnya dan mencair pada suhu 45 o
C.
gelatin juga memiliki fungsi yang sama seperti agar. Gelatin adalah polimer asam amino yang diproduksi dari kolagen. Kekurangannnya adalah lebih banyak jenis mikroba yang mampu menguraikannya dibanding agar.
Silicagel, yaitu bahan yang mengandung natrium silikat. Fungsinya juga sebagai pemadat media. Silica gel khusus digunakan untuk memadatkan media bagi mikroorganisme autotrof obligat.
2. Nutrisi atau zat makanan
Media harus mengandung unsur-unsur yang diperlukan untuk metabolisme sel yaitu berupa unsur makro seperti C, H, O, N, P; unsur mikro seperti Fe, Mg dan unsur pelikan/trace element.
Sumber karbon dan energi yang dapat diperoleh berupa senyawa organik atau anorganik esuai dengan sifat mikrobanya. Jasad heterotrof memerlukan sumber karbon organik antara lain dari karbohidrat, lemak, protein dan asam organik.
Sumber nitrogen mencakup asam amino, protein atau senyawa bernitrogen lain. Sejumlah mikroba dapat menggunakan sumber N anorganik seperti urea.
Vitamin-vitamin.
Bab 1
3. Bahan tambahan
Bahan-bahan tambahan yaitu bahan yang ditambahkan ke medium dengan tujuan tertentu, misalnya phenolred (indikator asam basa) ditambahkan untuk indikator perubahan pH akibat produksi asam organik hasil metabolisme. Antibiotik ditambahkan untuk menghambat pertumbuhan mikroba non-target/kontaminan.
4. Bahan yang sering digunakan dalam pembuatan media
Agar, agar dapat diperoleh dalam bentuk batangan, granula atau bubuk dan terbuat dari beberapa jenis rumput laut. Kegunaannya adalah sebagai pemadat (gelling) yang pertama kali digunakan oleh Fraw & Walther Hesse untuk membuat media. Jika dicampur dengan air dingin, agar tidak akan larut. Untuk melarutkannya harus diasuk dan dipanasi, pencairan dan pemadatan berkali-kali atau sterilisasi yang terlalu lama dapat menurunkan kekuatan agar, terutama pada pH yang asam
Peptone, peptone adalah produk hidrolisis protein hewani atau nabati seperti otot, liver, darah, susu, casein, lactalbumin, gelatin dan kedelai. Komposisinya tergantung pada bahan asalnya dan bagaimana cara memperolehnya.
Meatextract. Meatextract mengandung basa organik terbuat dari otak, limpa, plasenta dan daging sapi.
Yeastextract. Yeastextract terbuat dari ragi pengembang roti atau pembuat alcohol. Yeast extract mengandung asam amino yang lengkap & vitamin (B
complex).
Karbohidrat. Karbohidrat ditambahkan untuk memperkaya pembentukan asam amino dan gas dari karbohidrat. Jenis karbohidrat yang umumnya digunkan dalam amilum, glukosa, fruktosa, galaktosa, sukrosa, manitol, dll. Konsentrasi yang ditambahkan untuk analisis fermentasi adalah 0,5-1%.
Macam-Macam Media Pertumbuhan
1. Medium berdasarkan sifat fisik
Medium padat yaitu media yang mengandung agar 15% sehingga setelah dingin media menjadi padat.
Medium setengah padat yaitu media yang mengandung agar 0,3-0,4% sehingga menjadi sedikit kenyal, tidak padat, tidak begitu cair. Media semi solid dibuat dengan tujuan supaya pertumbuhan mikroba dapat menyebar ke seluruh media tetapi tidak mengalami percampuran sempurna jika
(NitrogenfreeBromthymolBlue) semisolid akan membentuk cincin hijau kebiruan di bawah permukaan media, jika media ini cair maka cincin ini dapat dengan mudah hancur. Semisolid juga bertujuan untuk mencegah/menekan difusi oksigen, misalnya pada media NitrateBroth, kondisi anaerob atau sedikit oksigen meningkatkan metabolisme nitrat tetapi bakteri ini juga diharuskan tumbuh merata diseluruh media.
Medium cair yaitu media yang tidak mengandung agar, contohnya adalah NB (NutrientBroth), LB (LactoseBroth).
2. Medium berdasarkan komposisi
Medium sintesis yaitu media yang komposisi zat kimianya diketahui jenis dan takarannya secara pasti, misalnya Glucose Agar, Mac Conkey Agar.
Medium semi sintesis yaitu media yang sebagian komposisinya diketahui secara pasti, misanya PDA (Potato Dextrose Agar) yang mengandung agar, dekstrosa dan ekstrak kentang. Untuk bahan ekstrak kentang, kita tidak dapat mengetahui secara detail tentang komposisi senyawa penyusunnya.
Medium non sintesis yaitu media yang dibuat dengan komposisi yang tidak dapat diketahui secara pasti dan biasanya langsung diekstrak dari bahan dasarnya, misalnya Tomato Juice Agar, Brain Heart Infusion Agar, Pancreatic Extract.
3. Medium berdasarkan tujuan
Media untuk isolasi
Media ini mengandung semua senyawa esensial untuk pertumbuhan mikroba, misalnya Nutrient Broth, Blood Agar.
Media selektif/penghambat
Media yang selain mengandung nutrisi juga ditambah suatu zat tertentu sehingga media tersebut dapat menekan pertumbuhan mikroba lain dan merangsang pertumbuhan mikroba yang diinginkan. Contohnya adalah Luria Bertani medium yang ditambah Amphisilin untuk merangsang E.coli resisten antibotik dan menghambat kontaminan yang peka, Ampiciline. Salt broth
yang ditambah NaCl 4% untuk membunuh Streptococcus agalactiae yang toleran terhadap garam.
Media diperkaya (enrichment)
Media diperkaya adalah media yang mengandung komponen dasar untuk pertumbuhan mikroba dan ditambah komponen kompleks seperti darah, serum, kuning telur. Media diperkaya juga bersifat selektif untuk mikroba tertentu. Bakteri yang ditumbuhkan dalam media ini tidak hanya membutuhkan nutrisi sederhana untuk berkembang biak, tetapi
membutuhkan komponen kompleks, misalnya Blood Tellurite Agar, Bile Agar, Serum Agar, dll.
Media untuk peremajaan kultur
Media umum atau spesifik yang digunakan untuk peremajaan kultur
Media untuk menentukan kebutuhan nutrisi spesifik.
Media ini digunakan unutk mendiagnosis atau menganalisis metabolisme suatu mikroba. Contohnya adalah Koser’s Citratemedium, yang digunakan untuk menguji kemampuan menggunakan asam sitrat sebagai sumber karbon.
Media untuk karakterisasi bakteri
Media yang digunakan untuk mengetahui kemempuan spesifik suatu mikroba. Kadang-kadang indikator ditambahkan untuk menunjukkan adanya perubahan kimia. Contohnya adalah Nitrate Broth, Lactose Broth, Arginine Agar.
Media diferensial
Media ini bertujuan untuk mengidentifikasi mikroba dari campurannya berdasar karakter spesifik yang ditunjukkan pada media diferensial, misalnya TSIA (Triple Sugar Iron Agar) yang mampu memilih Enterobacteria berdasarkan bentuk, warna, ukuran koloni dan perubahan warna media di sekeliling koloni.
Ciri-ciri beberapa bahan kompleks yang digunakan sebagai bahan pembuat media:
Bahan Mentah Ciri Nilai Nutrisi
Ekstrak daging sapi (beef extract)
Suatau ekstrak cair jaringan daging sapi yang empuk, dikonsentrasikan menjadi pasta
Mengandung karbohidrat, senyawa nitrogen organic, vitamin yang larut dalam air dan berbagai garam
Pepton
Produk yang dihasilkan dari bahan-bahan yang mengandung protein seperti daging, kasein, dan gelatin
Sumber utama nitrogen organic, dapat pula mengandung vitamin dan kadang-kadang
karbohidrat, bergantung pada jenis bahan awal.
Agar
Suatu karbohidrat
kompleks yang diperoleh dari algae marin tertentu (agar laut), diolah untuk membuang substansi yang tidak dikehendaki
Digunakan sebagai bahan pemadat media, bukan sumber nutrient bagi bakteri
dalam bentuk bubuk (komersial)
mengandung nitrogen organic dan senyawa-senyawa karbon
Ø Pembuatan
Nutrient Agar
1.Timbang komponen medium dengan menggunakan timbangan analitis untuk volume yang diinginkan sesuai dengan komposisi berikut:
§ Beefextract 3 g § Peptone 5 g § Agar 15 g
§ Akuades s.d 1000 ml
2. Akuades sebanyak 100 ml dibagi menjadi dua satu bagian untuk melarutkan Beefextract dan peptone dan sebagian lagi untuk melarutkan agar. Sebaiknya air untuk melarutkan agar lebih banyak
3. Larutkan agar pada sebagian air tersebut dengan mengaduk secara konstan dan diberi panas. Dapat menggunakan kompor gas atau hot plate stirrer (jangan sampai
overheat, karena akan terbentuk busa dan memuai sehingga tumpah).
4.Sementara itu sebagian akuades digunakan untuk melarutkan peptone dan beef extract, cukup dengan pengadukan.
5. Setelah keduanya larut, larutan dituangkan ke larutan agar dan diaduk sampai homogen. Kemudian pH media diukur dengan mencelupkan kertas pH indikator. Jika pH tidak netral maka dapat ditambahkan HCl/NaOH.
6. Setelah itu media dimasukkan ke dalam labu Erlenmeyer dan disterilisasi dengan autoklaf.
7. Tuang media steril ke cawan petri steril secara aseptis. Jika diinginkan media tegak atau miring pada point ke 5, media langsung dituang ke tabung kemudian disterilisasi.
Ø Pembuatan
Nutrient Broth
Komposisi untuk media NB sama dengan NA tetapi tidak memakai agar sebagai pemadat. Proses pembuatannyapun lebih sederhana, tinggal melarutkan peptone
dan beef extract kemudian ditampung dalam labu Erlenmeyer atau tabung reaksi dan siap disterilisasi. Proses pembuatan ini tidak memerlukan panas, peptone dan
beef extract akan mudah larut sempurna pada air suhu kamar jika diaduk
ØPembuatan
Potato Dextrose Agar
(PDA)
1. Timbang komponen media dengan menggunakan timbangan analitis untuk volume yang diinginkan sesuai dengan komposisi berikut:
§ Potato/kentang 3 g § Peptone 5 g
§ Agar 15 g
§ Akuades s.d 1000 ml
§ (sebelum ditimbang, sebaiknya kentang dikupas dan diiris kecil-kecil)
2. Rebus kentang dalam sebagian akuades tadi selama 1-3 jam sampai lunak, kemudian diambil ekstraknya dengan menyaring dan memerasnya menggunakan kertas saring lalu ditampung di Beakerglass baru.
3. Agar dilarutkan dengan Hot Plate Stirrer dalam 50 ml akuades lalu setelah larut dapat ditambahkan dekstrosa dan dihomogenkan lagi.
4. Setelah semua larut, ekstrak kentang dan agar-dekstrosa dicampur dan dihomogenkan. Atur pH media menjadi 5-6 dengan meneteskan HCl/NaOH.
5. Media dituang ke dalam Erlenmeyer atau ke tabung reaksi kemudian siap untuk disterilisasi.
Pengertian
Sterilisasi yaitu proses atau kegiatan membebaskan suatu bahan atau benda dari semua bentuk kehidupan.
Macam-macam sterilisasi
Pada prinsipnya sterilisasi dapat dilakukan dengan 3 cara yaitu secara mekanik, fisik dan kimiawi.
1. Sterilisasi secara mekanik (filtrasi) menggunakan suatu saringan yang berpori sangat kecil (0.22 mikron atau 0.45 mikron) sehingga mikroba tertahan pada saringan tersebut. Proses ini ditujukan untuk sterilisasi bahan yang peka panas, misal nya larutan enzim dan antibiotik.
2. Sterilisasi secara fisik dapat dilakukan dengan pemanasan & penyinaran. · Pemanasan
a. Pemijaran (dengan api langsung): membakar alat pada api secara langsung, contoh alat : jarum inokulum, pinset, batang L, dll.
b. Panas kering: sterilisasi dengan oven kira-kira 60-1800C. Sterilisasi panas kering cocok untuk alat yang terbuat dari kaca misalnya erlenmeyer, tabung reaksi dll.
c. Uap air panas: konsep ini mirip dengan mengukus. Bahan yang mengandung air lebih tepat menggungakan metode ini supaya tidak terjadi dehidrasi. d. Uap air panas bertekanan : menggunalkan autoklaf
· Penyinaran dengan UV
Sinar Ultra Violet juga dapat digunakan untuk proses sterilisasi, misalnya untuk membunuh mikroba yang menempel pada permukaan interior Safety Cabinet dengan disinari lampu UV
3. Sterilisasi secara kimiawi biasanya menggunakan senyawa desinfektan antara lain alkohol.
Bab 2
Sterilisasi dengan penyaringan (filtrasi)
Sterilisasi dengan penyaringan dilakukan untuk mensterilisasi cairan yagn mudah rusak jika terkena panas atu mudah menguap (volatile). Cairan yang disterilisasi dilewatkan ke suatu saringan (ditekan dengan gaya sentrifugasi atau pompa vakum) yang berpori dengan diameter yang cukup kecil untuk menyaring bakteri. Virus tidak akan tersaring dengan metode ini.
Sterilisasi dengan penyaringan dapat dilakukan dengan berbagai cara : · Non-disposable filtration apparatus
- Disedot dengan pompa vakum - Volume 20-1000 ml
· Disposable filter cup unit
- Disedot dengan pompa vakum - Volume 15-1000 ml
· Disposable filtration unit dengan botol penyimpan - Disedot dengan pompa vakum
- Volume 15-1000 ml
· Syringe filters
- Ditekan seperti jarum suntik - Volume 1-20 ml
· Spin filters
- Ditekan dengan gaya setrifugasi - Volume kurang dari 1 ml
Cara kerja menggunakan Non-disposable filtration apparatus
· Sterilkan saringan (dapat menggunakan saringan Bekerfeld, Chamberland Zeitz), membran penyaring (kertas saring) dan erlenmeyer penampung.
· Pasang atau rakit alat-alat tersebut secara aseptis (sesuai gambar), lalu isi corong dengan larutan yang akan disterilkan.
· Hubungkan katup erlenmeyer dengan pompa vakum kemudian hidupkan pompa. · setelah semua larutan melewati membran filter dan tertampung dierlenmeyer, maka larutan dapat dipindahkan kedalam gelas penampung lain yang sudah steril dan tutup dengan kapas atau aluminium foil yang steril.
Tyndalisasi
Konsep kerja metode ini merip dengan mengukus. Bahan yang mengandung air dan tidak tahan tekanan atau suhu tinggi lebih tepat disterilkan dengan metode ini. Misalnya susu yang disterilkan dengan suhu tinggi akan mengalami koagulasi dan bahan yang berpati disterilkan pada suhu bertekanan pada kondisi pH asam akan terhidrolisis.
Cara kerja :
· Bahan dimasukkan kedalam erlenmeyer atau botol dan ditutup rapat dengan sumbat atau aluminium foil.
· Erlenmeyer/botol lalu dimasukkan kedalam alat sterilisasi (alat standar menggunakan Arnold Steam Sterilizen atau dandang).
· Nyalakan sumber panas dan tunggu hingga termometer menunjukkan suhu 1000C kemudian hitung waktu mundur hingga 30 menit (uap panas yang terbentuk akan mematikan mikroba).
· Setelah selesai alat sterilisasi dimatikan dan bahan yang steril dikeluarkan. · Setelah 24 jam, bahan tersebut di sterilkan lagi dengan cara yang sama, sedang waktu ini dimaksudkan untuk memberi kesempatan spora atau sel vegetatif yang belum mati untuk tumbuh sehingga mudah dibunuh.
Sterilisasi dengan udara panas (Dry heat sterilization)
Sterilisasi dengan metode ini biasanya digunakan untuk peralatan gelas seperti cawan petri, pipet ukur dan labu erlenmyer. Alat gelas yang disterilisasi dengan udara panas tidak akan timbul kondensasi sehingga tidak ada tetes air (embun)
· Bungkus alat-alat gelas dengan kertas payung atau aluminium foil
· Atur pengatur suhu oven menjadi 1800C dan alat disterilkan selama 2-3 jam. Prinsip kerja Biological Saferty Cabinet atau Laminar Air Flow
Biological Safety Cabinet merupakan kabinet kerja yang sterilkan untuk kerja mikrobiologi. BSC memiliki suatu pengatur aliran udara yang menciptakan aliran udara kotor (dimungkinkan ada kontaminan) untuk disaring dan diresirkulasi melalui filter.
BSC juga disebut biosafety hood, dan juga dikenal dengan Laminar flowhood atau
Class II vertical flow cabinet yang menyediakan alat filtrasi dan aliran udara yang bersirkulasi didalam ruang kerja. Aliran udara diatur untuk menghambat udara luar masuk dan udara di dalam keluar, untuk mencegah kontaminasi dari luar dan pencemaran bakteri dari ruang BSC. Udara yang keluar disaring melewati
penyaring sehingga sel-sel yang berbahaya tidak lepas keluar ke ruangan lain. Berbagai kelas Biological Safety Cabinet.
TEKNIK KERJA ASEPTIS (TANPA KONTAMINASI)
Tehnik aseptis atau steril adalah suatu sistem cara bekerja (praktek) yang menjaga sterilitas ketika menangani pengkulturan mikroorganisme untuk mencegah kontaminasi terhadap kultur mikroorganisme yang diinginkan.
Dasar digunakannya tehnik aseptik adalah adanya banyak partikel debu yang mengandung mikroorganisme (bakteri atau spora) yang mungkin dapat masuk ke dalam cawan, mulut erlenmeyer, atau mengendap di area kerja. Pertumbuhan mikroba yang tidak diinginkan ini dapat mempengaruhi atau mengganggu hasil dari suatu percobaan.
Mikroorganisme dapat juga ”jatuh” dari tangan operator, sarung tangan atau jas laboratorium karena pergerakan lengan yang relatif cepat. Penggunaan tehnik aseptik meminimalisir material yang digunakan terhadap agen pengontaminasi. Pada kenyataanya tehnik aspetis tidak dapat melindungi secara sempurna dari bahaya kontaminan. Namun semakin banyak belajar dari pengalaman maka semakin mengurangi resiko yang
ditimbulkan.
Tehnik aseptis digunakan pada saat :
- Teknik aseptis seharusnya digunakan saat kita bekerja dengan mikroorganisme hidup dan dengan segala media pertumbuhannya.
- Teknik aseptis sebaiknya digunakan ketika kita tidak ingin larutan dari suatu botol tidak berubah sifat akibat aktivitas mikroorganisme, seperti saat membuat buffer meskipun buffer dengan konsentrasi garam tinggi atau mengandung deterjen.
- Teknik aseptis disarankan pada saat kita bekerja menggunakan agen atau senyawa yang berbahaya seperti bahan kimia beracun atau bahan radioaktif. Tentu saja perlindungan diri sendiri dari bahaya senyawa ini lebih penting.
Beberapa contoh :
- Mentransfer biakan dari media satu ke media lainnya. Bakteri kontaminan yang tumbuh tentu saja dapat mengganggu kemurnian biakan dan mungkin saja membuat rancu hasil yang didapatkan.
- Memfilter media atau serum dan menghitung jumlah bakteri dengan cara filtrasi. Kontaminasi yang ikut tersaring dapat tumbuh pada media baru yang membuat tidak terpakainya media pertumbuhan tersebut atau mempengaruhi jumlah total bakteri. - Membuka dan merehidrasi bakteri terliofolisasi. Teknik aseptis dapat menjaga sel yang terrehidrasi dari bakteri kontaminan dan menjaga tidak keluarnya sel ke meja kerja. - Melakukan reaksi restriksi atau PCR. Walaupun enzim restriksi pada umumnya disimpan dalam gliserol 50% (bakteriostatik) tapi enzim yang diencerkan akan lebih rentan rusak akibat aktivitas mikroorganisme atau dihambat oleh ion atau unsur tertentu. Kontaminasi DNA asing yang masuk ke dalam tube PCR mungkin dapat teramplifikasi sehingga hasil yang didapat membingungkan.
- Melabeli sel dengan (32P) fosfat. Pada kasus ini kerja aseptis ditujukan untuk melindungi operator dari bahan kimia berbahaya. Jika menggunakan teknik aseptis maka Anda tidak akan membiarkan tutup bahan radioaktif terbuka atau secara tidak sengaja menggunakan pipet bekas bahan radioaktif.
Aturan umum tehnik aseptis:
- Meja kerja sebaiknya jauh dari sesuatu yang dapat menciptakan aliran udara, misalnya tidak ada jendela yang terbuka, tidak dekat dengan pintu yang selalu dibuka-tutup dan jauh dari lalu-lintas orang. Penggunaan kabinet biosafety dapat menjaga dan mengatur aliran udara tetapi ini bukan merupakan suatu jaminan mutlak dari resiko terkontaminasi. - Pastikan meja kerja bersih dari kotoran dan benda-benda yang tidak akan digunakan. Kultur tua atau pipet bekas seharusnya tidak berada di meja kerja. Kotoran seringkali sulit dibersihkan pada sudut-sudut ruang.
sebagian besar laboratorium umumnya menggunakan etanol 70% untuk membersihkannya. Sediakan etanol pada posisi selalu dekat dengan meja. Jika telah selesai bekerja, sebaiknya meja kerja dikosongkan dari peralatan dan bersihkan lagi.
- Semua peralatan (pipet, cawan dll.) yang digunakan harus steril. Sebaiknya semua peralatan yang telah disterilisasi diberi label. Jika menemukan alat yang sepertinya telah disterilisai tapi masih ragu terhadap sterilitasnya maka sebaiknya jangan digunakan. Bungkus peralatan baik alat steril sekali pakai atau bukan (pipet, syringe dll.)diperiksa terlebih dahulu apakah terdapat kebocoran atau tersobek.
- Atur peralatan di meja kerja sedemikian rupa sehingga meminimalisir pergerakan tangan. Alat-alat yang biasanya digunakan dengan tangan kanan (jarum inokulum, filler, pipet dll.) letakkan disebelah kanan begitu juga sebaliknya (rak tabung, cawan petri,
erlenmeyer dll.) terkecuali untuk tangan kidal. Di bagian tengah meja kerja disediakan ruang lapang untuk bekerja.
- Membakar mulut atau bagian tepi dari suatu alat dapat membunuh mikroorganisme yang menempel.
- Telah siap dengan segala peralatan dan bahan yang dibutuhkan. Semua bahan dan alat untuk prosedur tertentu telah dipersiapkan di meja kerja. Jangan sampai meninggalkan meja kerja untuk mengambil sesuatu yang terlupa atau tertinggal. Perhitungkan semua yang diperlukan beserta cadangannya.
- Pakai sarung tangan lateks dan ganti secara berkala. Sarung tangan membantu melindungi dari tumpahan biakan atau bahan kimia berbahaya. Tidak menggunakan sarung tangan dirasa tidak bermasalah jika materi dan bakteri yang diteliti dipastikan tidak berbahaya. - Cuci tangan sebelum dan sesudah bekerja. Cuci tangan dengan desinfektan atau sabun bila tidak ada desinfektan. Cuci tangan dapat membilas mikroorganisme yang ada di tangan.
Saran-saran tehnik aseptis:
- Minimalisasi gerak : pergerakan tangan dapat menciptakan aliran udara . semakin cepat pergerakannya semakin cepat aliran udara yang ditimbulkan. Pergerakan lengan sebaiknya dilakukan seperlu mungin dan bergerak secara lembut.
- Minimalisasi jarak: jarak antar peralatan diatur seefektif dan seefisien mungkn. Antar peralatan jangan diletakkan terlalu jauh.
- Minimalisasi keterpaparan : semakin sering menggerakkan sesuatu (mis: cawan berisi media) melewati udara maka semakin besar partikel udara untuk masuk. Semakin lama tutup erlenmeyer terbuka juga semakin besar terkontaminasi.
Catatan penting dalam kerja aspetis :
- Tutup erlenmeyer, botol atau cawan sebaiknya dibuka kira-kira 450. tujuannya untuk meminimalisasi udara masuk namun masih dapat mentransfer sesuatu.
- Jika diharuskan untuk membuka penuh dan tutup diletakkan di meja kerja, maka tutup dapat diletakkan tertelungkup atau terlentang (muka menghadap ke atas). Jika tertelungkup pastikan permukaannya bersih dan bila terlentang pastikan juga tidak ada gerakan di
atasnya.
- Untuk menghindari bakteri yang menempel pada jarum inokulum terpental/terciprat maka diameter loops harus berkisar 2-3 mm dan untuk memperkecil getaran panjang kawat tidak
lebih dari 6cm.
- Tidak boleh menyedot cairan pada saat pippeting dengan mulut.
- Untuk menghindari penyebaran mikroba dari tetesan pipet yang terjatuh maka dapat digunakan kain steril yang diberi desinfektan sebagai alas. Kain ini setelah selesai dibuang sebagai limbah berbahaya.
UJI STERILITAS
Uji sterilitas dilakukan untuk mengetahui apakah bahan atau sediaan yang harus steril sudah memenuhi syarat atau tidak. Uji sterilitas dilakukan secara mikrobiologi dengan menggunakan medium pertumbuhan tertentu. Media untuk pengujian diperlukan dalam uji ini. Beberapa media yang dapat digunakan dalam pengujian ini adalah :
1. Media Tioglikolat Cair
Komposisi : L-sistin P 0,5 g NaCl P 2,5 g Glukosa P 5,5 g Agar P Granul 0,75 g Ekstrak ragi P 5,0 g
Digesti pancreas kasein P 15,0 g
Natrium tioglikolat atau P 0,5 g
Asam tioglikolat P 0,3 ml
Larutan natrium resazurin P 1,0 ml
Air 1000 ml
pH setelah sterilisasi 7,1 ± 0,2
Campur dan panaskan hingga larut. Atur pH larutan hingga setelah sterilisasi 7,1 ± 0,2 menggunakan NaOH 1 N. jika perlu saring selagi panas menggunakan kertas saring. Tempatkan media dalam tabung yang sesuai, yang memberikan perbandingan permukaan dengan kedalaman media sedemikian rupa sehingga tidak lebih dari setengah bagian atas media yang mengalami perubahan warna sebagai indikasi masuknya oksigen pada akhir masa inkubasi. Sterilisasi dalam autoklaf. Jika lebih dari sepertiga bagian atas terjadi perubahan warna merah muda, media dapat diperbaiki satu kali dengan pemanasan di atas tangas air atau dalam uap yang mengalir bebas hingga warna merah muda hilang. Media siap digunakan jika tidak lebih dari sepersepuluh bagian atas media berwarna merah muda.
2. Media Tioglikolat Alternatif
Komposisi :
L-sistin P 0,5 g
NaCl P 2,5 g
Glukosa P 5,5 g
Ekstrak ragi P 5,0 g
Digesti pancreas kasein P 15,0 g
Natrium tioglikolat atau P 0,5 ml
Asam tioglikolat P 0,3 ml
Air 1000 ml
Komposisi :
Digesti pancreas kasein P 17 ,0 g
Digesti papaik tepung kedele 3,0 g
NaCl P 5,0 g
Kalium fosfat dibasa P 2,5 g
Glukosa P 2,5 g
Air 1000 ml
pH setelah sterilisasi 7,3 ± 0,2 Tabel Jumlah Untuk Bahan Cair Isi Wadah (ml)
Volume minimum
(ml)
Vol. minimum untuk media
Jumlah Wadah Permedia Untuk inokulasi
langsung Untuk membran
< 1 < 10 10 – 50 50 – <100 50 – <100 (I.V) 100 – 500 > 500 Semua 1 5 10 Semua Semua Semua 15 15 40 80 - - - 100 100 100 100 100 100 100 20 20 20 20 10 10 10
Prosedur pengujian terdiri dari (1) inokulasi langsung ke dalam media uji dan (2) teknik penyaringan membran. Penyaringan membran berguna untuk cairan dan serbuk yang dapat larut yang bersifat bakteriostatik atau fungistatik, untuk memisahkan mikroba kontaminan dari penghambat pertumbuhan. Cara ini juga sangat bergun untuk bahan seperti minyak, salep/krim yang dapat melarut ke dalam larutan pengencer bukan bakteriostatik atau bukan fungistatik. Teknik penyaringan membran dapat juga digunakan untuk uji sterilitas permukaan atau lumen kritis alat-alat kesehatan.
Perincian dari prosedur inokulasi dan penyaringan tabung uji, termasuk modifikasi-modifikasi untuk keadaan tertentu, terdapat dalam USP. Penafsiran dan metode uji. Prinsip faktor pelaksanaan dalam uji tersebut adalah bahwa bagian bahan yang akan di uji di tempatkan dalam lingkungan yang dirancang sedemikian rupa, sehingga tiap organisme yang ada hidup dan tumbuh. Tetapi diketahui bahwa mikroorganisme tidak selalu bereproduksi atau bervegatasi (spora) hanya dengan menempatkannya dilingkungan yang diperkirakan baik. Pelemahan yang diakibatkan oleh radiasi sinar
ultraviolet atau pemaparan non lethal terhadap panas, tidak adanya stimulasi yang seringkali perlu untuk membuat spora bervegetasi, dan kontak sebelumnya dengan suatu zat bakteriostatik adalah beberapa efek yang biasa mengganggu pertumbuhan organisme tersebut. Dalam hal seperti itu akan diperoleh hasil negative palsu.
Prosedur sterilisasi merupakan tahap penting dalam mencapai produk steril, namun semua prosedur dan kondisi-kondisi lain yang dibutuhkan untuk pembuatan produk tersebut harus dirancang untuk membantu tahap ini. Pembersihan ruangan yang baik, lingkungan yang terkontrol dengan efektif, suatu muatan dari produk yang dapat dikontrol dan diidentifikasi, proses produksi yang direncanakan dan dikontrol dengan baik, serta personel yang ditatar dengan baik dan berdedikasi tinggi untuk produksi dan pengujian sangat penting untuk produksi suatu produk steril. Hanya bila semua factor ini melengkapi penemuan-penemuan dari uji sterilisasi, dapatlah disimpulkan dengan penuh kepercayaan bahwa produk tersebut steril.
Pengertian
Di alam populasi mikroba tidak terpisah sendiri menurut jenisnya, tetapi terdiri dari campuran berbagai macam sel. Di dalam laboratorium populasi bakteri inidapat diisolasi menjadi kultur murni yang terdiri dari satu jenis yang dapat dipelajari morfologi, sifat dan kemampuan biokimiawinya.
Teknik Pengambilan Sampel
Sebelum melakukan isolasi terlebih dahulu dilakukan pengambilan sampel. Berikut merupakan prosedur pengambilan sampel.
1. Sampel tanah
Jika mikroorganisme yang diinginkan kemungkinan berada di dalam tanah, maka cara pengambilannya disesuaikan dengan tujuan dan kebutuhan. Misal jika yang diinginkan mikroorganisma rhizosfer maka sampel diambil dari sekitar
perakaran dekat permukaan hingga ujung perakaran.. 2. Sampel air
Pengambilan sampel air bergantung kepada keadaan air itu sendiri. Jika beerasal dari air sungai yang mengalir maka botol dicelupkan miring dengan bibir botol melawan arus air. Bila pengambilan sampel dilakukan pada air yang tenang, botol dapat dicelupkan dengan tali, jika ingin mengambil sampel dari air keran maka sebelumya keran dialirkan dulu beberapa saat dan mulut kran dibakar.
Bab 3
Isolasi & Inokulasi
Mikroorganisme
Isolasi Dengan Cara Pengenceran (
Dilution
)
1. Teknik Preparasi Suspensi
Sampel yang telah diambil kemudian disuspensikan dalam akuades steril. Tujuan dari teknik ini pada prinsipnya adalah melarutkan atau melepaskan mikroba dari substratnya ke dalam air sehingga lebih mudah penanganannya. Macam-macam preparsi bergantung kepada bentuk sampel :
a. Swab (ulas), dilakukan menggunakan cotton bud steril pada sampel yang memiliki permukaan luas dan pada umumnya sulit dipindahkan atau sesuatu pada benda tersebut. Contohnya adalah meja, batu, batang kayu dll. Caranya dengan mengusapkan cotton bud memutar sehingga seluruh permukaan kapas dari cotton bud kontak dengan
permukaan sampel. Swab akan lebih baik jika cotton bud dicelupkan terlebih dahulu ke dalam larutan atraktan semisal pepton water.
b. Rinse (bilas) ditujukan untuk melarutkan sel-sel mikroba yang menempel pada permukaan substrat yang luas tapi relatif berukuran kecil, misalnya daun bunga dll. Rinse merupakan prosedur kerja dengan mencelupkan sampel ke dalam akuades dengan perbandingan 1 : 9 (w/v). Contohnya sampel daun diambil dan ditimbang 5 g kemudian dibilas dengan akuades 45 ml yang terdapat dalam beakerglass.
c. Maseration (pengancuran), sampel yang berbentuk padat dapat ditumbuk dengan mortar dan pestle sehingga mikroba yang ada
dipermukaan atau di dalam dapat terlepas kemudian dilarutkan ke dalam air. Contoh sampelnya antar alain bakso, biji, buah dll. Perbandingan antar berat sampel dengan pengenceran pertama adalah 1 : 9 (w/v). Unutk sampel dari tanh tak perlu dimaserasi
Tujuan dari pengenceran bertingkat yaitu memperkecil atau mengurangi jumlah mikroba yang tersuspensi dalam cairan. Penentuan besarnya atau banyaknya tingkat pengenceran tergantung kepada perkiraan jumlah mikroba dalam sampel.
Digunakan perbandingan 1 : 9 untuk sampel dan pengenceran pertama dan selanjutnya, sehingga pengenceran berikutnya mengandung 1/10 sel mikroorganisma dari pengenceran sebelumnya.
Cara Kerja :
a. Sampel yang mengandung bakteri dimasukan ke dalam tabung pengenceran pertama (1/10 atau 10-1) secara aseptis (dari preparasi suspensi). Perbandingan berat sampel dengan volume tabung pertama adalah 1 : 9 dan ingat akuades yang digunakan jika memakai teknik rinse dan swab sudah termasuk pengencer 10-1. Setelah sampel masuk lalu dilarutkan dengan mengocoknya (pengocokan yang benar dapat dilihat pada gambar disamping)
b. Diambil 1 ml dari tabung 10-1 dengan pipet ukur kemudian dipindahkan ke tabung 10-2 secara aseptis kemudian dikocok dengan membenturkan tabung ke telapak tangan sampai homogen. Pemindahan dilanjutkan hingga tabung pengenceran terakhir dengan cara yang sama, hal yang perlu diingat bahwa pipet ukur yang digunakan harus selalu diganti, artinya setiap tingkat pengenceran digunakan pipet ukur steril yang berbeda/baru. Prinsipnya bahwa pipet tidak perlu diganti jika memindahkan cairan dari sumber yang sama.
3. Teknik Penanaman
a. Teknik penanaman dari suspensi
Teknik penanaman ini merupakan lajutan dari pengenceran bertingkat. Pengambilan suspensi dapat diambil dari pengenceran mana saja tapi biasanya untuk tujuan isolasi (mendapatkan koloni tunggal) diambil beberapa tabung pengenceran terakhir.
a.1. Spread Plate (agar tabur ulas)
Spread plate adalah teknik menanam dengan menyebarkan suspensi bakteri di permukaan agar diperoleh kultur murni. Adapun prosedur kerja yang dapat dilakukan adalah sebagai berikut :
Ambil suspensi cairan senamyak 0,1 ml dengan pipet ukur kemudian teteskan diatas permukaan agar yang telah memadat.
Batang L atau batang drugal diambil kemudian disemprot alkohol dan dibakar diatas bunsen beberapa saat, kemudian didinginkan dan ditunggu beberapa detik.
Kemudian disebarkan dengan menggosokannya pada permukaan agar supaya tetesan suspensi merata, penyebaran akan lebih efektif bila cawan ikut diputar.
Hal yang perlu diingat bahwa batang L yang terlalu panas dapat menyebabkan sel-sel mikroorganisme dapat mati karena panas.
a.2. Pour Plate (agar tuang)
Teknik ini memerlukan agar yang belum padat (>45oC) untuk dituang bersama suspensi bakteri ke dalam cawan petri lalu kemudian dihomogenkan dan dibiarkan memadat. Hal ini akan menyebarkan sel-sel bakteri tidak hanya pada permukaan agar saja melainkan sel terendam agar (di dalam agar) sehingga terdapat sel yang tumbuh dipermukaan agar yang kaya O2 dan ada yang tumbuh di dalam agar yang tidak banyak begitu banyak mengandung oksigen. Adapun prosedur kerja yang dilakukan adalah sebagai berikut :
Siapkan cawan steril, tabung pengenceran yang akan ditanam dan media padat yang masih cair (>45oC)
Teteskan 1 ml secara aseptis.suspensi sel kedalam cawan kosong
Tuangkan media yang masih cair ke cawan kemudian putar cawan untuk menghomogenkan suspensi bakteri dan media, kemudian diinkubasi.
Alasan diteteskannya bakteri sebanyak 0,1 ml untuk spread plate dan 1 ml untuk pour plate karena spread plate ditujukan untuk menumbuhkan dipermukaanya saja, sedangkan pour plate membutuhkan ruang yang lebih luas untuk penyebarannya sehingga diberikan lebih banyak dari pada spread plate.
b. Teknik Penanaman dengan Goresan (Streak)
Bertujuan untuk mengisolasi mikroorganisme dari campurannya atau meremajakan kultur ke dalam medium baru.
b.1 Goresan Sinambung Cara kerja :
Sentuhkan inokulum loop pada koloni dan gores secara kontinyu sampai setengah permukaan agar.
Jangan pijarkan loop, lalu putar cawan 180oC lanjutkan goresan sampai habis. Goresan sinambung umumnya digunakan bukan untuk mendapatkan koloni tunggal, melainkan untuk peremajaan ke cawan atau medium baru.
b.2 Goresan T Cara kerja :
Bagi cawan menjadi 3 bagian menggunakan spidol marker
Inokulasi daerah 1 dengan streak zig-zag
Panaskan jarum inokulan dan tunggu dingin, kemudian lanjutkan streak zig-zag pada daerah 2 (streak pada gambar). Cawan diputar untuk memperoleh goresan yang sempurna
B.3 Goresan Kuadran (Streakquadrant) Cara kerja :
Hampir sama dengan goresan T, namun berpola goresan yang berbeda yaitu dibagi empat. Daerah 1 merupakan goresan awal sehingga masih mengandung banyak sel mikroorganisma.Goresan selanjutnya dipotongkan atau disilangkan dari goresan pertama sehingga jumlah semakin sedikit dan akhirnya terpisah-pisah menjadi koloni tunggal.
Cara Kerja Isolasi Bakteri dari Sampel Tanah :
1. Tanah seberat 1 g dimasukan ke dalam tabung pengenceran 10-1 secara aseptis dan selanjutnya dilakukan pengenceran bertingkat sampai 10-8 2. Tiga pengenceran terakhir diambil 0,1 ml untuk ditanam secara spread plate
pada medium NA, setelah selesai, diinkubasi pada 37oC selama 1x24 jam 3. Koloni akan tumbuh pada ketiga cawan tersebut kemudian dipilih koloni
yang relatif terpisah dari koloni lain dan koloni yang mudah dikenali 4. Koloni yang terpilih kemudian ditumbuhkan atau dimurnikan ke NA baru
dengan teknik streak kuadran 5. Inkubasi 1x24 jam.
Cara Kerja Isolasi Jamur dari Tanah :
1. Tanah dalam cawan petri dipanaskan dengan oven pada suhu 80oC selama 30 menit dengan cawan petri untuk membunuh sel vegetatiftetap bertahan 2. Tanah yang telah dioven diambil 1 g kemudian dimasukan ke dalam tabung
pengenceran bertingkat
3. Tiga pengenceran terakhir diambil untuk ditanama secara spread plate ke media PDA yang ditambah streptomycin atau penicillin. Kemudian
diinkubnasi pada suhu ruang 5-7 hari
4. Koloni jamur yang tumbuh dimurnikan dan ditanam pada medium PDA baru, 5. Inkubasi pada suhu ruang 5-7 hari.
Biakan Penyuburan:
Digunakan untuk meningkatkan peluang terisolasinya suatu organisme yang mempunyai beberapa ciri fisiologi atau biokimiawi yang unik. Langkahnya adalah sebagai berikut:
Lakukan pemindahan biakan secara berturut-turut (5-6 kali) dalam medium berisikan nutrient yang dikehendaki
Mikroorganisme atau mikroba adalah organisme yang berukuran sangat kecil sehingga untuk mengamatinya diperlukan alat bantu. Mikroorganisme disebut juga organisme mikroskopik . Mikroorganisme seringkali bersel tunggal (uniseluler) maupun bersel banyak (multiseluler) . Namun, beberapa protista bersel tunggal masih terlihat oleh mata telanjang dan ada beberapa spesies multisel tidak terlihat mata telanjang. Virus juga termasuk ke dalam mikroorganisme meskipun tidak bersifat seluler .
Perbandingan ukuran sel prokariot dengan sel lain dan biomolekul (skala logaritma)
Bakteri
A. Mengamati Morfologi Bakteri
Struktur bakteri terbagi menjadi dua yaitu:
1. Struktur dasar (dimiliki oleh hampir semua jenis bakteri)
Meliputi: dinding sel, membran plasma, sitoplasma, ribosom, DNA, dan granula penyimpanan
2. Struktur tambahan (dimiliki oleh jenis bakteri tertentu)
Meliputi kapsul, flagelum, pilus, fimbria, klorosom, Vakuola gas dan endospora. Struktur dasar sel bakteri:
1. Dinding sel tersusun dari peptidoglikan yaitu gabungan protein dan polisakarida (ketebalan peptidoglikan membagi bakteri menjadi bakteri
Bab 4
gram positif bila peptidoglikannya tebal dan bakteri gram negatif bila peptidoglikannya tipis).
2. Membran plasma adalah membran yang menyelubungi sitoplasma tersusun atas lapisan fosfolipid dan protein.
3. Sitoplasma adalah cairan sel.
4. Ribosom adalah organel yang tersebar dalam sitoplasma, tersusun atas protein dan RNA.
5. Granula penyimpanan, karena bakteri menyimpan cadangan makanan yang dibutuhkan.
Struktur tambahan bakteri :
1. Kapsul atau lapisan lendir adalah lapisan di luar dinding sel pada jenis bakteri tertentu, bila lapisannya tebal disebut kapsul dan bila lapisannya tipis disebut lapisan lendir. Kapsul dan lapisan lendir tersusun atas polisakarida dan air. 2.Flagelum atau bulu cambuk adalah struktur berbentuk batang atau spiral
yang menonjol dari dinding sel.
3.Pilus dan fimbria adalah struktur berbentuk seperti rambut halus yang menonjol dari dinding sel, pilus mirip dengan flagelum tetapi lebih pendek, kaku dan berdiameter lebih kecil dan tersusun dari protein dan hanya terdapat pada bakteri gram negatif. Fimbria adalah struktur sejenis pilus tetapi lebih pendek daripada pilus.
4.Klorosom adalah struktur yang berada tepat dibawah membran plasma dan mengandung pigmen klorofil dan pigmen lainnya untuk proses fotosintesis. Klorosom hanya terdapat pada bakteri yang melakukan fotosintesis.
5. Vakuola gas terdapat pada bakteri yang hidup di air dan berfotosintesis. 6.Endospora adalah bentuk istirahat (laten) dari beberapa jenis bakteri gram
positif dan terbentuk didalam sel bakteri jika kondisi tidak menguntungkan bagi kehidupan bakteri. Endospora mengandung sedikit sitoplasma, materi genetik, dan ribosom. Dinding endospora yang tebal tersusun atas protein dan menyebabkan endospora tahan terhadap kekeringan, radiasi cahaya, suhu tinggi dan zat kimia. Jika kondisi lingkungan menguntungkan endospora akan tumbuh menjadi sel bakteri baru.
B. Mengamati Morfologi Koloni Bakteri
Kegiatan ini merupakan tindakan pertama kali jika ingin mempelajari suatu jenis bakteri lebih lanjut, khususnya untuk tujuan identifikasi. Setelah mendapatkan kultur murni maka biakan yang diinginkan ditumbuhkan ke berbagai bentuk media untuk dikenali ciri koloninya.
Cara Kerja :
· Tumbuhkan biakan pada media NA cawan dengan streak kuadran
· Tumbuhkan biakan pada media NA miring dengan pola inokulasi yang tegak lurus
· Tumbuhkan biakan pada media NA tegak dengan stabinoculation
· Tumbuhkan biakan pada media NB
A.1. Pertumbuhan pada Cawan Petri
Ciri-ciri yang perlu diperhatikan adalah sebagai berikut :
· Ukuran; a a. pinpoint/punctiform (titik) b
b. Small (kecil)
c. Moderate (sedang) c
d. Large (besar) d
· Pigmentasi :
mikroorganisme kromogenik sering memproduksi pigmen intraseluler, beberapa jenis lain memproduksi pigmen ekstraseluler yang dapat terlarut dalam media
· Karakteristik optik : diamati berdasarkan jumlah cahaya yang melewati koloni. a. Opaque (tidak dapat ditembus cahaya)
b. Translucent (dapat ditembus cahaya sebagian) c. Transparant (bening) · Bentuk : a. Circular a b. Irregular c. Spindle d. Filamentous b e. Rhizoid c d e - Elevasi : a. Flat a b. Raised c. Convex b d. Umbonate c d · Permukaan : a. Halus mengkilap b. Kasar c. Berkerut
· Margins : 1 1. Entire 2 2. Lobate 3. Undulate 4. Serrate 3 5. Felamentous 6. Curled 4 6
A.2. Pertumbuhan pada Agar Miring
Ciri-ciri koloni diperoleh dengan menggoreskan jarum inokulum tegak dan lurus Ciri koloni berdasarkan bentuk:
A.3 Pertumbuhan pada Agar Tegak
Cara penanaman adalah dengan menusukkan jarum inokulum needle ke dalam media agar tegak.
Ciri koloni berdasar kebutuhan O2 :
A.4 Pertumbuhan pada Media Cair
Pola pertumbuhan berdasarkan kebutuhan O2
A. Mengamati Morfologi Bakteri
Sel bakteri dapat teramati dengan jelas jika digunakan mikroskop dengan perbesaran 100x10 yang ditambah minyak imersi. Jika dibuat preparat ulas tanpa pewarnaan, sel bakteri sulit terlihat. Pewarnaan bertujuan untuk memperjelas sel bakteri dengan menempelkan zat warna ke permukaan sel bakteri. Zat warna dapat mengabsorbsi dan membiaskan cahaya, sehingga kontras sel bakteri dengan sekelilingnya ditingkatkan.
Zat warna yang digunakan bersifat asam atau basa. Pada zat warna basa, bagian yang berperan dalam memberikan warna disebut kromofor dan mempunyai muatan positif. Sebaliknya pada zat warna asam bagian yang berperan memberikan zat warna memiliki muatan negatif. Zat warna basa lebih banyak digunakan karena muatan negatif banyak banyak ditemukan pada permukaan sel. Contoh zat warna
asam antara lain Crystal Violet, Methylene Blue, Safranin, Base Fuchsin, Malachite Green dll. Sedangkan zat warna basa antara lain Eosin, Congo Red dll.
Pewarnaan
Pewarnaan sederhana Pewarnaan diferensial Pewarnaan khusus
pewarnaan positif pewarnaan gram pewarnaan endospora pewarnaan negatif pewarnaan acid fast dll. pewarnaan flagella dll.
B.1. Pewarnaan Sederhana (Pewarnaan Positif)
Merupakan pewarnaan yang hanya menggunakan satu jenis zat pewarna (tunggal). Misalnya metylen blue, Carbol fuchsin, dll.
Sebelum dilakukan pewarnaan dibuat ulasan bakteri di atas object glass yang kemudian difiksasi. Jangan menggunakan suspensi bakteri yang terlalu padat, tapi jika suspensi bakteri terlalu encer, maka akan diperoleh kesulitan saat mencari bakteri dengan mikroskop. Fiksasi bertujuan untuk mematikan bakteri dan melekatkan sel bakteri pada object glass tanpa merusak struktur selnya.
Cara Kerja :
· Bersihkan object glass dengan kapas
· Jika perlu tulislah kode atau nama bakteri pada sudut object glass
· Bila menggunakan biakan cair maka pindahkan setetes biakan dengan pipet tetes atau dapat juga dipindahkan dengan jarum inokulum. Jangan lupa biakan dikocok terlebih dahulu. Jika digunakan biakan padat, maka biakan dipindahkan dengan jarum inokulum, satu ulasan saja kemudian diberi akuades dan disebarkan supaya sel merata.
· Keringkan ulasan tersebut sambil memfiksasinya dengan api bunsen (lewatkan di atas api 2-3 kali)
· Setelah benar-benar kering dan tersebar selanjutnya ditetesi dengan pewarna (dapat digunakan Methylen blue, Safranin, CrystalViolet) dan tunggu kurang lebih 30 detik.
· Cuci dengan akuades kemudian keringkan dengan kertas tissue
B.2 Pewarnaan Negatif
Beberapa bakteri sulit diwarnai dengan zat warna basa. Tapi mudah dilihat dengan pewarnaan negatif. Zat warna tidak akan mewarnai sel melainkan mewarnai lingkungan sekitarnya, sehingga sel tampak transparan dengan latar belakang hitam. Prosedur:
1. Ambil dua object glass, teteskan nigrosin atau tinta cina di ujung kanan salah satu object glass
2. Biakan diambil lalu diulaskan atau diteteskan dalam tetesan nigrosin tadi, lalu dicampurkan
3. Tempelkan sisi object glass yang lain kemudian gesekkan ke samping kiri 4. Biarkan preparat mengering di udara, jangan difiksasi atau dipanaskan di atas
api.
3 4
5. Setelah dilihat di mikroskop, maka akan tampak bentuk sel bakteri.
A.3. Pewarnaan Gram
Adalah pewarnaan diferensial yang sangat berguna dan paling banyak digunakan dalam laboratorium mikrobiologi, karena merupakan tahapan penting dalam langkah awal identifikasi. Pewarnaan ini didasarkan pada tebal atau tipisnya lapisan peptidoglikan di dinding sel dan banyak sedikitnya lapisan lemak pada membran sel bakteri. Jenis bakteri berdasarkan pewarnaan gram dibagi menjadi dua yaitu gram positif dan gram negatif. Bakteri gram positif memiliki dinding sel yang tebal dan membran sel selapis. Sedangkan baktri gram negatif mempunyai dinding sel tipis yang berada di antara dua lapis membran sel. Berikut merupakan tabel prosedur pewarnaan Gram:
Dengan metode ini, biasanya bakteri Gram (+) berwarna ungu dan Gram (-) berwarna merah. Perbedaan tersebut karea perbedaan struktur dinding sel bakteri Gram (+) yang mengandung peptidoglikan dan Gram (-) yang mengandung kadar lipid yang tinggi sehingga terjadi perbedaan reaksi dalam permiabilitas zat warna dan penambahan zat pemucat.
Hal-hal yang perlu diperhatikan dalam pewarnaan gram adalah sbb:
a. Fase yang paling kritis dari prosedur di atas adalah tahap dekolorisasi yang mengakibatkan CV-iodine lepas dari sel. Pemberian ethanol jangan sampai
berlebih yang akan menyebabkan overdecolorization sehingga sel gram positif tampak seperti gram negatif. Namun juga jangan sampai terlalu sedikit dalam penetesan etanol (underdecolorization) yang tidak akan melarutkan CV-iodine
secara sempurna sehingga sel gram negatif seperti gram positif.
b. Preparasi pewarnaan gram terbaik adalah menggunakan kultur muda yang tidak lebih lama dari 24 jam. Umur kultur akan berpengaruh pada kemampuan sel menyerap warna utama (CV), khususnya pada gram positif. Mungkin akan menampakkan gram variabel yaitu satu jenis sel, sebagian berwarna ungu dan sebagian merah karena pengaruh umur. Walaupun ada beberapa species yang memang bersifat gram variabel seperti pada genus Acinetobacter dan Arthrobacter.
PERBEDAAN BAKTERI GRAM POSITIF DAN GRAM NEGATIF:
CIRI PERBEDAAN RELATIF
GRAM POSITIF GRAM NEGATIF
Sturktur dinding sel Tebal (15-80 nm), berlapis tunggal (mono)
Tipis (10-15 nm), berlapis tiga (multi)
Komposisi dinding sel
Kandungan lipid rendah (1-4 %), peptidoglikan ada sebagai lapisan tunggal, ada asam tekoat
Kandungan lipid tinggi (11-22%), peptidoglikan ada di dalam lapisan kaku
sebelah dalam, tidak ada aam tekoat
Kerentanan terhadap
penisilin Lebih rentan Krang rentan
Pertumbuhan
dihambat oleh warna-warna dasar (seperti Kristal ungu)
Pertumbuhan dihambat dengan nyata
Pertumbuhan tidak begitu dihambat
Persyaratan nutrisi Relative rumit pada banyak
spesies Relative sederhana
Resistensi terhadap
gangguan fisik Lebih resisten Kurang resisten
Asam tekoat = polimer gliserol dan ribitol fosfat menempel pada peptodoglikan atau membran sitoplasma. Fungsi asam teikoat (muatan negatif) adalah :
• untuk transport ion positif dari dan keluar sel • penyimpanan fosfor
B.4. Pewarnaan Endospora
bentuk dorman dari sel vegetatif, sehingga metabolismenya bersifat inaktif dan mampu bertahan dalam tekanan fisik dan kimia seperti panas, kering, dingin, radiasi dan bahan kimia. Tujuan dilakukannya pewarnaan endospora adalah membedakan endospora dengan sel vegetatif, sehingga pembedaannya tampak jelas.
Endospora tetap dapat dilihat di bawah mikroskop meskipun tanpa pewarnaan dan tampak sebagai bulatan transparan dan sangat refraktil. Namun jika dengan pewarnaan sederhana, endospora sulit dibedakan dengan badan inklusi (kedua-duanya transparan, sel vegetatif berwarna), sehingga diperlukan teknik pewarnaan endospora. Berikut merupakan prosedur pewarnaan endospora dengan metode Schaeffer-Fulton.
Berikut merupakan beberapa tipe endospora dan contohnya
B.5. Pewarnaan Khusus (Pewarnaan Bakteri Tahan Asam)/ BTA
Bakteri-bakteri tahan asam memiliki lapisan lipid/lemak yang tebal dalam dinding selnya sehingga menyebabkan dinding sel bakteri tersebut relatif tidak permeable terhadap zat warna yang umum sehingga sel-sel tersebut tidak terwarnai oleh metode pewarnaan biasa. Pada pewarnaan ini, mikroorganisme dapat menahan zat warna yang tidak terpucatkan oleh asam alcohol sehingga dikatakan tahan asam dan tampak merah, sedangkan yang tidak tahan asam (terpucatkan) akan berwarna biru. Metode yang paling sering digunakan adalah Zeihl-Nelssen dan Kinyoun Gabbet/ Tan Thiam Hok.
C. Mengamati motilitas C.1 Pengamatan Langsung Cara Kerja :