NURCHOLIS
NURCHOLIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
KUALITAS SEMEN SEGAR DAN BEKU DOMBA GARUT
SETELAH PEMBERIAN LIMBAH TAUGE DAN
SUPLEMENTASI OMEGA-3
KUALITAS SEMEN SEGAR DAN BEKU DOMBA GARUT
SETELAH PEMBERIAN LIMBAH TAUGE DAN
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kualitas semen segar dan beku domba garut setelah pemberian pakan limbah tauge dan suplementasi omega-3 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Nurcholis
RINGKASAN
NURCHOLIS. Kualitas Semen Segar dan Beku Domba Garut setelah Pemberian Limbah Tauge dan Suplementasi Omega-3. Dibimbing oleh MOHAMAD YAMIN dan RADEN IIS ARIFIANTINI.
Domba garut merupakan salah satu domba lokal Indonesia yang berpotensi untuk dikembangkan sebagai domba penghasil daging karena pertumbuhannya yang relatif cepat, serta bersifat prolifik dan dapat dijadikan sebagai domba tangkas atau aduan. Perkembangan domba garut tersebar hampir di seluruh pulau Jawa dan populasi terbesar terdapat di Jawa Barat. Pengembangan usaha peternakan domba garut pada saat ini sangat pesat karena berkaitan dengan permintaan akan daging oleh masyarakat. Namun, ketersediaan daging kambing dan daging domba belum mampu memenuhi kebutuhan tersebut. Salah satu cara terbaik untuk menyelesaikan masalah tersebut adalah memperbaiki kualitas bibit pejantan unggul domba garut. Oleh sebab itu dibutuhkan manajemen yang baik salah satunya adalah manajemen bibit pejantan unggul domba garut. Proses budidaya domba garut yang tersebar merata dibeberapa wilayah dapat mendukung ketersediaan produksi daging. Proses tersebut dipengaruhi oleh beberapa faktor, salah satunya adalah faktor lingkungan. Suhu lingkungan di daerah Garut tentunya berbeda dengan daerah lain seperti daerah Dramaga Bogor. Perbedaan suhu dapat menyebabkan stres pada ternak sehingga dapat menurunkan reproduksi domba garut. Oleh sebab itu dibutuhkan manajemen lingkungan yang baik dan pemberian pakan yang berkualitas untuk mengurangi tingkat stres serta meningkatkan kualitas reproduksi ternak domba garut sebagai bibit.
Pakan yang berkualitas baik tidak harus mahal, akan tetapi murah, dan mudah diperoleh. Pemanfaatan limbah pertanian sebagai pakan ternak menjadi salah satu solusi yang memenuhi kriteria tersebut. Limbah tauge merupakan limbah pertanian yang berpotensi dijadikan sebagai pakan ternak karena memiliki kualitas nutrisi yang baik, terutama kadungan protein yang tinggi. Penggunaan limbah tauge diharapkan dapat memperbaiki kualitas semen segar dan meningkatkan kualitas reproduksi domba garut.
Peningkatan kualitas bibit domba garut membutuhkan sentuhan teknologi inseminasi buatan (IB). Salah satu kegiatan IB adalah penyimpanan material genetik berupa semen ternak yang dibekukan (kriopreservasi). Proses kriopreservasi semen memiliki kendala yaitu adanya cekaman dingin yang dapat merusak membran spermatozoa. Oleh sebab itu, dibutuhkan pelindung membran plasma pada saat proses kriopreservasi. Omega-3 merupakan asam lemak tak jenuh ganda yang berperan dalam mempertahankan membran sel spermatozoa dari pengaruh radikal bebas dan cekaman dingin. Suplementasi omega-3 dalam pakan dan pengencer semen diharapkan dapat meningkatkan kualitas semen segar dan beku domba garut post thawing.
omega-3 berupa omega-3 wild salmon oil dalam pengencer Tris kuning telur (TKTOS) dan kuning telur omega-3 dalam pengencer Tris (TKTO) dalam mempertahankan kualitas spermatozoa selama proses kriopreservasi. Penelitian menggunakan Rancangan Acak Lengkap (RAL) Repeated Measurement dengan 3 perlakuan dan 4 ulangan yang menggunakan prosedur General Linear Model
(GLM) serta menguji perbedaan antar perlakuan menggunakan Least Square Mean. Uji Independent sample t-Test digunakan untuk mengetahui perbedaan sebelum dan setelah perlakuan.
Hasil penelitian menunjukkan pemberian pakan limbah tauge dan omega-3 dapat meningkatkan (P<0.05) volume semen, motilitas, viabilitas serta konsentrasi spermatozoa per ml. Namun, pemberian pakan limbah tauge dan omega-3 pada pengamatan per minggu hanya mampu meningkatkan motilitas spermatozoa. Pemberian pakan limbah tauge dan omega-3 tidak meningkatkan gerakan massa dan morfologi spermatozoa (P>0.05). Pengencer TKTOS meghasilkan motilitas, viabilitas dan ketahanan membran plasma utuh spermatozoa yang lebih tinggi (P<0.05) dibandingkan TKTO. Pengencer TKTOS juga menunjukkan nilai
recovery rate lebih tinggi (P< 0.05) dibandingan TKTO.
Kesimpulan penelitian ini adalah pemberian pakan limbah tauge sebagai pengganti rumput dan suplementasi omega-3 selama 35 hari dapat meningkatkan kualitas spermatozoa. Penambahan omega-3 dalam pengencer Tris kuning telur lebih baik dibandingkan dengan Tris yang diberikan kuning telur omega 3 dalam mempertahankan kualitas spermatozoa post thawing.
SUMMARY
NURCHOLIS. Fresh and Frozen Semen Quality of Garut Rams after feeding with Bean Sprouts Waste and Omega-3 Supplementation Supervised by MOHAMAD YAMIN and RADEN IIS ARIFIANTINI.
Garut sheep is one of the Indonesian local sheep that have potential to be developed as a meat producer. Garut sheep is prolific and relatively growth fast, and also can be used as fighting sheep. Garut sheep spread almost all over Java Island, especially in West Java. Recently breeding business of garut sheep, developed fast, it relates to the meat demand by the community.
Breeding business of garut sheep, need superior rams to bred the does. The aviability of superior garut rams is limited and the otherhand to achive genetic potensial of this livestock require appropriate environmental. The temperature in Garut city is obviously different from other areas such as Dramaga Bogor. Temperature difference caused stress in livestock and reduce the reproduction performance. To avoid environmental stress to garut sheep, improved of management needed such as improvements of feeding quality. High qulity of animal feed could reduce stress levels and improve the reproduction quality.
High quality of feed does not have to be expensive, it could be cheap and easily obtained. The utilization of agricultural waste as feed has became one solutions. Bean sprouts waste is an agricultural waste which has potential to be used as animal feed, because of its nutritional quality, especially its high protein content. The use of bean sprouts waste as garut sheep feed is expected to improve the quality of the Garut rams reproduction such as semen quality.
To optimize garut sheep breeding needs reproductive technology such as Artificial Insemination (AI). One activities of AI is conservation of genetic material kown as frozen semen. Semen cryopreservation process decresed semen quality, especilly damage of sperm membrane. Therefore, during cryopreservation needs substance to protect plasma membrane during cryopreservation process. Omega-3 is polyunsaturated fatty acids that responsilble to protect spermatozoa cell membranes from the effects of free radicals and cold shock. Omega-3 supplementation in feed and semen diluent is expected to improve the quality of fresh and frozen Garut rams post-thawing semen.
The purposes of this research were to investigate the bean sprouts waste as a substitute for grass feed, and omega-3 supplementation on the quality of Garut rams semen for 35 days and analyze the ability of omega-3 to protect the quality of semen during freezing procces.
Based on the result, waste bean sprouts and omega-3 feeding increased (P <0.05) semen volume, motility, viability and concentration of spermatozoa per mL. Feeding of Bean sprouts waste and omega-3 did not increase the mass movement and morphology of spermatozoa (P >0.05). Supplementation of omega-3 in TEY diluent significanly higher (P <0.05) in spermatozoa motility, viability and plasma membrane intact as well as its recovery rate of spermatozoa compare to spermatozoa diluted with Tris with omega 3 eggyolk.
The conclusion of this research were feeding of bean sprouts waste as a substitute of grass and omega-3 supplementation for 35 days improve the quality garut ram semen quality and the use of omega-3 in Tris egg yolk diluent improve post thawing semen quality and recovery rate.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu massalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
KUALITAS SEMEN SEGAR DAN BEKU DOMBA GARUT
SETELAH PEMBERIAN LIMBAH TAUGE DAN
SUPLEMENTASI OMEGA-3
KUALITAS SEMEN SEGAR DAN BEKU DOMBA GARUT
SETELAH PEMBERIAN LIMBAH TAUGE DAN
SUPLEMENTASI OMEGA-3
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah kualitas semen segar dan beku domba garut setelah pemberian limbah tauge dan suplementasi omega-3. Tesis disusun sebagai salah satu syarat untuk memperoleh gelar magister pada program studi Ilmu Produksi dan Teknologi Peternakan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada bapak Dr Ir Mohamad Yamin, MAgrSc dan ibu Prof Dr Dra R Iis Arifiantini, MSi selaku komisi pembimbing atas ilmu yang diberikan, bimbingan serta dorongan semangat mulai dari penyusunan proposal, penelitian hingga penulisan tesis. Kepada Prof Dr Drh Iman Supriatna sebagai penguji luar komisi terimakasih atas saran dan ilmu yang telah diberikan. Ucapan terima kasih kepada kepala Lab. Rumcil FAPET IPB serta kepala Lab. URR FKH IPB atas izin yang diberikan kepada penulis selama melaksanakan penelitian, tidak lupa penulis ucapkan terimakasih kepada bapak Bondan yang telah membantu penulis dalam penelitian. Penghargaan penulis sampaikan kepada Direktorat Jenderal Pendidikan Tinggi dalam program BPPDN 2013 yang telah membantu penulis selama studi serta program BOPTN tahun 2014 atas nama bapak Dr Ir Mohamad Yamin, MAgrSc telah membantu penulis dalam biaya penelitian.
Terima kasih penulis ucapkan kepada Dr Ir Salundik, MSi selaku Ketua Program Studi/Mayor ITP beserta jajarannya atas pelayanan prima selama penulis menempuh studi. Kepada teman-teman pascasarjana ITP angkatan 2013 terimakasih atas kebersamaan selama ini, semoga persahabatan serta kerjasama tetap terjalin pada waktu mendatang. Kepada pihak yang telah membantu, mohon maaf tidak dapat disebutkan satu persatu penulis juga mengucapkan terimakasih.
Ungkapan terima kasih juga disampaikan kepada ayahanda Sunyoto, ibunda Surati dan adik khusnul khotimah serta keluarga besar atas segala doa dan perhatian yang diberikan kepada penulis.
Semoga karya ilmiah ini bermanfaat bagi pembaca.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 METODE 3
Waktu dan Tempat 3
Bahan 3
Alat 3
Prosedur Analisis Data 7
3 HASIL DAN PEMBAHASAN 8
Karakteristik makroskopis semen segar domba garut 8
Warna dan Konsistensi semen 8
Volume semen 8
pH semen 10
Karakteristik mikroskopis semen segar domba garut 10
Gerakan massa spermatozoa 10
Motilitas spermatozoa 11
Viabilitas spermatozoa 13
Konsentrasi spermatozoa 15
Konsentrasi spermatozoa per ejakulat 17
Morfologi spermatozoa 17
Kualitas spermatozoa domba garut post thawing 19
Recovery Rate semen domba garut 22
4 SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 24
LAMPIRAN 29
DAFTAR TABEL
1 Komposisi omega-3 (wild salmon oil) 3
2 Komposisi buffer sebagai pengencer 6
3 Komposisi pengencer semen beku domba 7
4 Volume semen segar domba garut sebelum dan setelah pemberian limbah
tauge dan suplementasi omega-3 8
5 Gerakan massa spermatoza domba garut sebelum dan setelah pemberian
limbah tauge dan suplementasi omega-3 10
6 Motilitas spermatozoa domba garut sebelum dan setelah pemberian limbah
tauge dan suplementasi omega-3 11
7 Viabilitas spermatozoa domba garut sebelum dan setelah pemberian
limbah tauge dan suplementasi omega-3 13
8 Konsentrasi spermatozoa domba garut sebelum dan setelah pemberian
limbah tauge dan suplementasi omega-3 16
9 Abnormalitas spermatozoa domba garut sebelum dan setelah pemberian
limbah tauge dan suplementasi omega-3 18
10 Kualitas spermatozoa domba garut post thawing 20
11 Recovery rate (RR) semen domba garut 23
DAFTAR GAMBAR
1 Peningkatan volume semen segar domba garut yang di koleksi per minggu 9 2 Peningkatan motilitas spermatozoa semen segar domba garut yang di
koleksi per minggu 12
3 Peningkatan viabilitas spermatozoa semen segar domba garut yang di
koleksi per minggu 14
4 Viabilitas spermatozoa domba garut 15
5 Peningkatan konsentrasi spermatozoa semen segar domba garut yang di
koleksi per minggu 17
6 Penurunan abnormalitas spermatozoa semen segar domba garut yang di
koleksi per minggu 19
DAFTAR LAMPIRAN
1
1
PENDAHULUAN
Latar Belakang
Domba garut merupakan salah satu domba lokal Indonesia yang berpotensi untuk dikembangkan sebagai domba penghasil daging karena pertumbuhannya yang relatif cepat, serta bersifat prolifik dan dapat dijadikan sebagai domba tangkas atau aduan. Perkembangan domba garut tersebar hampir diseluruh pulau jawa, dan populasi terbesar terdapat di jawa barat mencapai 11.7 juta ekor pada tahun 2011 (Ditjennak 2012). Pengembangan usaha peternakan domba garut pada saat ini sangat cepat karena berkaitan dengan kebutuhan protein hewani bagi masyarakat, akan tetapi ketersediaan daging kambing dan daging domba belum mampu untuk memenuhi kebutuhan tersebut. Oleh sebab itu dibutuhkan manajemen yang baik agar dapat meningkatkan produktivitas domba garut, salah satunya dengan cara memperbaiki manajemen bibit domba yang berkualitas dengan cara memperhatikan kualitas reproduksi serta budidaya yang merata diberbagai wilayah di Indonesia. Salah satu kendala yang dihadapi dalam proses budidaya bibit domba garut unggul adalah faktor lingkungan, karena suhu daerah asal domba garut rata-rata mencapai 24-27 oC (BMKG 2013) jika domba garut di budidayakan di wilayah lain di daerah jawa barat seperti Dramaga Bogor dengan suhu yang lebih tinggi 28-32 oC (BMKG 2013), hal tersebut tentunya dapat meningkatkan stres pada ternak yang berdampak terhadap proses produksi dan reproduksi ternak domba tersebut. Oleh sebab itu diperlukan manajemen lingkungan yang baik untuk mengurangi tingkat stres serta pemberian pakan yang berkualitas baik untuk meningkatkan produksi dan reproduksi ternak domba garut sebagai bibit. Pakan domba garut yang diberikan oleh peternak adalah rumput lapang yang memiliki kandungan nutrisi cukup rendah yaitu 6.61% (Salundik et al.
2011), pemberian rumput lapang saja belum dapat mencukupi kebutuhan domba secara maksimal sehingga untuk mencukupi kebutuhan nutrisi domba, perlu ditambahkan bahan pakan penguat seperti konsentrat.
2
ability) dan pengujian kualitas semen yang akan digunakan sebagai bibit. Pengujian kualitas semen pada umumnya adalah motilitas, konsentrasi dan morfologi spermatozoa (Arifiantini et al. 2006). Selain itu untuk meningkatkan dan perbaikan kualitas spermatozoa domba garut jantan dapat diberikan suplementasi omega-3 pada pakan. Penelitian serupa telah dilakukan oleh Dolatpanah et al. (2008) bahwa suplementasi minyak ikan yang mengandung omega-3 dalam pakan ternak kambing dapat meningkatkan kualitas spermatozoa.
Peningkatan jumlah bibit domba garut tentunya membutuhkan sentuhan teknologi seperti inseminasi buatan (IB). Salah satu kegiatan IB adalah penyimpanan material genetik berupa semen ternak yang dibekukan (kriopreservasi). Proses kriopreservasi semen terdapat kendala yaitu adanya cekaman dingin atau cold shock yang dapat merusak membran spermatozoa. Oleh sebab itu dibutuhkan pelindung membran plasma pada saat proses kriopreservasi. Studi tentang omega-3 yang memiliki kandungan asam lemak tak jenuh atau
Polyunsaturated Fatty Acid (PUFA) serta Eicosa Pentaenoic Acid (EPA) dan
Docosahexaenoic Acid (DHA) sebagai pelindung membran plasma secara in vitro
telah dilakukan oleh Towhidi et al. (2013) bahwa pemberian PUFA dan α- tokoferol secara in vitro dapat melindungi spermatozoa domba saat proses kriopreservasi.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji manfaat limbah tauge sebagai pakan pengganti rumput serta suplementasi omega-3 secara in vivo dalam meningkatkan kualitas semen segar dan suplementasi omega-3 secara in vitro dalam meningkatkan kualitas semen beku domba garut.
Manfaat Penelitian
Manfaat dari penelitian ini diharapkan dapat memberikan informasi kepada masyarakat bahwa pemberian pakan limbah tauge dapat meningkatkan produktivitas semen domba garut jantan, serta suplementasi omega-3 secara in vivo dan in vitro untuk mendapatkan semen beku yang berkualitas baik dan informasi yang berguna dalam mengembangkan teknologi inseminasi buatan menggunakan semen beku domba garut.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi dua tahap yaitu :
1. Penelitian Tahap I : Menganalisis pengaruh limbah tauge sebagai pengganti rumput dan suplementasi omega-3 secara in vivo terhadap kuantitas semen segar domba garut.
3
2
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juli sampai dengan Oktober 2014. Penelitian dilaksanakan di Laboratorium Lapang Ilmu Produksi Ternak Ruminansia Kecil Blok B, Fakultas Peternakan, Institut Pertanian Bogor dan di Laboratorium Unit Rehabilitasi Reproduksi (URR), Divisi Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan
Bahan yang digunakan adalah domba garut jantan sebanyak dua belas ekor yang telah mengalami massa sexual maturity dan satu ekor domba betina dewasa digunakan sebagai teaser (betina penggoda), limbah tauge, rumput, konsentrat komersial dan omega-3 (wild salmon oil).
Alat
Peralatan dalam penelitian ini adalah kandang individu berukuran 1.5 m x 0.75 m, 1 set alat koleksi semen vagina buatan, 1 set alat evaluasi semen segar dan 1 set alat pembekuan semen.
Prosedur
Domba garut diadaptasikan selama dua minggu sebelum perlakuan, domba garut jantan dibagi menjadi tiga kelompok perlakuan pakan yaitu berupa konsentrat 60% + rumput 40% (R1) sebagai kontrol, konsentrat 60% + limbah tauge 40% (R2) dan konsentrat 60% + limbah tauge 40% + omega-3 (R3), omega-3 omega-omega-3 yang digunakan dalam penelitian ini adalah wild salmon oil dengan komposisi tertera pada Tabel 1. Persentase pemberian pakan sebanyak 4% dari bobot badan domba berdasarkan bahan kering.
Tabel 1 Komposisi Omega-3 (wild salmon oil)a
Komposisi Total
Wild salmon oil Vitamin E
Eicosapentaenoic Acid (EPA)
Docosahexaenoic Acid (DHA)
4
Koleksi semen
Semen segar domba garut di koleksi menggunakan vagina buatan dengan frekuensi satu minggu sekali. Koleksi dilakukan selama 1.5 bulan mengikuti satu siklus spermatogenesis. Koleksi semen dilakukan pada pagi hari jam (06.00-08.00) WIB menggunakan domba betina sebagai pemancing libido pejantan (teasers). Vagina buatan yang terbuat dari karet khusus yang dilengkapi dengan
inner liner pada bagian dalamnya diberi air dengan suhu 50-55 °C dengan suhu akhir 41- 44 °C (Arifiantini 2012) diberi udara dan pelicin sehingga vagina buatan tersebut menyerupai kondisi sebenarnya dan semen yang diperoleh selanjutnya dianalisis di Laboratorium.
Pengujian Makroskopis
Teknik pengujian secara makroskopis dan mikroskopis mengacu pada Arifiantini (2012) pengujian makroskopis dilakukan secara visual meliputi pengukuran volume, warna, konsistensi dan pH semen. Pengukuran volume semen dilakukan menggunakan pipet ukur 1 mL dengan skala 0.1 mL. Warna semen segar dilihat secara visual di antaranya putih keruh, putih susu, krem sampai warna putih keabuan. Kosistensi semen diamati dengan cara tabung
microtube yang berisi semen dimiringkan kemudian dikembalikan ke posisi semula. Konsistensi semen dapat dikatakan cair jika proses kembalinya semen ke dasar tabung berlangsung cepat, namun jika kembalinya semen ke dasar tabung lambat maka kosistensi semen kental. Pengukuran pH dilakukan dengan menggunakan pH indiator paper, dengan cara meneteskan semen di pH indicator, hasil yang terlihat kemudian dicocokkan pada indikator warna.
Pengujian Mikroskopis
Evaluasi semen secara mikroskopis meliputi gerakan massa spermatozoa, gerakan individu (motilitas) spermatozoa, spermatozoa hidup (viabilitas), konsentrasi spermatozoa dan morfologi spermatozoa (normalitas dan abnormalitas spermatozoa).
Gerakan Massa
5
Gerakan Individu (Motilitas)
Penentuan persentase motilitas spermatozoa dengan cara meletakkan satu tetes semen pada gelas objek ditambahkan NaCl fisiologis 8-10 tetes, dihomogenkan dan diambil 1 tetes campuran tersebut diletakkan pada gelas objek yang lain kemudian ditutup dengan gelas penutup. Pengamatan dilakukan dengan menggunakan mikroskop pembesaran 400 kali pada 5 lapang pandang yang berbeda, penilaian diberikan dalam kisaran angka 0–100%.
Kosentrasi Spermatozoa
Konsentrasi spermatozoa dihitung menggunakan kamar hitung Neubauer ipmroved. Penghitungan dilakukan dengan terlebih dahulu membuat pengenceran 500 kali (semen segar 1 µl dan 499 µl formalsaline) kemudian dihomogenkan pada tabung microtube. Campuran yang telah homogen kemudian diteteskan ke dalam kamar hitung Neubauer improved dan dilakukan evaluasi dengan perbesaran mikroskop 400 kali. Penghitungan dilakukan pada lima kotak yaitu empat kotak yang ada di tepi dan satu kotak pada bagian tengah. Konsentrasi spermatozoa dihitung dengan cara mengalikan jumlah spermatozoa dengan dua puluh lima kali sepuluh pangkat enam per mililiter.
Persentase Spermatozoa Hidup (Viabilitas)
Penentuan persentase viabilitas (spermatozoa yang hidup) dihitung dengan cara membuat preparat ulas dari campuran semen dengan pewarna Eosin Nigrosin
(EN), serta perbandingan semen 1 tetes dan EN 8-10 tetes, preparat ulas dikeringkan di atas heating table, diamati di bawah mikroskop sebanyak 10 lapang pandang dengan jumlah sel terhitung minimal 200. Spermatozoa yang
viable (hidup) adalah spermatozoa yang tidak menyerap zat warna sehingga bagian kepala spermatozoa tidak terwarnai (putih), sedangkan spermatozoa yang dikategorikan mati adalah spermatozoa yang menyerap zat warna sehingga bagian kepala akan terwarnai. Persentase spermatozoa hidup dapat dihitung dengan cara membagi jumlah spermatozoa hidup dengan jumlah spermatozoa yang dihitung dikalikan dengan seratus persen.
Morfologi Spermatozoa
6
Persentase Membran Utuh (MPU)
Penilaian keutuhan membran plasma (MPU) dilakukan dengan menggunakan Hypo Osmotic Swelling (HOS) test (Fonseca et al. 2005). Pengujian dilakukan dengan cara memasukkan 20 µl semen dalam 1.000 µl larutan HOS (0.9 g fruktosa dengan 0.49 g sodium sitrat dalam 100 ml akuadest, tekanan osmotik 150 mOsm kg-1). Campuran dihomogenkan dan diinkubasi pada suhu 37 o
C selama 35-40 menit. Penghitungan MPU dilakukan dengan cara meneteskan semen dalam larutan HOS di atas gelas objek dan ditutup dengan gelas penutup diletakkan di bawah mikroskop dengan pembesaran 400 kali, dan minimum 200 spermatozoa dihitung secara acak sebanyak 10 lapang pandang (Arifiantini 2012). Spermatozoa yang memiliki membran plasma utuh ditandai dengan adanya ekor melingkar atau menggelembung, sedangkan yang rusak ditandai dengan ekor lurus. Persentase MPU dapat dihitung dengan cara membagi jumlah spermatozoa yang berreaksi dengan jumlah spermatozoa yang dihitung (berreaksi dan tidak berreaksi) dikali seratus persen.
Penyiapan Bahan Pengencer
Bahan pengencer buffer yang digunakan untuk pembekuan semen domba garut adalah Tris (Tris hydroxymetyl aminomethane), citrat acid, glukosa, aquadest(Tabel 2), mengadopsi dari Kulaksiz et al. (2012).
Tabel 2 Komposisi buffer sebagai pengencer
Komponen Jumlah
Tris Hydroxymetyl Aminomethane (g) Citrat acid (g)
Glukosa (g) Aquadest (mL)
3.63 1.99 0.5 100
7
Tabel 3 Komposisi pengencer semen beku domba
TKTOS: Tris kuning telur biasa menggunakan omega-3 wild salmon oil, TKTO: Tris kuning telur omega-3
Evaluasi Semen dan Pengenceran Semen
Evaluasi semen dilakukan dua tahap yaitu tahap I evaluasi semen segar dan dahap II evaluasi post thawing. Setelah dievaluasi pada tahap I semen di bagi ke dalam 2 tabung. Semen pada masing-masing tabung hasil dari perlakukan pakan R1 dan R2 diencerkan menggunakan TKTOS dan TKTO Perhitungan pengenceran dilakukan sebagai berikut.
Volume total = Vol semen x motilitas (%) x Konsentrasi spermatozoa x 0.25 mL Dosis inseminasi (50 juta)
Pengemassan, Ekuilibrasi dan Pembekuan Semen
Semen yang telah diencerkan kemudian dikemas ke dalam mini straw 0.25 mL (Minitub Germany), disimpan pada suhu 5 oC untuk proses ekuilibrasi selama 4 jam. Pembekuan dilakukan dengan cara meletakkan rak pembekuan 5 cm di atas permukaan Nitrogen cair (-130 oC) dalam kotak stryrofoam selama 10 menit. Setelah pembekuan, mini straw disimpan pada canester dalam kontainer nitrogen cair (-196 oC). Keberhasilan proses kriopreservasi dapat dinilai dengan menghitung nilai Recovery Rate (RR) yaitu presentase spermatozoa yang berhasil pulih dari proses kriopreservasi yang dihitung dengan membandingkan persentase spermatozoa motil pada semen segar dan post thawing dikali seratus persen.
Prosedur Analisis Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Repeated Measurement dengan 3 perlakuan dan 4 ulangan yang menggunakan prosedur
8
3
HASIL DAN PEMBAHASAN
Karakteristik Makroskopis Semen Segar Domba Garut
Warna dan Konsistensi Semen
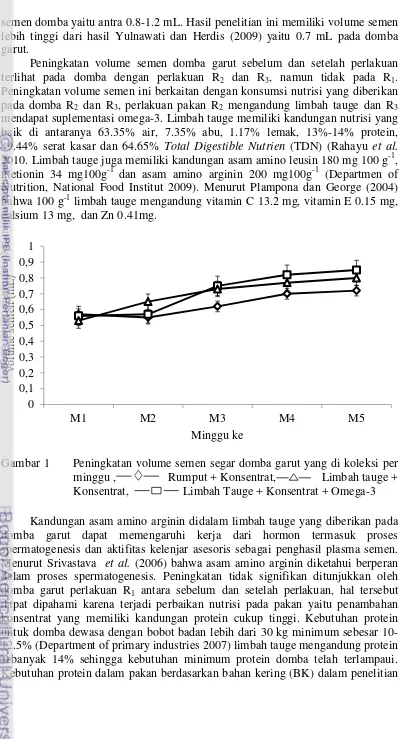
Keberhasilan limbah tauge sebagai pakan pengganti rumput serta suplementasi omega-3 dalam pakan berpengaruh terhadap kualitas semen domba garut dapat dilihat secara makroskopis dan mikroskopis. Secara makroskopis semen segar domba garut sebelum dan setelah perlakuan tidak menunjukkan perbedaan (P> 0.05) pada warna dan konsistensi semen. Seluruh semen yang diperoleh berwarna krem dengan konsistensi yang kental, hal tersebut sesuai dengan laporan Garner dan Hafez (2000) bahwa warna semen domba yang normal umumnya krem dengan konsistensi yang kental. Warna dan konsistensi semen secara umum dapat dijadikan parameter yang berkaitan dengan konsentrasi spermatozoa. Semen berwarna krem dan konsistensi kental memiliki jumlah konsentrasi spermatozoa yang tinggi, sebaliknya jika konsistensi encer makan jumlah konsentrasi spermatozoa juga rendah. pada perlakuan R1 tidak menunjukkan peningkatan yang signifikan. Namun antara perlakuan pakan R2 dan R3 tidak menunjukkan perbedaan yang signifikan, hal tersebut membuktikan bahwa suplementasi omega-3 dalam pakan domba garut tidak meningkatkan volume semen domba garut. Hasil ini sesuai dengan Fair et al.
(2014) bahwa penambahan minyak ikan yang mengandung omega-3 pada pakan domba tidak memengaruhi volume, konsistensi dan warna semen domba.
Tabel 4 Volume semen segar domba garut sebelum dan setelah pemberian pakan limbah tauge dan suplementasi omega-3
Perlakuan Pakan Volume semen (mL)1
Sebelum perlakuan Setelah perlakuan Huruf yang berbeda pada baris yang sama menunjukkan perbedaan nyata (P<0.05) R1 = rumput +
konsentrat, R2 = limbah tauge + konsentrat, R3 = limbah tauge + konsentrat + omega-3. 1
Peningkatan volume semen domba garut sebelum dan setelah perlakuan pakan.
9
semen domba yaitu antra 0.8-1.2 mL. Hasil penelitian ini memiliki volume semen lebih tinggi dari hasil Yulnawati dan Herdis (2009) yaitu 0.7 mL pada domba garut.
Peningkatan volume semen domba garut sebelum dan setelah perlakuan terlihat pada domba dengan perlakuan R2 dan R3, namun tidak pada R1. Peningkatan volume semen ini berkaitan dengan konsumsi nutrisi yang diberikan pada domba R2 dan R3, perlakuan pakan R2 mengandung limbah tauge dan R3 mendapat suplementasi omega-3. Limbah tauge memiliki kandungan nutrisi yang baik di antaranya 63.35% air, 7.35% abu, 1.17% lemak, 13%-14% protein, 49.44% serat kasar dan 64.65% Total Digestible Nutrien (TDN) (Rahayu et al.
2010. Limbah tauge juga memiliki kandungan asam amino leusin 180 mg 100 g-1, metionin 34 mg100g-1 dan asam amino arginin 200 mg100g-1 (Departmen of Nutrition, National Food Institut 2009). Menurut Plampona dan George (2004) bahwa 100 g-1 limbah tauge mengandung vitamin C 13.2 mg, vitamin E 0.15 mg, calsium 13 mg, dan Zn 0.41mg.
10
ini sesuai dengan NRC (2006) bahwa domba dengan bobot badan 30 kg membutuhkan BK sebanyak 3% dan protein 9.5%.
pH Semen
Derajat keasaman (pH) semen domba garut sebelum perlakuan adalah 6.4 (R1), 6.4 (R2) dan 6.5 (R3) setelah perlakuan cenderung lebih basa yaitu 6.87 (R1), 7.0 (R2) dan 7.1 (R3). Perubahan pH semen domba garut sebelum dan setelah perlakuan pakan tidak menunjukkan adanya perubahan yang signifikan (P> 0.05), juga terlihat pada pengamatan per minggu. Secara keseluruhan pH semen domba garut sebelum ataupun setelah perlakuan masih termasuk normal, karena menurut Garner dan Hafez (2000) pH semen domba yang normal berkisar antara 5.9-7.3. Nilai pH netral menunjukkan kelenjar assesoris (vesicularis, prostat dan
bulbourethralis) yang mensekresikan plasma seminal berfungsi dengan baik dan berfungsi sebagai buffer bagi spermatozoa sehingga pH semen tetap netral.
Karakteristik mikroskopis semen segar domba garut
Gerakan massa spermatozoa
Secara mikroskopis nilai gerakan massa domba garut sebelum perlakuan menunjukkan nilai antara positif dua dan tiga (++ dan +++) dan setelah perlakuan menunjukkan nilai yang baik dengan nilai positif tiga (+++), serta menunjukkan gelombang massa spermatozoa yang besar, tebal, banyak dan aktif bergerak, tetapi tidak terdapat perbedaan (P> 0.05) gerakan massa spermatozoa antara perlakuan pakan baik pada pengamatan per minggu ataupun saat pengamatan sebelum dan setelah perlakuan (Tabel 5). Gerakan massa merupakan gerakan spermatozoa secara bersama-sama pada satu arah, menyerupai gelombang-gelombang tipis dan tebal, bergerak secara cepat ataupun lambat (Feradis 2010).
Tabel 5 Gerakan massa spermatozoa domba garut sebelum dan setelah pemberian pakan limbah tauge dan suplementasi omega-3
Perlakuan Pakan Gerakan massa
11
Motilitas Spermatozoa
Motilitas spermatozoa adalah gerakan spermatozoa yang bergerak maju ke depan. Motilitas spermatozoa domba garut sebelum perlakuan antara 71.25% sampai dengan 72.50%. Setelah perlakuan pakan persentase motilitas spermatozoa menunjukkan adanya peningkatan (Tabel 6). Peningkatan persentase motilitas spermatozoa pengamatan per minggu mulai terlihat pada minggu ke tiga, namun peningkatan tersebut belum menunjukkan pengaruh yang nyata, peningkatan motilitas spermatozoa terlihat secara nyata terjadi pada minggu ke lima (Gambar 2).
Tabel 6 Motilitas spermatozoa domba garut sebelum dan setelah pemberian pakan limbah tauge dan suplementasi omega-3
Perlakuan Pakan Motilitas spermatozoa (%)1
Sebelum perlakuan Setelah perlakuan
Huruf yang berbeda pada baris yang sama menunjukkan perbedaan nyata (P< 0.05) R1 = rumput +
konsentrat, R2 = limbah tauge + konsentrat, R3 = limbah tauge + konsentrat + omega-3. 1
Peningkatan motilitas spermatozoa domba garut sebelum dan setelah perlakuan pakan.
Motilitas spermatozoa pengamatan per minggu pada domba yang diberi pakan R1 lebih rendah dibandingkan dengan pakan R2 dan R3. Pada domba yang diberi pakan mengandung limbah tauge menunjukkan adanya peningkatan motilitas dari sebelum perlakuan dan setelah perlakuan pakan dan antara keduanya terdapat perbedaan yang signifikan (P< 0.05) setelah pengamatan pada minggu ke lima, hal tersebut dapat diartikan bahwa pemberian omega-3 dalam penelitian ini mampu meningkatkan persentase motilitas spermatozoa. Pemberian pakan limbah tauge dan suplementasi omega-3 pada domba garut mulai memperbaiki kualitas spermatozoa dibagian tubuli seminiferi. Hal tersebut berkaitan dengan proses pembentukan spermatozoa dalam siklus spermatogenesis domba yang membutuhkan watu antara 45 - 47 hari. Motilitas spermatozoa domba garut dalam penelitian ini memiliki persentase lebih tinggi bila dibandingkan dengan temuan Yulnawati dan Herdis (2009) yaitu 73±2.45% pada domba garut.
12
Gambar 2 Peningkatan motilitas spermatozoa semen segar domba garut yang di koleksi per minggu , Rumput + Konsentrat,
Limbah tauge + Konsentrat, Limbah Tauge + Konsentrat + Omega-3
Limbah tauge memiliki kandungan asam amino arginin sebanyak 200 mg 100 g-1. Zat nutrisi asam amino arginin dapat memberikan pengaruh terhadap proses spermatogenesis, namun jika terjadi defisiensi asam amino argirin dapat menghambat metabolisme spermatozoa sehingga menyebabkan penurunan motilitas spermatozoa dan gangguan spermatogenesis. Asam amino argirin dapat melindungi membran plasma spermatozoa dari kerusakan akibat peroksidasi lipid dengan meningkatkan nitrit oksidasi (Husen et al. 2011). Mekanisme nitrit oksidasi menginaktivasi superoksidasi (O2) yang dihasilkan oleh spermatozoa selama proses konsumsi oksigen, superoksidasi yang berlebihan menyebabkan peroksidasi pada membran fosfolipid spermatozoa sehingga dapat menimbulkan kerusakan secara fungsional (Srivatsava et al. 2006). Asam amino arginin dapat menahan agen - agen yang mencegah pemecahan gula pada spermatozoa, sehingga dapat memperbesar aktifitas metabolik dan meningkatkan ketersediaan energi bagi sel-sel spermatozoa sehingga proses spermatogenesis dan kualitas spermatozoa menjadi lebih baik (Mayasari et al. 2005).
Suplementasi omega-3 dalam pakan mengandung PUFA dan DHA yang berpengaruh terhadap peningkatan motilitas spermatozoa hingga 82.50%. Hasil penelitian ini sejalan dengan laporan (Jafaroghli et al. 2014) bahwa pemberian minyak ikan mengandung PUFA dapat meningkatkan motilitas spermatozoa domba 82.68%. Peningkatan motilitas spermatozoa pada perlakuan R3 diduga akibat pengaruh PUFA karena dapat melindungi membran plasma serta meningkatkan kation Na+ dan K+. Menurut Robaire et al. (2006) bahwa kation Na+ dan K+ berperan dalam pembentukan keseimbangan osmotik plasma semen dan berperan penting dalam pergerakan spermatozoa.
13
Membran sel spermatozoa pada ternak ruminansia sebagian besar terdiri atas phospholipid bilayer dan protein, yang banyak mengandung asam lemak tak jenuh ganda atau PUFA khususnya DHA (C22: 6 n-3) yang berperan penting di dalam mempertahankan integritas membran plasma. Menurut Wathes et al. (2007), hewan tidak dapat mensintesis asam lemak tak jenuh, sehingga untuk mendapatkan asupan asam lemak tersebut harus diberikan dalam pakan. Kekurangan asupan DHA dalam pakan dapat menyebabkan gangguan pada motilitas spermatozoa, hal tersebut telah di laporkan oleh Gholmi et al. (2010) bahwa pemberian DHA 10% dan EPA 6% dalam pakan sapi selama sembilan minggu dapat meningkatkan motilitas spermatozoa dibandingkan dengan kontrol. Menurut Connor et al. (1998) bahwa 99% DHA pada spermatozoa kera berpusat di bagian ekor yang berfungsi untuk proses pergerakan.
Viabilitas Spermatozoa
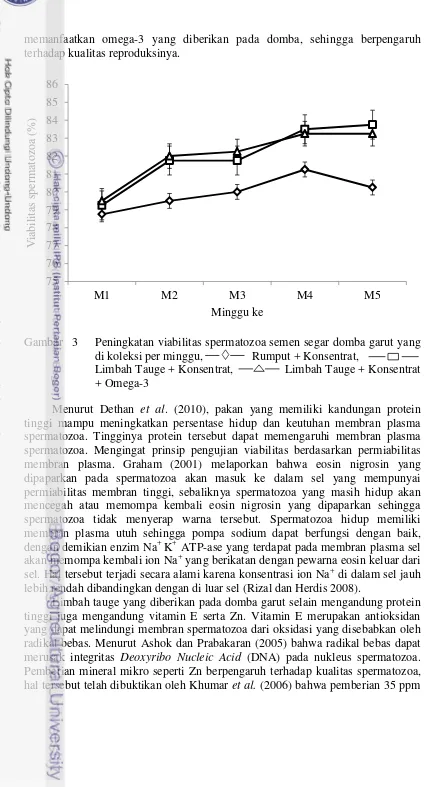
Viabilitas spermatozoa domba garut sebelum perlakuan menunjukkan nilai 78.00% - 79.00% dan setelah perlakuan nilai viabilitasnya adalah 80.00% - 83.00% (Tabel 7) Pengamatan viabilitas spermatozoa per minggu terlihat adanya perbedaan yang signifikan (P< 0.05) pada perlakuan R2 dan R3 minggu ke lima (Gambar 3).
Tabel 7 Viabilitas spermatozoa domba garut sebelum dan setelah pemberian pakan limbah tauge dan suplementasi omega-3
Perlakuan Pakan Viabilitas spermatozoa (%)1
Sebelum perlakuan Setelah perlakuan Huruf yang berbeda pada baris yang sama menunjukkan perbedaan nyata (P< 0.05) R1 = rumput +
konsentrat, R2 = limbah tauge + konsentrat, R3 = limbah tauge + konsentrat + omega-3. 1
Peningkatan viabilitas spermatozoa domba garut sebelum dan setelah perlakuan pakan.
14
memanfaatkan omega-3 yang diberikan pada domba, sehingga berpengaruh terhadap kualitas reproduksinya.
Gambar 3 Peningkatan viabilitas spermatozoa semen segar domba garut yang di koleksi per minggu, Rumput + Konsentrat, Limbah Tauge + Konsentrat, Limbah Tauge + Konsentrat + Omega-3
Menurut Dethan et al. (2010), pakan yang memiliki kandungan protein tinggi mampu meningkatkan persentase hidup dan keutuhan membran plasma spermatozoa. Tingginya protein tersebut dapat memengaruhi membran plasma spermatozoa. Mengingat prinsip pengujian viabilitas berdasarkan permiabilitas membran plasma. Graham (2001) melaporkan bahwa eosin nigrosin yang dipaparkan pada spermatozoa akan masuk ke dalam sel yang mempunyai permiabilitas membran tinggi, sebaliknya spermatozoa yang masih hidup akan mencegah atau memompa kembali eosin nigrosin yang dipaparkan sehingga spermatozoa tidak menyerap warna tersebut. Spermatozoa hidup memiliki membran plasma utuh sehingga pompa sodium dapat berfungsi dengan baik, dengan demikian enzim Na+ K+ ATP-ase yang terdapat pada membran plasma sel akan memompa kembali ion Na+ yang berikatan dengan pewarna eosin keluar dari sel. Hal tersebut terjadi secara alami karena konsentrasi ion Na+ di dalam sel jauh lebih rendah dibandingkan dengan di luar sel (Rizal dan Herdis 2008).
Limbah tauge yang diberikan pada domba garut selain mengandung protein tinggi juga mengandung vitamin E serta Zn. Vitamin E merupakan antioksidan yang dapat melindungi membran spermatozoa dari oksidasi yang disebabkan oleh radikal bebas. Menurut Ashok dan Prabakaran (2005) bahwa radikal bebas dapat merusak integritas Deoxyribo Nucleic Acid (DNA) pada nukleus spermatozoa. Pemberian mineral mikro seperti Zn berpengaruh terhadap kualitas spermatozoa, hal tersebut telah dibuktikan oleh Khumar et al. (2006) bahwa pemberian 35 ppm
15
Zn dalam pakan dapat meningkatkan motilitas, viabilitas dan konsentrasi spermatozoa pada sapi. Manfaat omega-3 yang mengandung PUFA dan DHA terhadap viabilitas spermatozoa telah di teliti oleh Tavilani et al. (2007) bahwa fosfolipid dan PUFA diperlukan untuk mempertahankan integritas membran plasma spermatozoa.
Gambar 4 Viabilitas spermatozoa domba garut (a: Spermatozoa hidup dan b: spermatozoa mati)
Konsentrasi Spermatozoa
Konsentrasi spermatozoa merupakan jumlah spermatozoa yang terkandung dalam satu mL semen, semakin banyak sel spermatozoa maka semakin tinggi spermatozoa yang dapat melakukan fertilisasi. Konsentrasi spermatozoa domba garut sebelum perlakuan pakan adalah 3430 x106 – 3491 x106 mL-1 dan setelah perlakuan pakan pada R2 3650 x106 mL-1 dan R3 3635 x106 mL-1 lebih tinggi (P< 0.05) dari R1 3522 x106 mL-1 (Tabel 8). Pengamatan konsentrasi spermatozoa domba garut per minggu belum menunjukkan adanya peningkatan signifikan (P> 0.05) hingga minggu ke lima, diduga karena domba garut jantan yang berumur 2-2.5 tahun telah mencapai puncak produksi spermatozoa, sehingga pakan yang diberikan hanya mampu mempengaruhi konsentrasi spermatozoa dalam jumlah yang sedikit. Namun dalam penelitian ini terlihat bahwa konsentrasi spermatozoa domba garut perlakuan R2 (Gambar 5), cenderung lebih tinggi bila dibandingkan dengan R3 dan R1. Peningkatan tidak signifikan juga terlihat pada perlakuan kontrol, karena pada perlakuan kontrol pakan ditambahkan konsentrat yang sebelumnya hanya menggunakan rumput lapang.
Perbedaan konsentrasi spermatozoa domba garut pada perlakuan pakan R2 dan R3 dibandingkan dengan R1 disebabkan oleh kandungan protein dan asam amino arginin yang terdapat pada limbah tauge sebanyak 200 mg 100g-1 (National Food Institut 2009). Asam amnio arginin dapat memperbaiki proses spermatogenesis sehingga konsentrasi spermatozoa yang diejakulasikan meningkat. Asam amino arginin pada tikus putih dapat meningkatkan jumlah spermatozoa dengan cara menghambat inhibitor glikolisis spermatozoa sehingga
a a
b b
a a
16
meningkatkan aktivitas metabolik hingga delapan kali lipat (Mayasari et al. 2005). Menurut Linder (2006) vitamin E merupakan agen pemacu fertilitas, yaitu untuk menormalkan epitel pada tubuli seminiferi. Degenerasi epitel tubuli seminiferi akibat defisiensi vitamin E pada tikus jantan dapat menyebabkan penghambatan spermatogenesis, menghentikan produksi spermatozoa, dan degenerasi sel benih (Bensoussan et al. 1998). Menurut Astuti et al. (2008) bahwa penambahan isoflavon, Zn dan vitamin E pada ransum tikus selama dua bulan dapat meningkatkan kadar hormon testosteron serta jumlah sel spermatogenia pada tubuli seminiferi.
Tabel 8 Konsentrasi spermatozoa domba garut sebelum dan setelah pemberian pakan limbah tauge dan suplementasi omega-3
Perlakuan Pakan Konsentrasi spermatozoa (juta ml-1)1 Sebelum perlakuan Setelah perlakuan
rumput + konsentrat, R2 : Pakan limbah tauge + konsentrat, R3 : Pakan limbah tauge + konsentrat +
omega-3. 1 Peningkatan konsentrasi spermatozoa domba garut sebelum dan setelah perlakuan pakan.
Vitamin E dalam limbah tauge dapat meningkatkan konsentrasi spermatozoa dengan cara menangkal terjadinya radikal bebas yang terjadi pada testis domba. Radikal bebas pada testis dapat mengubah kestabilan dan fungsi membran akibat dari terjadinya peroksidasi lipid. Menurut Sikka (2004) bahwa sistem pertahanan tubuh yang dapat digunakan untuk melawan radikal bebas dipengaruhi oleh tersedianya zat-zat gizi yang berasal dari bahan pakan yang memiliki potensi sebagai antioksidan. Vitamin E telah diketahui dapat meningkatkan konsentrasi spermatozoa, selain itu Zn juga memberikan pengaruh terhadap peningkatan konsentrasi spermatozoa dengan cara mensintesis hormon
dihydroxytestosteron yang memacu sel leydig untuk memproduksi hormon testosteron, sehingga membantu dalam proses pembelahan sel germinal dalam tubuli seminiferi pada saat proses spermatogenesis. Defisiensi Zn pada pakan dapat menyebabkan difusi gonad seperti penurunan berat testis serta penyusutan tubuli seminiferi (Liu et al. 2009). Menurut Hunt et al. (1992) bahwa defisiensi Zn secara langsung menurunkan jumlah sel leydig, serta menghentikan proses spermatogenesis karena terjadinya penyusutan tubuli seminiferi dan reduksi sel
Leydig. Akibat dari penyusutan tubuli seminiferi tersebut berdampak terhadap penurunan poduksi spermatozoa sehingga konsentrasi spermatozoa menurun.
17
domba berkisar antara 2000 - 3000x106 (Garner dan Hafez 2000) dan pada domba garut 3242x 106 (Herdis et al. 2005).
Konsentrasi spermatozoa per ejakulat merupakan jumlah total spermatozoa dalam satu kali ejakulasi, dapat dihitung dengan cara mengalikan volume semen yang diejakulasikan dengan konsentrasi spermatozoa per mL. Konsentrasi spermatozoa per ejakulat sebelum perlakuan pada penelitian ini menunjukkan R1 2058x106, R2 1701x106 dan R3 2094x106 dan setelah perlakuan konsentrasi spermatozoa per ejakulat meningkat pada R1 2335x106, R2 3102x106 dan R3 2908x106. Jumlah konsentrasi per ejakulat sebelum dan setelah perlakuan terlihat meningkat signifikan (P< 0.05) pada semua perlakuan pakan yang diberikan, karena seluruh domba mengalami perbaikan pakan termasuk pada perlakuan kontrol. Peningkatan total konsentrasi spermatozoa per ejakulat pada pengamatan per minggu tidak menunjukkan adanya perbedaan signifikan antara perlakuan (P> 0.05). Namun peningkatan total konsentrasi per ejakulat antara perlakuan R2 dan R3 lebih tinggi dibandingkan R1, karena konsentrasi spermatozoa per mL mengalami peningkatan disertai dengan meningkatnya volume semen sehingga total konsentrasi menjadi lebih tinggi.
Morfologi Spermatozoa
Morfologi spermatozoa adalah bentuk spermatozoa terdiri atas morfologi spermatozoa yang normal dan abnormal. Spermatozoa abnormal yang diamati dalam penelitian adalah abnormalitas primer dan sekunder. Abnormalitas primer merupakan kelainan spermatozoa yang berasal dari proses sprematogenesis di
18
antaranya kepala terlalu besar atau kecil, kepala lebih dari satu atau kelainan pada ekor (Chenoweth 2005) sedangkan kelainan abnormalitas sekunder biasanya terjadi pada saat pembuatan preparat seperti kepala terlepas dari ekor (Rizal dan Herdis 2008). Abnormalitas spermatozoa sebelum perlakuan cukup rendah yaitu hanya 4.00 sampai dengan 5.57%. Jumlah spermatozoa yang abnormal menurun (P< 0.05) setelah perlakuan antara 1.5% sampai dengan 2.3% (Tabel 9).
Tabel 9 Abnormalitas spermatozoa domba garut sebelum dan setelah pemberian pakan limbah tauge dan suplementasi omega-3
Perlakuan Pakan Abnormalitas spermatozoa (%)1 Sebelum perlakuan Setelah perlakuan
Huruf yang berbeda pada baris yang sama menunjukkan perbedaan nyata (P<0.05) R1 = rumput +
konsentrat, R2 = limbah tauge + konsentrat, R3 = limbah tauge + konsentrat + omega-3. 1
Penurunan abnormalitas spermatozoa domba garut sebelum dan setelah perlakuan pakan.
Pengamatan abnormalitas spermatozoa domba garut per minggu (Gambar 6), terlihat adanya penurunan pada semua perlakuan pakan, namun penurunan abnormalitas tersebut tidak berbeda nyata (P> 0.05) antara perlakuan pakan. Hasil penelitian ini lebih baik bila di bandingkan dengan hasil Rizal et al. (2013) yaitu abnormalitas spermatozoa domba garut mencapai 6.20±1.17%. Jumlah abnormalitas spermatozoa pada penelitian ini sangat baik mengingat abnormalitas spermatozoa pada domba menurut Garner dan Hafez (2000) berkisar antara 5% sampai dengan 20%. Rendahnya nilai spermatozoa dalam penelitian ini kemungkinan karena pakan yang diberikan sangat baik sehingga mendukung proses spermatogenesis dan pematangan spermatozoa dalam epididymis. Selain itu konsumsi asam amino arginin yang terdapat pada limbah tauge diduga memberikan pengaruh terhadap perbaikan abnormalitas spermatozoa. Menurut Husein et al. (2011) pemberian suplementasi arginin 0.1mg 100 g-1 dan vitamin E 0.1 mg 100 mg-1 pada minum tikus putih dapat menurunkan abnormalitas spermatozoa dalam 30 hari.
Limbah tauge yang mengandung protein, Zn dan vitamin E memberikan pengaruh terhadap morfologi spermatozoa, hal tersebut telah dilaporkan oleh Cheah dan Yang (2011) bahwa pemberian Zn dan selenium berpengaruh besar terhadap integritas morfologi spermatozoa terutama dalam pembentukan middle piece, jika middle piece abnormal akan menyebabkan cacat pada sambungan kepala dan ekor spermatozoa. Suplementasi omega-3 dalam pakan domba garut memberikan pengaruh tidak signifikan terhadap penurunan abnormalitas spermatozoa, hal tersebut sejalan dengan pendapat Esmaeili et al. (2012) bahwa pemberian minyak ikan yang mengandung omega-3 dan omega-6 dalam pakan domba selama empat minggu tidak memberikan pengaruh terhadap abnormalitas spermatozoa.
19
0 1 2 3 4 5 6 7
M1 M2 M3 M4 M5
Abnor
malit
as sper
matoz
oa
(%
)
Minggu ke
dalam bentuk apapun tidak dapat membuahi ovum, baik jenis abnormalitas yang terjadi pada bagian tubuli seminiferi dan epididimis ataupun saat proses penampungan semen. Proses spermatogenesis sampai dengan terbentuknya spermatozoa dalam tubuli seminiferi pada domba selama 46-49 hari, selanjutnya dari tubuli seminiferi spermatozoa di transportasikan kedalam epididimis (Toelihere 1985). Perbaikan abnormalitas spermatozoa domba garut pada penelitian ini diduga terjadi pada bagian tubuli seminiferi hal tersebut dikarenakan setelah lima minggu pemberian pakan R1, R2 dan R3, terlihat adanya respon penurunan persentase abnormalitas spermatozoa yang signifikan. Hal tersebut menunjukkan bahwa pemberian pakan limbah tauge dan suplemenstasi omega-3 telah sesuai dengan kebutuhan nutrisi pakan ternak, salah satunya adalah kandungan protein yang tinggi yaitu 13% pada limbah tauge. Kebutuhan protein bagi domba dewasa dengan bobot badan diatas 30 kg adalah 10-12.5%, sehingga dapat memperbaiki abnormalitas spermatozoa selama proses spermatogenesis yang terjadi pada bagian tubuli seminiferi.
Gambar 6 Penurunan abnormalitas spermatozoa semen segar domba garut yang di koleksi per minggu, Rumput + Konsentrat
Limbah Tauge + Konsentrat, Limbah Tauge + Konsentrat + Omega-3
Kualitas Spermatozoa Domba Garut Post Thawing
20
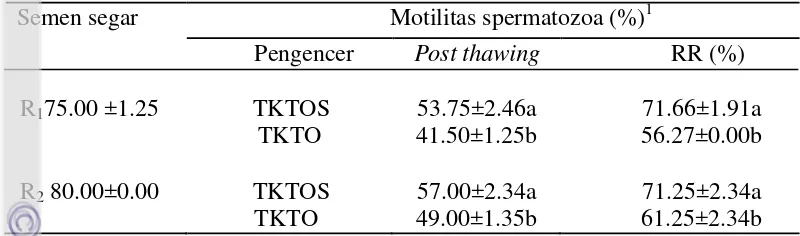
dengan 47%, akan tetapi penelitiannya menggunakan pengencer tris kuning telur biasa.
Viabilitas spermatozoa domba garut postthawing dalam pengencer TKTOS memiliki persentase lebih tinggi (P< 0.05) dari viabilitas spermatozoa dalam pengencer TKTO pada domba yang diberi perlakuan pakan R1 dan R2. Hasil penelitian ini lebih tinggi dari Iqbal et al. (2015) yaitu 54.50% pada semen kambing boer, perbedaan ini kemungkinan karena ternak yang digunakan berbeda. Membran plasma utuh (MPU) spermatozoa domba garut post thawing
dalam pengencer TKTSO lebih tinggi (P< 0.05) dibandingkan dengan TKTO pada domba dengan perlakuan pakan R1 dan R2. Nilai MPU pada penelitian ini lebih baik dari laporan Rizal et al. (2013) yaitu 52.80±4.21% pada jenis ternak yang sama, bahkan pada spermatozoa kambing boer, nilai MPU post thawing hanya 39.50 % (Iqbal et al. 2015) menggunakan pengencer yang sama.
Tabel 10 Kualitas spermatozoa domba garut post thawing dengan pengencer
konsentrat, TKTOS : Tris kuning telur biasa + omega-3 wild salmon oil, TKTO : Tris kuning telur omega-3. *Membran plasma utuh
Proses kriopreservasi dapat menyebabkan penurunan kualitas spermatozoa yang diakibatkan oleh adanya peroksidasi lipid. Menurut Holt (2000), reaksi peroksidasi lipid ini sangat berbahaya bagi kelangsungan hidup spermatozoa dikarenakan dapat merusak bagian dari membran plasma sel dan dapat mengakibatkan kematian spermatozoa. Ciri kerusakan sel spermatozoa akibat peroksida lipid ialah rendahnya motilitas spermatozoa, kerusakan enzim intraseluler, dan kerusakan membran plasma terutama pada bagian akrosom (White 1993). Peroksidasi lipid diakibatkan oleh adanya radikal bebas, karena radikal bebas dapat menyebabkan reaksi berlanjut sampai radikal bebas tersebut dihilangkan oleh reaksi dengan radikal bebas lain atau sistem anti oksidan seperti adanya vitamin E (Zhu et al. 2010).
21
vitamin E. Vitamin E berfungsi sebagai antioksidan untuk menangkal radikal bebas ataupun peroksidasi lipid dengan menyumbangkan hidrogen ke dalam reaksi yang mampu mengubah radikal peroksil (hasil peroksidasi lipid) menjadi radikal tokoferol yang kurang reaktif, sehingga tidak mampu merusak rantai asam lemak (Winarsi 2007).
Hasil penelitian ini menunjukkan bahwa persentase motilitas, viabilitas serta MPU spermatozoa domba garut post thawing dalam pengencer TKTOS lebih baik dibandingkan dengan pengencer TKTO. Perbedaan tersebut diduga karena pengaruh PUFA dan DHA dalam TKTOS yang menggunakan sumber omega-3 dari minyak ikan lebih tinggi dari omega-3 telur. Menurut Nichols et al. (2014) omega-3 yang berasal dari minyak ikan salmon mengandung PUFA 35.5%, EPA 180 mg 100 g-1 dan DHA 120 mg 100 g-1. Menurut Polat et al. (2013), kandungan PUFA telur omega-3 adalah 31.18% dan DHA 31 mg 100 g-1.
Pengencer TKTOS dan TKTO mengandung kuning telur, yang di dalamnya telah terdapat lesitin, fosfolipid dan lipoprotein sebagagai agen protektif. Menurut Toelihere (1985) kuning telur berfungsi untuk mempertahankan dan melindungi integritas selubung lipoprotein sel spermatozoa. Kandungan PUFA dan DHA yang terdapat dalam omega-3 minyak ikan salmon lebih baik bila dibandingkan dengan omega-3 telur dalam meningkatkan daya perlindungan membran plasma spermatozoa dari cekaman dingin pada saat proses kriopreservasi. Lesitin, fosfolipid, PUFA dan DHA dalam pengencer TKTOS, dapat menguatkan membran plasma di bagian kepala dan ekor spermatozoa, terlihat dari tingginya persentase motilitas, viabilitas serta keutuhan membran spermatozoa pada saat
post thawing.
Membran plasma spermatozoa dalam penelitian ini berfungsi dengan baik, hal tersebut dapat dibuktikan pada saat pewarna yang dipaparkan ditolak oleh membran spermatozoa. Penolakan pewarna yang dipaparkan berkaitan dengan permeabilitas membran, jika membran sel berlebihan kandungan elektrolitnya yang diakibatkan oleh pengkristalan es pada saat kriopreservasi, maka akan terjadi peningkatan permeabilitas membran sehingga dapat mengakibatkan sel menjadi mati pada saat thawing. Efek yang ditimbulkan pada spermatozoa akibat pembentukan kristal-kristal es adalah penurunan motilitas dan viabilitas spermatozoa.
Spermatozoa terdiri atas tiga bagian, yaitu middle piece, principle piece dan
end piece. Bagian utama dari middle piece adalah mitokondria yang berfungsi untuk menghasilkan Adenosin Tri Fosfat (ATP), ATP ini berfungsi untuk menggerakkan aksonema pada bagian principle piece dan end piece, sehingga spermatozoa dapat bergerak maju ke depan. Pergerakan spermatozoa maju ke depan memungkinkan adanya peluang fertilisasi lebih cepat.
Penelitian mengenai penggunaan PUFA dan DHA dalam pengencer semen untuk kriopreservasi telah dilaporkan sebelumnya oleh beberapa peneliti. Ansari
22
berperan dalam mengurangi terjadinya peroksidasi lipid. Landvik et al. (2002) melaporkan bahwa vitamin E berperan memperlambat berlangsungnya reaksi peroksidasi lipid karena mampu menangkap (scavenger) radikal bebas dan memutus rantai proses peroksidasi lipid di dalam membran dengan menyumbangkan satu atom hidrogen dari gugus OH pada cincinnya ke radikal bebas.
Recovery Rate (RR) Spermatozoa Semen Domba Garut
Keberhasilan kriopreservasi semen selain dapat dilihat dari kualitas spermatozoa, dapat juga dilihat dari segi kemampuan spermatozoa berhasil pulih kembali setelah proses kriopreservasi yang disebut recovery rate (RR). Nilai RR antara perlakuan pengencer TKTOS (P< 0.05) dibandingkan dengan TKTO, karena perlakuan pengencer yang mengandung omega-3 (Wild salmon oil) memiliki nilai persentase RR lebih tinggi bila dibandingkan dengan pengencer omega-3 telur (Tabel 11). Perbedaan tersebut dipengaruhi oleh adanya komponen PUFA dan DHA dalam omega-3 yang berbeda antara kedua pengencer. Menurut Towhidi et al. (2013) PUFA dan DHA dibutuhkan untuk mempertahankan membran plasma spermatozoa pada saat kriopreservasi, karena proses kriopreservasi menyebabkan terjadinya pembentukan kristal es yang dapat menurunkan kualitas spermatozoa. Keberhasilan RR dalam penelitian ini cukup tinggi bila dibandingkan dengan hasil penelitian Ashmawy et al. (2010) melaporkan penggunaan kuning telur sebanyak 2.5% dalam pengencer dapat mempertahankan spermatozoa post thawing (RR 65.9±0.25) bila dibandingkan dengan 20% kuning telur.
Proses kriopreservasi dapat menyebabkan kerusakan permanen pada organel spermatozoa dan terjadinya perubahan fluiditas membran serta aktifitas enzimatik yang dapat menurunkan motilitas, viabilitas dan fertilitas spermatozoa (Sariozkan
et al. 2009). Kerusakan spermatozoa pada saat proses kriopreservasi terjadi akibat pembentukan kristal es, yang dapat merusak membran spermatozoa. Kerusakan membran pada bagian middle piece, dapat mengganggu pembentukan ATP oleh mitokondria, sehingga menurunkan persentase motilitas spermatozoa. Semakin banyak spermatozoa yang rusak akibat proses kriopreservasi maka semakin sedikit spermatozoa yang dapat pulih kembali pada saat post thawing.
23
Tabel 11 Recovery Rate (RR) spermatozoa domba garut post thawing
Semen segar Motilitas spermatozoa (%)1
Pengencer Post thawing RR (%)
(limbah tauge + konsentrat) TKTOS : Tris kuning telur biasa + omega-3 wild salmon oil, TKTO : Tris kuning telur omega-3. 1Nilai kemampuan spermatozoa domba garut pulih kembali post thawing.
Penurunan motilitas spermatozoa post thawing yang diakibatkan oleh terbentuknya kristal es pada pengencer hipertonik karena mengandung gliserol, serta pembentukan peroksidasi lipid, yang dapat menyebabkan kerusakan pada spermatozoa. Penurunan motilitas spermatozoa diakibatkan oleh penurunan suhu pada saat ekuilibrasi dari suhu normal 37 oC menjadi suhu rendah 5 oC – 0 oC, setiap penurunan suhu 10 oC menyebabkan penurunan metabolisme sel spermatozoa hingga 50%, atau pada suhu 5 oC metabolisme sel spermatozoa tinggal 10%. Oleh karena itu untuk mempertahankan organ di dalam sel dari kerusakan akibat penurunan suhu, maka diberikan buffer sebagai pelindung membran sel pada saat pengenceran di antaranya yang mengandung lecitin, sehingga membran sel terlindungi dari proses kriopreservasi. Pada saat thawing
dengan suhu normal 37 oC – 38 oC sel spermatozoa dapat melakukan proses metabolisme kembali oleh mitokondria untuk menghasilkan ATP sehingga spermatozoa tersebut dapat bergerak. Menurut Ustuner et al. (2014), penurunan motilitas akibat kriopreservasi pada semen domba mencapai 29% - 41% post thawing. Hasil penelitian ini menunjukkan kerusakan spermatozoa yang dapat menyebabkan penurunan motilitas spermatozoa tergolong rendah berkisar antara 21.25% - 23.00% pada pengencer TKTOS dan 31.00% - 33.50% pada pengencer TKTO. Menurut Yimer et al. (2014) kerusakan bisa terjadi sampai 38% menggunakan suplementasi omega-3 dalam pengencer pada semen ternak kambing.
Hasil penelitian ini menunjukkan bahwa pakan limbah tauge pengganti rumput dapat meningkatkan volume semen, motilitas, viabilitas, konsentrasi spermatozoa per mL dan konsentrasi spermatozoa total per ejakulat. Penambahan omega-3 pada pakan limbah tauge hanya memperbaiki motilitas tetapi tidak pada parameter kualitas semen yang lain. Meningkatnya konsentrasi spermatozoa total perejakulat menyebabkan jumlah betina yang bisa dilayani jika dilakukan dengan teknik inseminasi buatan akan meningkat, dengan kata lain pemberian limbah tauge bisa meningkatkan produktivitas dan reproduksivitas domba garut.
24
dijadikan semen beku sesuai dengan Standar Nasional Indonesia (SNI) 4869.3:2014 tahun 2014 tentang semen beku kambing dan domba yaitu motilitas spermatozoa kambing dan domba minimal 40%.
4
SIMPULAN DAN SARAN
Simpulan
1. Pemberian pakan limbah tauge pengganti rumput dapat meningkatkan produktivitas kualitas spermatozoa semen segar domba garut.
2. Suplementasi omega-3 (wild salmon oil) hanya mampu meningkatkan motilitas spermatozoa.
3. Pengencer tris kuning telur yang disuplementasi omega-3 minyak ikan (wild salmon oil) memiliki kemampuan yang lebih baik dalam mempertahankan motilitas, viabilitas dan membran plasma spermatozoa selama proses kriopreservasi, serta layak dijadikan sebagai suplementasi dalam pengencer semen beku domba untuk program IB.
Saran
Suplementasi omega-3 (Wild salmon oil) secara in vivo pada domba garut perlu dikaji ulang, karena berkaitan dengan efisiensi biaya dan waktu, serta penggunaan omega-3 (Wild salmon oil) sebaiknya dilakukan secara in vitro.
DAFTAR PUSTAKA
Alizadeh A, Esmaeili V, Shahverdi A, Rashidi L. 2014. Dietary fish oil can change sperm parameters and fatty acid profiles of ram sperm during oil consumption period and after removal of oil source. 16 (3):289-298
Ansari M, Towhidi1 A, MorAdi SM, Bahreini M. 2012. Docosahexaenoic acid and alpha-tocopherol improve sperm cryosurvival in goat. SlovakJ Anim Sci
45(1): 7-13.
Arifiantini RI, Wresdiyati T, Retnani EF. 2006. Pengujian morfologi spermatozoa sapi bali (Bos Sondaicus) menggunakan pewarnaan "williams" J Indon Trop Anim Agric 31 (2)
Arfiantini RI. 2012. Teknik Koleksi dan Evaluasi Semen pada Hewan. Yusuf L T, editor. Bogor (ID): IPB Press
Ashmawy TAM, AA Sallam, AE Abd, El-Khalek, BE El-Saidy and MG Gabr, 2010. Recovery and fertilization rates of goat spermatozoa as affected by different levels of egg-yolk, dilution rates, freezing method and months of the year. J Sheep Goat Sci (5): 283-293.
Ashok A and Prabakaran SA. 2005. Oxidative stress and antioxidants in male infertility: a difficult balance. Iran J of Reprod Med 3 (1): 1-8
25
kadar hormon testosteron serum dan jumlah sel spermatogenik pada tubuli seminiferi testis tikus jantan. JITV 13(4):288-294
Astuti S, Muchtadi D, Astawan M, Purwanta B dan Wresdiyati T. 2009. Kualitas
spermatozoa tikus yang diberi tepung kedelai kaya isoflavon, seng (Zn) dan
vitamin E. Med Pet 32 (1): 12-21.
Bagley CV. 2009. Breeding soundness examination of rams cooperative extension work Utah State University. http://extension.usu.edu/files/publications/facts heet/AH Sheep_ 02.pdf (1 September 2014)
Barth AD, Oko RJ. 1989. Abnormal Morphology of Bovine Spermatozoa. Iowa: Iowa States (US) University Press
Bearden HJ, Fuquay JW, Willard ST.2004. Applied Animal Reproduction. 6th ed. New Jersey (US) : Pearson Prentice Hall.
[BMKG] Badan Meteorologi Klimatoligi dan Geofisika. 2013. Buletin Analisis Hujan dan Indeks Kekeringan Bulan November 2012 dan Prakiraan Hujan Bulan Januari, Februari, dan Maret 2013. [internet] [diunduh 2014 Sep 2] http://www.bmkg.go.id/BMKG_Pusat/Informasi_Cuaca/Prakiraan_Cuaca/P rakiraan_Cuaca_Propinsi.bmkg?prop=13
Bensoussan K, Morales CR and Hermo L. 1998. Vitamin E deficiency causes incomplete spermatogenesis and affects the structural differentiation of epithelial cells of the epididymis in the rat. J Androl 19: 266-288.
[BSN]) Badan Standar Nasional. 2014. [SNI] Standar Nasional Indonesia Nomer 4869.3: 2014 tentang Semen beku – Bagian 3 : Kambing dan domba (ID) Indonesia.
Chenoweth PJ. 2005. Genetic Sperm defect. Theriogenology 64 : 457 – 468. Cheah Y, Yang W (2011). Functions of essential nutrition for high quality
spermatogenesis. Advances in Biosc and Biotech 2: 182-197
Connor WE, Lin DS, Wolf DP, Alexander M. 1998. Uneven distribution of desmosterol and docosahexaenoic acid in heads and tails of monkey sperm.
J Lipid Res 11 (39):1404
[Ditjennak] Direktorat Jenderal Peternakan Kementerian Pertanian. 2012. Jakarta [internet] [di unduh tanggal 10 september 2014] tersedia pada : http://www. Ditjennak. deptan. go. id.
Department of Primary Industries. 2007. NSW DPI Prime Facts. [12 September 2014] http://www.dpi.nsw.gov.au/__data/assets/pdf_file/0016/104641/full-hand-feeding-of-sheep-quantities.pdf
Department of Nutrition .2009. Beans Sprout, Mung, Raw. National Food Institute DTU .http://www.foodcomp.dk/v7/fcdb_details.asp?FoodId=0817 (10 September 2014)
Dethan AA, Kustono, Hartadi H. 2010. Kualitas dan kuantitas sperma kambing Bligon jantan yang diberi pakan rumput gajah dengan suplementasi tepung darah. Buletin Petern. 34(3) : 145-153.
Dolatpanah MB, Towhidi A, Farshad A, Rashidi A and Rezayazdi K 2008.
Effects of dietary fish oil on semen quality of goats. Asian-Australasian J Anim Sci (21): 29–34.
Esmaeili V, Shahve rdi AH, Alizadeh AR, Alipour H, Chehraz M. 2012. Saturated, omega-6 and omega-3 dietary fatty acid effects on the characteristics of fresh, frozen–thawed semen and blood parameters in rams.