KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK n-HEKSAN
ETILASETAT DAN METANOL SELADA AIR
(Nasturtium officinale W.T.Aiton)
SKRIPSI
OLEH: JESSICA NOVIA
NIM 0915010131
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK n-HEKSAN
ETILASETAT DAN METANOL SELADA AIR
(Nasturtium officinale W.T.Aiton)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: JESSICA NOVIA
NIM 091501131
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK n-HEKSAN
ETILASETAT DAN METANOL SELADA AIR
(Nasturtium officinale W.T.Aiton)
OLEH: JESSICA NOVIA
NIM 091501131
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 08 Februari 2014
Pembimbing I, Panitia Penguji,
Dra. Saleha Salbi, M.Si., Apt.
Dr. Marline Nainggolan, M.S., Apt. NIP 194909061980032001 NIP 195709091985112001
Pembimbing II, Dra. Saleha Salbi, M.Si., Apt.
NIP 194909061980032001
Dra. Suwarti Aris, M.Si., Apt. Drs. Rasmadin Muchtar, M.S., Apt.
NIP 195107231982032001 NIP 194909101980031002
Drs. Aswita Hafni Lubis, M.Si., Apt. NIP 195304031983032001
Medan, April 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Prof. Dr. Sumadio Hadisahputra, Apt. NIP 195311281983031002
Puji syukur kehadirat Tuhan Yang Maha Esa oleh karena kasih
karunia-Nya penulis dapat menyelesaikan penyusunan skripsi yang berjudul
“Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas
Antioksidan Ekstrak n-Heksan Etilasetat dan Metanol Selada Air (Nasturtium
officinale W.T.Aiton)”. Skripsi ini diajukan sebagai salah satu syarat untuk
memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas
Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih yang
sebesar-besarnya kepada Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara, yang telah memberikan bantuan serta
fasilitas selama pendidikan, kepada Dra. Saleha Salbi, M.Si., Apt., dan Dra.
Suwarti Aris, M.Si., Apt., selaku dosen pembimbing yang telah membimbing
penulis dengan penuh kesabaran selama penelitian,. Ucapan terima kasih juga
disampaikan kepada Dr. Marline Nainggolan, M.S., Apt., Drs. Rasmadin
Muchtar, M.S., Apt., dan Dra. Aswita Hafni Lubis, M.Si., Apt., selaku dosen
penguji yang telah memberikan saran, arahan, kritik, dan masukan kepada
penulis dalam penyelesaian skripsi ini. Dosen pembimbing akademik penulis,
Drs. Muchlisyam, M.Si., Apt., yang telah memberikan arahan dan bimbingan
kepada penulis selama ini, serta Bapak dan Ibu staf pengajar Fakultas Farmasi
USU yang telah mendidik penulis selama masa perkuliahan.
Ucapan terima kasih dan penghargaan yang sebesar-besarnya kepada
Fransisca Novia yang selalu memberikan dukungan moral maupun materil
kepada penulis.
Penulis menyadari bahwa tulisan ini masih jauh dari sempurna, untuk
itu penulis mengharapkan kritik dan saran yang membangun dari semua pihak
untuk perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini
dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, 06 Januari 2014 Penulis,
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK n-HEKSAN
ETILASETAT DAN METANOL SELADA AIR (Nasturtium officinale W.T.Aiton)
ABSTRAK
Selada air (Nasturtium officinale W.T.Aiton) adalah tumbuhan tahunan dari suku Brassicaceae. Tumbuhan ini sangat mudah tumbuh dan sering dijumpai di aliran sungai kecil, kolam, rawa dan danau yang dangkal. Selada air selain sebagai sayuran juga memiliki khasiat dalam pengobatan yakni sebagai antikanker, antidiabetes, antialergi, dan obat tuberculosis. Tujuan penelitian ini untuk mengetahui karakteristik simplisia, skrining fitokimia simplisia, ekstrak n-heksan, ekstrak etilasetat dan ekstrak metanol selada air serta menguji aktivitas antioksidan dari ketiga ekstrak tersebut.
Karakterisasi simplisia selada air meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total dan kadar abu tidak larut asam. Ekstrak selada air diperoleh secara perkolasi bertahap dengan menggunakan pelarut n-heksan, etilasetat dan metanol. Pengujian aktivitas antioksidan ekstrak selada air menggunakan metode pemerangkapan radikal bebas DPPH( 1,1-diphenyl-2-picrylhydrazyl) dan vitamin C sebagai pembanding. Data diolah menggunakan persamaan regresi untuk memperoleh nilai IC50 (Inhibitory Concentration).
Hasil karakterisasi simplisia diperoleh kadar air 3,98%; kadar sari larut dalam air 40,27%; kadar sari larut dalam etanol 17,09%; kadar abu total 12,46% dan kadar abu tidak larut dalam asam 2,16%. Hasil skrining fitokimia pada ekstrak n-heksan hanya terdapat steroid/tritepenoid, pada simplisia dan ekstrak etilasetat menunjukkan adanya senyawa flavonoida, glikosida dan steroid/tritepenoid, dan pada ekstrak metanol terdapat glikosida dan flavonoid. Hasil pengujian menunjukkan ekstrak n-heksan, etilasetat dan metanol selada air memiliki aktivitas antioksidan yang sangat lemah dengan nilai IC50
berturut-turut sebesar 712,81 ppm, 405,01 ppm dan 273,14 ppm.
CHARACTERIZATION OF SIMPLEX AND PHYTHOCHEMICAL SCREENING AND ANTIOXIDANT ACTIVITY OF n-HEXANE
ETHYLACETATE AND METHANOL EXTRACT OF WATERCRESS (Nasturtium officinale W.T.Aiton)
ABSTRACT
Watercress (Nasturtium officinale W.T.Aiton) is a annual plant from Brassicaceae family. It is easily grown and often grows wildly at small river, pond, swamp and swallow lake. It is not only consumed as vegetable but also used as anticancer, antidiabetes, antiallergy, and tuberculosis drug. The objective of this research are to determine characteristic of simplex, phythochemical content in simplex, n-hexane, ethylacetate and methanol extract of watercress and also to test the antioxidant activity of these extracts.
Characterization of watercress simplex included macroscopic and microscopic examination, determination of water content, water-soluble extract content, ethanol-soluble extract content, total ash content and acid-insoluble ash content. Watercress extracts were made by continuous percolation using n -hexane, ethylacetate and methanol as the solvent. Antioxidant activity of watercress extracts were tested with free radical scavenging DPPH ( 1,1-diphenyl-2-picrylhydrazyl) method compared to vitamin C. The data were analyzed using regression equation to obtain IC50 (Inhibitory Concentration)
value.
The characterization results showed water content 3.98%; water-soluble extract content 40.27%; ethanol-soluble extract content 17.09%; total ash content 12.46% and acid-insoluble ash content 2.16%. The phythochemical screening of n-hexane extract showed the presence of steroids/triterpenoids, simplex and ethylacetate extract showed the presence of flavonoids, glycosides and steroids/triterpenoids and methanol extract showed the presence of glycosides and flavonoids. The test results showed n-hexane, ethylacetate and methanol extract of watercress possessed weak antioxidant activity with IC50
value were 712.81 ppm; 405.01 ppm and 273.14 ppm, respectively.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Sistematika tumbuhan ... 6
2.1.3 Nama daerah ... 6
2.1.4 Nama asing ... 6
2.1.5 Daerah tumbuh ... 7
2.1.6 Morfologi tumbuhan ... 7
2.1.7 Kandungan kimia ... 7
2.1.8 Kegunaan ... 9
2.2 Ekstraksi ... 9
2.3 Radikal Bebas ... 11
2.4 Antioksidan ... 12
2.4.1 Antioksidan alami ... 13
2.4.2 Vitamin C ... 14
2.4.3 Beta-karoten ... 15
2.4.4 Vitamin E ... 16
2.5 Spektrofotometri UV-Visibel ... 17
2.6 Metode Pemerangkapan Radikal Bebas DPPH ... 18
2.6.1 Pelarut ... 19
2.6.2 Pengukuran panjang gelombang ... 20
2.6.3 Waktu pengukuran ... 20
BAB III METODE PENELITIAN ... 21
3.1 Alat dan Bahan ... 21
3.1.1 Alat ... 21
3.1.2 Bahan ... 21
3.2 Penyiapan Bahan Tumbuhan ... 22
3.2.2 Identifikasi bahan tumbuhan ... 22
3.2.3 Pengeringan bahan tumbuhan ... 22
3.3 Pembuatan Pereaksi ... 23
3.3.1 Besi (III) klorida 1%b/v ... 23
3.3.2 Larutan asam klorida 2N ... 23
3.3.3 Timbal (II) asetat 0,4 M ... 23
3.3.4 Pereaksi Mayer ... 23
3.3.5 Pereaksi Mollish ... 23
3.3.6 Pereaksi Dragendorff ... 24
3.3.7 Larutan kloralhidrat ... 24
3.3.8 Larutan pereaksi asam sulfat 2N ... 24
3.3.9 Pereaksi Bouchardat ... 24
3.3.10 Pereaksi Liebermann-Burchard ... 24
3.3.11 Larutan pereaksi DPPH 0,05mM ... 24
3.4 Pemeriksaan Karakterisasi Simplisia ... 24
3.4.1 Pemeriksaan makroskopik ... 24
3.4.2 Pemeriksaan mikroskopik ... 25
3.4.3 Penetapan kadar air ... 25
3.4.4 Penetapan kadar sari larut air ... 26
3.4.5 Penetapan kadar sari larut etanol ... 26
3.4.6 Penetapan kadar abu total ... 26
3.4.7 Penetapan kadar abu tidak larut asam ... 27
3.5 Skrining Fitokimia ... 27
3.5.2 Pemeriksaan flavonoida ... 28
3.5.3 Pemeriksaan glikosida ... 28
3.5.4 Pemeriksaan glikosida antrakinon ... 29
3.5.5 Pemeriksaan saponin ... 29
3.5.6 Pemeriksaan tanin ... 29
3.5.7 Pemeriksaan steroida/triterpenoida ... 30
3.6 Pembuatan Ekstrak Selada Air (ESA)... 30
3.7 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel ... 31
3.7.1 Prinsip metode pemerangkapan radikal bebas DPPH ... 31
3.7.2 Pembuatan larutan blanko ... 31
3.7.3 Penetuan panjang gelombang serapan maksimum .. 31
3.7.4 Pembuatan larutan induk ESA ... 31
3.7.5 Pembuatan larutan uji ESA ... 31
3.7.6 Pembuatan larutan induk vitamin C ... 32
3.7.7 Pembuatan larutan uji vitamin C ... 32
3.7.8 Pembuatan persen peredaman ... 32
3.7.9 Penentuan nilai IC50 ... 33
BAB IV HASIL DAN PEMBAHASAN ... 34
BAB V KESIMPULAN DAN SARAN ... 46
4.1 Kesimpulan ... 46
4.2 Saran ... 46
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
Tabel Halaman
2.1 Kandungan kimia selada air ... 8
4.1 Hasil pemeriksaan karakteristik simplisia selada air ... 35
4.2 Hasil pemeriksaan skrining fitokimia simplisia dan ekstrak selada air ... 36
4.3 Hasil analisis peredaman radikal bebas oleh ekstrak selada air dan vitamin C ... 42
4.4 Nilai IC50 ekstrak selada air dan vitamin C ... 43
4.5 Kategori Nilai IC50 sebagai antioksidan ... 43
DAFTAR GAMBAR
Gambar Halaman
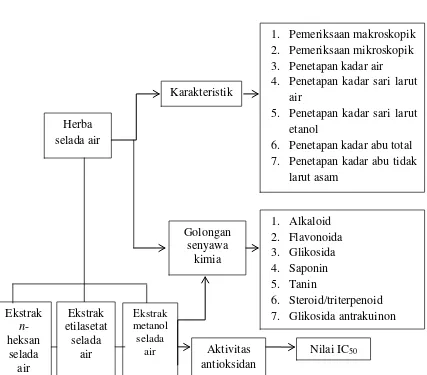
1.1 Kerangka pikir penelitian ... 5
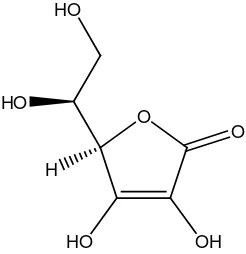
2.1 Rumus bangun vitamin C ... 14
2.2 Rumus bangun beta-karoten ... 15
2.3 Rumus bangun alfa tokoferol ... 16
2.4 Rumus bangun DPPH ... 18
2.5 Reaksi antara DPPH dengan atom H dari antioksidan ... 19
4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometeri visibel ... 38
4.2 Hasil analisis akivitas antioksidan ekstrak n-heksan herba selada air pada menit ke-60 ... 39
4.3 Hasil analisis aktivitas antioksidan ekstrak etilasetat herba selada air pada menit ke- 60 ... 39
4.4 Hasil analisis aktivitas antioksidan ekstrak metanol herba selada air pada menit ke- 60 ... 40
DAFTAR LAMPIRAN
Lampiran Halaman
1 Surat hasil identifikasi sampel ... 50
2 Makroskopik tumbuhan selada air ... 51
3 Makroskopik simplisia selada air ... 52
4 Gambar serbuk simplisia selada air ... 53
5 Hasil pemeriksaan mikroskopik serbuk simplisia selada air ... 54
6 Bagan kerja pembuatan simplisia ... 55
7 Bagan kerja pembuatan ekstrak selada air dengan cara perkolasi bertahap ... 56
8 Gambar alat spektrofotometer UV-Visibel (Shimadzu UV-1800 Series) ... 57
9 Perhitungan pemeriksaan karakterisasi simplisia selada air ... 58
10 Perhitungan aktivitas antioksidan ekstrak selada air dan vitamin C ... 62
11 Hasil analisa statistik aktivitas antioksidan ekstrak selada air dan vitamin C ... 78
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK n-HEKSAN
ETILASETAT DAN METANOL SELADA AIR (Nasturtium officinale W.T.Aiton)
ABSTRAK
Selada air (Nasturtium officinale W.T.Aiton) adalah tumbuhan tahunan dari suku Brassicaceae. Tumbuhan ini sangat mudah tumbuh dan sering dijumpai di aliran sungai kecil, kolam, rawa dan danau yang dangkal. Selada air selain sebagai sayuran juga memiliki khasiat dalam pengobatan yakni sebagai antikanker, antidiabetes, antialergi, dan obat tuberculosis. Tujuan penelitian ini untuk mengetahui karakteristik simplisia, skrining fitokimia simplisia, ekstrak n-heksan, ekstrak etilasetat dan ekstrak metanol selada air serta menguji aktivitas antioksidan dari ketiga ekstrak tersebut.
Karakterisasi simplisia selada air meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total dan kadar abu tidak larut asam. Ekstrak selada air diperoleh secara perkolasi bertahap dengan menggunakan pelarut n-heksan, etilasetat dan metanol. Pengujian aktivitas antioksidan ekstrak selada air menggunakan metode pemerangkapan radikal bebas DPPH( 1,1-diphenyl-2-picrylhydrazyl) dan vitamin C sebagai pembanding. Data diolah menggunakan persamaan regresi untuk memperoleh nilai IC50 (Inhibitory Concentration).
Hasil karakterisasi simplisia diperoleh kadar air 3,98%; kadar sari larut dalam air 40,27%; kadar sari larut dalam etanol 17,09%; kadar abu total 12,46% dan kadar abu tidak larut dalam asam 2,16%. Hasil skrining fitokimia pada ekstrak n-heksan hanya terdapat steroid/tritepenoid, pada simplisia dan ekstrak etilasetat menunjukkan adanya senyawa flavonoida, glikosida dan steroid/tritepenoid, dan pada ekstrak metanol terdapat glikosida dan flavonoid. Hasil pengujian menunjukkan ekstrak n-heksan, etilasetat dan metanol selada air memiliki aktivitas antioksidan yang sangat lemah dengan nilai IC50
berturut-turut sebesar 712,81 ppm, 405,01 ppm dan 273,14 ppm.
CHARACTERIZATION OF SIMPLEX AND PHYTHOCHEMICAL SCREENING AND ANTIOXIDANT ACTIVITY OF n-HEXANE
ETHYLACETATE AND METHANOL EXTRACT OF WATERCRESS (Nasturtium officinale W.T.Aiton)
ABSTRACT
Watercress (Nasturtium officinale W.T.Aiton) is a annual plant from Brassicaceae family. It is easily grown and often grows wildly at small river, pond, swamp and swallow lake. It is not only consumed as vegetable but also used as anticancer, antidiabetes, antiallergy, and tuberculosis drug. The objective of this research are to determine characteristic of simplex, phythochemical content in simplex, n-hexane, ethylacetate and methanol extract of watercress and also to test the antioxidant activity of these extracts.
Characterization of watercress simplex included macroscopic and microscopic examination, determination of water content, water-soluble extract content, ethanol-soluble extract content, total ash content and acid-insoluble ash content. Watercress extracts were made by continuous percolation using n -hexane, ethylacetate and methanol as the solvent. Antioxidant activity of watercress extracts were tested with free radical scavenging DPPH ( 1,1-diphenyl-2-picrylhydrazyl) method compared to vitamin C. The data were analyzed using regression equation to obtain IC50 (Inhibitory Concentration)
value.
The characterization results showed water content 3.98%; water-soluble extract content 40.27%; ethanol-soluble extract content 17.09%; total ash content 12.46% and acid-insoluble ash content 2.16%. The phythochemical screening of n-hexane extract showed the presence of steroids/triterpenoids, simplex and ethylacetate extract showed the presence of flavonoids, glycosides and steroids/triterpenoids and methanol extract showed the presence of glycosides and flavonoids. The test results showed n-hexane, ethylacetate and methanol extract of watercress possessed weak antioxidant activity with IC50
value were 712.81 ppm; 405.01 ppm and 273.14 ppm, respectively.
BAB I PENDAHULUAN
1.1 Latar Belakang
Selada air (Nasturtium officinale W.T.Aiton) adalah tumbuhan
tahunan dari famili Brasicaceae. Selada air sangat mudah tumbuh dan sering
dijumpai di aliran sungai kecil, kolam, rawa dan danau yang dangkal (Smith,
2002). Tumbuhan ini kaya akan kandungan vitamin C (62 mg/100 g porsi),
vitamin A (420 µg/100 g porsi (dikonversi dari kandungan β-karoten)), vitamin
E (1,46 mg/100 g porsi), vitamin K (250 µg/100 g porsi) (Costain, 2007), asam
folat, iodin, besi, protein dan kalsium (Gonçalves et.al., 2009). Menurut
penelitian Cartea et.al. (2011), selada air mengandung senyawa flavonoid
golongan flavonol yakni kuersetin dan kaempferol. Beberapa vitamin dan
senyawa flavonoid ini dapat berperan sebagai antioksidan.
Beberapa hasil penelitian menunjukkan bahwa selada air memiliki
kemampuan sebagai antialergi (Lingga, 2012), antidiabetes (Hoseini et.al.,
2009) dan pengobatan tuberculosis (Corona et.al., 2008). Sayuran ini juga
telah diuji aktivitas antikankernya yakni untuk kanker kolon dengan
menggunakan jus selada air dengan konsentrasi paling efektif 50 µl/ml
terhadap kerusakan DNA pada sel HT29 (Boyd et.al., 2006). Daun selada air
telah diteliti aktivitas antioksidannya terhadap ekstrak etanol dan air oleh Özen
(2009) dengan metode pemerangkapan radikal bebas DPPH dengan hasil
500 mg/ml dan penelitian antioksidan dari ekstrak etanol selada air utuh dan
bagian-bagiannya dilakukan oleh Salamah dkk. (2011) dengan metode
pemerangkapan DPPH dengan hasil IC50 untuk ekstrak etanol daun, batang dan
utuh berturut-turut 331,39 ppm, 439,10 ppm dan 337,32 ppm.
Metode pengujian aktivitas antioksidan secara in vitro yang umum
digunakan adalah metode ABTS (2,2’ Azino bis(3-ethylbenzthiazoline-6
sulfonic acid)), metode pemerangkapan radikal bebas DPPH(
1,1-diphenyl-2-picrylhydrazyl), metode reduksi FRAP (ferric reducing antioxidant power)
(Baradinath et.al., 2010; Rosidah et.al., 2008), metode CUPRAC (cupric ion
reducing antioxidant activity) (Baradinath et.al., 2010) dan metode bleaching
β-karoten-asam linoleat (Rosidah et.al., 2008)
Penelitian ini menggunakan metode pemerangkapan radikal bebas
DPPH untuk pengujian antioksidan karena metode ini dikenal lebih cepat,
praktis, akurat dan murah. Metode ini umum digunakan untuk mengukur
kemampuan senyawa yang berperan sebagai peredam radikal bebas atau
pendonor hidrogen, dan mengevaluasi aktivitas antioksidan dari makanan.
Metode DPPH juga dapat digunakan untuk sampel berwujud padat dan cair
serta tidak spesifik terhadap komponen antioksidan tertentu (Prakash, 2001).
Berdasarkan uraian di atas, penulis melakukan penelitian tentang
karakterisasi simplisia, skrining fitokimia dan uji aktivitas antioksidan dari
ekstrak n-heksan, ekstrak etilasetat dan ekstrak metanol selada air dengan
1.2 Perumusan Masalah
a. Apakah hasil karakterisasi simplisia selada air memenuhi persyaratan
Materia Medika Indonesia (MMI)?
b. Golongan senyawa kimia apakah yang terkandung pada simplisia dan
ekstrak n-heksan, etilasetat dan metanol selada air?
c. Apakah ekstrak n-heksan, ekstrak etilasetat dan ekstrak metanol selada
air memiliki aktivitas antioksidan?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis dari penelitian ini
adalah:
a. Hasil karakterisasi simplisia selada air memenuhi persyaratan Materia
Medika Indonesia (MMI).
b. Golongan senyawa kimia yang terkandung dalam ekstrak n-heksan
adalah steroid/triterpenoid, dalam simplisia dan ekstrak etilasetat adalah
glikosida, flavonoid, dan steroid/triterpenoid dan dalam ekstrak metanol
mengandung glikosida dan flavonoida.
c. Ekstrak n-heksan, ekstrak etilasetat dan ekstrak metanol selada air
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah:
a. Untuk membandingkan karakteristik simplisia selada air dengan hasil
yang ditetapkan dalam MMI.
b. Untuk mengetahui kandungan metabolit sekunder pada simplisia,
ekstrak n-heksan, etilasetat dan metanol selada air
c. Untuk mengetahui daya antioksidan dari ekstrak n-heksan, etilasetat
dan metanol selada air.
1.5 Manfaat
Manfaat dari penelitian ini adalah dapat memberikan informasi
golongan senyawa kimia yang terkandung dalam selada air dan informasi
1.6Kerangka Pikir Penelitian
Gambar 1.1 Kerangka pikir penelitian
Karakteristik
Variabel bebas Variabel terikat Parameter
1. Pemeriksaan makroskopik 2. Pemeriksaan mikroskopik 3. Penetapan kadar air
4. Penetapan kadar sari larut air
5. Penetapan kadar sari larut etanol
6. Penetapan kadar abu total 7. Penetapan kadar abu tidak
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi daerah tumbuh sistematika tumbuhan,
sinonim tumbuhan, nama daerah, nama asing, morfologi tumbuhan, kandungan
kimia dan kegunaan dari tumbuhan.
2.1.1 Sistematika tumbuhan
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledoneae
Bangsa : Dialypetalae
Suku : Cruciferae
Marga : Nasturtium
Jenis : Nasturtium officinale W.T.Aiton
(Bell, 1965)
2.1.2 Sinonim tumbuhan
Sinonim Rorippa nasturtium-aquaticum (Linn.) Hayek. (Khare, 2007).
2.1.3 Nama daerah
Indonesia: Selada air
2.1.4 Nama asing
Watercress (Inggris) (Khare, 2007), sai yeung ts’oi (china) (Herklots,
1972).
2.1.8 Kegunaan
Selada air memiliki aktivitas antibiotik, antitumor dan diuretik. Efek
diuretik kemungkinan disebabkan oleh kandungan minyak mustard. Sebagai
obat, selada air meningkatkan selera makan dan pencernaan. Selada air
digunakan untuk mengobati iritasi dari saluran urin efferen (Gruenwald dkk.,
2000). Penelitian Özen (2009), menunjukkan aktivitas ekstrak selada air dapat
melawan dan mengurangi peroksidasi lipid pada hati, otak dan ginjal. Selada
air juga telah diteliti aktivitasnya sebagai antidiabetes (Hoseini dkk., 2009),
antikanker yakni kanker kolon (Boyd dkk., 2006) dan obat tuberculosis
(Corona dkk., 2008).
2.2 Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia
dari jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya
bahan-bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat
kehalusan tertentu (Harborne, 1987).
Menurut Depkes RI (2000), beberapa metode ekstraksi yang sering
digunakan dalam berbagai penelitian antara lain yaitu:
a.Cara Dingin
1.Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
Maserasi yang dilakukan pengadukan secara terus-menerus disebut maserasi
dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut
remaserasi.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang
selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada
temperatur kamar. Proses perkolasi terdiri dari tahap pelembaban bahan, tahap
perendaman antara dan tahap perkolasi sebenarnya (penetesan/penampungan
ekstrak).
b. Cara Panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan pemanasan
menggunakan alat pada temperatur titik didihnya, selama waktu tertentu dan
jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2.Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pda
temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-50ºC.
3.Sokletasi
Sokletasi adalah proses penyarian berulang-ulang dengan pelarut
tertentu yang mudah menguap, dilakukan dengan menggunakan alat soklet
sehingga menjadi ekstraksi kontinu dengan pelarut relatif konstan dengan
4.Infus
Infus adalah proses penyarian dengan pemanasan menggunakan
pelarut air pada temperatur 90ºC selama 15 menit.
5.Dekok
Dekok adalah proses penyarian dengan pemanasan menggunakan
pelarut air pada temperatur 90ºC selama 30 menit.
2.3 Radikal Bebas
Radikal bebas bersifat reaktif karena mengandung atom dengan
jumlah elektron ganjil pada ruang valensinya (Mc Murry, 2008). Radikal bebas
sering dihubungkan dengan reaksi berantai. Berikut reaksi berantai yang
dimaksud.
1.Inisiasi: X–Y X· + Y·
2.Propagasi: X·+ H–R X– R + H· diulang sebanyak n kali H· + X–Y H–Y+ X·
3.Terminasi: 2 R· R–R 2 X· X–X
Keterangan: X·, Y·, R· dan H· adalah atom radikal bebas
n adalah jumlah rantai reaksi dalam fase propagasi
Reaksi berantai radikal bebas dimulai dengan fase inisiasi dimana
sebuah molekul terurai menjadi masing-masing dua atom radikal bebas.
Kemudian atom radikal bebas masuk ke fase propagasi. Fase propagasi adalah
fase produksi radikal bebas baru secara terus menerus maka dalam reaksi di
sebanyak n kali. Panjangnya rantai reaksi merupakan karakteristik dari reaksi
radikal bebas. Panjangnya rantai reaksi menentukan urutan fase propagasi yang
terjadi tiap reaksi. Fase terminasi terjadi saat dua atom radikal bebas bertemu
dan membentuk suatu molekul (Carey dkk., 2007).
2.4 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang
dapat memberikan elektronnya kepada molekul radikal bebas dan dapat
memutus reaksi berantai dari radikal bebas (Kumalaningsih, 2006).
Menurut Kosasih (2004), dari asal terbentuknya antioksidan
dibedakan menjadi dua yakni intraseluler (di dalam sel/endogen) dan
ekstraseluler (di luar sel/eksogen) ataupun dari makanan. Berdasarkan
fungsinya antioksidan dikelompokkan 3 yakni:
a. Primary antioxidants (Antioksidan utama/Antioksidan primer)
Antioksidan primer bekerja untuk mencegah terbentuknya senyawa
radikal bebas baru. Ia mengubah radikal bebas yang ada menjadi molekul yang
berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi.
Contohnya adalah SOD (Superoxide Dismutase), GPx (Gluthathion
Peroxidase), Metalbinding protein seperti Ferritin atau Ceruloplasmin.
b.Secondary antioxidants (Antioksidan kedua/Antioksidan sekunder)
Antioksidan ini berfungsi menangkap senyawa radikal bebas serta
mencegah terjadinya reaksi berantai. Contoh antioksidan sekunder: vitamin E,
vitamin C, β-karoten, asam urat, bilirubin dan albumin.
Antioksidan jenis ini memperbaiki kerusakan sel-sel dan jaringan
yang disebabkan radikal bebas. Contoh enzim yang memperbaiki DNA pada
inti sel adalah metionin sulfoksidan reduktase. Adanya enzim-enzim perbaikan
DNA ini berguna untuk mencegah penyakit misalnya kanker.
2.4.1Antioksidan alami
Hasil penelitian ilmiah menunjukkan bahwa buah-buahan, sayuran
dan biji-bijian adalah sumber antioksidan yang baik dan bisa meredam reaksi
berantai radikal bebas dalam tubuh, yang pada akhirnya dapat menekan proses
penuaan dini (Kosasih, 2004).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa
fenolik atau polifenolik yang dapat berupa golongan senyawa flavonoid,
turunan asam sinamat, kumarin, tokoferol dan asam-asam organik. Senyawa
antioksidan alami polifenolik dapat bereaksi sebagai pereduksi, penangkap
radikal bebas, pengkelat logam, dan peredam terbentuknya singlet oksigen
(Kumalaningsih, 2006). Beberapa senyawa, seperti galat, memiliki aktivitas
antioksidan yang tinggi sedangkan senyawa lain seperti mono-fenol termasuk
antioksidan lemah (Prakash, 2001).
2.4.2 Vitamin C
Vitamin C (nama kimia: asam askorbat dan askorbat) adalah senyawa
dengan 6 karbon lakton yang disintesa dari glukosa oleh banyak binatang
(FAO, 2001). Vitamin C adalah antioksidan larut air yang telah diketahui
sebagai mikronutrien penting sejak tahun 1700-an (Shekelle, 2003). Vitamin C
disintesa dalam hati pada sebagian hewan mamal dan dalam ginjal pada burung
termasuk manusia. Manusia dan hewan primata kekurangan terminal enzim
dalam jalur biosintesa asam askorbat yakni enzim l-gulonolakton oksidase,
karena gen yang mengkodekan enzim tersebut mengalami mutasi sehingga
tidak ada protein yang terbentuk (FAO, 2001).
O
HO OH
O
H HO
HO
Gambar 2.1 Rumus bangun vitamin C
Struktur cincin pada vitamin C yang tidak simetris menyebabkan
vitamin C ada empat stereoisomer, tetapi asam L-askorbat adalah bentuk
aktifnya secara biologis. Bentuk L-askorbat mewakili pertahanan antioksidan
primer dalam darah, senyawa ini bereaksi dengan semua spesies oksigen, dan
menghentikan reaksi berantai radikal bebas. Vitamin C juga mempunyai
interaksi penting dengan sejumlah antioksidan lain. Glutation adalah senyawa
penting yang mendaur ulang vitamin C yang teroksidasi dan vitamin C sendiri
penting untuk regenerasi ikatan lemak vitamin E (Shekelle, 2003).
2.4.3 Beta-karoten
Kelompok senyawa yang dikenal karoten alami, senyawa provitamin
A dan karotenoid termasuk α-, β-, dan γ- karoten dan siproxantin yang
A. Jenis karoten dan karotenoid terdiri dari kristal merah tua, tidak larut dalam
air, asam dan basa tetapi sangat sensitif terhadap oksidasi (FAO, 2001).
Sejumlah pigmen karotenoid yang terdapat dalam tumbuhan
dioksidasi untuk menghasilkan retinol; β-karoten merupakan provitamin
karotenoid penting yang dihasilkan paling banyak (Bender, 2003).
Beta-karoten merupakan salah satu provitamin A. Pemberian vitamin A dalam dosis
tinggi dapat bersifat toksis. Akan tetapi, dalam jumlah banyak mampu
memenuhi kebutuhan vitamin A, dan selebihnya tetap sebagai beta-karoten
yang berfungsi sebagai antioksidan dengan cara kerja memperlambat fase
inisiasi. (Silalahi, 2006).
Gambar 2.2 Rumus bangun beta-karoten
Para ahli menyakini, makanan mengandung beta-kroten yang berasal
dari alam jauh lebih berkhasiat daripada yang sudah dikemas dalam suplemen.
Dengan mengkonsumsi 50 mg beta-karoten setiap hari dalam menu makanan
dapat jauh mengurangi resiko terkena penyakit jantung (Kosasih, 2004).
2.4.4 Vitamin E
Vitamin E pada dasarnya adalah vitamin larut lemak, yang ditemukan
pada tahun 1936 (Shekelle, 2003). Vitamin E dinamakan demikian ditujukan
pada kelompok dengan 8 (eight) senyawa homolog yang disintesa oleh
tumbuhan dari asam homogentisik. Semua bentuk senyawa merupakan turunan
reaksi sudah mencapai kesetimbangan. Kecepatan reaksi dipengaruhi oleh sifat
dalam struktur cincin. Keempat homolog tokoferol (d-α-, d-β-,d-γ- dan d-δ-)
memiliki 16 rantai cabang karbon phytyl jenuh, sementara tokotrienol (d-α-,
d-β-,d-γ- dan d-δ-) memiliki tiga ikatan rangkap pada rantai cabang. Terdapat
bentuk sinteik, dl-α-tokoferol, dibuat dengan menyatukan trimetilhidrokuinon
dan isophytol (FAO, 2001).
O
Gambar 2.3 Rumus bangun alfa tokoferol
Vitamin E adalah mikronutrien penting yang harus didapatkan dari
makanan. Makanan yang mengandung vitamin E diserap dalam usus kecil,
menjalani proses yang tergantung pada kemampuannya untuk mengubah lemak
menjadi misel dan membawanya melewati dinding sel intestinal (dimana
dibungkus dalam kilomikron untuk transportasi). Meskipun proses absorpsi
semua homolog tokoferol dalam makanan hampir sama, bentuk alfa (α-) lebih
menonjol di darah dan jaringan. Hal ini disebabkan aksi protein pengikat yang
secara khusus memilih bentuk alfa (α-) dibandingkan bentuk lain. Mekanisme
yang selektif ini menjelaskan alasan homolog vitamin E memiliki kemampuan
antioksidan yang berbeda dalam sistem biologis dan menggambarkan
perbedaan efektivitas senyawa antioksidan dalam stabilitas secara in vitro dan
2.5 Spektrofotometri UV-Visibel
Spektrofotometri serap adalah pengukuran serapan radiasi
elektromagnetik panjang gelombang tertentu yang sempit, mendekati
monokromatik, yang diserap zat. Pengukuran serapan dapat dilakukan pada
daerah ultraviolet (panjang gelombang 190 nm-380 nm) atau pada daerah
cahaya tampak (panjang gelombang 380 nm-780 nm) (Depkesa, 1979).
Alat spektrofotometer pada dasarnya terdiri dari sumber sinar
monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus dan
alat ukur atau pencatat (Depkesa, 1979).
Pengukuran spektrofotometri menggunakan alat spektrofotometer
yang melibatkan energi elektronik yang cukup besar pada molekul yang
dianalisis, sehingga spektrofotometer UV-Vis lebih banyak dipakai untuk
analisis kuantitatif dibandingkan kualitatif. Konsentrasi dari analit di dalam
larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang
tertentu dengan menggunakan hukum Lambert-Beer. Hukum Lambert-Beer
menyatakan hubungan linieritas antara absorban dengan konsentrasi larutan
analit dan berbanding terbalik dengan transmitan. (Rohman, 2007).
2.6 Metode Pemerangkapan Radikal Bebas DPPH
Metode yang cepat, praktis dan tidak mahal untuk mengukur kapasitas
antioksidan makanan melibatkan penggunaan radikal bebas
1,1-diphenyl-2-picrylhydrazyl (DPPH). DPPH banyak digunakan untuk menguji kemampuan
antioksidan makanan (Prakash, 2001). DPPH merupakan singkatan untuk
senyawa kimia 1,1-diphenyl-2-picrylhydrazil. DPPH berupa serbuk berwarna
ungu gelap yang terdiri dari molekul radikal bebas yang stabil. DPPH
mempunyai berat molekul 394,32 dengan rumus bangun C18H12N5O6.
Penyimpanannya dalam wadah tertutup baik pada suhu -20°C (Molyneux,
2003).
NO2
O2N
N N
NO2
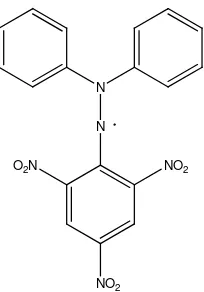
Gambar 2.4 Rumus bangun DPPH
Metode pemerangkapan radikal bebas DPPH dapat digunakan untuk
sampel padat atau cair dan tidak spesifik terhadap senyawa antioksidan tertentu,
tetapi diaplikasikan untuk kapasitas antioksidan total dalam sampel.
Pengukuran kapasitas total antioksidan membantu pemahaman tentang sifat
fungsional makanan (Prakash, 2001).
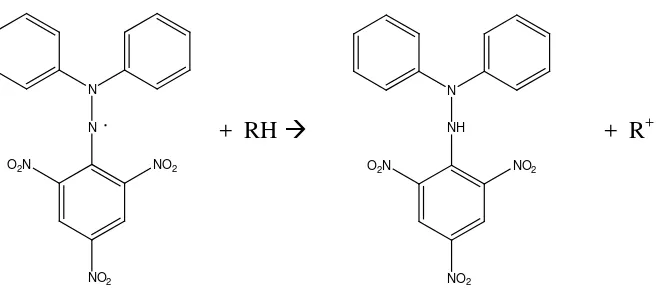
Larutan DPPH dicampur dengan zat yang dapat memberikan atom
hidrogen, maka akan menghasilkan bentuk yang tereduksi yakni
NO2
(1,1-diphenyl-2-picryl-hydrazyl) (1,1-diphenyl-2-picryl-hydrazyn)
Gambar 2.5 Reaksi antara DPPH dengan atom H dari antioksidan 2.6.1Pelarut
Metode ini dapat bekerja dengan baik dengan metanol atau etanol,
karena tidak ada di antara kedua pelarut tersebut yang mengganggu reaksi.
Penggunaan pelarut lain, seperti ekstrak dalam air atau aseton, memberikan
hasil yang lebih rendah dibandingkan dengan metanol atau etanol (Molyneux,
2003).
2.6.2Pengukuran panjang gelombang
Panjang gelombang maksimum yang dapat digunakan untuk
pengukuran dengan metode DPPH cukup beragam mulai dari 515 nm, 516 nm,
518 nm dan 520 nm. Namun, dalam prakteknya, panjang gelombang yang
digunakan ialah yang memberikan puncak maksimum (Molyneux, 2003).
2.6.3Waktu pengukuran
Waktu pengukuran menurut literatur yang direkomendasikan adalah
selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan
sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30 menit (Molyneux, 2003)
dan 60 menit (Rosidah et.al., 2008). Waktu reaksi yang tepat adalah ketika
BAB III
METODE PENELITIAN
Metode penelitian ini akan dilakukan secara eksperimental. Penelitian
meliputi pengumpulan bahan tumbuhan, karakterisasi simplisia, skrining
fitokimia, pembuatan ekstrak selada air serta pengujian aktivitas antioksidan
dengan metode DPPH menggunakan spektrofotometer visibel. Penelitian
dilakukan di Laboratorium Farmakognosi dan Laboratorium Penelitian,
Fakultas Farmasi, Universitas Sumatera Utara.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan terdiri dari: alat-alat gelas laboratorium,
seperangkat alat penetapan kadar air, spektrofotometer UV/Vis (Hitachi
U-2900), rotary evaporator (Stuart), oven (Dynamica), mikroskop (Olympus),
krus porselin, tanur (Nabertherm), neraca analitis (Vibra), penangas air,
desikator, neraca kasar (Ohaus), kaca objek , gelas penutup, lemari pengering,
pisau dan krus tang.
3.1.2 Bahan
Bahan yang digunakan dalam penelitian adalah herba selada air, kertas
saring dan air suling. Bahan-bahan kimia yang lainnya adalah berkualitas pro
analisis produksi Sigma: 1,1-diphenyl-2-picrylhydrazyl (DPPH); produksi
E-Merck: metanol, toluen, raksa (II) klorida, kalium iodida, bismuth(III) nitrat,
timbal (II) asetat, kloralhidrat, kloroform, isopropanol, benzen, asam asetat
anhidrat, natrium hidroksida dan amil alkohol. Bahan kimia berkualitas teknis:
metanol, etilasetat dan n-heksan.
3.2 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengambilan, identifikasi dan
pengolahan bahan tumbuhan.
3.2.1 Pengambilan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa
membandingkan dengan daerah lain. Bahan tumbuhan yang digunakan adalah
selada air segar berwarna hijau yang diambil dari Pusat Pasar, Jalan Sutomo,
Kelurahan Pusat Pasar, Kecamatan Medan Kota, Medan. Sumatera Utara.
3.2.2 Identifikasi bahan tumbuhan
Identifikasi selada air dilakukan di Herbarium Bogoriense, Bidang
Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Hasil identifikasi dapat dilihat pada Lampiran 1, halaman 50. Gambar
tumbuhan dapat dilihat pada Lampiran 2, halaman 51.
3.2.3 Pengeringan bahan tumbuhan
Selada air yang dibeli di pasar berupa herba dicuci bersih di bawah air
mengalir, ditiriskan, lalu ditimbang sebagai berat basah (6,13 kg). Sampel
kemudian dikeringkan di lemari pengering hingga kering, dimana jika simplisia
tersebut diremas akan hancur, kemudian ditimbang sebagai berat kering (302
3.3 Pembuatan Pereaksi 3.3.1 Besi (III) klorida 1%b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai
100 ml (Depkes, 1995).
3.3.2 Larutan asam klorida 2N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling
sampai 100 ml (Depkes, 1995).
3.3.3 Timbal (II) asetat 0,4 M
Timbal (II) asetat sebanyak 15,7 g dilarutkan dalam air suling bebas
CO2 hingga 100 ml (Depkes, 1995).
3.3.4 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida, kemudian dilarutkan dalam air suling
hingga 60 ml. Pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu
dilarutkan dalam air suling. Kedua larutan dicampurkan dan ditambahkan air
suling hingga diperoleh larutan 100 ml (Depkes, 1995).
3.3.5 Pereaksi Mollish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga
100 ml (Depkes, 1995).
3.3.6 Pereaksi Dragendorff
Sebanyak 0,8 g bismuth nitrat dilarutkan dalam asam nitrat pekat 20 ml
kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam
50 ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan
jernih diambil dan diencerkan dengan air suling secukupnya hingga 100 ml
3.3.7 Larutan kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20
ml air suling (Depkes, 1995).
3.3.8 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga
diperoleh 100 ml.
3.3.9 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya
kemudian ditambahkan 2 g iodida sedikit demi sedikit lalu dicukupkan dengan
air suling (Depkes, 1995).
3.3.10 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrat dengan 5 ml asam
sulfat pekat tambahkan etanol hingga 50 ml (Merck, 1978).
3.3.11 Larutan pereaksi DPPH 0,5mM (konsentrasi 200 ppm)
Sebanyak 19,7 mg DPPH ditimbang, kemudian dilarutkan dalam
metanol hingga volume 100 ml.
3.4 Pemeriksaan Karakteristik Simplisia 3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar
dari simplisia selada air.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia selada
larutan kloralhidrat dan ditutup dengan kaca penutup (deck glass), kemudian
diamati di bawah mikroskop. Hasil pemeriksaan mikroskopik dapat dlihat pada
Lampiran 5, halaman 54.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi
toluen) (WHO, 1998). Alat terdiri dari labu alas bulat 500 ml, alat penampung,
pendingin, tabung penyambung dan tabung penerima.
Cara kerja:
Dimasukkan 200 ml toluena dan 2 ml air suling ke dalam labu alas
bulat, lalu didestilasi selama 2 jam. Setelah itu, toluena dibiarkan mendingin
selama 30 menit, dan dibaca volume air pada tabung penerima dengan
ketelitian 0,05 ml. Kemudian ke dalam labu tersebut dimasukkan 5 g serbuk
simplisia yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15
menit. Setelah toluena mendidih, kecepatan tetesan diatur lebih kurang 2 tetes
tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan
dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam
pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit,
kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air
dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml.
Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang
terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen.
3.4.4 Penetapan kadar sari larut air
Penetapan kadar sari larut air dilakukan dengan metode gravimetri
dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam
air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama
6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring.
Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap
yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu
105ºC sampai bobot tetap. Kadar sari larut air dihitung dalam persen.
3.4.5 Penetapan kadar sari larut etanol
Penetapan kadar sari larut etanol dilakukan dengan metode gravimetri
menurut Depkes (1995). Prosedurnya adalah sebanyak 5 g serbuk simplisia
dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat
sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18
jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah
20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata
yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105ºC sampai
bobot tetap. Kadar sari larut etanol dihitung dalam persen.
3.4.6 Penetapan kadar abu total
Penetapan kadar abu total dilakukan dengan metode gravimetri menurut
Depkes (1995). Prosedurnya adalah sebanyak 2 g serbuk yang telah digerus
dan ditimbang seksama dimasukan dalam krus porselin yang telah dipijar dan
ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis,
pemijaran dilakukan pada suhu 600ºC selama 3 jam kemudian didinginkan dan
ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung dalam persen.
Penetapan kadar abu tidak larut asam dilakukan dengan metode
gravimetri menurut Depkes (1995). Prosedurnya adalah abu yang diperoleh
dalam penetapan kadar abu total dididihkan dalam 25 ml asam klorida encer
selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring
melalui kertas saring bebas abu lalu dipijar sampai bobot tetap, kemudian
didinginkan dan ditimbang. Kadar abu tidak larut dalam asam dihitung dalam
persen.
3.5 Skrining Fitokimia
Skrining fitokimia dilakukan untuk mengetahui golongan senyawa
alkaloida, flavonoida, glikosida, glikosida antrakinon, saponin, tanin, dan
steroida/triterpenoida.
3.5.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji
alkaloida: diambil tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi:
1. Ditambahkan 2 tetes pereaksi Mayer
2. Ditambahkan 2 tetes pereaksi Bouchardat
3. Ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan pada paling
3.5.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml
filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2
ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika
terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol
(Farnsworth, 1966).
3.5.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml
campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks
selama 2 jam, didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25
ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit
lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform
(2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan
pada temperatur tidak lebih dari 50ºC. Sisanya dilarutkan dalam 2 ml metanol.
Larutan sisa digunakan untuk percobaan berikut: 0,1 ml larutan percobaan
dimasukkan dalam tabung reaksi dan diuapkan di atas penangas air. Pada sisa
ditambahkan 2 ml air dan 5 tetes pereaksi Mollish. Kemudian secara
perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung,
terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan
3.5.4 Pemeriksaan glikosida antrakinon
Serbuk simplisia ditimbang sebanyak 0,2 g, kemudian ditambahkan 5
ml asam sulfat 2 N, dipanaskan sebentar setelah dingin ditambahkan 10 ml
benzen, dikocok dan didiamkan. Lapisan benzen dipisahkan dan disaring,
dikocok lapisan benzen dengan 2 ml NaOH 2 N, didiamkan. Lapisan air
berwarna merah dan lapisan benzen tidak berwarna menunjukan adanya
antrakinon (Depkes, 1978).
3.5.5 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam
tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan kemudian
dikocok kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang
stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes
asam klorida 2 N menunjukkan adanya saponin (Depkes, 1978).
3.5.6 Pemeriksaan tanin
Serbuk simplisia ditimbang sebanyak 1 g, dididihkan selama 3 menit
dalam 100 ml air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan
1-2 tetes pereaksi besi (III) klorida 1%b/v. Jika terjadi warna biru kehitaman
atau hijau kehitaman menunjukkan adanya tanin (Depkes, 1978).
3.5.7 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan
selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa
ditambahkan beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna
biru atau biru hijau menunjukkan adanya steroid, sedangkan warna merah,
3.6 Pembuatan Ekstrak Selada Air (ESA)
Pembuatan ekstrak selada air dilakukan secara perkolasi bertahap.
Sebanyak 200 g serbuk simplisia dibasahi dengan n-heksan dan dibiarkan
selama 3 jam. Kemudian dimasukkan ke dalam alat perkolator, lalu dituang
cairan penyari n-heksan sampai semua simplisia terendam dan terdapat selapis
cairan penyari di atasnya, bagian atas tabung perkolator ditutup dengan
aluminium foil dan dibiarkan selama 24 jam, kemudian kran dibuka dan
dibiarkan tetesan ekstrak mengalir dengan kecepatan perkolat diatur 1 ml/menit,
perkolat ditampung. Perkolasi dihentikan pada saat 500 mg perkolat yang
ditampung kemudian diuapkan dan tidak meninggalkan sisa. Perkolat yang
diperoleh kemudian dipekatkan dengan alat rotary evaporator setelah itu
dikeringbekukan dengan freeze dryer pada suhu -40ºC. Ampas dikeringkan lalu
diekstraksi dengan menggunakan pelarut etilasetat dan metanol dengan
prosedur yang sama seperti di atas (Depkesb, 1979). Bagan kerja pembuatan
ekstrak dapat dilihat pada Lampiran 7, halaman 56.
3.7 Pengujian Kemampuan Antioksidan dengan Spektrofotometer Visibel 3.7.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi DPPH sebagai
radikal bebas dalam larutan metanol (sehingga terjadi peredaman warna ungu
DPPH) dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam
radikal bebas sebesar 50%) digunakan sebagai parameter untuk menentukan
3.7.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml,
kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya
dengan metanol sampai garis tanda (konsentrasi 40 ppm).
3.7.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur
serapannya pada panjang gelombang 400-800 nm. Gambar spektrofotometer
dapat dilihat pada Lampiran 8, halaman 57.
3.7.4 Pembuatan larutan induk ESA
Sebanyak 25 mg ekstrak ditimbang kemudian dilarutkan dalam labu
tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan metanol
sampai garis tanda (konsentrasi 1000 ppm).
3.7.5 Pembuatan larutan uji ESA
Larutan induk dipipet sebanyak 1 ml; 1,5 ml; 2 ml; 2,5 ml kemudian
dimasukkan ke dalam labu tentukur 25 ml (untuk mendapatkan konsentrasi 40
ppm, 60 ppm, 80 ppm, 100 ppm), kemudian dalam masing-masing labu
tentukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 ppm) lalu
volume dicukupkan dengan metanol sampai garis tanda, didiamkan di tempat
gelap, lalu diukur serapannya pada spektrofotometer pada panjang gelombang
515,5 nm.
3.7.6 Pembuatan larutan induk vitamin C
Sebanyak 25 mg serbuk vitamin C ditimbang, dimasukkan ke dalam
labu tentukur 50 ml dilarutkan dengan metanol lalu volumenya dicukupkan
3.7.7 Pembuatan larutan uji vitamin C
Larutan induk dipipet sebanyak 0,05 ml; 0,1 ml; 0,2 ml; 0,4 ml ke
dalam labu ukur 25 ml untuk mendapatkan konsentrasi larutan uji 1 ppm, 2
ppm, 4 ppm, 8 ppm, kedalam masing-masing labu ukur ditambahkan 5 ml
larutan DPPH 0,5 mM (konsentrasi 40 ppm) lalu volumenya dicukupkan
dengan metanol sampai garis tanda. Diamkan selama 60 menit, lalu diukur
serapannya menggunakan spektrofotometer UV-visibel.
3.7.8 Penentuan persen peredaman
Kemampuan antioksidan diukur sebagai penurunan serapan larutan
DPPH (peredaman warna ungu DPPH) akibat adanya penambahan larutan uji.
Nilai serapan larutan DPPH sebelum dan sesudah penambahan larutan uji
tersebut dihitung sebagai persen peredaman.
% Peredaman=A kontrol − A sampel
A kontrol x 100%
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
3.7.9 Penentuan nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel
uji (µg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu
meredam proses oksidasi sebesar 50%). Nilai 0% berarti tidak mempunyai
aktivitas antioksidan, sedangkan nilai 100% berarti peredaman total dan
pengujian perlu dilanjutkan dengan pengenceran larutan uji untuk melihat batas
konsentrasi aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan
nilai %peredaman (antioksidan) sebagai ordinatnya (sumbu Y). Hasil
perhitungan aktivitas antioksidan ESA dapat dilihat pada Lampiran 10,
halaman 62-77.
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat
kuat jika nilai IC50 kurang dari 50 µg/ml, kuat untuk IC50 bernilai 50-100 µg/ml,
sedang jika IC50 bernilai 100-150 µg/ml dan lemah jika IC50 bernilai 151-200
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi-LIPI Bogor menunjukkan bahwa
sampel herba selada air termasuk suku Brassiccaceae, jenis Nasturtium
officinale W.T. Aiton.
4.2 Hasil Karakterisasi Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia selada air adalah berdaun
majemuk gasal dengan warna hijau tua, anak daun berjumlah rata-rata 5 lembar,
anak daun di ujung umumnya berbentuk jorong melebar sampai bundar dan
pangkal berbentuk bundar. Panjang helaian daun di ujung 2,5 cm dan lebar 1,5
cm. Batang daun dan tangkai daun berwarna hijau muda dengan panjang
batang 48 cm.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik simplisia selada air menunjukkan
adanya stomata tipe anisositik, jaringan mesofil berupa bunga karang dan
berkas pembuluh dengan penebalan spiral.
4.2.3 Hasil pemeriksaan karakteristik simplisia
Hasil pemeriksaan karakteristik simplisia selada air terlihat pada
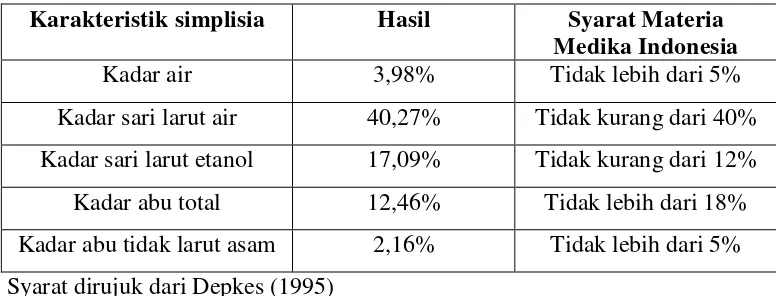
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia selada air
Karakteristik simplisia Hasil Syarat Materia Medika Indonesia
Kadar air 3,98% Tidak lebih dari 5%
Kadar sari larut air 40,27% Tidak kurang dari 40%
Kadar sari larut etanol 17,09% Tidak kurang dari 12%
Kadar abu total 12,46% Tidak lebih dari 18%
Kadar abu tidak larut asam 2,16% Tidak lebih dari 5% Syarat dirujuk dari Depkes (1995)
Penetapan kadar air menunjukkan jumlah air yang terkandung dalam
simplisia yang digunakan. Kadar air simplisia dilakukan untuk menjaga
kualitas simplisia karena kadar air mempunyai kaitan dengan kemungkinan
pertumbuhan jamur.
Kadar sari menunjukkan kandungan kimia terendah yang terdapat
dalam simplisia. Hasil kadar sari larut air lebih tinggi daripada kadar sari larut
etanol karena dalam air terkandung senyawa kimia metabolit primer dan
sekunder terutama glikosida.
Penetapan kadar abu total dilakukan untuk mengetahui kadar senyawa
anorganik dalam simplisia, seperti mineral kalsium, magnesium, natrium dan
kalium serta kadar cemaran logam berat seperti timbal, merkuri, dan kadmium
sedangkan tujuan penetapan kadar abu tidak larut asam untuk mengetahui
kadar zat anorganik yang tidak larut dalam asam, misalnya silikat. Semua hasil
karakterisasi memenuhi persyaratan MMI. Perhitungan hasil karakterisasi
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap simplisia, ekstrak selada air diketahui
bahwa selada air mengandung golongan senyawa-senyawa kimia seperti yang
terlihat pada Tabel 4.2 di bawah ini.
Tabel 4.2 Hasil pemeriksaan skrining fitokimia simplisia dan ekstrak selada air
No. Pemeriksaan Simplisia Ekstrak
n-heksan
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Pada Tabel 4.2 di atas menunjukkan bahwa simplisia memiliki
kandungan glikosida, flavonoida dan steroid/triterpenoid. Ekstrak n-heksan
hanya memiliki kandungan steroid/triterpenoid disebabkan oleh pelarut n
-heksan bersifat non-polar sehingga hanya dapat melarutkan senyawa metabolit
sekunder non-polar yakni steroid/triterpenoid. Ekstrak etilasetat memiliki
kandungan glikosida, flavonoida dan steroid/triterpenoid karena pelarut
etilasetat merupakan pelarut semi polar sehingga senyawa polar (glikosida dan
flavonoida) maupun nonpolar (steroid/triterpenoid) dapat larut. Ekstrak
metanol memiliki kandungan glikosida dan flavonoida karena pelarut metanol
dapat larut di dalamnya. Selada air memiliki potensi sebagai antioksidan yaitu
dengan adanya senyawa yang berpotensi sebagai antioksidan yakni flavonoida
(Prakash, 2001; Kumalaningsih, 2006). Senyawa tersebut bertindak sebagai
penangkap radikal karena gugus hidroksil yang terikat pada inti benzen
bertindak sebagai pendonor hidrogen terhadap radikal bebas (Silalahi, 2006).
4.4 Hasil Analisis Aktivitas Antioksidan Larutan Uji
Aktivitas antioksidan ekstrak n-heksan selada air (EHSA), ekstrak
etilasetat selada air (EESA), dan ekstrak metanol selada air (EMSA) diperoleh
dari hasil pengukuran absorbansi DPPH dengan adanya penambahan larutan uji
EHSA, EESA, dan EMSA.
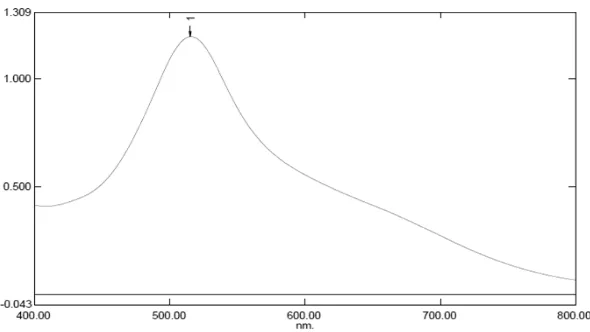
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
Hasil pengukuran serapan maksimum larutan DPPH 40 ppm dalam
metanol dengan menggunakan spektrofotometer UV-Vis. Hasil pengukuran
menunjukkan bahwa larutan DPPH dalam metanol menghasilkan serapan
maksimum sebesar 1,196 pada panjang gelombang 515,5 nm dan termasuk
dalam kisaran panjang gelombang sinar tampak (400-800 nm). Data hasil
Gambar 4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol
secara spektrofotometeri visibel.
4.5 Hasil Analisis Aktivitas Antioksidan
Aktivitas antioksidan ekstrak selada air diperoleh dari hasil pengukuran
absorbansi DPPH pada panjang gelombang 515,5 nm pada menit ke-60 dengan
adanya penambahan larutan uji dengan konsentrasi 50 ppm, 100 ppm, 200
ppm, 400 ppm yang dibandingkan dengan kontrol DPPH (tanpa penambahan
larutan uji). Untuk melihat hubungan absorbansi DPPH terhadap pertambahan
konsentrasi larutan uji dalam menganalisis aktivitas antioksidan dapat dilihat
Gambar 4.2 Hasil analisis aktivitas antioksidan ekstrak n-heksan selada air pada menit ke-60.
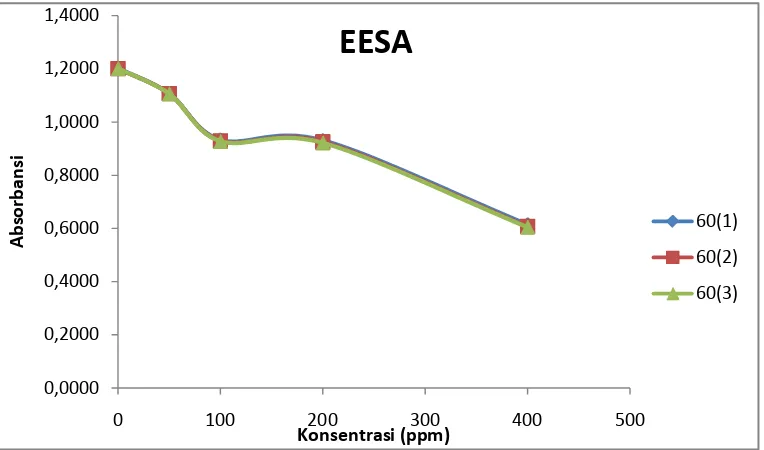
Gambar 4.3 Hasil analisis aktivitas antioksidan ekstrak etilasetat selada air
Gambar 4.4 Hasil analisis aktivitas antioksidan ekstrak metanol selada air
pada menit ke-60.
Pada gambar di atas, hasil analisis aktivitas antioksidan ekstrak
n-heksan, ekstrak etilasetat dan ekstrak metanol selada air dapat dilihat adanya
penurunan nilai absorbansi DPPH yang diberi larutan uji dibandingkan
terhadap kontrol pada setiap kenaikan konsentrasi.
Penurunan nilai absorbansi ini menunjukkan telah terjadi
pemerangkapan radikal bebas DPPH oleh larutan uji sehingga menunjukkan
adanya aktivitas antioksidan dari sampel. Interaksi antioksidan dengan DPPH
baik secara transfer elektron atau radikal hidrogen kepada DPPH, akan
menetralkan radikal bebas DPPH. Jika semua elektron pada radikal bebas
DPPH menjadi berpasangan, maka warna larutan berubah dari ungu tua
menjadi kuning terang dan absorbansi pada panjang gelombang maksimumnya
akan hilang. Perubahan ini dapat diukur secara stoikiometri sesuai dengan
jumlah elektron atau atom hidrogen yang ditangkap oleh molekul DPPH akibat
adanya zat antioksidan (Molyneux, 2003).
4.6 Hasil Analisis Peredaman Radikal Bebas DPPH oleh Sampel Uji
Kemampuan antioksidan diukur pada menit ke-60 sebagai penurunan
serapan larutan DPPH (peredaan warna ungu DPPH) akibat adanya
penambahan larutan uji. Nilai serapan larutan DPPH sebelum dan sesudah
penambahan larutan uji dihitung sebagai persen peredaman. Hasil analisis yang
telah dilakukan, diperoleh nilai persen peredaman pada setiap kenaikan
Tabel 4.3 Hasil analisis peredaman radikal bebas ekstrak selada air dan
Pada Tabel 4.3 di atas dapat dilihat bahwa semakin meningkat
konsentrasi larutan uji maka semakin meningkat aktivitas peredaman DPPH
karena semakin banyak DPPH yang berpasangan dengan atom hidrogen dari
ekstrak sehingga serapan DPPH menurun.
4.7 Analisis Nilai IC50 (Inhibitory Concentration) Sampel Uji
Nilai IC50 diperoleh berdasarkan persamaan regresi linier yang
DPPH sebagai parameter aktivitas antioksidan dimana konsentrasi larutan uji
(ppm) sebagai absis dan nilai persen peredaman sebagai ordinat. Hasil analisis
nilai IC50 yang diperoleh berdasarkan perhitungan persamaan regresi dapat
dilihat Tabel 4.4 di bawah ini:
Tabel 4.4 Nilai IC50 ekstrak selada air dan vitamin C
Sampel Nilai IC50
EHSA 712,81 ppm
EESA 405,01 ppm
EMSA 273,14 ppm
Vitamin C 3,97 ppm
Tabel 4.5 Kategori nilai IC50 sebagai antioksidan
No. Kategori Konsentrasi (ppm)
1. Sangat kuat <50
2. Kuat 50-100
3. Sedang 101-150
4. Lemah 151-200
Dikutip dari Mardawati dkk., 2008.
Menurut kategori kekuatan antioksidan pada Tabel 4.5 menunjukkan
bahwa ketiga ekstrak yakni ekstrak n-heksan, ekstrak etilasetat dan ekstrak
metanol selada air memiliki aktivitas antioksidan yang tergolong sangat lemah
sedangkan vitamin C memiliki aktivitas antioksidan yang tergolong sangat
kuat.
Hal ini disebabkan antioksidan yang terlarut dalam pelarut nonpolar (n
-heksan) seperti vitamin E dan vitamin A memiliki kandungan yang sangat
sedikit yakni 1,46 mg/100 g porsi dan 420 µg/100 g porsi (dikonversi dari
satuan betakaroten), demikian halnya dengan ekstrak etilasetat dan metanol
yang tergolong antioksidan sangat lemah disebabkan kandungan vitamin C
kuersetin dan kaemperol yang dari hasil skrining menunjukkan warna kuning
lemah (Costain, 2007).
Hasil penelitian ini didukung dengan penelitian menurut Salamah dkk.
(2011) yang menunjukkan ekstrak etanol daun, batang dan selada air utuh
memiliki antioksidan sangat lemah dengan nilai IC50 masing-masing sebesar
331,39 ppm, 439,10 ppm dan 337,32 ppm.
Data nilai IC50 dari ketiga ESA juga dianalisis secara statistik dengan
metode ANAVA lalu dilanjutkan uji Post Hoc Tukey HSD untuk melihat
perbedaan nyata dari setiap sampel.
Hasil analisa statisitik antara EHSA, EESA, EMSA dan vitamin C
diperoleh nilai signifikansi (0,000). Nilai signifikansi yang lebih kecil dari 0,05
menunjukkan adanya perbedaan aktivitas antioksidan yang signifikan antara
EHSA, EESA, EMSA dan vitamin C. Tabel hasil analisa statistik dengan
metode ANAVA dapat dilihat pada Lampiran 11, halaman 78. Perbedaan
antara aktivitas antioksidan ini ditunjukkan secara nyata dengan analisis Tukey
HSD pada Tabel 4.6 di bawah ini.
Tabel 4.6 Hasil analisis secara Tukey HSD
Sampel (I) Sampel (J) Signifikansi
Berdasarkan Tabel 4.6 di atas dapat dilihat bahwa adanya perbedaan
yang signifikan antara EHSA dengan EESA, EMSA dan vitamin C; EESA
dengan EHSA, EMSA dan vitamin C; EMSA dengan EHSA, EESA dan
vitamin C serta vitamin C dengan EHSA, EESA dan EMSA. Perbedaan ini
ditunjukkan dengan nilai signifikansi (0.000). Hasil analisa statistik aktivitas
antioksidan dengan uji Post Hoc Tukey HSD dapat dilihat pada Lampiran 12,
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Hasil karakterisasi simplisia selada air yakni untuk kadar air 3,98%; kadar
sari larut air 40,27%; kadar sari larut etanol 17,09%; kadar abu total 12,46%
dan kadar abu tidak larut asam 2,16% Hasil ini memenuhi persayaratan
Materia Medika Indonesia.
b. Kandungan metabolit sekunder pada ekstrak n-heksan mengandung
steroid/triterpenoid, pada simplisia dan ekstrak etilasetat selada air
mengandung glikosida, flavonoida, dan steroid/triterpenoid sedangkan pada
ekstrak metanol mengandung glikosida dan flavonoida.
c. Ekstrak n-heksan, etilasetat dan metanol selada air memiliki aktivitas
antioksidan yang sangat lemah dengan nilai IC50 berturut-turut sebesar
712,81 ppm; 405,01 ppm dan 273,14 ppm.
5.2 Saran
Pada penelitian selanjutnya dapat dilakukan isolasi senyawa yang
berperan sebagai antioksidan pada selada air serta penetapan kadar senyawa