PENYEDIAAN TANAMAN HAPLOID ATAU HAPLOID GANDA
PADA ANTHURIUM
BUDI WINARTO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Androgenesis: Upaya Terobosan untuk Penyediaan Tanaman Haploid atau Haploid Ganda pada Anturium adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pusaka di bagian akhir disertasi ini
Bogor, September 2009
© Hak Cipta milik IPB tahun 2009 Hak Cipta dilindungi oleh Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
BUDI WINARTO. Androgenesis: A Breakthrough Effort for Preparing Haploid or Double-haploid Plants in Anthurium. Under supervisory committee of NURHAYATI A. MATTJIK, AGUS PURWITO and BUDI MARWOTO.
Androgenesis via anther or microspore culture is one of important technological breakthrough in producing plant homozygous lines. Conventionally, producing the plants is laborious and time consuming. More or less 219 haploid technology protocols for 33 species were established. Ninety percent (90%) of them was established via anther culture and 8% through microspore culture. Anthuriums are bisexual and protogynous, with the spadix first producing a female phase followed by, after about a month, a male phase. This prevents and reduces self-pollination frequency of the flowers and causes cross-self-pollination in high frequency for the plants. Therefore establishment of anther culture method for producing the homozygous lines in Anthurium is important tool in strengthening Anthurium agribusiness in Indonesia in accordance with producing high qualified new hybrids and seeds. The aim of the study was to establish anther or microspore culture for producing haploid or double haploid plants. Spadix of Anthurium andreanum
Linden ex André c.v. Tropical, callus, shoot, root and acclimatized plants derived from the method were utilized in the study. The study involves plant donor selection, explant donor evaluation, study of callus formation, regeneration of callus, plantlet preparation and chromosome doubling, and evaluation of regenerants derived from anther culture of Anthurium. Factorial experiments were arranged by completely randomized design (CRD) and randomized complete block design (RCBD) with four replications. Regression and correlation analysis were also applied in a part of the study. Results of the study showed that MWR-3 optimized by increasing sucrose concentration from 30 to 60 g/l and supplemented with 30 g/l glucose was the most suitable basic medium in callus formation. Half- anther cultured in adaxial-side down position without treatment was the most appropriate isolation technique in anther culture of anthurium. Callus produced in anther was originated from anther wall cells. MWR supplemented with 1.0 mg/l 2,4-D and 0.5 mg/l TDZ was the appropriate medium for callus regeneration. High shoot regeneration for slow growth and haploid callus was established in MRM-6. High-qualified plantlets were etablished on MP-7 and MPH-1. Root tip and root cultured in medium containing 1% activated carchoal were suitable explant and root type for
in vitro chromosome staining. Ploidy ratio of regenerants derived from anther culture of anthurium was about 22.5-33.9% haploid, 60.4-75% diploid, and 2.3-5.7% triploid. Colchicine of 0.05% for 10 days of application time was the most appropriate combination treatment in chromosome doubling of anthurium. Plants derived from the anther culture had morphological variations with varied-characters. Some of them had potential to be developed. Androgenesis via anther culture and double haploid plants for anthurium were successfully established in the study. The system was also successfully applied to produce double haploid plants on other anthurium cultivars such as A. andreanum cv. Carnaval, Casino, Laguna and local anthuriums
Haploid atau Haploid Ganda pada Anturium. Dibimbing oleh NURHAYATI A. MATTJIK, AGUS PURWITO dan BUDI MARWOTO.
Androgenesis melalui kultur antera atau mikrospora merupakan salah satu terobosan teknologi penting dalam produksi tanama n haploid atau haploid ganda. Tanaman tersebut merupakan sumber genetik penting dalam produksi hibrida unggul baru dan biji berkualitas melalui program pemuliaan dan perbenihan yang terkontrol. Produksi tanaman tersebut melalui pemuliaan konvensional memerlukan banyak tenaga dan waktu. Sampai saat ini lebih kurang 219 protokol produksi tanaman haploid ganda, terkait dengan 33 species dan hibrida interspesifik pada serealia, sayuran, buah-buahan dan tanaman hias berhasil dikembangkan. Sembilan puluh persen (90%) dihasilkan melalui kultur antera dan delapan (8%) melalui kultur mikrospora. Anturium merupakan tanaman biseksual dan protoginous, dimana fase betina masak lebih kurang satu bulan lebih awal dibanding fase jantannya. Kondisi ini menjadi pembatas terjadinya penyerbukan sendiri, sehingga penyerbukan silang memiliki frekuensi yang tinggi dibanding penyerbukan sendiri. Anturium merupakan salah satu tanaman hias penting di Indonesia. Potensi agribisnis anturium cukup besar, namun belum tergarap dengan baik. Bertolak dari kenyataan tersebut, keberhasilan pengembangan androgenesis melalui kultur antera atau mikropora anturium yang dilakukan pada penelitian ini diharapankan mampu menjadi roda penggerak agribisnis anturium di Indonesia. Penelitian ini bertujuan untuk mengembangkan kultur antera atau mikrospora yang efektif sebagai penyedia tanaman haploid atau haploid ganda pada anturium. Penelitian ini diawali dengan studi tahap perkembangan mikrospora, seleksi tanaman donor, dan seleksi donor eksplan yang sesuai untuk androgenesis anturium. Dari studi awal diketahui bahwa
Anturium andreanum Linden ex André kultivar Tropical, antera yang diisolasi dari daerah transisi spadik merupakan tanaman donor dan donor eksplan yang sesuai untuk androgenesis anturium. Beberapa hal penting yang dilakukan untuk mencapai tujuan penelitian adalah melakukan studi pembentukan kalus, regenerasi kalus, penyiapan plantlet dan penggandaan kromosom, dan evaluasi regeneran hasil kultur antera anturium.
untuk kondisi Indonesia digunakan untuk karakterisasi dan mengetahui keragaman tanaman hasil kultur antera anturium. Peubah yang diamati dalam studi ini ialah (1) persentase tumbuh antera (PTA, %), (2) persentase antera membentuk kalus (PAMK, %), (3) jumlah antera membentuk kalus (JK), (4) volume kalus (mm3), (5) skoring jumlah bakal tunas, (SJBT) – s/d ++++, dimana – tidak ada bakal tunas yang teramati, + terdapat 1-5 bakal tunas, ++ terdapat 6-10 bakal tunas, +++ terdapat 11-20 bakal tunas, dan ++++ terdapat lebih dari 11-20 bakal tunas per eksplan yang diamati, (6) jumlah tunas (JT), (7) jumlah akar (JA), (8) persentase kematian (%), (9) variasi ploidi tanaman, (10) persentase tanaman haploid ganda (PTHG, %), (11) persentase keberhasilan penggandaan kromosom (PKK, %). Percobaan faktorial dan percobaan faktor tunggal disusun menggunakan rancangan acak lengkap (RAL) atau kelompok (RAK) dengan empat ulangan digunakan pada beberapa percobaan yang dilakukan dalam penelitian ini. Analisis regresi dan korelasi juga diaplikasikan pada sebagian percobaan.
melalui kultur antera berhasil dikembangkan pada anturium. Metode juga telah diaplikasikan untuk memproduksi tanaman haploid ganda pada kultivar anturium lain seperti A andreanum kultivar Carnaval, Casino, Laguna dan anturium lokal.
PADA ANTURIUM
BUDI WINARTO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Agronomi Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Irawati
Dr. Ir. Ni Made Armini Wiendi
Nama : Budi Winarto
NRP : A 161060111
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Nurhayati A. Mattjik, MS Ketua
Dr. Ir. Agus Purwito, MSc Dr. Ir. Budi Marwoto, MS, APU
Anggota Anggota
Mengetahui
Ketua Program Studi Agronomi Dekan Sekolah Pasca Sarjana
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
Puji dan syukur penulis panjatkan kehadirat Allah Bapa dalam Kristus Yesus yang dengan segala limpah rahmat dan kasih karuniaNya telah memberkati, menopang dan menolong penulis hingga berhasil menyelesaikan disertasi ini.
Terima kasih yang mendalam penulis ucapkan kepada Prof. Dr. Ir. Nurhayati. A. Mattjik, MS selaku Ketua Komisi Pembimbing, Dr. Ir. Agus Purwito, M. Agric. Sc dan Dr. Ir. Budi Marwoto, MS selaku Anggota Komisi Pembimbing yang telah memberikan bimbingan, kritikan, saran dan masukan yang sangat berharga sejak persiapan, pelaksanaan penelitian hingga selesainya penulisan disertasi ini.
Terima kasih juga penulis ucapkan kepada Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian yang telah memberikan kesempatan, kepercayaan dan dukungan biaya selama masa tugas belajar S3 ini berlangsung. Kepada ”Indonesian Torey Science Foundation (ITSF)-Jepang” yang telah memberikan sebagian dukungan biaya penelitian. Kepada Mr. Andre Smaal dari AGRIOM Achterweg 58A 1424 PR De Kwakel, The Netherland s untuk dukungan beberapa bahan kimia penting penunjang kegiatan penelitian.
Terima kasih yang sangat mendalam penulis ucapkan untuk istriku Nuri Rianti M, S.Pd (Almarhumah), anakku Yoga Aninditya dan Rexy Damarjati untuk kedalaman cinta, dukungan semangat dan pengorbanan yang telah mereka berikan. Kepada Ir. Fitri Rachmawati, M.Si, Dewi Pramanik, S.P., Euis Rohayati, Amd, Supenti, Nina Marlina, Dedi Rusnandi, Iwan Royada untuk dukungan dan kerjasama selama penelitian berlangsung. Kepada rekan-rekan seperjuangan, Ir. Sri Rianawati, MS, Ir. Suskandari Kartkaningrum, MS, Ir. Debora Herlina, MS beserta keluarga atas semua hal berharga yang telah diberikan. Kepada semua orang yang tak dapat disebutkan satu-per satu, kiranya Tuhan memberkati dan menyempurnakan semua yang telah dilakukan. Amin.
Bogor, Oktober 2009
xi
DAFTAR TABEL……… xiii
DAFTAR GAMBAR………... xvi
DAFTAR LAMPIRAN……… xix
PENDAHULUAN UMUM Latar Belakang……….. 1
Tujuan………... 10
Manfaat Penelitian……… 11
Ruang Lingkup Penelitian……… 12
STUDI PEMBENTUKAN KALUS/EMBRIO Pendahuluan………. 13
Bahan dan Metode……… 18
Hasil……….. 26
Pembahasan……….. 46
Simpulan………... 63
STUDI REGENERASI KALUS Pendahuluan……….. 64
Bahan dan Metode……… 69
Hasil... 74
Pembahasan……….. 94
Simpulan………... 104
STUDI PENYIAPAN PLANTLET DAN PENGGANDAAN KROMOSOM Pendahuluan ……… 105
Bahan dan Metode……… 108
Hasil………. 110
Pembahasan……….. 118
Simpulan... 123
xii
Pembahasan……….. 144
Simpulan... 151
PEMBAHASAN UMUM………. 152
SIMPULAN UMUM……… 170
DAFTAR PUSTAKA………... 172
xiii 1. Perkembangan mikrospora berdasarkan tahap perkembangan
spadiknya………. 8
2. Formula medium dasar untuk pembentukan kalus……….. 20
3. Formula medium dasar yang dioptimasi untuk pembentukan kalus…… 21
4. Pengaruh formula media dasar terhadap pembentukan kalus pada
kultur antera anturium tahap awal... 29
5. Pengaruh perbaikan medium dasar terseleksi terhadap pembentukan
kalus pada kultur antera anturium tahap optimasi... 31
6. Pengaruh teknik isolasi yang berbeda terhadap pembentukan kalus... 32
7. Pengaruh jenis agar yang berbeda terhadap pembentukan kalus... 33
8. Pengaruh interaksi antara posisi kultur antera dan media induksi
terhadap jumlah antera yang membentuk kalus per perlakuan (JK)…… 35
9. Pengaruh media induksi kalus terseleksi terhadap pembentukan kalus... 36
10. Pengaruh pengurangan kandungan garam mineral medium terseleksi
terhadap pembentukan kalus pada kultur antera anturium... 36
11. Pengaruh konsentrasi amonium nitrat terhadap pembentukan kalus... 37
12. Pengaruh interaksi media dasar dan konsentrasi amonium nitrat
terhadap jumlah antera yang membentu kalus per ulangan (JK)... 38
13. Pengaruh interaksi kombinasi-konsentrasi 2,4-D dan TDZ terhadap
jumlah rata-rata antera yang membentuk kalus per perlakuan (JK)... 39
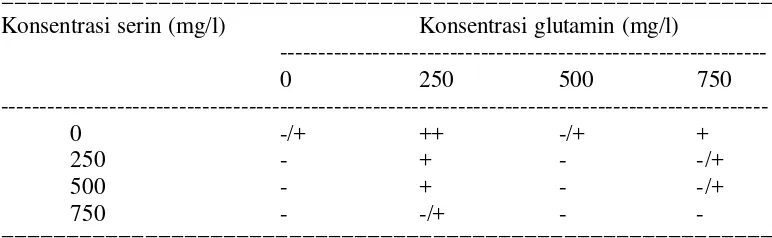
14. Pengaruh glutamin terhadap pembentukan kalus... 40
15. Pengaruh serin terhadap pembentukan kalus... 41
16. Pengaruh interaksi sukrosa dan glukosa terhadap jumlah rata-rata
antera yang membentuk kalus per perlakuan (JK)... 42
xiv 19. Skor jumlah bakal tunas per eksplan pada perlakuan medium dasar dan
konsentrasi amonium nitrat... 78
20. Pengaruh interaksi antara media dasar dan konsentrasi amonium nitrat
terhadap volume kalus (VK, mm3)... 79
21. Pengaruh interaksi antara media dasar dan konsentrasi amonium nitrat
terhadap jumlah tunas (JT)... 79
22. Pengaruh kombinasi konsentrasi 2,4-D dan TDZ terhadap skor bakal tunas...
81
23. Pengaruh interaksi kombinasi-konsentrasi 2,4-D dan TDZ terhadap pertumbuhan volume kalus (VK, mm3)...
82
24. Pengaruh interaksi kombinasi-konsentrasi 2,4-D dan TDZ terhadap jumlah tunas yang dihasilkan per eksplan (JT)...
82
25. Pengaruh glutamin terhadap pertumbuhan dan regenerasi kalus... 83
26. Pengaruh serin terhadap pertumbuhan dan regenerasi kalus... 83
27. Skor jumlah bakal tunas per eksplan perlakuan glutamin dan serin... 84 28. Pengaruh interaksi glutamin dan serin terhadap jumlah tunas per
eksplan (JT)... 86
29. Skor jumlah bakal tunas per eksplan pada perlakuan sukrosa dan
glukosa... 87
30. Pengaruh interaksi sukrosa dan glukosa terhadap volume kalus per
eksplan (VK, mm3)... 88
31. Pengaruh interaksi sukrosa dan glukosa terhadap jumlah tunas per
eksplan JT)... 88
32. Respon pertumbuhan kalus, pembentukan bakal tunas dan tunas kalus tumbuh lambat pada media regenerasi yang berbeda...
89
33. Pengaruh media regenerasi terhadap pertumbuhan kalus, pembentukan
bakal tunas dan tunas pada kalus haploid ... 90
xv 36. Pengaruh interaksi arang aktif dan media pengakaran terhadap jumlah
akar... 112
37. Pengaruh interaksi arang aktif dan media pengakaran terhadap
persentase akar berkualitas (PAB, %)... 113
38. Rasio ploidi hasil perlakuan konsentrasi kolkisin yang berbeda pada
plantlet haploid ………. 117
39. Rasio ploidi hasil perlakuan 0.05% kolkisin pada waktu perendaman
yang berbeda……… 117
40. Pengaruh sumber eksplan yang berbeda terhadap keberhasilan
penghitungan jumlah kromosom. ... 133
41. Variasi level ploidi pada sampel yang dapat dihitung jumlah
kromosom...
133
42. Pengaruh tipe akar terhadap keberhasilan pewarnaan
kromosom... 134
43. Variasi dan rasio level ploidi pada akar udara dan akar yang tumbuh
dalam medium dengan arang aktif sebagai sumber eksplan... 135
44. Variasi level ploidi pada sampel berhasil dihitung jumlah
xvi 1. Klasifikasi spadik berdasarkan tahap perkembangaan...
7
2. Tahap perkembangan mikrospora dalam antera Anturium andraeanum
Linden ex André………. 8
3. Pencoklatan eksplan dalam kultur antera anturium...
27
4. Perkembangan pembentukan kalus dalam kultur antera anturium... 28
5. Respon pertumbuhan antera pada formula media dasar yang berbeda... 29
6. Pengaruh posisi kultur antera (A) dan media induksi (B) terhadap induksi pembentukan kalus pada kultur antera anturium……….
34 7. Variasi respon sel-sel antera anthurium dalam androgenesis…………... 43
8. Proses inisiasi pembentukan kalus pada kultur antera anturium……….. 44
9. Hasil studi histologi pembentukan kalus dan tunas……….. 45
10. Pengaruh media dasar dan konsentrasi amonium nitrat terhadap
pertumbuhan dan regenerasi kalus hasil kultur anturium... 75
11. Bakal tunas dan tunas yang teregenerasi pengaruh perlakuan 2,4-D dan TDZ... 81
12. Pencoklatan kalus dalam kultur antera anturium sebagaian disebabkan
oleh perlakuan serin... 84
13. Pertumbuhan kalus dan regenerasinya pada medium terseleksi yang
mengandung 250 mg/l glutamin dan tanpa serin... 85
14. Respon pertumbuhan dan regenerasi kalus tumbuh lambat, kalus regenerasi daun dan petiol sampel tanaman haploid pada MRM-4 dan
MRM-6………. 91
15. Respon pembentukan tunas dan akar pada eksplan yang berbeda……… 92
16 Respon pembentukan tunas dan akar pada sampel tanaman haploid yang berbeda……….
xvii
18. Pengaruh media pengakaran terhadap jumlah akar... 111
19 Jumlah dan kualitas akar yang maksimal pada MP-7 yang mengandung 1% arang aktif... 113
20. Pengaruh media pengakaran terhadap induksi pembentukan akar pada tunas haploid... 115
21. Induksi pembentukan akar tunas haploid pada MPH-3d dan MPH-1... 115
22. Pertumbuhan tanaman haploid setelah aklimatisasi………. 116
23. Respon pertumbuhan tanaman akibat perlakuan kolkisin……… 118
24. Susunan kromosom somatik pada A. andreanum cv. Uniwa, 2n = 30... 125
25. Tiga tipe akar yang digunakan evaluasi sitologi... 128
26. Hasil pewarnaan kromosom pada eksplan yang berbeda... 132
27. Hasil pewarnaan kromosom yang potensial digunakan untuk studi kariotipe (Rachmawati, 2005)... 136
28. Variasi hasil pewarnaan kromosom menggunakan modifikasi metode Sharma dan Sharma (1994)... 137
29. Sebaran data, regresi dan korelasi antara metode penghitungan jumlah kromosom pada ujung akar dengan jumlah kloroplas pada sel pelindung stomata……… 138
30. Komparasi metode penhitungan jumlah kromosom dan jumlah kloroplas pada variasi ploidi tanaman hasil kultur antera... 139
31. Sebaran data, regresi dan korelasi antara metode penghitungan jumlah kromosom pada ujung akar dengan jumlah mikrospora per anteranya … 139 32. Sebaran data, regresi dan korelasi antara metode penghitungan jumlah kromosom pada ujung akar dengan kepadatan stomata per mm2 epidermis daun……… 140
xviii 35. Distribusi frekuensi warna dan jumlah tanaman hasil kultur antera…… 142
36. Tanaman haploid yang tidak berbunga ... 143
37. Penampilan daun yang terlihat berbeda antara tanaman haploid, diploid dan triploid ………
147
xix 1. Rekapitulasi nilai F pada persentase antera membentuk kalus (PAMK,
%) dan jumlah rata-rata antera yang membentuk kalus (JK) pada
percobaan awal seleksi formula media dasar... 204
2. Rekapitulasi nilai F pada persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang membentuk kalus (JK) pada
percobaan optimasi formula media dasar... 204
3. Rekapitulasi nilai F pada potensi tumbuh antera (PTA, %), persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang
membentuk kalus (JK) pada percobaan teknik isolasi dan jenis agar... 204
4. Rekapitulasi nilai F pada potensi tumbuh antera (PTA, %), persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang
membentuk kalus (JK) pada percobaan posisi kultur dan media induksi. 205
5. Pengaruh interaksi antara posisi kultur dan media terhadap potensi
tumbuh antera (PTA, %)... 205
6. Pengaruh interaksi antara posisi kultur dan media terhadap persentase
regenerasi antera (PAMK, %)... 206
7. Rekapitulasi nilai F pada potensi tumbuh antera (PTA, %), persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang membentuk kalus (JK) pada percobaan media terseleksi dan
pengurangan kandungan garam mineral... 206
8. Rekapitulasi nilai F pada potensi tumbuh antera (PTA, %), persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang membentuk kalus (JK) pada percobaan media dasar dan konsentrasi
NH4NO3 dalam pembentukan kalus... 207
9. Pengaruh interaksi media dasar dan konsentrasi amonium nitrat
terhadap potensi tumbuh antera (PTA, %)... 207
10. Pengaruh interaksi media dasar dan konsentrasi amonium nitrat
terhadap persentase antera membentuk kalus (PAMK, %)... 208
11. Rekapitulasi nilai F pada potensi tumbuh antera (PTA, %), persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang membentuk kalus (JK) pada percobaan 2,4-D dan TDZ dalam
xx 13. Pengaruh interaksi kombinasi-konsentrasi 2,4-D dan TDZ terhadap
persentase antera membentuk kalus (PAMK, %)... 209
14. Rekapitulasi nilai F pada potensi tumbuh antera (PTA, %), persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang membentuk kalus (JK) pada percobaan glutamin dan serin dalam
pembentukan kalus... 210
15. Rekapitulasi nilai F pada potensi tumbuh antera (PTA, %), persentase antera membentuk kalus (PAMK, %) dan jumlah rata-rata antera yang membentuk kalus (JK) pada percobaan sukrosa dan glukosa dalam
pembentukan kalus... 210
16. Pengaruh sukrosa terhadap pembentukan kalus……… 211
17. Pengaruh glukosa terhadap pembentukan kalus……… 211
18. Pengaruh interaksi sukrosa dan glukosa terhadap persentase tumbuh
antera (PTA, %)... 212
19. Pengaruh interaksi sukrosa dan glukosa terhadap persentase antera
membentuk kalus (PAMK, %)... 212
20. Rekapitulasi nilai F pada potensi tumbuh kalus (PTA, %), volume kalus (VK, mm2) dan jumlah rata-rata tunas per eksplan (JT) pada percobaan media dasar dan konsentrasi NH4NO3 dalam pertumbuhan dan
pembentukan tunas... 213
21. Rekapitulasi nilai F pada potensi tumbuh kalus (PTK, %), volume kalus (VK, mm3) dan jumlah rata-rata tunas per eksplan (JT) pada percobaan
2,4-D dan TDZ dalam pertumbuhan kalus dan pembentukan tunas... 213
22. Pengaruh 2,4-D terhadap pertumbuhan dan regenerasi kalus... 214
23. Pengaruh TDZ terhadap pertumbuhan dan regenerasi kalus... 214
24. Pengaruh interaksi kombinasi-konsentrasi 2,4-D dan TDZ terhadap
persentase tumbuh kalus (PTK, %)... 215
25. Rekapitulasi nilai F pada potensi tumbuh kalus (PTK, %), volume kalus (VK, mm3) dan jumlah rata-rata tunas per eksplan (JT) pada percobaan
xxi 27. Pengaruh interaksi glutamin dan serin terhadap volume kalus (VK,
mm2)... 216
28. Rekapitulasi nilai F pada potensi tumbuh kalus (PTK, %), volume kalus (VK, mm3) dan jumlah rata-rata tunas per eksplan (JT) pada percobaan
sukrosa dan glukosa dalam pertumbuhan kalus dan pembentukan tunas.. 217
29. Pengaruh interaksi sukrosa dan glukosa terhadap persentase tumbuh
kalus (PTK, %)... 217
30. Sidik ragam regresi jumlah kromosom dengan beberapa metode
estimasi level ploidy secara tak langsung yang diuji……… 218
31. Sidik ragam regresi jumlah kromosom dengan jumlah mikrospora per
antera………. 218
32. Sidik ragam regresi jumlah kromosom dengan kepadatan stomata per
mm2 epidermis daun……… 218
33. Sidik ragam regresi jumlah kromosom dengan rasio panjang lebar
stomata……….. 218
34. Sidik ragam regresi jumlah kromosom dengan rasio panjang lebar daun. 219
35. Metode penghitungan jumlah kromosom pada kalus menutur Fukui
(1996)... 219
36. Metode penghitungan jumlah kromosom pada daun muda menurut
Fukui (1996)... 220
37. Metode penghitungan jumlah kromosom pada ujung akar menurut
Darnaedi (1991)……… 221
38. Prosedur pembuatan bahan penunjang kegiatan pewarnaan kromosom... 222
39. Data gambar tanaman hasil kultur antera anturium... 224
40. Data karakterisasi kultivar Tropical dibandingkan dengan sampel 258
(Diploid)………... 229
41. Data karakterisasi kultivar Tropical dibandingkan dengan sampel 324
xxii 43. Data karakterisasi lokal merah dibandingkan dengan sampel
110(Triploid)……… 232
44. Data karakterisasi lokal putih dibandingkan dengan sampel 239
(Haploid)……… 233
45. Data karakter sampel 115 dan 16 yang memiliki potensi sebagai
tanaman pot………... 234
46. Data karakter sampel dominan hasil kultur antera anturium (Sampel 49
PENDAHULUAM UMUM
Latar Belakang
Tujuan utama penggunaan bioteknologi di bidang pertanian ialah untuk meningkatkan produksi, produktivitas dan kualitas hasil tanaman. Berbagai teknologi ini dari tingkat yang sederhana hingga yang komplek telah dimanfaatkan untuk mencapai tujuan tersebut. Salah satu teknologi yang telah diaplikasikan dan memberi dampak nyata terhadap kemajuan pro gram pemuliaan dan perbenihan tanaman ialah teknologi haploid (Kush dan Virmani, 1996; Thomas et al., 2003). Teknologi ini dieksplorasi dan diaplikasikan untuk memproduksi tanaman haploid dan/atau haploid ganda pada tanaman-tanaman yang memiliki nilai ekonomi tinggi (Maluszynski et al., 2003a).
Teknologi haploid dapat dikembangkan melalui (1) partenogenesis dan
apogamy, (2) eliminasi dan reduksi kromosom somatik dan (3) kultur in vitro
(Radzan, 1993). Di antara ketiga metode tersebut, kemajuan dan aplikasi kultur in vitro berkembang lebih pesat dibandingkan yang lain (Maluszynski et al., 2003a). Kultur ini mencakup kultur antera, mikrospora maupun ovule yang belum dibuahi (Mukhambetzhanov, 1997; Maluszynski et al., 2003a). Lebih kurang 219 protokol 33 spesies dan tanaman hibrida interspesifik telah berhasil dikembangkan (Maluszynski et al., 2003b). Sembilan puluh persen (90%) d i antaranya diperoleh melalui kultur antera dan 8% nya menggunakan kultur mikrospora. Aplikasi dan pemanfaatan kultur antera atau mikrospora dalam produksi tanaman haploid ganda disebut dengan androgenesis, sementara kultur ovul disebut juga dengan gynogenesis (Radzan, 1993).
keberhasilannya masih sangat rendah. Studi biologi bunga, perkembangan mikrospora dalam antera, teknik isolasi, studi pendahuluan pembentukan kalus pada kultur antera anturium, seleksi tanaman donor, kultur mikrospora dan kultur “shed-microspore” telah dilakukan (Winarto et al., 2004; Rachmawati, 2005; Winarto dan Rachmawati, 2007). Meskipun beberapa studi masih gagal, khususnya kultur mikrospora dan shed-microspore, beberapa data dasar yang diperoleh sangat penting pada pengembangan teknologi haploid anturium.
Pengembangan teknologi haploid pada anturium memiliki arti yang sangat penting bagi pengembangan agribisnis anturium di Indonesia mengacu pada kenyataan bahwa (1) potensi agribisnis anturium yang cukup besar di Indonesia, (2) hampir seluruh kultivar anturium berkualitas yang beredar di Indonesia adalah produk-produk negara maju yang telah dipatenkan, sehingga pemanfaatan produk tersebut untuk berbagai tujuan harus mendapatkan ijin dari pemegang hak paten yang disertai juga dengan kewajiban membayar royalty-nya, (3) pemuliaan anturium di Indonesia, terutama pemuliaan terprogram dengan arah dan tujuan yang jelas dan berkelanjutan masih sangat terbatas, (4) belum atau tidak tersedianya benih dan bibit yang berkualitas untuk menunjang agribisnis anturium di Indonesia dan (5) Anthurium andreanum adalah tanaman biseksual yang menyerbuk silang (Augustine , 2009; Caroll, 2007).
inisiasi dan regenerasi kalus/embio, penyiapan plantlet, evaluasi ploid i, dan evaluasi fenotipe tanaman yang dihasilkan dan akan diuraikan lebih mendalam pada bagian-bagian berikutnya dalam disertasi ini.
Anturium (Anthurium andreanum Linden ex André)
Anturium merupakan genus terbesar dalam famili Araceae (Geier, 1990; Chen et al., 2001), mencakup lebih dari 1.000 spesies (Croat, 1992). Lebih dari 800 spesies berasal dan tersebar di negara-negara tropis Amerika Selatan dan Tengah, seperti: Mexico, Costa Rica, Cuba hingga Brazil dan Argentina (Marutani et al., 1993; Chen et al., 2001). Keragaman spesies tertinggi ditemukan di dataran rendah dan menengah di America Selatan, Panama, dan Costa Rica; dan di hutan Amazon dari Bolivia, khususnya di Peru, Ecuador and Colombia (Anonim, 2006). Beberapa spesies juga ditemukan di India Barat dan daerah Karibia (Marutani et al., 1993). Pada perkembangan selanjutnya, tanaman ini juga dikembangkan di berbagai negara di Asia seperti: Cina (Xiaohan et al.,1998), Philippina (Rosario, 1998), Srilangka (Dhanasekera, 1998), Malaysia (Jong et al., 2001) dan Indonesia (Nurmalinda dan Satsijati, 2004).
Anthurium andreanum Linden ex André. dan A. scherzerianum Schott merupakan 2 spesies yang banyak dikembangkan secara komersial, baik sebagai bunga potong maupun tanaman pot (Hamidah et al., 1997; Martin et al., 2003). Species dan hybrid anturium memiliki bunga yang sangat menarik, warna yang bervariasi, daya simpan yang lama dengan daun yang eksotik (Aswath dan Biswas, 1999; Budhiprawira dan Saraswati, 2006). Struktur yang umumnya disebut bunga merupakan kombinasi antara spate (modifikasi daun dengan beragam warna) dan spadik berisi ratusan bunga-bunga kecil yang tersusun berurutan membentuk spiral pada tongkol bunga yang memanjang (Kamemoto dan Kuehnle, 1996).
masih terbatas. Pengembangan anturium sangat ditentukan oleh kesesuaian lahan, potensi pasar, volume produksi dan mtu hasil (Zainal, 1999). Tahun 2001 pasokan bunga potong anturium ke pasar bunga Rawa Belong mencapai 2.866.100 tangkai dengan nilai perdagangan mencapai 7.295.300.000,- (Nurmalinda dan Satsijati, 2004). Ekspor ke berbagai negara hanya mencapai 211.332 tangkai (Anonim, 2004). Tahun 1993 kebutuhan benih anturium di Indonesia mencapai 10.800.000 benih dengan volume impor mencapai 400.000 benih. Tahun 2004 impor benih mencapai 51.684 kg dari Malaysia dan 20.000 batang dari Belanda (Anonim, 2004). Sedangkan harga bunga potong anturium d i pasar lokal berkisar Rp. 1.500-2.500,- per tangkai, sementara harga tanaman potnya berkisar antara Rp. 25.000-45.000,- (Nurmalinda dan Satsijati, 2004).
Anthurium andreanum adalah tanaman biseksual dan menyerbuk silang (Augustine, 2009; Caroll, 2007). Peluang tanaman menyerbuk sendiri sangat rendah karena fase betina masak lebih kurang satu bulan lebih awal dibanding fase jantannya. Pemuliaan anturium umumnya dilakukan menggunakan seleksi biji hasil hibridisasi. Tanaman baru dengan karakter unggul diperoleh dengan mengandalkan kombinasi gen kedua tetuanya (Kamemoto dan Kuehnle, 1996). Hibridisasi secara konvensional ini umumnya memerlukan waktu yang cukup lama. Pada A. andreanum dibutuhkan waktu sekitar 6-7 bulan sejak penyerbukan hingga biji masak, sementara itu 10-12 bulan untuk A. scherzerianum. Biji tidak dapat disimpan dan harus segera ditanam. Seleksi dan evaluasi tanaman F1 dapat dilakukan setelah 2-3 tahun sejak penanaman biji. Kondisi ini menyebabkan kemajuan program pemuliaan anturium menjadi sangat lambat. Hibridisasi menghasilkan populasi tanaman yang bersegregasi dengan karakter bunga yang beragam. Namun umumnya 1/3 populasi segregan tersebut dibuang sebelum berbunga karena penampilannya inferior (Geier, 1990). Induksi mutasi menggunakan radiasi sinar gamma 5 hingga 15 Gy juga telah dilakukan, tetapi belum memberikan hasil yang optimal (Puchooa dan Sookun, 2003)
anturium, baik konvensional maupun in-konvensional yang terprogram dan terarah dengan tujuan yang jelas dan berkesinambungan masih sangat terbatas, sehingga kultivar-kultivar unggul baru produk dalam negeri yang mampu bersaing dipasar lokal dan global tidak ditemukan. Demikian pula aplikasi teknik kultur jaringan yang beorientasi pada produksi benih berkualitas di Indonesia juga belum berkembang pesat, sehingga kebutuhan benih berkualitas yang menunjang agribisnis anturium tidak dapat terpenuhi. Akibatnya agribisnis anturium di dalam negeri terus mengandalkan benih dan bibit berkualitas, serta varietas unggul impor dari negara-negara maju. Untuk mengejar ketertinggalan dari negara lain, diperlukan terobosan teknik pemuliaan dan perbenihan anturium di Indonesia.
Teknologi Haploid dan Manfaat nya
Ruang lingkup Teknologi haploid meliputi regenerasi kalus dan/atau embrio haploid dari gamet jantan dan betina hingga menghasilkan tanaman haploid dan/atau haploid ganda (Maluszynski et al., 2003ab). Teknologi ini paling cepat untuk me nghasilkan galur murni suatu tanaman (Kush dan Virmani, 2003). Teknik kultur antera pertama kali diperkenalkan oleh Guha dan Maheshwari (1964, 1966) pada Datura innoxia Mill, kemudian berkembang pesat dan diaplikasikan pada berbagai jenis tanaman (Maluszynski et al., 2003ab). Totipotensi sel gamet jantan dan dinding antera berpengaruh terhadap diperolehnya tanaman haploid. Pada kondisi yang sesuai, perkembangan sel polen dapat diubah dari pembentukan polen (jalur gametofitik) ke pembentukan embrio (jalur sporofitik), tanaman haploid dan/atau haploid ganda (Supena, 2004). Tanaman haploid ganda terbentuk akibat terjadinya penggandaan spontan atau melalui proses penggandaan kromosom.
dapat mempercepat diperolehnya homozigositas pada satu atau lebih generasi untuk menunjang pemuliaan hibrida (Thomas et al., 2003). Dengan demikian teknologi ini sangat bermanfaat bagi pengembangan hibrida baru yang memiliki karakter unggul dari proses heterosis tetua galur murni. Selain itu teknologi haploid dapat digunakan untuk seleksi resistensi tanaman terhadap penyakit di dalam rumah kaca dan mempelajari penurunan karakter-karakter kualitatif (Radzan, 1993).
Pada pemuliaan mutasi, aplikasi teknologi haploid ganda dapat dilakukan untuk skrining mutan dominan dan resesif pada generasi pertama setelah perlakuan mutagen, yang pada gilirannya dapat mempersingkat waktu dalam produksi mutan galur murni, meningkatkan efisiensi seleksi mutan dengan menggunakan metode seleksi in vitro pada level haploid dan haploid ganda (Radzan, 1993; Maluszynski
et al., 1996; Szarejsko, 2003).
Pada bidang transformasi /rekayasa tanaman, mikrospora yang diisolasi dari antera sangat potencial untuk penembakan gen, dan seleksi transgen secara in vitro
(Shim dan Kasha, 2003). Sedangkan pada pemetaan gen, tanaman haploid ganda dapat digunakan untuk memperbaiki variasi genetik setelah satu siklus rekombinasi (Forster dan Thomas, 2003).
Teknologi Haploid pada Anturium
kotak spora. Dari studi ini diketahui dua tipe kota spora yang menyimpan jumlah spora yang berbeda. Kotak spora yang lebih kecil dan tebal memiliki jumlah spora yang lebih banyak. Rata-rata jumlah spora per kotak spora berkisar antara 29.000-68.000 sel. Amigo 39.000-46.000 sel per kotak antera, 42.000-48.000 sel untuk Carnaval dan 31.000-37.000 sel untuk Tropical.
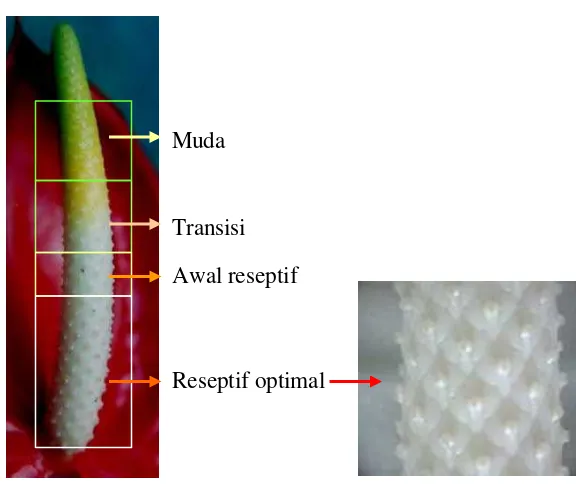
Studi perkembangan mikrospora diperoleh informasi bahwa spadik dibedakan dalam 4 kategori, yaitu: muda, transisi, awal reseptif, reseptif optimal (Gambar 1 dan 2). Dari studi ini terungkap bahwa tahap transisi merupakan tahap dengan persentase late-uninucleate tertinggi (Tabel 1). Sementara viabilitas sel mikrospora berkisar antara 36% – 75% dengan rata-rata viabilitas 70% untuk kultivar Amigo, 59% untuk tropical dan 46% untuk Carnaval (Winarto dan Rachmawati, 2007).
Gambar 1. Klasifikasi spadik berdasarkan tahap perkembangannya.
Reseptif optimal ditandai dengan produksi lendir yang banyak di ujung stigma/kepala putik.
Pada tahun 2004 dilakukan teknik isolasi antera, kultur mikrospora dan ovul. Dari studi ini diketahui bahwa isolasi ½ antera bagian ujung yang diikuti dengan penanaman secara langsung pada media kultur setengah padat menunjukkan hasil yang paling potensial untuk kultur antera anturium. Te knik ini memiliki tingkat
Muda
Transisi
Awal reseptif
kontaminasi hingga 64%, tetapi keberhasilan pembentukan kalusnya hanya mencapai 4.3%. Kultur mikrospora pada medium cair tidak berhasil dikembangkan, karena tingginya masalah kontaminasi.
A B C D
Gambar 2. Tahap perkembangan mikrospora dalam antera Anturium
andraeanum Linden ex André. A. Early- middle uninucleate, B. Late- uninucleate, C. Early binucleate D. Binucletae. Bar = 50 µm.
Tabel 1. Perkembangan mikrospora berdasarkan tahap perkembangan spadiknya ========================================================== Tahap Perkembangan mikrospora (%)
Spadik --- Awal inti Inti sel di Inti sel di Awal inti Inti ganda di tengah tengah tepi dinding ganda
sel
--- Muda 5.3 ± 1.94 61.3 ± 6.90 25.0 ± 5.58 5.9 ± 2.14 0
Transisi 1.9 ± 1.08 11.1 ± 2.61 75.7 ± 5.96 5.3 ± 2.05 1.2 ± 1.12 Awal
Reseptif 0 5.4 ± 1.49 70.2 ± 5.18 17.3 ± 1.86 2.5 ± 0.41 Reseptif
Optimal 0 0 6.9 ± 2.63 68.2 ± 6.21 14 ± 2.69 ========================================================== Keterangan: Data ± SD yang disajikan merupakan rata-rata dari 10 kali isolasi
dan pengamatan. Uji ini hanya dilakukan pada kultivar Tropical
persentase keberhasilan studi ini diduga juga berkaitan dengan tidak sesuainya formula medium inisiasi, sehingga pengembangan formula media dasar khususnya untuk kultur anturium menjadi hal mendasar yang perlu dilakukan.
Tahun 2005, tiga kultivar Anturium andreanum Linden ex André, yaitu: Amigo, Carnaval dan Tropical dipelajari peluangnya untuk pengembangan teknologi haploid pada anturium (Rachmawati, 2005). Dari kegiatan tahun tersebut diketahui bahwa (1) kultivar Tropical paling potensial digunakan sebagai tanaman model, (2) antera yang paling responsif diisolasi dari daerah transisi pada spadik yang 50% pistilnya reseptif, dimana 76% mikrosporanya berada pada fase late-uninucleate, (3) dua jenis kalus dengan kecepatan tumbuh yang berbeda (cepat dan lambat) diperoleh dalam kultur antera. Kultur antera utuh pada medium dua lapis NLN-13 dan MNM juga telah dilakukan pada studi pendahuluan, tetapi kultur antera ini gagal karena kontaminasi bakteri.
Kultur mikrospora anthurium pada kepadatan 30 ribu sel / ml pada medium NLN dengan variasi sukrosa dari 3, 6, 13 dan 17% sukrosa telah dilakukan, tetapi masih gagal akibat kontaminasi bakteri. Kultur mikrospora pada NLN dengan 13% sukrosa yang disertai dengan filtrasi dan subkultur berulang interval 12 jam juga telah dilakukan, tetapi belum memberikan hasil karena penurunan viabilitas mikrospora dan kontaminasi bakteri (Winarto, 2005). Meskipun kultur mikrospora masih gagal diinisiasi dan dikembangkan karena kontaminasi bakteri, pengembangan kultur mikrospora pada anthurium tetap menarik untuk diupayakan mengingat tingkat keberhasilan mendapatkan tanaman haploid dan haploid ganda yang lebih besar dibanding teknik haploid yang lain.
Tujuan Penelitian
Tujuan utama penelitian ini ialah mengembangkan teknologi haploid yang efektif dan efisien melalui kultur antera atau mikrospora untuk menyediakan tanaman haploid ganda pada anturium. Alur penelitian adalah sebagai berikut:
Teknologi Haploid Anthurium
Seleksi tanaman donor
Seleksi eksplan
Perlakuan Tanaman Donor Diperoleh A. andreanum kultivar Tropical
Diperoleh pada antera yang diisolasi dari daerah transisi
spadik
Studi Pembentukan Kalus / Embrio
Studi Regenerasi Kalus / Embrio
Studi Penyiapan Plantlet dan Penggandaan Kromosom
Evaluasi Tanaman 1. Evaluasi Sitologi 2. Evaluasi Fenotipe
Tanaman Haploid Ganda
?
?
?
Hipotesis
Hipotesis yang diajukan dalam penelitian ini ialah:
1. Minimal terdapat satu formula medium dasar, medium perbaikan, dan metode isolasi yang optimal untuk pembentukan kalus /embrio . Sel mikrospora, dinding antera dan sel penghubun dapat diinduksi membentuk kalus atau embrio.
2. Minimal terdapat satu medium yang optimal untuk regenerasi kalus/embrio hingga tunas atau plantlet.
3. Sedikitnya terdapat satu medium yang optimal untuk penyiapan plantlet dan perlakuan kolkisin yang sesuai untuk penggandaan kromosom
4. Terdapat keragaman ploidi dan fenotipe regeneran hasil kultur antera atau mikrospora
Manfaat Penelitian
Terdapat beberapa manfaat yang diperoleh dari hasil penelitian ini, antara lain:
1. Protokol kultur antera atau mikrospora, yang dapat digunakan untuk memproduksi tanaman haploid ganda pada beberapa kultivar anturium yang lain, baik untuk bunga potong maupun tanaman pot
2. Tanaman haploid ganda dapat langsung dimanfaatkan dan dilepas sebagai kultivar baru atau dijadikan sebagai tetua yang baik dalam persilangan konvensional untuk menghasilkan tanaman hibrida unggul baru dan benih yang berkualitas
Ruang Lingkup Penelitian
Ruang lingkup penelitian meliputi studi:
1. Pembentukan kalus/embrio terkait dengan formula medium dasar dan optimasinya , teknik isolasi, dan histologi dalam kultur antera anturium 2. Regenerasi kalus terkait dengan aplikasi medium terselaksi dan perbaikan
nya untuk mendukung pertumbuhan dan regenerasi kalus hingga membentuk tunas.
3. Penyiapan plantlet dan penggandan kromosom terkait dengan induksi pengakaran tunas dan aplikasi kolkisin
4. Evaluasi sitologi terkait dengan pewarnaan kromosom, penghitungan rasio ploidi dan komparasi beberapa metode estimasi ploidi secara tak langsung. 5. Evalusi fenotipe terkait dengan karakterisasi tanaman dan distribusi warna
STUDI PEMBENTUKAN KALUS / EMBRIO
Pendahuluan
Formula media dasar, teknik isolasi dan histologi merupakan salah satu hal mendasar yang diperlukan dalam pengembangan teknologi haploid pada anturium. Formula medium dasar khusus untuk kultur antera atau mikrospora pada anturium belum pernah dilaporkan. Beberapa medium dasar yang telah diaplikasikan dalam kultur jaringan anturium tidak selalu memiliki kesesuaian yang tinggi untuk pengembangan teknologi haploid. Teknik isolasi penting artinya terkait dengan pemilihan metode haploid yang sesuai dan akan dikembangkan pada anturium. Perbaikan medium terseleksi diperlukan untuk meningk atkan respon pembentukan kalus/embrio yang dihasilkan. Studi histologi penting eksistensinya, ketika kalus/embrio didahului pembentukannya oleh inisiasi kalus. Beberapa aspek penting tersebut diuraikan sebagai berikut.
senyawa makro tinggi, beberapa pada komponen mikro, vitamin atau pemberian ZPT tertentu (George et al., 2008).
Berbagai jenis formula media dasar, seperti: media Knop, White, Knudson, Nitsch dan Nitsch, Vacint dan Went, Murashige dan Skoog, N6, Chi dan Pool, Murashige dan Miller, dll. telah berhasil dikembangkan dalam kultur jaringan untuk berbaga i jenis tanaman (George, 1993; Mulyaningsih dan Nikmatullah, 2009). Namun medium Murashige dan Skoog (MS) (1962) merupakan salah satu komposisi atau formula media dasar yang sangat populer dan sesuai pada berbagai kultur jaringan tanaman (George, 1993). Medium ini diformulakan dengan memperhatikan konsentrasi tiap garam mineral yang menyusun medium.
Medium MS juga merupakan formula media dasar yang sering digunakan dalam kultur jaringan anturium, (Pierik et al., 1974; Pierik dan Steegmans, 1976; Kunisaki, 1980; Kuehnle et al., 1992; Hamidah et al., 1997; Chen et al., 1997; Teng, 1997; Martin et al., 2003; Joseph et al., 2003; Vargas et al., 2004); kemudian diikuti kemudian dengan medium Nitsch (Geier, 1986, 1987, 1988); dan medium Pierik (Kuehnle dan Sugii, 1991). Modifikasi media dasar tersebut dilakukan dengan meningkatkan dan menurunkan, menambahkan dan mengurangi kandungan garam mineral yang ada didalam media baik pada elemen makro (khususnya NH4NO3), mikro maupun vitamin (Kuehnle et al., 1992; Matsumoto et
al., 1996; Hamidah et al., 1997; Puchooa dan Sookun, 2003). Media-media tersebut umumnya digunakan untuk mengkultur organ atau eksplan somatik/vegetatif seperti daun, tangkai daun maupun bunga, spate, spadik maupun biji yang dikecambahkan secara in vitro baik pada Anturium andraeanum maupun
A. scherzerianum (Geier, 1990, Kamemoto dan Kuehnle, 1996; Aswath dan Biswas, 1999), untuk tujuan pembentukan kalus, tunas adventif maupun pembentukan embrio. Tetapi medium yang diformulakan secara khusus untuk kultur eksplan generatif seperti antera, mikrospora maupun ovul belum pernah dilaporkan.
merupakan teknik yang paling potensial dikembangkan dalam kultur antera anturium. Pada anturium isolasi langsung dengan memotong antera pada bagian ujung yang diikuti dengan penanaman langsung di atas media semi padat ternyata memberikan hasil pembentukan kalus yang paling potensial. Perbaikan teknik ini dapat dilakukan melalui pemberian perlakuan pada antera dan isolasi mikrospora pada medium semi padat. Perbaikan teknik isolasi juga dapat dilakukan dengan cara mengubah posisi aksplan saat dikultur pada media semi padat. Referensi pada kultur antera sangat terbatas, tetapi pada eksplan somatik memberikan hasil yang sangat signifikan. Posisi terlentang (Adaxial side down ) merupakan posisi yang sesuai untuk menginduksi eksplan dalam organogenesis dan pembentukan kalus, seperti dilaporkan pada anyelir (van Altvorst et al., 1992, Winarto, 2002), pada apricot (Perez-Tornero et al., 2000), pada anggrek (Chen dan Chang, 2000).
Jenis dan konsentrasi agar dalam kultur jaringan dilaporkan berpengaruh nyata terhadap pertumbuhan eksplan (Cardoso et al., 2007), kultur jaringan sel somatik lili dan sucorebutia (Scholten dan Pierik , 1998), mawar, cordyline dan homalomena (Podwyszynska dan Olszewski, 1995); kultur antera lili (Arzeta-Fernandez et al., 1997; Han et al., 1997), bunga matahari (Saji dan Sujatha, 1998), cyclamen (Ishizaka, 1998), kedelai (Cardoso et al., 2007), kultur ovul spatiphyllum (Eeckhaut et al., 2001) dan Allium cepa (Martinez, 2003). Pada studi pendahuluan gelrite merupakan jenis agar yang digunakan dalam pembentukan kalus, semenara aplikasi jenis dan konsentrasi agar yang lain belum pernah dilakukan.
Optimasi media dasar terseleksi umumnya dilakukan untuk meningkatkan kemampuan medium dalam menginduksi pembentukan kalus, embrio, maupun regenerasi eksplan yang dikultur. Optimasi tersebut dapat dilakukan melalui berbagai cara, diantaranya dengan (1) mengurangi kandungan garam mineral medium terseleksi, (2) menguji ulang media dasar terseleksi yang dikombinasikan dengan pemberian NH4NO3, (3) memvariasikan pemberian 2,4-D dengan TDZ, (4)
Medium MS dengan ½ kandungan garam mineral makro yang mengandung 1 g/l glycine, 60 g/l sukrosa merupakan medium induksi kalus yang optimal pada kultur anther asparagus (Woylin dan Nichols, 2003). Pada Trapa japonica, ½ MS yang ditambah 2.7 mM 2,4-D, 108.0 mM casein hydrolisat, dan 10.8 mM floroglusinol merupakan medium yang maksimum untuk induksi kalus (Hoque dan Arima, 2002). Medium ½ MS yang ditambah dengan 4 mg/l 2,4-D juga optimal untuk meningkatkan pembentukan kalus pada Bupleurum kaoi (Chen
et al., 2005). Selanjutnya pada kultur antera Prunus persica 10 ppm NH4NO3
sesuai untuk pembentukan kalus (Biggs dan Sherman, 1980). Pada Colocasia esculenta penurunan konsentrasi NH4NO3 dari 700 menjadi 200 mg/l
meningkatkan pembentukan kalus (Malamug et al., 1992). NH4NO3 pada 10.30
mM konsentrasi optimum untuk pembentukan kalus pada barley (Chauhan dan Kothari, 2004).
Keseimbangan kombinasi konsentrasi hormon dalam medium berpengaruh pada morfogenesis eksplan. Thangene et al. (1994) menemukan medium MS yang ditambah dengan 1.0 mg/l 2,4-D dan 0.5 mg/l BAP untuk induksi pembentukan embrio pada kultur antera bunga matahari. Pada tanaman yang sama, Coumans dan Zong (1995) menggunakan medium N6 yang mengandung 1.0 mg/l NAA dan 0.2 mg/l BA, kemud ian Saji dan Sujatha (1998) memanfaatkan 0.1 mg/l NAA dan 0.5 mg/l BA pada medium MS untuk pembentukan kalus. Pembentukan kalus pada kultur antera lili dilakukan pada medium N6 yang mengandung 2 mg/l 2,4-D (Arzeta-Fernandez et al., 1997). Pada kultur antera cyclamen, Ishizaka (1998) menemukan medium B5 yang ditambah dengan 0.1-1.0 mg/l NAA atau 1.0 mg/l 2,4-D untuk induksi kalus embriogenik.
Pemberian asam amino dalam medium seringkali juga diaplikasikan untuk meningkatkan kualitas medium dalam inisiasi kalus. Pada kultur antera padi, 5 mM aspartat dan 5 mM glutamine pada medium B5 sesuai untuk meningkatkan efisiensi pembentukan kalus (Masaaki et al. 2000). Pemberian 200 mg/l glutamine pada medium ½ MS sesuai untuk kultur kalus Colocasia esculenta var. Esculenta
et al., 1991), 25 mg/1 asparagine dan glutamine pada medium DS untuk Sophora japonica dan Ailanthus glandulosa (Civínovádan Sladký, 1990).
Penambahan dan penurunan kombinasi konsentrasi sumber karbon juga ditemukan meningkatkan respon ekspla dalam pembentukan kalus. Pada kultur antera Linum usitatissimum 2.5% sukrosa dan 2.5% glukosa merupakan kombinasi konsentrasi sumber karbon yang paling efektif untuk induksi kalus (Rutkowska-Krause et al., 2003) Pemberian 9% atau 12% sukrosa meningkatkan pembentukan kalus pada Linum usitatissimum kultivar 'Lirina', 'Barbara' dan 'Szaphir' (Burbulis
et al., 2005), Peningkatan konsentrasi sukrosa dari 8 % menjadi 20% meningkatkan kemampuan Brassica napus ssp. oleífera dalam menginduksi pembentukan embrio (Dunwell dan Thurling, 1985). Aplikasi berbagai perlakuan tersebut diharapkan mampu meningkatkan kemampuan medium terseleksi pada kultur antera anturium dalam membentuk kalus.
Histologi dalam kultur antera atau mikrospora merupakan salah satu langkah penting yang perlu dilakukan untuk mengkonfirmasi asal sel yang membentuk kalus, tunas adventif atau embrio yang proses pembentukannya didahului dengan inisiasi kalus (indirect organo atau embriogenesis) seperti yang dilaporkan pada Narcissus (Hussey, 1982), anggur (Altamura et al., 1992), kacang kedelai (Rodrigues et al., 2004), kubis (Zhao et al., 2006). Pada kultur antera anturium, asal sel pembentuk kalus pada setengah antera yang dikultur ada medium terseleksi juga belum diketahui. Tiga jenis sel berpotensi membentuk kalus, yaitu: sel mikrospora, jaringan dinding sel dan penghubung. Karena itu histologi dalam kultur antera anturium merupakan hal penting yang harus dilakukan untuk memastikan asal sel kalus.
medium terseleksi bertujuan untuk melakukan optimasi medium terseleksi melalui pengurangan kandungan garam mineral, menguji ulang mediu dasar dengan variasi konsentrasi NH4NO3, memvariasikan konsentrasi 2,4-D dengan TDZ, glutamin
dan serin, sukrosa dan glukosa yang berbeda untuk pembentukan kalus. Percobaan histologi bertujuan untuk mengungkap asal sel yang membentuk kalus.
Hipotesis yang diajukan ialah minimal terdapat satu formula medium dasar, metode isolasi, jenis dan konsentrasi agar, dan medium teroptimasi yang sesuai untuk pembentukan kalus pada kultur antera anturium. Mikrospora, dinding antera dan jaringan penghubung memiliki potensi untuk diinduksi membentuk kalus.
Bahan dan Metode
Penelitian ini dilakukan di laboratorium kultur jaringan Balai Penelitian Tanaman Hias pada bulan Agustus 2006 hingga Mei 2008. Anturium andreanum
kultivar Tropical yang ditanam pada polibag plastik (diameter 30 cm) pada campuran media arang sekam, humus bambu dan pakis (1:1:1, v/v/v) digunakan dalam penelitian ini. Spadik yang 50% pistilnya berada dalam kondisi reseptif optimal dipanen dari tanaman dan digunakan sebagai donor antera.
Spadik diletakkan di bawah air mengalir selama 0.5-1.0 jam, kemudian dipindahkan ke dalam larutan 1% benomil + bactomycin selama 30 menit dan dibilas dengan air destilasi beberapa kali hingga bersih. Setelah itu spadik direndam sambil digojok dalam larutan 2% natrium hipoklorida (NaOCl) + 5 tetes Tween 20 selama 5 menit kemudian pindahkan ke dalam larutan 1% NaOCl selama 10 menit dan dibilas dengan air destilasi steril hingga bersih (5-6x, @ 5 menit).
Media yang telah disiapkan, dimasak kemudian dituang ke dalam botol-botol kultur (± 30 cc per botol-botol). Botol berisi media selanjutnya disterilk an dalam autoklaf pada suhu 121ºC selama 20 menit pada tekanan atmosfir 15 kPsi. Setelah botol disterilkan disimpan dalam rak-rak media dan siap digunakn pada hari berikutnya.
Formula , modifikasi, seleksi dan optimasi medium dasar
Formula , modifikasi dan seleksi medium dasar.
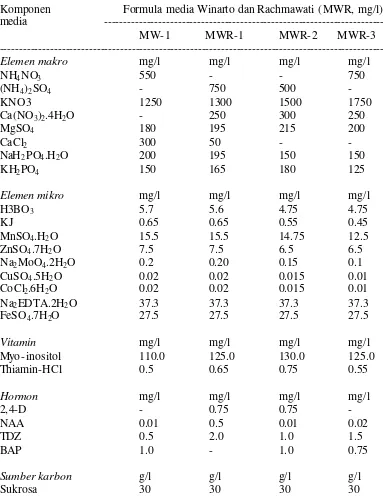
Percobaan 1, formula medium dasar awal yang dikembangkan ialah (1) MW-1, (2) MW-2, (3) MW-3 (Tabel 2). MW-3 yang berbasis medium MS dimodifikasi dengan menambahkan 50 ppm Cefotaxim (C) dan 2 mg/l asam panthotenat (P) menjadi MW-3 + C, MW-3+P dan MW-3+C+P. Dengan demikian terdapat 3 formula media dasar baru dan 3 formula media dasar modifikasi yang akan diuji dalam penelitian ini.
Optimasi formula mediun dasar
Percobaan 2, MW-1 diketahui merupakan formula medium dasar yang paling potensial untuk kultur antera anturium. MW-1 dioptimasi melalaui peningkatan atau penurunan konsentrasi komponen medium dasar dan penambahan atau pengurangan satu atau dua komponen medium dasar (Tabel 3). Formula media dasar baru yang dikembangkan ialah (1) MW-1, sebagai kontrol, (2) MWR-1, (3) MW R-2, dan (4) MWR-3.
Parameter yang diamati dalam percobaan ini ialah (1) persentase antera membentuk kalus (PAMK, %), (2) jumlah antera yang membentuk kalus (JK), dan (3) skor pembentukan kalus (- s/d +++, dimana - - tidak ada kalus, + - sedikit kalus, kurang dari 25% dari total eskplan, ++ - kalus agak banyak, 25-50% total eksplan, +++ - kalus banyak, >50% total eksplan). Pengamatan dilakukan 2.5 bulan setelah kultur inisiasi. Pengamatan dilakukan 2.5 bulan setelah kultur awal.
Data pengamatan dianalisis menggunakan analisis varian (ANOVA) dengan program SAS Release Window 6.12. Jika terdapat perbedaan nilai rata-rata perlakuan maka dilakukan uji lanjutan menggunakan uji jarak berganda Duncan pada taraf kepercayaan 5%.
Teknik isolasi dan optimas inya
Pengaruh teknik isolasi dan jenis agar terhadap pembentukan kalus
Pada percobaan 3 ini beberapa teknik isolasi dan jenis agar diuji. Teknik isolasi (TI) yang dikembangkan ialah: (1) setengah antera bagian ujung tanpa diberi perlakuan penekanan kotak antera untuk mengeluarkan sebagian mikrospora yang ada di dalamnya (TI-1), setengah antera bagian ujung yang diberi perlakuan (TI-2), dan kultur mikrospora 5.000-10.000 sel (TI-3). Sementara jenis agar (JA) yang diuji ialah (1) Gelrite (JA-1, 1.5 g/l), (2) Phytagel (JA-2, 2.5 g/l) dan (3) agar Swallow (JA-3, 6 g/l). Formula medium dasar yang digunakan ialah MWR-3 + 30 g/l sukrosa. Media ini dalam pembuatannya ditambah dengan 30 g/l sukrosa dan diatur pHnya pada 5.8.
Pengaruh posisi kultur antera dan media induksi terhadap pembentukan kalus
yang mengandung 0,5 mg/l 2,4-D. Dua formula media dasar yang digunakan dalam penelitian ini ialah (1) MW-1 dan (2) MWR-3. Keduanya ditambah dengan 30 g/l sukrosa dan 2.0 g/l gelrite. pH media diatur pada 5.8.
Percobaan faktorial yang disusun menggunakan rancangan acak kelompok dengan 4 ulangan digunakan dalam percobaan 3 dan 4. Tiap perlakuan terdapat 3 botol dan tiap boto l berisi 6 antera yang dikultur, sehingga total antera yang dikultur untuk tiap perlakuan ialah 72 antera.
Semua kultur antera diinkubasi pada kondisi gelap ± selama 2 bulan. Setelah itu kultur dipindahkan pada inkubasi terang dengan 12 jam fotoperiode dan diletakkan di bawah lampu fluoresen (13 µmol.m-2.s-1) hingga kalus terbentuk.
Peubah yang diamati ialah: (1) potensi tumbuh antera (PTA, %) adalah antera yang tetap segar setelah 1 bulan inkubasi. PTA diamati 1 bulan setelah kultur inisiasi. (2) persentase antera membentuk kalus (PAMK, %) (diamati 2.0 bulan setelah kultur inisiasi) dan (3) jumlah antera yang membentuk kalus (JK), (diamati 3.0 bulan setelah kultur inisiasi).
Data pengamatan dianalisis menggunakan analisis varian (ANOVA) dengan program SAS Release Window 6.12. Jika terdapat perbedaan nilai rata-rata perlakuan maka dilakukan uji lanjutan menggunakan uji wilayah berganda Duncan pada taraf kepercayaan 5%.
Perbaikan medium terseleksi dalam pembentukan kalus
Pengaruh media terseleksi dan pengurangan kandungan garam mineral terhadap pembentukan kalus
Percobaan 5, dua media terseleksi yang diuji ialah (1) MW-1 dan (2) MWR-3. Kandungan garam mineral yang dipelajari ialah kandungan penuh (kontrol), setengah, seperempat, seperdelapan, seperenambelas dan tanpa garam mineral (hanya 2.0 g/l gelrite).
penyusun medium diturunkan konsentrasinya hingga setengahnya. Misal: kandungan penuh NH4NO3 MW-1 ialah 550 mg/l, kandungan setengah berarti 550
x ½ = 225 mg/l; kandungan seperempat berarti 550 x ¼ = 112.5 mg/l, dan seterusnya sesuai perlakuan pada semua garam mineral dan vitamin penyusun medium.
Pengaruh media dasar dan konsentrasi amonium nitrat yang berbeda terhadap pembentukan kalus
Pada percobaan 6, media dasar yang digunakan dalam percobaan ini ialah: (1) ½ MW-1, (2) ½ MWR-3, dan (3) MWR-3. Sedangkan konsentrasi amonium nitrat yang diaplikasikan ialah (1) 750 mg/l, (2) 550 mg/l, (3) 413 mg/l, (4) 206 mg/l, dan (5) 103 mg/l.
Pengaruh kombinasi konsentrasi 2,4-D dan TDZ yang berbeda terhadap pembentukan kalus
Pada percobaan 7, konsentrasi 2,4-D yang digunakan ialah (1) 0 mg/l, (2) 0,5 mg/l, (3) 1,0 mg/l dan (4) 2,0 mg/l. Sedangkan konsentrasi TDZ yang digunakan dalam percobaan ini ialah (1) 0 mg/l, (2) 0,5 mg/l, (3) 1,0 mg/l dan (4) 2,0 mg/l. Medium dasar yang digunakan dalam percobaan ini adalah MWR-3.
Pengaruh kombinasi konsentrasi glutamin dan serin yang berbeda terhadap pembentukan kalus
Pengaruh kombinasi konsentrasi sukrosa dan glukosa yang berbeda terhadap pembentukan kalus
Pada percobaan 9, pengaruh konsentrasi dan kombinasi antara sukrosa dan glukosa terhadap pembentukan kalus dipelajari. Konsentrasi sukrosa yang digunakan ialah (1) 20 g/l, (2) 40 g/l, (3) 60 g/l dan (4) 80 g/l. Sementara konsentrasi glukosa yang digunakan ialah (1) 0 g/l, (2) 10 g/l, (3) 30 g/l dan (4) 60 g/l. Medium dasar yang digunakan dalam percobaan ini adalah MWR-3.
Percobaan faktorial yang disusun menggunakan rancangan acak kelompok dengan 4 ulangan digunakan dalam percobaan 5, 6, 7, 8 dan 9. Tiap perlakuan terdapat 3 botol dan tiap boto l berisi 6 antera yang dikultur, sehingga total antera yang dikultur untuk tiap perlakuan ialah 72 antera.
Semua kultur antera diinkubasi pada kondisi gelap ± selama 2 bulan. Setelah itu kultur dipindahkan pada inkubasi terang dengan 12 jam fotoperiode dan diletakkan di bawah lampu fluoresen (13 µmol.m-2.s-1) hingga kalus terbentuk.
Peubah yang diamati ialah: (1) potensi tumbuh antera (PTA, %) adalah antera yang tetap segar setelah 1 bulan inkubasi. PTA diamati 1 bulan setelah kultur inisiasi. (2) persentase antera membentuk kalus (PAMK, %) (diamati 2.0 bulan setelah kultur inisiasi) dan (3) jumlah antera yang membentuk kalus (JK), (diamati 3.0 bulan setelah kultur inisiasi).
Data pengamatan dianalisis menggunakan analisis varian (ANOVA) dengan program SAS Release Window 6.12. Jika terdapat perbedaan nilai rata-rata perlakuan maka dilakukan uji lanjutan menggunakan uji wilayah berganda Duncan pada taraf kepercayaan 5%.
Histologi pembentukan kalus dan regenerasi tunas
MWR dan diinkubasi gelap selama ± 2 bulan. Sedangkan kalus yang beregenerasi membentuk tunas diambil dari kalus yang sudah mengalami subkultur (1-3 kali subkultur) dan terlihat mulai membentuk bakal tunas hingga bakal tunas terlihat jelas. Setiap periode inkubasi diambil minimal 3-5 sampel.
Antera dan kalus hasil sampling selanjutnya difiksasi dalam larutan FAA (formalin: asam asetat glasial: 50% etanol, 5:5:90 (v/v/v)) selama 48 jam. Sampel kemudian didehidrasi menggunakan seri etanol (30, 50, 75, 95, 100% (v/v)) dua kali selama 30 menit untuk tiap serinya. Setelah didehidrasi eksplan direndam dalam larutan xyline: paraffin pada rasio yang berbeda (75: 25, 50: 50, 25: 75, 0: 100) selama satu jam untuk tiap rasionya dan pada akhir kegiatan direndam dalam 100% paraffin selama 1 malam. Sampel se lanjutnya dicetak dalam paraffin pada posisi yang jelas untuk membantu proses dan tujuan pengirisannya.
Sampel yang telah dicetak diparafin selanjutnya dipotong pada ketebalan (10-15 µm) dengan mikrotom rotari model 820 Spencer. Irisan sampel selanjutnya dilekatkan pada kaca obyek dengan larutan 10% albumin- glycerin (Lampiran 30). Kaca obyek dan irisan sampel kemudian disimpan dalam oven bersuhu 30ºC selama minimal 3 hari.
Spesimen selanjutnya diwarnai menggunakan larutan 1% asam- fuchsin dan 0.05% toluidine blue. Pengecatan dimulai dengan perendaman specimen dalam xylin selama 5 menit dan seri alkohol dari 100, 90, 80, 70, 60, 50, 40 dan 30% selama masing- masing 10 detik, kemudian dicelupkan dalam air destilasi selama 10 detik. 1% asam- fuchsin (Lampiran 30) selama 1 menit, 0.05% toluidine-blue (Lampiran 30) selama 1 menit, dan air destilasi kurang dari 5 detik. Setelah kering, specimen diawetkan menggunakan larutan entelan, selanjutnya diamati di bawah mikroskop dan difoto sesuai kebutuhan penelitian.
Hasil
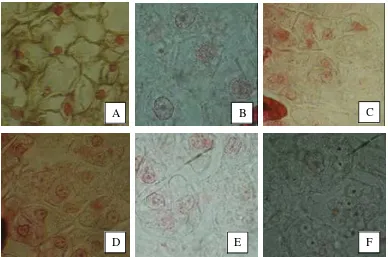
berubah dari putih ke arah kecoklatan. Warna coklat ini makin menjadi jelas dan pada akhirnya eksplan berwarna hitam dan mati. Antera yang mati terjadi pada 1-2 bulan setelah kultur inisiasi (Gambar 3). Kasus ini tidak hanya terjadi pada pembentukan kalus, tetapi juga terjadi pada kalus yang telah berhasil diregenerasikan.
Gambar 3. Pencoklatan eksplan dalam kultur antera anturium. A-B. Eksplan (antera atau antera + kalus yang teregenerasi) yang sedang mengalami pencoklatan (panah coklat). A-B. Sebagian eksplan tumbuh dan beregenerasi membentuk kalus (panah hijau). C. Antera teregenerasi membentuk kalus dan mati (panah merah). D. Kalus yang tumbuh bagus dan kalus yang sebagian mengalami pencoklatan. E. Antera yang tidak teregenerasi dan mati (Panah merah). F. Kalus teregenerasi dari antera yang mati. Bar hijau = 0.45 cm, bar hitam =
0.80 cm.
Setengah antera yang diisolasi secara langsung dan dikultur pada medium uji akan berada pada fase stagnasi selama 5-15 hari setelah kultur inisiasi (Gambar 4A). Setelah itu sel-sel dinding antera akan mengalami dideferensiasi akibat respon terhadap komponen medium dan hormon. Sel kompeten ini akan berubah menjadi meristemiatik yang aktif membelah. Secara visual kondisi ini terlihat dari perubahan ukuran antera yang lebih besar dan terbentuknya kalus 20-35 hari setelah kultur inisiasi (Gambar 4B). Kalus yang tidak mengalami pencoklatan,
A B
C
F E
akan terus berkembang dan bertumbuh. Kalus yang berukuran 0.15 – 0.50 cm mudah diamati ± 3.0 bulan setelah kultur inisiasi (Gambar 4C).
Gambar 4. Perkembangan pembentukan kalus dalam kultur antera anturium. A. Kondisi antera pada awal kultur. B. Antera yang potensial tumbuh dan sebagian telah membentuk kalus. C. Kalus hasil regenerasi 3 bulan setelah kultur inisiasi. Bar = 0.6 cm.
Formula, modifikasi, seleksi dan optimasi medium dasar
Formula, modifikasi, dan seleksi medium dasar
Formula media dasar dan modifikasinya ternyata memberikan pengaruh yang sangat nyata terhadap respon pertumbuhan antera yang ditanam (Lampiran 1). Respon pertumbuhan yang baik umumnya ditandai dengan kondisi antera yang tetap segar dan inisiasi kalus pada daerah bekas potongan pisau kultur, meskipun sebagian besar mati akibat pencoklatan (Gambar 5B-C). Antera yang tetap segar memiliki peluang terinduksi membentuk kalus, meskipun tidak setiap antera yang segar dapat membentuk kalus. Kalus terus bertumbuh dan berkembang dan terlihat jelas 2.5 bulan setelah kultur inisiasi.
Antera memiliki peluang tumbuh dan mampu membentuk kalus pada formula media dasar yang pertama (MW-1) dan MW-3 yang dimodifikasi dengan menambahkan 50 ppm cefotaxim dan 2 g/l asam panthotenat (MW-3 + C + P) (Gambar 5B, Tabel 4). MW-1 merupakan formula media dasar yang paling potensial untuk kultur antera anturium. Formula tersebut mampu menginduksi persentase antera yang membentuk kalus, jumlah antera yang mementuk kalus dan
skor pembentukan kalus tertinggi dibanding formula media dasar yang lain (Tabel 4). Semua antera yang dikultur pada media MW-2, MW-3 + C dan MW-3 + P mengalami pencoklatan dan mati (Gambar 5C).
Gambar 5. Respon pertumbuhan antera pada formula media dasar yang berbeda. A. Antera yang tumbuh bagus dengan pembentukan kalus yang optimal pada MW-1, B. Antera yang tumbuh dengan pembentukan kalus yang minimal pada MW-3 + C + P, C. Antera yang mati karena pencoklatan yang ditumbuhkan pada MW-2, MW-3 + C dan MW-3 + P. Panah hijau = antera yang membentuk kalus, panah putih = antera yang mati. Bar = 0.45 cm
Tabel 4. Pengaruh formula media dasar terhadap pembentukan kalus pada kultur antera anturium tahap awal.
==========================================================
Formula media dasar PAMK (%) JK Skor pembentukan
(MW) kalus (- s/d ++++)
--- MW-1 11.3 a 2.3 a ++/+++
MW-2 0.0 c 0.0 c - MW-3 0.0 c 0.0 c - MW-3 + C 0.0 c 0.0 c - MW-3 + P 0.0 c 0.0 c - MW-3 + C + P 7.5 b 1.5 b +
---
Koefisien variasi (CV, %) 11.39 10.78
========================================================== Keterangan: PAMK – persentase antera membentuk kalus (%), JK – jumlag antera yang
membentuk kalus. Skor kalus: - tidak ada kalus, + - sedikit kalus, kurang dari 25% dari total eskplan, ++ - kalus agak banyak, 25-50% total eksplan, +++ - kalus banyak, >50% total eksplan. Angka rataan yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak adanya pe rbedaan yang nyata menurut uji wilayah berganda Duncan pada taraf kepercayaan 5%.
Optimasi formula medium dasar
Perbaikan MW-1 melalui reformula komponen medium berpengaruh nyata terhadap pembentukan kalus (Lampiran 2). Reformula melalui perubahan konsentrasi komponen elemen makro NH4NO3 dari 550-750 mg/l, KNO3 dari
1250 menjadi 1750 mg/l, MgSO4 dari 180 ke 200 mg/l, penambahan
Ca(NO3)2.4H2O pada konsentrasi 250 mg/l dan penghilangan CaCl2, penurunan
konsentrasi NaH2PO4. H2O dari 200 – 150 mg/l dan KH2PO4 dari 150-125 mg/l.
Selanjutnya penurunan seluruh konsentrasi elemen mikro dari MW-1 ke MW-6 (H3BO3 dari 5.7 ke 4.75 mg/l; KJ dari 0.65 ke 0.45 mg/l; MnSO4. H2O dari 15.5 ke
12.5 mg/l; ZnSO4. 7H2O dari 7.5 ke 6.5 mg/l; Na2MoO4. 2H2O dari 0.2 ke 0.1
mg/l, CuSO4. 5H2O dan CoCl2. 6H2O dari 0.02 ke 0.01 mg/l. Peningkatan
konsentrasi myo-inositol 110 mg/l ke 125 mg/l myo- inositol dan thiamin-HCl dari 0.5 ke 0.55 mg/l dan perubahan konsentrasi 0.01 mg/l NAA, 0.5 mg/l TDZ dan 1.0 mg/l BAP pada MW-1 menjadi 0.02 mg/l NAA, 1.5 mg/l TDZ dan 0.75 mg/l BAP pada MWR-3 menyebabkan formula tersebut lebih sesuai untuk pembentukan kalus. MW R-3 memiliki persentase antera membentuk kalus, jumlah kalus dan skor pembentukan kalus terbaik dan berbeda nyata dibandingkan formulai media yang lain (Tabel 5).
NH4NO3 pada formula medium dasar diduga memberikan pengaruh yang
nyata terhadap kemampuan medium dalam pembentukan kalus. Substitusi NH4NO3 dengan (NH4)2SO4 pada MW-4 dan MW-5 justru menekan pertumbuhan
antera. Ini menunjukkan bahwa masuknya (NH4)2SO4 menggantikan NH4NO3
kedua media tersebut perubahan komponen medium mengakibatkan pencoklatan dan kematian antera.
Tabel 5. Pengaruh perbaikan medium dasar terseleksi terhadap pembentukan kalus pada kultur antera anturium tahap optimasi.
==========================================================
Formula media dasar PAMK (%) JK Skor pembentukan (MW) kalus (- s/d ++++) --- MW-1 12.5 b 2.5 b +++
MWR-1 0.0 c 0.0 c - MWR-2 0.0 c 0.0 c - MWR-3 20.0 a 4.0 a ++++
---
Koefisien variasi (CV, %) 9.39 8.64
==========================================================
Keterangan: PAMK – persentase antera membentuk kalus (%), JK – jumlag antera yang membentuk kalus. Skor kalus: - tidak ada kalus, + - sedikit kalus, kurang dari 25% dari total eskplan, ++ - kalus agak banyak, 25-50% total eksplan, +++ - kalus banyak, >50% total eksplan. Angka rataan yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak adanya perbedaan yang nyata menurut uji wilayah berganda Duncan pada taraf kepercayaan 5%.
Teknik isolasi dan optimasinya
Pengaruh teknik isolasi dan jenis agar terhadap pembentukan kalus
Perbaikan teknik isolasi antera dan pemanfaatan jenis agar yang berbeda memberikan pengaruh terhadap pembentukan kalus (Lampiran 3), meskipun pengaruh interaksi yang nyata tidak ditemukan. Perbaikan teknik isolasi me lalui penekanan dinding setengah antera untuk mengeluarkan sebagian sel mikrospora yang ada di dalamnya (TI-2) tidak memberikan pengaruh nyata terhadap pembentukan kalus. Perlakuan tersebut justru menekan pembentukan kalus. Perlakuan tersebut diduga menyebabkan stress eksplan yang ditandai dengan meningkatnya jumlah antera yang menjadi coklat dan mati, serta kontaminasi eksplan oleh bakteri.