Utama. Halaman 131 – 132. Lampiran 1. Gambar Sampel
1.Sampel Minuman Berenergi merek Kratingdaeng-S®
Lampiran 2.Spesifikasi Sampel Spesifikasi sampel:
Minuman Berenergi Merek Kratingdaeng-S®
Minuman Berenergi Merek Hemaviton®
Taurine 800 mg Taurine 1000 mg
Glucoronolactone 1,3,7 Trimethylxanthine 50 mg
Kafein 50 mg Inositol 50 mg
Inositol 50 mg Ginseng extract 10 mg
Niasin 20 mg Nicotinamide 20 mg
Panotenat 5 mg Vitamin B6 5 mg
Vitamin B6 5 mg Dexpanthenol 5 mg
Sukrosa 25 g Vitamin B12 5 mcg
Air Mengandung gula alami dan sorbitol
Natrium Benzoat Tartrazin Cl 19140
Sampel
Kratingdaeng-S® Hemaviton®
Nomor Bets Tanggal Kadaluarsa
Nomor Bets Tanggal Kadaluarsa 1 498A112 H 10 Februari 2016 07545407:58 Juli 2016 2 498A112 H 10 Februari 2016 075454 07:58 Juli 2016 3 498A112 H 10 Februari 2016 075454 07:58 Juli 2016 4 498A112 H 10 Februari 2016 075454 07:58 Juli 2016 5 498A112 H 10 Februari 2016 075454 07:58 Juli 2016 6 498A112 H 10 Februari 2016 075454 07:58 Juli 2016
Panjang gelombang maksimum bahan-bahan dalam sampel: Bahan Panjang gelombang
maksimum (nm)
Rujukan
Taurine 570 Draganov, dkk., 2014
Kafein 273 Moffat, dkk., 2005
Inositol 261 Moffat, dkk., 2005
Niasinamid 261 Moffat, dkk., 2005
Vitamin B6 290 Moffat, dkk., 2005
Vitamin B12 361 Moffat, dkk., 2005
Sukrosa 190 Sumantri, dkk., 2013
Natrium Benzoat 230 Moffat, dkk., 2005
Asam sitrat 520 Napitupulu, 2011
Ponceau 4R 506 Kartadarma, dkk., 2007
Vitamin B5 200 Engel, 2009
Lampiran 3. Hasil Uji Kualitatif Vitamin C pada sampel Kratingdaeng-S® dan Hemaviton®
1. Uji Kualitatif sampel Kratingdaeng-S® dengan pembanding Baku Vitamin C BPFI
2. Uji Kualitatif sampel Hemaviton® dengan pembanding Baku Vitamin C BPFI
Analit Sebelum Penambahan NaOH + FeCl3
Setelah Penambahan NaOH + FeCl3
Baku Vitamin C
(a) Larutan kuning lemah
Terbentuk endapan ungu tua
Kratingdaeng-S®
(b) Larutan kuning terang Terbentuk endapan ungu a
b
c
Hasil Uji Kualitatif dengan Pembanding warna Baku Vitamin C
Lampiran 4.Gambar Alat Spektrofotometer Ultraviolet (UV) Hemaviton®
Lampiran 5. Perhitungan Pembuatan HCl 0,1N
HCl pekat = 37% setara dengan 12 N V1 x N1 = V2 x N2
V1 x 12 N = 1000 mL x 0,1 N
V1 = 12N
N 1 , 0
mL 1000
x
Lampiran 6. Bagan Alir Prosedur Penelitian
dimasukkan ke labu 10 mL
dimasukkan ke labu 10 mL
dimasukkan ke labu 10 mL
dimasukkan ke
labu 10 mL dimasukkan ke labu 10 mL
dimasukkan ke labu 10 mL diambil 2,8 mL diambil 2,5 mL
dimasukkan ke dalam labu tentukur 25 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
LIB II Kafein 100 μg/mL
Standar 1 8 μg/mL Standar 2 12 μg/mL Standar 3 16 μg/mL Standar 4
20 μg/mL 24 μg/mLStandar 5
diambil 0,8 mL diambil 1,2 mL diambil 1,6 mL
diambil 2 mL diambil 2,4 mL diukur serapan
maksimumpada λ 200-400nm
Standar 6 28 μg/mL Kafein BPFI
ditimbang 25 mg
dimasukkan ke dalam labu tentukur 25 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
Lampiran 6. (Lanjutan)
dimasukkan ke labu 10 mL dimasukkan ke
labu 10 mL
dimasukkan ke labu 10 mL
diambil 4,8 mL diambil 2,5 mL
dimasukkan ke dalam labu tentukur 25 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
LIB II vitamin C 100 μg/mL
Standar 1
8 μg/mL 16 μg/mLStandar 2 24 μg/mLStandar 3
diambil 0,8 mL diambil 1,6 mL diambil 2,4 mL
diambil 3,2 mL diambil 4 mL diukur serapan
maksimum pada λ 200-400nm
Vitamin C BPFI
ditimbang 25 mg
dimasukkan ke dalam labu tentukur 25 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
Lampiran 6. (Lanjutan)
Persamaan regresi
dibuat kurva kalibrasi Larutan Standar Kafein
(8; 12; 16; 20; 24; 28μg/mL)
diukur serapan pada λ 200-400 nm ditransformasikan ke serapan derivat pertama
ditransformasikan ke serapan derivat kedua
ditentukan zero crossing ditentukan panjang gelombang analisis
Lampiran 6. (Lanjutan)
Persamaan regresi vitamin C
dibuat kurva kalibrasi Larutan Standar Vitamin C
(8; 16; 24; 32; 40; 48μg/mL)
diukur serapan pada λ 200-400 nm ditransformasikan ke serapan derivat pertama
ditransformasikan ke serapan derivat kedua
ditentukan zero crossing ditentukan panjang gelombang analisis
Lampiran 6. (Lanjutan)
Sampel
diambil 25 mL
dimasukkan ke dalam beaker gelas disaring
dibuang filtrat pertama diambil 1 mL
dimasukkan ke dalam labu tentukur 25 mL dilarutkan dan dicukupkan dengan HCL 0,1N diukur pada λ 293,4 nm (kafein)
diukur pada λ 214 nm (vitamin C)
Absorbansi
Kandungan kafein dan vitamin C
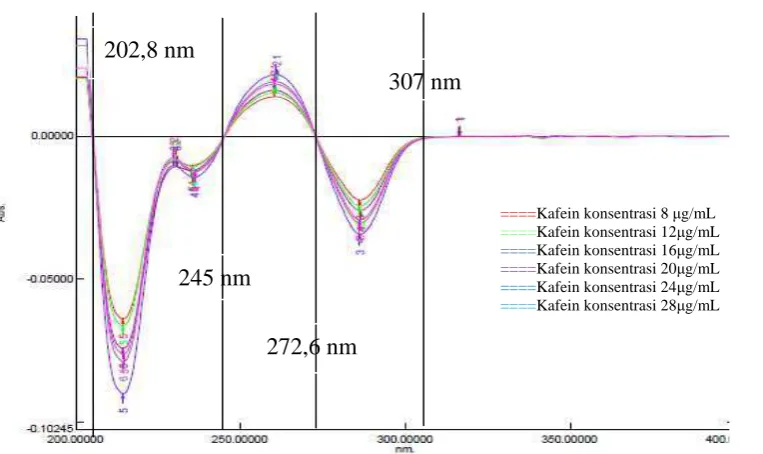
Lampiran 7. Kurva Serapan Kafein dan Vitamin C
Gambar 7.1Kurva serapan kafein konsentrasi 8 μg/mL
Gambar 7.3Kurva serapan kafein konsentrasi 16 μg/mL Lampiran 7. (Lanjutan)
Gambar 7.4Kurva serapan kafein konsentrasi 20 μg/mL
Gambar 7.6Kurva serapan kafein konsentrasi 28 μg /mL
Lampiran 7. (Lanjutan)
Gambar 7.8Kurva serapan vitamin Ckonsentrasi 16 μg /mL
Gambar 7.9Kurva serapan vitamin Ckonsentrasi 24μg /mL Lampiran 7. (Lanjutan)
Gambar 7.11Kurva serapan vitamin Ckonsentrasi 40 μg /mL
Gambar 7.12Kurva serapan vitamin Ckonsentrasi 48μg /mL
Gambar 8.1Kurva serapan derivat pertama kafein konsentrasi 8 μg /mL
Gambar 8.2Kurva serapan derivat pertama kafein konsentrasi 12 μg /mL
Gambar 8.4 Kurva serapan derivat pertama kafein konsentrasi 20 μg /mL
Gambar 8.5 Kurva serapan derivat pertama kafein konsentrasi 24 μg /mL
Gambar 8.7 Kurva serapan derivat pertama vitamin C konsentrasi 8 μg /mL
Gambar 8.8 Kurva serapan derivat pertama vitamin C konsentrasi 16 μg /mL
Gambar 8.10 Kurva serapan derivat pertama vitamin C konsentrasi 32 μg /mL
Gambar 8.11 Kurva serapan derivat pertama vitamin C konsentrasi 40 μg /mL
Gambar 9.1Kurva serapan derivat kedua kafein konsentrasi 8 μg /mL
Gambar 9.2Kurva serapan derivat kedua kafein konsentrasi 12 μg /mL
Gambar 9.4Kurva serapan derivat kedua kafein konsentrasi 20 mcg /mL
Gambar 9.5Kurva serapan derivat kedua kafein konsentrasi 24 μg /mL
Lampiran 9.(Lanjutan)
Gambar 9.7Kurva serapan derivat kedua vitamin C konsentrasi 8 mcg /mL
Gambar 9.9Kurva serapan derivat kedua vitamin C konsentrasi 24 μg /mL Lampiran 9.(Lanjutan)
Gambar 9.10Kurva serapan derivat kedua vitamin C konsentrasi 32 μg /mL
Gambar 9.12Kurva serapan derivat kedua vitamin C konsentrasi 48 μg /mL Lampiran 10. Kurva Serapan Panjang Gelombang Analisis
Lampiran 10. (Lanjutan)
Lampiran 11. Data Kalibrasi Kafein BPFI, Persamaan Regresi dan Koefisien Korelasi
Kalibrasi Serapan Derivat Kedua Kafein pada Panjang Gelombang 293,4 nm No. Konsentrasi (μg/mL)(X) Absorbansi(Y)
1. 0,0000 0,00000
2. 8,0000 0,00237
3. 12,0000 0,00378
4. 16,0000 0,00489
5. 20,0000 0,00612
6. 24,0000 0,00736
7. 28,0000 0,00860
Perhitungan Persamaan Garis Regresi
No. X Y XY X2` Y2
1. 0,0000 0,00000 0,0000 0,0000 0,000000000 2. 8,0000 0,00237 0,01896 64,0000 0,000005617 3. 12,0000 0,00378 0,04536 144,0000 0,000014288 4. 16,0000 0,00489 0,07824 256,0000 0,000023912 5. 20,0000 0,00612 0,12240 400,0000 0,000037454 6. 24,0000 0,00736 0,17664 576,0000 0,000054169 7. 28,0000 0,00860 0,24080 784,0000 0,000073960
ΣX = 108
X� =15,42857
ΣY = 0,03312
Y
� = 0,00473
ΣXY = 0,6824
ΣX2
=2224
Σ Y2 = 0,000209400
�
=
(
∑ ��
)
−
(
∑ �
)(
∑ �
)/
�
(
∑ �
2)
−
(∑ �)2�
=
(0,6824)
−
(108)(0,03312)/7
(2224)
−
(108)²/7
= 30,73 . 10−5
��= ���+�
�= �� − ���= (0,00473)−(307,3 . 10−6)(15,42857) = −1. 10−5
Perhitungan Koefisien Korelasi(r)
r
=
(∑ ��)−(∑ �)(∑ �)/���(∑ �2)−(∑ �)2/���(∑ �2)−(∑ �)2/��
Lampiran 11. (Lanjutan)
r
=
(0,6824) – (108)(0,03312) /7�[(2224)−(108)2/7]�0,000209400−(0,03312)2/7�
r
=
0,171410,17147
r = 0,9996
Lampiran 12. Data KalibrasiVitamin C, Persamaan Regresi dan Koefisien Korelasi
Kalibrasi Serapan Derivat Kedua Vitamin C pada Panjang Gelombang214 nm No. Konsentrasi (μg/mL)(X) Absorbansi(Y)
1. 0,0000 0,00000
2. 8,0000 0,00089
3. 16,0000 0,00185
4. 24,0000 0,00282
5. 32,0000 0,00366
6. 40,0000 0,00452
7. 48,0000 0,00547
Perhitungan Persamaan Garis Regresi
No. X Y XY` X2 Y2
1. 0,0000 0,00000 0,0000 0,0000 0,0000
2. 8,0000 0,00089 0,00712 64,0000 7,92.10-7 3. 16,0000 0,00185 0,02960 256,0000 34,22.10-7 4. 24,0000 0,00282 0,06768 576,0000 79,52.10-7 5. 32,0000 0,00366 0,11712 1024,0000 133,95.10-7 6. 40,0000 0,00452 0,18080 1600,0000 204,30.10-7 7. 48,0000 0,00547 0,26256 2304,0000 299,21.10-7
ΣX = 168
X� =24
ΣY = 0,01921
Y
� = 0,00274
ΣXY = 0,66488 ΣX2 = 5824 ΣY2 = 75,91.10-7
�
=
(
∑ ��
)
−
(
∑ �
)(
∑ �
) /
�
(
∑ �
2)
−
(
∑ �
)
2/
�
=
(
0,66488)
−
(168)(
0,01921)/7
(
5824)
−
(168
2)/7
=
11. 10−5��= ���+�
�= �� − ���= (0,00274)−(11. 10−5)(24) = 1. 10−5
Lampiran 12. (Lanjutan)
Perhitungan Koefisien Korelasi(r)
r
=
(∑ ��)−(∑ �)(∑ �)/���(∑ �2)−(∑ �)2/���(∑ �2)−(∑ �)2/��
r
=
(0,66488)−(168)(0,01921)/7�[(5824)−1682/7][(75,91.10−7)−(0,01921)2/7]
r = 0,20380
0,20387
r = 0,9996
Lampiran 13.Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Kafein
Persamaan garis regresinya adalah �= (30,73� −1) × 10−5
No. X Y Yi (10-5) Y-Yi (10-5) (Y-Yi)2 (10-10)
1. 0,0000 0,00000 1 -1 1
2. 8,0000 0,00237 244 -7 40
3. 12,0000 0,00378 367 -11 120
4. 16,0000 0,00489 491 -2 4
5. 20,0000 0,00612 613 -1 1
6. 24,0000 0,00736 736 0 0
7. 28,0000 0,00860 859 1 1
Σ(Y-Yi)2 167
��= �∑(�−��)
2
�−2
=
�167.10−10
7−2
=
5,77.10-5
���= 3 × �������
=
3 ×5,77.10−530,73.10−5
=
0,5632 μg/mL ���= 10 × �������
=
10 ×5,77.10−5
Lampiran 14. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Vitamin C
Persamaan garis regresinya adalah �= (11� +1) x 10−5
No. X Y Yi (10-5) Y-Yi (10-5) (Y-Yi)2 (10-10)
1. 0,0000 0,00000 1 -1 1
2. 8,0000 0,00089 89 0 0
3. 16,0000 0,00185 177 8 64
4. 24,0000 0,00282 265 17 289
5. 32,0000 0,00366 353 13 169
6. 40,0000 0,00452 441 11 121
7. 48,0000 0,00547 529 18 324
Σ (Y-Yi)2 968
��= �∑(�−��)
2
�−2
=
�968.10−10
7−2
=
13,9 .10-4
���= 3 × �� �����
=
3 × 13,9 .10−4
11.10−5
=
3,7936 μg/mL���= 10 × �� �����
=
10 × 13,9 .10−4
Lampiran 15. Kurva Serapan Derivat Kedua Sampel
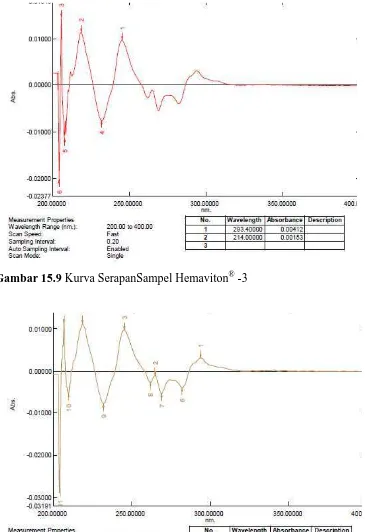
[image:33.595.126.502.397.668.2]Gambar 15.1Kurva Serapan Sampel Kratingdaeng-S® -1
Lampiran 15. (Lanjutan)
Gambar 15.3 Kurva Serapan Sampel Kratingdaeng-S® -3
[image:34.595.123.500.319.673.2]Lampiran 15. (Lanjutan)
Gambar 15.5 Kurva Serapan Sampel Kratingdaeng-S® -5
Lampiran 15. (Lanjutan)
Gambar 15.8 Kurva SerapanSampel Hemaviton® -2
[image:37.595.119.484.158.690.2]Lampiran 15. (Lanjutan)
Gambar 15.10 Kurva SerapanSampel Hemaviton® -4
Lampiran 15. (Lanjutan)
Gambar 15.12 Kurva SerapanSampel Hemaviton® -6
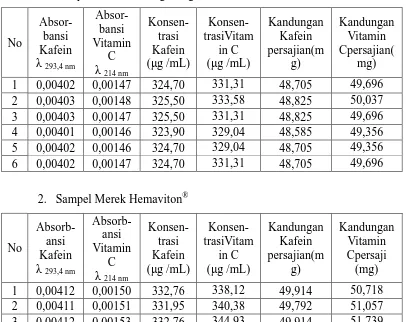
Lampiran 16.Hasil Analisis Kandungan Jumlah Kafeindan Vitamin Cdalam Sampel
1. Sampel Merek Kratingdaeng-S®
No
Absor-bansi Kafein λ 293,4 nm
Absor-bansi Vitamin
C λ 214 nm
Konsen-trasi Kafein (μg /mL)
Konsen-trasiVitam
in C (μg /mL)
Kandungan Kafein persajian(m g) Kandungan Vitamin Cpersajian( mg) 1 0,00402 0,00147 324,70 331,31 48,705 49,696 2 0,00403 0,00148 325,50 333,58 48,825 50,037 3 0,00403 0,00147 325,50 331,31 48,825 49,696 4 0,00401 0,00146 323,90 329,04 48,585 49,356 5 0,00402 0,00146 324,70 329,04 48,705 49,356 6 0,00402 0,00147 324,70 331,31 48,705 49,696
2. Sampel Merek Hemaviton®
No
Absorb-ansi Kafein λ 293,4 nm
Absorb-ansi Vitamin
C λ 214 nm
Konsen-trasi Kafein (μg /mL)
Konsen-trasiVitam
in C (μg /mL)
Lampiran 17.Contoh Perhitungan Kandungan Kafein dan Vitamin C dalamSampelKratingdaeng-S®
Volume sampel 1 yang digunakan = 1 mL
Absorbansi analisis (Y) kafein (293,4 nm)= 0,00402
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang kafein pada λ293,4 nm : Y = 30,73X – 1 . 10-5
Sehingga untuk mendapatkan kadar (X) sampel, digunakan subtitusi Yterhadappersamaan regresi pada masing-masing panjang gelombang.
Konsentrasi Kafein : Y = (30,73X – 1). 10-5 0, 00402 = (30,73X – 1) . 10-5
(30,73.10-5 )X = 0,00403
X = 13,1142 μg /mL Kandungan kafein dalam sampel : �×�×��
�
C : konsentrasi larutan sampel (μg /mL) V : volume larutan pengenceran (mL) Fp : faktor pengenceran
W : volume sampel (mL)
Kandungan kafein dalam sampel = 13,1142μg /mL× 25 mL × 1 1 mL
= 327,85 mcg/mL
= 324,70 μg /mL Lampiran 17.(Lanjutan)
Volume sampel Kratingdaeng-S®= 150 mL
Jumlah Kandungan kafein = Kandungan kafein sebenarnya x volume sampel = 324,70 μg /mL x 150 mL
= 48705 μg = 48,705 mg Absorbansi analisis vitamin C (214 nm) = 0,00147
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang vitamin C pada λ 214 nm : Y = (11X+1) . 10-5
Konsentrasi Vitamin C : Y = (11X+1) . 10-5 0, 00147 = (11X+1) . 10-5 (11.10-5 )X = 0,00146
X = 13,2727μg /mL
Kandungan Vitamin C dalam sampel : ����
�
C : konsentrasi larutan sampel (μg /mL) V : volume larutan pengenceran (mL) Fp : faktor pengenceran
W : volume sampel (mL)
KandunganVitamin C dalam sampel = 13,2727 μg /mL × 25 mL × 1 1 mL
= 331,81 μg /mL
KandunganVitamin C sebenarnya = KandunganVitamin C dalam sampel x persen baku Vitamin C
= 331,31μg /mL
Lampiran 17.(Lanjutan)
Volume sampel Kratingdaeng-S®= 150 mL
Jumlah Kandungan Vitamin C = KandunganVitamin C sebenarnya x volume sampel
= 331,31 μg /mL x 150 mL = 49696 μg
Lampiran 18.Contoh Perhitungan Kandungan Kafein dan Vitamin C dalamSampel Hemaviton®
Volume sampel 1 yang digunakan = 1 mL
Absorbansi analisis (Y) kafein (293,4 nm)= 0,00412
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang kafein pada λ293,4 nm: Y = 30,73X – 1 . 10-5
Sehingga untuk mendapatkan kadar (X) sampel, digunakan subtitusi Y terhadap persamaan regresi pada masing-masing panjang gelombang.
Konsentrasi Kafein : Y = (30,73X – 1). 10-5 0, 00412 = (30,73X – 1) . 10-5
(30,73.10-5 )X = 0,00413
X = 13,4396μg /mL
Kandungan kafein dalam sampel : ����
�
C : konsentrasi larutan sampel (μg /mL) V : volume larutan pengenceran (mL) Fp : faktor pengenceran
W : volume sampel (mL)
Kandungan kafein dalam sampel = 13,4396μg /mL× 25 mL × 1 1 mL
Lampiran 18.(Lanjutan)
Kandungan kafein sebenarnya = Kandungan kafein dalam sampel x persen baku = 327,85 μg /mL x 99,04%
= 332,76μg /mL
Volume sampel Kratingdaeng-S®= 150 mL
Jumlah Kandungan kafein = Kandungan kafein sebenarnya x volume sampel = 332,76μg /mL x 150 mL
= 49914μg = 49,914 mg
Absorbansi analisis vitamin C (214 nm) = 0,00150
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang vitamin C pada λ 214 nm: Y = (11X+1) . 10-5
Konsentrasi Vitamin C : Y = (11X+1) . 10-5 0, 00150 = (11X+1) . 10-5 (11.10-5 )X = 0,00149
X = 13,5454 μg /mL
Kandunganvitamin C dalam sampel : ����
�
Fp : faktor pengenceran W : volume sampel (mL) Lampiran 18.(Lanjutan)
Kandungan vitamin C dalam sampel = 13,5454 μg /mL× 25 mL × 1 1 mL
= 338,63μg /mL
Kandungan vitamin C sebenarnya= Kandungan vitamin C dalam sampel x persen baku vitamin C
= 338,63μg /mL x 99,85% = 338,12 μg /mL
Volume sampel Kratingdaeng-S®= 150 mL
Jumlah kandunganvitamin C = Kandungan vitamin C sebenarnya x volume sampel = 338,12μg /mL x 150 mL
Lampiran 19.Perhitungan Statistik Kandungan Kafein dan Vitamin C dalamSampel Merek Kratingdaeng-S®
1. Kafein
No. X
Kadar (mg) (� − �) (� − � )
2
1 48,705 -0,02 0,0004
2 48,825 0,1 0,01
3 48,825 0,1 0,01
4 48,585 -0,14 0,0196
5 48,705 -0,02 0,0004
6 48,705 -0,02 0,0004
�= 48,725 Σ(� − �)2= 0,0408
SB =
�
∑��−�� 2�−1
=
�
0,04086−1
=
�
0,04085
=
0,0903Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel
t hitung 1 =
�
�−��� √�⁄
�
=
�
−0,02
0,0903⁄√6
�
= 0,5425 t hitung 2 =�
�−��� √�⁄
�
=
�
0,1
0,0903⁄√6
�
= 2,7126 t hitung 3 =�
�−��� √�⁄
�
=
�
0,1
t hitung 4 =
�
�−��� √�⁄
�
=
�
−0,14
0,0903⁄√6
�
= 3,7976Lampiran 19.(Lanjutan)
t hitung 5 =
�
�−��� √�⁄
�
=
�
−0,02
0,0903⁄√6
�
= 0,5425 t hitung 6 =�
�−��� √�⁄
�
=
�
−0,02
0,0903⁄√6
�
= 0,5425Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kandungan kafein dalam sampel merek Kratingdaeng-S®: μ = � ± (tα/2, dk) x SB/√n)
= 48,725 mg ± (4,0321 x 0,0903/√6) = 48,725 mg ± (4,0321 x 0,0368) = (48,725± 0,14) mg
2. Vitamin C
No. X
Kadar (mg) (� − �) (� − �)
2
1 49,696 0 0
2 50,037 0,341 0,1162
3 50,037 0,341 0,1162
4 49,356 -0,34 0,1156
5 49,356 -0,34 0,1156
6 49,696 0 0
�= 49,696 Σ(� − �)2=0,4636
SB =
�
∑��−�� 2=
�0,46366−1
=
0,3044Lampiran 19.(Lanjutan)
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1=5,maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel
t hitung 1 =
�
�−��� √�⁄
�
=
�
0
0,3044⁄√6
�
= 0 t hitung 2 =�
�−��� √�⁄
�
=
�
0,341
0,3044⁄√6
�
= 2,7440 t hitung 3 =�
�−��� √�⁄
�
=
�
0,341
0,3044⁄√6
�
= 2,7440t hitung 4 =
�
�−��� √�⁄
�
=
��
−0,34
0,3044⁄√6
��
= 2,7359t hitung 5 =
�
�−��� √�⁄
�
=
��
−0,34
0,3044⁄√6
��
= 2,7359t hitung 6 =
�
�−��� √�⁄
�
=
�
0
0,3044⁄√6
�
= 0Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kandungan vitamin C pada sampel merek Kratingdaeng-S® : μ = � ± (tα/2, dk) x SB/√n)
Lampiran 20.Perhitungan Statistik Kandungan Kafein danVitamin C dalamSampel Merek Hemaviton®
1. Jumlah Kafein
No. X
Kadar (mg) (� − �) (� − �)
2
1 49,914 0,101 0,0102
2 49,792 -0,021 0,0004
3 49,914 0,101 0,0102
4 49,672 -0,141 0,0198
5 49,672 -0,141 0,0198
6 49,914 0,101 0,0102
�= 49,813 Σ(� − �)2= 0,0706
SB =
�
∑��−�� 2�−1
=
�0,07066−1
=
0,1188Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1=5, maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel
t hitung 1 =
�
�−��� √�⁄
�
=
�
0,101
0,1188⁄√6
�
= 2,0824 t hitung 2 =�
�−��� √�⁄
�
=
�
−0,021
0,1188⁄√6
�
= 0,4329t hitung 3 =
�
�−��� √�⁄
�
=
�
0,101
0,1188⁄√6
�
= 2,0824t hitung 4 =
�
�−��� √�⁄
�
=
�
−0,141
t hitung 5 =
�
�−��� √�⁄
�
=
�
−0,141
0,1188⁄√6
�
= 2,9072Lampiran 20.(Lanjutan)
t hitung 6 =
�
�−��� √�⁄
�
=
�
0,101
0,1188⁄√6
�
= 2,0824Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Jumlah kandungan kafein dalam sampel merek Hemaviton® : μ = � ± (tα/2, dk) x SB/√n)
= 49,813 mg ± (4,0321 x 0,1188/√6) = (49,813 ± 0,1955) mg
2. Jumlah Vitamin C
No. X
Kadar (mg) (� − �) (� − �)
2
1 50,718 -0,623 0,3881
2 51,057 -0,284 0,0806
3 51,739 0,398 0,1584
4 51,399 0,058 0,0033
5 51,739 0,398 0,1584
6 51,399 0,058 0,0033
�= 51,341 Σ(� − �)2=0,7921
SB =
�
∑��−�� 2�−1
=
�
0,79216−1
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1=5, maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel Lampiran 20.(Lanjutan)
t hitung 1 =
�
�−��� √�⁄
�
=
�
−0,623
0,3980⁄√6
�
= 3,8342 t hitung 2 =�
�−��� √�⁄
�
=
�
−0,284
0,3980⁄√6
�
= 1,7478 t hitung 3 =�
�−��� √�⁄
�
=
�
0,398
0,3980⁄√6
�
= 2,4494 t hitung 4 =�
�−��� √�⁄
�
=
�
0,058
0,3980⁄√6
�
= 0,3569 t hitung 5 =�
�−��� √�⁄
�
=
�
0,398
0,3980⁄√6
�
= 2,4494 t hitung 6 =�
�−��� √�⁄
�
=
�
0,058
0,3980⁄√6
�
= 0,3596Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Jumlah kandungan vitamin C pada sampel merek Hemaviton®: μ = � ± (tα/2, dk) x SB/√n)
Lampiran 21. Kurva Serapan Uji Perolehan Kembali Kafein dan Vitamin C dalam Sampel Kratingdaeng-S®
Gambar 21.2Kurva Serapan Uji Perolehan KembaliKafein dan Vitamin C dalam Sampel Kratingdaeng-S® -2
Lampiran 21.(Lanjutan)
Gambar 21.4 Kurva Serapan Uji Perolehan KembaliKafein dan Vitamin C dalam Sampel Kratingdaeng-S® -4
Lampiran 21.(Lanjutan)
Gambar 21.6Kurva Serapan Uji Perolehan KembaliKafein dan Vitamin C dalam Sampel Kratingdaeng-S® -6
Lampiran 22. Hasil Uji Perolehan Kembali Kafein dan Vitamin C Setelah Penambahan Masing-Masing Larutan Standar Pada Sampel Kratingdaeng-S®
1. Hasil Analisis Kafein Setelah Penambahan Larutan Standar Kafein
Sampel
Serapan λ 293,4
nm
Konsentrasi (μg /mL)
Persen Perolehan Kembali (%) Setelah penambahan Baku (μg /mL)
Sebelum penambahan
Baku (μg /mL)
Baku yang ditambahkan
(μg /mL)
1 0,00783 632,49 324,70 330 93,23
2 0,00785 633,30 325,50 330 93,47
3 0,00786 634,10 325,50 330 93,71
4 0,00785 633,30 323,90 330 93,47
5 0,00784 632,48 324,70 330 93,22
6 0,00784 632,48 324,70 330 93,22
X
�= 93,38
Sampel
Serapan λ 214
nm
Konsentrasi (μg /mL)
Persen Perolehan Kembali (%) Setelah penambahan Baku (μg /mL)
Sebelum penambahan
Baku (μg /mL)
Baku yang ditambahkan
(μg /mL)
1 0,00282 637,67 331,31 330 92,95
2 0,00285 644,48 333,58 330 95,01
3 0,00285 644,48 331,31 330 95,01
4 0,00281 635,40 329,04 330 92,26
5 0,00284 642,21 329,04 330 94,32
6 0,00282 637,67 331,31 330 92,95
X
�= 93,75
Lampiran 23. Contoh Perhitungan Uji Perolehan Kembali dengan menggunakan Sampel Kratingdaeng-S®
Volume sampel 1 yang digunakan = 1 mL Absorbansi analisis (Y) :
Kafein (293,4 nm) = 0,00783 Vitamin C (214 nm) = 0,00282
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang kafein pada λ293,4 nm: Y = (30,73X – 1) . 10-5
Persamaan regresi pada absorbansi maksimum dengan panjang gelombang vitamin C pada λ214nm : Y = (11X + 1) . 10-5
0, 00783 = (30,73X – 1) . 10-5 X = 25,5125 μg /mL Konsentrasi Vitamin C: Y = (11X + 1) . 10-5
0, 00282 = (11X + 1) . 10-5 X = 25,5454 μg /mL
1. Perhitungan Uji Perolehan Kembali Kafein
Konsentrasi awal setelah penambahan larutan baku = 25,5125 μg /mL Konsentrasi = Konsentrasi (μg /mL )
Volume sampel (mL ) × volume (mL) × Faktor pengenceran
= 25,5125 μg /mL × 25 mL × 1 1 mL
= 638,63 μg /mL Lampiran 23.(Lanjutan)
CF = konsentrasi kafein x persen baku
= 638,63 μg /mL x 99,04% = 632,49 μg /mL
Kadar sampel setelah ditambah larutan baku (CF ) = 632,49 μg /mL
Kadar rata-rata sampel sebelum ditambah larutan baku (CA) = 324,83 μg /mL
Kadar larutan standar yang ditambahkan (C*A)
C*A =
Konsentrasi baku yang ditambahkan
Volume sampel
×
ml yang ditambahkan=
100 μg /mLMaka persen perolehan kembali kafein = CF − CA
CA∗
×
100%=
(632,49−324,83)μg /mL330 μg /mL
×
100% = 93,23%2. Perhitungan Uji Perolehan Kembali Vitamin C
Konsentrasi awal setelah penambahan larutan baku = 25,5454μg /mL Konsentrasi = Konsentrasi (μg /mL )
Volume sampel (mL ) × volume (mL) × Faktor pengenceran
Lampiran 23. (Lanjutan)
= 25,5454μg /mL× 25 mL × 1 1 mL
= 638,63 μg /mL
CF = kadar x persen baku
= 638,63 μg /mL x 99,85% = 637,67 μg /mL
Kadar sampel setelah ditambah larutan baku (CF ) = 637,67 μg /mL
Kadar rata-rata sampel sebelum ditambah larutan baku (CA) = 330,93 μg /mL
Kadar larutan standar yang ditambahkan (C*A)
C*A =
Konsentrasi baku yang ditambahkan
Volume sampel
×
mL yang ditambahkan=
100 μg /mLMaka persen perolehan kembali Vitamin C = CF − CA
CA∗
×
100%=
�637,67–330,93�μg /mL330 μg /mL ×100% = 92,95%
Lampiran 24. Perhitungan Simpangan Baku Relatif (SBR) Kandungan Kafein No. Persen Perolehan Kembali
(Xi) (Xi - X� ) (Xi - X� )
2
1 93,23 -0,15 0,0225
2 93,47 0,09 0,0081
3 93,71 0,33 0,1089
4 93,47 0,09 0,0081
5 93,22 -0,16 0,0256
6 93,22 -0,16 0,0256
X
� = 93,38 ∑ = 0,0331
SB =
�
∑(Xi− X�) 2 n−1=
�
0,03315
= 0,0813 SBR = SB
X
= 0,0813
Lampiran 25. Perhitungan Simpangan Baku Relatif (SBR) Kandungan Vitamin C
No. Persen Perolehan Kembali
(Xi) (Xi - X� ) (Xi - X� )
2
1 92,95 -0,8 0,64
2 95,01 1,26 1,5876
3 95,01 1,26 1,5876
4 92,26 -1,49 2,2201
5 94,32 0,57 0,3249
6 92,95 -0,8 0,64
X
�= 93,75 ∑ = 1,1667
SB =
�
∑(Xi− X�) 2 n−1=
�
1,16675
= 0,4830
SBR = SB
X�x 100% = 0,4830
93,75x 100%
DAFTAR PUSTAKA
Badan POM RI. (2004). Ketentuan Pokok Pengawasan Suplemen Makanan. Jakarta: Badan Pengawas Obat dan Makanan RI. Halaman 3, 11.
Ditjen POM. (1979). Farmakope Indonesia Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 53.
Ditjen POM. (1995). Farmakope Indonesia Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 39, 254 - 255, 1067.
Cairns, D. (2008). Essentials of Pharmaceutical Chemistry. Third Edition. London: Pharmaceutical Press. Halaman 177 - 179.
Connors, K. A. (1982). Textbook of Pharmaceutical Analysis.Third Edition. New York: Willey - VCH. Halaman 171 - 222.
Draganov, G. B., Pencheva, I. P., and Todorova, K. A. (2014). UV – Spectrophotometry Determination of Taurine in Energy Drink Mixtures.International Journal of Nutrition and Food Sciences. 3(2): 123 - 126.
El-Sayed, Abdel-Aziz, Y., Hussein, Y.Z., Mohammed, M.A. (2001). Simultaneous Determination of Phosphate and Silicate by First-Derivative Spectrophotometry. Analytical Science. The Japan Society for Analytical Chemistry. 1(17): 1461-1464.
Engel, R. (2009). Development of Analytical Methods for Determination of Water Soluble Vitamins in Functional Foods Products. Tanggal Akses 24 Juli
Ermer, J., danMcB Miller, J. H. (2005). Method Validation in Pharmaceutical Analysis. A Guide to Best Practice. Weinheim: Willey – VCH. Halaman 69-70, 99, 117.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitugannya. Majalah Ilmu Kefarmasian. 1(3): 117 - 135.
Hayun., Harianto., dan Yenti. (2006). Penetapan Kadar Triprolidina Hidroklorida dan Pseudoefedrina Hidroklorida dalam Tablet Anti Influenza Secara Spektrofotometri Derivatif.Majalah Ilmu Kefarmasian. 3(1): 94 - 105. Karinda, M., Fatimawali., dan Citraningtyas, G. (2013). Perbandingan Hasil
Kartadarma, E., Nawawi, A., dan Halida. (2007). Penentuan Kuantitatif Zat Warna Karmoisin, Ponceau 4R Dan Merah Alura yang Ditambahkan dalam Minuman Angrem. Jurnal Teknologi dan Industri Pangan. 18(1): 67 - 71. Kartono, T. H. S. (1985). Pro dan Kontra Penggunaan Vitamin C Dosis Mega.
Dalam: Tjokronegoro, A., dan Utama, H. (1985). Vitamin C dan Penggunaannya Dewasa Ini. Jakarta: Fakultas Kedokteran Universitas Indonesia. Halaman 9 - 11.
Louisa, M., dan Dewoto, H. R. (2007). Perangsang Susunan Saraf Pusat. Dalam: Gunawan, S. G., Setiabudi, Rianto., Nafrialdi., Elysabeth. (2007). Farmakologi dan Terapi Edisi 5. Jakarta: Departemen Farmakologi dan Terapeutik Fakultas Kedokteran UI. Halaman 252 - 253.
Melawati, T. (2004). Identifikasi dan Penentuan Kadar Berbagai Zat Gizi pada Teh Buah Kersen (Muntingia calabura L) dengan Variasi Metode Pengolahan. Jurnal FMIPA Universitas Negeri Yogyakarta. 1(3): 7 – 9. Moffat, A. C., Osselton, M. D., danWiddop, B. (2005). Clarke’s Analysis of Drug
and Poisons. Fourth Edition. London: Pharmaceutical Press. Halaman 965, 1028, 1173, 1521, 1772, 1988, 2017, 2038, 2142.
Munson, J. W. (1984). Pharmaceutical Analysis Modern Methods – Part B. Penerjemah: Harjana, dan Soemadi. (1991). Analisis Farmasi Metode Modern - Bagian B. Surabaya: Airlangga University Press. Halaman 385. Napitupulu, P. M. (2011). Pemisahan dan Penentuan Kadar Asam Sitrat Dari
Buah Asam Jawa (Tamarindus indica. L.). Tanggal Akses 24 Juli 2014.
Nersyanti, F. (2006). Spektrofotometri Derivatif Ultraviolet untuk Penentuan Kadar Kafein dalam Minuman Suplemen dan Ekstrak Teh. Jurnal Kefarmasian Indonesia. Tanggal Akses 8 Desember 2014. http://repository.ipb.ac.id/handle/123456789/46158.
Nurhidayati, L. (2007). Spektrofotometri Derivatif dan Aplikasinya dalam Bidang Farmasi. Jurnal ilmu Kefarmasian Indonesia. 5(2): 93 - 99.
Owen, A. J. (1995). Uses of Derivative Spectroscopy Aplication Note UV - Visible Spectroscopy. HP Way: Agilent Technologies. Halaman 168.
Owen, T. (2000). Fundamentals of ModernUV-Visible Spectroscopy - Primer. HP Way: Agilent Technologies. Halaman 9,10, 20, 21, 36.
Safitri, M. (2007). Metode Cepat Penentuan Simultan Kadar Kafein, Vitamin B2, dan B6 dalam Minuman Berenergi dengan Teknik Zero-Crossing. Skripsi. Bogor: FMIPA Institut Pertanian Bogor.
Satiadarma, K., Mulja, M., Tjahjono, D. H., Kartasasmita, R. E. (2004). Asas Pengembangan Prosedur Analisis. Edisi Pertama. Surabaya: Airlangga University Press. Halaman 49, 87 - 93.
Standar Nasional Indonesia (SNI). (2002). SNI 01-6684-2002. Minuman Berenergi. Jakarta: BSN. Halaman 2.
Sudjana. (2005). Metode Statistika. Bandung: Penerbit Tarsito. Halaman 93, 145, 201, 225.
Sumantri., Budiarti, A., dan Parameita, I. (2013). Perbandingan Kadar Sukrosa dalam Madu Randu dan Madu Kelengkeng dari Peternak Lebah dan Madu Perdagangan di Kota Semarang. Tanggal Akses 24 Juli 2014. http://publikasiilmiah.unwahas.ac.id/index.php/ilmuFarmasidanklinik/artic le/view/867.
Talsky, G. (1994). Derivative Spectrophotometry. Low and Higher Order. Weinheim Germany: VCH Verlagsgesellschaft mbH. Halaman 16 - 43. Tan, H.J., dan Rahardja, K. (2007). Obat-obat Penting: Khasiat, Penggunaan, dan
Efek-Efek Sampingnya. Edisi Keenam. Jakarta: PT. Elex Media Komputindo. Halaman 373.
Tautua, A., Martin, W. B., dan Diepreye, E. R. E. (2013). Ultra-violet Spectrophotometric Determination of Caffeine in Soft and Energy Drinks Available in Yenagoa, Nigeria. Journal of Food Science and Technology. 6(2): 155 - 158.
Tjokronegoro, A. (1985). Vitamin C dan Penggunaannya Dewasa Ini. Jakarta: Fakultas Kedokteran Universitas Indonesia. Halaman 1 – 4.
Wardani, L. A. (2012). Validasi Metode Analisis dan Penentuan Kadar Vitamin C pada Minuman Buah Kemasan dengan Spektrofotometri UV-Visible. Tanggal Akses 8 Desember 2014. http//lib.ui.ac.id/file?file=digital/ 20289783.
Watson, D. G. (2005). Pharmaceutical Analysis: A Textbook for Pharmacy Students and Pharmaceutical Chemists. 2 edition. Penerjemah: Syarief, W.R. (2007). Analisis Farmasi: Buku Ajar Untuk Mahasiswa Farmasi dan Praktisi Kimia Farmasi. Edisi Kedua. Jakarta: EGC. Halaman 19.
BAB III
METODE PENELITIAN
3.1Jenis Penelitian
Jenis penelitian ini adalah penelitian deskriptif dengan metode spektrofotometri derivatif analisa terhadap dua zat yang terkandung dalam dua merek sampel minuman berenergi.
3.2Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara, dimulai dari April - Agustus 2014.
3.3Alat
Alat–alat yang digunakan dalam penelitian ini adalah spektrofotometer ultraviolet (UV-1800 Shimadzu) dengan Personal Computer (PC) menggunakan software UVProbe 2.43, neraca analitik (Mettler Toledo), kuvet, kertas saring, bola karet, spatula, alat-alat gelas dan alat-alat lainnya yang diperlukan dalam penyiapan sampel.
3.4Bahan-bahan
3.5 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif yaitu pengambilan sampel ditentukan atas dasar pertimbangan bahwa sampel yang diambil mempunyai karakteristik yang sama dengan sampel yang diteliti (Sudjana, 2005). Sampel yang digunakan pada penelitian ini adalah minuman berenergi dengan dua merek yaitu Kratingdaeng-S® dan Hemaviton®yang dibeli di Pasar Swalayan sekitar Universitas Sumatera Utara, Medan. Gambar dan spesifikasi sampel dapat dilihat pada Lampiran 1 dan 2 di halaman 59 dan 60.
3.6 Prosedur Penelitian 3.6.1 Pembuatan Pereaksi
Diencerkan 8,3 mL HCl 37% dengan 1 liter akuades (Ditjen POM, 1979). Perhitungan pembuatan pereaksi dapat dilihat pada Lampiran 5 halaman 63.
3.6.2 Uji Kualitatif
Dipipet sampel minuman berenergi 5 mL lalu diteteskan pada spot plate kemudian diteteskan NaOH sampai suasana basa, lalu diteteskan larutan FeCl3
hingga terjadi perubahan warna menjadi ungu. Hasil kualitatif dapat dilihat pada Lampiran 3 halaman 61.
3.6.3 Pembuatan Larutan Induk Baku
3.6.3.1 Pembuatan Larutan Induk Baku Kafein
Ditimbang dengan seksama 25 mg baku pembanding kafein kemudian dimasukkan ke dalam labu tentukur 25 mL, dilarutkan dengan HCl 0,1 N hingga larut, dicukupkan volume dengan HCl 0,1 N sampai garis tanda (LIB I) untuk
dipipet 2,5 mL dimasukkan ke dalam labu tentukur 25 mL, dicukupkan dengan HCl 0,1 N sampai garis tanda untuk mendapatkan larutan dengan konsentrasi 100 μg/mL (LIB II).
3.6.3.2 Pembuatan Larutan Induk Baku Vitamin C
Ditimbang dengan seksama 25mg baku pembanding vitamin Ckemudian dimasukkan ke dalam labu tentukur 25 mL, dilarutkan dengan HCl 0,1N hingga larut, dicukupkan volume dengan HCl 0,1 N sampai garis tandauntuk mendapatkan larutan dengan konsentrasi1000 μg/mL(LIB I)Dari larutan LIB I dipipet 2,5 mL dimasukkan ke dalam labu tentukur 25 ml, dicukupkan dengan HCl 0,1 N sampai garis tanda untuk mendapatkan larutan dengan konsentrasi 100 μg/mL (LIB II).
3.6.4 Pembuatan Spektrum Serapan Maksimum
3.6.4.1 Pembuatan Spektrum Serapan Maksimum Kafein
Dipipet 0,9 mL Larutan Induk Baku II kafein (konsentrasi100 μg/mL), dimasukkan ke dalam labu tentukur 10 mL, diencerkan dengan HCl 0,1 N hingga garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 9 μg/mL, kemudian diukur serapan pada panjang gelombang 200 - 400 nm.
3.6.4.2 Pembuatan Spektrum Serapan Maksimum Vitamin C
3.6.5 Pembuatan Spektrum Serapan Derivatif
3.6.5.1 Pembuatan Spektrum Serapan Derivatif Kafein
DipipetLarutan IndukBakuIIkafein(konsentrasi 100μg/mL)sebanyak0,8 mL; 1,2 mL; 1,6 mL; 2,0 mL; 2,4 mL; dan 2,8 mL.Masing-masing dimasukkan kedalamlabu tentukur10mL,diencerkan dengan HCl0,1N hingga garistanda.Laludikocok sampaihomogen sehinggadiperolehlarutan dengan konsentrasi8 μg/mL, 12 μg/mL, 16 μg/mL, 20 μg/mL dan 24μg/mL. Kemudiandibuat spektrum serapan,spektrumserapan derivatpertamadan derivat keduapadapanjanggelombang200 - 400nmdengan∆λ=4nm.
3.6.5.2 Pembuatan Spektrum Serapan Derivatif Vitamin C
DipipetLarutan IndukBakuIIvitamin C (konsentrasi 100μg/mL)sebanyak0,8 mL; 1,6 mL; 2,4 mL; 3,2 mL; 4,0 mL; dan 4,8 mL.Masing-masing dimasukkan kedalamlabu tentukur10mL,diencerkan dengan HCl0,1N hingga garistanda.Laludikocok sampaihomogen sehinggadiperolehlarutan dengan konsentrasi8 μg/mL, 16 μg/mL, 24 μg/mL, 32 μg/mL, 40 μg/mL dan 48μg/mL. Kemudiandibuat spektrum serapan,spektrumserapan derivatpertamadan derivat keduapadapanjanggelombang200 - 400nmdengan∆λ = 4nm.
3.6.6 Penentuan Zero Crossing
konsentrasi.
3.6.7 Penentuan Panjang Gelombang Analisis
Dibuat larutan kafein dengan konsentrasi 9μg/mL, larutan vitamin C dengan konsentrasi 8 μg/mL, serta larutan campuran kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL. Kemudian dibuat spektrum serapan derivat pertama dan derivat kedua dari kafein, vitamin C serta campuran kafein dan vitamin C lalu ditumpangtindihkan. Panjang gelombang analisis yang dipilih adalah pada saat serapan senyawa pasangannya nol dan serapan maksimum senyawa itu dan campurannya hampir sama atau persis sama, karena pada panjang gelombang tersebut dapat secara selektif mengukur serapan senyawa tersebut.
3.6.8 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi
Dibuat larutan kalibrasi kafein dengan konsentrasi 8 μg/mL, 12 μg/mL, 16 μg/mL, 20 μg/mL, 24 μg/mLdan 28 μg/mL, larutan kalibrasi vitamin C dengan konsentrasi 8 μg/mL, 16 μg/mL, 24 μg/mL, 32 μg/mL, 40 μg/mL,dan 48 μg/mL kemudian diukur serapan derivat kedua pada panjang gelombang analisisdan ditentukan persamaan regresi linear y = ax + b, berdasarkan nilai serapan pada panjang gelombang analisisnya, dilakukan pula perhitungan batas deteksi (limit of detection, LOD) dan batas kuantitasi (limit of quantitation, LOQ). Untuk menentukan batas deteksi (LOD) dan batas kuantitasi (LOQ) dapat digunakan rumus:
�� = �∑(�−��)2
���= 3��
���� � LOQ = 10��
�����
Keterangan: SB = Simpangan baku
LOD = Limit Of Detection, Batas deteksi LOQ = Limit Of Quantitation, Batas kuantitasi
3.6.9 Penentuan Jumlah Kandungan Kafein dan Vitamin C dalam Minuman Berenergi
Untuk penentuan jumlah kandungan sampel, digunakan dua merek minuman berenergi masing-masing sebanyak enam sampel dengan volume 150 mL/botol. Sebanyak 25 mL larutan diambil dari masing-masing sampel. Larutan selanjutnya disaring, lebih kurang 10 mL filtrat pertama dibuang, dan filtrat selanjutnya ditampung. Filtrat dipipet sebanyak 1 mL ke dalam labu tentukur 25 mL dan dicukupkan dengan larutan HCl 0,1 N, lalu dikocok sampai homogen. Larutan kemudian diukur absorbansinya pada serapan derivat kedua dengan panjang gelombang 293,4 nm untuk analisis kafein dan 214 nm untuk analisis vitamin C.
Konsentrasi kafein dan vitamin C dapat dihitung dengan rumus: Konsentrasi (μg/mL) = Konsentrasi pengukuran (μg/mL)×volume (mL )×F. Pengenceran
Volume Sampel (mL )
Jumlah kandungan kafein dan vitamin C yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis untuk mengetahui data ditolak atau diterima menggunakan uji distribusi t dengan rumus:
t hitung =�
X−X� SD /√n�
Untuk menentukan jumlah kandungan kafein dan vitamin C sebenarnya dalam sampel dengan interval kepercayaan 99%, α = 1%, dk = n-1, dapat digunakan rumus (Sudjana, 2005):
Jumlah kandungan zat: µ = X�± (t (α/2, dk) x SB/√n )
Keterangan : µ : jumlah kandungan sebenarnya
X
� : jumlah kandungan zat rata-rata sampel SB: simpangan baku
dk : derajat kebebasan (dk = n-1)
t : harga t tabel sesuai dengan dk = n-1 α: tingkat kepercayaan
n : jumlah pengulangan
3.6.10 Uji Validasi
Uji validasi yang dilakukan pada penelitian ini menggunakan uji akurasi dengan parameter persen perolehan kembali menggunakan metode penambahan baku (standard addition method) dan uji presisi menggunakan parameter simpangan baku relatif (Relative Standard Deviation, RSD).Persen perolehan kembali dapat dihitung dengan rumus (Harmita, 2004):
% perolehan kembali = CF −CA
CA∗ × 100 %
Keterangan: CF: Konsentrasi zat dalam sampel setelah penambahan larutan baku
CA : Konsentrasi zat dalam sampel sebelum penambahan larutan
baku
3.6.10.1 Uji Akurasi
Disiapkan larutan standar vitamin C dengan dengan cara dipipet 2,5 mL dari LIB I vitamin C dalam labu ukur 25 mL, kemudian dicukupkan dengan HCl 0,1 N untuk mendapatkan larutan standar vitamin C dengan konsentrasi 100μg/mL. Disiapkan juga larutan standar kafein dengan cara dipipet 2,5 mL kafein lalu dicukupkan dengan HCL 0,1 N dalam labu ukur 25 mL untuk mendapatkan konsentrasi 100 μg/mL. Disiapkan sampel dan diambil 1 mL sampel untuk dimasukkan ke dalam labu ukur 25 mL. Kemudian ditambahkan larutan standar vitamin C sebanyak 3,3 mL yang setara dengan konsentrasi 330 μg/mL. Ditambahkan juga 3,3 mL larutan standar kafein sehingga memperoleh konsentrasi 330 μg/mL. Selanjutnya labu dicukupkan dengan HCL 0,1 N dan diukur dengan menggunakan spektrofotometer ultraviolet. Hasil spektrum ditransformasikan menjadi derivat kedua dengan Δλ = 4 nm, kemudian dihitung persen perolehan kembali berdasarkan nilai absorbansi pada panjang gelombang analisis zat masing-masing.
3.6.10.2 Uji Presisi
Presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Presisi yang diukur menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
perhitungan antara persen perolehan kembali kafein dan vitamin C menggunakan rumus simpangan baku (SB) (Sudjana, 2005):
SB = �∑(X−X�)2 n−1
Keterangan : X : Jumlah kandungan zat dalam sampel
X
� : Jumlah kandungan zat rata-rata sampel n : Jumlah pengulangan
Simpangan baku relatif dapat dihitung dengan rumus di bawah ini: SBR = ��
� x 100%
Keterangan : � : Jumlah kandungan zat rata-rata sampel SB : Simpangan Baku
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penentuan Kurva Serapan Maksimum
Penentuan kurva serapan maksimum dilakukan pada panjang gelombang 200–400 nm. Untuk kafein pengukuran dilakukan pada konsentrasi 9 μg/mL, sedangkan untuk vitamin C pengukuran dilakukan pada konsentrasi 8 μg/mL. Berdasarkan hasil penelitian diperoleh panjang gelombang dengan absorbansi maksimum pada serapan biasa yaitu λ = 272,6 nm untuk kafein dan λ = 243,3 nm
dimana panjang gelombang tersebut mendekati absorbansi maksimum pada panjang gelombang kafein dan vitamin C menurut Moffat dkk., (2005), yaitu 273 nm untuk kafein dan 243 nm untuk vitamin C. Kurva serapan maksimum kafein konsentrasi 9 μg/mLdan vitamin C konsentrasi 8 μg/mLdapat dilihat pada Gambar 4.1 dan 4.2.
Gambar 4.1Kurva serapan maksimum kafein konsentrasi 9 μg/mL
Gambar 4.2Kurva serapan maksimum vitamin C konsentrasi 8 μg/mL
Berdasarkan pada gambar 4.1 dan 4.2 diatas, absorbansi maksimum pada panjang gelombang kafein dan vitamin C adalah 272,6 nm dan 243,3 nm secara berturut-turut. Kurva hasil penentuan absorbansi maksimum pada panjang gelombang tersebut selanjutnya digunakan untuk penentuan derivat kafein dan vitamin C.
4.2 Hasil Penentuan Kurva Serapan Kafein dan Vitamin C
Kurva serapan untuk larutan kafein dibuat dalam konsentrasi 8 μg/mL; 12 μg/mL; 16 μg/mL; 20 μg/mL; 24 μg/mL; dan 28 μg/mL dapat dilihat pada Lampiran 7 di halaman 52. Untuk larutan vitamin C dibuat dalam konsentrasi 8 μg/mL; 16 μg/mL; 24 μg/mL; 32 μg/mL; 40 μg/mL; dan 48 μg/mL dapat dilihat pada Lampiran 7 di halaman 69. Kurva serapan kafein dan vitamin C dalam berbagai konsentrasi dapat dilihat pada Gambar 4.3 dan 4.4.
Gambar 4.3 Kurva serapan kafein dalam berbagai konsentrasi
Gambar 4.4 Kurva serapan vitamin C dalam berbagai konsentrasi
4.3Hasil Penentuan Kurva Serapan Derivat 4.3.1Kurva Serapan Derivat Pertama
Berdasarkan pengukuran kurva serapan biasa dari larutan kafein dengan konsentrasi8 μg/mL; 12 μg/mL; 16 μg/mL; 20 μg/mL;24μg/mL dan 28 μg/mL dan larutan vitamin C dengan konsentrasi8 μg/mL; 16 μg/mL; 24 μg/mL;32 μg/mL; 40 μg/mL; dan 48 μg/mL. Pengukuran dilakukan pada masing-masing konsentrasi
==== Kafein konsentrasi 8 μg/mL
====Kafein konsentrasi 12μg/mL
====Kafein konsentrasi 16μg/mL
====Kafein konsentrasi 20μg/mL
====Kafein konsentrasi 24μg/mL
====Kafein konsentrasi 28μg/mL
==== Vitamin C konsentrasi 8 μg/mL
==== Vitamin C konsentrasi 16μg/mL
==== Vitamin C konsentrasi 24μg/mL
==== Vitamin C konsentrasi 32μg/mL
==== Vitamin C konsentrasi 40μg/mL
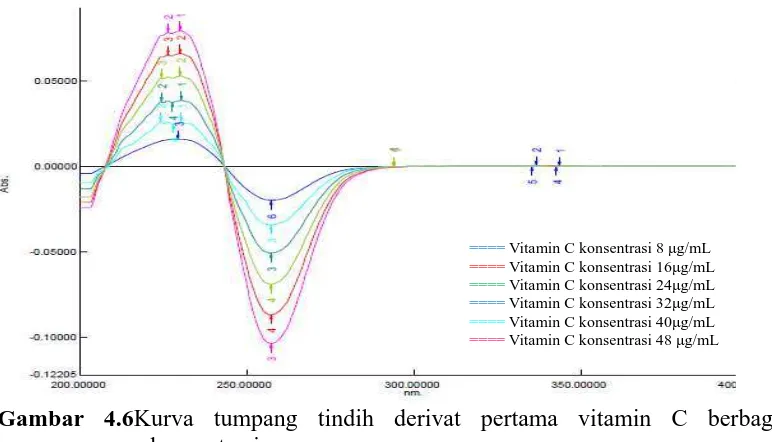
yang dilakukan pada panjang gelombang 200 – 400 nm. Kurva serapan yang telah diperoleh selanjutnya ditransformasikan menjadi kurva serapan derivat pertama dengan Δλ = 4 nm. Kurva serapan derivat pertama dari masing-masing konsentrasi kafein dan vitamin C kemudian ditumpangtindihkan (overlapping). Kurva serapan derivat pertama untuk kafein dengan konsentrasi 8 μg/mL; 12 μg/mL; 16 μg/mL; 20 μg/mL; 24 μg/mL;dan 28 μg/mL dapat dilihat pada Lampiran 8 halaman 73. Untuk vitamin C dengan konsentrasi 8 μg/mL; 16 μg/mL; 24 μg/mL; 32 μg/mL; 40 μg/mL; dan 48 μg/mL dapat dilihat pada Lampiran 8 halaman75. Kurva tumpang tindih derivat pertamakafein dan vitamin C berbagai konsentrasi dapat dilihat pada Gambar 4.5 dan 4.6.
Gambar 4.5 Kurva tumpang tindih derivat pertama kafein berbagai konsentrasi ====Kafein konsentrasi 8 μg/mL
====Kafein konsentrasi 12μg/mL
====Kafein konsentrasi 16μg/mL
====Kafein konsentrasi 20μg/mL
====Kafein konsentrasi 24μg/mL
Gambar 4.6Kurva tumpang tindih derivat pertama vitamin C berbagai konsentrasi
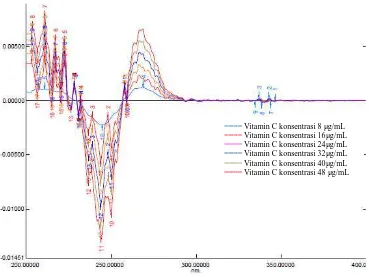
4.3.2Kurva Serapan Derivat Kedua
Kurva serapan derivat kedua didapatkan dari hasil transformasi kurva serapan dari kafein dan vitamin C yang sebelumnya telah diperoleh menjadi kurva serapan derivat kedua dengan Δλ = 4 nm. Kurva serapan derivat kedua untuk kafein dan vitamin dapat dilihat pada Lampiran 9 halaman 77. Kurva serapan derivat kedua kafein dan vitamin C dalam berbagai konsentrasi dapat dilihat pada Gambar 4.7 dan 4.8.
Gambar 4.7 Kurva serapan derivat kedua kafein dalam berbagai konsentrasi
==== Vitamin C konsentrasi 8 μg/mL
==== Vitamin C konsentrasi 16μg/mL
==== Vitamin C konsentrasi 24μg/mL
==== Vitamin C konsentrasi 32μg/mL
==== Vitamin C konsentrasi 40μg/mL
==== Vitamin C konsentrasi 48 μg/mL
====Kafein konsentrasi 8 μg/mL
====Kafein konsentrasi 12μg/mL
====Kafein konsentrasi 16μg/mL
====Kafein konsentrasi 20μg/mL
====Kafein konsentrasi 24μg/mL
[image:85.595.115.501.81.302.2]Gambar 4.8Kurva serapan derivat kedua vitamin C dalam berbagai konsentrasi
4.4Hasil Penentuan Zero Crossing 4.4.1Zero Crossing Derivat Pertama
Penentuan zero crossing pada derivat pertama diperoleh dengan menumpangtindihkan spektrum serapan derivat pertama pada masing-masing kafein dan vitamin C dari berbagai konsentrasi larutan. Zero Crossing pada spektrum derivat pertama dari masing-masing kafein dan vitamin C ditunjukkan oleh panjang gelombang yang memiliki serapan nol pada berbagai konsentrasi. Zero Crossing kafein dan vitamin C derivat pertama dapat dilihat pada Gambar 4.9 dan 4.10.
==== Vitamin C konsentrasi 8 μg/mL
==== Vitamin C konsentrasi 16μg/mL
==== Vitamin C konsentrasi 24μg/mL
==== Vitamin C konsentrasi 32μg/mL
==== Vitamin C konsentrasi 40μg/mL
Gambar 4.9 Zero Crossing kafein derivat pertama dengan λ = 202,8; 245; 272,6; dan 307 nm
Gambar 4.10 Zero Crossing vitamin C derivat pertama dengan λ = 207,3; 242,8; dan 289,5 nm
4.4.2 Zero Crossing Derivat Kedua
Penentuan zero crossing pada derivat kedua diperoleh dengan menumpangtindihkan spektrum serapan derivat kedua pada masing-masing kafein dan vitamin C dari berbagai konsentrasi larutan. Zero Crossing pada spektrum
202,8 nm
245 nm
272,6 nm
307 nm
207,3 nm
242,8 nm
289,5 nm
====Kafein konsentrasi 8 μg/mL
====Kafein konsentrasi 12μg/mL
====Kafein konsentrasi 16μg/mL
====Kafein konsentrasi 20μg/mL
====Kafein konsentrasi 24μg/mL ====Kafein konsentrasi 28μg/mL
==== Vitamin C konsentrasi 8 μg/mL ====Vitamin C konsentrasi 16μg/mL
==== Vitamin C konsentrasi 24μg/mL
====Vitamin C konsentrasi 32μg/mL
====Vitamin C konsentrasi 40μg/mL
[image:87.595.127.501.354.596.2]derivat kedua dari masing-masing kafein dan vitamin C ditunjukkan oleh panjang gelombang yang memiliki serapan nol pada berbagai konsentrasi. Zero crossing kafein dan vitamin Cderivat kedua dapat dilihat pada Gambar 4.11 dan 4.12.
Gambar 4.11 Zero crossing kafein derivat kedua dengan λ = 214,6; 229,2; 236; 260,8; 285,6; dan 306,4 nm
Gambar 4.12 Zero crossingvitamin C derivat kedua dengan λ = 229,8; 256,3; dan 294 nm
nm.
200.00 250.00 300.00 350.00 400
0.00000
-0.02000
4.5Hasil Penentuan Panjang Gelombang Analisis
Panjang gelombang analisis larutan kafein dengan konsentrasi 9 μg/mL,
larutan vitamin C dengan konsentrasi 8 μg/mL dan larutan campuran kafein
konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL diperoleh pada panjang
gelombang 200 - 400 nm. Selanjutnya diperoleh spektrum serapan derivat pertama dan derivat kedua dari masing-masing larutan kafein dan vitamin C dan dari campuran kafein dan vitamin C. Spektrum serapan derivat pertama dari larutan kafein dan vitamin C dan campuran keduanya kemudian ditumpangtindihkan, untuk spektrum derivat kedua dari larutan kafein dan vitamin C dan campuran keduanya juga ditumpangtindihkan.
Penentuan panjang gelombang analisis dilakukan berdasarkan pengamatan pada kurva serapan masing-masing derivat, kemudian dilanjutkan dengan pengukuran absorbansi pada masing-masing zero crossing. Kurva serapan campuran kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL dapat
dilihat pada Gambar 4.13.
Gambar 4.14Kurva tumpang tindih serapan kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
Gambar 4.15 Kurva tumpang tindih serapan kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL, dan campuran kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
==== Vitamin C konsentrasi 8 μg/mL
====Kafein konsentrasi 9 μg/mL
==== Vitamin C konsentrasi 8 μg/mL
==== Kafein konsentrasi 9 μg/mL
[image:90.595.118.511.414.674.2]Gambar 4.16 Kurva serapan derivat pertama campuran yang di dalamnya terdapat kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
Gambar 4.17 Kurva tumpang tindih serapan derivat pertama kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
==== Vitamin C konsentrasi 8 μg/mL
[image:91.595.121.504.427.699.2]Gambar 4.18Kurva tumpang tindih serapan derivat pertama kafein konsentrasi 9 μg/mL, vitamin C konsentrasi 8 μg/mL dan campuran kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
Gambar 4.19 Kurva serapan derivat kedua campuran yang di dalamnya terdapat kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
==== Vitamin C konsentrasi 8 μg/mL
====Kafein konsentrasi 9 μg/mL
[image:92.595.126.485.427.677.2]Gambar 4.20 Kurva tumpang tindih serapan derivat kedua kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
Gambar 4.21 Kurva tumpang tindih serapan derivat kedua kafein konsentrasi 9 μg/mL, vitamin C konsentrasi 8 μg/mL dan campuran kafein konsentrasi 9 μg/mL dan vitamin C konsentrasi 8 μg/mL
==== Vitamin C konsentrasi 8 μg/mL
==== Kafein konsentrasi 9 μg/mL
====Vitamin C konsentrasi 8 μg/mL
==== Kafein konsentrasi 9 μg/mL
[image:93.595.123.514.91.349.2] [image:93.595.118.534.417.671.2]Gambar 4.22Zero crossing dari kafein konsentrasi 9 μg/mL pada λ = 293,4 nm
Gambar 4.23Zero crossing dari vitamin C konsentrasi 8 μg/mL pada λ = 214 nm 293,4 nm
214 nm
====Vitamin C konsentrasi 8 μg/mL
==== Kafein konsentrasi 9 μg/mL
====Vitamin C konsentrasi 8 μg/mL
[image:94.595.125.493.376.665.2]Gambar 4.24Zero crossing campuran dengan kafein λ = 293,4 nm
Gambar 4.25Zero crossing campuran dengan vitamin Cλ = 214 nm
Dari gambar diatas, diperoleh panjang gelombang yang dapat dipakai untuk penetapan kadar campuran kafein dan vitamin C adalah pada serapan derivat kedua. Hal ini diketahui berdasarkan pemilihan panjang gelombang analisis pada setiap derivat. Panjang gelombang analisis didapatkan dengan menentukan zero crossing untuk masing-masing kafein dan vitamin C.
293,4 nm
214 nm
====Vitamin C konsentrasi 8 μg/mL
==== Kafein konsentrasi 9 μg/mL
====Campuran kafein konsentrasi 9μg/mL dan vitamin C konsentrasi 8 μg/mL
====Vitamin C konsentrasi 8 μg/mL
==== Kafein konsentrasi 9 μg/mL
Gambar 4.26Zero crossing kafein konsentrasi 9 μg/mL, vitamin C konsentrasi 8 μg/mL dan sampel kratingdaeng-S konsentrasi 13,3 μg/mL
Dari gambar diatas maka dapat dibuktikan bahwa panjang gelombang analisis untuk sampel kratingdaeng-S yaitu pada 214 nm untuk vitamin C dan 293,4 nm untuk kafein.
Pada serapan derivat pertama, zero crossing untuk kafein ditemukan pada panjang gelombang 202,8 nm; 245 nm; 272,6 nm; dan 307 nm. Sedangkan untuk vitamin C zero crossing ditemukan pada panjang gelombang 207,3 nm; 242,8 nm; dan 289,5 nm.
Panjang gelombang analisis ditentukan dengan cara menumpangtindihkan spektrum derivat kedua dari kafein dan vitamin C. Selanjutnya ditentukan panjang gelombang dimana absorbansi salah satu zat berada pada nilai nol, sedangkan pada zat lain memiliki nilai positif. Pada serapan derivat pertama, panjang gelombang analisis untuk kafein dapat ditemukan. Namun panjang gelombang analisis untuk vitamin C tidak ditemukan, sehingga penentuan kadar sampel tidak bisa dilakukan pada derivat pertama. Oleh karena itu dibuat spektrum serapan derivat kedua, kemudian dilakukan penentuan panjang gelombang analisis dengan cara yang sama seperti cara derivat pertama.
293,4 nm 214 nm
====Vitamin C konsentrasi 8 μg/mL
==== Kafein konsentrasi 9 μg/mL
Dari hasil spektrum serapan derivat kedua, diketahui bahwa zero crossing untuk kafein berada pada panjang gelombang 214,6 nm; 229,2 nm; 236 nm; 260,8 nm; 285,6 nm; dan 306,4 nm. Sedangkan zero crossing untukvitamin C adalah pada panjang gelombang 229,8 nm; 256,3 nm; dan 294 nm. Setelah spektrum serapan derivat kedua dari kafein dan vitamin C serta campuran kafein dengan vitamin C ditumpangtindihkan, didapatkan panjang gelombang analisis untuk kafein pada 293,4 nm dan untuk vitamin C pada 214 nm. Panjang gelombang analisis dan absorbansinya dapat dilihat pada Tabel 4.1.
Tab el 4.1 Panjang Gelombang Analisis dan Absorbansinya
Zat Panjang Gelombang (nm)
211 214 256 293,4 306
Kafein 0 0 0 0,00245 0
Vitamin C 0,00085 0,00114 0,00050 0 0
Campuran 0,00073 0,00115 0,00048 0,00244 0
gelombang analisisnya adalah pada 293,4 nm. Spektrum dan absorbansi kafein dan vitamin C dapat dilihat pada Lampiran 10 halaman 64.
4.6Hasil Penentuan Linearitas Kurva Kalibrasi 4.6.1Kurva Kalibrasi
[image:98.595.129.492.392.602.2]Linearitas kurva kalibrasi menunjukkan hubungan yang linier antara absorbansi dengan konsentrasi. Kurva kalibrasi untuk kafein pada gambar 4.27 diperoleh persamaan regresi Y = (30,73X-1) x 10-5. dengan korelasi r = 0,9996. Sedangkan untuk vitamin C pada gambar 4.28 diperoleh persamaan regresi Y = (11X-1) x 10-5dengan korelasi r = 0,9996. Nilai r > 0,99 menunjukkan adanya korelasi linier hubungan antara X dan Y (Watson, 2007). Data kalibrasi dan perhitungan regresi dapat dilihat pada Lampiran 11 dan 12 halaman 83 dan 85.
Gambar 4.28Kurva kalibrasi vitamin C pada panjang gelombang 214 nm 4.6.2 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi dihitung dari persamaan regresi yang diperoleh dalam kurva kalibrasi. Batas deteksi dan batas kuantitasi analisis kafein yang diperoleh secara berturut-turut adalah 0,5632μg/mL dan 1,8776μg/mL. Sedangkan untuk vitamin C, batas deteksinya adalah 3,7936μg/mL dan batas kuantitasinya adalah 12,6450μg/mL. Perhitungan batas deteksi dan batas
kuantitasi ini dapat dilihat pada Lampiran 13 dan 14 di halaman 87 dan88.
4.7 Hasil Analisis Kandungan Kafein dan Vitamin C dalam Sampel Minuman Berenergi
Analisis kandungan kafein dan vitamin C dilakukan dengan menggunakan dua merek minuman berenergi yaitu Kratingdaeng-S® dan Hemaviton®. Berdasarkan label yang tercantum, kedua merek minuman berenergi ini mengandung kafein dengan kadar 50 mg per sajiannya dan vitamin C sebagai antioksidan tidak tercantum kandungannya di label, maka perlu dilakukan uji kualitatif untuk memastikan adanya kandungan vitamin C dalam sampel. Kadar sampel ditentukan menggunakan enam botol dengan volume tiap botol sebanyak 150 mL masing-masing untuk dua merek sampel yang akan dianalisis.
Sampel yang telah dipreparasi kemudian diukur pada panjang gelombang 200 – 400 nm. Selanjutnya spektrum hasil serapan ditransformasikan menjadi spektrum serapan derivat kedua dengan Δλ = 4 nm. Dari spektrum ini dapat ditentukan absorbansi kafein dan vitamin C pada panjang gelombang analisis yang telah diperoleh sebelumnya, yaitu pada panjang gelombang 293,4 nm untuk kafein dan pada 214 nm untuk vitamin C.
Spektrum serapan sampel Kratingdaeng-S® dan Hemaviton® dapat dilihat pada Lampiran 15 halaman 89, data perhitungan dan contoh perhitungan kadar sampel yang diukur dapat dilihat pada Lampiran 16 dan 17 di halaman95 dan 96. Data hasil kandungan kafein dan vitamin C dalam persajian sampel 150 mL dapat dilihat pada Tabel 4.2.
Tab el 4.2Kandungan Kafein dan Vitamin C dalam persajian sampel 150 mL
No. Sampel Kandungan Kafein
(mg/sajian)
Berdasarkan tabel di atas, diperoleh hasil untuk kedua merek minuman berenergi yang dipakai sebagai sampel memenuhi persyaratan untuk minuman berenergi. Untuk kafein, berdasarkan SNI 01-6684-2002, persyaratan kadar yang masih bisa diterima adalah maksimum 50 mg/sajian. Kadar kafein dalam sampel Kratingdaeng-S® dan Hemaviton® yang dihitung berdasarkan analisa statistika, masih berada di bawah batas maksimum, sedangkan berdasarkan Keputusan Kepala BPOM Republik Indonesia No HK0005233644, dimana persyaratan kadar vitamin C yang masih bisa diterima sebagai vitamin pada minuman suplemen makanan adalah maksimum 1000 mg/hari. Dari hasil analisis statistika, kadar vitamin C dalam sampel Kratingdaeng-S® dan Hemaviton® masih berada di bawah batas maksimum yang telah ditetapkan Standar Nasional Indonesia. Jadi kafein dan vitamin C di dalam sampel memenuhi persyaratan SNI 01-6684-2002 tentang minuman berenergi dan Keputusan Kepala BPOM Republik Indonesia No HK0005233644 tentang ketentuan pokok pengawasan suplemen makanan untuk daftar vitamin, mineral, asam amino dan bahan lain yang diizinkan digunakan dalam suplemen makanan dengan pembatasan. Perhitungan kadar sampel secara st