Hubungan Helicobacter pylori dengan sitokin TNF-α, IL-6, dan IL-8 Gontar Alamsyah Siregar
Divisi Gastroentero-Hepatologi, Departemen Ilmu Penyakit Dalam, Fakultas Kedokteran
Universitas Sumatera Utara / RSUP H. Adam Malik Medan
Helicobacter pylori
H.pylori adalah etiologi utama terjadinya gastritis. Bakteri ini merupakan bakteri Gram
negatif, bentuk heliks, mikroaerofilik, dengan panjang 3 mikrometer dan diameter sekitar 0,5
mikrometer. yang ditemukan di gaster. Pertama kali diidentifikasi tahun 1982 oleh ilmuwan
Australia Barry Marshall dan Robin Warren, yang saat itu ditemukan pada pasien gastritis
kronik dan ulkus gaster (Blaser MJ, 2006)
Berikut akan dijelaskan mengenai faktor virulesi utama dari H.pylori
a. Cytotoxin-associated gene (cag) pathogenicity island (cagPaI)
CagPaI adalah regio DNA yang disusun oleh 30 gen yang mengkode Type IV
Secretion System (T4SS). Infeksi strain H.pylori dengan cagPaI sekitar 2x beresiko
terkena ulkus peptikum dan adenokarsinoma gaster (Fischer W, et al, 2001).
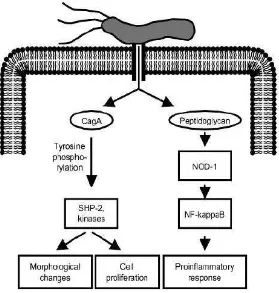
T4SS dapat menginduksi ekspresi sitokin proinflamasi ketika berinteraksi
dengan sel pejamu, dengan mekanisme yang tidak melibatkan CagA tetapi komponen
dinding sel H.pylori seperti peptidoglikan. Peptidoglikan dikenali oleh molekul pertahanan pejamu, NOD1, dan hal ini menyebabkan aktivasi NF-κB, dan dapat meningkatkan ekspresi sitokin proinflamasi seperti IL-8. IL-8 merupakan kemoatraktan
penting untuk neutrofil dan limfosit. Infiltrasi neutrofil pada mukosa gaster lebih berat
secara signifikan pada pasien yang terinfeksi strain cag(+) dibandingkan yang (-).
Kondisi ini menunjukkan adanya cagPaI berperan besar menginduksi inflamasi.
Banyak penelitian melaporkan adanya hubungan antara prognosis klinis dengan adanya
cag. CagA meningkatkan produksi reactive oxidative species (ROS) dan dapat
menginduksi stres oksidatif terhadap mukosa gaster (Holck S, et al, 2003; Farinati F et
Gambar 1. Interaksi CagA dengan molekul pejamu (Kusters JG, et al, 2006)
b. Vacuolating cytotoxin A (VacA)
Semua strain H.pylori memiliki gen vacA dan sekitarnya separuhnya
mensekresikan protein VacA aktif. Protein ini toksin yang dapat menginduksi
pembentukan vakuola secara masif pada sel epitel in vitro dan mengurangi proliferasi
sel T. Inhibisi sel T menyebabkan H.pylori dapat menyebabkan infeksi kronik. Toksin
dapat membentuk pori-pori pada sel epitel gaster yang mengangkut cairan interstisial
bersama urea menuju ke bakteri. Dengan cara ini bakteri mendapatkan nutrisi,
mempertahankan pH dengan mengubah urea menjadi amonia sehingga membantu
H.pylori untuk tumbuh. VacA juga berperan melonggarkan tight junction antara sel-sel
dan menyebabkan kerusakan epitel (Pelicic, et al, 1999; Sundrud MS, et al, 2004).
c. Duodenal ulcer promoting gene A (dupA)
Gen dupA terutama berhubungan dengan ulkus peptikum. Pada penelitian di
China menunjukkan pasien ulkus duodenum memiliki prevalensi strain dupA positif
dibandingkan pasien Ca gaster dan ulkus gaster (Zhang Z, et al, 2008). Penelitian Lu et
al menemukan bahwa infeksi strain dupA+ berkaitan dengan peningkatan kadar IL-8
pada mukosa gaster dan infiltrasi neutrofil yang lebih berat (Lu H, et al, 2005).
Gen oipA juga dapat menginduksi ekspresi IL-8 dari sel epitel gaster. Adanya
oipA berkorelasi dengan ulkus duodenum dan Ca gaster (Yamaoka Y, et al, 2006).
e. Protein membran luar lainnya
Banyak protein membran luar H.pylori memungkinkan perlekatan H.pylori
terhadap sel epitel gaster, seperti BabA, SabA, HpaA, Omp18, AlpA, AlpB, dan HopZ.
BabA (blood group antigen binding adhesion A), salah satu faktor yang paling banyak
dipelajari, ditemukan pada sel epitel dan memfasilitasi kolonisasi H.pylori dan
meningkatkan respons IL-8, yang menyebabkan inflamasi mukosa (Rad R, et al, 2002).
f. HP-NAP
HP-NAP adalah faktor lain yang dapat mengaktivasi neutrofil. HP-NAP
mengaktivasi sel mast sehingga menyebabkan pelepasan isi granul dan sitokin
proinflamasi IL-6. Faktor ini dapat menyebabkan datangnya monosit dan neutrofil ke
lokasi infeksi (Montemurro P, et al, 2002). HP-NAP juga dapat menginduksi respons
Th1 yang kuat, induksi neutrofil untuk memproduksi ROS dan menyebabkan inflamasi
dan kerusakan sel (Montecucco C, et al, 2003).
[image:3.595.163.416.402.592.2]
Gambar 2. Biopsi gaster menunjukkan H.pylori dengan pembesaran 1000x (Garg B, et al, 2012)
Secara histologi, bakteri ini biasanya dideteksi dalam lapisan gel mukos yang
melapisi mukosa gaster. H.pylori bisa sulit dideteksi pada kasus metaplasia intestinal
ekstensif maupun selama terapi antisekretorik (PPI). Pada beberapa kasus, infeksi H.pylori
bisa diperkirakan dengan adanya inflamasi mononuklear dan neutrofilik (aktif). Setelah
neutrofil dan/atau mononuklear yang menetap mengindikasikan kegagalan pengobatan.
(Suzana MK, et al, 2009).
Walaupun dari spesimen biopsi ditemukan adanya H.pylori tidak berarti H.pylori
menjadi etiologi tunggal. Di beberapa kasus bisa terdapat etiologi multipel. Adanya
H.pylori berhubungan dengan kerusakan jaringan dan temuan histologi gastritis kronik.
Gastritis H.pylori merupakan infeksi primer pada gaster dan penyebab tersering gastritis
kronik. H.pylori mendiami gaster lebih dari 50% orang dan penyebab tersering gastritis
kronik di dunia (Suzana MK, et al, 2009).
Gastritis H.pylori menyebabkan 2 pola topografi utama yang memiliki konsekuensi
klinis yang berbeda, yaitu gastritis antrum dan gastritis atrofi multifokal. Gastritis antrum
ditandai inflamasi yang terutama terbatas pada antrum. Pasien dengan ulkus peptikum
sering mengalami gastritis pola ini. Gastritis atrofi multifokal ditandai keterlibatan korpus
dan antrum gaster dengan perkembangan atrofi gaster yang progresif (kehilangan kelenjar
gaster) dan penggantian kelenjar gaster dengan epitel tipe intestinal (metaplasia intestinal).
Pasien dengan adenoma gaster dan ulkus gaster biasanya mengalami pola ini (Suzana MK,
et al, 2009).
H.pylori ditemukan di musin yang melapisi epitel permukaan dan di dalam foveola,
oleh karena itu H.pylori dapat dideteksi dengan pewarnaan Hematoksilin-Eosin bila
jumlahnya banyak tetapi jika jarang, ada beberapa metode pewarnaan seperti
Warthin-Starry; Cresyl-violet, Gimminez, Alcian yellow-toluidine blu-Leung, Genta stain, Giemsa,
May Grünwald Giemsa (Suzana MK, et al, 2009).
Kolonisasi H.pylori pada awalnya menyebabkan gastritis superfisial akut, yang
ditandai dengan infiltrasi neutrofil antara permukaan dan sel epitel foveolar dan di dalam
gastric pits, epitel permukaan menunjukkan perubahan degeneratif dengan hilangnya
musin dan peningkatan eksfoliasi, awal yang terkena mukosa antrum dan pada akhirnya
mukosa korpus, infiltrasi limfoplasmasitik meningkat setelah 11-14 hari, lamina propria
edema. Infeksi H.pylori kronik ditandai infiltrasi mononuklear, predileksi foveolar;
infiltrasi aktif neutrofil pada zona proliferatif mukosa gaster, interstisial, dan epitel
foveolar; agregat limfoid, gastritis H.pylori kronik dominan di antrum. Setelah eradikasi
H.pylori neutrofil akan menghilang setelah 6-8 minggu, infiltrasi kronik menetap lebih
lama di regio antrum (Cerar A, et al, 2003).
H.pylori tinggal di lapisan mukus yang melapisi epitel gaster. H.pylori mensekresikan
faktor-faktor, peptida, dan lipopolisakarida yang bersifat kemotaktik terhadap neutrofil dan
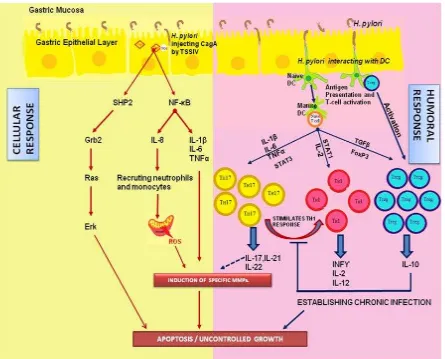
monosit. In vivo, infeksi H.pylori di mukosa gaster menginduksi produksi sitokin-sitokin IL-1 , IL-6, IL-8 dan TNF-α. IL-IL-1 atau TNF-α saja, maupun TNF-α bersinergis dengan IFN-menginduksi produksi IL-8 di sel gaster. Peningkatan produksi IL-8 bisa disebabkan infeksi H.pylori maupun sekunder dari peningkatan kadar IL-1 atau TNF-α. Produksi IL-8 oleh sel epitel gaster berkepanjangan dapat menyebabkan rekruitmen neutrofil dan limfosit ke
[image:5.595.81.528.252.488.2]jaringan yang terinfeksi (Szoke D, 2009).
Gambar 3. Imunopatogenesis Infeksi H.pylori (Szoke D, 2009)
H.pylori menginduksi sitokin-sitokin proinflamasi seperti IL-1 , IL-6, TNF-α, IL-8 melalui aktivasi NF-κB. Respons inflamasi yang terjadi menyebabkan Treg mensekresikan
sitokin imunosupresif, yang mempertahankan kadar H.pylori dalam mukosa gaster. Peran
Treg dalam memodulasi respon imun pejamu selama infeksi H.pylori telah beberapa kali
dipikirkan. Treg adalah subset dari sel T yang mensupresi respon imun pejamu dan
berhubungan dengan kanker. Sel T khusus tersebut mengekspresikan marker seperti CD4,
CD25, dan FoxP3. Treg meningkatkan toleransi terhadap antigen diri sendiri dan pada saat
bersamaan memfasilitasi pertumbuhan tumor melalui imunosupresi. Beberapa studi
menyebutkan peningkatan dari TH1, TH2, Treg, mengindikasikan keseimbangan
imunomodulasi pejamu untuk inflamasi. Infeksi H.pylori memiliki respon TH1 yang kuat
diseimbangkan dengan IL-10 dari Treg untuk menyebabkan infeksi kronik dengan
imunosupresi parsial (Banerjee A, et al, 2013).
[image:6.595.76.521.111.470.2]Gambar 4. Respons Inflamasi akibat Helicobacter pylori (Banerjee A, et al, 2013)
Penelitian epidemiologis menunjukkan bahwa adanya hubungan kuat antara infeksi H
pylori dan gastritis serta adanya ulkus baik di duodenum atau di lambung, MALT limfoma
dan adenokarsinoma lambung, seperti terlihat pada gambar di bawah ini. Pembuktian adanya
kuman tersebut merupakan indikasi kuat untuk dilakukan eradikasi. WHO telah menetapkan
Gambar 5. Kaskade Kanker oleh Infeksi Helicobacter pylori (Tepes B, 2009)
Gambar 6. Infeksi Helicobacter pylori dan outcome yang bisa terjadi (Tepes B, 2009) Perjalanan alamiah dari infeksi H pylori yang berhubungan dengan inflamasi mulai
[image:8.595.102.467.423.690.2]dengan penurunan sekresi asam, hilangnya sel parietal dan atrofi korpus. (El-Zimaity HMT,
2007).
TNF- α
TNF-α merupakan sitokin utama pada respons inflamasi akut. Infeksi yang berat dapat
memicu produksi TNF dalam jumlah besar yang menimbulkan reaksi sistemik. TNF disebut
TNF-α atas dasar historis dan untuk membedakannya dari TNF- atau limfotoksin (Pelicic V,
et al, 1999).
TNF-α diproduksi oleh neutrofil, limfosit yang diaktifkan, makrofag sel NK, dan beberapa sel non limfoid seperti astrosit, sel endotel dan sel otot polos, sementara
TNF-nampaknya hanya diproduksi oleh sel T (Detrick B, et al, 2008).
LPS merupakan rangsangan poten untuk mensekresi TNF. IFN- yang diproduksi oleh
sel T dan sel NK juga merangsang makrofag antara lain meningkatkan sintesis TNF. TNF
memiliki efek biologik antara lain pengerahan neutrofil dan monosit ke tempat infeksi serta
mengaktifkan sel-sel tersebut untuk menyingkirkan mikroba, memacu ekspresi molekul adesi
sel endotel vaskular terhadap leukosit, merangsang makrofag mensekresi kemokin dan
menginduksi kemotaksis dan pengerahan leukosit, merangsang fagosit mononuklear,
merangsang hipotalamus yang menginduksi demam dan oleh karena itu disebut pirogen
endogen (Baratawidjaja KG, 2004).
TNF-α adalah sitokin proinflamasi yang berperan penting dalam respon baik akut maupun kronis pada infeksi virus, bakteri, dan parasit. Bioaktivitas TNF-α terjadi melalui terikatnya TNF-α pada reseptor seluler spesifik TNF-R, TNF-R1 (p55) dan TNF-R2 (p75), yang berbeda berat molekul, lokasi, dan fungsinya. TNF-R1 tersebar di banyak tempat,
sementara R2 lebih terbatas distribusinya, yaitu pada sel-sel asal hematopoietin. TNF-R1 memperantarai kebanyakan respon seluler yang diinduksi TNF-α, termasuk aktivasi faktor traskripsi seperti NF-κB dan apoptosis (Bradley JR, 2008).
Interleukin-6
Interleukin 6 (IL-6) merupakan interleukin yang berperan sebagai sitokin proinflamasi.
IL-6 disekresikan oleh sel T dan makrofag untuk menstimulasi respons imun seperti infeksi,
trauma, dll. IL-6 penting dalam patofisiologi demam, inflamasi akut, dan kronik. IL-6 dapat
disekresikan oleh makrofag sebagai respons terhadap molekul mikroba spesifik, yang disebut
dengan molekul dari sistem imun bawaan yang disebut pattern recognition receptors (PRRs)
termasuk Toll-like receptors (TLRs). TLR terdapat di permukaan sel dan kompartemen
intraseluler dan menginduksi kaskade sinyal intraseluler yang dapat menyebabkan
peningkatan produksi sitokin inflamasi.
IL-6 penting dalam respons inflamasi kronik. IL-6 tidak hanya berperan dalam reaksi
fase akut tetapi juga perkembangan respons imun seluler dan humoral, termasuk diferensiasi
sel B tahap akhir, sekresi imunoglobulin, dan aktivasi sel T. Peralihan dari inflamasi akut ke
kronik yang utama adalah adanya monosit pada area inflamasi. IL-6 ini penting dalam transisi
antara inflamasi akut ke kronik (Kaplanski G, et al, 2003).
Kompleks IL-6 dan reseptor IL-6 dapat mengaktivasi sel endotel untuk mensekresikan
monocyte chemoattractant protein (MCP)-1 dan menginduksi ekspresi molekul adesi.
Kompleks IL-6/ Reseptor IL-6 memungkinkan transisi dari neutrofil ke monosit dalam
patogenesis inflamasi. Transisi dari akumulasi neutrofil ke monosit bisa akibat pergeseran
tipe kemokin yang diproduksi oleh sel stroma, makrofag atau neutrofil. Neutrofil yang
distimulasi sitokin inflamasi selama beberapa jam akan secara selektif menghasilkan MCP-1.
Aktivasi endotel (atau sel stroma) oleh molekul proinflamasi menyebabkan sekresi PAF
(Platelet activating factor), IL-8, IL-6. Kombinasi IL-6R dengan IL-6 memungkinkan ligasi
ke gp130 pada membran sel endotel dan meningkatkan sekresi IL-6 dan MCP-1 sel endotel
(atau stroma), yang memungkinkan transisi dari rekrutmen neutrofil ke monosit. Transisi dari
akumulasi neutrofil ke monosit pada lokasi inflamasi tidak hanya terjadi rekrutmen monosit
tetapi juga hilangnya neutrofil. Neutrofil apoptosis mengekspresikan antigen membran baru
yang dikenali oleh berbagai reseptor makrofag yang menyebabkan terjadinya fagositosis.
Fagositosis dari PMN apoptotik oleh makrofag menyebakan peningkatan sekresi TGF- dan
sekresi MCP-1, menyebabkan terjadinya rekrutmen monosit (Marin V, et al, 2001; Jones SA,
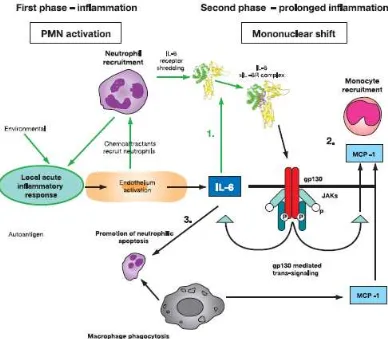
Gambar 7. Peranan IL-6 terhadap inflamasi (Gabay C, 2006)
Keterangan. Tahap 1: pada respons inflamasi akut, IL-6 dapat berikatan dengan dengan
reseptornya. Tahap 2: trans sinyal melalui gp130 menyebabkan rekrutmen monosit. Tahap 3:
paparan jangka panjang IL-6 menyebabkan apoptosis neutrofil, fagositosis, dan akumulasi
mononuklear pada lokasi cedera. IL: interleukin; JAK: Janus activated kinase; MCP:
monocyte chemoattractant protein; sIL-6R: solluble IL-6 receptor
IL-6 berperan penting dalam pertahanan pejamu sebagai messenger antara sistem
adaptif dan innate dengan menstimulasi produksi IFN- di sel T, dengan meningkatkan
sekresi imunoglobulin di sel B yang teraktivasi dan melalui aktivasi polimorfoneutrofil
(Yamaoka Y, et al, 1996).
Interleukin-8
IL-8 adalah kemokin yang diproduksi oleh monosit, limfosit T, neutrofil, sel endotel
vaskular, fibroblas dermis, keratinosit, hepatosit dan sel kanker gaster manusia. Pada manusia
neutrofil in vitro. Selain itu, IL-8 dapat menginduksi neutrofil untuk melepaskan enzim
lisosom. IL-8 ini tidak terdeteksi pada plasma orang dewasa normal (Luster AD, 1998).
IL-8 merupakan salah satu faktor penting yang menyebabkan influks neutrofil menuju
sel-sel yang terinfeksi dan jumlah IL-8 diekspresikan oleh sel epitel gaster sebagai respons
terhadap H.pylori yang cukup untuk menginduksi kemotaksis neutrofil (Yamada H, et al,
2001). Penelitian in vivo dan in vitro menunjukkan adanya peningkatan kadar IL-8 yang
berhubungan dengan infeksi H.pylori (Kim H, et al, 2001; Seo JH, et al, 2004; Robinson K, et
al, 2008). Induksi ekspresi IL-8 dimediasi melalui NF-κB dan proten activator-1 (AP-1) (Chu
SH, et al, 2003). H.pylori secara langsung akan melakukan up regulasi ekspresi mesenger
RNA dari IL-8 dan protein IL-8 pada sel epitel (Crabtree JE, et al, 1995).
Hubungan TNF-α, IL-6, IL-8 terhadap Infeksi Helicobacter pylori
H. pylori yang menginfeksi kurang lebih 50% penduduk di seluruh dunia, yang
menyebabkan inflamasi lambung kronis yang akan menjadi atrofi, metaplasia, displasia dan
akhirnya kanker lambung (Fox JG, 2007b).
Inflamasi kronis tersebut melibatkan netrofil, limfosit (sel T dan B), sel plasma, dan
makrofag, sesuai dengan tingkat degenerasi dan kerusakan selnya (Israel DA, 2001).
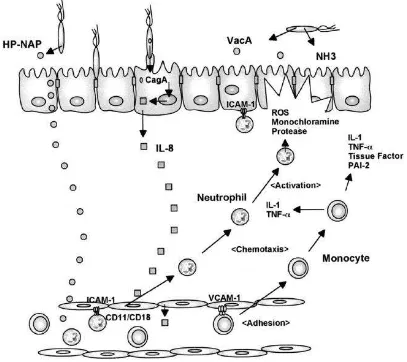
Mekanisme inflamasi lainnya melalui kontak langsung dengan sel epitel lambung dan
Gambar 8. Molekul adhesi, sitokin dan mediator yang terlibat pada sel mukosa lambung (Naito Y, 2002)
TNF-α berperan untuk meningkatkan reaksi inflamasi dan diyakini berperan penting dalam kerusakan mukosa gaster akibat H.pylori. TNF-α menyebabkan kaskade inflamasi terhadap infeksi, respons inflamasi berlebihan di mukosa gaster yang berhubungan dengan
inhibisi sekresi asam lambung dan kerentanan yang lebih tinggi terhadap Ca gaster (Furuta T,
et al, 2002)
Yamaoka et al, melaporkan bahwa kadar IL-6 mukosa meningkat pada gastritis
H.pylori (Yamaoka Y, et al, 1996). Nakagawa H et al melaporkan bahwa pasien dewasa di
Jepang yang terinfeksi H.pylori menunjukkan kadar IL-6 yang lebih tinggi, dan hal ini juga
konsisten dengan studi lainnya pada orang Kaukasia (Nakagawa H, et al, 2013). Lindholm et
al melaporkan bahwa pada pasien yang terinfeksi H.pylori, kadar IL-6 meningkat pada
mukosa gaster dibandingkan pasien sehat (Lindholm C, et al, 1998).
Kadar IL-6 serum dilaporkan lebih tinggi pada pasien Ca gaster dibandingkan dengan
lesi gaster jinak akibat infeksi H.pylori. Kadar IL-6 mukosa juga lebih tinggi pada Ca gaster
tahap awal dengan infeksi H.pylori aktif daripada non infeksi H.pylori. Kadar IL-6 ini turun
secara dramatis setelah eradikasi infeksi. Penelitian pada binatang menunjukkan adanya
hubungan antara IL-6 dengan H.pylori dan juga berkorelasi dengan tingkat inflamasi gaster
(Harris P, et al, 2000; Yamaoka Y, et al, 2001).
mana makin tinggi kadar sitokin sebanding dengan peningkatan derajat inflamasi dan
aktivitas neutrofil (Bodger K, et al, 2001).
Xuan, et al. tahun 2005 mendapatkan kadar IL-8 mukosa metode ELISA yang lebih
tinggi pada derajat gastritis yang lebih berat (infiltrasi neutrofil, infiltrasi mononuklear dan
atrofi) (Xuan J, et al, 2005).
Penelitian Andersen et al mendapatkan bahwa IL-8 meningkat secara signifikan pada
derajat inflamasi yang lebih berat dan tingkat kepadatan H.pylori yang makin banyak
(Andersen LP, et al, 2005).
Holck et al melaporkan adanya hubungan signifikan antara IL-8 dengan gastritis
maupun tingkat kepadatan H.pylori. Aktivitas sitokin IL-8 meningkat pada pasien yang
terinfeksi H.pylori. IL-8 ditemukan meningkat pada separuh pasien H.pylori, dibandingkan
dengan 25% pada pasien yang tidak terinfeksi H.pylori. (Holck S, et al, 2003).
DAFTAR PUSTAKA
Andersen LP, Holck S, Janulaityte-Gu¨nther D, Kupcinskas L, Kiudelis G, Jonaitis L, et al.
Gastric inflammatory markers and interleukins in patients with functional dyspepsia, with and
without Helicobacter pylori infection. FEMS Immunology and Medical Microbiology.2005;44:233–8.
Banerjee A, Mukhopadhyay AK, Paul S, Bhattacharyya A and Swarnakar S. Unveiling the
Intricacies of Helicobacter pylori-induced Gastric Inflammation: T Helper cells and Matrix
Metalloproteinases at a Crossroad. In: Mozsik G, editor. Current Topics in Gastritis. Croatia:
InTech Publishers; 2013. Chapter 7.
Baratawidjaja KG. Imunologi Dasar: Sitokin. Jakarta: Balai Penerbit FK-UI; 2004. hlm.
128-31.
Bodger K, Crabtree JE. Helicobacter pylori and gastric inflammation. British Med Bull.
1998;54:139-50.
Bradley JR. TNF-mediated inflammatory disease. J Pathol. 2008; 214:149-60.
Cerar A, Vodopivec B. Sydney and beyond: Helicobacter pylori gastritis. Update in Pathology, Proceedings Book. Ljubljana, Slovenia: Fac Med, Univ Lubljana; 2003. hlm. 89– 93.
Chu SH, Kim H, Seo JY, Lim JW, Mukaida N, Kim KH. Role of NF-kappaB and AP-1 on
Helicobater pylori-induced IL-8 expression in AGS cells. Dig Dis Sci. 2003; 48:257-65.
Crabtree JE, Covacci A, Farmery SM. Helicobacter pylori induced interleukin-8 expression
in gastric epithelial cells is associated with CagA positive phenotype. J Clin Pathol.
1995;48:41-5.
Detrick B, Nagineni CN, Hooks J. Cytokines: Regulators of Immune Responses and Key
Therapeutic Targets. In: Gorman MRG, Donnenberg AD, editor. Handbook of Human
Imunology. 2nd ed. Boca Raton, FL: CRC Press; 2008.
Farinati F, Cardin R, Russo VM, Busatto G, Franco M, Rugge M. Helicobacter pylori CagA
status, mucosal oxidative damage and gastritis phenotype: a potential pathway to cancer?
Helicobacter. 2003; 8:227-34.
Fischer W, Puls J, Buhrdorf R, Gebert B, Odenbreit S, Haas R. Systematic mutagenesis of the
Helicobacter pylori cag pathogenicity island: essential genes for CagA translocation in host
cells and induction of interleukin-8. Mol Microbiol. 2001; 42:1337-48.
Fox JG, Wang TC. Inflammation, atrophy and gastric cancer. The Journal of Clinical
Furuta T, El-Omar EM, Xiao F, Shirai N, Takashima M, Sugimura H. Interleukin 1beta
polymorphisms increase risk of hypochlorhydria and atrophic gastritis and reduce risk of
duodenal ulcer recurrence in Japan. Gastroenterology. 2002;123(1):92-105.
Gabay C. Interleukin-6 and chronic inflammation. Ar thritis Research & Therapy. 2006;
8(2):1-6.
Garg B, Sandhu V, Sood N, Sood A, Malhotra V. Histopathological analysis of chronic
gastritis and correlation of pathological features with each other and with endoscopic
findings. Pol J Pathol. 2012;3:172-8.
Harris P, Smyties LE, Smith PD, Dubois A. Inflammatory cytokine mRNA expression during
early and persistent Helicobacter pylori infection in nonhuman primates. J Infect Dis. 2000;
181:783-6.
Holck S, Norgaard A, Bennedsen M, Permin H, Norn S, Andersen LP, et al. Gastric mucosal
cytokine responses in Helicobacter pylori-infected patients with gastritis and peptic ulcers.
Association with inflammatory parameters and bacteria load. FEMS Immunology and
Medical Microbiology. 2003;36:175-80.
Israel DA, Peek RM. Review article: Pathogenesis of Helicobacter pylori-induced gastric
inflammation. Aliment Pharmacol Ther. 2001;15:1271-90.
Jones SA, Richards PJ, Scheller J, Rose-John S. IL-6 transsignaling: the in vivo
consequences. J Interferon Cytokine Res. 2005;25:241-53.
Kaplanski G, Marin V, Montero-Julian F, Mantovani A, Farnarier C. IL-6: a regulator of the
transition from neutrophil to monocyte recruitment during inflammation. Trends Immunol.
2003; 24:25-9.
Kim H, Lim JW, Kim KH. Helicobacter pylori-induced expression of interleukin-8 and
cyclooxygenase-2 in AGS gastric epithelial cells: mediation by nuclear factor-kappaB. Scand
Kusters JG, van Vliet AH, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin
Microbiol Rev. 2006; 19:449-90.
Lindholm C, Quiding-Jarbrink M, Lonroth H, Hamlet A, Svennerholm AM. Local cytokine
response in Helicobacter pylori-infected subjects. Infect Immun. 1998;66: 5964-71.
Lu H, Hsu PI, Graham DY, Yamaoka Y. Duodenal ulcer promoting gene of Helicobacter
pylori. Gastroenterology. 2005;128:833-48.
Luster AD. Chemokines-chemotactic cytokines that mediate inflammation. N Engl J Med.
1998;338:436-45.
Marin V, Montero-Julian FA, Gres S, Boulay V, Bongrand P, Farnarier C, et al. The
IL-6/soluble IL-6Ra autocrine loop of endothelial activation as an intermediate between acute
and chronic inflammation: an experimental model involving thrombin. J Immunol. 2001;
167:3435-42.
Montecucco C, de Bernard M. Molecular and cellular mechanisms of action of the
vacuolating cytotoxin (VacA) and neutrophil-activating protein (HP-NAP) virulence factors
of Helicobacter pylori. Microbes Infect. 2003;5:715-21.
Montemurro P, Nishioka H, Dundon WG, de Bernard M, Del Giudice G, Rappuoli R, et al.
The neutrophil-activating protein (HP-NAP) of Helicobacter pylori is a potent stimulant of
mast cells. Eur J Immunol. 2002;32:671-6.
Naito Y, Yoshikawa T. Molecular and cellular mechanism involved in Helicobacter pylori
induced inflammation and oxidative stress. Free Rad Biol and Med. 2002;33:323-6.
Nakagawa H, Tamura T, Mitsuda Y, Goto Y, Kamiya Y, Kondo T, et al. Significant
Association between Serum Interleukin-6 and Helicobacter pylori Antibody Levels among H.
Pelicic V, Reyrat JM, Sartori L, Pagliaccia C, Rappuoli R, Telford JL, et al. Helicobacter
pylori VacA cytotoxin associated with the bacteria increases epithelial permeability
independently of its vacuolating activity. Microbiology. 1999;145(8): 2043-50.
Rad R, Gerhard M, Lang R, Schoniger M, Rosch T, Schepp W, et al. The Helicobacter pylori
blood group antigen-binding adhesin facilitates bacterial colonization and augments a
nonspecific immune response. J Immunol. 2002;168: 3033-41.
Robinson K, Kenefeck R, Pidgeon E, Shakib S, Patel S, Polson R, et al. Helicobacter
pylori-induced peptic ulcer disease is associated with inadequate regulatory T-cell responses. Gut.
2008;57:1375-85.
Seo JH, Lim JW, Kim H, Kim KH. Helicobacter pylori in a Korean isolate activates
mitogen-activated protein kinases, AP-1, and NF-kappaB and induces chemokine expression in gastric
epithelial AGS cells. Lab Invest. 2004;84:49-62.
Sundrud MS, Torres VJ, Unutmaz D, Cover TL. Inhibition of primary human T cell
proliferation by Helicobacter pylori vacuolating toxin (VacA) is independent of VacA effects
on IL-2 secretion. Proc Natl Acad Sci U S A. 2004;101:7727-32.
Suzana MK, Skender T, Emine DS, Halil A, Vjollca SM, Agron K, et al. Helicobacter pylori
gastritis updated sydney classification applied in our material. Sec. Biol. Med. Sci. 2009;30(1):45–60.
Szoke D. Genetic factors related to the histological and macroscopic lesions of the stomach.
[disertasi]. Budapest: Semmelweis University; 2009. Hlm 7-61.
Viala J, Chaput C, Boneca IG, Cardona A, Girardin SE, Moran AP, et al. Nod1 responds to
peptidoglycan delivered by the Helicobacter pylori cag pathogenicity island. Nat Immunol.
2004; 5: 1166-74.
Xuan J, Deguchi R, Yanagi H, Ozawa H, Urano T, Ogawa Y, et al. Relationship between
gastric mucosal IL-8 levels and histological gastritis in patients with Helicobacter pylori
infection. Tokai J Exp Clin Med. 2005;30(2):83-8.
Yamada H, Aihara T, Okabe S. Mechanism for Helicobacter pylori stimulation of
interleukin-8 production in a gastric epithelial cell line (MKN 28): roles of mitogen-activated
protein kinase and interleukin-1beta. Biochem Pharmacol. 2001;61:1595-604.
Yamaoka Y, Kita M, Kodama Y, Sawai N, Imanishi J. Helicobacter pylori cagA gene and
expression of cytokine messenger RNA in gastric mucosa. Gastroenterology. 1996;
110:1744-52.
Yamaoka Y, Kodama T, Kita M, Imanishi J, Kashima K, Graham DY. Relation between
cytokines and Helicobacter pylori in gastric cancer. Helicobacter. 2001;6(2):116-24.
Zakaria Z. The role of interleukin-10 in Helicobacter pylori infection. Master [Tesis].
Nottingham,UK: University of Nottingham; 2010.hlm. 55.
Zhang Z, Zheng Q, Chen X, Xiao S, Liu W, Lu H. The Helicobacter pylori duodenal ulcer
promoting gene, dupA in China. BMC Gastroenterol. 2008;8:49-54.
Zuniga-Noriega JR, Bosques-Padilla FJ, Perez GI, et al. Diagnostic utility of invasive test and
serology for the diagnosis of Helicobacter pylori infection in different clinical presentation.