1
PEMBUATAN GLUKOSAMIN HIDROKLORIDA (GlcN HCl)
DENGAN METODE AUTOKLAF
ERNAWATI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSITUT PERTANIAN BOGOR
BOGOR
2
RINGKASAN
ERNAWATI. C34080060. Pembuatan Glukosamin Hidroklorida (GlcN HCl) dengan Metode Autoklaf. Dibimbing oleh PIPIH SUPTIJAH dan BUSTAMI IBRAHIM.
World Health Organization (WHO) memperkirakan bahwa tahun 2020 osteoarthritis akan menjadi penyebab utama cacat fisik umat manusia di dunia terutama lansia. Terdapat beberapa cara yang dapat dilakukan untuk mengatasi osteoarthritis diantaranya ialah dengan mengkonsumsi glukosamin. Seiring dengan semakin meningkatnya kebutuhan dunia terhadap konsumsi glukosamin, maka diperlukan suatu upaya untuk menyediakan glukosamin dalam jumlah besar dengan metode produksi yang dapat diandalkan dari segi kualitas produk dan kelimpahannya (rendemen).
Tujuan penelitian adalah untuk memperoleh metode pembuatan glukosamin hidroklorida yang aman, praktis, dan efisien melalui penggunaan autoklaf serta menganalisis karakteristik glukosamin yang dihasilkan.
Metode yang digunakan merujuk pada penelitian Rismawan (2012) dengan mengkombinasikan waktu pemanasan, konsentrasi asam, dan perlakuan tekanan vakum. Proses ekstraksi diawali dengan merendam sampel kitin atau kitosan sebanyak 2,5 gram dalam larutan HCl (1:9) (b/v). Perlakuan yang diberikan ialah konsentrasi HCl 1:2, 1:3, dan 1:4 atau 18,5%, 12,3%, 9,2% (v/v) untuk sampel kitin dan HCl 0-22% (v/v) dengan interval konsentrasi 2% untuk sampel kitosan. Waktu pemanasan yang diberikan adalah 30, 60, 90, dan 120 menit pada tekanan vakum 0,5 dan 1 atm. Perlakuan terbaik dilihat dari karakteristik kelarutan, derajat putih, dan kosentrasi HCl yang digunakan.
Produksi GlcN HCl dapat dilakukan dengan teknik sederhana yakni melalui penggunaan autoklaf. Perlakuan terbaik GlcN HCl diperoleh pada penggunaan HCl 8% (v/v) dengan tekanan maksimum 1 atm selama 1 jam. Glukosamin hidroklorida hasil penelitian memiliki karakteristik yakni larut sempurna dalam air, berbentuk serbuk berwarna putih kekuningan dengan nilai LoD 0,92%, titik leleh 190-192 oC, dan rendemen 69,80%. Spektrum FTIR menunjukkan pola pita serapan gugus fungsi yang mirip antara GlcN HCl hasil hidrolisis dengan standar yang menunjukkan bahwa hidrolisis GlcN HCl dari kitosan berhasil dilakukan.
3
PEMBUATAN GLUKOSAMIN HIDROKLORIDA (GlcN HCl)
DENGAN METODE AUTOKLAF
ERNAWATI
C34080060
SKRIPSI
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSITUT PERTANIAN BOGOR
BOGOR
i
Judul Skripsi : Pembuatan Glukosamin Hidroklorida (GlcN HCl) dengan Metode Autoklaf
Nama : Ernawati
NIM : C34080060
Program Studi : Teknologi Hasil Perairan
Menyetujui,
Mengetahui,
Tanggal Pengesahan : Dosen Pembimbing I
Dr. Pipih Suptijah, M.BA NIP. 19531001 198503 2 001
Dosen Pembimbing II
Dr. Ir. Bustami Ibrahim, M.Sc NIP. 19611101 198703 1 002
Ketua Departemen Teknologi Hasil Perairan
ii
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul “Pembuatan Glukosamin Hidroklorida (GlcN HCl) dengan Metode Autoklaf” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Nopember 2012
iii
RIWAYAT HIDUP
Penulis lahir di Bandung pada 26 Nopember 1990. Penulis merupakan anak kedua dari lima bersaudara dari pasangan ayah bernama Endang Koswara dan ibu bernama Sari Mulyati. Riwayat pendidikan formal penulis dimulai dari SDN Wangunsari Ciamis (1996-1999), kemudian pindah sekolah ke SDN Sukapura V Bandung (1999-2002). Selanjutnya penulis menempuh pendidikan menengah di SMPN 34 Bandung (2002-2005) dan SMAN 8 Bandung (2005-2008). Tahun 2008, penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan, penulis aktif mengikuti berbagai organisasi kemahasiswaan intra kampus. Organisasi yang pernah diikuti penulis yaitu Organisasi Mahasiswa Daerah (OMDA) Pamaung (2008) sebagai anggota, Bimbingan Remaja dan Anak (Birena) Lembaga Dakwah Kampus Al Hurriyyah (2008-2010), Asrama Putri Darmaga (2009-2012) sebagai ketua divisi PSDMK, serta Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (BEM FPIK) (2009-2010) sebagai bendahara divisi HRD dan Sekretaris divisi PSDM (2010-2011). Penulis aktif dalam berbagai kegiatan kepanitiaan kemahasiswaan di lingkungan kampus. Selain itu, penulis berpengalaman menjadi asisten mata kuliah Avertebrata Air (2010), Pendidikan Agama Islam (2011-2012), Teknologi Pengolahan Hasil Perairan (2012) dan Kitin Kitosan (2012).
Penulis melakukan praktek lapangan serta menyelesaikan laporan magang yang berjudul “Identifikasi Critical Control Point (CCP) pada Produksi Fresh Tuna H&G (Headed And Gutted) di PT Madidihang Freshindo, Muara
iv
KATA PENGANTAR
Alhamdulillah, puji dan syukur kepada Allah SWT karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan tugas akhir skripsi yang berjudul
“Pembuatan Glukosamin Hidroklorida (GlcN HCl) dengan Metode Autoklaf”. Penulis mengucapkan terima kasih kepada semua pihak yang telah berperan dalam penyusunan skripsi ini, terutama kepada:
1. Dr. Dra. Pipih Suptijah, M.BA dan Dr. Ir. Bustami Ibrahim, M.Sc atas segala saran, bimbingan dan arahan dalam penyusunan skripsi ini.
2. Dr. Sugeng Heri Suseno, S.Pi, M.Si selaku dosen penguji atas segala koreksi dan saran yang diberikan.
3. Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen Teknologi Hasil Perairan.
4. Dr. Ir. Agoes M Jacoeb, Dipl. Biol. selaku Komisi Pendidikan departemen Teknologi Hasil Perairan.
5. Bunda Mimy, Bunda Wahyu, dan ayah bunda Genksi Social Fund atas segala dukungan baik secara materil maupun moril kepada penulis.
6. Yayasan BMM Sejati dan PT Van Melle atas dukungan dana yang diberikan selama penelitian.
7. Bu Ema, Mb Dini, Mas Rizky atas segala kesabaran dan bantuannya kepada penulis selama penelitian.
8. Asisten kitin kitosan 2012, terima kasih dari hati terdalam atas kebersamaannya, semoga ilmu yang kita peroleh dapat bermanfaat kelak. 9. Teman-teman THP 45 atas segala semangat, dukungan mental, dan
spiritual serta memori indah yang terjalin selama ini.
10.Teman-teman angkatan rE. terima kasih tak terkira atas kebersamaan, kenangan, suka duka, dan dukungan selama ini. Semoga ukhuwah ini senantiasa terjaga hingga akhir hayat.
11.Mamah, Bapak, A Asep, Diwan, Haidah, dan Taopik, atas segala do’a, dukungan dan perhatian yang tiada henti.
v
Penulis sangat menyadari bahwa penyusunan skripsi ini masih jauh dari sempurna. Penulis mengharapkan kritik dan saran membangun demi perbaikan di masa mendatang. Akhir kata semoga hasil penelitian sederhana ini dapat bermanfaat bagi pihak yang memerlukan.
Bogor, Nopember 2012
vii
Halaman
5 SIMPULAN DAN SARAN ... 24
5.1 Simpulan ... 24
5.2 Saran ... 24
DAFTAR PUSTAKA... 25
viii
DAFTAR GAMBAR
Nomor Halaman
1 Struktur kimia glukosamin hidroklorida ... 4
2 Struktur kimia kitin ... 6
3 Struktur kimia kitosan ... 7
4 Diagram alir uji pendahuluan (UP) 1 ... 10
5 Diagram alir uji pendahuluan (UP) 2 ... 10
6 Diagram alir penelitian inti ... 11
7 Kelarutan glukosamin hidroklorida dari kitin ... 15
8 Grafik rendemen dan derajat putih GlcN ... 17
9 Glukosamin hidroklorida 8% setelah dilarutkan ... 18
10 Kitosan udang untuk pembuatan GlcN HCl ... 19
ix
DAFTAR TABEL
Nomor Halaman
1 Spesifikasi mutu glukosamin hidroklorida (GlcN) menurut US
Pharmacopeia (USP) ………..……….. 5
2 Karakteristik kelarutan, derajat putih, dan rendemen glukosamin
hidroklorida dari kitin………... 14 3 Karakteristik glukosamin dari kitosan pada perlakuan asam yang
berbeda………...…... 17
x
DAFTAR LAMPIRAN
Nomor Halaman
1 PENDAHULUAN
1.1Latar Belakang
Meningkatnya penyakit kronis seperti penyakit jantung, diabetes, kanker, dan radang sendi berpengaruh pada tingginya biaya kesehatan yang harus dikeluarkan masyarakat (Kralovec dan Barrow 2008). Organisasi Kesehatan Dunia (WHO) memasukkan osteoarthritis sebagai salah satu dari empat kondisi otot dan tulang yang membebani individu, sistem kesehatan maupun sistem perawatan sosial dengan biaya yang cukup besar. Di dunia diperkirakan setidaknya terdapat 9,6% pria dan 18% wanita di atas usia 60 tahun menderita osteoarthritis (OA). Kasus tersebut diduga akan terus meningkat akibat bertambahnya usia harapan hidup, obesitas (kegemukan) dan kebiasaan merokok (Merdikoputro dan Asri 2006).
Tahun 2020, WHO juga memperkirakan OA akan menjadi penyebab utama cacat fisik pada umat manusia setelah arthritis rematoid (jenis penyakit rematik yang mengenai jari tangan/jari kaki), osteoporosis (keropos tulang) dan nyeri punggung bawah. Indonesia merupakan negara ke-4 dengan jumlah orang lanjut usia (lansia) terbanyak sesudah negara China, India dan Amerika Serikat (Merdikoputro dan Asri 2006).
Jumlah penderita OA di Indonesia paling banyak ditemukan terutama pada lansia dengan rentang usia di atas 50 tahun. Lebih dari 85% orang berusia 65 tahun menggambarkan OA pada gambaran x-ray, meskipun 35-50% hanya mengalami gejala. Kecenderungan terjadinya osteoarthritis pada orang berumur di bawah 45 tahun lebih banyak terjadi pada pria sedangkan pada umur 55 tahun lebih banyak terjadi pada wanita. Perbandingan penderita OA wanita dan pria adalah 4:1 (Reksoprajo 2000 dalam Utami 2010).
terjangkau menjadi penting untuk dilakukan.
Afridiana (2011) berhasil membuat glukosamin hidroklorida dengan tingkat kemurnian sebesar 45,64% dari kitin udang pada perlakuan HCl 37% (pekat) dengan suhu pemanasan 90 oC selama 4 jam. Rismawan (2012) berhasil membuat glukosamin dari kitosan dengan rendemen 51,04% pada perlakuan HCl 22% dengan tekanan vakum 1 atm selama 2 jam. Penelitian Rismawan (2012) dinilai lebih praktis karena tidak memerlukan proses pengadukan yang kontinyu dalam proses pembuatannya.
Pada penelitian ini akan dilakukan pengembangan dari penelitian terdahulu yaitu mendapatkan kondisi optimum pembuatan glukosamin hidroklorida dari kitin atau kitosan pada skala laboratorium dengan metode pembuatan yang sederhana yakni menggunakan autoklaf. Hasil penelitian yang diharapkan adalah diperolehnya metode pembuatan glukosamin hidroklorida yang efektif dan efisien dari segi kualitas, waktu maupun biaya produksi. Karakteristik yang akan dilihat diantaranya tingkat kelarutan, warna, titik leleh (melting point temperature), pita serapan infra merah (uji FTIR), dan nilai rendemen glukosamin.
1.2Tujuan
Tujuan dari penelitian ini adalah
1. Memperoleh metode pembuatan glukosamin hidroklorida (GlcN HCl) yang praktis dan efisien melalui penerapan teknologi sederhana dan aman. 2. Menganalisis karakteristik produk glukosamin hidroklorida (GlcN HCl)
2 TINJAUAN PUSTAKA
2.1Osteoarthritis (OA)
Osteoarthritis yang juga sebagai penyakit degeneratif pada sendi adalah bentuk penyakit radang sendi yang paling umum dan merupakan sumber utama penyebab rasa sakit dan lumpuh, terutama pada orang lanjut usia (lansia). OA merupakan penyakit degeneratif kronik pada sendi yang terjadi akibat menipisnya lapisan tulang rawan yang melindungi ujung tulang sejati. Tulang rawan menjadi kasar sehingga menimbulkan gesekan dan peradangan. Bentuk kerusakan yang terjadi ialah perubahan struktural dan pengikisan kartilago yang menimbulkan rasa sakit dan kaku (Kralovec dan Barrow 2008).
OA dapat disebabkan oleh penekanan beban tubuh yang secara terus-menerus terhadap persendian, sehingga mengakibatkan kerusakan terhadap tulang rawan sendi. Akibat lanjut dari OA diantaranya adalah timbulnya rasa nyeri karena terjepitnya ujung-ujung saraf sensoris oleh osteofit-osteofit yang terbentuk serta adanya pembengkakan dan penebalan jaringan lunak di sekitar sendi yang akan mengakibatkan deformitas, terlepasnya osteofit pada suatu gerakan menimbulkan krepitasi pada sendi tersebut (Carter 1995 dalam Utami 2010).
2.2Glukosamin hidroklorida (GlcN HCl)
Glukosamin hidroklorida memiliki nama lain yakni 2-amino-2-deoxy-D-glucopyranose, kitosamin hidroklorida, dan D-(+)-glukosamin hidroklorida. Secara struktural, glukosamin merupakan gula beramin dengan rumus molekul C6H13NO5HCl dan massa molekul 215,63 Da. Glukosamin dalam bentuk murni berbentuk serbuk kristal putih dengan titik leleh 190-194 oC. Glukosamin memiliki kelarutan tinggi dalam air dengan titik larut 100 mg/mL pada suhu 20 oC (Kralovec dan Barrow 2008). Struktur kimia glukosamin hidroklorida ditunjukkan oleh Gambar 1.
Gambar 1 Struktur kimia glukosamin hidroklorida (Mojarrad et al. 2007) menimbulkan kekakuan pada sendi sehingga menyebabkan penyakit osteoarthritis (OA). Pemberian glukosamin sulfat secara oral dapat membantu produksi cairan synovial untuk mencegah dan mengobati penyakit OA (Williams 2004 dalam Afridiana 2011). Penelitian Kulkarni et al. (2012) menunjukkan bahwa konsumsi glukosamin hidroklorida dan atau glukosamin sulfat terhadap pasien penderita OA (tingkat sedang) berpengaruh nyata terhadap pengurangan rasa nyeri pada sendi. Dosis harian untuk konsumsi glukosamin menurut Badan Pengawas Obat dan Makanan Republik Indonesia (BPOM RI) tahun 2004 adalah 1500 mg/ hari. Hasil penelitian Hathcock dan Andrew (2006) menunjukkan bahwa asupan glukosamin secara oral pada dosis 2000 mg/ hari aman untuk dikonsumsi. Adapun efek konsumsi glukosamin terhadap tubuh dapat dilihat setelah satu bulan pemakaian. Mutu glukosamin hidroklorida menurut standar United State Pharmacopeia (USP) ditunjukkan pada Tabel 1.
Tabel 1 Spesifikasi mutu glukosamin hidroklorida (GlcN) menurut (USP)
Sumber: USP 2006 dalam Cargill Inc. 2006 2.3Kitin
Kitin adalah polisakarida struktural yang umum digunakan untuk menyusun eksokleton dari artropoda (serangga, laba-laba, krustase, dan hewan-hewan lain sejenis). Kitin juga tergolong homopolisakarida linear yang tersusun atas residu N-asetilglukosamin pada rantai beta dan memiliki monomer berupa molekul glukosa dengan cabang yang mengandung nitrogen. Kitin murni mirip dengan kulit, namun akan mengeras ketika dilapisi dengan garam kalsium karbonat CaCO3. Kitin membentuk serat mirip selulosa yang tidak dapat dicerna oleh vertebrata (Sugita et al 2009).
Keberadaan kitin di alam umumnya terikat dengan protein, mineral, dan berbagai macam pigmen. Contohnya, kulit udang mengandung 25-40% protein, 40-50% CaCO3, dan 15-20% kitin, tetapi besarnya komponen tersebut masih bergantung pada jenis udangnya (Altschul 1976 dalam Sugita et al. 2009) sedangkan kulit kepiting mengandung protein (15,60-23,90%), kalsium karbonat (53,70-78,40%) dan kitin (18,70-32,20%), hal ini tergantung pada jenis kepiting tempat hidupnya (Focher 1992 dalam Sugita et al. 2009).
Secara kimia, struktur kitin merupakan poli (2-asetamido-2-deoksi-β-(1→4) -D-glukopiranosa) dengan rumus molekul (C8H13NO5)n yang tersusun atas 47% C, 6% H, 7% N, dan 40% O. Struktur kitin menyerupai struktur selulosa dan hanya berbeda pada gugus yang terikat di posisi atom C2. Gugus pada C2 selulosa Uji USP-NF Spesifikasi USP-NF
Penampakan Serbuk putih
Spesifik rotasi Antara +70.0o sampai +73.0o (larutan uji 25 mg/mL) pH 3.0-5.0, dalam larutan 20 mg/mL
adalah gugus hidroksil -OH, sedangkan pada C2 kitin adalah gugus N-asetil (Muzzarelli 1977). Struktur kimia kitin ditunjukkan oleh Gambar 2.
Gambar 2 Struktur kimia kitin (Muzzarelli 1977).
Kitin tidak larut dalam pelarut biasa tetapi cenderung stabil dalam asam maupun basa lemah. Kitin dapat dideasetilasi sehingga membentuk produk turunan seperti kitosan, oligosakarida, dan glukosamin. Bentuk turunan ini memiliki manfaat lebih besar sebagai neutraceutical (Kralovec dan Barrow 2008). Proses isolasi kitin pada dasarnya terdiri dari tiga tahap, yaitu: tahap pemisahan protein (deproteinasi), tahap pemisahan mineral (demineralisasi), dan tahap penghilangan warna (depigmentasi) (Savitri et al. 2010).
2.4Kitosan
Kitosan merupakan produk deasetilasi kitin melalui proses reaksi kimia menggunakan basa natrium hidroksida atau reaksi enzimatis menggunakan enzim kitin deacetylase. Kitosan merupakan biopolimer yang resisten terhadap tekanan mekanik. Unsur-unsur yang menyusun kitosan hampir sama dengan unsur-unsur yang menyusun kitin yaitu C, H, N, O dan unsur-unsur lainnya. Kitosan adalah turunan kitin yang diisolasi dari kulit kepiting, udang, rajungan, dan kulit serangga lainnya. Kitosan merupakan kopolimer alam berbentuk lembaran tipis, tidak berbau, terdiri dari dua jenis polimer, yaitu poli (2-Deoksi-2-asetilamin-2-Glukosa) dan poli (2-Deoksi-2 Aminoglukosa)
yang berikatan β-D (1–4 ) (Hirano 1986).
nitrat serta larut baik dalam asam lemah seperti asam formiat dan asam asetat (Sugita et al 2009). Struktur kimia kitosan ditunjukkan pada Gambar 8.
Gambar 3 Struktur kimia kitosan (Hirano 1986).
Tahap utama yang berperan penting dalam proses transformasi kitin menjadi kitosan ialah tahap deasetilasi dengan penggunaan basa kuat KOH atau NaOH. Proses deasetilasi gugus asetil pada asetamida kitin dapat dijelaskan sebagai berikut: gugus karbon karbonil diserang oleh nukleofil OH-, akibatnya terjadi reaksi adisi sehingga terbentuk zat antara. Zat antara ini selanjutnya mengalami reaksi elimininasi sehingga gugus asetil pada asetamida kitin lepas membentuk asetat. Proses pelepasan gugus asetil dari gugus asetamida kitin berhubungan dengan konsentrasi ion OH- pada larutan. Konsentrasi OH- akan lebih besar pada larutan basa kuat. Semakin kuat suatu basa semakin besar konsentrasi OH- dalam larutannya. Dengan demikian kekuatan basa mempengaruhi proses deasetilasi gugus asetil dari gugus asetamida kitin (Azhar et al. 2010).
2.5Fourier Transform Infra Red (FTIR)
Fourier Transform Infra Red (FTIR) merupakan suatu teknik spektroskopi inframerah yang dapat mengidentifikasi kandungan gugus fungsi suatu senyawa termasuk senyawa kalsium fosfat, namun tidak dapat mengidentifikasi unsur-unsur penyusunnya. Ada dua jenis energi vibrasi yaitu vibrasi bending dan vibrasi stretching. Vibrasi bending yaitu pergerakan atom yang menyebabkan perubahan sudut ikatan antara dua ikatan atom atau pergerakan dari seluruh atom terhadap atom lainnya. Sedangkan vibrasi stretching adalah pergerakan atom yang teratur sepanjang sumbu ikatan antara dua atom sehingga jarak antara dua atom dapat bertambah atau berkurang (Samsiah 2009).
Spektroskopi IR digunakan untuk menetukan struktur molekul melalui sederetan gugus fungsi yang berdasarkan pada perubahan amplitudo vibrasi yang diawali oleh terjadinya aksi antara molekul dengan radiasi infra merah yang medan listriknya memiliki frekuensi sama. Prinsip dasar dari spektrofotometri IR adalah perubahan amplitudo radiasi IR dari gugus dalam molekul pada energi (bilangan gelombang atau bilangan gelombang) yang sesuai. Pengujian FTIR memiliki beberapa keuntungan, yakni relatif cepat, sampel tidak perlu murni, dan tingkat ketelitian tinggi (Pavia et al. 2009).
3 METODE
3.1Waktu dan Tempat
Penelitian ini dilakukan pada bulan Agustus sampai dengan September 2012. Laboratorium yang digunakan yaitu Laboratorium Biokimia Hasil Perairan I untuk preparasi sampel dan pembuatan larutan HCl, Unit Produksi Hasil Perairan untuk autoklaf sampel, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Kimia Analisis Departemen Kimia untuk analisis titik leleh dan Laboratorium Analisis Bahan Departemen Fisika untuk pengujian FTIR, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
3.2Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah Erlenmeyer 250 ml, autoklaf bertekanan 2 atm, FTIR Perkin Elmer SpektrumOne, pemanas listrik titik leleh MelTemp, gelas piala 100 ml, pipet morr 10 ml, gelas ukur 50 ml, oven, kertas pH, kertas saring, dan timbangan digital. Bahan yang digunakan adalah kitin dan kitosan komersil yang diperoleh dari PT Biotech Surindo Cirebon, HCl 12 N (teknis), Isoprophyl Alcohol/ IPA (teknis), dan akuades.
3.3Metode Penelitian
Penelitian ini dibagi menjadi dua tahap utama yakni tahap pendahuluan dan tahap penelitian inti. Penelitian pendahuluan dimaksudkan untuk menentukan kombinasi perlakuan terbaik dalam pembuatan glukosamin. Bahan baku utama yang digunakan pada penelitian pendahuluan ialah kitin dan kitosan komersial. Penelitian inti dimaksudkan untuk membuat dan mengkarakterisasi glukosamin yang dihasilkan. Karakter fisik dan kimia glukosamin yang diamati meliputi penampakan, warna, kelarutan, titik leleh (melting point temperature), dan serapan pita amida (uji FTIR).
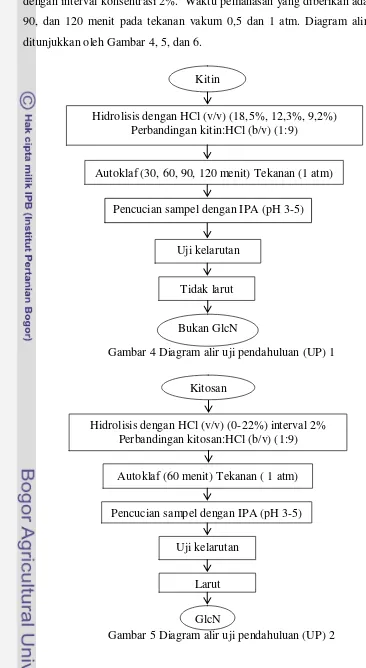
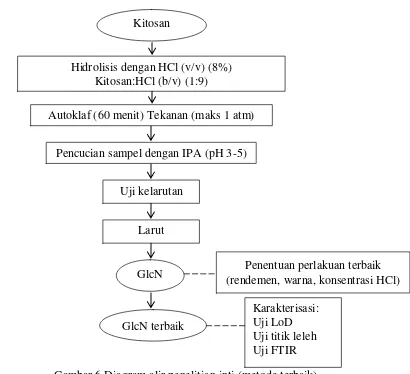
HCl 18,5%, 12,3%, dan 9,2% (v/v) untuk sampel kitin dan HCl 0-22% (v/v) dengan interval konsentrasi 2%. Waktu pemanasan yang diberikan adalah 30, 60, 90, dan 120 menit pada tekanan vakum 0,5 dan 1 atm. Diagram alir penelitian ditunjukkan oleh Gambar 4, 5, dan 6.
Gambar 4 Diagram alir uji pendahuluan (UP) 1
Gambar 5 Diagram alir uji pendahuluan (UP) 2 Kitin
Hidrolisis dengan HCl (v/v) (18,5%, 12,3%, 9,2%) Perbandingan kitin:HCl (b/v) (1:9)
Autoklaf (30, 60, 90, 120 menit) Tekanan (1 atm)
Uji kelarutan
Tidak larut
Bukan GlcN
Pencucian sampel dengan IPA (pH 3-5)
Uji kelarutan
Autoklaf (60 menit) Tekanan ( 1 atm)
GlcN Kitosan
Hidrolisis dengan HCl (v/v) (0-22%) interval 2% Perbandingan kitosan:HCl (b/v) (1:9)
Pencucian sampel dengan IPA (pH 3-5)
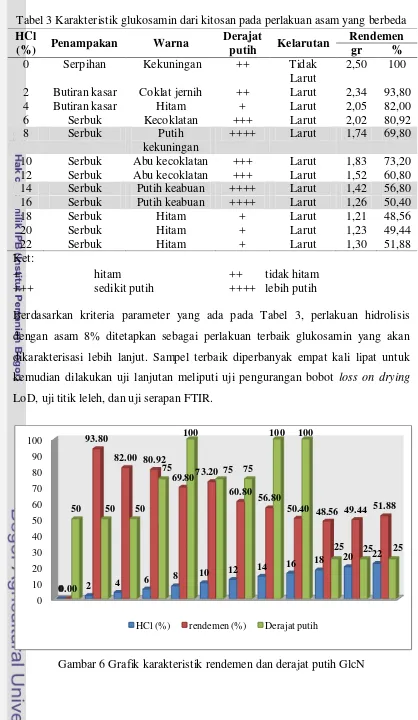
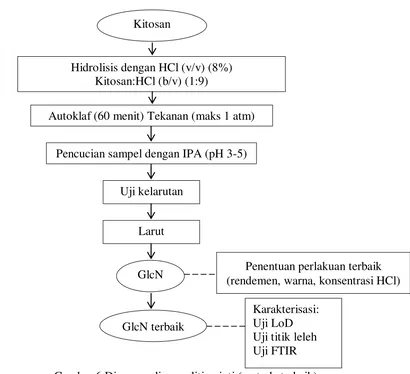
Gambar 6 Diagram alir penelitian inti (metode terbaik)
Sampel yang telah diautoklaf dicuci dengan IPA atau alkohol hingga pH nya mencapai 3-5. Sampel kemudian dioven pada suhu 80 oC selama 4 jam dan dihitung rendemennya. Selanjutnya dilakukan uji karakter fisika glukosamin yakni uji Fourier Transform Infra Red (FTIR), uji titik leleh, dan kenampakan warna.
3.3.1Uji kelarutan
Kelarutan merupakan salah satu cara yang paling mudah dilakukan untuk mengenali sampel sebagai glukosa atau glukosamin. Uji ini dilakukan dengan cara melarutkan sampel glukosamin dalam air. Sampel sebanyak 100 mg dilarutkan dalam 1 ml air dingin bersuhu 20 oC sehingga sampel larut sempurna.
3.3.2Penampakan dan warna
Penampakan glukosamin dianggap baik jika glukosamin berbentuk serbuk setelah dihaluskan. Warna sampel glukosamin dianggap baik jika berwarna putih
GlcN terbaik
Autoklaf (60 menit) Tekanan (maks 1 atm)
GlcN Kitosan
Hidrolisis dengan HCl (v/v) (8%) Kitosan:HCl (b/v) (1:9)
Pencucian sampel dengan IPA (pH 3-5)
Larut
atau mendekati putih. Penampakan dan warna dilihat langsung secara visual kemudian dibandingkan dengan glukosamin standar yang sudah ada.
3.3.3Spektrum glukosamin hidroklorida (GlcN HCl)
Penentuan spektrum glukosamin hasil penelitian ditentukan melalui uji FTIR (Fourier Transform Infra Red). Padatan glukosamin hidroklorida hasil hidrolisis dan standar masing-masing dicampur dengan KBr dengan nisbah 1:100 lalu digerus sampai rata dengan menggunakan mortar. Campuran ini ditempatkan dalam alat pengepresan dan dilakukan pengepresan pada tekanan beban 800 kg. Kepingan hasil pengepresan diukur absorbansinya menggunakan FTIR. Kisaran scanning yang digunakan antara 450 cm-1 hingga 4000 cm-1.
Sampel glukosamin yang diuji adalah glukosamin terbaik hasil penelitian. Absorbansi grafik spektrum glukosamin hasil hidrolisis kemudian dibandingkan dengan absorbansi spektrum glukosamin standar dari penelitian terdahulu. Glukosamin hasil uji dianggap baik (cukup murni) jika kisaran absorbansi spektrumnya tidak jauh berbeda dengan kisaran absorbansi glukosamin standar.
3.3.4Uji titik leleh (AOAC 1995)
Uji titik leleh dilakukan dengan bantuan alat MelTemp. Serbuk glukosamin hidroklorida dimasukkan ke dalam pipa kapiler melalui ujung tabung yang terbuka. Dasar pipa kemudian diketuk di bagian bawah atau dijatuhkan melalui sebuah tabung sempit yang panjang. Hal ini dimaksudkan agar glukosamin menjadi padat sehingga proses pelelehan berlangsung secara merata. Cara ini dilakukan berulang kali untuk mendapatkan contoh padat dalam tabung setinggi 1,5-3 mm. Tabung kapiler dimasukkan ke dalam pemanas listrik yang dilengkapai dengan termometer 400 oC untuk penetapan titik leleh. Alat dinyalakan dan suhu dinaikkan perlahan sampai titik leleh tercapai. Pengujian titik leleh ini dilakukan secara triplo.
3.3.5Uji loss on drying (LoD) (USP 2006)
setelah pengovenan nilainya tidak lebih dari 1%. Persentase LoD dihitung dengan rumus
LoD (%) = �1−�2 (� )
�1 (� )
�
100%
dengan:
W1: Bobot sampel awal sebelum dioven W2: Bobot sampel setelah dioven
3.3.6Perhitungan rendemen
Perhitungan rendemen dimaksudkan untuk mengetahui kadar efektif sampel kitin atau kitosan yang dapat diubah menjadi glukosamin. Rendemen diperoleh dengan cara membandingkan bobot glukosamin dengan bobot awal sampel kitin atau kitosan yang digunakan. Rendemen glukosamin yang dihasilkan dihitung dengan menggunakan rumus
Rendemen (%) = � � � � � (� )
4 HASIL DAN PEMBAHASAN
Pembuatan glukosamin hidroklorida (GlcN HCl) pada penelitian ini dilakukan melalui proses hidrolisis pada autoklaf bertekanan 1 atm. Berbeda dengan proses hidrolisis glukosamin pada suhu 90 oC disertai proses pengadukan selama 4 jam yang dilakukan oleh Afridiana (2011), pembuatan glukosamin dengan autoklaf dapat dilakukan tanpa pengadukan dengan waktu pemanasan lebih singkat yakni 1 jam. Pembuatan glukosamin hidroklorida dilakukan dalam dua tahap penelitian pendahuluan dengan menggunakan sampel kitin dan kitosan.
4.1 Pembuatan Glukosamin Hidroklorida dari Kitin
Penelitian pendahuluan I dilakukan dengan menggunakan sampel kitin. Sampel dihidrolisis dengan dua ragam perlakuan yakni konsentrasi HCl (18,5%, 12,3%, dan 9,2%) serta waktu pemanasan (30, 60, 90, dan 120 menit) pada tekanan 1 atm. Indikator pertama yang digunakan untuk menentukan keberhasilan hidrolisis kitin menjadi glukosamin hidroklorida adalah tingkat kelarutannya dalam air. Kelarutan glukosamin kitin ditunjukkan pada Tabel 2 dan Gambar 4.
Tabel 2 memperlihatkan bahwa dari semua perlakuan yang diberikan, tidak ada sampel glukosamin yang larut dalam air. Hal ini menunjukkan bahwa kitin belum terhidrolisis menjadi glukosamin. Konsentrasi HCl yang digunakan diduga terlalu rendah sehingga belum cukup mampu menghidrolisis kitin menjadi glukosamin meskipun perlakuan tekanan telah diterapkan. Kralovec dan Barrow (2008) menyatakan bahwa kadar asam yang rendah menyebabkan terjadinya hidrolisis yang tidak sempurna.
Semua sampel kitin dari setiap perlakuan asam dan waktu pemanasan menunjukkan tingkat kelarutan yang hampir sama seperti ditunjukkan Gambar 7.
Gambar 7 Kelarutan glukosamin hidroklorida dari kitin
Sesaat setelah dilarutkan, sampel membentuk dua fase yang berbeda yakni fase cair dan padatan. Karakter kelarutan sampel ini jauh berbeda dengan karakteristik glukosamin seperti yang diungkapkan oleh Kralovec dan Barrow (2008) bahwa glukosamin hidroklorida bersifat larut sempurna dalam air bersuhu 20 oC dengan konsentrasi 100 mg/ ml. Berdasarkan data kelarutan yang ditunjukkan Tabel 2 dapat disimpulkan bahwa sampel belum terhidrolisis menjadi glukosamin.
Hidrolisis glukosamin dengan metode autoklaf pada dasarnya merupakan sistem kerja yang menggabungkan fungsi tekanan dan asam. Tekanan berperan penting dalam pemotongan ikatan polimer menjadi unit-unit yang lebih kecil. Asam HCl berperan dalam pembentukan ikatan dengan gugus amin –NH2 setelah gugus asetil –COCH3 terpotong. Mekanisme kinerja asam dan tekanan terhadap sampel dapat dijelaskan sebagai berikut: glukosamin hidroklorida dapat larut dalam air karena adanya ikatan gugus –OH dan NH2Cl. Kitin merupakan polimer yang masih mengandung gugus asetil –COCH3 yang terikat kuat pada gugus amin
–NH2. Gugus asetil ini harus dihilangkan sehingga gugus amin dapat berikatan Fase cair
dengan –Cl dari asam HCl dan membentuk ikatan NH3Cl. Fungsi tekanan pada autoklaf hanya membantu proses pemotongan rantai polimer kitin menjadi lebih pendek. Tekanan tidak dapat memotong gugus asetil karena gugus asetil hanya dapat dipisahkan oleh basa kuat seperti KOH atau NaOH. Adanya gugus asetil menghalangi ion –Cl untuk berikatan dengan gugus amin –NH2 membentuk kompleks NH3Cl sehingga sampel glukosamin dari kitin tidak bersifat larut air.
Kitin cenderung stabil pada asam dan basa lemah namun dapat larut pada asam kuat dengan konsentrasi tinggi. Glukosamin yang dibuat dari kitin diduga dapat terhidrolisis sempurna pada penggunaan HCl dengan konsentrasi lebih tinggi serta waktu pemanasan yang cukup panjang. Akan tetapi, hal ini dirasa kurang efisien dari segi biaya dan waktu hidrolisis. Merujuk pada penelitian hidrolisis glukosamin hidroklorida dari kitosan oleh Rismawan (2012), maka dilakukan uji pendahuluan tahap 2 untuk menentukan teknik hidrolisis glukosamin hidroklorida yang lebih efisien.
4.2 Pembuatan Glukosamin Hidroklorida dari Kitosan
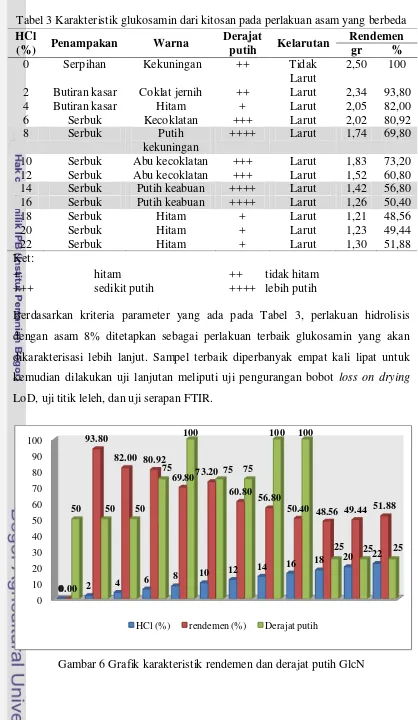
Merujuk pada penelitian Rismawan (2012) yang telah berhasil membuat glukosamin hidroklorida dari kitosan, maka dilakukan penelitian pendahuluan 2 dengan menggunakan sampel kitosan. Perlakuan terbaik Rismawan (2012) adalah penggunaan HCl 22% (v/v) dengan waktu pemanasan selama 2 jam pada autoklaf bertekanan 1 atm. Peubah yang diragamkan pada penelitian ini adalah konsentrasi asam yang diberikan berkisar antara 0 hingga 22% (v/v) dengan interval 2%. Perlakuan waktu pemanasan yang diberikan adalah 1 jam. Karakteristik hasil uji pendahuluan 2 ditunjukkan oleh Tabel 3.
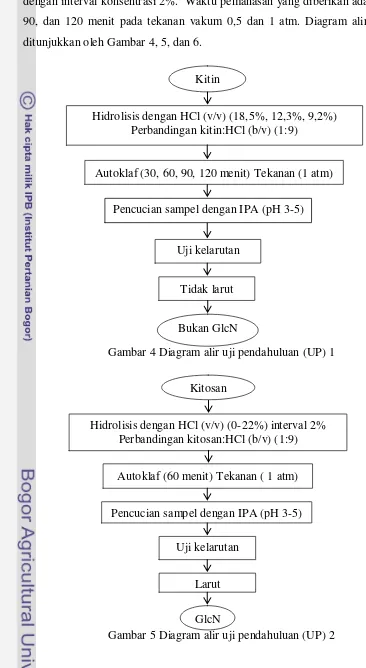
Tabel 3 Karakteristik glukosamin dari kitosan pada perlakuan asam yang berbeda
Ket:
+ hitam ++ tidak hitam
+++ sedikit putih ++++ lebih putih
Berdasarkan kriteria parameter yang ada pada Tabel 3, perlakuan hidrolisis dengan asam 8% ditetapkan sebagai perlakuan terbaik glukosamin yang akan dikarakterisasi lebih lanjut. Sampel terbaik diperbanyak empat kali lipat untuk kemudian dilakukan uji lanjutan meliputi uji pengurangan bobot loss on drying LoD, uji titik leleh, dan uji serapan FTIR.
Gambar 6 Grafik karakteristik rendemen dan derajat putih GlcN 0
HCl (%) rendemen (%) Derajat putih
4.2.1Kelarutan Glukosamin Hidroklorida (GlcN HCl)
Pada uji pendahuluan 2 kelarutan glukosamin hidroklorida dilakukan dengan menggunakan air bersuhu 27 oC. Pada uji lanjutan, uji kelarutan dilakukan kembali dengan menggunakan air bersuhu 20 oC. Semakin tinggi suhu pelarut yang digunakan maka kelarutan zat akan terjadi lebih cepat. Kelarutan cenderung berjalan lambat dalam pelarut bersuhu rendah. Suatu zat yang larut dengan mudah pada pelarut bersuhu rendah mengindikasikan bahwa zat terlarut memiliki tingkat kelarutan yang baik. Kelarutan glukosamin hidroklorida 8% yang dihidrolisis dari kitosan ditunjukkan pada Gambar 8.
Gambar 8 Glukosamin hidroklorida 8% setelah dilarutkan
Glukosamin dari kitosan memiliki tingkat kelarutan yang baik. Berbeda dengan sampel glukosamin dari kitin pada pendahuluan 1, glukosamin yang dibuat dari kitosan bersifat larut sempurna bahkan pada air dingin bersuhu 20 oC.
Berbeda dengan kitin, kitosan telah kehilangan gugus asetilnya. Ketika sampel diganti kitosan, tekanan pada autoklaf tidak lagi memutus gugus asetil melainkan hanya memotong polimer kitosan menjadi unit yang lebih kecil sehingga ion Cl- dari HCl lebih mudah berikatan dengan dengan gugus amin kitosan membentuk NH3Cl. Adanya ikatan hidroksil antara O-H dan NH3Cl ini menyebabkan glukosamin hidroklorida bersifat larut dalam air.
pengotor. Penampakan sampel kitosan komersial yang digunakan pada penelitian ditunjukkan pada Gambar 9.
Gambar 9 Kitosan udang untuk pembuatan GlcN HCl
4.2.2Penampakan, Warna, dan Derajat Putih Glukosamin Hidroklorida (GlcN HCl)
Kriteria penampakan glukosamin terbaik dilihat dari tekstur glukosamin setelah dikeringkan dan digerus. Penampakan dinilai baik jika sampel berbentuk serbuk halus setelah penggerusan. Warna dan derajat putih glukosamin dianggap baik jika sesuai atau mendekati warna dan derajat putih glukosamin standar. Penampakan glukosamin hasil penelitian dapat dilihat pada Gambar 10.
Gambar 10 Penampakan glukosamin hasil penelitian
monomer pada kitosan telah terurai sempurna selama proses hidrolisis menjadi glukosamin. Kitosan telah terurai menjadi molekul-molekul glukosamin yang lebih pendek dan bersifat polar (terdapat gugus O-H) sehingga larut dalam air.
Zat molekular yang memiliki molekul polar mudah dilarutkan dalam air. Gugus hidroksil O-H yang terikat pada atom karbon suatu molekul merupakan tapak untuk interaksi dwikutub dengan molekul air. Tarikan ini menggantikan interaksi zat-zat terlarut (Irawadi et al. 2006) sehingga setiap molekul glukosamin yang berair akan bergerak menuju larutan.
4.2.3Loss on Drying (LoD)
Uji pengurangan bobot didesain untuk mengukur jumlah air dan komponen volatil yang mungkin masih terkandung dalam sampel ketika dikeringkan pada kondisi tertentu. Glukosamin dengan bobot tertentu dipanaskan dalam oven pada suhu 105 oC selama 2 jam. Uji LoD pada penelitian ini dilakukan secara duplo. Sesuai dengan kriteria mutu USP, nilai LoD glukosamin hidroklorida tidak lebih dari 1%. Pengurangan bobot GlcN setelah pemanasan ditunjukkan pada Tabel 4.
Tabel 4 Pengurangan bobot glukosamin setelah pemanasan
Cawan Bobot GlcN awal (gr) Bobot GlcN akhir (gr) LoD (%)
1 0,3 0,27 1
2 0,3 0,275 0,83
Rata-rata 0,92
Rata-rata hasil uji menunjukkan bahwa nilai pengurangan bobot glukosamin setelah pemanasan 105 oC selama 2 jam tidak lebih dari 1% yakni hanya mencapai 0,92%. Nilai LoD ini telah sesuai dengan standar yang disyaratkan oleh USP (2006).
4.2.4Rendemen Glukosamin Hidroklorida (GlcN HCl)
Adanya perbedaan nilai rendemen glukosamin ini diduga dipengaruhi oleh faktor suhu, konsentrasi asam, waktu pemanasan, dan tekanan yang diberikan. Mojarrad et al. (2007) menyatakan bahwa perbandingan antara waktu hidrolisis dan konsentrasi asam merupakan faktor yang menentukan nilai rendemen sampel (glukosamin). Nilai rendemen GlcN yang dihasilkan menurun seiring dengan peningkatan konsentrasi asam dan waktu reaksi. Penurunan rendemen diduga terjadi karena adanya reaksi samping sehingga terbentuk zat pengotor dan menurunkan nilai rendemen GlcN yang dihasilkan.
Hasil penelitian pada Gambar 5 sesuai dengan Mojarrad et al. (2007). Seiring dengan peningkatan konsentrasi asam yang digunakan. jumlah rendemen yang dihasilkan cenderung semakin menurun. Nilai rendemen sedikit meningkat pada konsentrasi asam 20% dan 22%. Hal ini diduga terjadi karena pemutusan polimer kitosan menjadi glukosamin cenderung lebih cepat pada konsentrasi asam tersebut yang dibantu dengan pengaruh tekanan tinggi dari autoklaf.
Afridiana (2011) dan Rismawan (2012) berturut-turut memerlukan HCl dengan konsentrasi 37% dan 22% (v/v) untuk memperoleh glukosamin dengan karakteristik terbaik. Akan tetapi, pada penelitian ini konsentrasi asam 8% telah mampu menghidrolisis glukosamin dengan karakter terbaik. Hal ini terjadi karena adanya faktor tekanan yang diberikan saat hidrolisis. Kombinasi perlakuan antara tekanan dan suhu mempercepat proses depolimerisasi kitosan menjadi glukosamin sehingga waktu pemanasan menjadi lebih singkat dengan konsentrasi asam yang cukup rendah.
Pemberian tekanan pada proses dapat menyebabkan terjadinya puffing (Pamungkas et al. 2008). Puffing dapat diartikan sebagai suatu proses pemasukan gas ke dalam bahan yang kemudian terjadi ekspansi untuk kemudian dilepaskan dan mengakibatkan pengembangan/ pemutusan terhadap struktur luar dari struktur seluler sebuah produk (Tabeidie 1992 dalam Pamungkas et al. 2008). Pengembangan struktur ini terjadi sebagai akibat dari pemasukan udara (gas) secara paksa serta pelepasan tekanan secara tiba-tiba yang menghasilkan struktur permukaan yang lebih porous (Pamungkas et al. 2008).
digantikan oleh ikatan jenuh tunggal dari unit monomer tunggal yang terbuka dari sisi lainnya sehingga membentuk satu rantai panjang berulang yang terdiri atas unit-unit/ monomer (Brinson dan Brinson 2008). Waktu yang diperlukan untuk hidrolisis glukosamin pada penelitian ini hanya 1 jam karena proses pemutusan ikatan kitosan menjadi glukosamin berlangsung lebih cepat dengan adanya pengaruh tekanan. Tanpa adanya perlakuan kombinasi tekanan dan suhu, proses hidrolisis glukosamin akan cenderung lambat.
4.2.5Titik Leleh Glukosamin Hidroklorida (GlcN HCl)
Hasil analisis titik leleh menunjukkan titik leleh GlcN berkisar pada suhu 190-193 oC. Hal ini menunjukkan bahwa GlcN hasil pembuatan lebih bersih. Semakin banyak pengotor atau zat asing yang terkandung dalam glukosamin maka titik leleh akan semakin menurun. Kisaran nilai titik leleh glukosamin hidrolisis sesuai dengan penelitian Kralovec dan Barrow (2008) yakni 190-194 oC. Titik leleh hasil pembuatan juga lebih baik dari penelitian Afridiana (2011) yang berkisar antara 187-189 oC pada penggunaan asam 37%. Mojarrad et al. (2007) menpembuatan glukosamin hidroklorida dengan titik leleh 190-192 oC pada penggunaan konsentrasi asam 32%. Kisaran titik leleh glukosamin hidroklorida hasil hidrolisis ditunjukkan oleh Tabel 5.
Tabel 5 Kisaran suhu titik leleh glukosamin hidroklorida
Tabung kapiler Kisaran suhu (oC)
1 190,0-192,0
2 190,0-192,0
3 191,0-193,0
Rata-rata 191,3
4.2.6Spektrum Glukosamin Hidroklorida (GlcN HCl)
Salah satu cara yang dapat digunakan untuk menetukan tingkat keberhasilan hidrolisis glukosamin hidroklorida ialah dengan menggunakan analisis FTIR. Analisis FTIR memanfaatkan sinar infra merah pada kisaran bilangan gelombang 800-4000 cm-1. Hasil pengujian FTIR glukosamin hidroklorida hasil hidrolisis dapat dilihat pada Lampiran 1-3.
lebar dan kuat pada bilangan gelombang 3066 cm-1 sedangkan pada GlcN HCl hasil hidrolisis (Lampiran 2) menunjukkan gugus OH- yang dominan pada bilangan gelombang 3000-3263 cm-1. Brugnerotto (2001) menambahkan bahwa monomer GlcN HCl akan menunjukkan gugus OH- pada 3350 cm-1 sedangkan apabila berbentuk polimer gugus OH- semakin mendekati 3450 cm-1. Gugus N-H yang dominan yaitu pada glukosamin hasil hidrolisis adalah 3333 cm-1. Spektrum tersebut hampir mirip dengan Mojarrad et al. (2007) yaitu 3333-3380 cm-1.
Pita serapan gugus N-H amida primer ditunjukkan pada 1635 cm-1 sedangkan pita serapan amida sekunder berada pada bilangan 1566 cm-1. Pada bentuk sampel padat. pita amida primer berada pada kisaran bilangan gelombang 1640-1620 cm-1 dan pita amida sekunder berada pada daerah bilangan 1550 cm-1 (Pavia et al. 2009). Pita serapan juga menunjukkan nilai yang hampir sama dengan hasil penelitian Mojarrad et al. (2007) yakni 1535-1583 cm-1.
Pita serapan gugus C-N GlcN HCl hasil hidrolisis ditunjukkan pada bilangan gelombang 1381 cm-1 sedangkan pada standar 1288 cm-1. Nilai hidrolisis ini hampir mendekati literatur bahwa pita serapan C-N ditunjukkan pada 1394 cm-1 (Mojarrad et al. 2007). Secara keseluruhan pita serapan gugus khas pada GlcN hasil hidrolisis menunjukkan kemiripan dengan GlcN HCl standar dan hasil penelitian lainnya namun masih terdapat sedikit selisih pada bilangan gelombang yang ditampilkan. Hal ini dapat terjadi karena adanya range nilai serapan gelombang setiap gugus fungsi. Sedikit perbedaan serapan gelombang pada standar dan sampel dianggap normal atau wajar selama bilangan gelombang yang diserap sampel masih berada dalam range bilangan gelombang gugus fungsinya.
4.3Keunggulan Pembuatan GlcN HCl dengan Autoklaf
5 SIMPULAN DAN SARAN
5.2Simpulan
Glukosamin hidroklorida (GlcN HCl) dapat dibuat dengan metode yang sederhana yakni dengan penggunaan autoklaf. Produksi GlcN HCl dengan metode autoklaf lebih unggul dari segi keamanan kerja, proses produksi, waktu, dan biaya produksi. Perlakuan terbaik GlcN diperoleh pada penggunaan asam 8% dengan tekanan satu atm selama satu jam. GlcN HCl hasil hidrolisis memiliki beberapa karakteristik yakni larut sempurna dalam air, berbentuk serbuk berwarna putih kekuningan, nilai LoD 0,92%, titik leleh 190-192 oC, dan rendemen 69,80%. Spektrum FTIR memiliki pola pita serapan OH- (3000-3263 cm-1) dan serapan gugus N-H (primer 1635 cm-1 dan sekunder 1566 cm-1) yang mirip antara GlcN HCl hasil hidrolisis dengan GlcN HCl standar. Secara umum dapat disimpulkan bahwa pembuatan GlcN HCl yang praktis dan efisien dengan autoklaf telah berhasil dilakukan.
5.2 Saran
1. Pencucian sampel glukosamin dengan IPA cukup dilakukan tiga kali.
DAFTAR PUSTAKA
Afridiana N. 2011. Recovery Glukosamin Hidroklorida dari Cangkang Udang Melalui Hidrolisis Kimiawi Sebagai Bahan Sediaan Suplemen Osteoarthritis [skripsi]. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Azhar M, Efendi J, Syofyeni E, Lesi RM, Novalina S. 2010. Pengaruh konsentrasi NaOH dan KOH terhadap derajat deasetilasi kitin dari limbah kulit udang. Eksakta Vol 1.
[BPOM RI] Badan Pengawas Obat Dan Makanan Republik Indonesia. 2004. Nomor HK.00.05.23.3644. Ketentuan Pokok Pengawasan Suplemen Makanan.
Brinson HF dan Brinson FC. 2008. Polymer Engineering Science and Viscoelasticity an Introduction. Springer. USA.
Brugnerotto J. 2001. An infrared investigation inrealtion with chitin and chitosan. characterization. Polymer 42: 3569-3580.
Cargill Incorporated. 2006. Application for the Approval of the use REGENASURE® Non-Shellfish Glucosamine Hydrochloride from Aspergillus niger (RGHAN). for use in Certain Foods Products under Regulation (EC) No 258/97 for the European Parliament and of the Council of 27 January 1997 concerning novel foods and novel food ingredients. Eddyville. USA.
Hathcock dan Shao A. 2006. Risk assesement for glucosamine and chondroitin sulfate. Journal Science Direct-Regulatory Toxicology and Pharmacology 47 (2007) 78-83.
Hirano S. 1986. Production and Application of Chitin and Chitosan in Japan. Departemen of Agricultural Biochemistry. Tottori University. Japan. Irawadi TT, Adijuwana H, Kadarusman LK, Heryanto R, Achmadi SS, Sjahreza
A, Mulijani S, Sutriah K, Suradikusumah E, Purwaningsih H, Batubara I, Rohaeti E, Rafi M, Saeni MS, Purwatiningsih, Kemala T. 2006. Kimia Edisi Revisi (diktat kuliah). Departemen Kimia. Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor.
Karmas E. 1992. Poultry and Seafood Technology. Noyes Data Corporation. USA.
Kralovec JA, Barrow CJ. 2008. Marine Neutraceticals and Functional Foods. CRC Press. London. New York.
Merdikoputro dan Asri. 2006. Nyeri lutut membatasi mobilitas. http://www.suaramerdeka.com/harian/0601/23/ragam01.htm (diakses pada 18 Juli 2012).
Mojarrad JS, Mahboob N, Valizadeh H, Ansarin M, dan Bourbour S. 2007. Preparation of glucosamine from exoskeleton of shrimp and predicting production by response surface metodhology. Journal of Agricultural and Chemistry 55:2246-2250.
Muzzarelli RAA. 1977. Chitin. Oxford: Pergamon Press.
Pamungkas WH, Bintoro N, Rahayu S, dan Rahardjo B. 2008. Perubahan laju pengeringan pasta dengan perlakuan awal puffing udara. Prosiding Seminar Nasional Teknik Pertanian 2008. Yogyakarta 18-19 November 2008. Pavia DL, Lampman GM, Kriz GS, dan Vyvyan JR. 2009. Introduction to
Spectroscopy. Fourth Edition. Belmont. USA.
Rismawan. 2012. Rendemen Glukosamin dari Kitin Udang [skripsi]. Departemen Kimia. Fakultas Matematika dan Ilmu Pengetahuan Alam. Sekolah Tinggi MIPA. Bogor.
Samsiah R. 2009. Karakterisasi Biokomposit Apatit-Kitosan dengan XRD (Xray Difraction), FTIR (Fourier Transform Infra Red), SEM (Scanning Electron Microscopy) dan Uji Mekanik [skripsi]. Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Savitri E, Soeseno N, dan Adiarto T. 2010. Sintesis Kitosan. Poli (2-amino-2-deoksi-D-Glukosa). Skala Pilot Project dari Limbah Kulit Udang sebagai Bahan Baku Alternatif Sintesis Biopolimer. Prosiding Seminar Nasional
Teknik Kimia “Kejuangan” ISSN 1693 – 4393. Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia. Yogyakarta. 26 Januari 2010.
Sugita P, Wukirsari T, Sjahriza A, dan Wahyono D. 2009. Kitosan: Sumber Biomaterial Masa Depan. IPB Press. Bogor.
Lampiran 1 Spektrum FTIR GlcN HCl standar (Afridiana 2011)
1 PENDAHULUAN
1.1Latar Belakang
Meningkatnya penyakit kronis seperti penyakit jantung, diabetes, kanker, dan radang sendi berpengaruh pada tingginya biaya kesehatan yang harus dikeluarkan masyarakat (Kralovec dan Barrow 2008). Organisasi Kesehatan Dunia (WHO) memasukkan osteoarthritis sebagai salah satu dari empat kondisi otot dan tulang yang membebani individu, sistem kesehatan maupun sistem perawatan sosial dengan biaya yang cukup besar. Di dunia diperkirakan setidaknya terdapat 9,6% pria dan 18% wanita di atas usia 60 tahun menderita osteoarthritis (OA). Kasus tersebut diduga akan terus meningkat akibat bertambahnya usia harapan hidup, obesitas (kegemukan) dan kebiasaan merokok (Merdikoputro dan Asri 2006).
Tahun 2020, WHO juga memperkirakan OA akan menjadi penyebab utama cacat fisik pada umat manusia setelah arthritis rematoid (jenis penyakit rematik yang mengenai jari tangan/jari kaki), osteoporosis (keropos tulang) dan nyeri punggung bawah. Indonesia merupakan negara ke-4 dengan jumlah orang lanjut usia (lansia) terbanyak sesudah negara China, India dan Amerika Serikat (Merdikoputro dan Asri 2006).
Jumlah penderita OA di Indonesia paling banyak ditemukan terutama pada lansia dengan rentang usia di atas 50 tahun. Lebih dari 85% orang berusia 65 tahun menggambarkan OA pada gambaran x-ray, meskipun 35-50% hanya mengalami gejala. Kecenderungan terjadinya osteoarthritis pada orang berumur di bawah 45 tahun lebih banyak terjadi pada pria sedangkan pada umur 55 tahun lebih banyak terjadi pada wanita. Perbandingan penderita OA wanita dan pria adalah 4:1 (Reksoprajo 2000 dalam Utami 2010).
terjangkau menjadi penting untuk dilakukan.
Afridiana (2011) berhasil membuat glukosamin hidroklorida dengan tingkat kemurnian sebesar 45,64% dari kitin udang pada perlakuan HCl 37% (pekat) dengan suhu pemanasan 90 oC selama 4 jam. Rismawan (2012) berhasil membuat glukosamin dari kitosan dengan rendemen 51,04% pada perlakuan HCl 22% dengan tekanan vakum 1 atm selama 2 jam. Penelitian Rismawan (2012) dinilai lebih praktis karena tidak memerlukan proses pengadukan yang kontinyu dalam proses pembuatannya.
Pada penelitian ini akan dilakukan pengembangan dari penelitian terdahulu yaitu mendapatkan kondisi optimum pembuatan glukosamin hidroklorida dari kitin atau kitosan pada skala laboratorium dengan metode pembuatan yang sederhana yakni menggunakan autoklaf. Hasil penelitian yang diharapkan adalah diperolehnya metode pembuatan glukosamin hidroklorida yang efektif dan efisien dari segi kualitas, waktu maupun biaya produksi. Karakteristik yang akan dilihat diantaranya tingkat kelarutan, warna, titik leleh (melting point temperature), pita serapan infra merah (uji FTIR), dan nilai rendemen glukosamin.
1.2Tujuan
Tujuan dari penelitian ini adalah
1. Memperoleh metode pembuatan glukosamin hidroklorida (GlcN HCl) yang praktis dan efisien melalui penerapan teknologi sederhana dan aman. 2. Menganalisis karakteristik produk glukosamin hidroklorida (GlcN HCl)
2 TINJAUAN PUSTAKA
2.1Osteoarthritis (OA)
Osteoarthritis yang juga sebagai penyakit degeneratif pada sendi adalah bentuk penyakit radang sendi yang paling umum dan merupakan sumber utama penyebab rasa sakit dan lumpuh, terutama pada orang lanjut usia (lansia). OA merupakan penyakit degeneratif kronik pada sendi yang terjadi akibat menipisnya lapisan tulang rawan yang melindungi ujung tulang sejati. Tulang rawan menjadi kasar sehingga menimbulkan gesekan dan peradangan. Bentuk kerusakan yang terjadi ialah perubahan struktural dan pengikisan kartilago yang menimbulkan rasa sakit dan kaku (Kralovec dan Barrow 2008).
OA dapat disebabkan oleh penekanan beban tubuh yang secara terus-menerus terhadap persendian, sehingga mengakibatkan kerusakan terhadap tulang rawan sendi. Akibat lanjut dari OA diantaranya adalah timbulnya rasa nyeri karena terjepitnya ujung-ujung saraf sensoris oleh osteofit-osteofit yang terbentuk serta adanya pembengkakan dan penebalan jaringan lunak di sekitar sendi yang akan mengakibatkan deformitas, terlepasnya osteofit pada suatu gerakan menimbulkan krepitasi pada sendi tersebut (Carter 1995 dalam Utami 2010).
2.2Glukosamin hidroklorida (GlcN HCl)
Glukosamin hidroklorida memiliki nama lain yakni 2-amino-2-deoxy-D-glucopyranose, kitosamin hidroklorida, dan D-(+)-glukosamin hidroklorida. Secara struktural, glukosamin merupakan gula beramin dengan rumus molekul C6H13NO5HCl dan massa molekul 215,63 Da. Glukosamin dalam bentuk murni berbentuk serbuk kristal putih dengan titik leleh 190-194 oC. Glukosamin memiliki kelarutan tinggi dalam air dengan titik larut 100 mg/mL pada suhu 20 oC (Kralovec dan Barrow 2008). Struktur kimia glukosamin hidroklorida ditunjukkan oleh Gambar 1.
Gambar 1 Struktur kimia glukosamin hidroklorida (Mojarrad et al. 2007) menimbulkan kekakuan pada sendi sehingga menyebabkan penyakit osteoarthritis (OA). Pemberian glukosamin sulfat secara oral dapat membantu produksi cairan synovial untuk mencegah dan mengobati penyakit OA (Williams 2004 dalam Afridiana 2011). Penelitian Kulkarni et al. (2012) menunjukkan bahwa konsumsi glukosamin hidroklorida dan atau glukosamin sulfat terhadap pasien penderita OA (tingkat sedang) berpengaruh nyata terhadap pengurangan rasa nyeri pada sendi. Dosis harian untuk konsumsi glukosamin menurut Badan Pengawas Obat dan Makanan Republik Indonesia (BPOM RI) tahun 2004 adalah 1500 mg/ hari. Hasil penelitian Hathcock dan Andrew (2006) menunjukkan bahwa asupan glukosamin secara oral pada dosis 2000 mg/ hari aman untuk dikonsumsi. Adapun efek konsumsi glukosamin terhadap tubuh dapat dilihat setelah satu bulan pemakaian. Mutu glukosamin hidroklorida menurut standar United State Pharmacopeia (USP) ditunjukkan pada Tabel 1.
Tabel 1 Spesifikasi mutu glukosamin hidroklorida (GlcN) menurut (USP)
Sumber: USP 2006 dalam Cargill Inc. 2006 2.3Kitin
Kitin adalah polisakarida struktural yang umum digunakan untuk menyusun eksokleton dari artropoda (serangga, laba-laba, krustase, dan hewan-hewan lain sejenis). Kitin juga tergolong homopolisakarida linear yang tersusun atas residu N-asetilglukosamin pada rantai beta dan memiliki monomer berupa molekul glukosa dengan cabang yang mengandung nitrogen. Kitin murni mirip dengan kulit, namun akan mengeras ketika dilapisi dengan garam kalsium karbonat CaCO3. Kitin membentuk serat mirip selulosa yang tidak dapat dicerna oleh vertebrata (Sugita et al 2009).
Keberadaan kitin di alam umumnya terikat dengan protein, mineral, dan berbagai macam pigmen. Contohnya, kulit udang mengandung 25-40% protein, 40-50% CaCO3, dan 15-20% kitin, tetapi besarnya komponen tersebut masih bergantung pada jenis udangnya (Altschul 1976 dalam Sugita et al. 2009) sedangkan kulit kepiting mengandung protein (15,60-23,90%), kalsium karbonat (53,70-78,40%) dan kitin (18,70-32,20%), hal ini tergantung pada jenis kepiting tempat hidupnya (Focher 1992 dalam Sugita et al. 2009).
Secara kimia, struktur kitin merupakan poli (2-asetamido-2-deoksi-β-(1→4) -D-glukopiranosa) dengan rumus molekul (C8H13NO5)n yang tersusun atas 47% C, 6% H, 7% N, dan 40% O. Struktur kitin menyerupai struktur selulosa dan hanya berbeda pada gugus yang terikat di posisi atom C2. Gugus pada C2 selulosa Uji USP-NF Spesifikasi USP-NF
Penampakan Serbuk putih
Spesifik rotasi Antara +70.0o sampai +73.0o (larutan uji 25 mg/mL) pH 3.0-5.0, dalam larutan 20 mg/mL
adalah gugus hidroksil -OH, sedangkan pada C2 kitin adalah gugus N-asetil (Muzzarelli 1977). Struktur kimia kitin ditunjukkan oleh Gambar 2.
Gambar 2 Struktur kimia kitin (Muzzarelli 1977).
Kitin tidak larut dalam pelarut biasa tetapi cenderung stabil dalam asam maupun basa lemah. Kitin dapat dideasetilasi sehingga membentuk produk turunan seperti kitosan, oligosakarida, dan glukosamin. Bentuk turunan ini memiliki manfaat lebih besar sebagai neutraceutical (Kralovec dan Barrow 2008). Proses isolasi kitin pada dasarnya terdiri dari tiga tahap, yaitu: tahap pemisahan protein (deproteinasi), tahap pemisahan mineral (demineralisasi), dan tahap penghilangan warna (depigmentasi) (Savitri et al. 2010).
2.4Kitosan
Kitosan merupakan produk deasetilasi kitin melalui proses reaksi kimia menggunakan basa natrium hidroksida atau reaksi enzimatis menggunakan enzim kitin deacetylase. Kitosan merupakan biopolimer yang resisten terhadap tekanan mekanik. Unsur-unsur yang menyusun kitosan hampir sama dengan unsur-unsur yang menyusun kitin yaitu C, H, N, O dan unsur-unsur lainnya. Kitosan adalah turunan kitin yang diisolasi dari kulit kepiting, udang, rajungan, dan kulit serangga lainnya. Kitosan merupakan kopolimer alam berbentuk lembaran tipis, tidak berbau, terdiri dari dua jenis polimer, yaitu poli (2-Deoksi-2-asetilamin-2-Glukosa) dan poli (2-Deoksi-2 Aminoglukosa)
yang berikatan β-D (1–4 ) (Hirano 1986).
nitrat serta larut baik dalam asam lemah seperti asam formiat dan asam asetat (Sugita et al 2009). Struktur kimia kitosan ditunjukkan pada Gambar 8.
Gambar 3 Struktur kimia kitosan (Hirano 1986).
Tahap utama yang berperan penting dalam proses transformasi kitin menjadi kitosan ialah tahap deasetilasi dengan penggunaan basa kuat KOH atau NaOH. Proses deasetilasi gugus asetil pada asetamida kitin dapat dijelaskan sebagai berikut: gugus karbon karbonil diserang oleh nukleofil OH-, akibatnya terjadi reaksi adisi sehingga terbentuk zat antara. Zat antara ini selanjutnya mengalami reaksi elimininasi sehingga gugus asetil pada asetamida kitin lepas membentuk asetat. Proses pelepasan gugus asetil dari gugus asetamida kitin berhubungan dengan konsentrasi ion OH- pada larutan. Konsentrasi OH- akan lebih besar pada larutan basa kuat. Semakin kuat suatu basa semakin besar konsentrasi OH- dalam larutannya. Dengan demikian kekuatan basa mempengaruhi proses deasetilasi gugus asetil dari gugus asetamida kitin (Azhar et al. 2010).
2.5Fourier Transform Infra Red (FTIR)
Fourier Transform Infra Red (FTIR) merupakan suatu teknik spektroskopi inframerah yang dapat mengidentifikasi kandungan gugus fungsi suatu senyawa termasuk senyawa kalsium fosfat, namun tidak dapat mengidentifikasi unsur-unsur penyusunnya. Ada dua jenis energi vibrasi yaitu vibrasi bending dan vibrasi stretching. Vibrasi bending yaitu pergerakan atom yang menyebabkan perubahan sudut ikatan antara dua ikatan atom atau pergerakan dari seluruh atom terhadap atom lainnya. Sedangkan vibrasi stretching adalah pergerakan atom yang teratur sepanjang sumbu ikatan antara dua atom sehingga jarak antara dua atom dapat bertambah atau berkurang (Samsiah 2009).
Spektroskopi IR digunakan untuk menetukan struktur molekul melalui sederetan gugus fungsi yang berdasarkan pada perubahan amplitudo vibrasi yang diawali oleh terjadinya aksi antara molekul dengan radiasi infra merah yang medan listriknya memiliki frekuensi sama. Prinsip dasar dari spektrofotometri IR adalah perubahan amplitudo radiasi IR dari gugus dalam molekul pada energi (bilangan gelombang atau bilangan gelombang) yang sesuai. Pengujian FTIR memiliki beberapa keuntungan, yakni relatif cepat, sampel tidak perlu murni, dan tingkat ketelitian tinggi (Pavia et al. 2009).
3 METODE
3.1Waktu dan Tempat
Penelitian ini dilakukan pada bulan Agustus sampai dengan September 2012. Laboratorium yang digunakan yaitu Laboratorium Biokimia Hasil Perairan I untuk preparasi sampel dan pembuatan larutan HCl, Unit Produksi Hasil Perairan untuk autoklaf sampel, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Kimia Analisis Departemen Kimia untuk analisis titik leleh dan Laboratorium Analisis Bahan Departemen Fisika untuk pengujian FTIR, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
3.2Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah Erlenmeyer 250 ml, autoklaf bertekanan 2 atm, FTIR Perkin Elmer SpektrumOne, pemanas listrik titik leleh MelTemp, gelas piala 100 ml, pipet morr 10 ml, gelas ukur 50 ml, oven, kertas pH, kertas saring, dan timbangan digital. Bahan yang digunakan adalah kitin dan kitosan komersil yang diperoleh dari PT Biotech Surindo Cirebon, HCl 12 N (teknis), Isoprophyl Alcohol/ IPA (teknis), dan akuades.
3.3Metode Penelitian
Penelitian ini dibagi menjadi dua tahap utama yakni tahap pendahuluan dan tahap penelitian inti. Penelitian pendahuluan dimaksudkan untuk menentukan kombinasi perlakuan terbaik dalam pembuatan glukosamin. Bahan baku utama yang digunakan pada penelitian pendahuluan ialah kitin dan kitosan komersial. Penelitian inti dimaksudkan untuk membuat dan mengkarakterisasi glukosamin yang dihasilkan. Karakter fisik dan kimia glukosamin yang diamati meliputi penampakan, warna, kelarutan, titik leleh (melting point temperature), dan serapan pita amida (uji FTIR).
HCl 18,5%, 12,3%, dan 9,2% (v/v) untuk sampel kitin dan HCl 0-22% (v/v) dengan interval konsentrasi 2%. Waktu pemanasan yang diberikan adalah 30, 60, 90, dan 120 menit pada tekanan vakum 0,5 dan 1 atm. Diagram alir penelitian ditunjukkan oleh Gambar 4, 5, dan 6.
Gambar 4 Diagram alir uji pendahuluan (UP) 1
Gambar 5 Diagram alir uji pendahuluan (UP) 2 Kitin
Hidrolisis dengan HCl (v/v) (18,5%, 12,3%, 9,2%) Perbandingan kitin:HCl (b/v) (1:9)
Autoklaf (30, 60, 90, 120 menit) Tekanan (1 atm)
Uji kelarutan
Tidak larut
Bukan GlcN
Pencucian sampel dengan IPA (pH 3-5)
Uji kelarutan
Autoklaf (60 menit) Tekanan ( 1 atm)
GlcN Kitosan
Hidrolisis dengan HCl (v/v) (0-22%) interval 2% Perbandingan kitosan:HCl (b/v) (1:9)
Pencucian sampel dengan IPA (pH 3-5)
Gambar 6 Diagram alir penelitian inti (metode terbaik)
Sampel yang telah diautoklaf dicuci dengan IPA atau alkohol hingga pH nya mencapai 3-5. Sampel kemudian dioven pada suhu 80 oC selama 4 jam dan dihitung rendemennya. Selanjutnya dilakukan uji karakter fisika glukosamin yakni uji Fourier Transform Infra Red (FTIR), uji titik leleh, dan kenampakan warna.
3.3.1Uji kelarutan
Kelarutan merupakan salah satu cara yang paling mudah dilakukan untuk mengenali sampel sebagai glukosa atau glukosamin. Uji ini dilakukan dengan cara melarutkan sampel glukosamin dalam air. Sampel sebanyak 100 mg dilarutkan dalam 1 ml air dingin bersuhu 20 oC sehingga sampel larut sempurna.
3.3.2Penampakan dan warna
Penampakan glukosamin dianggap baik jika glukosamin berbentuk serbuk setelah dihaluskan. Warna sampel glukosamin dianggap baik jika berwarna putih
GlcN terbaik
Autoklaf (60 menit) Tekanan (maks 1 atm)
GlcN Kitosan
Hidrolisis dengan HCl (v/v) (8%) Kitosan:HCl (b/v) (1:9)
Pencucian sampel dengan IPA (pH 3-5)
Larut
atau mendekati putih. Penampakan dan warna dilihat langsung secara visual kemudian dibandingkan dengan glukosamin standar yang sudah ada.
3.3.3Spektrum glukosamin hidroklorida (GlcN HCl)
Penentuan spektrum glukosamin hasil penelitian ditentukan melalui uji FTIR (Fourier Transform Infra Red). Padatan glukosamin hidroklorida hasil hidrolisis dan standar masing-masing dicampur dengan KBr dengan nisbah 1:100 lalu digerus sampai rata dengan menggunakan mortar. Campuran ini ditempatkan dalam alat pengepresan dan dilakukan pengepresan pada tekanan beban 800 kg. Kepingan hasil pengepresan diukur absorbansinya menggunakan FTIR. Kisaran scanning yang digunakan antara 450 cm-1 hingga 4000 cm-1.
Sampel glukosamin yang diuji adalah glukosamin terbaik hasil penelitian. Absorbansi grafik spektrum glukosamin hasil hidrolisis kemudian dibandingkan dengan absorbansi spektrum glukosamin standar dari penelitian terdahulu. Glukosamin hasil uji dianggap baik (cukup murni) jika kisaran absorbansi spektrumnya tidak jauh berbeda dengan kisaran absorbansi glukosamin standar.
3.3.4Uji titik leleh (AOAC 1995)
Uji titik leleh dilakukan dengan bantuan alat MelTemp. Serbuk glukosamin hidroklorida dimasukkan ke dalam pipa kapiler melalui ujung tabung yang terbuka. Dasar pipa kemudian diketuk di bagian bawah atau dijatuhkan melalui sebuah tabung sempit yang panjang. Hal ini dimaksudkan agar glukosamin menjadi padat sehingga proses pelelehan berlangsung secara merata. Cara ini dilakukan berulang kali untuk mendapatkan contoh padat dalam tabung setinggi 1,5-3 mm. Tabung kapiler dimasukkan ke dalam pemanas listrik yang dilengkapai dengan termometer 400 oC untuk penetapan titik leleh. Alat dinyalakan dan suhu dinaikkan perlahan sampai titik leleh tercapai. Pengujian titik leleh ini dilakukan secara triplo.
3.3.5Uji loss on drying (LoD) (USP 2006)
setelah pengovenan nilainya tidak lebih dari 1%. Persentase LoD dihitung dengan rumus
LoD (%) = �1−�2 (� )
�1 (� )
�
100%
dengan:
W1: Bobot sampel awal sebelum dioven W2: Bobot sampel setelah dioven
3.3.6Perhitungan rendemen
Perhitungan rendemen dimaksudkan untuk mengetahui kadar efektif sampel kitin atau kitosan yang dapat diubah menjadi glukosamin. Rendemen diperoleh dengan cara membandingkan bobot glukosamin dengan bobot awal sampel kitin atau kitosan yang digunakan. Rendemen glukosamin yang dihasilkan dihitung dengan menggunakan rumus
Rendemen (%) = � � � � � (� )
4 HASIL DAN PEMBAHASAN
Pembuatan glukosamin hidroklorida (GlcN HCl) pada penelitian ini dilakukan melalui proses hidrolisis pada autoklaf bertekanan 1 atm. Berbeda dengan proses hidrolisis glukosamin pada suhu 90 oC disertai proses pengadukan selama 4 jam yang dilakukan oleh Afridiana (2011), pembuatan glukosamin dengan autoklaf dapat dilakukan tanpa pengadukan dengan waktu pemanasan lebih singkat yakni 1 jam. Pembuatan glukosamin hidroklorida dilakukan dalam dua tahap penelitian pendahuluan dengan menggunakan sampel kitin dan kitosan.
4.1 Pembuatan Glukosamin Hidroklorida dari Kitin
Penelitian pendahuluan I dilakukan dengan menggunakan sampel kitin. Sampel dihidrolisis dengan dua ragam perlakuan yakni konsentrasi HCl (18,5%, 12,3%, dan 9,2%) serta waktu pemanasan (30, 60, 90, dan 120 menit) pada tekanan 1 atm. Indikator pertama yang digunakan untuk menentukan keberhasilan hidrolisis kitin menjadi glukosamin hidroklorida adalah tingkat kelarutannya dalam air. Kelarutan glukosamin kitin ditunjukkan pada Tabel 2 dan Gambar 4.
Tabel 2 memperlihatkan bahwa dari semua perlakuan yang diberikan, tidak ada sampel glukosamin yang larut dalam air. Hal ini menunjukkan bahwa kitin belum terhidrolisis menjadi glukosamin. Konsentrasi HCl yang digunakan diduga terlalu rendah sehingga belum cukup mampu menghidrolisis kitin menjadi glukosamin meskipun perlakuan tekanan telah diterapkan. Kralovec dan Barrow (2008) menyatakan bahwa kadar asam yang rendah menyebabkan terjadinya hidrolisis yang tidak sempurna.
Semua sampel kitin dari setiap perlakuan asam dan waktu pemanasan menunjukkan tingkat kelarutan yang hampir sama seperti ditunjukkan Gambar 7.
Gambar 7 Kelarutan glukosamin hidroklorida dari kitin
Sesaat setelah dilarutkan, sampel membentuk dua fase yang berbeda yakni fase cair dan padatan. Karakter kelarutan sampel ini jauh berbeda dengan karakteristik glukosamin seperti yang diungkapkan oleh Kralovec dan Barrow (2008) bahwa glukosamin hidroklorida bersifat larut sempurna dalam air bersuhu 20 oC dengan konsentrasi 100 mg/ ml. Berdasarkan data kelarutan yang ditunjukkan Tabel 2 dapat disimpulkan bahwa sampel belum terhidrolisis menjadi glukosamin.
Hidrolisis glukosamin dengan metode autoklaf pada dasarnya merupakan sistem kerja yang menggabungkan fungsi tekanan dan asam. Tekanan berperan penting dalam pemotongan ikatan polimer menjadi unit-unit yang lebih kecil. Asam HCl berperan dalam pembentukan ikatan dengan gugus amin –NH2 setelah gugus asetil –COCH3 terpotong. Mekanisme kinerja asam dan tekanan terhadap sampel dapat dijelaskan sebagai berikut: glukosamin hidroklorida dapat larut dalam air karena adanya ikatan gugus –OH dan NH2Cl. Kitin merupakan polimer yang masih mengandung gugus asetil –COCH3 yang terikat kuat pada gugus amin
–NH2. Gugus asetil ini harus dihilangkan sehingga gugus amin dapat berikatan Fase cair