BERDASARKAN TEKNIK SEROLOGI DAN POLYMERASE CHAIN REACTION
SHERLI ANGGRAINI
DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
ABSTRAK
SHERLI ANGGRAINI. Deteksi Bean Common Mosaic Potyvirus Penyebab Penyakit Mosaik pada Kacang Panjang (Vigna sinensis L.) Berdasarkan Teknik Serologi dan Polymerase Chain Reaction. Dibimbing oleh SRI HENDRASTUTI HIDAYAT.
Tanaman kacang panjang (Vigna sinensis L.) merupakan salah satu komoditas yang sangat potensial untuk dikembangkan dalam usaha tani. Penyakit mosaik kacang panjang merupakan penyakit penting karena dapat menurunkan kualitas dan kuantitas produksi. Penyakit mosaik pada kacang panjang dapat disebabkan oleh beberapa virus antara lain Bean common mosaic potyvirus (BCMV). Deteksi BCMV dapat dilakukan berdasarkan metode serologi dan PCR. Penelitian ini bertujuan melakukan evaluasi terhadap tiga metode deteksi yaitu Indirect Enzym Linked Immunosorbent Assay (I-ELISA), Dot Immunobinding Assay (DIBA), dan RT-PCR untuk menentukan metode deteksi yang dapat digunakan sebagai metode diagnosis BCMV pada kacang panjang. Sampel yang digunakan adalah isolat virus (BCMV) asal Cirebon yang diperbanyak di rumah kaca. Evaluasi metode deteksi ditujukan untuk menentukan batas sensitifitas, yaitu dengan melakukan pengenceran pada sap tanaman dan antiserum (I-ELISA dan DIBA) atau cDNA (RT-PCR). Berdasarkan pengukuran nilai absorbans ELISA diketahui bahwa batas sensitifitas metode I-ELISA adalah pada tingkat pengenceran sap 1:103 dan pengenceran antiserum 102. Berdasarkan intensitas warna pada menbran nitroselulosa ditetapkan bahwa batas sensitifitas metode DIBA adalah pada tingkat pengenceran sap 1:105. Metode RT-PCR memiliki batas sensitifitas yang lebih tinggi karena pita DNA masih terbentuk pada pengenceran cDNA 104. Deteksi sampel lapangan yang berasal dari Kabupaten Bogor (Bubulak, Balebak, Cikabayan, Cibereum, dan Situ gede) dan Kabupaten Brebes berhasil mendiagnosis BCMV dan Geminivirus sebagai penyebab penyakit mosaik kacang panjang.
BERDASARKAN TEKNIK SEROLOGI DAN POLYMERASE CHAIN REACTION
SHERLI ANGGRAINI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertnian pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul Skripsi : Deteksi Bean common mosaic potyvirus Penyebab Penyakit Mosaik pada Tanaman Kacang Panjang (Vigna sinensis L.) Berdasarkan Teknik Serologi dan Polymerase Chain Reaction
Nama : Sherli Anggraini
NRP : A34070053
Disetujui, Dosen Pembimbing
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. NIP : 19610708 198603 2 001
Diketahui, Ketua Departemen
Prof. Dr. Ir. Dadang, M.Sc. NIP : 19640204 199002 1 002
Penulis dilahirkan di Talang Tinggi, pada tanggal 5 Februari 1989 dari Ayah Supriyanto dan Ibu Suminar. Penulis merupakan putri kedua dari enam bersaudara.
Tahun 2007 penulis menyelesaikan Sekolah Menengah Umum Negeri 1 Pagaralam. Pada tahun yang sama penulis diterima sebagai mahasiswa tingkat persiapan bersama pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB).
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan YME atas segala berkat dan karunia serta penyertaan-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul Deteksi Bean common mosaic potyvirus Penyebab Penyakit Mosaik pada Kacang Panjang (Vigna sinensis L.) Berdasarkan Teknik Serologi dan Polymerase Chain Reaction.
Penulis menyampaikan terimakasih sebesar-besarnya kepada Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. sebagai pembimbing yang banyak memberikan masukan, saran, dan pengarahan sehingga penulisan skripsi ini dapat diselesaikan. Terima kasih kepada Dr. Ir. Purnama Hidayat, M.Sc. sebagai dosen penguji tamu pada ujian lisan yang memberikan banyak masukan dan koreksi terhadap skripsi ini. Terima kasih kepada Dr. Ir. Bonny P.W Soekarno. M.Si selaku Pembimbing Akademik yang telah memberi pengarahan sejak penulis berada di tingkat awal hingga tingkat akhir. Terima kasih juga saya ucapkan untuk Dr. Ir. Tri Asmira D, M.sc atas bimbingnnya. Terimakasih pula kepada seluruh staf pengajar Fakultas Pertanian yang telah memberikan ilmu dan pengalaman selama penulis menyelesaikan pendidikan di Fakultas Pertanian Departemen Proteksi Tanaman IPB.
Penulis juga mengucapkan terimakasih kepada orang tua, Ayah Supriyanto dan Ibu Suminar untuk dukungan, doa, kasih sayang, bantuan moril dan materi yang selalu diberikan hingga penulis menyelesaikan tugas akhir. Terima kasih kepada kakak dan adik-adikku atas semua doa, dukungan dan perhatian yang diberikan kepada penulis. Terima kasih pada penanggung jawab Laboratorium Virologi Tumbuhan yang telah menyediakan alat-bahan penelitian dan kepada teman-teman seperjuangan di Laboratorium Virologi Tumbuhan (Erika, Harwan, Rizki, Rita, Vanti, Fitri, Shora, Bundo Rita, Mbak Miftah, Mbak Dama, Mbak Mel, Mbak Dwi) serta Mbak Tuti atas segala bantuannya selama penelitian. Terimakasih kepada teman-teman ‘Rempati’s kost’ (Michel, Dede, Ima, Ajeng, Tami, Hanum, Hesti, Neno, Mbak Arta), ‘Pondok Bidadari’ (Soekma I, Indah P, Winda, Tika, Listika, Nurul, Fatma, Selvi) serta Mita, Mira neng Inda, dan Bibi Mariana atas dukungan, persahabatan, kebersamaan dan pengalaman selama ini. Terimakasih penulis ucapkan juga kepada ‘geng cantik’ (Sista, Anik, Gama, dan Doli) dan seluruh teman-teman Proteksi Tanaman 44 yang tidak dapat disebutkan satu per satu atas semangat, persahabatan dan dukungannya selama kuliah hingga menyelesaikan tugas akhir. Semoga skripsi ini dapat bermanfaat.
Bogor, Mei 2011
DAFTAR ISI ... vii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat ... 3
TINJAUAN PUSTAKA ... 4
Budi Daya Kacang Panjang (Vigna sinensis L.) ... 4
Hama dan Penyakit Tanaman Kacang Panjang ... 4
Sifat- sifat Penting BCMV... 5
Metode Deteksi dan Karakteririsasi Virus Tanaman ... 6
Serologi ... 7
Polymerase Chain reaction (PCR) ... 7
Reverse Transcription Polymerase Chain Reaction (RT-PCR) ... 9
Pemanfaatan Metode Serologi dan PCR untuk Mendeteksi Virus Tumbuhan ... 9
BAHAN DAN METODE ... 11
Tempat dan Waktu Penelitian ... 11
Metode Penelitian ... 11
Persiapan Tanaman Inang Sumber Inokulum ... 11
Inokulasi Virus secara Mekanis ... 11
Metode Indirect Enzyme -Linked Immunosorbent Assay (I-ELISA) ... 12
Metode Dot Immunobinding Assay (DIBA) ... 12
Metode Reverse Transcription-Polymerase Chain Reaction (RT-PCR) ... 13
Deteksi Virus dari Sampel Kacang Panjang Bergejala ... 16
HASIL DAN PEMBAHASAN ... 18
Perbanyakan Sumber Inokulum Virus ... 18
Deteksi BCMV dengan Metode I – ELISA ... 18
Deteksi BCMV dengan Metode DIBA ... 19
Deteksi BCMV dengan RT – PCR ... 21
Deteksi Sampel dari Lapangan ... 21
Deteksi BCMV dengan RT-PCR ... 22
Deteksi BCMV dengan DIBA... 23
Deteksi Geminivirus dengan PCR ... 24
Pembahasan ... 24
KESIMPULAN DAN SARAN ... 27
DAFTAR PUSTAKA ... 28
Nomor Halaman
1. Hasil pengujian BCMV menggunakan metode I-ELISA pada
berbagai tingkat pengenceran cairan perasan tanaman dan
antiserum………... 19
DAFTAR GAMBAR
1. Gejala infeksi BCMV pada kacang panjang varietas Parade ... 18 2. Reaksi perubahan warna pada metode DIBA dengan berbaga tingkat
pengenceran sap dengan menggunakan membran HybondTM-P
Amersham dan Nitropure science GE……… 20 3. Hasil amplifikasi RT-PCR dari tanaman kacang panjang
terinfeksi BCMV ... 21 4. Gejala pada daun tanaman kacang panjang dari berbagai lokasi ... 22 5. Hasil amplifikasi RT-PCR dari tanaman kacang panjang yang
terinfeksi BCMV ... 22 6. Reaksi perubahan warna pada membran DIBA dengan
menggunakan 6 isolat BCMV ... 23 7. Hasil amplifikasi RT-PCR dari tanaman kacang panjang yang
terinfeksi Geminivirus ... 24
Nomor Halaman 1. Rata-rata nilai absorbansi sampel terinfeksi BCMV pada berbagai
tingkat pengenceran cairan perasan tanaman dan antiserum
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna sinensis L.) merupakan salah satu komoditas sayuran yang sudah lama dikenal dan digemari banyak orang. Selain rasanya enak, kacang panjang sangat penting sebagai sumber vitamin A, vitamin B, vitamin C, dan mineral terutama pada polong yang muda. Biji kacang panjang mengandung protein, lemak, dan karbohidrat, sehingga kacang panjang merupakan sumber protein nabati yang baik bagi manusia ( Haryanto et al. 1999).
Tanaman kacang panjang sangat berpotensi untuk dikembangkan sebagai komoditi usaha tani, karena selain mudah dibudidayakan, pangsa pasarnya juga cukup tinggi. Salah satu kendala dalam usaha meningkatkan produksi kacang panjang adalah gangguan hama dan penyakit tanaman. Selain hama dan penyakit, faktor kendala yang dihadapi petani dalam mengembangkan usahatani kacang panjang adalah harga di pasar yang relatif rendah dan penggunaan benih dengan mutu yang rendah.
Salah satu penyakit yang sering ditemui pada tanaman kacang panjang adalah penyakit mosaik. Penyakit mosaik merupakan penyakit penting karena dapat menurunkan kualitas dan kuantitas produksi kacang panjang. Penyakit mosaik tersebut dapat disebabkan oleh beberapa jenis virus, diantaranya Bean common mosaic potyvirus (BCMV) dan Cucumber mosaic cucumovirus (CMV) (Damayanti et al. 2009).
Penyakit mosaik pada kacang panjang dapat ditularkan melalui benih, secara mekanis, dan serangga vektor yaitu kutudaun Aphis craccivora (Hemiptera : Aphididae). A. craccivora dapat menularkan lebih dari 30 virus tanaman secara non persisten. Peranan A. craccivora dalam menularkan virus di lapangan sangat penting, apalagi keberadaan kutudaun dapat terjadi sepanjang tahun (Galvez & Morales 1989). Selain kacang panjang, virus mosaik dapat menginfeksi tanaman dari famili leguminosae yang lain seperti Calopogonium mucuniodes, Crotalaria brevidens, Pisum sativum, Vigna unguiculata, Gliycine max,Trifolium hybridum,
Beberapa tahun terakhir (2008-2011) dilaporkan adanya peningkatan kejadian penyakit mosaik kacang panjang di beberapa daerah di Jawa Barat, Jawa Tengah dan Banten (Mulyaman 2008). Damayanti et al. (2009) melaporkan bahwa salah satu virus yang berasosiasi dengan penyakit mosaik tersebut adalah BCMV dan CMV. Hasil diagnosis lainnya menyimpulkan adanya infeksi Geminivirus pada tanaman kacang panjang yang menunjukkan gejala mosaik
kuning (S. H Hidayat 11 Juli 2011, komunikasi pribadi). Hasil diagnosis tersebut menunjukkan pentingnya upaya deteksi dan diagnosis penyebab penyakit yang akurat dan benar.
Teknik deteksi (virus) yang akurat menjadi persyaratan dalam tahapan awal diagnosis penyebab penyakit. Teknik dasar yang sejak lama dilakukan untuk mendeteksi dan mengidentifikasi virus tanaman adalah melalui pengamatan partikel virus menggunakan mikroskop elektron, pengamatan gejala pada tanaman terinfeksi, uji kisaran inang, dan uji penularan virus (Akin 2006). Teknik deteksi menggunakan uji serologi seperti ELISA (Enzyme Linked Immunosorbent Assay) dan DIBA (Dot Immunobinding Assay) telah dikembangkan sejak tahun 1970-an (Hull 2002). Teknik deteksi tersebut didasarkan pada reaksi spesifik antara antigen dan antibodi. Dilaporkan bahwa teknik serologi tersebut sangat baik untuk deteksi virus tumbuhan. Teknik deteksi lain yang sering digunakan dewasa ini adalah teknik deteksi molekuler seperti PCR (Polymerase Chain Reaction) yang memanfaatkan sifat spesifk urutan nukleotida virus (Akin 2006). Teknik PCR telah umum digunakan untuk mendeteksi virus, seperti Virus kerupuk daun tembakau (Kadir 2002), Chilli veinal mottle potyvirus (ChiVMV) pada cabai (Opriana 2011), Tomato chlorosis virus (ToCV) dan Tomato infectious choloris virus (TiCV) (Nurulita 2011). Pemilihan teknik deteksi yang tepat sangat
menentukan hasil deteksi, karena teknik deteksi yang kurang baik akan menyebabkan kerancuan pada identifikasi penyebab penyakit.
Tujuan Penelitian
3
Manfaat Penelitian
Budi Daya Kacang Panjang (Vigna sinensis L.)
Kacang panjang termasuk dalarn divisi Spermatophyta, kelas Angiospermae, subkelas Dicotyledonae, ordo Rosales, famili Leguminosae, genus Vigna, spesies Vigna sinensis L. (Susila 2005).
Budi daya kacang panjang dapat dilakukan di dataran rendah maupun dataran tinggi dengan ketinggian antara 0-1500 m di atas permukaan laut (dpl). Namun demikian tanaman ini tumbuh lebih baik pada ketinggian kurang dari 600 m dpl. Oleh sebab itu, kacang panjang banyak diusahakan di dataran rendah dan digolongkan dalam sayuran dataran rendah. Sebelum dilakukan penanaman benih kacang panjang perlu dilakukan pengolahan tanah terlebih dahulu seperti penggemburan, pembuatan bedengan, dan pengapuran. Tanaman kacang panjang membutuhkan tanah yang gembur yaitu tanah yang kaya akan bahan organik atau ditambah pupuk kandang pada saat pengolahan tanah agar tumbuh dengan baik, Pemeliharaan yang umum dilakukan pada pertanaman kacang panjang adalah penyulaman, penyiangan, penyiraman, pemangkasan cabang, dan pemupukan. Tanaman kacang panjang mulai berbunga pada umur 30 hari setelah tanam dan pemanenan polong kacang panjang dapat dilakukan setelah tanaman berumur 45 hari (Susila 2005).
Hama dan Penyakit Tanaman Kacang Panjang
Produksi rata- rata kacang panjang Indonesia pada tahun 1997 sampai tahun 2000 adalah 400.66 ton, sedangkan produksi rata-rata pada tahun 2001 sampai tahun 2004 mengalami penurunan menjadi 313.743 ton. Penurunan produksi kacang panjang disebabkan karena luasan panen mengalami penurunan sebanyak 12% (sekitar 70.000 ha), produktivitas tanaman yang rendah yakni 10,09 ton/ha, penggunaan benih dengan mutu yang kurang baik, dan gangguan hama penyakit tanaman (Statistik Indonesia 2011).
5
Bemisia tabaci (Hemiptera : Aleyrodidae), penggerek polong Riptortus linearis
(Hemiptera: Alydidae), kutudaun Aphis craccivora (Hemiptera : Aphididae) dan ulat penggerek polong Maruca restualis (Lepidoptera : Crambidae). Upaya yang banyak dilakukan untuk mengendalikan hama-hama tersebut adalah dengan melakukan pergiliran tanaman, melakukan pengendalian secara biologi dengan menggunakan musuh alaminya yaitu kumbang Scymnus sp dan laba-laba (Anwar et al. 2005).
Beberapa penyakit yang menyerang tanaman kacang panjang diantaranya layu cendawan (Fusarium sp.), antraknosa (Colletotricum lindemuthianum), puru akar (Meloidogyne sp), penyakit sapu (Cowpea Witches-broom Virus/Cowpea Stunt Virus), layu bakteri (Pseudomonas solanacearum) dan penyakit mosaik yang disebabkan oleh Bean common mosaic potyvirus (BCMV), Bean yellow mosaic potyvirus (BYMV) dan Cowpea aphid borne mosaic potyvirus (CABMV)
(Anwar et al. 2005). Penyakit mosaik kuning kacang panjang dilaporkan oleh Damayanti et al. (2009) disebabkan oleh Bean common mosaic potyvirus (BCMV) dan Cucumber mosaic cucumovirus (CMV).
Sifat-sifat Penting BCMV
Bean common mosaic potyvirus (BCMV) termasuk dalam famili Potyviridae dan genus Potyvirus (Agrios 1997). Potyvirus merupakan kelompok virus tumbuhan terbesar yang diketahui saat ini. Partikel virus ini berbentuk batang panjang lentur dengan kisaran panjang 720-770 nm dan lebarnya 11-12 nm. Tipe asam nukleatnya adalah RNA utas tunggal. Berat molekul asam nukleatnya yaitu 2,3-4,3 juta kDa. Kandungan asam nukleat dalam partikel virus sebesar 5% dan kandungan protein dalam mantelnya sebesar 95%. Nukleokapsid merupakan subunit protein yang membentuk mantel protein yang menyelubungi asam nukleat. Asam nukleat yang diselubungi oleh mantel protein menyebabkan virus bersifat virulen atau menimbulkan penyakit (Shukla et al. 1994).
ditularkan secara mekanik oleh sap tanaman. Virus ini juga ditularkan oleh beberapa jenis kutudaun termasuk A. craccivora secara non persisten (Shukla et al. 1994)
Tipe gejala penyakit yang disebabkan oleh BCMV tergantung dari strain BCMV, suhu dan genotip inang. Lebih dari 15 strain BCMV yang telah diketahui diantaranya Blackeye, US1, US5, NL2, NL3, NL4, NL5, NL6, NL7 dan NL8 (Morales & Bos 1988). Gejala BCMV ditunjukkan dengan mosaik berupa lepuhan, pola warna kuning dan hijau pada daun, tulang daun menguning, bercak dan malformasi. Tanaman yang terinfeksi dapat menjadi kerdil dan menghasilkan hanya sedikit polong dan masak lebih lambat dibandingkan dengan polong yang tidak terinfeksi (Shukla et al. 1994). Gejala pada tanaman umumnya muncul 7 sampai 10 hari setelah inokulasi (Djikstra & Dejeger 1998)
Metode Deteksi dan Karakterisasi Virus Tanaman
Pengamatan gejala penyakit saja tidak cukup untuk mendeteksi dan mengidentifikasi virus pada tanaman. Beberapa virus dapat menimbulkan gejala yang sama pada tanaman yang sama, satu virus dapat menghasilkan variasi gejala tergantung strain virusnya, campuran beberapa virus atau strain virus dapat mempengaruhi gejala. Selain itu, suatu virus dapat menimbulkan gejala yang berbeda pada tanaman yang berbeda. Kondisi lingkungan dan iklim juga berpengaruh terhadap tipe gejala yang muncul (Hull 2002).
7
Serologi
Uji serologi dengan memanfaatkan reaksi antigen dan antibodi mempunyai banyak kegunaan, diantaranya untuk mengidentifikasi virus penyebab penyakit tumbuhan, mengukur konsentrasi virus dalam jaringan tumbuhan, mendeteksi virus tumbuhan dalam tubuh serangga vektor dan untuk mengetahui hubungan kekerabatan antar virus (Agrios 1997). Deteksi dan identifikasi secara serologi sudah umum diaplikasikan untuk berbagai virus. Ada beberapa cara yang digunakan untuk deteksi serologi antara lain presipitasi dalam tabung, aglutinasi kloroplas, flokulasilateks, gel double-diffusion test, Dot immunobinding assay (DIBA), immunoblotting atau western blotting, dan Enzyme Linked Immunosorbent Assay (ELISA) (Harlow & Lane 1999).
Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara in vitro. Metode ini banyak digunakan untuk berbagai macam manipulasi dan analisis genetik, misalnya untuk melipatgandakan suatu molekul DNA. Dengan metode ini, segmen tertentu pada DNA dapat digandakan hingga jutaan kali lipat dalam waktu relatif singkat. Kelebihan lain metode PCR adalah bahwa reaksi ini dapat dilakukan dengan menggunakan komponen dalam jumlah sangat sedikit, misalnya DNA cetakan yang diperlukan hanya sekitar 5 μg, oligonukleotida yang diperlukan hanya sekitar 1 mM, dan reaksi ini biasa dilakukan dalam volume 50- 100 μl (Yuwono 2006). Menurut Muladno (2010), PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan cara
mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target tersebut melalui bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler. Panjang target DNA berkisar antara puluhan sampai ribuan
Reaksi pelipatgandaan suatu fragmen DNA dengan cara PCR terdiri dari tiga tahapan atau tiga reaksi, yaitu denaturasi, penempelan primer (annealing), dan pemanjangan primer (extension).
Denaturasi. Tahapan pertama dimulai dengan melakukan denaturasi DNA cetakan sehinggga rantai DNA yang berantai ganda (double stranded) akan terpisah menjadi rantai tunggal (single stranded). Denaturasi DNA dilakukan dengan menggunakan panas (95ºC) selama 1-4 menit (Yuwono 2006). Denaturasi yang tidak lengkap mengakibatkan DNA mengalami renaturasi (membentuk DNA untai ganda kembali) secara cepat, dan ini mengakibatkan gagalnya proses PCR. Adapun waktu denaturasi yang terlalu lama, mungkin dapat mengurangi aktivitas enzim Taq polymerase (Muladno 2010).
Penempelan Primer (Annealing). Tahap kedua yaitu penempelan primer (annealing) pada DNA cetakan yang telah terpisah menjadi rantai tunggal yang dilakukan pada suhu 55ºC selama 1 menit. Primer akan membentuk jembatan hidrogen dengan cetakan pada daerah sekuen yang komplementer dengan sekuen primer (Yuwono 2006). Pada tahapan ini, primer forward yang runutan nukleotidanya berkomplemen dengan salah satu untai tunggal akan menempel pada posisi komplemennya. Demikian juga primer reverse akan menempel pada untai tunggal lainnya (Muladno 2010).
Pemanjangan Primer (Extension). Setelah kedua primer menempel pada posisinya masing-masing, enzim Taq polymerase mulai mensintesis molekul DNA baru yang dimulai dari ujung 3’ masing-masing primer (Muladno 2010). Sintesis DNA ini terjadi pada suhu 72ºC selama 1-2 menit. Pada suhu ini, DNA polymerase akan melakukan proses polimerasi rantai DNA yang baru berdasarkan
informasi yang ada pada DNA cetakan dengan bantuan enzim Taq DNA polymerase (Yuwono 2006).
9
tersebut diulangi lagi sampai 25-30 siklus sehingga pada akhir siklus akan didapatkan molekul-molekul DNA rantai ganda yang baru hasil polimerasi dalam jumlah yang jauh lebih banyak dibandingkan dengan jumlah DNA cetakan yang digunakan (Yuwono 2006).
Reverse Transcription Polymerase Chain Reaction (RT-PCR)
Teknik RT-PCR dikembangkan untuk melakukan analisis terhadap molekul RNA hasil transkripsi yang terdapat dalam jumlah sangat sedikit di dalam sel. Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan, maka terlebih dahulu dilakukan proses transkripsi balik (reverse transcription) terhadap molekul RNA sehingga diperoleh molekul cDNA
(complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006).
Pemanfaatan Metode Serologi dan PCR untuk Mendeteksi Virus Tumbuhan Masing-masing metode serologi yang diuraikan di atas telah dikembangkan dan berhasil digunakan untuk mendeteksi beberapa jenis virus penting pada tumbuhan. Metode DIBA dilaporkan digunakan untuk mendeteksi Tobaco mosaic tobamovirus (TMV) (Somowiyarjo et al. 1997) dan Chilli veinal
mottle potyvirus (ChiVMV) pada cabai (Opriana 2009). Abouzid et al. (2002)
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di rumah kaca University Farm IPB di Cikabayan dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Maret sampai Juli 2011.
Metode Penelitian Persiapan Tanaman Inang Sumber Inokulum
Tanaman untuk perbanyakan virus yang digunakan adalah bibit tanaman kacang panjang varietas Parade. Benih kacang panjang ditanam dalam polybag dengan menggunakan media tanam berupa campuran tanah dan pupuk kandang (1:1) dan ditempatkan di rumah kaca atau pada ruang kedap serangga untuk menghindari serangan hama terutama serangga vektor. Tanaman kacang panjang tersebut akan diinokulasi dengan BCMV secara mekanis.
Inokulasi Virus secara Mekanis
Metode Indirect Enzyme -Linked Immunosorbent Assay (I-ELISA)
Metode I-ELISA dilakukan dengan menggunakan tanaman yang terinfeksi BCMV. Sampel tanaman terinfeksi BCMV digerus dalam buffer coating dengan perbandingan 1:100 (b:v). Sampel tersebut kemudian dimasukkan ke dalam masing-masing sumuran pada plat mikrotiter ELISA sebanyak 100 µl dan diinkubasi pada suhu 4oC selama semalam. Masing-masing sumuran selanjutnya dicuci sebanyak 5-7 kali dengan phosphate buffer saline tween-20 (PBST) dan kemudian diisi dengan 100 µl antiserum BCMV yang telah dilarutkan dalam bufer ECL (bovine serum albumin 2 g, PVP 20 g, NaN3 0.2 g) (1:200).
Plat ELISA tersebut kemudian diinkubasi pada suhu 37oC selam 2 jam. Masing-masing sumuran selanjutnya dicuci kembali dan kemudian diisi dengan 100 µl konjugat yang dilarutkan dalam bufer ECL dengan perbandingan 1:1000. Larutan konjugat terebut kemudian diinkubasi pada suhu ruang selam 2 jam. Setelah 2 jam plat dicuci 2-7 kali dengan PBST. Sumuran selanjutnya diisi dengan 100 µl PNP yang dilarutkan dalam bufer PNP. Setelah diinkubasi pada suhu ruang selama 30 menit dilakukan pengamatan secara kuantitatif dengan menggunakan ELISA reader (Bio-RAD 550) pada panjang gelombang 405 nm. Reaksi dihentikan dengan cara menambahkan larutan NaOH 3 M sebanyak 50 µl kedalam masing-masing sumuran. Pada setiap pengujian disertakan kontrol negatif yaitu tanaman sehat dan bufer.
Evaluasi metode I – ELISA dilakukan untuk menentukan batas sensitifitas, yaitu dengan melakukan pengenceran pada sap tanaman dan antiserum. Sap tanaman diencerkan secara berseri sampai 106 dan antiserum diencerkan hingga pengenceran 105.
Metode Dot Immunobinding Assay (DIBA)
13
selanjutnya diteteskan ke atas membran nitroselulosa sebanyak 10 μl. Setelah tetesan sampel kering, membran direndam di dalam 10 ml larutan blocking non fat milk 2% dalam TBS yang mengandung Triton X-100 dengan konsentrasi akhir 2%. Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 2 jam dengan menggunakan EYELA multi shaker MMS. Membran kemudian dicuci 5 kali dengan dH2O, tiap pencucian berlangsung 5 menit sambil digoyang dengan kecepatan 100 rpm. Membran selanjutnya direndam dalam 5 ml TBS yang mengandung antibodi 5 μl ditambah non fat milk dengan konsentrasi akhir 2% dan kemudian membran diinkubasi semalam pada suhu kamar sambil digoyang dengan kecepatan 50 rpm. Membran kemudian dicuci sebanyak 5 kali dengan Tween 0.05% dalam TBS (TBST). Membran selanjutnya direndam dalam 5 ml TBS yang mengandung konjugat 5 μl (goat anti rabbit-IgG, Sigma, USA) ditambah non fat milk dengan konsentrasi akhir 2% dan kemudian membran diinkubasi selama 60 menit sambil digoyang dengan kecepatan 50 rpm. Membran selanjutnya dicuci kembali dengan TBST dan direndam selama 5 menit dalam 10 ml bufer substrat (Tris-HCl 0.1 M, NaCl 0.1 M dan MgCl2 5 mM) yang mengandung nitro blue tetrazolium (NBT) 66 μl dan bromo chloro indolil phosphate (BCIP) 30 μl. Bila reaksi positif akan terjadi perubahan warna putih menjadi ungu pada membran nitroselulosa yang telah ditetesi cairan perasan tanaman dan reaksi dapat dihentikan dengan merendam membran dalam dH2O.
Evalusi metode DIBA dilakukan dengan perlakuan pengenceran sap tanaman hingga 106 dan penggunaan dua membran yang berbeda yaitu Amersham HybondTM-P dan Nitropure GE untuk menentukan sensitifitas metode deteksi.
Metode Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
Tahapan metode deteksi BCMV menggunakan metode RT-PCR terdiri atas tahapan ekstraksi RNA total, transkripsi balik, dan amplifikasi cDNA.
Ekstraksi RNA Total. Metode ekstraksi RNA dilakukan dengan menggunakan NucleoSpin RNA Plant mini kit mengikuti metode Macherey-Nagel (2010). Daun
Sebanyak 350 μl bufer RA1 yang telah ditambahkan 1% merkaptoetanol (3.5 μl) dimasukkan ke dalam hasil gerusan yang telah menjadi bubuk. Sap yang dihasilkan dimasukkan ke dalam tabung mikro1.5 ml kemudian disentrifugasi dengan kecepatan 11 000 rpm selama 1 menit. Sap tanaman dipindahkan dalam tabung mikro yang baru tanpa endapannya dan ditambahkan 350 μl etanol 70%. Sap dipindahkan ke dalam kolom ungu dan disentrifugasi dengan kecepatan 11 000 rpm selama 1 menit. Supernatan yang terbentuk ditambahkan 350 μl MBD (Membrane Desalting Buffer) dan kemudian dipindahkan dalam kolom biru. Hal ini dilakukan dengan tanpa menyentuh pelet di dasar tabung. Sebanyak 95 μl DNase ditambahkan dalam kolom biru dan diinkubasi pada suhu ruang selama 15 menit.
Proses selanjutnya adalah pencucian dan pengeringan membran silika. Proses pencucian dilakukan sebanyak tiga kali dengan bufer pencucian yang berbeda. Sebanyak 200 μl RA2 ditambahkan pada kolom biru kemudian disentrifugasi dengan kecepatan 11 000 rpm selama 30 detik. Pencucian kedua dilakukan dengan menambahkan RA3 sebanyak 600 μl pada kolom biru lalu disentrifugasi dengan kecepatan 11 000 rpm selama 30 detik. Pencucian ketiga dilakukan dengan menambahkan bufer yang sama pada pencucian kedua, tapi hanya sebanyak 250 μl dan disentrifugasi dengan kecepatan 11 000 rpm selam 2 menit. Setiap proses pencucian kolom biru sebelumnya dipindahkan ke collection tube baru lalu ditambahkan bufer-bufer pencucian. Untuk memastikan bahwa kolom biru benar-benar kering, selanjutnya kolom dipindahkan lagi ke collection tube baru dan disentrifugasi lagi 11 000 rpm selama 1 menit. Kolom dipindahkan ke tabung mikro 1.5 ml baru dan ditambahkan 60 μl RNase- free water ke permukaan saringan dalam kolom sehingga pelet tergenang, lalu disentrifugasi dengan kecepatan 11 000 rpm selama 1 menit. Hasil ekstraksi disimpan pada suhu -80oC sampai akan digunakan.
15
kondisi RT; 25oC selama 5 menit, 37oC selama 90 menit dan 70oC selama 15 menit. Hasil akhir dari RT adalah produk cDNA yang akan digunakan pada reaksi selanjutnya yaitu PCR.
Amplifikasi cDNA. Amplifikasi dilakukan dengan menggunakan pasangan primer yaitu BIC-cpF (5’-TCA GGA ACT GGG CAG CCG CAA C-3’) dan BIC-cpR (5’-CTG CGG GGA ACC CAT GCC AAG-3’). Reaksi amplifikasi (25 μl) terdiri atas 16.3 μl water free nuclease, 2.5 μl PCR buffer, 0.2 μl dNTP, 2.5 μl sucrose creasol, 1μl primer BIC-F, 1 μl primer BIC-R, 1 μl taq polymerase, 1 μl cDNA hasil RT. Semua bahan tersebut diisi ke dalam tabung mikro, selanjutnya tabung mikro tersebut dimasukkan ke dalam thermal cycler (Gene Amp PCR System 9700). Amplifikasi BCMV dilakukan sebanyak 35 siklus mengikuti metode Udayashankar et al. (1995) melalui beberapa tahapan yaitu pemisahan utas DNA pada suhu 94 oC selama 2 menit, penempelan primer pada DNA 68 oC selama 1 menit dan sintesis DNA pada suhu 72 oC selama 1 menit. Khusus untuk siklus terakhir ditambah tahapan sintesis selama 10 menit, kemudian siklus berakhir dengan suhu 4 oC.
Evaluasi metode RT-PCR dilakukan dengan perlakuan pengenceran cDNA hingga 105 untuk menentukan batas cDNA yang dapat digunakan untuk deteksi BCMV.
Metode Polymerase Chain Reaction (PCR)
Metode PCR dilakukan melalui tahapan ekstrasi DNA, amplifikasi DNA, dan visualisasi hasil PCR dengan gel agarosa.
kemudian ditambahkan 1 ml campuran Kloroform:Isoamilalkhohol (CI) dengan perbandingan 24:1 (v : v). Agar tercampur dengan baik tabung divorteks selama 5 menit, kemudian disentrifugasi dengan kecepatan 12000 rpm selama 15 menit dan diambil supernatannya. Supernatan yang diperoleh diambil secara hati-hati dan dipindahkan pada tabung baru dan ditambahkan 0.1 volume sodium asetat (CH3COOH 3M pH 5.2) dicampur dengan rata dan ditambahkan 2.5 volume etanol absolut dan diinkubasi pada suhu -20oC selama satu malam. setelah itu disentrifugasi dengan kecepatan 12 000 rpm selama 15 menit. Pelet hasil sentrifugasi dicuci dengan menambahkan etanol 70%, kemudian disentrifugasi kembali selama 10 menit dan dibuang supernatannya, selanjutnya pelet dikeringkan. Setelah kering, pelet yang diperoleh dilarutkan dengan 60 μl bufer TE 1x (10 mM Tris-HCl pH 8.0, 1 mM EDTA).
Amplifikasi DNA. Metode amplifikasi dilakukan mengikuti metode yang dilakukan oleh Rojas et al. (1993). Reaksi PCR (volume total 25 μl) dilakukan dengan mencampurkan water free nuclease, 16.3 μl bufer PCR, 2.5 μl sucrose cresol, 0.5 μl dNTP, 1 μl masing-masing primer pAL1v 1978 (5’GCA TCT GCA GGC CCA CAT YGT CTT YCC NGT 3’)pAR1c 715 (5’ GAT TTC TGC AGT TDA TRT TYT CRT CCA TCC A 3’) (Rojas et al. 1993), 0.2 μl unit Taq DNA polimerase, dan 1 μl DNA template. PCR dilakukan pada reaksi sebagai berikut: satu siklus optimasi pada suhu 94oC selama 1 menit, 30 siklus yang terdiri dari tahap denaturasi DNA pada suhu 94oC selama 1 menit, tahap penempelan primer ke DNA target pada suhu 55oC selama 2 menit, dan tahap pemanjangan DNA pada suhu 72oC selama 10 menit yang diakhiri pada suhu 4oC untuk penyimpanan.
Visualisasi Hasil PCR. Hasil PCR divisualisasi pada 1% gel agarosa dalam 0.5x bufer TBE (Tris-borate EDTA) dengan tegangan 100 volt selama 25 menit. Gel diamati dengan UV transilluminator setelah diwarnai dengan etidium bromida.
Deteksi Virus dari Sampel Kacang Panjang Bergejala
17
Perbanyakan Sumber Inokulum Virus
Tanaman kacang panjang varietas Parade yang diinokulasi BCMV mulai menunjukkan gejala pada 7 hari setelah inokulasi. Gejala pada daun kacang panjang diawali dengan lepuhan atau daun mengkerut dan malformasi pada daun muda dan gejala berkembang mejadi mosaik pada daun tua (Gambar 1). Djikstra & De Jegger (1998) melaporkan tanaman kacang panjang yang terinfeksi oleh beberapa strain BCMV menunjukkan gejala yang mirip dengan hasil penelitian yaitu menunjukkan daun mosaik, klorosis, dan malformasi pada daun-daun muda.
Gambar 1. Gejala infeksi BCMV pada kacang panjang varietas Parade: (A) Gejala melepuh pada daun muda, (B) Gejala mosaik.
Deteksi BCMV dengan Metode I – ELISA
Metode ELISA merupakan suatu metode pengujian serologi yang didasarkan pada terbentuknya kompleks ikatan antara antibodi dengan antigen di dalam sumuran plat mikrotiter ELISA yang terbuat dari bahan plastik. Jika terjadi reaksi kompatibel antara antibodi dengan antigen akan ditunjukkan dengan adanya perubahan warna (Dijkstra et al. 1998). Pengamatan secara visual terhadap perubahan warna yang terjadi pada plat mikrotiter ELISA menunjukkan perbedaan warna kuning. Warna kuning terlihat sangat jelas pada pengenceran sap 1:102 dan warna kuning semakin berkurang dengan semakin tingginya pengenceran sap tanaman. Begitu juga dengan pengenceran antiserum, semakin tinggi pengenceran maka warna kuningnya akan semakin berkurang. Hasil
19
pembacaan nilai absorbansi ELISA (NAE) pada 405 nm menunjukkan bahwa pada pengenceran sap 1: 102 NAE dapat mencapai lebih dari 6 kali NAE kontrol negatif bila konsentrasi antiserum yang digunakan adalah 100 dan 101 (Tabel 1 dan Lampiran 1). Nilai absorbansi tersebut menurun mengikuti faktor pengenceran antiserum. Pada pengenceran sap 1:103 NAE dapat mencapai lebih dari 2 kali NAE kontrol negatif untuk konsentrasi antiserum 1: 100 dan 1: 10 dan NAE akan menurun mengikuti faktor pengenceran antiserum. Batas sensitifitas pengujian dengan metode I-ELISA adalah pada tingkat pengenceran sap tanaman 1:103 dengan pengenceran antiserum 102. Batas sensitifitas yang sama dilaporkan oleh Opriana (2009) pada pengujian ChiVMV dengan ELISA.
Tabel 1 Hasil pengujian BCMV menggunakan metode I-ELISA pada berbagai
tingkat pengenceran cairan perasan tanaman dan antiserum.
- : nilai absorban < 2 kali kontrol negatif + : nilai absorban 2 kali kontrol negatif ++ : nilai absorban > 2 – 4 kali kontrol negatif +++ : nilai absorban > 4 - 6 kali kontrol negatif ++++ : nilai absorban > 6 kali kontrol negatif.
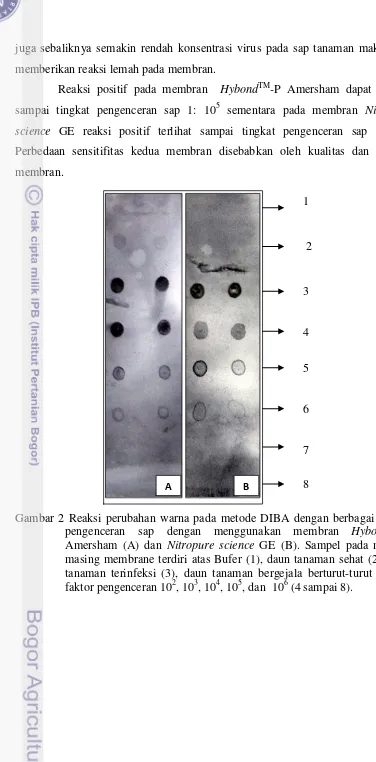
Deteksi BCMV dengan Metode DIBA
Metode DIBA menggunakan membran HybondTM-P Amersham dan Nitropure science GE memberikan reaksi positif yang ditandai dengan adanya
juga sebaliknya semakin rendah konsentrasi virus pada sap tanaman maka akan memberikan reaksi lemah pada membran.
Reaksi positif pada membran HybondTM-P Amersham dapat terlihat sampai tingkat pengenceran sap 1: 105 sementara pada membran Nitropure science GE reaksi positif terlihat sampai tingkat pengenceran sap 1: 104. Perbedaan sensitifitas kedua membran disebabkan oleh kualitas dan kondisi membran.
1
2
3
4
5
6
7
8
Gambar 2 Reaksi perubahan warna pada metode DIBA dengan berbagai tingkat pengenceran sap dengan menggunakan membran HybondTM-P Amersham (A) dan Nitropure science GE (B). Sampel pada masing-masing membrane terdiri atas Bufer (1), daun tanaman sehat (2), daun tanaman terinfeksi (3), daun tanaman bergejala berturut-turut dengan faktor pengenceran 102, 103, 104, 105, dan 106 (4 sampai 8).
21
Deteksi BCMV dengan RT – PCR
Amplifikasi menggunakan pasangan primer BIC-cpF dan BIC-cpR menghasilkan produk yang berukuran sekitar 850 pasang basa (bp) (Gambar 3). Pengenceran bertingkat terhadap cDNA yang digunakan sebagai DNA cetakan pada tahap amplifikasi menunjukkan bahwa semakin banyak cDNA yang digunakan maka hasil amplifikasi akan semakin jelas. Produk amplifikasi DNA berkorelasi positif dengan konsentrasi cDNA. Pita DNA masih terbentuk pada pengenceran cDNA 104 dan pita tidak terbentuk lagi pada pengenceran 105, 106 dan 107.
100 10-2 10-3 10-4 10-5 10-6
M 1 2 3 4 5 6 7 8 9
Gambar 3 Hasil amplifikasi RT-PCR dari tanaman kacang panjang terinfeksi BCMV dengan cDNA yang diencerkan bertingkat menggunakan primer BIC-F dan BIC-R. (M) Marker 1 kb; (1) tanaman sehat; sampel cDNA yang diencerkan bertingkat berturut- turut 100, 101, 102, 103, 104, 105, 106, 107 (2 sampai 9).
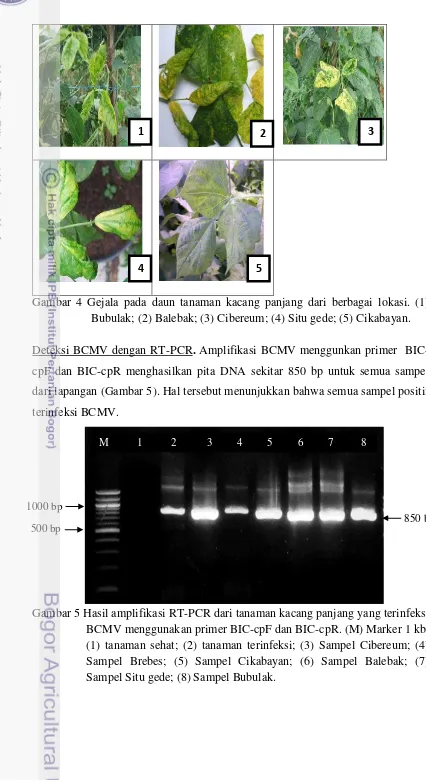
Deteksi Sampel dari Lapangan
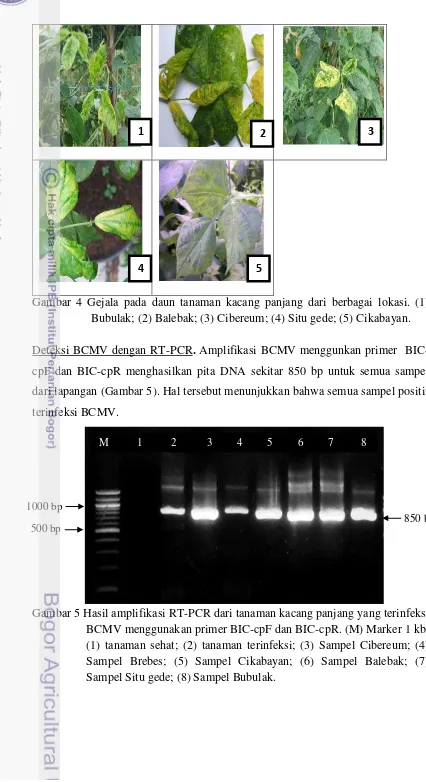
Gejala pada tanaman kacang panjang di lapangan cukup beragam antara satu tempat dengan tempat lainnya. Gejala mosaik kuning ditemukan pada tanaman di Bubulak, Balebak, Brebes, dan Situ Gede sedangkan gejala melepuh ditemukan pada tanaman di Cibereum dan Cikabayan (Gambar 4).
500 bp
Gambar 4 Gejala pada daun tanaman kacang panjang dari berbagai lokasi. (1) Bubulak; (2) Balebak; (3) Cibereum; (4) Situ gede; (5) Cikabayan.
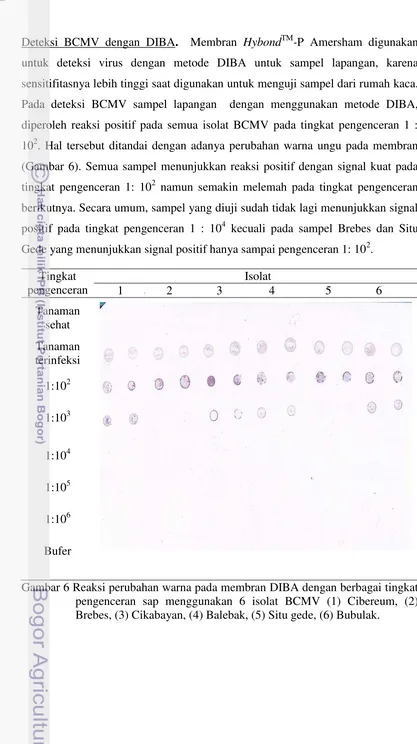
Deteksi BCMV dengan RT-PCR. Amplifikasi BCMV menggunkan primer BIC-cpF dan BIC-cpR menghasilkan pita DNA sekitar 850 bp untuk semua sampel dari lapangan (Gambar 5). Hal tersebut menunjukkan bahwa semua sampel positif terinfeksi BCMV.
Gambar 5 Hasil amplifikasi RT-PCR dari tanaman kacang panjang yang terinfeksi BCMV menggunakan primer BIC-cpF dan BIC-cpR. (M) Marker 1 kb; (1) tanaman sehat; (2) tanaman terinfeksi; (3) Sampel Cibereum; (4) Sampel Brebes; (5) Sampel Cikabayan; (6) Sampel Balebak; (7) Sampel Situ gede; (8) Sampel Bubulak.
M 1 2 3 4 5 6 7 8
1 2
4 5
3
500 bp 850 bp
23
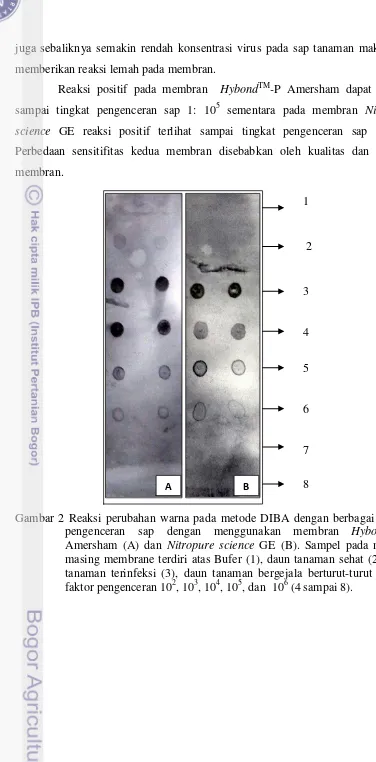
Deteksi BCMV dengan DIBA. Membran HybondTM-P Amersham digunakan untuk deteksi virus dengan metode DIBA untuk sampel lapangan, karena sensitifitasnya lebih tinggi saat digunakan untuk menguji sampel dari rumah kaca. Pada deteksi BCMV sampel lapangan dengan menggunakan metode DIBA, diperoleh reaksi positif pada semua isolat BCMV pada tingkat pengenceran 1 : 102. Hal tersebut ditandai dengan adanya perubahan warna ungu pada membran (Gambar 6). Semua sampel menunjukkan reaksi positif dengan signal kuat pada tingkat pengenceran 1: 102 namun semakin melemah pada tingkat pengenceran berikutnya. Secara umum, sampel yang diuji sudah tidak lagi menunjukkan signal positif pada tingkat pengenceran 1 : 104 kecuali pada sampel Brebes dan Situ Gede yang menunjukkan signal positif hanya sampai pengenceran 1: 102.
Tingkat pengenceran
Isolat
1 2 2 3 4 5 6 Tanaman
sehat Tanaman terinfeksi
1:102
1:103
1:104
1:105
1:106
Bufer
Deteksi Geminivirus dengan PCR. Deteksi Geminivirus dilakukan karena sampel yang diambil dari lapangan menunjukkan gejala yang diduga berasosiasi dengan infeksi Geminivirus yaitu gejala kuning pada daun. Dari enam sampel yang diuji terdapat empat sampel (Cirebon, Cikabayan, Balebak, dan Bubulak) yang menghasilkan pita DNA berukuran 1600 bp sesuai yang dilaporkan Aidawati (2000) (Gambar 7). Hasil tersebut menunjukkan bahwa gejala kuning yang disertai mosaik pada tanaman kacang panjang merupakan gejala infeksi Geminivirus. Perbedaan ketebalan pita DNA dapat disebabkan oleh konsentrasi
virus dalam jaringan tanaman.
Gambar 7 Hasil amplifikasi PCR dari tanaman kacang panjang yang terinfeksi Geminivirus menggunakan primer pAL1v 1978 dan pAR1c 718. (M) Marker 100 base pairs (bp); (1) tanaman sehat; (2-8) sampel berturut- turut berasal dari Cirebon, Cibereum, Brebes, Cikabayan, Balebak, Situ gede, Bubulak.
Pembahasan
Deteksi dan identifikasi virus dapat dilakukan berdasarkan karakter biologi dan molekuler. Deteksi virus berdasarkan karakter biologi dapat dilakukan dengan pengujian tanaman indikator, penularan, dan berdasarkan bentuk partikel. Deteksi dan identifikasi menggunakan karakter molekuler umumnya dilakukan dengan dua cara yaitu berdasarkan sifat protein dengan uji serologi dan sifat asam nukleat dengan hibridisasi DNA, ekstraksi dsDNA/dsRNA serta PCR/RT-PCR (Foster & Taylor 1998; Hull 2002).
Metode ELISA dan DIBA merupakan metode serologi yang banyak digunakan untuk mendeteksi dan mengidentifikasi virus tumbuhan. Dalam metode
M 1 2 3 4 5 6 7 8
1600 bp
25
ini antiserum dikonjugasikan dengan enzim, sehingga bila ditambahkan substrat enzim maka kompleks antigen-antibodi dalam jumlah yang sedikit saja dapat tervisualisasi. Hasil yang diperoleh pada metode ELISA dapat dianalisis secara kuantitatif dengan spektrofotometer (ELISA reader) sementara hasil DIBA hanya dapat dianalisis secara kualitatif. Keuntungan uji ELISA adalah sensitifitas yang sangat tinggi yaitu dapat mendeteksi virus pada konsentrasi rendah (1-10 ng/ml), dapat menguji sampel dalam jumlah banyak secara cepat, penggunaan antiserum yang sedikit, dan hasilnya dapat diperoleh secara kualitatif dan kuantitatif, serta prosedur pengujian yang mudah. Karena keuntungan tersebut, ELISA dengan cepat menggantikan semua teknik seri diagnostik yang lain (Agrios 1997; Dijkstra et al. 1998).
Deteksi serologi dengan metode Indirect ELISA memberi hasil positif untuk BCMV sampai pengenceran sap 103 dan pengenceran antiserum 103. Tingkat pengujian yang lebih sensitif diperoleh dengan metode DIBA yang mampu memberikan hasil positif sampai pengenceran sap 105. Batas sensitifitas sap DIBA lebih tinggi dibandingkan dengan metode I-ELISA dan hanya memerlukan antiserum yang lebih sedikit dibandingkan dengan I-ELISA untuk pengujian dengan sampel yang sama.
Dewasa ini metode deteksi yang lebih banyak digunakan adalah metode deteksi berdasarkan sifat molekuler virus. Metode ini lebih sensitif, akurat, dan lebih efisien dalam penggunaan waktu dan tenaga. Hasil visualisasi elektroforesis menunjukkan bahwa metode RT-PCR berhasil mengamplifikasi BCMV dengan konsentrasi template cDNA yang rendah. Hal tersebut menunjukkan keunggulan teknik PCR yaitu kemampuan mendeteksi virus dari jaringan tanaman dengan konsentrasi virus yang rendah.
positif,kontrol negatif, dan larutan penyangga. Sebaliknya, RT-PCR tidak dapat dilakukan pada kondisi lapangan karena memerlukan peralatan yang canggih.
Teknik RT-PCR memiliki keunggulan pada aspek kecepatan diagnosis. Waktu yang dibutuhkan dalam teknik RT-PCR adalah sekitar 6,5 jam, sedangkan untuk teknik I-ELISA dan DIBA sekitar 10 - 15 jam (bila dilakukan secara overnight akan memakan waktu selama 22 - 30 jam) (Tabel 2). Teknik RT-PCR memiliki tingkat kesulitan yang lebih tinggi daripada teknik I-ELISA. Untuk mendapatkan hasil yang akurat, dibutuhkan keterampilan yang tinggi. Ketrampilan dalam melakukan berbagai pengujian dapat diperoleh melalui latihan yang intensif sehingga hasil pengujian yang diperoleh akan optimal.
Berdasarkan kebutuhan biaya pengujian I-ELISA dan DIBA memerlukan biaya lebih rendah daripada RT-PCR (Tabel 2), karena bahan-bahan untuk I-ELISA dan DIBA relatif lebih murah. Perhitungan biaya I-I-ELISA dan RT-PCR menunjukkan bahwa untuk 1 sampel uji yang dilakukan secara duplo, teknik I-ELISA hanya membutuhkan biaya Rp 5.500,- sedangkan tiap sampel uji RT-PCR membutuhkan biaya sekitar Rp 103.000,- (Kartiningtyas et al. 2006).
Ketersediaan metode deteksi virus yang sangat beragam perlu disikapi dengan tepat dan bijaksana, terutama untuk menetapkan metode yang akan digunakan. Beberapa hal yang perlu diperhatikan untuk memilih metode deteksi yang akan digunakan adalah sensitifitas, dapat mendeteksi secara spesifik, dapat selesai dalam waktu yang singkat, dan murah (Naidu & Hughes 2003).
Tabel 2 Evaluasi metode I-ELISA, DIBA, dan RT-PCR
Pembanding Metode
I-ELISA DIBA RT-PCR
Sensitivitas 0.01 g 0.001 g 0.0002 g
Akurasi Sedang-tinggi Sedang-tinggi Tinggi
Waktu 10-30 jam 10-30 jam 3-6.5 jam
Kapasitas 45-90 sampel 45-90 sampel 96 sampel
KESIMPULAN DAN SARAN
Kesimpulan
Metode I-ELISA, DIBA dan RT-PCR dapat digunakan untuk mendeteksi Bean common mosaic potyvirus (BCMV) dengan tingkat sensitifitas yang berbeda- beda. Tingkat sensitifitas metode I-ELISA adalah sampai pada tingkat pengenceran antigen 103 dan antiserum 102, sementara metode DIBA mempunyai sensitifitas lebih tinggi, karena masih dapat mendeteksi hingga tingkat pengenceran sap 105. Sensitifitas RT-PCR dalam mendeteksi BCMV lebih tinggi dibandingkan DIBA dan I-ELISA karena jumlah sampel daun tanaman minimal yang digunakan untuk pengujian lebih kecil. Akurasi dan biaya RT-PCR lebih tinggi daripada I-ELISA dan DIBA. Dari segi waktu pengujian RT-PCR lebih cepat dibandingkan dengan I-ELISA dan DIBA.
Saran
WE, Petersen MA, Peyser B, Patte C, Hiebert E. 2002. Serological studies using polyclonal antisera prepared against the viral coat protein of four Begomovirus expressed in Escherichia coli. Plant Dis 86:1109-1114.
Agdia Incorporated. 2009. Metode I-ELISA. Indiana, USA
Akin HM. 2006. Virologi Tumbuhan. Yogyakarta: Penerbit Kanisius. Agrios GN. 1997. Plant Pathology. Ed.ke-4. San Diego : Academic press.
Aidawati N. 2000. Penularan virus kerupuk tembakau dengan Bemisia tabaci genn. (Homoptera: Aleyrodidae)[Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Anwar A, Sudarsono, Ilyas S, 2005. Indonesian Vegetable Seeds: Current Condition and Prospects in Business of Vegetable seeds. Bul Agron 33: 38-47.
[CABI] Center for Agriculture and Bioscience International. 2007. Crop Protection Compendium [CD-ROM]. CABI Publish.
Damayanti TA, Alibi OJ, Naidu RA, Rauf A. 2009. Severe Outbreak of a Yellow Mosaic Disease on the Yard Long Bean in Bogor, West Java. HAYATI Journal of Biosciences 16: 78-82.
Damayanti TA, Gede S, Nurdianto, Rustiani US, Mugiono. 2005. Kajian sifat biologi-ekologi dan molekuler Banana streak virus isolat Indonesia (BSV-In) virus baru pada tanaman di Indonesia. [laporan penelitian]. IPB
Djikstra J, De Jegger. 1998. Practical Plant Virology: protocol and Exercise. Boston: Springer.
Drijfhout, Bos L. 1977. Classification of strains of bean common mosaic virus. Neth. J. Pl. Path 83: 13.
Doyle JJ, Doyle JL. 1990. Isolation of Plant DNA from Fresh Tissue. Focus 12: 13- 15.
Foster GD, Taylor SC. 1998. Plant Virology Protocols. From virus isolation to transgenic resistence. New Jersey: Human Press.
Galvez GE, Morales FJ. 1989. Aphid-transmitted Viruses. Di dalam : H. F. Schwartz and M. A & Pastor-Corrales, editor. Bean Production Problems in the Tropics. Ed ke-2. Colombia : Cent. Int. Agric. Trop. (CIAT). Hlm 333-361.
Haryanto E, Suhartini T, Rahayu E. 1999. Budi Daya Kacang Panjang. Jakarta; Penebar Swadaya.
Hidayat SH. 1999. Keragaman genetik virus-virus Gemini di Indonesia: kisaran inang dan karakter molekuler [laporan penelitian]. IPB.
29
Harlow, Lane D. 1999. Using Antibodies. A Laboratorium Manual. New York: Cold Springer Harbor Laboratory Press.
Kadir M. 2002. Deteksi vrus penyebab penyakit kerupuk pada tanaman tembakau (Nicotinia tabacum L) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Kartiningtyas, Hidayat SH. 2006. Deteksi Turnip mosaic virus (TuMV) pada benih dan jaringan daun. J HPT Tropica 6: 32-40
Langeveld SA et al. 1991. Identification of potyvirus using the polymerase chain reaction with degenerate primer. J Gen Virol 69: 1351-1357.
Mahmood T, Hein GL, French RC. 1997. Development of serological procedures for rapid and reliable detection of Wheat streak mosaic virus in a single wheat curl mite. Plant Dis 81:250-253.
Morales FJ, Bos L. 1988. Bean Common Mosaic Virus. Description of Plant Viruses 37.
Muladno. 2010. Teknologi Rekayasa Genetika. Ed ke-2. Bogor: IPB Press.
Mulyaman S. 2009. Mewaspadai OPT baru yang eksplosif dan upaya penanggulangannya. Sinar Tani 28 Mei 2009 No. 3254.
Nazaruddin. 2003. Budi daya dan Pengaturan Panen Sayuran Dataran Rendah. Jakarta: Penebar Swadaya.
Naidu RA, Hughes JDA (2003). Methods for the detection of plant viral diseases in plant virology in sub-Saharan Africa, Proceedings of plant virology, IITA, Ibadan, Nigeria. Eds. Hughes JDA, Odu B, pp. 233- 260.
Nurulita S. 2011. Identifikasi Tomato infectious chlorosis virus (TiCV) dan Tomato chlorosis virus (ToCV) melalui Reverse transcription polymerase chain reaction (RT-PCR) dan sikuen nukleotida [Skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Opriana E. 2009. Metode deteksi untuk pengujian respon ketahanan beberapa genotipe cabai terhadap infeksi Chilli veinal mottle potyvirus (ChiVMV)[Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Robertson NL, French R, Gray SM. 1991. Use of group-spesific primers ant the
polymerase chain reaction for the detection and identification of Luteovirus. J Gen Virol 72: 1473-1477.
Rojas ME, Gilbertson RL, Russel DR, Maxwell DP. 1993. Use of the generate primers in the polymerase chain reaction to detect whitefly- Transmitted Geminiviruses. Plant Dis 77: 340- 347.
Shukla DD, Ward CW, Brunt AA. 1994. The Potyviridae. CAB INTERNATIONAL. United Kingdom.
Statistik Indonesia. 2011. Production of Vegetables in Indonesia. http://www.bps.go.id/sector/agri/horti/table7.shtml. [7 September 2011]. Sudarshana MR, Wang HL, Lucas WJ, Gilbertson RL. 1997. Dynamics of Bean
dwarf mosaic geminivirus cell-to-cell and long distance movement in Phaseolus vulgaris revealed, using the green fluorescent protein. MPMI 4:277-291.
Susila AD. 2005. Panduan Budidaya Tanaman Sayuran. Bogor: IPB Press.
Udayashankar AC, Nayaka SC, Kumar HB, Mortensen CN, Shetty HS, Prakash HS. 2010. Establishing inoculum threshold levels for Bean. common mosaic virus strain blackeye cowpea mosaic infection in cowpea seed. African Journal of Biotechnology 9: 53.
LAMPIRAN
Lampiran 1 Rata-rata nilai absorbansi sampel terinfeksi BCMV pada berbagai tingkat pengenceran cairan perasan tanaman dan antiserum
menggunakan metode I-ELISA*.
Pengenceran cairan perasan tanaman
terinfeksi **
Pengenceran antiserum
101 102 103 104 105 106
1: 102 1.643 2.026 0.514 0.425 0.723 0.491
1: 103 0.446 0.764 0.340 0.360 0.220 0.185
1: 104 0.367 0.269 0.360 0.431 0.203 0.192
1: 105 0.168 0.257 0.269 0.248 0.237 0.265
1: 106 0.118 0.218 0.399 0.186 0.159 0.093
kontrol negatif 0.214 0.210 0.220 0.239 0.406 0.320
* Sampel dinyatakan positif bila nilai absorbansinya lebih dari dua kali nilai absorbansi control negatif yaitu sampel tanaman sehat
Penyakit Mosaik pada Kacang Panjang (Vigna sinensis L.) Berdasarkan Teknik Serologi dan Polymerase Chain Reaction. Dibimbing oleh SRI HENDRASTUTI HIDAYAT.
Tanaman kacang panjang (Vigna sinensis L.) merupakan salah satu komoditas yang sangat potensial untuk dikembangkan dalam usaha tani. Penyakit mosaik kacang panjang merupakan penyakit penting karena dapat menurunkan kualitas dan kuantitas produksi. Penyakit mosaik pada kacang panjang dapat disebabkan oleh beberapa virus antara lain Bean common mosaic potyvirus (BCMV). Deteksi BCMV dapat dilakukan berdasarkan metode serologi dan PCR. Penelitian ini bertujuan melakukan evaluasi terhadap tiga metode deteksi yaitu Indirect Enzym Linked Immunosorbent Assay (I-ELISA), Dot Immunobinding Assay (DIBA), dan RT-PCR untuk menentukan metode deteksi yang dapat digunakan sebagai metode diagnosis BCMV pada kacang panjang. Sampel yang digunakan adalah isolat virus (BCMV) asal Cirebon yang diperbanyak di rumah kaca. Evaluasi metode deteksi ditujukan untuk menentukan batas sensitifitas, yaitu dengan melakukan pengenceran pada sap tanaman dan antiserum (I-ELISA dan DIBA) atau cDNA (RT-PCR). Berdasarkan pengukuran nilai absorbans ELISA diketahui bahwa batas sensitifitas metode I-ELISA adalah pada tingkat pengenceran sap 1:103 dan pengenceran antiserum 102. Berdasarkan intensitas warna pada menbran nitroselulosa ditetapkan bahwa batas sensitifitas metode DIBA adalah pada tingkat pengenceran sap 1:105. Metode RT-PCR memiliki batas sensitifitas yang lebih tinggi karena pita DNA masih terbentuk pada pengenceran cDNA 104. Deteksi sampel lapangan yang berasal dari Kabupaten Bogor (Bubulak, Balebak, Cikabayan, Cibereum, dan Situ gede) dan Kabupaten Brebes berhasil mendiagnosis BCMV dan Geminivirus sebagai penyebab penyakit mosaik kacang panjang.
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna sinensis L.) merupakan salah satu komoditas sayuran yang sudah lama dikenal dan digemari banyak orang. Selain rasanya enak, kacang panjang sangat penting sebagai sumber vitamin A, vitamin B, vitamin C, dan mineral terutama pada polong yang muda. Biji kacang panjang mengandung protein, lemak, dan karbohidrat, sehingga kacang panjang merupakan sumber protein nabati yang baik bagi manusia ( Haryanto et al. 1999).
Tanaman kacang panjang sangat berpotensi untuk dikembangkan sebagai komoditi usaha tani, karena selain mudah dibudidayakan, pangsa pasarnya juga cukup tinggi. Salah satu kendala dalam usaha meningkatkan produksi kacang panjang adalah gangguan hama dan penyakit tanaman. Selain hama dan penyakit, faktor kendala yang dihadapi petani dalam mengembangkan usahatani kacang panjang adalah harga di pasar yang relatif rendah dan penggunaan benih dengan mutu yang rendah.
Salah satu penyakit yang sering ditemui pada tanaman kacang panjang adalah penyakit mosaik. Penyakit mosaik merupakan penyakit penting karena dapat menurunkan kualitas dan kuantitas produksi kacang panjang. Penyakit mosaik tersebut dapat disebabkan oleh beberapa jenis virus, diantaranya Bean common mosaic potyvirus (BCMV) dan Cucumber mosaic cucumovirus (CMV) (Damayanti et al. 2009).
Penyakit mosaik pada kacang panjang dapat ditularkan melalui benih, secara mekanis, dan serangga vektor yaitu kutudaun Aphis craccivora (Hemiptera : Aphididae). A. craccivora dapat menularkan lebih dari 30 virus tanaman secara non persisten. Peranan A. craccivora dalam menularkan virus di lapangan sangat penting, apalagi keberadaan kutudaun dapat terjadi sepanjang tahun (Galvez & Morales 1989). Selain kacang panjang, virus mosaik dapat menginfeksi tanaman dari famili leguminosae yang lain seperti Calopogonium mucuniodes, Crotalaria brevidens, Pisum sativum, Vigna unguiculata, Gliycine max,Trifolium hybridum,
Beberapa tahun terakhir (2008-2011) dilaporkan adanya peningkatan kejadian penyakit mosaik kacang panjang di beberapa daerah di Jawa Barat, Jawa Tengah dan Banten (Mulyaman 2008). Damayanti et al. (2009) melaporkan bahwa salah satu virus yang berasosiasi dengan penyakit mosaik tersebut adalah BCMV dan CMV. Hasil diagnosis lainnya menyimpulkan adanya infeksi Geminivirus pada tanaman kacang panjang yang menunjukkan gejala mosaik
kuning (S. H Hidayat 11 Juli 2011, komunikasi pribadi). Hasil diagnosis tersebut menunjukkan pentingnya upaya deteksi dan diagnosis penyebab penyakit yang akurat dan benar.
Teknik deteksi (virus) yang akurat menjadi persyaratan dalam tahapan awal diagnosis penyebab penyakit. Teknik dasar yang sejak lama dilakukan untuk mendeteksi dan mengidentifikasi virus tanaman adalah melalui pengamatan partikel virus menggunakan mikroskop elektron, pengamatan gejala pada tanaman terinfeksi, uji kisaran inang, dan uji penularan virus (Akin 2006). Teknik deteksi menggunakan uji serologi seperti ELISA (Enzyme Linked Immunosorbent Assay) dan DIBA (Dot Immunobinding Assay) telah dikembangkan sejak tahun 1970-an (Hull 2002). Teknik deteksi tersebut didasarkan pada reaksi spesifik antara antigen dan antibodi. Dilaporkan bahwa teknik serologi tersebut sangat baik untuk deteksi virus tumbuhan. Teknik deteksi lain yang sering digunakan dewasa ini adalah teknik deteksi molekuler seperti PCR (Polymerase Chain Reaction) yang memanfaatkan sifat spesifk urutan nukleotida virus (Akin 2006). Teknik PCR telah umum digunakan untuk mendeteksi virus, seperti Virus kerupuk daun tembakau (Kadir 2002), Chilli veinal mottle potyvirus (ChiVMV) pada cabai (Opriana 2011), Tomato chlorosis virus (ToCV) dan Tomato infectious choloris virus (TiCV) (Nurulita 2011). Pemilihan teknik deteksi yang tepat sangat
menentukan hasil deteksi, karena teknik deteksi yang kurang baik akan menyebabkan kerancuan pada identifikasi penyebab penyakit.
Tujuan Penelitian
3
Manfaat Penelitian
Budi Daya Kacang Panjang (Vigna sinensis L.)
Kacang panjang termasuk dalarn divisi Spermatophyta, kelas Angiospermae, subkelas Dicotyledonae, ordo Rosales, famili Leguminosae, genus Vigna, spesies Vigna sinensis L. (Susila 2005).
Budi daya kacang panjang dapat dilakukan di dataran rendah maupun dataran tinggi dengan ketinggian antara 0-1500 m di atas permukaan laut (dpl). Namun demikian tanaman ini tumbuh lebih baik pada ketinggian kurang dari 600 m dpl. Oleh sebab itu, kacang panjang banyak diusahakan di dataran rendah dan digolongkan dalam sayuran dataran rendah. Sebelum dilakukan penanaman benih kacang panjang perlu dilakukan pengolahan tanah terlebih dahulu seperti penggemburan, pembuatan bedengan, dan pengapuran. Tanaman kacang panjang membutuhkan tanah yang gembur yaitu tanah yang kaya akan bahan organik atau ditambah pupuk kandang pada saat pengolahan tanah agar tumbuh dengan baik, Pemeliharaan yang umum dilakukan pada pertanaman kacang panjang adalah penyulaman, penyiangan, penyiraman, pemangkasan cabang, dan pemupukan. Tanaman kacang panjang mulai berbunga pada umur 30 hari setelah tanam dan pemanenan polong kacang panjang dapat dilakukan setelah tanaman berumur 45 hari (Susila 2005).
Hama dan Penyakit Tanaman Kacang Panjang
Produksi rata- rata kacang panjang Indonesia pada tahun 1997 sampai tahun 2000 adalah 400.66 ton, sedangkan produksi rata-rata pada tahun 2001 sampai tahun 2004 mengalami penurunan menjadi 313.743 ton. Penurunan produksi kacang panjang disebabkan karena luasan panen mengalami penurunan sebanyak 12% (sekitar 70.000 ha), produktivitas tanaman yang rendah yakni 10,09 ton/ha, penggunaan benih dengan mutu yang kurang baik, dan gangguan hama penyakit tanaman (Statistik Indonesia 2011).
5
Bemisia tabaci (Hemiptera : Aleyrodidae), penggerek polong Riptortus linearis
(Hemiptera: Alydidae), kutudaun Aphis craccivora (Hemiptera : Aphididae) dan ulat penggerek polong Maruca restualis (Lepidoptera : Crambidae). Upaya yang banyak dilakukan untuk mengendalikan hama-hama tersebut adalah dengan melakukan pergiliran tanaman, melakukan pengendalian secara biologi dengan menggunakan musuh alaminya yaitu kumbang Scymnus sp dan laba-laba (Anwar et al. 2005).
Beberapa penyakit yang menyerang tanaman kacang panjang diantaranya layu cendawan (Fusarium sp.), antraknosa (Colletotricum lindemuthianum), puru akar (Meloidogyne sp), penyakit sapu (Cowpea Witches-broom Virus/Cowpea Stunt Virus), layu bakteri (Pseudomonas solanacearum) dan penyakit mosaik yang disebabkan oleh Bean common mosaic potyvirus (BCMV), Bean yellow mosaic potyvirus (BYMV) dan Cowpea aphid borne mosaic potyvirus (CABMV)
(Anwar et al. 2005). Penyakit mosaik kuning kacang panjang dilaporkan oleh Damayanti et al. (2009) disebabkan oleh Bean common mosaic potyvirus (BCMV) dan Cucumber mosaic cucumovirus (CMV).
Sifat-sifat Penting BCMV
Bean common mosaic potyvirus (BCMV) termasuk dalam famili Potyviridae dan genus Potyvirus (Agrios 1997). Potyvirus merupakan kelompok virus tumbuhan terbesar yang diketahui saat ini. Partikel virus ini berbentuk batang panjang lentur dengan kisaran panjang 720-770 nm dan lebarnya 11-12 nm. Tipe asam nukleatnya adalah RNA utas tunggal. Berat molekul asam nukleatnya yaitu 2,3-4,3 juta kDa. Kandungan asam nukleat dalam partikel virus sebesar 5% dan kandungan protein dalam mantelnya sebesar 95%. Nukleokapsid merupakan subunit protein yang membentuk mantel protein yang menyelubungi asam nukleat. Asam nukleat yang diselubungi oleh mantel protein menyebabkan virus bersifat virulen atau menimbulkan penyakit (Shukla et al. 1994).
ditularkan secara mekanik oleh sap tanaman. Virus ini juga ditularkan oleh beberapa jenis kutudaun termasuk A. craccivora secara non persisten (Shukla et al. 1994)
Tipe gejala penyakit yang disebabkan oleh BCMV tergantung dari strain BCMV, suhu dan genotip inang. Lebih dari 15 strain BCMV yang telah diketahui diantaranya Blackeye, US1, US5, NL2, NL3, NL4, NL5, NL6, NL7 dan NL8 (Morales & Bos 1988). Gejala BCMV ditunjukkan dengan mosaik berupa lepuhan, pola warna kuning dan hijau pada daun, tulang daun menguning, bercak dan malformasi. Tanaman yang terinfeksi dapat menjadi kerdil dan menghasilkan hanya sedikit polong dan masak lebih lambat dibandingkan dengan polong yang tidak terinfeksi (Shukla et al. 1994). Gejala pada tanaman umumnya muncul 7 sampai 10 hari setelah inokulasi (Djikstra & Dejeger 1998)
Metode Deteksi dan Karakterisasi Virus Tanaman
Pengamatan gejala penyakit saja tidak cukup untuk mendeteksi dan mengidentifikasi virus pada tanaman. Beberapa virus dapat menimbulkan gejala yang sama pada tanaman yang sama, satu virus dapat menghasilkan variasi gejala tergantung strain virusnya, campuran beberapa virus atau strain virus dapat mempengaruhi gejala. Selain itu, suatu virus dapat menimbulkan gejala yang berbeda pada tanaman yang berbeda. Kondisi lingkungan dan iklim juga berpengaruh terhadap tipe gejala yang muncul (Hull 2002).
7
Serologi
Uji serologi dengan memanfaatkan reaksi antigen dan antibodi mempunyai banyak kegunaan, diantaranya untuk mengidentifikasi virus penyebab penyakit tumbuhan, mengukur konsentrasi virus dalam jaringan tumbuhan, mendeteksi virus tumbuhan dalam tubuh serangga vektor dan untuk mengetahui hubungan kekerabatan antar virus (Agrios 1997). Deteksi dan identifikasi secara serologi sudah umum diaplikasikan untuk berbagai virus. Ada beberapa cara yang digunakan untuk deteksi serologi antara lain presipitasi dalam tabung, aglutinasi kloroplas, flokulasilateks, gel double-diffusion test, Dot immunobinding assay (DIBA), immunoblotting atau western blotting, dan Enzyme Linked Immunosorbent Assay (ELISA) (Harlow & Lane 1999).
Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara in vitro. Metode ini banyak digunakan untuk berbagai macam manipulasi dan analisis genetik, misalnya untuk melipatgandakan suatu molekul DNA. Dengan metode ini, segmen tertentu pada DNA dapat digandakan hingga jutaan kali lipat dalam waktu relatif singkat. Kelebihan lain metode PCR adalah bahwa reaksi ini dapat dilakukan dengan menggunakan komponen dalam jumlah sangat sedikit, misalnya DNA cetakan yang diperlukan hanya sekitar 5 μg, oligonukleotida yang diperlukan hanya sekitar 1 mM, dan reaksi ini biasa dilakukan dalam volume 50- 100 μl (Yuwono 2006). Menurut Muladno (2010), PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan cara
mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target tersebut melalui bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler. Panjang target DNA berkisar antara puluhan sampai ribuan
Reaksi pelipatgandaan suatu fragmen DNA dengan cara PCR terdiri dari tiga tahapan atau tiga reaksi, yaitu denaturasi, penempelan primer (annealing), dan pemanjangan primer (extension).
Denaturasi. Tahapan pertama dimulai dengan melakukan denaturasi DNA cetakan sehinggga rantai DNA yang berantai ganda (double stranded) akan terpisah menjadi rantai tunggal (single stranded). Denaturasi DNA dilakukan dengan menggunakan panas (95ºC) selama 1-4 menit (Yuwono 2006). Denaturasi yang tidak lengkap mengakibatkan DNA mengalami renaturasi (membentuk DNA untai ganda kembali) secara cepat, dan ini mengakibatkan gagalnya proses PCR. Adapun waktu denaturasi yang terlalu lama, mungkin dapat mengurangi aktivitas enzim Taq polymerase (Muladno 2010).
Penempelan Primer (Annealing). Tahap kedua yaitu penempelan primer (annealing) pada DNA cetakan yang telah terpisah menjadi rantai tunggal yang dilakukan pada suhu 55ºC selama 1 menit. Primer akan membentuk jembatan hidrogen dengan cetakan pada daerah sekuen yang komplementer dengan sekuen primer (Yuwono 2006). Pada tahapan ini, primer forward yang runutan nukleotidanya berkomplemen dengan salah satu untai tunggal akan menempel pada posisi komplemennya. Demikian juga primer reverse akan menempel pada untai tunggal lainnya (Muladno 2010).
Pemanjangan Primer (Extension). Setelah kedua primer menempel pada posisinya masing-masing, enzim Taq polymerase mulai mensintesis molekul DNA baru yang dimulai dari ujung 3’ masing-masing primer (Muladno 2010). Sintesis DNA ini terjadi pada suhu 72ºC selama 1-2 menit. Pada suhu ini, DNA polymerase akan melakukan proses polimerasi rantai DNA yang baru berdasarkan
informasi yang ada pada DNA cetakan dengan bantuan enzim Taq DNA polymerase (Yuwono 2006).