I. Latar Belakang
Bahagian ini memperkenalkan tesis dengan menjelaskan konteks kajian iaitu Pliek U, makanan tradisional Aceh yang dihasilkan melalui proses fermentasi spontan. Kajian ini relevan dengan matapelajaran mikrobiologi makanan, bioteknologi makanan dan sains makanan. Pelajar akan memahami proses fermentasi makanan tradisional, potensi antimikroba dalam makanan, dan aplikasi pengetahuan saintifik dalam industri makanan. Penggunaan Pliek U sebagai contoh kajian memberikan perspektif budaya dan ekonomi, merangsang pelajar untuk mengaplikasi ilmu pengetahuan dalam konteks tempatan. Ini juga membuka peluang untuk penyelidikan lanjut dalam aspek bioprospeksi dan pembangunan produk makanan bernilai tambah.
II. Perumusan Masalah
Bahagian ini mentakrifkan persoalan utama tesis, iaitu mengenal pasti jenis bakteria asid laktik (BAL) dalam Pliek U dan mengkaji potensinya sebagai agen antimikroba. Ini mengukuhkan kemahiran pelajar dalam rumusan hipotesis dan mengenal pasti jurang pengetahuan yang perlu dikaji. Dari aspek pedagogi, pelajar akan dilatih untuk merumuskan masalah secara tepat dan objektif, selaras dengan kaedah penyelidikan saintifik. Relevansi dengan matapelajaran penyelidikan saintifik dan metodologi penyelidikan terserlah di sini.
III. Tujuan Penelitian
Bahagian ini menyatakan objektif kajian yang merangkumi pengasingan dan pengenalan BAL daripada Pliek U, serta penilaian potensi antimikroba ekstrak terhadap beberapa mikroorganisma patogen. Pelajar akan memahami kepentingan objektif kajian yang jelas dan terukur. Dari segi pedagogi, ia mendemonstrasikan bagaimana tujuan kajian dibentuk untuk menjawab persoalan yang telah dirumuskan. Ini penting dalam membentuk kerangka penyelidikan yang sistematik dan logik, kemahiran yang amat diperlukan dalam penulisan tesis dan penyelidikan saintifik amnya.
IV. Hipotesis
Bahagian ini mengemukakan hipotesis kajian iaitu BAL yang diasingkan daripada Pliek U berpotensi untuk menghalang pertumbuhan mikroorganisma patogen. Bahagian ini amat penting dalam penyelidikan kerana ia menyediakan jangkaan hasil kajian. Ia juga melatih pelajar untuk membentuk hipotesis berdasarkan kajian literatur dan pengetahuan sedia ada. Aspek pedagogi ini menonjolkan kepentingan proses penaakulan saintifik dalam pembangunan hipotesis yang boleh diuji.
V. Manfaat Penelitian
Bahagian ini menjelaskan kepentingan kajian, khususnya dalam konteks aplikasi dalam industri makanan dan kesihatan. Ini merangkumi potensi pembangunan probiotik dan makanan berfungsi berasaskan BAL daripada Pliek U. Dari sudut pedagogi, ia menekankan impak penyelidikan dan faedahnya kepada masyarakat dan negara. Ia juga menanamkan nilai aplikasi ilmu pengetahuan dalam menyelesaikan masalah kehidupan sebenar.
VI. Tinjauan Pustaka
Bahagian ini mengulas literatur berkaitan proses fermentasi Pliek U, mekanisme antimikroba BAL dan peranan BAL dalam menghalang pertumbuhan mikroorganisma patogen. Ini menyediakan asas teori bagi kajian dan menunjukkan proses sintesis maklumat sedia ada. Pelajar dapat memahami kepentingan kajian literatur dalam menjustifikasikan kajian dan membentuk kerangka teori bagi penyelidikan mereka. Ini penting dalam memperkukuhkan asas ilmu pengetahuan dalam bidang berkaitan.
VII. Metodologi Penelitian
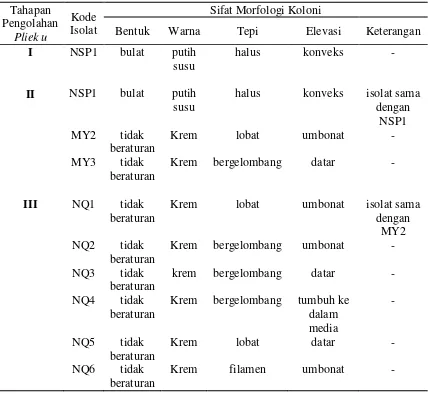
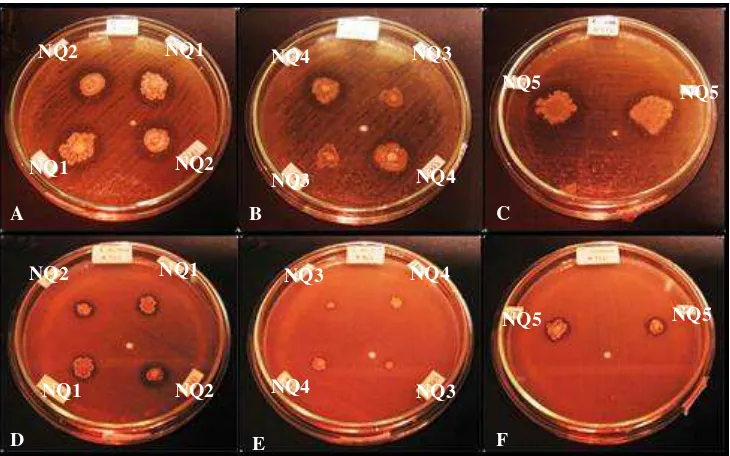
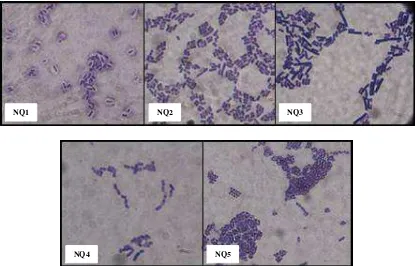
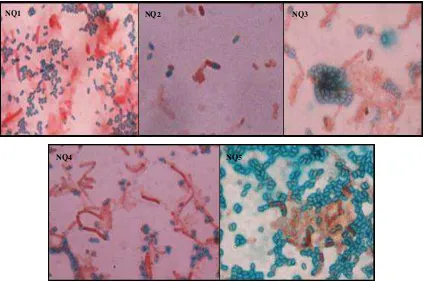
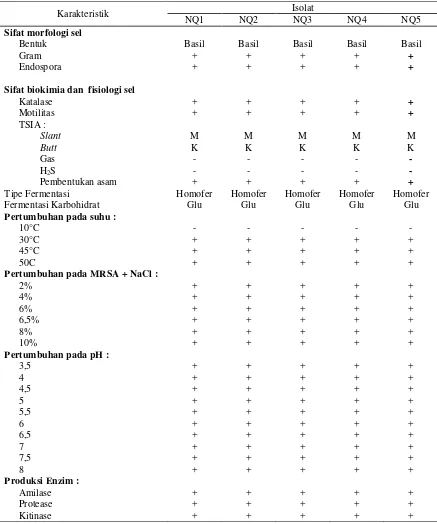
Bahagian ini menerangkan kaedah yang digunakan dalam kajian, termasuk proses pengasingan, pengenalan dan ujian antimikroba. Ini menunjukkan ketepatan dan ketelitian dalam metodologi penyelidikan. Aspek pedagogi adalah pendedahan pelajar kepada pelbagai teknik makmal dan kaedah analisis data yang digunakan dalam mikrobiologi dan kajian berkaitan. Pelajar juga mempelajari tentang reka bentuk eksperimen yang mantap.
VIII. Hasil dan Pembahasan
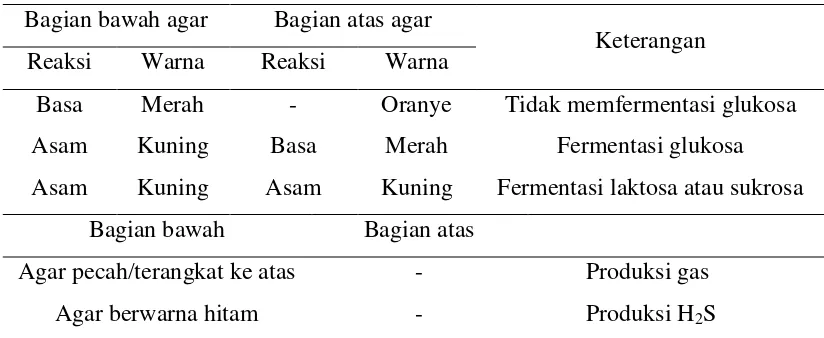
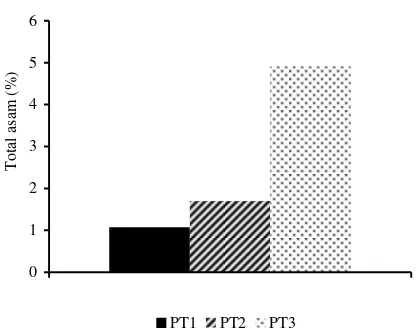
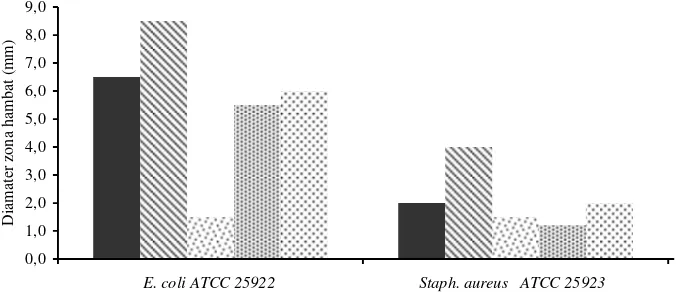
Bahagian ini membentangkan dapatan kajian dan analisis terperinci, meliputi karakterisasi BAL, daya penghambatan terhadap patogen, dan interpretasi keputusan. Ia melatih pelajar untuk menganalisis data dan mentafsir keputusan secara kritis. Dari aspek pedagogi, ia menekankan kemahiran komunikasi saintifik melalui penyampaian data secara jelas dan logik. Ia juga menekankan kepentingan analisis data yang teliti dalam mencapai kesimpulan yang tepat.
IX. Kesimpulan dan Saran
Bahagian ini merumuskan dapatan kajian dan mengemukakan cadangan untuk kajian lanjut. Ia merangkum keseluruhan tesis dan memberi perspektif masa depan. Dari segi pedagogi, ia melatih pelajar untuk merumuskan kesimpulan secara ringkas dan tepat, berdasarkan analisis data. Ia juga memberi peluang untuk pelajar mencadangkan penambahbaikan dan penyelidikan lanjut.
X. Daftar Pustaka
Senarai rujukan yang digunakan dalam tesis, menunjukkan ketepatan dan integriti akademik. Ini penting dalam memastikan keaslian dan kredibiliti kajian.