SITOTOKSISITAS EKSTRAK LERAK (Sapindus rarak DC)
TERHADAP SEL FIBROBLAS SEBAGAI
BAHAN IRIGASI SALURAN AKAR
SECARA IN VITRO
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi
syarat guna memperoleh gelar Sarjana Kedokteran Gigi
Oleh :
SITI NURSANI SIREGAR NIM : 070600022
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
Fakultas Kedokteran Gigi
Departemen Konservasi Gigi
Tahun 2011
Siti Nursani Siregar
Sitotoksisitas Ekstrak Lerak (Sapindus rarak DC) Terhadap Sel Fibroblas
Sebagai Bahan Irigasi Saluran Akar Secara In Vitro
xiv + 62 halaman
Tindakan irigasi sebagai chemomechanical cleansing dilakukan selama dan
sesudah pembersihan dan pembentukan saluran akar. NaOCl 5% sebagai bahan
irigasi saluran akar yang dianggap paling baik digunakan ternyatamemiliki beberapa
kelemahan. Diantaranya bersifat toksik. Berdasarkan keputusan JAKSTRA
2000-2004 tentang penggunaan tanaman tradisional dipilih buah lerak (Sapindus rarak
DC). Untuk mengembangkan ekstrak lerak sebagai alternatif bahan irigasi saluran
akar yang lebih baik dan memenuhi syarat sebagai bahan irigasi, maka diperlukan
pengujian sitotoksisitas sebagai langkah awal dalam penggunaan bahan alami yang
biokompatibel.
Ekstrak lerak dengan konsentrasi 40%, 20%, 10%, 5%, 2,5%, 1,25%, 0,62%
dan 0,31% (8 sampel) dilarutkan dengan media RPMI 1640 untuk dilakukan uji
sitotoksisitas menggunakan metode MTT assay pada kultur cell lines fibroblas
(BHK-21). Kelompok uji dibagi atas kelompok perlakuan masing-masing konsentrasi
ekstrak lerak 9 sampel. Kontrol sel sebagai kontrol positif 6 sampel dan kontrol
konsentrasi 3 sampel. Absorbansi dari perubahan garam MTT (kuning) menjadi biru
formazan oleh enzim reduktase dengan menggunakan ELISA reader pada panjang
gelombang 620 nm menunjukkan jumlah sel yang hidup.
Hasil uji ANOVA menunjukkan ekstrak lerak pada pengamatan 24 jam
memberikan pengaruh yang bermakna terhadap kehidupan sel fibroblas (BHK-21)
(p<0,05). Dengan hasil uji masing-masing konsentrasi 40% (88,12% + 0,0306477),
20%(67,16% + 0,1792200), 10% (60,19% + 0,0265674), 5% (67,51% + 0,0160682),
2,5% (59,83% + 0,0466951), 1,25% (52,15% + 0,0530334), 0,62% (51,08% +
0,0518714) dan 0,31% (56,10% + 0,0817768). Hasil uji LSD ekstrak lerak pada
pengamatan 24 jam menunjukkan adanya perbedaan yang signifikan antara semua
kelompok perlakuan, kelompok kontrol sel dan kelompok kontrol media terhadap
kehidupan sel fibroblas (BHK-21) (p<0,05) tetapi tidak pada kelompok perlakuan
dengan konsentrasi 1,25%, 0,62%, 0,31%. Dari hasil penelitian diperoleh nilai LC50
ekstrak lerak yaitu pada konsentrasi 1,25% dengan rerata kehidupan sel (52,15% +
0,0530334). Artinya ekstrak lerak memiliki batas konsentrasi yang biokompatibel dan
dapat digunakan sebagai alternatif bahan irigasi saluran akar.
SITOTOKSISITAS EKSTRAK LERAK (Sapindus rarak DC)
TERHADAP SEL FIBROBLAS SEBAGAI
BAHAN IRIGASI SALURAN AKAR
SECARA IN VITRO
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi
syarat guna memperoleh gelar Sarjana Kedokteran Gigi
Oleh :
SITI NURSANI SIREGAR NIM : 070600022
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
LEMBAR PENGESAHAN
SKRIPSI INI TELAH DISETUJUI UNTUK DISEMINARKAN PADA TANGGAL 30 JUNI 2011
OLEH : Pembimbing
Nevi Yanti, drg., M.Kes NIP : 19631127 199203 2 004
Mengetahui
Ketua Departemen Ilmu konservasi Gigi Fakultas Kedokteran Gigi
Universitas Sumatera Utara
PERNYATAAN PERSETUJUAN
Skripsi berjudul
SITOTOKSISITAS EKSTRAK LERAK (Sapindus rarak DC) TERHADAP SEL FIBROBLAS SEBAGAI BAHAN IRIGASI SALURAN AKAR
SECARA IN VITRO
Yang dipersiapkan dan disusun oleh :
SITI NURSANI SIREGAR NIM : 070600022
Telah dipertahankan didepan tim penguji pada tanggal 30 Juni 2011
dan dinyatakan telah memenuhi syarat untuk diterima
Susunan Tim Penguji Skripsi
Ketua Penguji
Nevi Yanti, drg., M.Kes NIP : 19631127 199203 2 004
Anggota tim penguji lain
Prof. Dr. Rasinta Tarigan, drg., Sp.KG(K) Cut Nurliza, drg., M.Kes
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang Maha Pengasih lagi Maha
Penyayang atas segala rahmat dan karunia-Nya sehingga skripsi ini dapat
diselesaikan sebagai salah satu syarat untuk mendapatkan gelar Sarjana Kedokteran
Gigi di Fakultas kedokteran Gigi Universitas Sumatera Utara. Shalawat beriring
salam kepada Nabi Muhammad SAW yang telah membawa kita ke zaman yang
penuh dengan ilmu pengetahuan ini.
Skripsi ini didedikasikan untuk kedua orang tua, Bapak Muchlis Siregar dan
Ibu Masnilawati Simamora tercinta sebagai tanda hormat, rasa sayang dan terima
kasih yang tiada terhingga atas kasih sayang, perhatian, dukungan, semangat, dan
doanya selama ini. Juga untuk Bang Dedi, Bang Dedek, Bang Baim, Kak Eni, Kak
Dewi, Cinta, Dhuha dan seluruh keluarga Oppung Parlindungan dan Oppung Jamiul.
Dalam penulisan skripsi ini, banyak mendapat bimbingan dan bantuan dari
berbagai pihak. Untuk itu, dengan segala kerendahan hati dan penghargaan yang
tulus, disampaikan rasa terima kasih kepada:
1. Prof. H. Nazruddin, drg., C. Ort., Sp.Ort., Ph.D selaku Dekan Fakultas
Kedokteran Gigi Universitas Sumatera Utara.
2. Cut Nurliza, drg., M.Kes, selaku Ketua Departemen Ilmu Konservasi
Gigi, Fakultas Kedokteran Gigi, Universitas Sumatera Utara, yang telah membantu
3. Nevi Yanti, drg., M.Kes selaku dosen pembimbing yang telah meluangkan
waktu, tenaga, dan pikiran serta dengan sabar memberikan bimbingan, arahan,
motivasi, nasihat, dan semangat selama penulisan skripsi ini.
4. Seluruh staf pengajar Departemen Ilmu Konservasi Gigi, Fakultas
Kedokteran Gigi, Universitas Sumatera Utara, yang telah memberikan saran dan
masukan dalam penyelesaian skripsi ini.
5. Sayuti Hasibuan, drg, Sp. PM, selaku dosen pembimbing akademik di
Fakultas Kedokteran Gigi, Universitas Sumatera Utara.
6. Seluruh staf pengajar di Fakultas Kedokteran Gigi, Universitas Sumatera
Utara, yang telah mendidik, membimbing dan membantu selama menuntut ilmu di
masa pendidikan.
7. Wahyu Hidayatiningsih, S.Si., M.Kes yang membantu peneliti di
Laboratorium Pusat Veterinaria Farma Surabaya yang telah meluangkan waktunya,
membimbing, dan membantu pelaksanaan penelitian ini.
8. Drs. Awaluddin Saragih, M.Si., Apt selaku Kepala Laboratorium Obat
Tradisional Fakultas Farmasi USU yang telah banyak membagi ilmunya, memberi
semangat dan masukan, serta telah meluangkan waktunya untuk berdiskusi.
9. Prof. Trimurni Abidin, drg., M.Kes., Sp.KG(K) yang telah memberikan
masukan, serta telah meluangkan waktunya untuk berdiskusi.
10. Drs. Abdul Jalil Amri Arma, M. Kes, yang telah membantu dan
meluangkan waktunya untuk berdiskusi tentang analisis data dalam penelitian ini.
11. Ilham Syahputra yang telah memberikan dukungan, semangat dan
12. Sahabatku, yaitu: Ina, Maya, Mey, Riri, Suci, Ika, teman-teman
seperjuangan skripsi Nunu, Rena, Idel, Yuli, Mitha, serta semua teman-teman
angkatan 2007 yang tidak dapat disebutkan namanya satu per satu atas dukungan
semangat dan bantuannya selama penelitian dan penulisan skripsi ini.
13. Senior-senior, yaitu: Kak Tari, Kak Tiwi, Kak Ica, Kak Ratih, Kak Mila,
KakOza, Kak Ulfa yang telah memberikan bantuan, masukan, dan semangat.
Skripsi ini masih belum sempurna disebabkan oleh kelemahan dan
keterbatasan ilmu yang dimiliki, tetapi diharapkan skripsi ini dapat memberikan
sumbangan pikiran yang berguna bagi fakultas, pengembangan ilmu, dan masyarakat.
Medan, 30 Juni 2011 Penulis,
DAFTAR ISI
Halaman
HALAMAN JUDUL ...
HALAMAN PERSETUJUAN... ...
HALAMAN TIM PENGUJI SKRIPSI... ...
KATA PENGANTAR ...
BAB 2 TINJAUAN PUSTAKA 2.1 Tindakan Irigasi Saluran Akar... ... 5
2.2 Buah Lerak (Sapindus rarak DC) …………. ... 9
2.3 Sitotoksisitas………. ... 12
2.4 Sel Fibroblas………. ... 14
BAB 3 KERANGKA KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Konsep ... 17
3.2 Hipotesis Penelitian ... 19
4.7 Prosedur Penelitian ... 28
4.8 Analisis Data……….. ... 37
BAB 5 HASIL PENELITIAN DAN ANALISIS HASIL PENELITIAN 5.1 Hasil Penelitian ... 38
5.1.1 Ekstrak Kental Lerak (Sapindus rarak DC) ... 38
5.1.2 Pengujian Sitotoksisitas Ekstrak Lerak ………. ... 38
5.2 Analisis Hasil Penelitian... ... 42
BAB 6 PEMBAHASAN ... 45
BAB 7 KESIMPULAN DAN SARAN 7.1 Kesimpulan... 53
7.2 Saran ... 53
DAFTAR PUSTAKA ... 55
DAFTAR TABEL
Tabel Halaman
1. Nilai OD(Optical density) formazan kelompok uji ……… 36
2. Hasil uji ANOVA efek sitotoksik ekstrak lerak
terhadap kehidupan sel fibroblas (BHK-21) ... 42
3. Hasil uji LSD efek sitotoksik ekstrak lerak
DAFTAR GAMBAR
Gambar Halaman
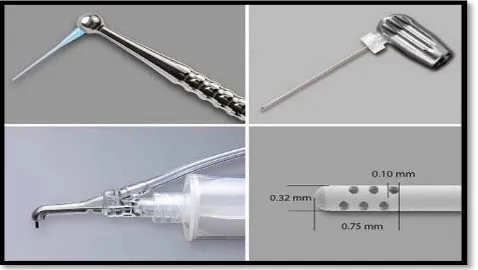
1. Spuit endodonti ... 7
2. Jarum irigasi bengkok dimasukkan sebagian ke dalam saluran akar tanpa terjepit. Larutan irigasi merembes keluar dan diabsorpsi dengan kain kasa steril, untuk memonitor pengambilan debris dari saluran akar ... 8
3. EndoVac sistem menggunakan np ... 8
4. Tanda panah di atas menunjukkan pohon lerak yang terdapat di Desa Ujung Pasir, Kec.Danau Kerinci, Jambi... ... 9
5. Buah lerak yang dikeluarkan bijinya ... 10
6. Buah lerak yang berasal dari Desa Muara Imat, Kab.Kerinci, Jambi ... 10
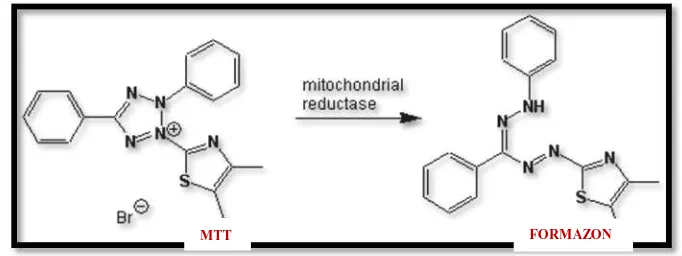
7. Reaksi Reduksi MTT menjadi Formazan ... 13
8. Gambaran sel fibroblas secara mikroskopis ... 14
9. Gambaran sel fibroblas secara anatomis ... 15
10. 96-well tissue culture plate ... 27
11. Microscope inverted ... 27
12. Laminar flow hood ... 27
13. Inkubator ... 27
14. Micropipette ... 27
15. Multi channel pipette ... 27
17. Penimbangan buah lerak ... 29
26. Kultur cell lines BHK-21 dalam media RPMI-1640 ... 33
27. 27.a. Sel fibroblas didistribusikan kedalam 96- well microplate ... 33
27.b. Sel fibroblas dalam 96- well microplate ... 33
28. Kontrol sel fibroblas diperiksa dengan microscope inverted ... 33
29. Siapkan bahan uji ... 33
30. Bahan uji dimasukkan ke dalam sumuran 25 μl/konsentrasi ... 34
31. Inkubasi selama 24 jam ... 34
32. MTT dilarutkan dalam PBS 5 mg/ml dan ditambahkan langsung pada plate yang berisi sel fibroblas sebanyak 10 μl dan diinkubasi selama 4 jam ... 34
33. Hasil uji diperiksa dengan microscope inverted untuk melihat terbentuknya Formazan ... 34
34. Seluruh media dan bahan uji dalam sumuran diambil dan ditambah DMSO 50 µl ... 34
36. 36a. Plate dimasukkan kedalam alat ELISA reader ... 35
36b. Formazan dibaca absorbansinya pada panjang gelombang 620 nm ... 35
37. Ekstrak kental lerak ... 37
38. Kontrol sel 24 jam (pembesaran 40x) ... 38
39. a. Kristal formazan, b. Sel fibroblas yang hidup, c. Sel fibroblas yang mati (Pembesaran100x) ... 39
40. Grafik rerata persentase kehidupan sel fibroblas (BHK-21) setelah kontak selama 24 jam ... 41
DAFTAR LAMPIRAN
Lampiran
1. Alur penyiapan bahan coba
2. Alur pengujian sitotoksisitas
3. Alur pikir
4. Hasil uji sitotoksisitas ekstrak lerak terhadap sel fibroblas
5. Hasil uji statistik (ANOVA dan LSD) sitotoksisitas ekstrak lerak terhadap sel
Fakultas Kedokteran Gigi
Departemen Konservasi Gigi
Tahun 2011
Siti Nursani Siregar
Sitotoksisitas Ekstrak Lerak (Sapindus rarak DC) Terhadap Sel Fibroblas
Sebagai Bahan Irigasi Saluran Akar Secara In Vitro
xiv + 62 halaman
Tindakan irigasi sebagai chemomechanical cleansing dilakukan selama dan
sesudah pembersihan dan pembentukan saluran akar. NaOCl 5% sebagai bahan
irigasi saluran akar yang dianggap paling baik digunakan ternyatamemiliki beberapa
kelemahan. Diantaranya bersifat toksik. Berdasarkan keputusan JAKSTRA
2000-2004 tentang penggunaan tanaman tradisional dipilih buah lerak (Sapindus rarak
DC). Untuk mengembangkan ekstrak lerak sebagai alternatif bahan irigasi saluran
akar yang lebih baik dan memenuhi syarat sebagai bahan irigasi, maka diperlukan
pengujian sitotoksisitas sebagai langkah awal dalam penggunaan bahan alami yang
biokompatibel.
Ekstrak lerak dengan konsentrasi 40%, 20%, 10%, 5%, 2,5%, 1,25%, 0,62%
dan 0,31% (8 sampel) dilarutkan dengan media RPMI 1640 untuk dilakukan uji
sitotoksisitas menggunakan metode MTT assay pada kultur cell lines fibroblas
(BHK-21). Kelompok uji dibagi atas kelompok perlakuan masing-masing konsentrasi
ekstrak lerak 9 sampel. Kontrol sel sebagai kontrol positif 6 sampel dan kontrol
konsentrasi 3 sampel. Absorbansi dari perubahan garam MTT (kuning) menjadi biru
formazan oleh enzim reduktase dengan menggunakan ELISA reader pada panjang
gelombang 620 nm menunjukkan jumlah sel yang hidup.
Hasil uji ANOVA menunjukkan ekstrak lerak pada pengamatan 24 jam
memberikan pengaruh yang bermakna terhadap kehidupan sel fibroblas (BHK-21)
(p<0,05). Dengan hasil uji masing-masing konsentrasi 40% (88,12% + 0,0306477),
20%(67,16% + 0,1792200), 10% (60,19% + 0,0265674), 5% (67,51% + 0,0160682),
2,5% (59,83% + 0,0466951), 1,25% (52,15% + 0,0530334), 0,62% (51,08% +
0,0518714) dan 0,31% (56,10% + 0,0817768). Hasil uji LSD ekstrak lerak pada
pengamatan 24 jam menunjukkan adanya perbedaan yang signifikan antara semua
kelompok perlakuan, kelompok kontrol sel dan kelompok kontrol media terhadap
kehidupan sel fibroblas (BHK-21) (p<0,05) tetapi tidak pada kelompok perlakuan
dengan konsentrasi 1,25%, 0,62%, 0,31%. Dari hasil penelitian diperoleh nilai LC50
ekstrak lerak yaitu pada konsentrasi 1,25% dengan rerata kehidupan sel (52,15% +
0,0530334). Artinya ekstrak lerak memiliki batas konsentrasi yang biokompatibel dan
dapat digunakan sebagai alternatif bahan irigasi saluran akar.
BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Tindakan irigasi dilakukan selama dan sesudah pembersihan dan pembentukan
saluran akar, dengan tujuan untuk menghilangkan kotoran fragmen jaringan pulpa
dan serpihan dentin yang menumpuk. Kotoran ini menyebabkan celah apikal pada
saluran akar yang diisi dengan gutaperca, menjadi tempat persembunyian bakteri dan
mengurangi perlekatan bahan pengisi dengan dinding saluran akar. Pada perawatan
saluran akar, larutan irigasi selain mengisi seluruh saluran juga dapat mengalir ke
jaringan periapikal yang dapat menimbulkan iritasi. Oleh sebab itu tindakan irigasi
yang diabaikan menyebabkan kegagalan perawatan endodontik.1
Bahan irigasi yang dianggap paling efektif dan populer saat ini adalah larutan
Natrium Hipoklorit (NaOCl) 5%.2-4 Larutan ini tidak mahal, mudah diperoleh dan
mudah untuk digunakan.2 Larutan NaOCl 5% mampu melarutkan jaringan serta
membersihkan saluran akar dan memiliki efek antibakteri yang paling baik.3,4
Namun, kekurangannya adalah bersifat toksik.2,3 Larutan ini mampu merusak dan
menekan jaringan periapikal, bersifat korosif, menyebabkan reaksi alergi, bau dan
rasa yang tidak enaksehingga dalam penggunaannya harus berhati-hati. Hal ini tentu
tidak sesuai dengan syarat-syarat bahan irigasi yang digunakan di klinik. Yaitu
bersifat antibakteri, sebagai pelarut debris dan pelarut jaringan, tidak toksik, tegangan
Mengingat kelemahan bahan sintetik ini, maka diperlukan bahan alami yang
dapat dikembangkan sebagai bahan alternatif irigasi saluran akar yang memiliki
khasiat lebih baik, toksisitasnya lebih rendah, lebih biokompatibel, harga murah, dan
mudah didapat. Hal ini sesuai dengan fokus area kegiatan penelitian, pengembangan
dan rekayasa untuk pembangunan nasional (JAKSTRA 2000-2004) antara lain
menyangkut penggunaan tanaman tradisional.5 Salah satu tanaman tradisional yang
dapat digunakan adalah buah lerak (Sapindus rarak DC).
Kandungan utama dari buah lerak adalah saponin.6-8 Saponin memiliki efek
antibakteri terhadap S.pyogenus pada Minimum Inhibitory Concentration (MIC) 0,75
mg/ml, dan >50 mg/ml untuk S.aureus,7 ekstrak lerak 0,01 % terhadap Streptococcus
mutans,9 terhadap Fusobacterium nucleatum ekstrak lerak mempunyai efek
antibakteri dengan nilai kadar hambat minimal (KHM) 0,25 %,10 terhadap
Enterococcus faecalis ekstrak lerak mempunyai efek dengan nilai MBC 25% 11 serta
memiliki efek antifungal terhadap Candida albicans lebih baik daripada NaOCl 5
%.12 Sedangkan pada penelitian lain terdapat ± 10 gram (17,5 %) saponin dari 175
gram daging buah lerak, yang pada konsentrasi 0,008 % dapat membersihkan dinding
saluran akar lebih baik dari NaOCl 5 % yang umum digunakan di praktek.13 Saponin
bersifat emulgator (detergen) yang dapat melarutkan smear layer organik dan
anorganik,dan bisa menurunkan tegangan permukaan sehingga permeabilitas dentin
meningkat yang dapat mempermudah penetrasi bahan adhesif.7
Untuk mengembangkan bahan irigasi saluran akar maka harus diuji terlebih
dahulu dengan uji biokompatibilitas sesuai dengan syarat material di bidang
suatu bahan tersebut biokompatibel dilakukan dengan cara uji sitotoksisitas. Uji
sitotoksisitas adalah bagian dari evaluasi bahan kedokteran gigi dan diperlukan untuk
prosedur screening standar.15 Metode Brine shrimp yang pernah dilakukan
mendapatkan konsentrasi ekstrak lerak 0,01% memiliki efek antibakteri terhadap
Streptococcus mutans lebih baik dari NaOCl 5%.9
Pada waktu irigasi saluran akar, bahan irigasi dapat berdifusi dan menekan ke
jaringan periapikal dan ligamen periodontal serta dapat menyebabkan iritasi seperti
yang disebabkan oleh larutan NaOCl.1 Sementara komponen jaringan ini yang
terpenting adalah sel fibroblas dimana sel fibroblas adalah tipe sel yang paling umum
terlihat dalam jumlah yang besar di pulpa mahkota serta merupakan substansi dasar
penyusun jaringan periapikal dan ligamen periodontal.2,3,16 Sehingga, walaupun sudah
ada penelitian untuk mengetahui efek antibakteri dan antifungal dari lerak (Sapindus
rarak DC) namun sampai saat ini belum pernah dilakukan penelitian untuk
mengetahui sitotoksisitas ekstrak lerak terhadap sel fibroblas dalam usaha
pengembangannya sebagai bahan alternatif irigasi saluran akar.
Salah satu metode untuk menilai sitotoksisitas suatu bahan adalah dengan uji
enzimatik menggunakan pereaksi MTT (MTT assays).17 Dasar uji ini adalah
mengukur kemampuan sel hidup berdasarkan aktivitas mitokondria dari kultur
sel.15,18 Dalam penelitian ini digunakan sampel penelitian berupa sel fibroblas (kultur
cell lines BHK-21). Bahan uji berupa ekstrak lerak yang berasal dari buah lerak
secara keseluruhan dan dicoba dari konsentrasi 40%, 20%, 10%, 5%, 2,5%, 1,25%,
0,62%, hingga 0,31% (8 sampel) dan diamati dalam waktu kontak 24 jam sesuai
berupa nilai LC50 (Lethal Concentration), nilai ini menunjukkan konsentrasi yang
menghasilkan hambatan proliferasi sel 50% dan menunjukkan potensi toksisitas suatu
senyawa terhadap sel. 13
1.2 Rumusan Masalah
Berdasarkan uraian dalam latar belakang masalah di atas, dapat dirumuskan
rumusan masalah penelitian sebagai berikut:
Apakah ada efek sitotoksik ekstrak lerak (Sapindus rarak DC) dilihat dari nilai
LC50 terhadap sel fibroblas sebagai bahan irigasi saluran akar secara in vitro?
1.3 Tujuan Penelitian
Untuk mengetahui efek sitotoksitas ekstrak lerak (Sapindus rarak DC) dilihat
dari nilai LC50 terhadap sel fibroblas sebagai bahan irigasi saluran akar secara in vitro.
1.4 Manfaat Penelitian
1. Sebagai dasar penelitian lebih lanjut dalam pemanfaatan ekstrak lerak
(Sapindus rarak DC) sebagai alternatif bahan irigasi saluran akar.
2. Meningkatkan pemanfaatan bahan alami yang bersifat biokompatibel sebagai
material kedokteran gigi serta meningkatkan pelayanan kesehatan gigi masyarakat
dengan bahan alami yang mudah didapat dengan harga terjangkau.
3. Sebagai informasi bagi dokter gigi tentang sitotoksisitas lerak (Sapindus rarak
BAB 2
TINJAUAN PUSTAKA
Tindakan irigasi dilakukan selama dan sesudah pembersihan dan pembentukan
saluran akar, dengan tujuan untuk menghilangkan kotoran fragmen jaringan pulpa dan
serpihan dentin yang menumpuk.19 Ekstrak lerak diharapkan dapat dikembangkan
menjadi bahan irigasi saluran akar yang dapat membunuh mikroba, tidak toksik dan
bersifat biokompatibel terhadap jaringan.
2.1 Tindakan Irigasi Saluran Akar
Perawatan endodontik dapat dibagi dalam tiga fase (triad endodontics) yaitu :
preparasi biomekanis saluran akar (pembersihan dan pembentukan/pemberian
bentuk), disinfeksi dan obturasi. Langkah pertama untuk pembersihan dan
pembentukan saluran akar adalah jalan masuk yang benar ke kamar yang
menghasilkan penetrasi garis-lurus ke orifis saluran akar. Langkah selanjutnya adalah
eksplorasi saluran akar, ekstirpasi jaringan pulpa yang masih tertinggal dan
debridemen jaringan nekrotik dan verifikasi/ pembuktian kedalaman instrumen.
Langkah ini diikuti oleh instrumentasi, irigasi dan debridemen yang benar, serta
disinfeksi (sanitization) saluran akar. Obturasi biasanya melengkapi prosedur.19
Irigasi adalah pengambilan fragmen kecil-kecil debris organik dan serpihan
dentin dari saluran akar. Tindakan irigasi adalah salah satu kunci keberhasilan dalam
perawatan endodontik.20 Sebab jika diabaikan dapat menyebabkan kegagalan
tempat persembunyian bakteri, mengurangi perlekatan bahan pengisi saluran akar dan
meningkatkan celah apikal.19,20
Fungsi utama bahan irigasi adalah membuang debris dari saluran akar, bahan
irigasi bisa pula memiliki sifat lain yang dapat membantu pembersihan dan
pembentukan saluran akar. Adapun sifat bahan irigasi yang ideal adalah merupakan
pelarut debris atau pelarut jaringan, tidak toksis, memiliki tegangan permukaan
rendah, sebagai pelumas, mampu membuang smear layer serta bahan irigasi tidak
mudah dinetralkan dalam saluran akar agar efektivitasnya tetap terjaga.2
Bahan irigasi yang biasa dipakai adalah yang mempunyai sifat antiseptik
artinya suatu bahan yang dapat menghambat pertumbuhan mikroorganisme secara in
vitro dan in vivo pada jaringan hidup. Bahan irigasi yang populer digunakan adalah
natrium hipoklorit dan natrium hipoklorit kombinasi EDTA.2,3,19,20 Natrium
Hipoklorit (NaOCl) 5% tidak mahal, mudah diperoleh dan mudah untuk digunakan.2
NaOCl 5% mampu melarutkan jaringan serta membersihkan saluran akar dan
memiliki efek antibakteri yang paling baik.3,4 Namun, kekurangannya adalah bersifat
toksik.2,3 Bahan irigasi ini mampu merusak dan menekan jaringan periapikal, bersifat
korosif, menyebabkan reaksi alergi, bau dan rasa yang tidak enak sehingga dalam
penggunaannya harus berhati-hati.
Berbagai teknik irigasi yang digunakan juga telah berkembang. Teknik irigasi
yang digunakan secara sederhana adalah dengan menggunakan alat semprit disposible
12 ml berupa jarum berlubang dengan ujung buntu dan bertakik.19 Kemudian dengan
mencegah penetrasi ke dalam saluran akar yang berdiameter kecil agar debris pada
saluran akar dapat keluar.21
Gambar 1. Spuit endodonti 21
Gambar 1 menunjukkan suatu spuit endodonti berupa jarum berlubang dengan
ujung buntu serta penampang saluran akar gigi. Tanda panah di atas menunjukkan
lubang jarum yang merupakan tempat keluarnya bahan irigasi ke arah lateral sehingga
menyebabkan perforasi ke arah lateral dan jika mengenai jaringan periapikal maka
akan menyebabkan infeksi seperti yang disebabkan oleh NaOCl 5%. Jadi dengan
menggunakan alat ini tekanan harus diatur sedemikian rupa agar bahan irigasi dapat
keluar secara konstan.20
Gambaran jarum endodonti di dalam saluran akar (Gambar 2), menunjukkan
jarum harus dibengkokkan menjadi sudut tumpul untuk mencapai saluran akar gigi
depan dan belakang.1.20 Jarum dimasukkan sebagian ke dalam saluran dan harus ada
ruang yang cukup antara jarum dan dinding saluran yang memungkinkan pengaliran
Gambar 2. Jarum irigasi bengkok dimasukkan sebagian ke dalam saluran akar tanpa terjepit. Larutan irigasi merembes keluar dan diabsorpsi dengan kain kasa steril, untuk memonitor pengambilan
debris dari saluran akar 19
Dan teknik yang terbaru adalah dengan menggunakan teknik Ultrasound,
dengan prinsip kerja negative pressure.20 Artinya alat-alat yang digunakan pada
sistem ini harus memiliki pergerakan dan perputaran selama irigasi berlangsung tanpa
berkontak atau menyentuh dinding saluran akar (seperti roda berputar).20 Tujuan akhir
dari teknik irigasi yang akan digunakan adalah untuk mendapatkan saluran akar yang
bersih artinya bebas dari mikroorganisme.2,20
2.2 Buah Lerak (Sapindus rarak DC)
Menurut taksonominya, Sapindus rarak DC diklasifikasikan dalam:22
• Divisi : Spermatophyta
• Subdivisi : Angiospermae
• Kelas : Dycotyledonae
• Bangsa : Sapindales
• Suku : Sapindaceae
• Marga : Sapindus
• Spesies : Sapindus rarak
Nama umumnya adalah Lerak. Masyarakat Sunda menyebutnya dengan nama
Rerek, penduduk Jambi menyebutnya Kalikea, masyarakat Minang menyebutnya
Kanikia. Di Palembang tanaman ini dikenal dengan nama Lamuran, sedangkan di
Jawa dikenal dengan nama Lerak atau Werak dan Tapanuli Selatan dikenal dengan
nama buah sabun.22
Gambar 4. Tanda panah di atas menunjukkan pohon lerak yang terdapat di Desa Ujung Pasir,
Lerak (Sapindus rarak DC) merupakan tanaman rimba yang tingginya dapat
mencapai 42 m dan lebarnya 1 m. Tanaman ini mempunyai batang berwarna putih
kotor, berakar tunggang dan berwarna kuning kecoklatan. Daun tanaman ini majemuk
menyirip ganjil dan anak daun berbentuk lanset. Bunga tanaman ini melekat di
pangkal, kuning, dan daun mahkotanya empat. Tanaman ini mempunyai buah yang
keras, bulat, diameter + 1,5 cm dan berwarna kuning kecoklatan. Biji tanaman ini
tunggang dan kuning kecoklatan. Buah lerak terdiri dari 73% daging buah dan 27%
biji.7
Gambar 5. Buah lerak yang telah dikeluarkan Gambar 6. Buah lerak yang berasal dari Muara
Bijinya 23 Imat, Kab.Kerinci, Jambi 23
Buah lerak sering dipergunakan untuk mencerahkan warna yang diperoleh
dari soga alam/pewarna alam, mencuci kain batik, emas dan sebagai sabun wajah
untuk mengurangi jerawat.6 Lerak sangat baik untuk membasmi cacing tanah. Di
Jakarta buah ini sudah diolah menjadi insektisida. Secara tradisional, lerak juga
digunakan sebagai sabun wajah untuk mengurangi jerawat, obat eksim dan kudis.6,7
Sementara khasiat farmakologiknya antara lain adalah sebagai antijamur, bakterisid,
menunjukkan bahwa lerak mengandung senyawa saponin, alkaloid, steroid dan
triterpen masing-masing berurutan mengandung bahan aktif sebesar 12%, 1%,
0,036%, dan 0,029%.8
Ekstrak lerak memiliki kandungan berupa saponin dan flavonoid didapat dari
kulit buah, biji, kulit batang dan daun. Sedangkan alkaloid dan polifenol terdapat
pada kulit buahnya. Senyawa saponin dapat bekerja sebagai antimikroba sebagai
surfaktan atau deterjen yang diduga akan menyerang lapisan batas sel melalui ikatan
gugus polar dan non polar. Saponin yang merupakan kandungan utama dari buah
lerak juga dapat dikembangkan sebagai bahan baku untuk membuat sampo.23
Flavonoid diduga dapat merusak membran sel karena sifatnya yang lipofilik dan
kemampuannya membentuk kompleks dengan protein ekstraseluler. Senyawa fenol
menghambat enzim penting mikroorganisme, sedangkan alkaloid sudah digunakan
berabad-abad dalam bidang medis karena dapat melawan sel asing melalui ikatan
DNA sel sehingga mengganggu fungsi sel.10
Berbagai penelitian untuk mengembangkan lerak sebagai alternatif bahan
irigasi saluran akar telah dilakukan. Ekstrak lerak memiliki efek antibakteri terhadap
Streptococcus mutans dengan nilai MBC 0,01%,9 terhadap Fusobacterium nucleatum
ekstrak lerak mempunyai efek antibakteri dengan nilai kadar hambat minimal (KHM)
0,25 %,10 terhadap Enterococcus faecalis ekstrak lerak mempunyai efek antibakteri
dengan nilai MBC 25% 11 Saponin yang merupakan kandungan utama dari buah lerak
juga memiliki efek antibakteri terhadap S.pyogenus pada Minimum Inhibitory
Concentration (MIC) 0,75 mg/ml, dan >50 mg/ml untuk S.aureus.7 Sedangkan pada
yang pada konsentrasi 0,008 % dapat membersihkan dinding saluran akar lebih baik
dari NaOCl 5 % yang umum digunakan di praktek.13 Ekstrak lerak juga memiliki efek
antifungal terhadap Candida albicans lebih baik daripada NaOCl 5 %.12 Ekstrak lerak
selain memiliki efek anti bakteri dan antifungal juga memiliki efek anti analgetik dan
efek anti inflamasi. Untuk efek analgetik sebagai bahan pereda nyeri gigi yaitu pada
konsentrasi 2,5% dan 7,5%.25 Dan ekstrak lerak 0,01% memiliki efek anti inflamasi
dilihat dari penurunan sel radang dan perbaikan jaringan.26
2.3 Sitotoksisitas
Sitotoksisitas adalah sejauh mana agen memiliki tindakan destruktif spesifik
pada sel-sel tertentu.Uji sitotoksisitas merupakan salah satu tahap pengujian paling
awal dan penting dilakukan terhadap suatu bahan yang akan dipakai di bidang
kedokteran gigi.15 Karena uji sitotoksisitas ini bagian dari evaluasi bahan kedokteran
gigi dan diperlukan untuk prosedur screening standar (Tahap 1).15 Uji sitotoksisitas
dilakukan untuk mengetahui apakah bahan tersebut memenuhi syarat untuk dapat
diterima jaringan yaitu tidak membahayakan pulpa dan jaringan lunak, tidak
mengandung substansi yang bisa menyebabkan respon sistemik bila berdifusi dan
diadsorpsi ke dalam sistem sirkulasi, bebas dari agen sensitisasi yang dapat
menyebabkan respon alergi, tidak berpotensi karsinogenik.1 Dua metode umum yang
digunakan untuk uji sitotoksisitas adalah metode perhitungan langsung (direct
counting) dengan menggunakan biru tripan (trypan blue) dan metode MTT assay.1
Dalam penelitian ini digunakan uji MTT assay yang memiliki kelebihan yaitu
dan hasilnya bisa digunakan untuk memprediksi sifat sitotoksik suatu bahan.1 Dasar
uji enzimatik MTT adalah dengan mengukur kemampuan sel hidup berdasarkan
aktivitas mitokondria dari kultur sel.16 Metode ini dapat digunakan untuk mengukur
proliferasi sel secara kolorimetri.1
Metode ini berdasarkan pada perubahan garam tetrazolium [3-(4,5-dimet
iltiazol-2-yl)-2,5-difeniltetrazolium bromide] (MTT) menjadi formazan dalam
mitokondria yang aktif pada sel hidup. MTT diabsorbsi ke dalam sel hidup dan
dipecah melalui reaksi reduksi oleh enzim reduktase dalam rantai respirasi
mitokondria menjadi formazan yang terlarut dalam SDS 10% berwarna ungu.1
Konsentrasi formazan yang berwarna ungu dapat ditentukan secara spektrofotometri
visibel dan berbanding lurus dengan jumlah sel hidup karena reduksi hanya terjadi
ketika enzim reduktase yang terdapat dalam jalur respirasi sel pada mitokondria
aktif.1 Semakin besar absorbansi menunjukkan semakin banyak jumlah sel yang
hidup. Reaksi reduksi MTT dapat dilihat pada Gambar 7.
Gambar 7. Reaksi Reduksi MTT menjadi Formazan1
Sementara itu, mekanisme kematian sel fibroblas oleh ekstrak lerak diduga
berupa kerusakan permeabilitas membran yang disebabkan oleh adanya kandungan
saponin dalam lerak (Sapindus rarak DC). Saponin ini memecah lapisan lemak pada
membran sehingga timbul gangguan permeabilitas diikuti dengan influx/efflux ion
dan substansi sel lainnya mengakibatkan sel membengkak dan pecah.1
2.4 Sel Fibroblas
Sel fibroblas (spindle shape) adalah sel jenis eukariotik (memiliki
dinding/membran inti) yang merupakan tipe sel yang paling umum terlihat dalam
jumlah paling besar di pulpa mahkota.2,3,16 Bentuknya seperti kumparan dengan
nuklei ovoid dan prosesus sitoplasmik yang panjang. Biasanya sejajar dengan serabut
kolagen, dengan prosesus yang terbungkus serabut.
Gambar 8. Gambaran sel fibroblas secara mikroskopis (microscope inverted). Nuklei ovoid sel fibroblas utuh yang terletak di inti sel (a) sel fibroblas secara keseluruhan (b)
Gambar 9. Gambaran sel fibroblas secara anatomis27
Seperti odontoblas, penonjolan organel sitoplasmanya berubah-ubah sesuai
dengan aktivitasnya. Makin aktif selnya, makin menonjol organel dan komponen
lainnya yang diperlukan untuk sintesis dan sekresi. Akan tetapi tidak seperti
odontoblas, sel-sel ini mengalami kematian apoptosis dan diganti jika perlu oleh
maturasi dari sel-sel yang kurang terdiferensiasi.2
Pada waktu irigasi saluran akar, bahan irigasi dapat berdifusi dan menekan ke
jaringan periapikal dan ligamen periodontal serta dapat menyebabkan iritasi seperti
yang disebabkan oleh larutan NaOCl.1 Sementara komponen jaringan ini yang
terpenting adalah sel fibroblas dimana sel fibroblas adalah tipe sel yang paling umum
terlihat dalam jumlah yang besar di pulpa mahkota serta merupakan substansi dasar
penyusun jaringan periapikal dan ligamen periodontal.2,3,16
Fungsi sel ini menghasilkan, mensintesis, mempertahankan kolagen dan
matriks serta zat dasar pulpa dan mengubah struktur pulpa jika ada penyakit.2,19
fibroblas yang ada. Bila bertambah tua, sel ini menjadi lebih bulat, dengan nuklei
bulat dan prosesus sitoplasmik yang pendek. Perubahan bentuk disebabkan oleh
pengurangan aktivitas sel karena bertambah tua.16 Jenis sel yang dipakai dalam
BAB 3
KERANGKA KONSEPTUAL DAN HIPOTESIS PENELITIAN
3.1 Kerangka Konsep
Saponin Alkaloid Polifenol Flavonoid
Lerak (Sapindus rarak DC) memiliki kandungan kimia berupa saponin dan
flavonoida dari kulit buah, biji, kulit batang, dan daun, di samping itu kulit buahnya
mengandung alkaloida dan polifenol.7 Senyawa saponin dapat bekerja sebagai
antimikroba. Senyawa saponin akan merusak membran sitoplasma dan membunuh
sel. Saponin yang berperan sebagai surfaktan / sabun atau deterjen (bahan aktif
permukaan) akan menyerang lapisan batas sel bakteri melalui ikatan gugus polar
saponin dengan lipoprotein membran sel dan gugus non polar saponin dengan lemak
membran sel sehingga menyebabkan terjadinya gangguan fungsi sel diikuti dengan
pecahnya sel dan diakhiri kematian sel.
Senyawa flavonoid diduga mekanisme kerjanya mendenaturasi protein sel dan
merusak membran sel tanpa dapat diperbaiki lagi.8 Senyawa fenol berfungsi sebagai
antimikroba, dengan mekanisme penghambatan mikroba berupa perusakan dinding
sel sehingga mengakibatkan lisis atau menghambat proses pembentukan dinding sel
pada sel yang sedang tumbuh, mengubah permeabilitas membran sitoplasma yang
menyebabkan kebocoran nutrien dari dalam sel, mendenaturasi protein sel, merusak
sistem metabolisme di dalam sel dengan cara menghambat kerja enzim intraseluler.
Hal ini akan mengganggu permeabilitas membran sel. Sedangkan alkaloid sudah
digunakan berabad-abad dalam bidang medis karena mengandung toksisitas yang
dapat melawan sel yang berasal dari organisme asing. Alkaloid dapat berikatan
dengan DNA sel sehingga mengganggu fungsi sel diikuti kematian sel.
Kemampuan larutan ekstrak lerak sebagai alternatif bahan irigasi saluran akar
tergantung pada konsentrasi, suhu dan waktu. Konsentrasi merupakan dasar dalam
konsentrasi whole extract dari buah lerak. Konsentrasi yang tinggi akan menyebabkan
kandungan dari senyawa aktif buah lerak akan semakin banyak jumlahnya sehingga
mempengaruhi kerja uji MTT assay. Sebaliknya dengan konsentrasi yang rendah
maka jumlah kandungan bahan aktif juga semakin sedikit dan akan mempengaruhi
kerja MTT assay juga. Perubahan suhu akan mengganggu pertumbuhan sel,1
sehingga dalam penelitian ini digunakan suhu inkubasi 370 C yang sesuai dengan
suhu hewan coba sebagai host. Dan waktu pengamatan akan berpengaruh terhadap
aktifitas pertumbuhan sel. Artinya sel akan berproliferasi seiring bertambahnya waktu
pengamatan. Pembelahan sel secara mitosis membutuhkan waktu antara 12-17 jam.
Oleh sebab itu, waktu pengamatan dipilih 24 jam berdasarkan pada aktifitas dan
kemampuan sel untuk bertahan hidup yang paling maksimal. Oleh sebab itu, untuk
memenuhi sebagian dari syarat-syarat bahan irigasi perlu dilakukan uji sitotoksisitas
ekstrak lerak pada sel fibroblas untuk melihat efek sitotoksiknya dengan
menggunakan metode MTT assay. Dengan mekanisme di atas dapat diketahui apakah
ekstrak lerak memiliki efek sitotoksik terhadap sel fibroblas sebagai bahan irigasi
saluran akar secara in vitro.
3.2 Hipotesis Penelitian
Ada efek sitotoksik ekstrak lerak terhadap sel fibroblas dilihat dari nilai LC50
BAB 4
METODE PENELITIAN
4.1 Rancangan Penelitian : Post test only control group design
Jenis Penelitian : Eksperimental laboratorium
4.2 Populasi, Sampel, dan Besar Sampel
4.2.1 Populasi adalah sel jaringan fibroblas (kultur cell lines BHK-21)
4.2.2 Sampel adalah kultur cell lines fibroblas (BHK-21)
4.2.3 Besar sampel
Penentuan besar sampel untuk setiap kelompok perlakuan dipilih secara
random dan perhitungan besar sampel memakai rumus (Steel dan Torrie, 1995):
n = (Zα + Zβ)2 2δ2 = (1,96 + 1,64)2 2(3,55)2 = 8,83
d2 (6.08)2
Maka besar sampel dari setiap kelompok penelitian ini adalah 9.
Keterangan : n = besar sampel
Zα = harga standar normal dari α = 0,05
Zβ = harga standar normal dari β = 0,10
d = penyimpangan yang ditolerir
4.2.3.1 Kelompok Perlakuan terdiri dari:
a. Kelompok 1 : larutan ekstrak lerak 40% 9 sampel
b. Kelompok 2 : larutan ekstrak lerak 20% 9 sampel
c. Kelompok 3 : larutan ekstrak lerak 10% 9 sampel
d. Kelompok 4 : larutan ekstrak lerak 5% 9 sampel
e. Kelompok 5 : larutan ekstrak lerak 2,5% 9 sampel
f. Kelompok 6 : larutan ekstrak lerak 1,25% 9 sampel
g. Kelompok 7 : larutan ekstrak lerak 0,62% 9 sampel
h. Kelompok 8 : larutan ekstrak lerak 0,31% 9 sampel
4.2.3.2 Kontrol sel, sebagai kontrol positif dianggap persentase sel hidupnya
100% 6 sampel
4.2.3.3 Kontrol media, sebagai kontrol negatif dianggap persentase sel
hidupnya 0% 24 sampel:
a. Kontrol media media RPMI + ekstrak 40% 3 sampel
b. Kontrol media media RPMI + ekstrak 20% 3 sampel
c. Kontrol media media RPMI + ekstrak 10% 3 sampel
d. Kontrol media media RPMI + ekstrak 5% 3 sampel
e. Kontrol media media RPMI + ekstrak 2,5% 3 sampel
f. Kontrol media media RPMI + ekstrak 1,25% 3 sampel
g. Kontrol media media RPMI + ekstrak 0,62% 3 sampel
h. Kontrol media media RPMI + ekstrak 0,31% 3 sampel
4.3 Variabel Penelitian
4.3.1 Variabel bebas
Larutan ekstrak lerak dengan konsentrasi 40%, 20%, 10%, 5%, 2,5%, 1,25%,
0,62%, 0,31%.
4.3.2 Variabel tergantung
Sitotoksisitas terhadap sel fibroblas (kultur cell lines BHK-21)
Variabel Bebas
Larutan ekstrak lerak dengan konsentrasi 40%, 20%, 10%, 5%, 2,5%, 1,25%, 0,62%. 0,31%
a. Jenis dan asal tumbuhan lerak (Sapindus rarak DC, Desa Maga, Kec.Panyabungan
Tapanuli Selatan)
b. Sterilisasi alat, bahan coba, dan media c. Suhu penguapan dengan rotavapor (400
C)
d. Media pertumbuhan sel fibroblas (RPMI-1640)
e. Stem sel fibroblas (kultur cell lines BHK-21)
f. Suhu inkubasi uji sitotoksisitas (370 C) dan suasana CO2 5%
g. Waktu pengamatan (24 jam) h. Keterampilan operator
Variabel Tak Terkendali
a. Perlakuan terhadap lerak selama tumbuh
b. Lingkungan (kondisi tanah dan iklim) tempat tumbuh lerak c. Waktu dan suhu penyimpanan
buah lerak setelah dipetik dari pohon
d. Waktu ekstraksi lerak
e. Waktu dan suhu penyimpanan bahan coba
4.3.3 Variabel terkendali
a. Jenis dan asal tumbuhan lerak (Sapindus rarak DC, Desa
Maga,Kec.Panyabungan Tapanuli Selatan)
b. Sterilisasi alat, bahan coba, dan media
c. Suhu penguapan dengan rotavapor (400 C)
d. Media pertumbuhan sel fibroblas (RPMI-1640)
e. Stem sel fibroblas (kultur cell lines BHK-21)
f. Suhu inkubasi uji sitotoksisitas (370 C) dan suasana CO2 5%
g. Waktu pengamatan (24 jam)
h. Keterampilan operator
4.3.3 Variabel tidak terkendali
a. Perlakuan terhadap lerak selama tumbuh
b. Lingkungan (kondisi tanah dan iklim) tempat tumbuh lerak
c. Waktu dan suhu penyimpanan buah lerak setelah dipetik dari pohon
d. Waktu ekstraksi lerak
e. Waktu dan suhu penyimpanan bahan coba
f. Waktu dan suhu pengiriman bahan coba
4.4 Definisi Operasional
4.4.1 Ekstrak lerak adalah ekstrak yang diperoleh dengan melakukan ekstraksi
lerak dengan pelarut etanol dan dimasukkan ke dalam rotavapor sehingga diperoleh
ekstrak kental dengan konsentrasi 40%, 20%, 10%, 5%, 2,5%, 1,25%, 0,62% dan
0,31%.
4.4.2 Sel fibroblas adalah sel yang berasal stem sel Fibroblas BHK-21 yang
berasal dari Laboraturium Pusat Veterinaria Farma UNAIR (Surabaya) dan dibiakkan
secara murni pada media Rosewell Park Memorial Institute 1640 (RPMI-1640).
4.4.3 Sitotoksisitas adalah viabilitas sel fibroblas BHK-21 terhadap ekstrak
lerak dilihat dari nilai LC50, dihitung memakai metode MTT assay dengan
menggunakan ELISA reader (Enzyme-Linked Immunosorbent Assay) pada panjang
gelombang 620 nm dengan gambaran yang terbentuk biru formazan pada sel yang
hidup.
4.4.4 LC50 ekstrak lerak adalah konsentrasi dari ekstrak lerak yang
menghambat pertumbuhan sel fibroblas sebesar 50% dari kontrol sel yang diperoleh
dari nilai rata-rata persentase kehidupan sel pada waktu pengamatan 24 jam.
4.5Bahan dan Alat Penelitian 4.5.1 Bahan Penelitian
Ekstraksi Lerak
1. Buah lerak 940 gram (Desa Maga, Kec. Panyabungan Tapanuli Selatan,
2. Aquadest (Kimia Farma, Indonesia) 1 liter
3. Alkohol 70% (Kimia Farma, Indonesia) 1 liter
4. Etanol 96% (Kimia Farma, Indonesia) 4 liter
Uji Sitotoksisitas
1. Ekstrak Lerak 40%, 20%, 10%, 5%, 2,5%, 1,25%, 0,62%, 0,31%
2. Kultur cell lines fibroblas (BHK-21) (Pusvetma, Surabaya)
3. MTT solution (Sigma, St. Louis, OM)
4. Dimethyilsulfoxide/DMSO (Merck, Germany)
5. Trypsine versene solution 0,25% (Merck, Germany)
6. RPMI-1640 (Pusvetma, Surabaya)
7. Phosphate Buffer Saline/PBS (pH 7) (Pusvetma, Surabaya)
4.5.2 Alat Penelitian
Ekstraksi Lerak
1. Electronic balance (Ohyo JP2 6000, Japan dan Denver Instrument
Company, USA)
2. Timbangan (Home Line, China)
3. Alat destilasi pelarut (Electrothermal, England)
4. Blender (Waring, Japan)
5. Kertas saring (Whatman no.42, England)
6. Autoklaf (Tomy, Japan)
Uji Sitotoksisitas
1. 96-well tissue culture plate (Nunc,USA)
2. Timbangan (Mettler, Germany)
3. Hemositometer (Neubeur, Swiss)
4. Scanning multiwell spectrophotometer (Thermo Scientific,USA)
5. Automatic plate shaker (Vari shaker,USA)
6. Inkubator (Memmert, Germany)
7. Micropipette (Finnpipette Colour 40 – 200 µl, China)
8. Botol kultur (Roux, Schott Duran, Germany)
9. Microscope inverted (Nikon,Jepang)
10. Multi channel pipette (ICN, Germany)
11. Laminar flow hood (Clemco, Australia)
12. Sterile pipette tips (Eppendorf, North America)
13. Tabung steril (Pyrex, USA)
14. Stopwatch (Citizen, Japan)
15. Spuit (Sterra, Indonesia)
16. Filter holder (Millipore, USA)
Gambar 10. 96-well tissue culture plate Gambar 11. Microscope inverted
Gambar12. Laminar flow hood Gambar 13. Inkubator
Gambar 14. Micropipette Gambar 15. Multi channel pipette
4.6 Tempat dan Waktu Penelitian 4.6.1 Tempat Penelitian
1. Laboratorium Obat Tradisional Fakultas Farmasi USU
2. Laboratorium Pusat Veterinaria Farma (UNAIR), Surabaya
4.6.2 Waktu Penelitian
Waktu penelitian adalah 6 bulan
4.7 Prosedur Penelitian
4.7.1 Ekstraksi tumbuhan Lerak
Ekstraksi dilakukan berdasarkan ekstraksi yang telah dilakukan penelitian
terdahulu yaitu Risya Dini Marsa. Buah lerak dicuci bersih dengan air mengalir lalu
ditimbang sebanyak 940 gr (Gambar 17) kemudian diambil bijinya dan daging buah
dipotong kecil dengan lebar ± 3 mm (Gambar 18) lalu dikeringkan dalam lemari
pengering (Gambar 19) pada temperatur ± 40°C sampai dapat diremas rapuh
(Gambar 20). Potongan daging buah yang telah kering ditimbang sebanyak 600 gr
(Gambar 21), kemudian diblender (Gambar22), diayak dan didapat serbuk seberat
520 gr (Gambar 23) lalu disimpan dalam wadah plastik tertutup. Tambahkan etanol
destilasi sebanyak 800 ml untuk maserasi (Gambar 24) lalu disimpan dalam wadah
tertutup dan didiamkan selama 3 jam. Massa dipindahkan sedikit demi sedikit ke
dalam perkolator dengan hati-hati sambil sesekali ditekan, kemudian tuangkan etanol
destilasi sebanyak 200 ml dan disaring dengan selapis kertas saring. Biarkan sampai
dibiarkan menetes dengan kecepatan ± 20 tetes/menit, etanol destilasi ditambahkan
berulang-ulang secukupnya hingga selalu terdapat selapis cairan penyari diatas
simplisia (Depkes RI,2000). Perkolat diuapkan dengan alat vacuum rotavapor pada
suhu tidak lebih 50°C hingga diperoleh ekstrak kental dengan konsistensi seperti
madu (Gambar 25). Ekstrak lerak dimasukkan ke dalam botol kaca lalu disimpan di
tempat yang sejuk. (Lampiran 1)
Gambar 17. Penimbangan buah lerak
Gambar 20. Potongan lerak di lemari pengering Gambar 21. Potongan lerak yang sudah kering
Gambar 22. Potongan lerak diblender Gambar 23. Simplisia lerak
4.7.2 Pembuatan Suspensi Bahan Uji
Pembuatan suspensi bahan uji ekstrak lerak dimulai dari konsentrasi 40%
karena kemampuan alat filtrasi yang digunakan hanya dapat melarutkan bahan pada
konsentrasi 40%. Ekstrak lerak disuspensikan dengan media Rosewell Park Memorial
Institute 1640 (RPMI-1640) dengan perbandingan 100% artinya 1 gram/1 ml.
Kemudian dilakukan pengenceran bahan secara dilusi berganda (pengenceran ganda)
dengan mengambil setengah dari ekstrak 40% dan ditambahkan 0,5 ml media RPMI
untuk mendapatkan konsentrasi 20%. Kemudian diambil lagi setengah dari
konsentrasi 20% dan ditambah 0,5 ml RPMI untuk mendapatkan konsentrasi 10%,
dan seterusnya hingga diperoleh konsentrasi 5%, 2,5%, 1,25%, 0,62%, dan 0,31%.
4.7.3 Uji Sitotoksisitas
Semua pekerjaan dilakukan dalam Laminar flow (Gambar 12). Kultur sel
BHK-21 dalam bentuk cell-line ditanam dalam botol roux selama 4 hari (Gambar 26).
Setelah itu kultur sel dipanen menggunakan trypsine versene solution. Hasilnya
kemudian ditanam pada media Rosewell Park Memorial Institute 1640 (RPMI-1640)
yang terdiri dari 10% serum albumin fetal bovine yang diinkubasi selama 24 jam
pada suhu 370 C (Gambar 26). Selanjutnya sel fibroblas didistribusikan pada setiap
96 sumuran (well) microplate (Gambar 27a dan b).
Setiap sumuran terdiri dari sel dan media RPMI dengan kepadatan 75 x 104
sel/ml dalam 150 µ l dan masing-masing diberikan larutan ekstrak lerak pada
25 µ l (bahan uji tersebut sebelumnya telah disterilisasi dengan cara filltrasi dengan
kertas saring (Millipore, USA) ukuran pori-pori 0,45 µ m) dengan waktu kontak bahan
uji selama 24 jam(Gambar 28). Microplate diinkubasi kembali pada suhu 370 C
selama waktu kontak (Gambar 29), kemudian dipindahkan dari inkubator.
Kontrol sel disiapkan, dan dianggap persentase sel hidupnya adalah 100%.
Kontrol media dianggap persentase sel hidupnya 0%. Selanjutnya, garam tetrazolium
(MTT) dilarutkan dalam Phosphate-Buffered Saline (PBS) 5 mg/mL. MTT
ditambahkan secara langsung pada plate yang berisi medium kultur sebanyak 10 μl
(Gambar 30), kemudian diinkubasi kembali selama kurang lebih 4 jam pada suhu
370C suasana CO2 5%. Seluruh media dalam sumuran dan bahan uji diambil.
Kemudian, setiap sumuran ditambahkan DMSO (Dimethylsufoxide) sebanyak 50 μl
(Gambar 32). Plate diaduk secara mekanis dengan Plate Shaker sampai kristal
formazan terlarut + 10 menit (Gambar 35). Sel fibroblas yang hidup akan terwarnai
dengan formazan menjadi biru (Gambar 39), sedang yang mati tidak terbentuk warna
biru.
Selanjutnya, formazan dibaca absorbansinya secara spektrofotometri dengan
ELISA reader pada panjang gelombang 620 nm (Gambar 35b). Hitung rata-rata
persentase kehidupan sel dari nilai Optical density (absorbansi) masing-masing
sampel pada setiap konsentrasi terhadap nilai kontrol. Buat grafik persentase
kehidupan sel terhadap kelompok perlakuan dan kontrol. Nilai LC50 selanjutnya dapat
ditentukan dari nilai rata-rata persentase kehidupan sel. Alur uji sitotoksisitas dapat
Gambar 26. Kultur cell lines BHK-21 dengan media RPMI-1640
Gambar 27. Sel fibroblas didistribusikan ke dalam 96-well microplate (a) sel fibroblas dalam 96-well microplate (b)
Gambar 28. Kontrol sel diperiksa dengan Gambar 29. Siapkan bahan uji
microscope inverted
Gambar 30. Bahan uji dimasukkan ke dalam Gambar 31. Inkubasi dengan suhu 370C
sumuran 25 μl/konsentrasi suasana CO2 5% selama 24 jam
Gambar 32. MTT dilarutkan dalam PBS 5 mg/ml dan ditambahkan langsung pada plate yang berisi sel fibroblas sebanyak 10 μl dan diinkubasi selama 4 jam
Gambar 33. Hasil uji diperiksa dengan microscope Gambar 34. Seluruh media dan bahan uji inverted untuk melihat terbentuknya formazan dalam sumuran diambil dan ditambah
Gambar 35. Plate di-shaking dengan plate shaker
Gambar 36. Plate dimasukkan kedalam alat ELISA reader (a) Formazan dibaca absorbansinya (pada monitor) menggunakan panjang gelombang 620 nm (b)
Persentase kehidupan sel dihitung menggunakan rumus yang digunakan oleh
Christian Khoswanto (UNAIR, 2008) sebagai berikut:15
Rumus Umum:
Keterangan:
% kehidupan sel : persentase jumlah kehidupan sel setelah uji % Kehidupan sel = Grup tes + media x 100% Sel + media
Grup tes : nilai OD (Optical density) formazan setiap sampel setelah tes
Media : nilai OD (Optical density) formazan pada rata-rata setiap
kontrol media
Sel : nilai OD (Optical density) formazan pada rata-rata kontrol sel
Contoh hasil pengujian sitotoksisitas ekstrak lerak terhadap sel fibroblas pada
pengamatan 24 jam.
Tabel 1. NILAI OD (OPTICAL DENSITY) FORMAZAN KELOMPOK UJI
Keterangan :
= nilai OD formazan grup tes
= nilai OD formazan rata-rata sel
= nilai OD formazan rata-rata media
Sesuai dengan hasil nilai OD formazan, contoh yang akan dihitung persen kehidupan
sel fibroblas adalah pada konsentrasi ekstrak lerak 40%, sesuai dengan rumus:
% Kehidupan sel = Grup tes + media x 100%
Sel + media
% Kehidupan sel = 0,209 + 0,15 x 100% 0,254 + 0,15
% Kehidupan sel = 91,83%
Kemudian seterusnya dilakukan perhitungan % kehidupan sel pada setiap sampel tes
yang telah dilakukan uji.
4.8 Analisa Data
Data dari setiap pemeriksaan dianalisis secara statistik dengan tingkat
kemaknaan (α = 0,05), memakai uji statistik sebagai berikut :
• Uji analisa varians satu arah (ANOVA), untuk melihat pengaruh
sitotoksisitas terhadap sel fibroblas (BHK-21) antara kelompok perlakuan.
• Uji Least Significant Different (LSD), untuk melihat perbedaan
sitotoksisitas terhadap pertumbuhan sel fibroblas (BHK-21) antar semua
BAB 5
HASIL PENELITIAN DAN ANALISIS HASIL PENELITIAN
5.1 Hasil Penelitian
5.1.1 Ekstrak kental Lerak
Daging buah lerak yang telah dikeringkan dan dihaluskan (520 gram)
diekstraksi, diperoleh ekstrak kental berwarna coklat kehitaman (Gambar 37),
disimpan dalam wadah kaca tertutup dan diletakkan di tempat yang sejuk atau lemari
pendingin sebelum digunakan untuk uji sitotoksisitas.
Gambar 37. Ekstrak kental lerak
5.1.2 Pengujian Sitotoksisitas Ekstrak Lerak
Pengujian sitotoksisitas dilakukan dengan waktu pengamatan yaitu setelah
kontak 24 jam. Untuk mengetahui sitotoksisitas larutan maka dilakukan penghitungan
absorbansi (Optical density) dari jumlah sel hidup yang terwarnai dengan formazan
Absorbansi ini digunakan untuk menghitung persentase sel hidup sebagai respon.
Hasil uji ANOVA secara umum menunjukkan adanya pengaruh yang bermakna
terhadap pertumbuhan sel fibroblas (BHK-21) (p<0,05). Hasil uji LSD menunjukkan
adanya perbedaan yang signifikan terhadap pertumbuhan sel fibroblas (BHK-21)
(p<0,05). Tetapi tidak pada konsentrasi ekstrak lerak 1,25%, 0,62% dan 0,31%.
Berdasarkan pengujian yang dilakukan didapatkan nilai LC50 ekstrak lerak yaitu pada
konsentrasi antara 1,25% dengan rerata persen kehidupan sel (52,15% + 0,0530334).
Artinya ekstrak lerak memiliki batas konsentrasi yang biokompatibel dan relatif aman
digunakan sebagai alternatif bahan irigasi saluran akar.
Berdasarkan pengamatan yang dilakukan dengan microscope inverted,
diperoleh gambaran mikroskopis koloni sel fibroblas sebagai kontrol sel (Gambar
38). Sementara gambaran mikroskopis sel fibroblas setelah diberi perlakuan dapat
dilihat pada (Gambar 39).
Gambar 38 menunkukkan koloni sel fibroblas yang hidup yang akan
digunakan untuk pengujian sitotoksisitas ekstrak lerak sebagai bahan uji. Sel
fibroblas yang terlihat berbentuk seperti kumparan dengan nuklei ovoid dan prosesus
sitoplasmik yang panjang. Sejajar dengan serabut kolagen, dengan prosesus yang
terbungkus serabut.
Gambar 39. a. Kristal formazan, b. Sel fibroblas yang hidup, c. Sel fibroblas yang mati (Pembesaran 100x) dengan microscope inverted
Gambar 39 menunjukkan sel fibroblas yang telah diberikan ekstrak lerak
secara umum dan diamati selama kontak waktu 24 jam. Terlihat perubahan struktur
anatomis dari sel fibroblas. Dimana sel fibroblas yang hidup tetap memiliki
gambaran struktur anatomis yang lengkap (b). Sedangkan sel fibroblas yang mati (c)
tidak memiliki gambaran struktur yang lengkap. Terlihat pada gambar yaitu tidak
memiliki nuklei ovoid dan prosesus yang tidak terbungkus serabut. Sedangkan a
b
gambar (a) merupakan gambaran dari kristal formazan (berwarna biru) yaitu respon
dari sel yang akan digunakan untuk menghitung persentase sel hidup.
Berikut adalah grafik rata-rata persentase kehidupan sel fibroblas (BHK-21)
terhadap ekstrak lerak pada pengamatan 24 jam.
Kelompok Perlakuan
Kelompok Perlakuan
Gambar 40. Grafik rerata persentase kehidupan sel fibroblas (BHK-21) setelah kontak 24 jam.
Keterangan :
= % rerata kehidupan sel pada kelompok perlakuan ekstrak lerak pada
masing-masing konsentrasi
= % kehidupan sel pada kontrol sel
Hasil uji sitotoksisitas setelah kontak 24 jam perlakuan pada Gambar 40
memperlihatkan rata-rata persentase kehidupan sel fibroblas (BHK-21) untuk
masing-masing kelompok ekstrak lerak dengan konsentrasi 40% (88,12% + 0,0306477),
20%(67,16% + 0,1792200), 10% (60,19% + 0,0265674), 5% (67,51% + 0,0160682),
0,0518714) dan 0,31% (56,10% + 0,0817768). Nilai perhitungan persentase
kehidupan sel dapat dilihat pada Lampiran 4 .
5.2 Analisis Hasil Penelitian
Data dari persentase kehidupan sel fibroblas (BHK-21) terhadap ekstrak lerak
dianalisa secara statistik dengan derajat kemaknaan (α = 0,05). Uji Analisa varians
satu arah (ANOVA), untuk melihat pengaruh sitotoksisitas antara semua kelompok
perlakuan, dan uji Least Significant Different (LSD), untuk melihat perbedaan
sitotoksisitas antar kelompok perlakuan. Hasil uji statistik dapat dilihat pada lampiran
5.
Tabel 2. HASIL UJI ANOVA EFEK SITOTOKSIK EKSTRAK LERAK TERHADAP KEHIDUPAN SEL FIBROBLAS (BHK-21) SETELAH 24 JAM PERLAKUAN
Hasil uji ANOVA setelah 24 jam perlakukan (Tabel 2) menunjukkan
pengaruh yang bermakna terhadap kehidupan sel fibroblas (BHK-21) (p<0,05). Tetapi
tidak memberikan pengaruh yang bermakna terhadap kehidupan sel fibroblas pada
konsentrasi 1,25%, 0,62% dan 0,31%. Kelompok perlakuan ekstrak lerak dengan
masing-masing konsentrasi memberikan hasil persentase kehidupan sel yang lebih
rendah dibandingkan dengan kelompok kontrol sel. Dari uji ANOVA didapatkan nilai
LC50 ekstrak lerak yaitu pada konsentrasi antara 1,25% dengan nilai rerata persen
kehidupan sel (52,1456 + 0,0530334).
Tabel 3. HASIL UJI LSD EFEK SITOTOKSIK EKSTRAK LERAK TERHADAP SEL FIBROBLAS (BHK-21) SETELAH 24 JAM PERLAKUAN
Ekstrak 40% 20% 10% 5% 2,50% 1,25% 0,62% 0,31% Kontrol
Hasil uji LSD (Tabel 3) menunjukkan adanya perbedaan yang signifikan
antara semua kelompok perlakuan, kontrol sel dan kontrol media. Kelompok
perlakuan ekstrak lerak pada masing-masing konsentrasi berbeda signifikan dengan
10%, 5%, 2,5%, 1,25%, 0,62%, dan 0,31%. Ekstrak 20% dengan ekstrak 2,5%,
1,25%, 0,62%, dan 0,31%. Ekstrak 10% dengan ekstrak 1,25%, 0,62%. Ekstrak 5%
dengan ekstrak 2,5%, 1,25%, 0,62%, dan 0,31%. Serta ekstrak 2,5% dengan ekstrak
5%, 1,25%, 0,62%. Namun tidak terdapat perbedaan yang signifikan antara ekstrak
20% dengan ekstrak 10% dan 5%. Ekstrak 10% dengan ekstrak 20%, 2,5% dan
0,31%. Ekstrak 5% dengan ekstrak 20%. Ekstrak 2,5% dengan ekstrak 10% dan
0,31%. Ekstrak 1,25% dengan ekstrak 0,62% dan 0,31%. Ekstrak 0,62% dengan
ekstrak 1,25% dan 0,31%. Serta ekstrak 0,31% dengan ekstrak 10%, 2,5%, 1,25%
dan 0,62%. Dari hasil uji LSD didapatkan nilai LC50 ekstrak lerak yaitu pada
BAB 6 PEMBAHASAN
.
Uji sitotoksisitas yang dilakukan dengan menggunakan metode MTT assay
memiliki kelebihan yaitu relatif cepat, sensitif, dan akurat (karena menggunakan alat
spektrofotometer yang dapat mendeteksi perubahan metabolisme sel secara jelas,
manipulasi mudah, menghemat waktu, tenaga, tidak menggunakan isotop radioaktif),
serta dapat digunakan untuk mengukur sampel dalam jumlah besar dan hasilnya bisa
untuk memprediksi sifat sitotoksik suatu bahan.1
Metode ini berdasarkan pada perubahan garam tetrazolium (MTT) menjadi
formazan dalam mitokondria sel fibroblas (Gambar 7). MTT yang berwarna kuning
diabsorbsi ke dalam sel fibroblas dan dipecah melalui reaksi reduksi oleh enzim
mitokondrial suksinat dehidrogenase. Enzim ini terdapat pada bagian matriks
mitokondria dan partikel kecil pada krista. Enzim inilah yang mengkonversi MTT
menjadi kristal formazan berwarna biru yang menandai bahwa sel tersebut hidup.16
Formazan adalah kompleks substrat enzim yang dibentuk oleh MTT dan
enzim suksinat dehidrogenase pada mitokondria sel. Warna biru formazan setara
dengan panjang gelombang ( ) 500-600 nm. Protokol MTT Assay mempunyai
panjang gelombang terpilih pada kisaran 550-620 nm.18 Terbentuknya warna biru
diakibatkan oleh adanya perubahan ikatan rangkap menjadi ikatan selang seling dari
senyawa MTT menjadi formazan, ikatan selang seling ini disebut dengan gugus
kromofor dimana pada pembacaan spektrofotometri dengan 620 nm terbentuk
untuk jenis reagen MTT yang digunakan (sigma, ST. Louis) dan mengingat bahwa
daerah pengukuran spektrofotometri visible pada 380-780 nm.30 Pengukuran
absorbansi pada panjang gelombang maksimal akan memberikan absorbansi yang
maksimal. Hal ini untuk meningkatkan sensitifitas analisa.30
Semakin kuat intensitas warna biru yang terbentuk, absorbansi akan semakin
tinggi, hal ini menunjukkan bahwa semakin banyak MTT yang diabsorbsi ke dalam
sel hidup dan dipecah melalui reaksi reduksi oleh enzim reduktase dalam rantai
respirasi mitokondria, sehingga formazan yang terbentuk juga semakin banyak.
Absorbansi ini yang digunakan untuk menghitung persentase sel hidup sebagai
respon. Intensitas warna biru yang terbentuk berbanding langsungdengan jumlah sel
yang aktif melakukan metabolisme.
Hasil uji ANOVA (Tabel 2) menunjukkan bahwa pemberian ekstrak lerak
dengan konsentrasi 40%, 20%, 10%, 5%, 2,5% memberikan pengaruh yang
bermakna terhadap kehidupan sel fibroblas (BHK-21) (p<0,05). Tetapi tidak
memberikan pengaruh yang bermakna terhadap kehidupan sel fibroblas pada
konsentrasi 1,25%, 0,62% dan 0,31%. Dan jika dibandingkan dengan kelompok
kontrol sel, ekstrak lerak memiliki nilai rerata kehidupan sel yang rendah. Hal ini
menunjukkan bahwa hipotesis alternatif (Ha) diterima, yang berarti ada efek
sitotoksik ekstrak lerak terhadap sel fibroblas (BHK-21). Efek toksik ini diduga
karena adanya kandungan senyawa aktif dari bahan uji. Pengamatan setelah kontak
24 jam memperlihatkan bahwa persentase kehidupan sel tertinggi terjadi pada ekstrak
lerak dengan konsentrasi 40% (88,12% + 0,0306477) dan persentase terendah pada
Hasil uji LSD (Tabel 3) menunjukkan adanya perbedaan yang signifikan
antara ekstrak lerak dengan konsentrasi 40%, 20%, 10%, 5%, 2,5%, 1,25%, 0,62%
dan 0,31% dengan kelompok kontrol sel dan kelompok kontrol media pada waktu
pengamatan setelah kontak 24 jam. Hal ini menandakan bahwa perlakuan pada waktu
kontak selama 24 jam memiliki nilai yang berbeda di setiap konsentrasinya (p<0,05).
Kemungkinan disebabkan kandungan dan interaksi zat aktif dari lerak terhadap sel
fibroblas yang diamati selama waktu kontak pengamatan.
Kemampuan zat aktif kandungan lerak yang diduga bersifat toksik berupa
saponin. Mekanisme saponin dalam membunuh sel disebabkan karena saponin
bersifat surfaktan. Saponin mempunyai ujung polar fosfat hidrofilik dan ujung
nonpolar hidrofobik (molekul ampifatik) yang dapat melarutkan protein membran.
Dimana molekul hidrofilik bahan surfaktan tersebut akan berikatan dengan
lipoprotein dinding sel dan menumpuk pada dinding tersebut lalu memecah serta
melarutkan lemak dan protein sehingga permeabilitas dinding sel rusak diikuti
dengan kebocoran yang mengakibatkan membran sel pecah dan mengalami lisis.
Membran sel memiliki peran yang sangat penting, berfungsi melindungi dan
mempertahankan isi sel, serta mengatur lalu lintas molekul-molekul yang berguna
dalam mempertahankan kehidupan sel.29 Struktur membran sel dapat dilihat pada
Gambar 41. a. Menunjukkan bagian hidrofobik dari protein membran yang diduga
akan berikatan dengan bagian hidrofobik dari saponin sehingga protein membran dapat larut, b.
Struktur fosfolipid bilayer membran, c. Protein transmembran. 29
Sementara itu, sitoplasma merupakan bagian terbesar dari sel yang di
dalamnya mengandung bagian-bagian sel, diantaranya adalah organel yang dianggap
sebagai substansi hidup yang berfungsi penting dalam kehidupan sel. Organel yang
terpenting dan dijuluki sebagai the power of house adalah mitokondria. Didalam
mitokondria terjadi proses respirasi yang dapat menghasilkan energi dalam bentuk
ATP. Kemungkinan, senyawa polifenol menyebabkan kerusakan pada sitoplasma
yang menyebabkan kebocoran nutrien dari dalam sel, mendenaturasi protein sel,
merusak sistem metabolisme di dalam sel dengan cara menghambat kerja enzim
intraseluler sehingga menyebabkan aktivitas mitokondria terganggu, ditambah
sebelumnya dengan adanya kandungan saponin yang sudah terlebih dahulu merusak
membran sel, sehingga sel fibroblas akan mudah lisis.
Evaluasi mikroskop pada uji MTT assay (Gambar 39) terlihat bahwa sel
fibroblas setelah diberi ekstrak lerak (secara umum dari berbagai konsentrasi) c
b